Симбиотические взаимодействия микроорганизмов и растений
РГАУ-МСХА
имени К.А. Тимирязева
Кафедра
микробиологии
Курсовая
работа на тему:
“Симбиотические
взаимодействия микроорганизмов и растений”
Введение
Микробно-растительные взаимодействия являются
основой жизни на планете. Растения поставляют кислород и продукты питания для
человека, животных и существенной части микромира. Микроорганизмы осуществляют
возврат питательных элементов для растений, разлагая и потребляя в качестве
субстратов как отмершие растения, так и зачастую живые. В последнем случае мы
имеем дело с паразитизмом микроорганизмов на растениях. В целом же
микроорганизмы и растения успешно сосуществуют вместе. Боле того, именно
совместное развитие бактерий рода Rhizobium и растений семейства бобовых, а
также микоризных грибов и разнообразных растений - распространённый пример
симбиоза.
1. Систематика микробно-растительных
взаимодействий
Микробно-растительные взаимодействия можно
классифицировать по-разному. Их можно подразделить на специфические,
эволюционно закреплённые, и неспецифические, временные и случайные. Оценивая
пространство или среду, можно отметить наземные и внутрипочвенные
взаимодействия.
Эволюционно микроорганизмы - более древние живые
существа, чем растения. Считается, что бактерии возникли раннее 3,5 млрд лет
назад (архей), одноклеточные растения и водоросли появились в протерозое (1,6
млрд лет назад), а первые микроскопические наземные водоросли возникли,
вероятно, на границе протерозоя и палеозоя (0,6-0,5 млрд лет назад). И только в
раннем девоне (около 0,4 млрд лет назад) высшие растения были уже весьма
разнообразны и имели корни и зачатки сосудов. Грибы, как предполагается,
возникли в кембрии (≈ 0,6 млрд лет назад). Так как растения появились
позже бактерий, следовательно, их взаимодействие развивалось постепенно, и растениям
приходилось внедряться в уже занятые бактериями экониши. Это означает, что
растения обладают такими особенностями, которые позволяют им успешно
конкурировать с микроорганизмами, уверенно занимать заселённые микроорганизмами
экониши и, более того, использовать микроорганизмы. В свою очередь,
микроорганизмы также приобрели способность использовать растения для роста,
развития и расселения.
Растения подразделяют на высшие и низшие,
микроскопические и макроскопические. В силу довольно близких размеров низших,
одноклеточных растений и бактерий и грибов, эти живые организмы часто занимают
одни и те же экониши.
Взаимодействие микроорганизмов и растений
следует рассматривать как со стороны микроорганизмов, так и со стороны
растений.
С организационно-морфологической точки зрения
прокариоты представлены как одноклеточными (в основном), так и
«многоклеточными», точнее мицелиальными организмами, к которым относятся
актиномицеты. Следовательно, в бактериально-растителтных взаимодействиях имеют
место взаимодействия прокариотных одноклеточных и мицелиальных организмов с
одноклеточными, многоклеточными и организованными в ткани и органы высшими
растениями.
К микроорганизмам относят и царство грибов.
Грибо-растительные взаимодействия и взаимоотношения составляют важную часть
биологии. Грибы и растения относятся к эукариотам, т. е. формально принадлежат
к одному уровню клеточной организации. Именно благодаря высокой обоюдной
организации растений и грибов их взаимодействия носят более широкий и часто
более драматический характер. По разным оценкам, известно от 120000 до 250000
видов грибов, и среди них свыше 8000 видов фитопатогенных, а среди бактерий
известно только около 200 фитопатогенных видов.
Среди грибов есть одноклеточные организмы,
дрожжи и, следовательно, имеет место взаимодействие одноклеточных грибов с
одноклеточными и многоклеточными, низшими и высшими растениями. Однако более
многочисленны талломные или мицелиальные грибы. По наличию или отсутствию
полового процесса у грибов их подразделяют на высшие (совершенные) и низшие
(несовершенные). Среди взаимодействий тех и других грибов с растениями имеются
общие закономерности, но есть и различия. Например, разные стадии развития
грибов могут проходить как на одном хозяине-растении, так и на разных.
Вирусы, другие микроскопические биологические
объекты также вписываются в систему микробно-растительных взаимодействий.
Однако положение вирусов в иерархии живого остаётся спорным, и они скорее
воздействуют на растения, чем взаимодействуют с ними, хотя при движении вирусных
частиц в плазмодесмах растений можно говорить о вирусно-растительном
взаимодействии.
К сфере растительно-микробных взаимодействий
относятся также взаимодействия микроскопических животных и растений. Часто эти
взаимодействия носят паразитарный характер, где растения играютют роль хозяина.
При систематизации микробно-растительных
взаимодействий необходимо отметить уровни способов взаимодействия с точки
зрения организации материи. Наиболее важным является химический уровень
взаимодействий. На этом уровне имеют место такие взаимодействия, как
«узнавание» хозяина, обмен «информацией», восприятие или торможение молекул и
организмов, и др. Физический уровень - это физический контакт микроорганизма и
растения. Биологический уровень - это и молекулятно-генетический уровень
взаимодействия, и клеточный уровень, который для многих организмов является уже
и организменным. Клеточный уровень взаимодействий по отношению к
микроорганизмам трудно отделим от популяционного уровня. В
микробно-растительных взаимодействиях имеет место и уровень сообществ, который
наиболее сложен.
Проблему микробно-растительных взаимодействий
можно рассматривать и с практической стороны, что имеет место в специальных
курсах, посвящённых фитопатологии конкретных групп растений, защите растений,
их продуктивности и др.
Можно говорить о продолжении взаимодействия
микроорганизмов и растений после отмирания одного из компонентов. При отмирании
растения происходит его разрушение и утилизация микроорганизмами, как и
наоборот.
2. Роль микроорганизмов в жизни
растений
Микроорганизмы в жизни растений выполняют
функцию средообразования и общего питания. Они осуществляют разложение и
минерализацию растительных остатков и органического вещества в целом,
высвобождая и возвращая в почву минеральные элементы, необходимые для роста
растений, а в атмосферу - CO2 некоторые другие газы. Микроорганизмы продуцируют
стимуляторы роста и токсические для растения вещества и др. Микроорганизмы
фактически создают почву.
Бактерии играют ключевую роль в обеспечении
экосистем азотом. Активными и наиболее изученными азотфиксаторами являются
симбиотические азотфиксирующие бактерии, особенно представители рода Rhizobium,
Bradyrhizobium и Azospirillum. Существенную роль микроорганизмы, а именно
грибы, играют и в обеспечении растений фосфором. Грибами обрастают корни
растений с образованием микоризы. Ризосферные микроорганизмы могут оказывать и
прямое защитное действие одних растений относительно других.
Существуют бактерии - стимуляторы роста. Это,
например, некоторые штаммы бактерий рода Pseudomonas, которые защищают растения
от заморозков, предотвращая кристаллообразование на наземных частях растения
при кратковременном резком понижении температуры. Представители рода Bacillus,
Agrobacterium и Pseudomonas являются «поставщиками» биоконтролирующих агентов.
Микроорганизмы оказывают на растения и много
негативных воздействий. Кроме прямого паразитизма микроорганизмов на растениях
имеют место и опосредованные негативные воздействия, например создание
микроорганизмами анаэробиоза в переувлажнённых почвах. Если такие почвы богаты
к тому же органическим веществом, то иногда имеет место массовое развитие
сульфатредуцирующих бактерий, один из продуктов метаболизма которых -
сероводород, крайне ядовитый для всего живого.
3. Роль растений в жизни
микроорганизмов
Растения являются источниками питания для
микроорганизмов, в первую очередь для гетеротрофных организмов, и для аэробных,
и для анаэробных.
Микроорганизмы используют растения в качестве
источника питания как пассивно, так и активно, паразитируя на них и часто
приводя к гибели, т.е. растения, являются также частично и средой обитания для
микроорганизмов. Растения оказывают какое-то селектирующее влияние на
окружающее его и находящееся на нём микробное сообщество.
Растения осуществляют физическую защиту
микроорганизмов, а также участвуют в их распространении. Во время роста
растений имеет место физический перенос микроорганизмов как вглубь почвы, так и
на поверхность, в надпочвенное пространство, и, следовательно, служат переносчиками
(векторами) для микроорганизмов. При поедании растений животными разного уровня
организации микроорганизмы попадают в желудочно-кишечный тракт этих животных.
Часть микроорганизмов погибает, а часть с экскрементами опять попадает на
поверхность растений и почву. Поэтому можно говорить о цикле микроорганизмов,
где растения исполняют роль и переносчиков, и субстратов одновременно.
4. Микробно-растительные
взаимодействия при росте и развитии растений
Логично начать с прорастания семян в почве.
Однако семена растений, попадающие в почву, уже заселены микроорганизмами, т.
е. микробно-растительные отношения начинаются гораздо раньше. Очень часто
микроорганизмы уже находятся внутри созревшего семени. Потенциально семя
растения может нести на (в) себе бактериальные клетки, их эндоспоры или цисты,
конидиеспоры и / или обрывки гиф актиномицетов, обрывки мицелия грибов, цисты
простейших, а также яйца нематод и вирусы. Численность микроорганизмов
варьирует и зависит от географических и климатических факторов и др. Важную
роль в контаминации поверхности семян, способности удерживаться на их
поверхности играют такие характеристики микроорганизмов, как размеры и
морфология, структура поверхности клеток, способность к длительному выживанию
при обезвоживании, при воздействии света и т.д.
На поверхности и в покровах, а также в тканях
разных семян можно обнаружить бактерии, принадлежащие к родам Agrobacterium
(рис. 1,а), Arthrobacter, Bacillus, Burkholderia, Clavibacter, Clostridium
(рис. 1,б), Curtobacterium, Erwinia, Pseudomonas (рис. 1,в), Rhizobacter,
Rhizomonas, Streptomyces, Xanthomonas и др., Грибы родов: Acremonium,
Alternaria, Aspergillus, Botrytis, Fusarium, Gibberella, Penicillium,
Perenospora, Phoma, Phitophthora, Ustilago, Verticillium и др.

Рис. 1, а - Выросты на стебле растения -
результат развития Agrobacterium tumefasciens

Рис. 1, б - Клетки Clostridium pasteurianum со
спорами. Увел. X 3500 (по В.И. Дуде)

Рис. 1, в - Pseudomonas fluorescens
В семени растений, даже находящихся в состоянии
глубокого покоя, протекают процессы метаболизма и, следовательно, происходят
обменные процессы с окружающей средой.
При попадании в благоприятные условия влажности
и температуры семя растения набухает и прорастает. При этом происходят
соответствующие Молекулярно-генетические и физико-биохимические процессы.
Влажность и температура оказывают соответствующее действие и на микроорганизмы,
находящиеся на поверхности семени. Однако основное действие на микробное
сообщество поверхности семян оказывает «выброс» органических веществ из
набухающего и прорастающего семени. Концентрация и состав таких веществ вида
специфичны.
5. Микробно-растительные
взаимодействия в ризосфере и ризоплане
Прорастающее и развивающееся из семени в почве
растение сталкивается с различными микроскопическими биологическими объектами.
Будущее растение контактирует с ними как формирующейся корневой системой, так и
стеблем, пока проростком. Корень контактирует с неспецифическими для него
микроорганизмами, т. е. такими, контакт с которыми не приводит к его
инфицированию, и со специфическими, инфицирующими корень микроорганизмами.
Среди инфицирующих имеются непатогенные (клубеньковые бактерии, микоризные,
эндо- и эктомикоризные грибы) и типичные патогенны.
Совокупность корневой системы с почвой
представляет собой сложную экологическую нишу, заселенную полезными, вредными и
нейтральными для растений микроорганизмами].
Пространство и почву, окружающие формирующийся
корень, называют ризосферой. Считается, что первое определение понятия
ризосферы было дано Хилтнером в 1904 году. В настоящее время под ризосферой
понимают пространство вокруг корня от 0 до 2-8 мм в диаметре, в котором имеет
место более обильное развитие микроорганизмов из-за стимулирования их роста
корневыми выделениями, а в более широком смысле - корневыми депозитами.
Пространство ризосферы иногда называют ещё эндоризосферой, включая в это
понятие и ткани самого корня в противовес ризоплане, под которой подразумевают
только то, что находится непосредственно на поверхности корня и прикреплено к
корню. Корневые экссудаты представляют собой низкомолекулярные органические
вещества, продукты фотосинтеза и метаболизма (сахара, органические и аминокислоты,
спирты, гормоны, витамины и др.). Эти вещества «вытекают» из зоны растяжения
корня в процессе его роста и развития.
Корневые ризодепозиты включают не только
экссудаты, но и все другие вещества - высокополимерные слизи полисахаридной и
белковой природы, ферменты, отмирающие и слущивающиеся поверхностные клетки с
их содержимым, куски тканей, корневой чехлик, корневые волоски, летучие
органические вещества и др. В виде ризодепозитов растение теряет более 30-40%
продуктов фотосинтеза.
Имеет место и чисто механическое воздействие
растущего корня на окружающую его эконишу.
Активная секреция клетками корня различных
веществ обеспечивает питательными субстратами микроорганизмы, образующие с ним
прочные ассоциации как внутри корневых тканей, так и на корневой поверхности
(ризоплане), а также в почве, непосредственно окружающей корни (ризосфере). В
связи с этим в ризосфере и ризоплане в значительных количествах концентрируются
бактерии, актиномицеты, грибы, водоросли и нематоды, существенно превышая
количество этих же организмов в обычной почве. Одной из характеристик ризосферы
различных растений, отражающей ее заселенность микроорганизмами, является
количественное отношение R / S (rhizosphera / soil - ризосфера / почва).
Величина R / S показывает, во сколько раз количество микроорганизмов
определенной таксономической группы в ризосфере данного растения превышает
количество этих микроорганизмов в почве. Для большинства бактерий величина R /
S колеблется от 2 до 25. В ризосфере в отличие от свободной от корней почвы
доминируют грамотрицательные бактерии, причем преобладают флуоресцирующие
бактерии рода Pseudomonas. Некоторые штаммы бактерий Pseudomonas putida (рис.
2), P. Fluorescens (см. рис. 1,в выше), P. aureofaciens (chlororaphis), P.
corrugata и др. способствуют значительному улучшению роста и развития растений.
В настоящее время бактерии, обладающие совокупностью полезных для растений
свойств, принято обозначать как PGPR (от Plant Growth-Promoting Rhizobacteria -
ризобактерии, способствующие росту растений)].
Феномен более высокой плотности микроорганизмов
вокруг корня за счёт потребления экссудатов и ризодепозитов называется
ризосферным эффектом. Численность микроорганизмов в ризосфере может превышать
их численность в окружающей почве от нескольких % до десятков % и даже на
порядок.
Общая численность микроорганизмов зависит от
типа почвы, растения и др. факторов.
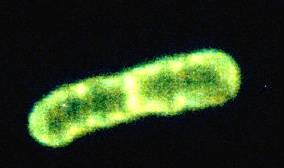
Рис. 2 - Pseudomonas putida
5.1 Положительное влияние PGPR
Pseudomonas на растения
1. Прямая или непосредственная стимуляция роста
растений за счет синтеза различных метаболитов, полезных для растений;
. Опосредованная стимуляция роста растений за
счет вытеснения и подавления развития почвенных фитопатогенов или
микроорганизмов, угнетающих рост растений.
К первому типу прежде всего можно отнести
способность PGPR Pseudomonas синтезировать регуляторы роста растений и улучшать
фосфорное питание растений. Кроме того, некоторые штаммы псевдомонад способны к
фиксации атмосферного азота и индукции у растений устойчивости к фитопатогенам.
Прямая стимуляция роста растений:
синтез регуляторов роста растений. У ризосферных
псевдомонад наиболее хорошо изучена способность к синтезу индолил-3-уксусной
кислоты (ИУК), которая, как известно, стимулирует развитие корневой системы растений.
Однако большинство штаммов псевдомонад, стимулирующих рост растений,
продуцируют ИУК в незначительных количествах (3-5 мкг/мл), тогда как
псевдомонады, угнетающие рост растений, продуцируют до 20 мкг/мл ИУК.
Исследования синтеза ИУК у PGPR Pseudomonas демонстрируют возможность получения
генетически модифицированных штаммов PGPR Pseudomonas, способных к повышенному
синтезу ИУК;
улучшение фосфорного питания растений. Фосфор
присутствует в почве в виде органических (отложения растительного, животного и
микробного происхождения) и неорганических или минеральных соединений. Из этого
общего пула фосфорных соединений только около 5% доступны растениям. Некоторые
микроорганизмы, в особенности микоризные грибы и некоторые ризобактерии,
способны усиливать поступление фосфора в растения. Бактерии могут использовать
две системы повышения концентрации экзогенного фосфата: 1) за счет гидролиза
органических фосфатов под действием фосфатаз; 2) путем растворения минеральных
фосфатов за счет продукции кислот;
фиксация атмосферного азота. В холодных
климатических зонах в ризосфере растений азотфиксирующие псевдомонады
доминируют над представителями других таксономических групп азотфиксаторов.
Преимущество псевдомонад выражается в их холодоустойчивости, поскольку оптимальная
температура для азотфиксации 14-20°С. В то же время для процесса азотфиксации
других ассоциативных диазотрофов, как, например, бактерий рода Azospirillum,
оптимальной температурой является 25°С. Ризобактерии Pseudomonas наряду с
другими свободноживущими и ассоциативными диазотрофами родов Azotobacter,
Bacillus, Klebsiella и Azospirillum могут играть существенную роль как в
ассоциативных, так и в симбиотических азотфиксирующих сообществах, улучшая, к
примеру, клубенькообразование у бобовых при совместном использовании с
некоторыми штаммами Rhizobium и Bradirhizobium;
индукция резистентности к фитопатогенам.
Например, обработка корней бобов и гвоздики определенными штаммами PGPR P.
putida повышает устойчивость растений к фитопатогенному грибу Fusarium solani
(рис. 3). При этом отмечаются усиление лигнификации корневой ткани и повышение
содержания фитоаллексинов в стеблях растений.
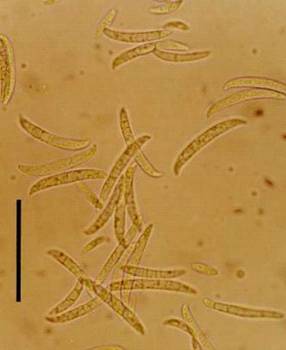
Рис. 3 - Fusarium solani
Опосредованная стимуляция роста растений:
Бактерии рода Pseudomonas - одна из наиболее
изученных групп бактерий-антагонистов почвенных фитопатогенов.
Продукция сидерофоров. Хорошо известна
способность псевдомонад продуцировать желто-зеленые флуоресцирующие
водорастворимые пигменты, называемые сидерофорами, которые выполняют функцию
связывания и транспорта железа в клетки бактерий. Сидерофоры флуоресцирующих
псевдомонад имеют различную химическую структуру и обладают, как правило,
высоким сродством к трехвалентному железу, образуя с ним стабильные комплексы,
недоступные для использования фитопатогенами. Фитопатогены продуцируют
собственные сидерофоры, однако в отличие от сидерофоров псевдомонад они гораздо
медленнее связываются с ионами железа, и псевдомонады выигрывают в конкурентной
борьбе с фитопатогенами за такой жизненно важный элемент, как железо. Таким
образом, связывание железа сидерофорами псевдомонад приводит к ограничению
роста фитопатогенов и улучшению роста растений.
Синтез антибиотиков. PGPR Pseudomonas способны
продуцировать широкий спектр вторичных метаболитов, в том числе антибиотиков.
Наиболее хорошо изученными антибиотиками, играющими важную роль в супрессии
болезней растений, являются антибиотики группы феназинов, флороглюцинов,
пиолютеорин, пирролнитрин и оомицин А. Роль продукции антибиотиков в защите
растений непосредственно в почве была показана в исследованиях Л. Томашов по
бактеризации семян пшеницы штаммом P. fluorescens 2-79 и его дефектным по
синтезу феназинового антибиотика (феназин-1-карбоновой кислоты) мутантом.
Защиту растений от одного из возбудителей корневой гнили обеспечивал только
исходный штамм с нормальной продукцией антибиотика, тогда как мутантный штамм
хотя и не полностью, но в значительной степени утрачивал эту способность.
5.2 Факторы, влияющие на колонизацию
PGPR Pseudomonas ризосферы растений
Pseudomonas могут оказывать положительное
действие на растение только при успешной колонизации ими его ризосферы. Поэтому
чрезвычайно важно углубленное изучение процесса колонизации PGPR Pseudomonas
ризосферы растений. Известно много факторов, влияющих на колонизацию бактериями
корней растений и жизнедеятельность псевдомонад в почве и ризосфере:
адгезия клеток к корневой поверхности -
способность ризобактерий прикрепляться к поверхности корней растений;
хемотаксис и подвижность клеток псевдомонад -
способность бактериальных клеток перемещаться к корням растений, секретирующим
широкий набор источников углеродного и азотного питания для микроорганизмов;
скорость размножения бактерий;
5.3 Ассоциативная азотфиксация
В 1974 1976 гг. бразильский учёный И. Доберейнер
впервые обнаружил спиралевидные грамотрицательные аэробные (микроаэрофильные)
бактерии - азоспириллы, развивающиеся в ризосфере и ризоплане тропических
травянистых растений, обладающие способностью к азотфиксации и вступающие в
ассоциативные взаимоотношения с растениями. К данным бактериям относятся такие
виды, как Azospirillum lipoferum, A. brasilense (рис. 4, а,б), A. amozanense,
A. halopraeferans.

Рис. 4, а - Azospirillum lipoferum
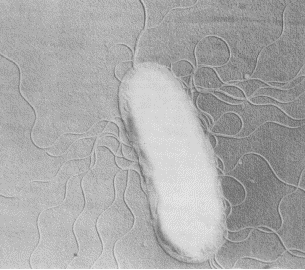
Рис. 4, б - Azospirillum brasilense
Рост и развитие ассоциативных бактерий связаны с
поступлением к ним от растений легкодоступных источников углерода и энергии в
виде корневых выделений (сахаров, органических кислот и др.), а также корневого
отпада и опада.
В ризосфере небобовых растений достаточно широко
распространены и азотфиксирующие бактерии родов Enterobacter, Klebsiella,
Escherichia, Erwinia, Citobacter, которые представляют собой грамотрицательные
палочки, подвижные (кроме представителей рода Klebsiella), факультативные
анаэробы.
В ризосфере на корнях кукурузы, сорго и риса
обнаружен новый вибриоидный организм - Herbaspirillum seropedicae (рис. 5),
способный к фиксации азота в условиях ассоциативного симбиоза.

Рис. 5 - Herbaspirillum sp. seropedicae
seropedicae - грам-отрицательные бактерии,
способные к фиксации азота и стимулированию роста растений.
На корнях злаковых и других небобовых растений
распространены представители рода Pseudomonas, среди которых имеется ряд
азотфиксаторов.
Ассоциативная азотфиксация протекает практически
во всех почвах в прикорневом пространстве или на корнях различных небобовых
растений.
При таком практически повсеместном
распространении эффективность её, определяемая деятельностью диазотрофных
бактерий, далеко не одинакова по разной растительностью.
Активность ассоциативной азотфиксации
определяется количеством органических веществ - корневых выделений и корневого
спада. Считают, что высокая активность азотфиксации в ризосфере тропических
растений (сахарного тростника, маиса и др.) обусловлена их способностью
использовать при фотосинтезе путь через дикарбоновые кислоты (С-4 путь). Этим
растениям необходимо интенсивное освещение, максимальная скорость фотосинтеза у
них существенно выше, чем у растений, использующих цикл Кальвина (С-3 путь)
(овёс, пшеница, ячмень и др.). Полагают, что поскольку растения С-4 типа
расходуют мало углеводов при фотодыхании, то большее количество последних может
быть использовано для роста корней и увеличения корневой экссудации.
Перечисленные особенности положительно сказываются на уровне ассоциативной
азотфиксации. И можно отметить, что ассоциативные бактерии Azospirillum
lipoferum преимущественно развиваются в ризоплане растений с С-4 типом
фотосинтеза, а Azospirillum brasilense - в ризоплане с С-3 типом фотосинтеза.
Уровень азотфиксации, которая протекает в почве
без растений и осуществляется благодаря деятельности свободноживущих
диазотрофов, существенно ниже, чем в почве под растениями. Обычно
свободноживущие в почве бактерии, связывающие азот, используют как источник
углерода и энергии пожнивные растительные остатки, а ассоциативные диазотрофы -
органические вещества, выделяемые растениями в прикорневую зону в виде корневых
экссудатов и корневого опада.
6. Микробно-растительные
взаимодействия в филлосфере и филлоплане
Пространство, окружающее надпочвенную
поверхность растения, включая ткани этого растения, называют филлосферой, а
поверхность растения - филлопланой. Микроорганизмы, колонизирующие надземные
поверхности растений, называют иногда эпифитными микроорганизмами. Количество
микроорганизмов, обнаруживаемых на поверхности листьев, иногда может достигать
108 клеток на грамм свежих листьев, или 106 на 1 см2. Численность и
разнообразие микроорганизмов зависит от вида растения и от его местообитания,
климата, погодных условий и некоторых др. обстоятельств. К этим микроорганизмам
относятся сапротрофные и фитопатогенные представители родов Pseudomonas,
Erwinia, Xanthomonas, Agrobacterium, Enterobacter, Klebsiella, Methylobacterium
и др. Имеются различия в микробном сообществе верхней стороны листа и нижней.
Существенную роль играют в этом свет и температура.
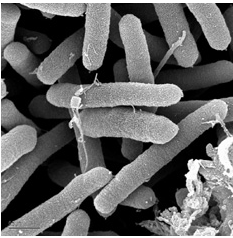
Рис. 6 - Pseudomonas syringae
syringae - фитопатогенная
<#"564335.files/image010.jpg">
Рис. 7 - Erwinia herbicola
Количество азота, фиксированного ассоциативными
бактериями в филлосфере растений, зависит и от вида растения, и от внешних
факторов (температуры, влажности, солнечной радиации и др.).
Свет резко усиливает «утечку» углеводов из листьев,
тогда как выход многих других соединений светом не активируется. Наибольшее
количество углеводов было обнаружено в зрелых листовых оболочках и вблизи
апикальных и интеркалярных меристематических тканей стебля и листьев, а
присутствие излишков фотосинтеза обеспечивало благоприятные условия для
развития азотфиксирующих микроорганизмов].
Считают, что ассоциативная азотфиксация
происходит в филлоплане всех небобовых растений, хотя её эффективность различна
и определяется главным образом генотипом растений.
7. Специфические взаимовыгодные
формы микробно-растительных взаимодействий
.1 Симбиотические взаимоотношения
бактерий и растений
Симбиоз (Антуан Де Бари, 1879) - это «совместное
существование разных организмов». Однако традиционно сложилось, что в качестве
примера симбиоза микроорганизмов и растений приводится взаимовыгодное
сосуществование бактерий рода Rhizobium, способных к азотфиксации, с бобовыми
растениями, хотя этот тип взаимоотношений более соответствует понятию
мутуализма.
Бактерии рода ризобиум - это аэробные
грамотрицательные палочки длиной 0,7-1,8 мкм, живущие в почве и на поверхности
растений. При инфицировании бобовых вызывают у последних образование на корнях
клубневидных образований (рис. 8, 9).
Для каждого рода бобовых имеются свои разновидности
(штаммы) бактерий, которые называют по названию растения-хозяина. Например,
Rhizobium trifolii - клубеньковые бактерии клевера, Rh.lupini - клубеньковые
бактерии люпина и пр. (рис. 10).

Рис. 8 - Клубеньки на корнях сои.
Бактерии-ризобии, живущие в клубеньках, переводят атмосферный азот в доступную
для растений форму (аммоний), получая взамен комфортные условия жизни и все
необходимые питательные вещества. Фото с сайта www.uoguelph.ca
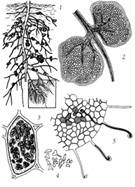
Рис. 9 - Симбиотическая фиксация азота в
корневых клубеньках бобовых: 1 - корень гороха с клубеньками; 2 - клубеньки в
разрезе; 3 - растительная клетка в разрезе, заполненная бактериями; 4 -
бактерии, находящиеся в клетках растения приобретают необычную форму; 5 -
внедрение бактерий через кончики корневых волосков, и рост инфекционных нитей
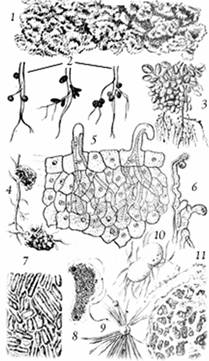
Рис. 10 - Образование клубеньков у различных
видов растений: 1 - азолла; 2 - клубеньки чины; клевера; вики; 3 - клубеньки на
корнях арахиса; 4 - клубеньки на корнях ольхи; 5 - возникновение инфекционных
нитей в корневых волосках; 6 - искривление корневых волосков бобовых в
присутствии клубеньковых бактерий; 7 - клетки бактерий из клубеньков люцерны; 8
- бактероид клубеньковых бактерий клевера; 9 - клетки клубеньковых бактерий на
поверхности волоска; 10 - азотобактер (делящаяся клетка); 11 - клубеньковая
ткань ольхи
Растения и ризосферные бактерии «обмениваются»
химическими веществами - «сигналами», которые позволяют им вступать в
мутуалистические взаимоотношения. Среди таких веществ, образуемых
ризобактериями, имеются стимуляторы роста растений - гормоны роста растений, в
частности ауксин (индол-3-уксусная кислота, ИУК). Активными продуцентами ИУК
являются бактерии Aeromonas veronii, Edwardsiella tarda, Listonella
anguillarum, Pantoea ananas, Vibrio fluvialis (рис. 11), Vibrio furnisii, в том
числе типичные почвенные бактерии, представители родов Arthrobacter,
Agrobacterium, Pseudomonas и др.
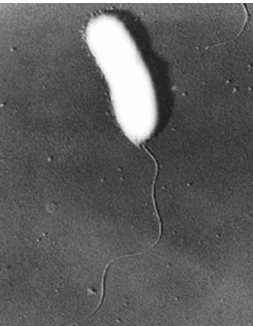
Рис. 11 - Vibrio fluvialis
Кроме ауксина некоторые ризобактерии продуцируют
N-ацилированный лактон гомосерина (АЛГ), который служит аутоиндуктором
активности бактериальной популяции и взаимодействия бактерий с окружающей
средой и растением-хозяином. Широко известен продецент АЛГ - Agrobacterium
tumefaciens (см. рис. 1,а). Важную роль в микробно-растительных взаимодействиях
играют и некоторые высокомолекулярные соединения, в частности лектины.
Лектины - углеводсодержащие белки, обладающие
свойством обратимо и избирательно связывать углеводы и углеводные детерминанты
биополимеров без изменения их ковалентной структуры. Лектины синтезируются
практически всеми живыми организмами и в связи с этим играют роль в
межорганизменных взаимодействиях всех уровней. Лектины участвуют в адгезии,
влияют на прорастание семян, могут выполнять защитную роль.
Согласно одной из гипотез, симбиоз Rhizobium и
бобовых возник как результат защитной реакции бобовых от патогенов, которыми
выступали бактерии рода Rhizobium. Взаимодействие данных организмов - сложный
многоступенчатый процесс, контролируемый множеством генов как в бактериях, так
и в растениях.
Азотфиксация осуществляется ферментным
комплексом бактерий - нитрогеназой. Нитрогеназа очень чувствительна к
кислороду, инактивируясь в его присутствии. Следовательно, процесс азотфиксации
может часто лимитироваться наличием кислорода.
Процесс инфицирования начинается с адгезии
клеток бактерий на поверхности корневых волосков. Корневые волоски бобовых
продуцируют особые вещества - хемоаттрактаты для бактерий. К таким соединениям
относятся флавоноиды и изофлавоноиды. В процессе узнавания принимают участие
лектины, способствующие прикреплению бактерий к корневым волоскам. Флавоноиды и
изофлавоноиды индуцируют экспрессию бактериальных nod-генов, которые отвечают
за синтез веществ, называемых Nod-факторами, обеспечивающих межвидовое
взаимодействие. В настоящее время известно более 24 веществ, продуктов
экспрессии nod-генов, большинство из них ферменты. Компонент корневых экссудатов,
аминокислоту триптофан, ризобии способны трансформировать индолилуксусную
кислоту. ИУК по своей природе является ростовым гормоном, стимулирующим рост
растительных клеток.
В месте выделения экссудатов (кончик корневого
волоска) имеет место и повышенное скопление бактерий, а следовательно и
повышенное выделение ИУК. Это ведёт к более активному росту поверхностных
клеток корневого волоска, в результате чего корневой волосок закручивается, а
бактерии оказываются как ба внутри спирали. В процессе участвует и фермент
полигалактуроназа, который может синтезироваться как бактериями, так и
растением. Этот фермент, гидролизуя пектины, размягчает поверхностные покровы
волоска. Бактерии, проникая через корневые волоски внутрь клеток растения,
формируют инфекционную нить, которая, развиваясь в кортексе корня, активно
инфицирует его тетраплоидные клетки. Клетки ризобий, выходя из инфекционной
нити, теряют свою первоначальную палочковидную форму, и в этом состоянии их
называют бактероидами. Интенсивный рост и размножение тетраплоидных клеток и
бактероидов приводит к образованию наростов на корнях растения, называемых
клубеньками. Внутри клубеньков протекает процесс азотфиксации - биологическое
превращение бактериями газообразного атмосферного азота в доступную растениям форму
- аммоний.
В акте азотфиксации главную роль играет вещество
леггемоглобин. Этот пигмент находится, по-видимому, в растительных клетках, а
его синтез осуществляется частично бактериями и частично растением, т. е. можно
говорить о симбиозе на молекулярно-генетическом уровне.
7.2 Симбиоз актиномицетов и растений
В симбиотические отношения с растениями способны
вступать представители цианобактерий и актиномицетов, в частности представители
рода Frankia. sp. - нитевидные бактерии, которые способны фиксировать
атмосферный азот и преобразовывать его в аммонийную форму.
Симбиотические отношения Frankia могут
возникнуть с более чем 200 видами двудольных древесных растений, принадлежащих
к 8 семействам, среди которых ольха (Alnus), облепиха (Hippophae), стланик
(Dryas) и др. При проникновении в растения часть гиф Frankia превращается в
морфологически уникальные структуры, способные к азотфиксации и называемые
везикулами. К конечном итоге на корнях инфицированных растений образуются
азотфиксирующие клубеньки, где и происходит синтез нитрогеназы и фиксации
азота.
Корневые клубеньки древесных растений довольно
крупные, обычно формируются на боковых корнях. Клубеньки бывают двух типов -
коралловые и (у ольхи, облепихи) с прорастающими через дольки клубенька корнями,
направленными вверх (у казуарины). Азотфиксирующие актиномицеты обладают
определённой специфичностью к растениям.
Актиномицеты-симбионты способны инфицировать
только паренхимные клетки коры корня. Микроорганизм проникает в корни из почвы
через корневые волоски, которые в результате скручиваются. В месте
инфицирования стенки корневого волоска утолщаются и гифы, проникшие внутрь
клетки, покрываются толстым чехлом. По мере продвижения гиф по корневым
волоскам чехол утоньшается, и вокруг гиф формируется капсула, которая
образуется как растением, так и актиномицетом.
Из корневого волоска гифы проникают в эпидермис
и кору корня, вызывая деление и гипертрофию инфицированных клеток. Как правило,
клубки гиф заполняют центр клеток растения, у клеточных клеток происходит
расширение и деление концов гиф, и формируются специфические структуры -
везикулы. В клубеньках образуется вещество, подобное леггемоглобину бобовых
растений. В конце вегетации везикулы деградируют, но в клетках растений
сохраняются гифы, заражающие весной новые ткани. Обычно при симбиозе с
небобовыми растениями энергия азотфиксации актиномицетами рода Frankia больше,
чем у клубеньковых бактерий бобовых растений.
Бактерии рода Frankia способны к азотфиксации и
в свободноживущем состоянии, т.е. без контакта с растением.
7.3 Грибо-растительный симбиоз.
Микориза
Грибы, как и растения вступают с растениями в
симбиотические (мутуалистические) отношения. Партнерами такого симбиоза
являются в первую очередь высшие грибы, а со стороны растений - небобовые растения,
в том числе многолетние древесные растения. Речь идёт о микоризообразовании. В
таких отношениях гриб использует растение как источник питательных веществ, не
вызывая его заболевания. Для гриба, установившего связь с растением,
существенно снижается конкурентное давление со стороны других микро- и
макроорганизмов. В свою очередь, гриб способствует обеспечению растения
соответствующими питательными веществами, в первую очередь фосфором, азотом и
калием, а также и влагой. Гриб «защищает» инфицированное растение от реальных
фитопатогенов, в частности от грибов Euzarium, способствует выработке у него
устойчивости к токсинам и др. Такое явление называют индуцированной
устойчивостью.
Различают эктотрофную и эндотрофную микоризу.
Эктомикоризные грибы (Из аскомицетов - трюфели, из базидиомицетов - болетовые,
сыроежки, паутинник и др.) на корнях растений образуют внешний покров до 40 мкм
толщиной. Гифы проникают в межклеточное пространство тканей корней, но не в
клетки. В случае эндотрофной микоризы - это, как правило, представители
несовершенных грибов, их мицелий проникает внутрь тканей и клеток корня. Такой
тип микоризы часто образуется с растениями семейств вересковых, орхидных и др.
Микоризные грибы занимают уникальную экологическую нишу, связывая внешнюю окружающую
среду и внутреннюю среду растений.
Большинство эндомикоризных грибов в процессе
взаимодействия с растениями образуют морфологически особые структуры, везикулы
и арбускулы, из-за чего её часто называют везикулярно-арбускулярной микоризой
(ВАМ). После проникновения в корень (обычно это корневой волосок) гифа растёт в
двух направлениях - к кончику и основанию волоска. В клетках кортекса корня
гифы образуют дихотомически ветвящиеся структуры - арбускулы. Также гифы грибов
образуют в других клетках кортекса корня пузырьковидные вздутия - везикулы.
Считается, что именно через эти структуры происходит химическое взаимодействие
гриба и растения.
ВАМ возникает на корнях как однолетних, так и
многолетних диких и культурных растений, в том числе пшеницы, кукурузы, многих
паслёновых, винограде и др. Микоризные грибы имеют много особенностей. Они
являются многоядерными, в цитоплазме многих ВАМ, таких как Glomus caledonium,
Acaulospora laevis, Gigaspora margarita и некоторых других, а также в
образуемых ими спорах присутствуют структуры, напоминающие бактерии. Таким
образом, можно уже говорить о тройственном бактерио-грибо-растительном
взаимодействии. ВАМ - облигатные симбионты, их не удаётся выращивать на
искусственных средах.
7.4 Другие формы взаимовыгодных микробно-растительных
взаимодействий
Азотфиксация имеет место не только в почве, в
ассоциации с корнями растений или вне их, но и на поверхности растений.
Цианобактерия Anabaena образует на нижней стороне листьев тропического водного
папоротника Azolla слизистые углубления, которые со временем как бы погружаются
(инвагинируют) в лист папоротника. Anabaena фиксирует атмосферный азот, а
Azolla, как и положено растению, обеспечивает цианобактерию необходимыми ей
питательными веществами.
Примером облигатного симбиоза одноклеточных
фотосинтезирующих организмов и грибов является лишайник.
Лишайники (Lichenes) - широко распространенная
группа симбиотических организмов, обычно растущих на камнях или древесных
стволах, реже на почве и получающих необходимую им для жизни влагу из
атмосферы. Несколько видов обитают на морской литорали (приливо-отливной
полосе). Как правило, грибной мицелий служит для водоросли защитной оболочкой,
предохраняющей ее от высыхания и в то же время позволяющей ей беспрепятственно
получать необходимые для фотосинтеза воду и углекислый газ. Сам гриб, не
способный синтезировать органические вещества, питается продуктами фотосинтеза
водоросли.
Фотобионт обычно представлен зелеными
водорослями (Chlorophyta) или цианобактериями, а микобионт - сумчатыми
(Ascomycetes) или, гораздо реже, трутовыми базидиальными (Basidiomycetes)
грибами. Именно цианобактерии осуществляют азотфиксацию и тем самым снабжают
азотными компонентами весь таллом лишайника.
По строению тела (таллома, или слоевища)
лишайники бывают накипными (корковыми), листоватыми и кустистыми. Они
распространены по всему земному шару от тропиков до приполярных областей.
Хорошо известны такие лишайники, как ягель, или олений мох (Cladonia
rangiferina), и виды Usnea, свешивающиеся с деревьев наподобие бород и очень
похожие внешне на цветковые эпифитные растения рода Tillandsia.
У ряда лишайников пищевая зависимость гриба от
фотобионта, возможно, не полная, и микобионт получает часть (реже -
большинство) необходимых ему питательных веществ как паразит, внедряясь своими
гифами в живые мхи или другие лишайники. Некоторые лишайники, содержащие в
качестве фотобионтов цианобактерии из родов Nostoc и Calothrix, способны
«фиксировать» и в результате использовать атмосферный азот. Когда лишайники
рода Peltigera, включающие в себя зеленую водоросль, сталкиваются с
цианобактерией, гифы микобионта (обычно коровые) быстро окружают ее, образуя
особое поверхностное вместилище, цефалодий, из которого организм получает
дополнительное азотное питание. У лишайников рода Stereocaulon такой чужеродный
фотобионт, хотя и изолируется на поверхности слоевища, соединяется рыхлым
пучком гиф с сердцевиной, а у части видов рода Lobaria цефалодии внутренние.
Лишайники очень чувствительны к загрязнению
воздуха, особенно к диоксиду серы (сернистому газу). При этом степень
чувствительности варьирует у разных видов, поэтому их используют в качестве
биоиндикаторов степени загрязненности окружающей среды.
7.5 Паразитизм микроорганизмов на
растениях
Паразитизм бактерий, грибов, вирусов и некоторых
микроскопических животных на растениях и в связи с этим болезни растений
изучает наука фитопатология. Фитопатогенов среди грибов гораздо больше, чем
среди бактерий. Например, у культурного растения ржи (Secale sereale)
насчитывают более 70 грибных заболеваний. Часть фитопатогенов может
существовать и сапротрофно, а некоторые из грибных фитопатогенов имеют
сапротрофную фазу. Микроорганизмы, которые могут переходить от сапротрофного
существования к паразитическому, называют иногда «оппортунистическими» видами.
Среди бактерий - типичный представитель Pseudomonas syringae. Довольно много и
облигатных паразитов.
Контакт паразита с хозяином происходит через
филлоплану или ризоплану соответственно. Проникновение патогена внутрь растения
происходит различными способами: через естественные отверстия, например устьица
или места образования боковых корней, после активного (энзиматического,
целлюлозами и пектиназами) разрушения покровных оболочек, тканей и клеточных
стенок растений, через раны при механических воздействиях, например
повреждениях, вызываемых насекомыми. Как известно, в растениях довольно много
пектина, особенно в некоторых плодах. Одним из способов воздействия и
проникновения патогена в растение-хозяина - это выделение пектинолитических ферментов.
При этом происходят гидролиз пектинов растения и расслоение тканей и клеток.
Примером одной из наиболее агрессивных
бактерий-фитопатогенов может быть Agrobacterium tumefaciens (рис. 12).
tumefaciens - грамотрицательная
<#"564335.files/image015.jpg">
Рис. 12 - Электронная микрофотография
Agrobacterium tumefaciens в процессе инфицирования клетки моркови
<#"564335.files/image016.gif">
· 100%, где
-масса бюкса с сырой почвой (50,2)-масса бюкса с
сухой почвой (47,9)-масса пустого бюкса (24,7)
А%= ((50,2 - 47,9)/(47,9-24,7)) ∙ 100% =
9,91%
Приготовление почвенной суспензии и посев
Навеску почвы (10 г) переносят в колбу на 250 мл
с 90 мл стерильной водопроводной воды, взбалтывают 10 мин (лучше на
механической мешалке) и дают отстояться грубым частицам почвы.
Одновременно со взятием навески для анализа из
средней пробы отбирают 10-20 г почвы для определения влажности, так как
полученные при анализе данные пересчитывают на 1 г абсолютно сухой почвы.
После того, как почва в колбе с водой
отстоялась, начинают готовить разведения: первая колба с суспензией
соответствует разведению 10-1, последующие разведения - 10-2,10-3,10-4,10-5.
Из каждого предыдущего разведения отдельной
стерильной пипеткой берут 10 мл суспензии и переносят в следующую колбу с 90 мл.
Всякий раз пипетку ополаскивают и отставляют. Последующие колбы встряхивают по
1 мин.
Из полученных разведений делают посев на плотные
среды.
При определении количества бактерий в почве для
посева на МПА, берем разведение 10-5 и 10-4, среде Гетчинсона берем разведение
10-2 и 10-3, на сусло-агаре берем разведение 10-3 и 10-4, на среде Эшби
применяют метод обрастания комочков.
Для глубинного посева берут 1 мл почвенной
суспензии из разведения на порядок меньшего, чем для поверхностного посева.
Суспензию вносят в стерильную чашку Петри,
заливают агаром, расплавленным и охлажденным до 45°С, и смешивают с ним. При
глубинном посеве показатели получаются более низкие, чем при поверхностном.
Среды, используемые в данной работе
При определении численности микроорганизмов нами
были использованы плотные среды: МПА, сусло-агар, среда Эшби и среда
Гетчинсона.
МПА (мясо-пептонный агар) - используют для
выращивания сапротрофных микроорганизмов (из различных типов почв, зерна, воды,
навоза, воздуха), усваивающих органические формы азота, учета количества
бактерий, выделения чистой культуры и других целей.
Сусло-агар используют для микроскопических
грибов; среду Эшби - для выявления аэробных азотфиксаторов путём раскладывания
комочков почвы; среда Гетчинсона - для аэробных целлюлозоразрушающих
микроорганизмов.
Определение численности различных групп
микроорганизмов
Учёт на плотных средах
После инкубации чашки с засеянными средами
вынимают из термостата и в них подсчитывают число колоний, которые отражают
число живых клеток микроорганизмов в почве.
При подсчете колоний на плотных питательных
средах закрытые чашки Петри просматривают в проходящем свете. Посчитав число
колоний в чашке, определяют количество клеток микроорганизмов в 1 мл
соответствующего разведения.
Учёт микроорганизмов на МПА
Проводят его визуально на 4-й день после посева.
При наличие колоний Bacillus mycoides количество микроорганизмов определяют на
2-й или 3-й день. После подсчёта всех колоний на чашке их группируют по
культурным признакам и определяют роды (а иногда и виды) микроорганизмов.
Учет микроорганизмов на Сусло-агаре
Колонии микроорганизмов (грибов) на сусло-агаре
подсчитывают через 2 суток после инкубации. После 7 суток определяют родовой
состав.
В почве часто встречаются грибы родов: Mucor, Rhizopus,
Penicillium, Aspergillus, Alternaria, Fusarium,Macrosporium, Chaetomium,
Cephalosporum, Phoma, Coremium, Trichoderma, Trichothecium, Stachybotrys.
Учет микроорганизмов на среде Гетчинсона
Определяют на 8-10-е сутки после инкубации в
термостате при 28°С по образованию колоний и разрушению целлюлозы на границе
между жидкой средой и воздухом.
Учет микроорганизмов методом обрастания комочков
почвы в среде Эшби
Для определения качественного состава почвы и
относительной оценки населенности почвы азотобактером, используют среду Эшби.
На среде Эшби следует разместить 25 комочков почвы диаметром 1-2 мм, чашки
поместить во влажную камеру и поставить в термостат при 28°С. Если в комочках
почвы находятся соответствующие клетки микроорганизмов, то они начинают развиваться
и образуют вокруг комочков колонии. При подсчете результатов вычисляют процент
обросших комочков почвы от их исходного числа.
Содержание колоний азотобактера на среде Эшби
определяют на 3-5 сутки инкубации по бело-серым слизистым колониям, которые
постепенно приобретают темно-бурый или зеленый пигмент.
Результаты опыта
Таблица 1 - Учёт микроорганизмов на различных
типах почв
|
Наименование
образца
|
Разведение
|
Количество
колоний в чашке, шт.
|
Среднее
количество колоний, шт.
|
Число
м/о КОЕ/г, влажн. почвы
|
Число
м/о КОЕ/г, абсол. сух. почвы
|
|
Чернозём
|
|
МПА
|
|
|
Бактерии
|
5
5
|
36
40
|
38
|
3,8·106
|
4,2∙106
|
|
Сусло-агар
|
|
|
Грибы
|
3
3
|
8
8
|
8
|
8·105
|
8,8∙105
|
|
Среда
Гетчинсона
|
|
|
Бактерии
|
3
3
|
78
61
|
71
|
7,1·106
|
7,9∙106
|
|
Дерново-подзолистая
почва
|
|
МПА
|
|
|
Бактерии
|
5
5
|
65
71
|
68
|
6,8·106
|
7,7∙106
|
|
Сусло-агар
|
3
3
|
7
7
|
7
|
7·105
|
7,9∙105
|
|
Среда
Гетчинсона
|
|
|
Бактерии
|
2
2
|
16
14
|
15
|
1,5·106
|
1,7∙106
|
|
Болотно-низинно-торфяно-перегнойная
почва
|
|
МПА
|
|
|
Бактерии
|
4
4
|
5
41
|
23
|
2,3·106
|
3,5∙106
|
|
Грибы
|
4
4
|
8
6
|
7
|
7·105
|
1,08∙106
|
|
Сусло-агар
|
|
|
Грибы
|
3
3
|
103
117
|
110
|
11,0·106
|
1,7∙107
|
|
Среда
Гетчинсона
|
|
|
Грибы
|
2
2
|
34
46
|
40
|
4,0·106
|
6,1∙106
|
симбиоз актиномицет растение
микориза
Таблица 2 - Численность микроорганизмов
различных физиологических групп в различных типах почвы
|
Типы
почв
|
Численность
микроорганизмов, КОЕ/г абсолютно сухой почвы
|
Плотность
азотобактера, % (обр.комочков от общ. числа)
|
|
Бактерии,
использующие органические формы азота
|
Микроскопические
грибы
|
Аэробные
целлюлозообразующие
|
|
|
Чернозём
|
4,2∙106
|
8,8∙105
|
7,9∙106
|
33,3
|
|
Дерново-подзолистая
|
7,7∙106
|
7,9∙105
|
1,7∙106
|
100
|
|
Болотно-низинно-торфяно-перегнойная
|
3,5∙106
|
1,7∙107
|
0
|
0
|
Анализируя таблицы 1 и 2 можно сделать вывод,
что болотно-торфяная почва имеет наиболее благоприятные свойства для развития
микроскопических грибов. Она характеризуется мощным слоем торфа (более 40 см),
высоким естественным плодородием (содержание гумусовых веществ достигает
8-10%), содержит много азота (2-4%), но мало фосфора и особенно калия. Её
отличает слабокислая реакция (рН 5-6,5), высокая степень разложения торфа (30-60%)
и большая влагоемкость (от 400 до 900% на сухую навеску и выше). Это всё
создаёт хорошие условия для развития грибов. Поэтому грибы проросли на всех
питательных средах, в большей степени на сусло-агаре.
Дерново-подзолистые почвы обладают малым плодородием,
небольшой мощностью гумусового горизонта (10-20 см), невысоким содержанием
гумуса (1-5%), содержат мало азота, фосфора и других элементов, реакция кислая
(рН 4,2- 5,6).
Чернозёмные почвы характеризуются высоким (до
15%) содержанием гумуса, большой мощностью гумусового горизонта (до 120 см),
хорошими водно-физическими свойствами, слабокислой, близкой к нейтральной,
реакцией среды (рН 5,5-6,5), но содержат малое количество азота (0,2-0,5%).
Поэтому на данных почвах хорошо развиты
бактерии, тогда как микроскопических грибов проросло небольшое количество и
только на сусло-агаре.
Таблица 3 - Учёт микроорганизмов на Среде Эшби
на различных типах почв
|
Наименование
образца
|
Количество
комочков
|
Количество
обросших Azotobacter chroococum
|
Плотность
азотобактера, % обросш. К общ. Числу
|
|
дерново-подзолистая
|
25
|
25
|
25
|
100
|
|
Чернозём
|
25
|
18
|
6
|
33,3
|
|
Болотно-торфяная
|
25
|
8
|
0
|
0
|
Анализируя таблицу 3 и сравнивая
дерново-подзолистую почву и чернозём можно сказать, что и для той и для другой
почвы характерно наличие азотобактера, но плотность азотобактера в
дерново-подзолистой почве значительно выше, чем в черноземной почве. Это
говорит о том, что дерново-подзолистые почвы богаты бактериями, способными
фиксировать атмосферный азот. Торфяно-болотная почва, где вообще азотобактера
не обнаружилось, очень плоха по своим агрономическим свойствам, и,
следовательно, для вовлечения её в сельскохозяйственный процесс понадобится
вмешательство человека.
Особенности бактерий, использующих органические
формы азота, на различных типах почв.
В проделанном нами опыте мы изучали бактерии,
использующие органические формы азота, анализировали выросшие на средах
колонии, подсчитывали их количество, выявляли доминирующие колонии, определяли
их качественный состав, используя микроскоп.
Данные особенности бактерий мы исследовали на
3-х разных типах почв - на чернозёмной, дерново-подзолистой и
болотно-низинно-торфяно-перегнойной почвах. Все три типа были посеяны на МПА,
который используется для выявления нужных нам бактерий.
Колонии гладкие, бежевые, выпуклые,
жирно-блестящие, края колоний ровные округлые, консистенция маслянистая. Форма
бактерий палочковидная, палочки соединены в цепочки, имеет место способность к
спорообразованию. Поэтому можно предположить, что данные бактерии являются
Bacillus megaterium.
Недоминирующими колониями являются колонии
бактерий рода Micrococcus (предположительно Micrococcus agilis).
Болотно-низинно-торфяно-перегнойная почва
Здесь преобладают микроскопические грибы, так как
болотно-низинно-торфяно-перегнойная почва является наиболее благоприятной
средой для их развития. Но несколько бактериальных колоний здесь тоже имеется,
в том числе и бактерии рода Bacillus.
Дерново-подзолистая почва
Здесь произросло большое количество бактериальных
колоний, но преобладающими являются колонии целлюлозообразующих бактерий.
Недоминирующими являются колонии рода Bacillus.
Заключение
Роль микроорганизмов в жизни растений так же
важна, как и роль растений в жизни микроорганизмов, несмотря на то, что
некоторые могут существовать и друг без друга. Но без микроорганизмов не смогли
бы существовать растения, так как микроорганизмы участвуют в почвообразовании.
Некому было бы разлагать растительные остатки и вообще органические вещества до
минеральных, которые необходимы для развития растений. Микроорганизмы снабжают
азотом не только растения, но и всю экосистему. В свою очередь растения
необходимы микроорганизмам для питания, даже как среда обитания и переносчики в
пространстве. Также растения физически защищают микроорганизмы.
Но, если заглянуть в историю, то можно заметить,
что микроорганизмы появились намного раньше растений, поэтому они могли жить и
без растений.
После появления растений началась конкуренция
между ними и микроорганизмами. Они начали взаимодействовать друг с другом,
используя друг друга для развития. В результате появлялись симбиозы.
Но взаимодействия микроорганизмов и растений
являются не только взаимовыгодными, имеет место и паразитизм, и просто
негативное воздействие (например, токсичные выделения).
Поэтому можно сделать вывод, что растения и
микроорганизмы влияют друг на друга как положительно, так и отрицательно.
Говоря о практической части данной курсовой
работы, можно сказать, что на основе эксперимента можно сделать вывод, что
чернозёмная почва является наиболее благоприятной средой для развития бактерий,
использующих органическую форму азота, хотя дерново-подзолистая почва ей в этом
почти не уступает (судя по результатам). Средой для выявления данных бактерий
является МПА, и при рассмотрении образцов с двух других типов почв
(болотно-низинно-торфяно-перегнойная и дерново-подзолистая) на данной среде эти
бактерии произросли в меньшей степени, чем на МПА с образцом чернозёмной почвы.
Это произошло, наверно, потому, что чернозём имеет почти нейтральную реакцию
среды и содержит намного больше гумуса, чем дерново-подзолистая почва, и
обладает хорошими водно-физическими свойствами и не такой большой
влагоёмкостью, как болотно-торфяная почва, которая является наиболее
благоприятной средой для развития грибов, а не бактерий.
Список использованной литературы
1.
Экология микроорганизмов / А.И. Нетрусов и др.; под ред. А.И. Нетрусова - М.:
Изд. центр «Академия», 2004. - 272 с.
.
Емцев В.Т., Мишустин Е.Н. Микробиология: учебник для вузов.- М.: Дрофа, 2005. -
445 с.
.
Умаров М.М. Ассоциативная Азотфиксация. - М.: Изд-во МГУ, 1986. - 205 с.
.
http://bio.1september.ru/articlef.php?ID=200204701
.
http://www.krugosvet.ru/enc/nauka_i_tehnika/biologiya/LISHANIKI.html
.
<http://www.pereplet.ru/obrazovanie/stsoros/641.html>
.
http://images.google.ru/
.
<http://ru.wikipedia.org/wiki/>
.
<http://bse.sci-lib.com/article121993.html>
.
Практикум по микробиологии / Е.З. Теппер, В.К. Шильникова, Г.И. Переверзева;
под ред. В.К. Шильниковой; 5-е издание, переработанное и дополненное. - М.:
изд-во «Дрофа» 2004.