Идентификация микроводорослей Euglena glacilis и анализ их чувствительности к ингибирующим веществам
Реферат
Пояснительная записка 76 с., 15 рис., 3 табл.,
15 источников.
МИКРОВОДОРОСЛЬ, КЛАССИФИКАЦИЯ, ПОДВИЖНОСТЬ,
АНТИБИОТИКИ, КСЕНОБИОТИКИ, РАЗОБЩИТЕЛЬ КЛЕТОЧНОГО ДЫХАНИЯ И СИНТЕЗА АТФ, СРЕДА
ЛОЗИНО-ЛОЗИНСКОГО, EUGLENA
GRACILIS.
Цель работы - выделение и идентификация
микроводорослей и анализ их чувствительности к ингибирующим веществам.
В процессе работы были выделены чистые культуры
микроводоросли Euglena
glacilis, проведена ее
идентификация. Также были рассмотрены методы определения содержания микроводорослей,
методы определения подвижности клеток, методы определения жизнеспособности
клеток. Проведен эксперимент по определению влияния антибиотиков, разобщителей
дыхания и синтеза АТФ на подвижность микроводоросли Euglena
glacilis.
Практическая значимость работы заключается в
возможности использования ее результатов для определения антибиотиков в
мясомолочной продукции, позволяющий в течение 15-20 мин обнаружить присутствие
антибиотиков в концентрации 0,001 ед./мл с относительной погрешностью 10%.
Содержание
Введение
1.
Основная часть
1.1 Проблема загрязнения водной
среды и пищевых продуктов антибиотиками и ингибирующими веществами
1.1.1 Характеристика уровня
химической загрязненности с/х сырья и пищевых продуктов
1.1.2 Влияние ингибиторов на
качество с/х сырья и готовой продукции
1.2 Биотестирование ингибирующих
веществ с помощью микроводорослей
1.2.1 Характеристика микроводорослей
и их классификация
1.2.2 Способы выделения
микроводорослей и их идентификация
1.2.3 Использование микроводорослей
для оценки качества водных сред
1.3 Методы наблюдения и описания
подвижности микроводорослей
1.3.1 Изменение подвижности
микроводорослей в присутствии антибиотиков
1.3.2 Изменение жизнеспособности
микроводорослей в присутствии ксенобиотиков
1.3.3 Метод микроскопического
подсчета численности и подвижности микроводорослей
1.3.4 Метод цифровой фотосъемки
1.3.5 Математическое описание
влияние ингибиторов на подвижность микроводорослей
1.4 Механизмы подавления подвижности
клеток
1.4.1 Биоэнергетика клеток и ее
связь с подвижностью микроорганизмов
1.4.2 Разобщители клеточного дыхания
и окислительного фосфолирования
2.
Экспериментальная часть
2.1 Материалы и оборудование
2.1.1 Микроорганизмы и питательные
среды для культивирования микроорганизмов
2.1.2 Выделение чистых культур
микроводорослейи их идентификация
2.2 Методы анализа
2.2.1 Методы определения содержания
микроводорослей
2.2.2 Методы определения подвижности
клеток
2.2.3 Методы определения
жизнеспособности клеток
2.3 Результаты и их обсуждение
2.3.1 Описание выделения и
идентификации микроводорослей
2.3.2 Изучение влияния антибиотиков
на подвижность микроводорослей
2.3.3 Анализ влияния разобщителей
дыхания и синтеза АТФ на подвижность клеток
Заключение
Список использованных источников
Введение
Микроводоросли - древнейшие про- и
эукариотические фотосинтезирующие организмы, ведущие свободный и симбиотический
образ жизни. Распространенные по всему земному шару, в самых разнообразных
местообитаниях, они играют огромную роль в жизни природы и человека.
Эта группа организмов обладает большим
разнообразием морфологии, анатомии, онтогенеза, географии и экологии. В связи с
этим микроводоросли являются перспективными объектами для проведения
разноплановых научных исследований в области физиологии, биохимии, биофизики,
генетики, космической биологии и т.д. Их используют для повышения
продуктивности водоемов и плодородия почв, получения биологически активных
веществ и различных пищевых и кормовых добавок, в качестве индикаторных
организмов при изучении текущего состояния почв и водоемов. В последнее время
проводятся исследования, направленные на изучение возможности использования
водорослей для получения биотоплива и поглощения углекислого газа из атмосферы.
Целью
данной курсовой работы является выделение и идентификация микроводорослей и
анализ их чувствительности к ингибирующим веществам.
Задачи:
) Рассмотреть методы выделения чистых
культур микроводорослей и способы их идентификации;
) Выделить чистую культуру микроводоросли
Euglena glacilis;
) Рассмотреть методы определения содержания
микроводорослей;
) Рассмотреть методы определения
подвижности клеток;
) Рассмотреть методы определения
жизнеспособности клеток.
) Изучить влияние антибиотиков на
подвижность Euglena
glacilis;
) Изучить влияние разобщителей дыхания и
синтеза АТФ на подвижность клеток.
1.
Основная часть
микроводоросль euglena
glacilis клетка
1.1 Проблема загрязнения водной среды и
пищевых продуктов антибиотиками и ингибирующими веществами
1.1.1 Характеристика уровня химической
загрязненности с/х сырья и пищевых продуктов
Современный Мировой океан, содержащий
многочисленные стоки различных высокотоксичных химических веществ и
нефтепродуктов, уничтожает фитопланктон, который является основным источником
кислорода на Планете, по пищевым цепям загрязняет флору и фауну. Леса,
уменьшающие негативное антропогенное влияние и улучшающие экологическую
ситуацию, производящие наряду с кислородом эфирные масла, электризующие
атмосферу и способствующие образованию озона за счет молниеобразования, активно
сводятся в Европе, в Сибири, на Дальнем Востоке, в долине реки Амазонки.
Загрязнение атмосферы промышленными выбросами
приводит к выпадению кислотных дождей, снижающих урожайность
сельскохозяйственных культур и резко повышающих токсичность продовольственного
сырья за счет вынужденного увеличения количества применяемых минеральных
удобрений и образования высокотоксичных водорастворимых металлоорганических
соединений, в т.ч. тяжелых металлов, что в целом ряде случаев вызывает гибель
растений.
Повсеместное в течение длительного времени применение
в сельскохозяйственном производстве пестицидов и минеральных удобрений,
особенно азотсодержащих, загрязняет литосферу, гидросферу и атмосферу,
продовольственное сырье и пищевые продукты ксенобиотиками суперэкотоксикантами.
В водопроводной воде, являющейся основным ингредиентом большей части пищевых
продуктов, содержатся различные чужеродные химические вещества.
В результате потребления загрязненных продуктов
питания существенно снижаются иммунобиологическая защита организма человека и
качество его здоровья.
Необходимость нормирования вредных веществ в
почвенном покрове особенно актуальна в последнее время в связи с интенсивным
процессом накопления в литосфере различных высокотоксичных соединений,
продуцируемых, прежде всего, энергетическим комплексом и промышленными
предприятиями, а также вследствие применения пестицидов и минеральных удобрений
в сельском и лесном хозяйстве. Даже на значительном расстоянии от мест
размещения металлургических и химических производств в почвенном покрове и,
соответственно в выращенных на этой почве овощах и фруктах, наблюдается
повышенное содержание высокотоксичных солей тяжелых металлов, таких как хром,
никель, медь, цинк, свинец, кадмий и др.
В основу нормативов качества питьевой воды, воды
пресных водоемов и морей, используемых в рекреационных целях, источников
водоснабжения и сточных вод положен принцип эпидемиологической безопасности. В
качестве нормативного уровня для водоемов, служащих источниками
хозяйственно-питьевого водоснабжения, принят такой уровень микробиологического
загрязнения по различным индикаторным микроорганизмам, при котором патогенные
бактерии и кишечные вирусы, как правило, не выделяются из воды водоемов в
условиях их промышленно-бытового загрязнения и при сбросе обеззараженных
сточных вод: Е. coli - не более 1000 в 1л, энтерококки - не более 100 в 1л,
фаги кишечных палочек - не более 1000 клеток в 1л.
Наибольшую экологическую опасность представляют
нарушения в системе централизованного водоснабжения, обусловливающие до 80%
вспышек инфекционных заболеваний "водного" происхождения. Важным
показателем качества водопроводной воды, используемой для хозяйственно-питьевых
целей, служит количество бактерий группы кишечной палочки: в 1л воды должно
быть не более 3 бактерий (коли-индекс=3) или, соответственно, количество воды,
в котором содержится 1 бактерия (коли-титр) - не менее 300 мл.
Биологическому загрязнению окружающей среды в
значительной мере способствуют предприятия микробиологической промышленности.
Существенным фактором в распространении аэрогенных инфекций является воздух
закрытых помещений, преимущественно больничных.
В существующих, практически повсеместно
неблагоприятных экологических условиях, продовольственное сырье и продукты
питания загрязняются различными чужеродными для живого организма веществами,
представляющими существенную опасность для здоровья людей. Для защиты организма
человека от токсичных веществ, которые могут попасть с пищей, создан комплекс
нормативов содержания чужеродных химических веществ и загрязнителей
биологического происхождения в продовольственном сырье и продуктах питания. Эти
нормативы регламентируют такое содержание загрязняющих веществ, которое не
должно вызывать заболеваний или нарушений здоровья, в том числе в отдаленные
сроки у настоящего и будущих поколений [1].
1.1.2 Влияние ингибирующих веществ на качество
с/х сырья и пищевых продуктов
Чужеродные токсические вещества в продуктах
питания могут иметь как естественное, так и искусственное происхождение. К
последним, так называемым ксенобиотикам (от греч. xenos - чужой и bios -
жизнь), относят антропогенные и иные вещества, случайно попадающие в продукты
или преднамеренно вносимые как пищевые добавки для улучшения их потребительских
свойств или повышения технологичности основного производства: красители,
консерванты, антиоксиданты, эмульгаторы и пр. Пищевые продукты могут быть
загрязнены также такими высокотоксичными веществами, как пестициды,
гормональные стимуляторы, ветеринарные препараты, микотоксины, тяжелые металлы,
ингредиенты упаковочных материалов, преимущественно полимерных, и др.
Продовольственной и сельскохозяйственной
организацией ООН (ФАО) и Всемирной организации здравоохранения (ВОЗ) совместно
с Программой ООН по окружающей среде (ЮНЕП) в целях обеспечения безопасности
пищевых продуктов рекомендован обязательный контроль на наличие следующих
токсичных загрязняющих веществ:
загрязнители биологического происхождения -
бактерии и бактериальные токсины, гельминты, вирусы, микотоксины: афлатоксины,
цитринин, фузариотоксин, охратоксин А, патулин;
химические загрязнители - металлы: сурьма,
мышьяк, кадмий, хром, кобальт, свинец, ртуть, никель, олово и их соли;
пестициды: дитиокарбаматы, метилбромиды, хлорорганические, фосфорорганические;
прочие вещества: асбесты, фториды, нитраты, нитриты, нитрозосоединения, диоксины
и диоксиноподобные соединения, полиароматические углеводороды, винилхлорид,
антибиотики, гормональные препараты;
радиоизотопы - цезий-137, стронций-90, йод-131.
В современном мировом сельскохозяйственном
производстве используется широкий ассортимент химических средств,
предназначенных для повышения урожайности, защиты и регуляции роста растений.
Из них к числу наиболее опасных, с точки зрения загрязнения окружающей
природной среды, продовольственного сырья и продуктов питания, а также
негативного влияния на здоровье человека, относятся пестициды.
.) Пестициды (от лат. pestis - зараза и
caedo - убиваю, ядохимикаты) - химические препараты для борьбы с сорняками
(гербициды), вредителями (инсектициды, акарициды, зооциды и др.), болезнями
(фунгициды, бактерициды и др.) культурных растений. В группу пестицидов
включают также: дефолианты (от де... и лат. folium - лист) - химические
препараты, вызывающие старение листьев и искусственный листопад, что ускоряет
созревание и облегчает уборку урожая, в основном хлопчатника; десиканты (от
лат. desicco - высушиваю) - химические препараты, вызывающие обезвоживание
тканей растений, что ускоряет их созревание и облегчает уборку урожая, в
основном хлопчатника, риса, клещевины, картофеля; регуляторы роста растений.
Большинство пестицидов - синтетические органические вещества.
В настоящее время в сельскохозяйственном
производстве разрешено использование около 600 наименований пестицидов,
изготовленных из более 300 веществ, относящихся к различным группам химических
соединений. Пестициды подразделяются на хлор-, ртуть-, и фосфорорганические
соединения, синтетические пиретроиды, медьсодержащие фунгициды и др.
Принята, основанная на гигиенических
характеристиках, следующая классификация пестицидов.
А) По токсичности при однократном поступлении в
организм через желудочно-кишечный тракт пестициды делятся на:
сильнодействующие - ЛД50 - до 50 мг/кг;
высокотоксичные - ЛД50 - 50-200 мг/кг;
среднетоксичные - ЛД50 -200-1000 мг/кг;
малотоксичные - ЛД50 - более 1000 мг/кг,
где ЛД50 - доза, вызывающая гибель подопытных животных.
Б) По кумулятивным (от лат. cumulatio -
скопление), свойствам - на вещества, обладающие:
сверхкумуляцией - коэффициент кумуляции менее 1;
- выраженной кумуляцией - коэффициент кумуляции 1-3;
умеренной кумуляцией - коэффициент кумуляции
3-5;
слабовыраженной кумуляцией - коэффициент
кумуляции более 5,
где коэффициент кумуляции - отношение суммарной
дозы препарата при многократном введении к дозе, вызывающей гибель животных при
однократном введении.
В) По стойкости:
очень стойкие - время разложения на нетоксичные
компоненты более 2 лет;
стойкие - время разложения 0,5-1 год;
умеренно стойкие - время разложения 1-6 мес.;
малостойкие - время разложения 1 мес. и менее.
Нарушение гигиенических норм хранения,
транспортирования и применения пестицидов приводят к их накоплению в кормах,
продовольственном сырье и пищевых продуктах. Попадая в организм человека, они
оказывают различное токсическое действие, в зависимости от особенностей
химической структуры и дозы.
.) Регуляторы роста растений (РРР)
применяют с целью влияния на процессы роста, развития и жизнедеятельности
растений, обеспечения урожайности, улучшения качества продукции, облегчения
уборки. К этой группе соединений можно отнести также гербициды, вызывающие
задержку роста и гибель растений, при этом гербициды в зависимости от дозы,
могут проявлять как ингибирующее, так и стимулирующее действие. В отличие от
гербицидов, РРР создают подобный эффект в значительно более малых дозах -
граммах и миллиграммах действующего вещества на гектар.
Все существующие регуляторы роста растений можно
разделить на две группы: природные и синтетические.
Природные РРР - это присущие растениям
соединения, выполняющие роль фитогормонов: ауксины, гиббереллины, цитокинины,
абсцизовая кислота, этилен и др. Они не представляют какой-либо опасности для
человека, так как в процессе эволюции человеческого организма вырабатывались
соответствующие механизмы их биотрансформации.
Синтетические РРР получают химическим или
микробиологическим путем. С физиологической точки зрения они являются аналогами
эндогенных фитогормонов, либо могут оказывать влияние на гормональный статус
растений.
К этой группе относятся:
производные сульфонилмочевины;
азоксофор;
биферан (предпосевная обработка клубней
картофеля);
кротонолактон (обработка семян риса);
квартазин (семян ячменя, пшеницы, ржи);
фумар (саженцев) и др.
В отличие от природных, синтетические РРР могут
оказывать вредное воздействие на организм человека, как ксенобиотики, однако
степень опасности многих из них полностью не изучена. Известно, что механизм
действия высоких доз РРР заключается в подавлении активности
ацетолактатсинтетазы - ключевого фермента на раннем этапе биосинтеза ряда
аминокислот. Предполагается при этом, что ростостимулирующее действие низких доз
связано с влиянием на эндогенный уровень природных гормонов или непосредственно
на клеточные структуры.
Используют регуляторы роста растений и для
увеличения сроков хранения растительных продуктов, например, картофеля,
моркови, лука, репы и др. При этом сохраняется водный баланс, вкусовые
качества, витамины, минеральные вещества, другие показатели пищевой ценности.
Вместе с тем, по причине отсутствия полной
ясности о скрытых механизмах воздействия РРР на обменные процессы растений,
специалистами не исключается возможность их негативного влияния, связанного с
нарушением внутриклеточного обмена и образования токсичных соединений. К тому
же, как установлено, остаточные количества РРР в продовольственном сырье и
продуктах питания могут сами проявлять токсические свойства.
Потенциальная опасность регуляторов роста
растений для человека усугубляется стойкостью этих соединений в окружающей
среде и продуктах питания.
.) Удобрения. Применение удобрений в
сельском хозяйстве имеет важное значение для управления плодородием почв,
повышения урожайности и пищевой ценности сельскохозяйственных культур.
Нарушение агрохимических и гигиенических регламентов применения удобрений
приводит к их чрезмерному накоплению в почве, растениях, к загрязнению
продовольственного сырья и пищевых продуктов, что оказывает токсическое
действие на организм человека.
В зависимости от химического состава различают
удобрения азотные, фосфорные, калийные, известковые, микроудобрения,
бактериальные, комплексные и др. Условно их можно подразделить на минеральные и
органические. Необходимость в удобрениях обусловлена тем, что естественный
круговорот азота, фосфора, калия и других питательных для растений соединений
не может восполнить потерь этих биоэлементов, уносимых из почвы с урожаем.
Азот играет очень важную роль в
жизнедеятельности растений как компонент белков, нуклеиновых кислот, витаминов,
других биологически активных веществ. Азотные удобрения, в зависимости от формы
соединения азота, существуют в следующих видах:
аммиачные - азот присутствует в виде свободного
аммиака (жидкий, водный, безводный);
аммонийные - азот представлен ионом аммония
(сульфат аммония);
нитратные - азот находится в составе остатка
азотной кислоты (натриевая и кальциевая селитры);
аммонийнонитратные - содержат азот в аммонийной
и нитратной формах (аммиачная селитра);
амидные - представлены мочевиной - амидом
карбаминовой кислоты, превращающимся в почве под воздействием уреазы бактерий в
углекислый аммоний;
К медленнодействующим азотным удобрениям
относятся мочевиноформальдегидные, мочевиноальдегидные, изобутилдиендимочевина,
оксамид и некоторые другие. Нитратная форма удобрений в допустимых дозах
способствует образованию в растениях аскорбиновой кислоты и кальция, аммонийная
- фосфора.
Фосфорные удобрения различаются количеством
оксида фосфора Р2О5, один из самых
распространенных видов - суперфосфат. Накопление в почве и растениях
чрезмерного количества Р2О5 тормозит протекающие в них
биологические процессы.
Калийные удобрения - калийная соль (калий
хлористый), калиймагнезиальное удобрение (КСl+NaCl+MgSO4), калийно-аммиачная селитра
(КNО3+NH4Cl) и др. Калий не входит в
органический состав веществ растений, он активно участвует в углеводном и
белковом обменах.
Микроудобрения необходимы для обогащения почвы
микроэлементами, наибольшее распространение из них получили борные,
молибденовые, медные, марганцевые, цинковые и кобальтовые.
Комплексные удобрения содержат комплекс
питательных для растений элементов - фосфорно-азотные, фосфорно-калийные и др.
С целью повышения продуктивности
сельскохозяйственных животных, профилактики их заболеваний и сохранения
доброкачественности кормов в животноводстве широко применяются различные
кормовые добавки, а также лекарственные и химические препараты: аминокислоты,
минеральные вещества, ферменты, антибиотики и другие антибактериальные
вещества, транквилизаторы (от лат. tranquillo - успокаиваю, психотропные
средства, уменьшающие чувство напряжения, тревоги, страха), антиоксиданты
(природные или синтетические вещества, замедляющие или предотвращающие
окисление органических соединений), красители, ароматизаторы и др.
.) Антибактериальные вещества.
Антибиотики, наряду с сульфаниламидами и нитрофуранами, относятся к
антибактериальным веществам, которые интенсивно применяются в ветеринарии и
животноводстве для ускорения откорма, профилактики и лечения эпизодических
заболеваний, улучшения качества кормов, их сохранности и т.д. Добавляются, как
правило, в корм в количестве 50-200 г на 1 тонну. Около половины производимых в
мире антибиотиков применяется в настоящее время в животноводстве.
Антибиотики способны переходить в мясо, молоко
животных, яйца птиц и многие другие продукты и оказывать токсическое действие
на организм человека. Эта проблема усугубляется существованием R-плазмидной
(внехромосомной) передачи лекарственной устойчивости, как в организме людей,
так и животных: R-фактор обладает способностью переносить от бактерии к
бактерии устойчивость к множеству антибиотиков сразу и, что особенно опасно,
делает возможным передачу резистентности (от лат. resisto - сопротивляюсь) от
непатогенных бактерий к патогенным видам, например от S. faecalis к S. aureus,
от E. coli к Salmonella или Shigella. Существование внехромосомной передачи
лекарственной устойчивости может быть причиной снижения терапевтического эффекта
антибиотиков.
Антибиотики могут быть природными компонентами в
пищевых продуктах или попадать в них в результате технологических процессов,
как, например, при созревании сыров. Такие антибиотики в определенных небольших
количествах могут быть полезны для человека, в ряде случаев они определяют
вкусовые и диетические свойства продукта.
Антибиотики, содержащиеся в пищевых продуктах в
количествах, превышающих допустимые нормы, могут оказывать аллергическое (от
греч. allos - другой и ergon - действие, повышенная или извращенная
чувствительность организма к какому-либо аллергену - веществу, вызывающему
аллергию) действие. При этом наиболее сильными аллергенами являются пенициллин
и тилозин. Очевидно, что это обуславливает необходимость эффективного контроля
как за применением антибиотиков в ветеринарии и животноводстве, так и за их
возможными остаточными количествами в продовольственном сырье и продуктах
питания.
Сульфаниламиды, также как и антибиотики,
оказывают антимикробное действие. Оно менее эффективно, чем у антибиотиков,
однако для борьбы с инфекционными заболеваниями животных сульфаниламиды более
доступны. При этом концентрация сульфаниламидов в кормах достигает десятков
миллиграммов на 1 кг, они способны накапливаться в организме животных,
загрязнять молоко, мясо, яйца, мед, а также изготовленные из них продукты. Как
показал опыт, наиболее часто обнаруживаются следующие сульфаниламиды:
сульфаметазин, сульфахиноксазолин, сульфадиметоксин и сульфаметозин.
Нитрофураны, также относящиеся к
антибактериальным препаратам, обладают бактерицидным (от бактерии и лат. caedo
- убиваю; свойство химических веществ - бактерицидов, физических и
биологических факторов - температура, ионизирующее излучение и др. - вызывать
гибельбактерий) и бактериостатическим (стат - от греч. statos - стоящий,
не-подвижный; часть слова, указывающая на неизменность состояния, постоянство
чего-либо) действием. Наибольшую антимикробную активность проявляют
5-нитро-2-замещенные фураны, которые различаются по способу применения,
длительности циркуляции в организме и пр. Важной особенностью нитрофуранов
является их эффективность в борьбе с инфекциями, устойчивыми к сульфаниламидным
препаратам и к антибиотикам.
Накопление нитрофуранов в органах и тканях
животных зависит от сроков отмены препаратов перед убоем, которые составляют от
5 до 20 суток, увеличение срока особенно важно для кур-несушек. Считается, что
остатки этих лекарственных препаратов не должны содержаться в пище человека,
поэтому их допустимые концентрации в продуктах питания отсутствуют. Вместе с
тем имеются фактические данные, свидетельствующие о возможной контаминации
нитрофуранов
.) Гормональные препараты . Гормональные
препараты (ГП) используются в ветеринарии и животноводстве для стимуляции роста
животных, улучшения усвояемости кормов, многоплодия, регламентации сроков
беременности, ускорения полового созревания и др. Многие гормональные препараты
обладают выраженной анаболической (от греч. anabole - подъем (ассимиляция) -
совокупность химических процессов в живом организме, направленных на
образование и обновление структурных частей клеток и тканей, составляет
противоположную катаболизму сторону обмена веществ и заключается в синтезе
сложных молекул из более простых с накоплением энергии) активностью и
применяются в этой связи для откорма скота и птицы: полипептидные и белковые
гормоны (инсулин, соматотропин и др.); производные аминокислот - тиреоидные
гормоны; стероидные гормоны, их производные и аналоги.
Следствием применения гормональных препаратов в
животноводстве является проблема загрязнения ими продовольственного сырья и
продуктов питания.
.) Азотосодержащие кормовые добавки. В
сельскохозяйственном производстве в качестве азотосодержащей кормовой добавки
длительное время применяли мочевину. В желудке жвачных она расщепляется до
аммиака, который используется микроорганизмами для синтеза белка. Однако
передозировка мочевины может приводить к интоксикации, а в ряде случаев - и к
гибели крупного рогатого скота. Более перспективной азотосодержащей кормовой
добавкой является полиакриламид, кормовая ценность которого обеспечивается
наличием группы NH2.
Применение лекарственных препаратов и кормовых
добавок в ветеринарии, животноводстве и птицеводстве требует соблюдения
определенных гигиенических правил, направленных на снижение загрязнения
продовольственного сырья и продуктов питания. При этом важно обеспечить
необходимый контроль остаточных количеств загрязнителей в продуктах питания с
использованием быстрых и надежных методов их анализа.
Продукты питания человека, как правило, представляют
собой сложные многокомпонентные системы, состоящие из сотен различных
химических соединений, которые принято подразделять на следующие три основные
группы.
А) Соединения, имеющие алиментарное (от лат.
alimentum - пища, содержание) значение; это необходимые организму нутриенты (от
позднелат. nutritio - питание): белки, жиры, углеводы, витамины, минеральные
вещества.
Б) Вещества, участвующие в формировании вкуса,
аромата, цвета, предшественники и продукты распада основных нутриентов, другие
биологически активные вещества, которые являются условно неалиментарными; к
этой группе относят также природные соединения, обладающие антиалиментарными
(например, антивитамины) и токсическими (фазин в фасоли, соланин в картофеле и
др.) свойствами.
В) Чужеродные, потенциально опасные соединения
антропогенного (от греч. anthropos - часть сложных слов, означающая:
относящийся к человеку) или природного происхождения; согласно принятой
терминологии, их называют ксенобиотиками (от греч. xenos - чужой и bios -
жизнь), а также контаминантами (от лат. contaminatio - соприкосновение,
смешение); эти соединения могут быть неорганической и органической природы, в
том числе микробиологического происхождения.
Основными путями загрязнения продовольственного
сырья и продуктов питания являются:
использование неразрешенных красителей,
консервантов, антиоксидантов и других пищевых добавок или их применение в
повышенных дозах (от греч. dosis - порция, прием - точно отмеренное количество
чего-либо: вещества, лекарства);
применение новых, не прошедших соответствующую
апробацию (лат. approbatio - одобрение, утверждение, основанное на проверке,
обследовании, испытании) нетрадиционных технологий производства продуктов
питания или отдельных пищевых веществ, в том числе полученных путем химического
и микробиологического синтеза;
загрязнение сельскохозяйственных культур и
продуктов животноводства пестицидами (от лат. pestis - зараза и caedo - убиваю)
- ядохимикатами, используемыми для борьбы с вредителями растений и в
ветеринарной практике - для профилактики заболеваний животных;
нарушение гигиенических (от греч. hygieinos -
здоровый) правил использования в растениеводстве удобрений, оросительных вод,
твердых и жидких отходов промышленности и животноводства, коммунальных и других
сточных вод, осадков очистных сооружений и т.д.;
использование в животноводстве и птицеводстве
неразрешенных кормовых добавок, консервантов, стимуляторов роста,
профилактических и лечебных медикаментов или их применение в повышенных дозах;
миграция в продукты питания токсических веществ
из пищевого оборудования, посуды, тары, упаковки при использовании
неразрешенных неметаллических материалов, в т.ч. полимерных, или металлов;
образование в пищевых продуктах эндогенных (от
греч. endon - внутри), токсических (от греч. toxikon - яд) соединений в
процессе теплового воздействия, кипячения, жарения, облучения и других способов
технологической обработки;
несоблюдение санитарных требований к технологии
производства и хранения пищевых продуктов, приводящее к образованию
бактериальных токсинов: микотоксинов (от греч. mykes - гриб), ботулотоксинов
(от лат. botulus - колбаса, - пищевая токсикоинфекция (от лат. infectio -
заражение, - внедрение и размножение в организме человека или животного
болезнетворных микроорганизмов), в результате отравления продуктами,
зараженными палочками ботулизма и их токсинами) и др.;
поступление в продовольственное сырье и продукты
питания токсических веществ, в т.ч. радионуклидов, из окружающей среды:
атмосферы, гидросферы, литосферы.
Наибольшую опасность с точки зрения
распространенности и токсичности имеют следующие ксенобиотики и контаминанты.
А) Токсины микроорганизмов, которые относятся к
числу наиболее опасных природных загрязнителей, широко распространены в
растительном сырье. Так, в, арахисе, кукурузе и ячмене, в т.ч. в поступающих по
импорту (от лат. importo - ввожу), обнаруживаются афлатоксины, вырабатываемые
плесневыми грибами, главным образом аспергиллами, оказывающие токсическое
действие на печень млекопитающих, птиц, рыб, потенциальные канцерогены; токсин
патулин, как правило, выявляется в продуктах переработки фруктов - соки,
фруктовые пюре и джемы, что связано с нарушениями основной технологии основного
производства и использованием нестандартного сырья.
Б) Токсические химические элементы, в т.ч. тяжелые
металлы, основной источник загрязнения которых - тепловая энергетика,
добывающая, металлургическая и химическая промышленность.
В) Антибиотики (греч. anti- - против и греч.
bios - жизнь; органические вещества, образуемые микроорганизмами и обладающие
способностью убивать микробов или препятствовать их росту; антибиотиками
называются также антибактериальные вещества, извлекаемые из растительных и
животных клеток) - как результат нарушений их примененияв ветеринарной
практике; остаточные количества антибиотиков обнаруживаются в 15-25% продукции
животноводства и птицеводства.
Г) Пестициды - накапливаются в продовольственном
сырье и пищевых продуктах вследствие неправильного использования химических
средств защиты растений, особую опасность при этом вызывает одновременное
наличие нескольких пестицидов, уровень которых превышает предельно допустимую
концентрацию (ПДК).
Д) Нитраты, нитриты и нитрозоамины, наличие
которых в продуктах питания связано с нерациональным использованием азотистых
удобрений и пестицидов, приводящее к их накоплению, а также усилению процессов
нитрозирования (нитрозирование - введение в молекулу органического соединения
нитрозогруппы N-О, при этом образуются нитрозосоединения, нитрозоамины R2NNO, оксимы R2CNOH) в объектах окружающей среды
и в организме человека, и, как следствие этого, образо-ванию высокотоксичных
соединении - N-нитрозоаминов; по данным Института питания РАМН РФ в настоящее
время N-нитрозоамины встречаются практически во всех мясных, молочных и рыбных
продуктах, при этом до 35% мясных и до 50% некоторых рыбных продуктов содержат
их в концентрациях, превышающих гигиенические нормативы.
Е) Диоксины и диоксиноподобные соединения
(диоксин - бесцветные кристаллы, tпл. 320-325°С; диоксин и близкие к нему по
строению соединения - источники загрязнения окружающей среды, химически
инертны, способны накапливаться в организме, наиболее высокотоксичны); являются
хлорорганическими, особо опасными ксенобиотиками, образуются как побочные
продукты при синтезе некоторых гербицидов (от лат. herba - трава и caedo -
убиваю; химические препараты из группы пестицидов для уничтожения
нежелательной, главным образом сорной, растительности; включают арборициды и
альгициды), а также в целлюлозно-бумажной промышленности, при сжигании мусора и
пр.; основными источниками диоксинов являются предприятия, производя-щие
хлорную продукцию.
Ж) Полициклические ароматические углеводороды
(ПАУ) - образуются преимущественно в результате техногенных процессов, но также
и природных процессов.
З) Радионуклиды - искусственные и природные
источники.
И) Пищевые добавки - красители, консерванты,
антиоксиданты, стабилизаторы, подсластители, ароматизаторы и пр.; их применение
регламентируется нормативной документацией и наличием соответствующего
разрешения санитарных органов здравоохранения [1].
1.2 Биотестирование ингибирующих веществ с
помощью микроводорослей
1.2.1 Характеристика микроводорослей и их
классификация
В основу разграничения водорослей по основным
таксонам (царствам, отделам, классам и др.) положены следующие признаки: тип
фотосинтетических пигментов, а следовательно, и окраска клеток; наличие
жгутиков, их строение, количество и способ прикрепления к клетке; химический
состав клеточной стенки и дополнительных оболочек; химический состав запасных
веществ; число клеток в талломе и способ их взаимодействия.
К началу 20в. Различали следующие классы
водорослей по Пашеру:
сине-зеленые водоросли - Cynophceae;
красные водоросли - Rhodophyceae;
зеленый водоросли - Chlorophyceae;
золотистые водоросли - Chrysophyceae;
желто-зеленые, или разножгутиковые, водоросли - Xanthophyceae,
или Heterocontae;
диатомовые водоросли -Bacillariophyceae,
или Diatomeae;
динофициевые водоросли - Dinophyceae;
криптофициевые водоросли - Cryptophyceae;
эвгленофициевые водоросли - Euglenophyceae.
Каждый класс характеризуется специфическим
набором пигментов, запасным продуктом, откладывающимся в клетке в процессе
фотосинтеза, и если есть жгутики, то их строением.
Прокариотические микроводоросли объединены в
подцарство - цианеи (Cyanobionta).
К нему относятся все сине-зеленые водоросли или цианеи. Это простого строения
организмы приспособленные жить в воде. Исторические связи этих водорослей с
бактериями проявляются в строении клеток. Но они отличаются от бактерий по
наличию хролофилла "а" и очень редко - "b".
В процессе фотосинтеза они выделяют кислород.
· Отдел Cyаnophyta
- сине-зеленые водоросли или цианеи
Большинство цианобактерий - облигатные
фототрофы, которые, однако способны к непродолжительному существованию за счёт
расщепления накопленного на свету гликогена в окислительном пентозофосфатном
цикле и в процессе гликолиза.
Цианобактерии, по общепринятой версии, явились
"творцами" современной кислородсодержащей атмосферы на Земле, что
привело к "кислородной катастрофе" - глобальному изменению состава
атмосферы Земли, произошедшему в самом начале протерозоя (около 2,4 млрд лет
назад) которое привело к последующей перестройке биосферы и глобальному
гуронскому оледенению. В настоящее время,
являясь значительной составляющей океанического планктона, цианобактерии стоят
в начале большей части пищевых цепей и производят значительную часть кислорода
(вклад точно не определен: наиболее вероятные оценки колеблются от 20 % до 40
%).
Цианобактерия
Synechocystis стала первым фотосинтезирующим организмом, чей геном был
полностью расшифрован. Рассматривается
возможное применение цианобактерий в создании замкнутых циклов
жизнеобеспечения, а также как массовой кормовой или пищевой добавки.
Классификация:
Порядок Chroococcales - Хроококковые:
Класс Gloeobacteria;
Порядок Nostocales - Ностоковые;
Порядок Oscillatoriales - Осциллаториевые;
Порядок Pleurocapsales - Плеврокапсовые;
Порядок Prochlorales - Прохлорофиты;
Порядок Stigoneomatales - Стигонемовые.
Эукариотические микроводоросли одно- или
многоклеточные, различно окрашенные, первично фотоавтотрофные растения, большей
частью живущей в воде. Пластиды этих водорослей содержат хролофилл и чаще всего
дополнительный хролофиллы "b",
"с" каротиноиды, ксантофиллы и редко фикобилины. Донором электронов
для фотосинтеза служит вода. Ранее водоросли классифицировали в составе Царства
Растений, где они составляли обособленную группу. Однако с развитием
молекулярно-генетических методов систематики стало ясно, что эта группа
филогенетически очень неоднородна. В настоящее время водоросли относят к двум
Царствам эукариот: Chromista и Protista.
Водоросли, относящиеся к Царству Chromista
Фотосинтезирующие хромисты обычно содержат в
хлоропластах не свойственный растениям каротиноид фукоксантин, а иногда и
другие специфические пигменты, а также хлорофилл с. Еще одной особенностью
клеток хромистое является наличие двух эукариотических жгутиков, один из
которых обычно перистый - имеет трубчатые ответвления основной нити. Хлоропласт
и ядро чаще окружены общей мембраной, при этом в хлоропласте имеются
светочувствительные гранулы (стигма), воспринимающие изменения интенсивности
освещения и обусловливающие фототаксис. Запасными веществами хромистое является
не крахмал, как у растений, а жироподобное вещество лейкозин, полисахарид
ламинарии или другие специфические полисахариды. Типичная по структуре клетка
хромистое изображена в соответствии с рисунком 1.
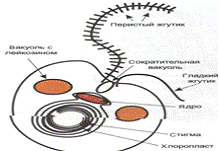
Рисунок 1 - Структура клеток представителей
Царства Chromista
- Подцарство Водоросли (Phycobionta):
· Отдел Bacillariophyta-
диатомовые водоросли:
Являясь важнейшей составляющей морского
планктона, диатомовые создают до четверти всего органического вещества планеты.
Только коккоиды, форма разнообразна. В основном
одиночные, реже - колониальные. Большинство представителей этого отдела
одноклеточные, однако встречаются ценоцитные и нитчатые формы. Диатомовые
водоросли играют очень важную роль в трофических связях водных организмов,
являясь основным компонентом фитопланктона, а также придонных осадков. Будучи
фотосинтезирующими организмами, они служат главным источником пищи для
пресноводных и морских животных. Считается, что на их долю приходится до
четверти всего совершаемого на нашей планете фотосинтеза.
Хлоропласты диатомей содержат хлорофиллы а и с,
а также фукоксантин. Размножение в основном бесполое - путем деления клетки.
Запасным веществом служит лейкозин.
У диатомовых водорослей жгутиковая стадия
представлена только мужскими гаметами (у некоторых видов). Поэтому подвижные
формы передвигаются за счет направленного перетекания цитоплазмы в районе шва
панциря, в котором цитоплазма и мембрана граничат с окружающей средой. Эти
организмы имеют уникальные двустворчатые панцири, состоящие из кремнезема (SiO2∙nН2O)
и формирующие две половинки, вставляющиеся одна в другую. Створки панциря имеют
тонкую орнаментацию и выглядят очень красиво. Известно более 10 тысяч видов
диатомей, которые отличаются поразительным разнообразием и тончайшей
филигранностью.
При отмирании клеток кремниевые скелеты не разрушаются,
они накапливаются в течение десятков миллионов лет на дне водоемов. Эти
отложения называют "диатомовым илом" и используют в качестве
абразивного материала для полировки, а также для фильтрования.
· Отдел Chrysophyta
- золотистые водоросли:
Включают в себя преимущественно микроскопические
водоросли различных оттенков жёлтого цвета.
Большинство золотистых водорослей -
одноклеточные, реже колониальные, ещё реже многоклеточные организмы.
В основном золотистые водоросли - миксотрофы, то
есть, имея пластиды, способны поглощать растворённые органические соединения
и/или пищевые частички. У некоторых тип питания (автотрофный, миксотрофный или
гетеротрофный) зависит от условий окружающей среды или клеточного состояния.
Вегетативное размножение происходит путём
продольного деления клетки пополам или фрагментами колонии слоевища. Бесполое
размножение осуществляется с помощью одно- или двужгутиковых зооспор, или,
реже, апланоспор и амёбоидов. Половое размножение лучше всего описано у
представителей с домиками благодаря хорошо наблюдаемому образованию зигот.
Клетки прикрепляются друг к другу в зоне отверстия домика, и их протопласты
сливаются, образуя зиготу.
Насчитывается более тысячи описанных видов
золотистых водорослей, большинство из которых представлено подвижными за счет
жгутиков одноклеточными формами, однако встречаются и нитевидные, и
колониальные виды. Некоторые представители имеют амебоидное строение клеток и
отличаются от амеб только наличием хлоропластов.
Многие хризофиты лишены клеточной стенки, но имеют
кремнеземовые чешуйки или скелетные элементы. Запасным веществом служит
хризоламинарин. Фотосинтетические пигменты представлены хлорофиллами а и с, а
также каротинами и ксантофиллами, которые придают клеткам золотисто-коричневый
оттенок.
Золотистые водоросли, как правило, обитают в
планктоне, но встречаются и донные, прикреплённые формы. Входят в состав
нейстона. Большинство золотистых водорослей встречается в основном в
пресноводных бассейнах умеренного климата, достигая наибольшего видового
многообразия в кислых водах сфагновых болот, что связано с образованием у них
кислых, а не щелочных фосфатаз. Они необычайно требовательны к содержанию
железа в воде, которое используют для синтеза цитохромов. Меньшее количество
видов обитает в морях и солёных озёрах, единичные обнаружены в почве. Максимума
развития золотистые водоросли достигают в холодное время года: в планктоне они
доминируют ранней весной, поздней осенью и зимой. В это время они играют
значительную роль как продуценты первичной продукции и служат пищей
зоопланктону. Некоторые золотистые водоросли (р. Uroglena, Dinobryon,
Mallomonas, Synura; Prymnesium parvum), развиваясь в массовом количестве,
способны вызывать цветение воды.
Цисты золотистых водорослей, встречаемые в
осадках со дна водоёмов, используют в качестве экологических индикаторов для
изучения условий окружающей среды в прошлом и настоящем. Золотистые водоросли
улучшают газовый режим водоёмов, имеют значение в образовании илов и
сапропелей.
· Отдел Cryptophyta
- криптофитовые водоросли:
Криптофиты - небольшая, но экологически и
эволюционно очень важная группа организмов, обитающих в морских и
континентальных водах. Почти все они - одноклеточные подвижные жгутиконосцы,
некоторые представители способны формировать пальмеллоидную стадию. Только один
род Bjornbergiella (выделен из почв Гавайских островов) способен к образованию
простых нитчатых талломов (положение этого рода до конца не выяснено, и в ряде
систем его не относят к криптофитам), оспаривается и существование колониальных
форм.
Среди криптомонад встречаются автотрофы,
гетеротрофы (сапротрофы и фаготрофы) и миксотрофы. Большинство из них требуют
витамин В12 и тиамин, некоторые нуждаются в биотине. Криптомонады могут
использовать аммоний и органические источники азота, но морские представители
менее способны к превращениям нитратов в нитриты по сравнению с другими
водорослями. Органические вещества стимулируют рост криптомонад.
Основной способ размножения криптомонад -
вегетативный, за счёт деления клетки пополам с помощью борозды деления. При
этом впячивание плазмалеммы идёт начиная с заднего конца клетки. Чаще всего
делящаяся клетка сохраняет подвижность. Максимальная скорость роста для многих
криптомонад - одно деление в день при температуре около 20 °С. Дефицит азота и
избыточное освещение стимулируют образование покоящихся стадий. Покоящиеся
цисты окружены толстым экстрацеллюлярным матриксом.
Криптофитовые - типичные представители
планктона, изредка они встречаются в иле солёных озёр и среди детрита в пресных
водоёмах. Они занимают видное положение в олиготрофных, умеренных и
высокоширотных, пресных и морских водах.
Пресноводные представители предпочитают
искусственные и естественные водоёмы со стоячей водой - отстойники, различные
пруды (биологические, технические, рыбоводные), реже встречаются в
водохранилищах и озёрах. Они образуют крупные популяции в озёрах на глубине
15-23 м, в месте соединения слоёв воды, богатых и бедных кислородом, где
уровень света значительно ниже, чем у поверхности. Бесцветные представители
распространены в водах, загрязнённых органическими веществами, их много в
сточной воде, поэтому они могут служить показателем загрязнения воды
органическими веществами.
Среди криптофит встречаются типичные
сфагнофиллы, живущие в болотах с низким значением рН, в то время как ряд видов
может развиваться в широком диапазоне рН.
· Отдел Haptophyta
- гаптофитовые водоросли:
Гаптофиты - это группа аутотрофных, осмотрофных
или фаготрофных простейших, которые населяют морские экосистемы. Гаптофиты, как
правило, одноклеточные, но встречаются и колониальные формы. Несмотря на
маленький размер, эти организмы играют очень большую и важную роль в
геохимических циклах углерода и серы.
Многие гаптофиты помимо фототрофии способны к
осмотрофному и фаготрофному поглощению питательных веществ, таким образом,
миксотрофия для них - обычное явление.
Большинство примнезиофитов обитает в морях,
предпочитая открытые зоны, лишь немногие встречаются в пресных и солоноватых
водоёмах. Наибольшего биоразнообразия примнезиофиты достигают в водах,
содержащих минимальное количество биогенов, субтропических океанических
открытых водах, где встречаются даже на глубине более 200 м.
Некоторые примнезиофиты играют отрицательную
роль в природе. Так, виды, образующие кокколиты, участвуют в глобальном
потеплении климата как ключевые элементы в глобальном балансе улекислого газа.
Они могут вызывать "цветение" воды, которое из-за способности
кокколитов отражать свет, называют "белым".
· Отдел Xanthophyta
- желто-зеленые водоросли:
Водоросли, хлоропласты которых окрашены в
жёлто-зелёный или жёлтый цвет.
Среди ксантофитов встречаются одноклеточные
жгутиковые формы, а также колониальные, нитчатые и ценоцитные. Последние
представлены широко распространенным родом Vaucheria ("водяной
войлок"). Эти ценоцитные нитчатые слабоветвящиеся водоросли часто
обнаруживаются на периодически затопляемом прибрежном иле.
У большинства жёлто-зелёных известно
вегетативное и бесполое размножение.
Жёлто-зелёные водоросли входят в различные
экологические группы - планктон, реже в перифитон и бентос. Подавляющее
большинство из них - свободноживущие формы.
Водоросли, относящиеся к Царству Protista
Фотосинтезирующие Протесты в совокупности с
гетеротрофными Протистами входят в состав смешанных типов - Dinoflagellata
(динофлагелляты) и Euglenida (эвгленовые), а также представлены крупными
группами зеленых и красных водорослей. Динофлагелляты. Относящиеся к типу
Dinoflagellata водоросли иначе называют огненными (Pyrrhophyta) за способность
к биолюминесценции - явлению свечения, или испускания видимого света.
Большинство огненных водорослей представляют
собой одноклеточные формы с двумя жгутиками, часто причудливой и очень
разнообразной формы, с плотными целлюлозными пластинками, образующими клеточную
стенку в виде шлема или доспехов. Некоторые имеют довольно большие размеры,
достигая 2 мм в диаметре. Из-за наличия под плазматической мембраной большого
количества слоистых ячеек (альвеол) эти водоросли относят к особой группе
Протистов - альвеолятам.
Фотосинтезирующие динофлагелляты обычно содержат
хлорофиллы а и с, а также каротиноиды, их клетки бывают окрашены в золотистые и
буро-коричневые тона. Запасным веществом является крахмал. Эти водоросли часто
вступают в симбиотические отношения с морскими организмами (губками, медузами,
актиниями, кораллами, кальмарами и др.). В этом случае они утрачивают
целлюлозные пластинки и выглядят как золотистые сферические клетки, называемые
зооксантеллами. В таких симбиотических системах животное обеспечивает
динофлагелляты углекислотой, необходимой им для фотосинтеза, и предоставляет
защиту, а водоросли снабжают животное кислородом и органикой.
Основной способ бесполого размножения
динофлагеллят - продольное деление, реже встречается формирование зооспор.
Некоторые виды способны к половому размножению в ходе изогамии, иногда -
анизогамии.
Известно около 2000 видов ныне живущих
динофлагеллят, обитающих чаще в морских, реже - в пресноводных водоемах.
Фотосинтезирующие представители типа являются высокопродуктивными компонентами
морского планктона, способными, однако, вызывать массовые вспышки заболевания и
гибели рыбы, моллюсков, других животных. Оно объясняется необычайно бурным
развитием некоторых огненных водорослей, способных образовывать яды,
относящиеся к числу мощных нервных токсинов. В результате наносится огромный ущерб
морским промыслам, а кроме того, получают отравления люди, употребляющие в пищу
рыбу или моллюсков, питавшихся ядовитыми водорослями.
· Отдел Chlorophyta
- зеленые водоросли:
Самый обширный на данное время отдел водорослей.
По приблизительным подсчётам сюда входит около 500 родов и от 13 000 до 20 000
видов. Все они отличаются в первую очередь чисто-зелёным цветом своих слоевищ,
сходным с окраской высших растений и вызванным преобладанием хлорофилла над
другими пигментами. Чрезвычайно велик и диапазон их размеров - от нескольких
микрон до нескольких метров.
Преобладающими пигментами хлоропластов (как и у
растений) являются хлорофиллы а и Ь, отчего талломы окрашены в зеленый цвет.
Каротиноиды в хлоропластах многих одноклеточных Зеленых водорослей формируют скопление
в виде "глазка" (стигмы). Многие виды содержат в клетках
сократительные вакуоли, участвующие в осморегуляции. Одноклеточные формы обычно
подвижны за счет двух одинаковых жгутиков, причем жгутики не покрыты трубчатыми
ответвлениями, как у Хромистов.
Основным резервным материалом зеленых водорослей
является крахмал, а клеточные стенки большинства видов состоят из целлюлозы.
Эти признаки в совокупности с химическим составом фотосинтезирующих пигментов и
некоторыми особенностями строения отдельных клеточных элементов делают зеленые
водоросли очень похожими на растения. Кроме того, как и у растений, у зеленых
водорослей наблюдается смена генераций в жизненном цикле. Подобное сходство
позволяет считать зеленые водоросли непосредственными предками наземных
растений. Исследование малых рРНК показало, что отдельные представители данной
группы, в частности харовые водоросли, даже ближе по степени филогенетического
родства к растениям, чем к другим водорослям.
Размножение зелёных водорослей бывает
вегетативным, бесполым и половым.
Зелёные водоросли широко распространены по всему
миру. Большинство из них можно встретить в пресных водоёмах (представители
харофитов и хлорофициевых), но немало солоноватоводных и морских форм
(большинство представителей класса ульвофициевых). Среди них есть планктонные,
перифитонные и бентосные формы. Есть зелёные водоросли, которые приспособились
к жизни в почве и наземных местообитаниях. Их можно встретить на коре деревьев,
скалах, различных постройках, на поверхности почв и в толще воздуха. Массовое
развитие микроскопических зелёных водорослей вызывает "цветение"
воды, почвы, снега, коры деревьев и т. д.
Существуют паразитические представители зелёных
водорослей, большинство из которых в качестве хозяина имеют высшие растения.
· Отдел Euglenophyta
- эвгленовые водоросли:
У эвгленовых форма тела варьирует от
веретеновидной, овальной до плосколистовидной и игловидной. Передний конец тела
более или менее закруглён, задний может быть вытянутым и заканчиваться
заострённым отростком. Клетки могут быть спирально скручены. Длина клеток от 5
до 500 мкм и более.
Эвглениды имеют 1, 2, 3, 4 и 7 видимых жгутиков,
за исключением небольшой группы безжгутиковых форм, а также прикрепленных
организмов. Жгутики отходят от колбообразного впячивания на переднем конце
клетки - глотки (ампулы).
Светочувствительная система эвгленовых состоит
из двух структур. Первый компонент - это парафлагелларное тело (парабазальное
вздутие), представляет собой вздутие при основании одного видимого жгутика и
содержит синие светочувствительные флавины. Второй компонент системы - глазок
(стигма), расположенный в цитоплазме около резервуара напротив
парафлагелларного тела.
Эвгленовым водорослям свойственно автотрофное и
гетеротрофное (сапротрофное) питание. В последнем случае питательные вещества
поступают в клетку в растворенном виде, всасываясь всей ее поверхностью
(осмотрофный тип). Некоторые виды характеризуются также фаготрофным способом
питания. Известны ауксотрофные представители эвглен, зависимые по витаминам В12
и В,.
Если эвглен долго культивировать в подходящей
питательной среде в темноте, они могут утрачивать хлоропласты и неограниченно
долго демонстрировать гетеротрофный тип питания, ничем не отличаясь в этом
случае от простейших. Таким образом, эвглен можно считать простейшими с
нестабильным наследованием хлоропластов.
Эвгленовые водоросли обитают в основном в
пресных водах, предпочитая водоёмы с замедленным стоком и богатым содержанием
органических веществ. Их можно обнаружить в прибрежье озёр и рек, в мелких
водоёмах, включая лужи, на рисовых полях, на сырой почве. В почвах бесцветные
представители встречаются на глубине 8-25 см. Окрашенные эвгленовые могут
вызывать цветение воды, образуя на её поверхности плёнку зелёного или красного
цвета.
В значительной степени эвгленовые водоросли
реагируют на степень минерализации воды: чем она выше, тем беднее их
качественный и количественный состав. Некоторые выдерживают высокую солёность
воды.
Среди эвгленовых встречаются фотоавтотрофы,
гетеротрофы (фаготрофы и сапротрофы) и миксотрофы. Только треть родов способны
к фотосинтезу, а остальные - фаготрофы и осмотрофы. Даже фотосинтезирующие
эвгленовые способны к гетеротрофному росту. Большинство гетеротрофных форм -
сапротрофы, поглощающие растворённые в воде питательные вещества.
· Отдел Dinophyta
- динофитовые водоросли:
Большинство представителей -
двусторонне-симметричные или асимметричные жгутиконосцы с развитым
внутриклеточным панцирем.
Размножаются вегетативным, бесполым и половым
способом.
Морские и пресноводные формы, планктон и бентос,
иногда встречаются как симбионты растений, иногда - паразиты ракообразных и
червей. Могут вызывать цветение воды. Динофиты - важная группа фитопланктона в
морских и пресных водах. Их значение прежде всего определяется тем, что они
занимают второе место после диатомей как продуценты первичной продукции в
прибрежных морских водах, являются пищей для различных простейших, коловраток,
рыб. Большинство динофит (около 90 % видов) обитают в морских водах.
Подцарство Багряники (Rhodobionta):
· Отдел Rhodophyta
- красные водоросли:
Обычно это довольно крупные растения, но
встречаются и микроскопические. Среди красных водорослей имеются одноклеточные
(крайне редко), нитчатые и псевдопаренхимные формы, истинно паренхимные формы
отсутствуют. Ископаемые остатки свидетельствуют, что это очень древняя группа
растений. Обычно это довольно крупные растения, но встречаются и
микроскопические.
Для красных водорослей характерен сложный цикл
развития, не встречающийся у других водорослей.
Отдел красных водорослей (Rhodophyta) включает
виды, в клетках которых есть особый класс фотосинтетических пигментов -
фикобилинов (фикоцианин и фикоэритрин), придающих им красную окраску (поэтому
их называют багрянками). Эти вспомогательные пигменты маскируют цвет основного
фотосинтетического пигмента - хлорофилла а. Преобладающим резервным веществом
багрянок является крахмалоподобный полисахарид. Клеточные стенки этих
водорослей содержат целлюлозу или другие полисахариды, погруженные в слизистый
матрикс, который представлен, в свою очередь, агаром или карраги-наном. Эти
компоненты делают красные водоросли гибкими и скользкими на ощупь. Некоторые
багрянки откладывают в клетках карбонат кальция, что придает им жесткость.
Такие формы играют важную роль в формировании коралловых рифов.
Красные водоросли не имеют жгутиков, большинство
ведет неподвижный образ жизни в прикрепленном к камням или другим водорослям
состоянии.
В Баренцевом море красные водоросли - типичные
представители прибрежной бентосной растительности.
Некоторые виды красных водорослей употребляются
в пищу. Из красных водорослей также получают гелеобразующее вещество агар-агар
[2].
1.2.2 Способы выделения микроводорослей и их
идентификации
Выделение микроводорослей в культуру с помощью
традиционных методов является хорошо изученной процедурой. Впервые методы
выделения водорослей были описаны еще в конце XIX века М.Бейеринком и
П.Миквелом. Все водоросли условно можно разделить на две группы. В первую
группу входят виды, в английском языке часто называемые "weeds",
которые легко выделяются и культивируются. Ко второй группе относятся виды,
которые достаточно сложно выделяются и плохо культивируются. Поэтому не
удивительно, что организмы из экстремальных и необычных местообитаний менее
многочисленны в коллекциях культур, чем те, которые обитают в пресных водоемах,
почвах и возле морских побережий.
Часто первым шагом на пути к успешной изоляции
водорослей из их природной среды являются комплексные данные об их среде
обитания. Например, для прибрежных морских водорослей важными факторами
являются температура и соленость воды. Для океанского фитопланктона, кроме этих
факторов, важны качество воды и токсичность металлов. Пресноводные водоросли,
отобранные в весенне-летне-осеннее время, часто менее чувствительны к
температуре, но подвержены влиянию рН среды. Полярные водоросли и водоросли
снега очень чувствительны к высоким температурам, в то время как протисты
горячих источников чувствительны к более холодным температурам. Водоросли,
обитающие в кислых или засоленных местообитаниях, требуют специальных
питательных сред. Для наземных или почвенных водорослей факторы окружающей
среды менее значимы.
Для успешного культивирования необходимы и
знания таксономии. Для выращивания диатомовых водорослей необходим кремний,
эвгленовых - аммоний, некоторые виды (например, Chrysochromulina) нуждаются в
селене. Миксотрофные виды (например, некоторые динофлагелляты и золотистые
водоросли) нуждаются в добавлении источников питания для бактерий, бесцветные
фаготрофы (например, Pfiesteria) могут требовать эукаритотических источников
питания.
Следующим важным фактором, который нужно
учитывать при культивировании, является уничтожение загрязнителей, особенно
тех, которые могут конкурировать с нужным видом. Среди методов выделения
водорослей наиболее распространенными являются изоляция с помощью разведения,
изоляция отдельных клеток с помощью микропипеток, изоляция при помощи агара и
др. Конечный этап выделения требует создания условий для дальнейшего роста
водорослей. Иногда желаемый вид растет на начальных стадиях изоляции, но потом
погибает после нескольких пересевов на свежую среду. Это является показателем
того, что питательная среда лишена специфических элементов или органических
веществ, недостаток которых сразу не проявляется. К сожалению, исследователь
узнает об этом слишком поздно, когда оригинальный изолят уже погиб. Организм
может подавляться отходами жизнедеятельности, что отравляет его среду обитания,
приводя к гибели. В природе эти отходы обычно нейтрализуются другими
организмами.
Отбор образцов
Методы культивирования иногда являются
критическими точками при проведении экспериментальных работ, так как
поврежденные или мертвые клетки приводят к неудаче. Если нужный вид хорошо
известен, и если его собирали и изучали ранее, исследователь будет вооружен
багажом знаний, который позволит ему успешно культивировать эти водоросли.
Образцы, отобранные на глубине, могут быть
чувствительны к изменению давления, света или температуры. Образцы, отобранные
в чистые контейнеры и хранимые при постоянной температуре, часто обеспечивают
сохранение жизнеспособности водорослей, в то время как концентрированные среды
для отбора образцов оказываются непригодными. Ученый должен потратить много
времени, чтобы выделить несколько клеток нужного ему вида. Наконец, если отбор
проб ведется в местообитании, сведения об особенностях которого отсутствуют,
или если вид неизвестен, исследователь может использовать целый комплекс
методов для выделения и культивирования.
Природные образцы часто содержат мелких
животных. Эти животные могут быстро поедать и уничтожать водоросли. Более
крупные животные (например, коллемболы, ресничные черви и др.) и нежелательные
колониальные водоросли могут быть удалены путем фильтрации. Отверстия фильтра
должны пропускать водоросли и задерживать животных. Для удаления ненужных
организмов эффективно проводить фильтрацию сразу же после сбора образцов. Таким
же образом, если образец содержит большое количество более мелких нежелательных
организмов, таких как бактерии и другие водоросли, путем фильтрации можно
собрать нужные водоросли, которые остаются на поверхности фильтра.
Время является важным фактором во время
выделения водорослей. Некоторые организмы быстро погибают, даже спустя один или
несколько часов после сбора образцов. Выделение этих организмов должно
проводиться очень быстро. Когда образцы обогащаются, некоторые виды очень
быстро размножаются, но могут внезапно погибнуть. В этих случаях рекомендуется
следить за состоянием культуры через 1-2 дня. Наконец, некоторые организмы,
которые не обнаруживаются во время сбора образцов, появляются спустя недели или
даже месяцы.
Другим аспектом фактора времени является
изменение условий существования вида. Успешный рост выделенных клеток зависит
от условий или состояния клеток во время сбора образцов.
Во время сбора образцов другим важным фактором
является соблюдение условий стерильности. Грязная посуда, сети, фильтры и
другие приспособления для отбора образцов могут содержать устойчивые стадии
других организмов, особенно цисты, которые могут привести к загрязнению. Это
особенно важно, если исследователь пытается собрать пробы с неизвестными
организмами, потому что загрязнитель можно легко принять за вид, обитающий в
естественных условиях.
Среды, используемые при выделении водорослей
Выбор подходящей среды является важным условием
для успешного культивирования водорослей. Поэтому перед началом выделения самое
пристальное внимание следует уделить выбору среды для культивирования.
Одиночные клетки широко распространенных организмов (таких, как Chlorella,
диатомовые водоросли) хорошо растут после непосредственного помещения в готовую
среду. Однако многие другие водоросли погибают в питательных средах. Слишком
высокая концентрация солей является основной причиной неудачных попыток
культивирования многих видов. Поэтому при выделении водорослей лучше всего
использовать очень разбавленные среды. Для улучшения роста через неделю после
начала культивирования в разбавленную среду нужно добавить необходимое
количество питательных веществ. На разных стадиях роста культура требует
разного количества питательных веществ, поэтому необходимо осуществлять
постоянный мониторинг состояния культуры. После достижения необходимой скорости
роста культуру можно поддерживать на обычных питательных средах.
Прежде чем приступить к характеристике
разнообразных питательных сред, следует рассмотреть универсальные требования,
предъявляемые к ним:
питательная среда должна содержать достаточные
количества биогенных, макро- и микроэлементов в составе тех веществ, которые
используются данными микроорганизмами. При этом следует учитывать тип питания
микроорганизмов;
для инкубирования ауксотрофных микроорганизмов
среда должна содержать необходимые факторы роста;
среда должна содержать достаточное количество
воды, чтобы все вещества в ее составе были в растворенном состоянии. Следует
также учитывать потребность культивируемого микроорганизма к степени влажности,
активности воды;
среда должна характеризоваться определенными для
данного микроорганизма значением pH
и, по возможности, обладать высокой буферной емкостью, поскольку в процессе
роста культуры микроорганизмов выделяют продукты обмена (чаще кислые),
способные сильно изменить рН;
среда должна быть стерильной.
Природные образцы часто лишены одного или более
питательных веществ, однако в природе водоросли выживают, так как
жизнедеятельность бактерий и гибель организмов восполняет этот дефицит. В
отобранном образце это восполнение уменьшается или совсем прекращается, и этот
питательный стресс может вызвать гибель нужного вида. Таким образом, для
некоторых видов небольшое обогащение может продлить жизнь здоровых клеток
водорослей, необходимых для выделения культуры. Обогащение полевых образцов
может быть эффективным для океанических видов, когда отбор проб ведется на
корабле, особенно во время длительных путешествий. В этих случаях добавление
очень небольшого количества питательной среды или раствора солей позволяет
культуре сохраниться до конца путешествия. Однако обогащение может быть вредным
для водорослей в зависимости от места культивирования. Например, если нужный
вид является редким и не может конкурировать с более широко распространенными
видами, обогащение может снизить численность этого вида. В этом случае лучше не
обогащать образец. Обогащенную культуру лучше хранить в специальном шкафу для
инкубации, проверяя состояние нужного вида. После получения хорошо растущей
культуры выделяют этот вид. Если водоросль хорошо растет в обогащенной
культуре, это облегчает еѐ выделение.
Для подбора оптимального вещества для обогащения
можно провести следующий эксперимент. В 10 пробирок нужно поместить по 10мл
среды, и в каждую из пробирок добавить разные добавки (нитраты, фосфаты,
силикаты, аммоний, железо и т.д.). Кроме того, можно попытаться смешать разные
добавки. Затем в каждой из пробирок можно будет обнаружить различные организмы,
в зависимости от того, какие добавки эти организмы предпочитают. Более того, в
некоторых пробирках можно будет обнаружить организмы, не обнаруженные в среде
до обогащения.
В каком количестве нужно обогащающие добавки?
Хотя ответ на этот вопрос зависит от образца и среды, в целом ответ будет
таков: "не очень много". Максимальное количество добавки - столько
же, сколько содержится в обычной среде, содержащей этот компонент, минимум -
одна тысячная доля этого количества. Добавление аммония особенно полезно для
видов, нуждающихся в этом компоненте (например, для Aureoumbra). В некоторых
случаях (например, для Aureococcus) концентрации аммония свыше 20мкммоль
являются летальными. Таким образом, эти два вида водорослей, так похожие друг
на друга во многих отношениях, различаются по своей потребности в питательных
веществах.
Выборочное культивирование является
разновидностью обогащенного культивирования для специальных целей. Если целью
является выделение микроводорослей, которые могут расти при высоких
концентрациях углекислого газа, тогда среды обогащают углекислым газом. Таким
же образом могут быть составлены селективные культуры и по отношению к другим
факторам (высокая и низкая температура, свет, соленость, рН). Специальные
физические условия могут оказать сильное воздействие на рост культур. Например,
некоторые бентосные диатомеи, особенно крупные Pinnularia, лучше развиваются
при наличии осадка, по которому они могут двигаться и расти.
) Выделение клеток с помощью
микропипетки:
Этот метод является наиболее распространенным
методом выделения водорослей. В этом методе используется микропипетка Пастера
или стеклянный капилляр. Для этого пипетку Пастера нагревают в пламени
спиртовки, вытягивают с помощью пинцета и ломают.
После некоторой практики эта процедура
становится быстрой и легкой. Пипетку следует держать в одной руке, в другой
руке следует держать пинцет, придерживая наконечник. Пипетки следует слегка
покручивать, обеспечивая ее размягчение в точке плавления. Когда нагреваемый
участок расплавится, пипетку двигают в пламени и постепенно вытягивают для
получения тонкой трубочки. Если пипетку растягивать быстро и делать это в
пламени горелки, то получается очень тонкая ниточка. Некоторые исследователи
предпочитают работать с прямыми пипетками и затем загибать у них кончик.
Изогнутый кончик удобен для того, чтобы достать водоросли из глубокой емкости,
но прямой наконечник удобен для того, чтобы поместить водоросль в каплю воды.
После вытягивания кончика пипетки его следует остудить в течение пары секунд.
Затем пинцетом нужно найти участок в самом тонком месте, лучше всего перед
изгибом вниз. Затем легким движением нужно сломать пипетку и отломанный конец
выбросить. Если конец пипетки получился зубчатым, надо повторить всю процедуру,
так как неровный конец не позволит захватить нужную клетку.
Некоторые исследователи делают сразу несколько
микропипеток, в то время как другие предпочитают делать пипетку непосредственно
перед использованием. Использованную ранее пипетку можно снова использовать для
получения новых стерильных наконечников, при условии, что вода не попала в
пипетку при предыдущем использовании. При повторном использовании пипетки,
погружаемой в морскую воду, на стенках часто образуются микроскопические корки
из соли.
Целью изоляции с помощью микропипетки является
захват клетки водоросли из образца, перенесение клетки без повреждения в
стерильную каплю, новый захват клетки, и перенесение клетки в новую стерильную
каплю. Этот процесс повторяется до тех пор, пока одиночная клетка водоросли,
свободная от других протист, может быть перенесена в среду для культивирования
в соответствии с рисунком 2.

Рисунок 2 - Использование пипетки для удаления
нежелательных организмов.
В левой и средней части рисунка показано, как
удаляются нежелательные организмы, при этом в правой части рисунка показано,
что нужный организм остается в стерильной капле
Для организмов с прочной клеточной оболочкой
даже многоэтапная процедура изоляции не страшна, однако выделяя водоросли с
нежной оболочкой, нужно всегда помнить об осторожности.
При выделении водорослей необходимо использовать
микроскоп. Образец, содержащий нужный вид, может быть перенесен в стеклянную
или пластиковую чашку, планшету или любой другой контейнер. Стерильная капля
воды должна быть подготовлена до начала процесса выделения. Иногда
рекомендуется помещать каплю на агар для уменьшения испарения, однако это не
всегда необходимо. Кроме того, агар не прозрачен, как стекло или пластик, и
очень мелкие клетки на нем трудно разглядеть. Стерильная капля может состоять
из стерильной морской, озерной или речной воды, или питательной среды.
Водоросли должны выживать в капле, не испытывая стресса. Например, пресноводные
водоросли погибают в морской воде или концентрированной питательной среде.
) Выделение клеток с использованием агара:
Посев штрихом:
Выделение водорослей на агаровых чашках также
является одним из старейших и распространенных методов. Этот способ
предпочтителен для выделения многих коккоидных и большинства почвенных
водорослей. Популярность метода объясняется не только его легкостью, но и тем,
что аксеничные культуры могут быть получены без использования других процедур.
Для успеха этого метода водоросли должны растить на агаре. Некоторые флагелляты
(например, Heterosigma, Pelagomonas, Peridinium) не растут на агаре, другие
(например, Chlamydomonas, Pavlova, Synura, Tetra-selmis) растут очень хорошо.
Коккоидные клетки обычно очень хорошо растут на агаре, за некоторыми
исключениями (например, Aureococcus, Au-reoumbra). Большинство диатомовых
водорослей и некоторые криптофиты тоже хорошо растут на агаре.
В
большинстве случаев концентрация агара не является определяющим фактором, она
может колебаться от 0,8% до 1,5-2%. Некоторые водоросли растут на
"мокром" агаре (с концентрацией 0,3-0,6%), однако большинство
водорослей все же хуже растут на влажных агаризованных поверхностях.
Агар
также является хорошей средой для роста грибов и бактерий. Полевые образцы с
существенным грибным загрязнением могут принести много неприятных сюрпризов,
так как грибы растут очень быстро, образуя спорангии и споры, затрудняя
выделение водорослей. Для удаления нитей можно использовать фильтры и
органические вещества. Если рост грибов наблюдается в чашках Петри, то их лучше
сразу выбросить, не открывая. Наоборот, бактерии часто образуют маленькие
ограниченные колонии, и одновидовые культуры можно получить, если их аккуратно
перенести с поверхности твердой среды. Исключение составляют бактерии из
образцов бентоса, отобранные в тропиках, поскольку они часто содержат бактерии,
которые "растворяют" участки на поверхности агара.
Выделение водорослей методом "штриха"
аналогично методикам, используемым для изоляции бактерий. Микробиологической
петлей берут небольшое количество образца, который потом распределяют по
поверхности среды, используя одну из нескольких методик.
Сначала штрихи содержат большое число
водорослей, однако по мере движения петли число клеток уменьшается до одиночных
клеток. После посева водорослей чашки инкубируют до начала роста колоний. Время
инкубации варьирует от нескольких дней для почвенных и пресноводных водорослей
до нескольких месяцев для океанических видов. Затем колонии, образованные
потомками отдельных клеток, выделяют в культуру.
Колонии можно отделить с поверхности агара при
помощи микропипетки или нихромовой (платиновой) микробиологической петли.
Микропипетку обычно используют в сухих условиях. Если пипетка
"загружена" стерильной жидкостью, то небольшое количество жидкости
может рассеяться по колонии. Когда конец микропипетки коснется колонии,
некоторое число клеток попадает в пипетку. Затем микропипетку нужно быстро
опустить в сосуд с питательной средой или в другую чашку Петри. Клетки следует
осторожно выдуть из пипетки. Водоросли можно также посеять штрихом на другую агаровую
чашку. Если клетки были выделены из отдельных клеток с соблюдение правил
стерильности, постепенно можно получить чистую аксеничную культуру.
Культивирование водорослей внутри агара:
Некоторые водоросли не растут на поверхности
агара, но очень хорошо растут внутри него. Впервые эту методику использовал
М.Бейеринк, однако он использовал вместо агара желатин. К.Скиннер применял
интересную модификацию этого метода: он наливал агар в пробирки с водорослями,
а потом, после инкубации, разбивал пробирки и доставал колонии водорослей.
Е.Прингшейм обобщил историю методики выращивания внутри агара.
Позднее эту методику стали использовать для
выращивания океанских пикопланктоновых видов. Для получения погруженных в агар
колоний клетки из полевого образца или обогащенной культуры смешивают с жидким
агаром и потом разливаются в чашки Петри. Агар должен быть прохладным - чуть
выше температуры застывания - для предотвращения чрезмерного нагревания
водорослей. Для этих целей лучше использовать агар с низкой температурой
застывания. После этого чашки нужно остудить. Затем колонии нужно инкубировать
при нужной температуре и освещенности до появления колоний водорослей. Потом
можно выделить нужные водоросли с помощью микропипетки и поместить в жидкую
питательную среду. Хотя с помощью этой методики можно поддерживать культуру
достаточно длительное время, все же в большинстве случаев способ выращивания
клеток внутри агара используется для выделения культуры.
Методика автоматизированного распыления:
Этот способ может использоваться для посева
водорослей в чашки Петри. Методика может варьировать, однако суть метода
состоит в распылении суспензии клеток водорослей с помощью специальных
устройств. Для достижения лучших результатов эту процедуру лучше проводить в
стерильном боксе, чтобы бактерии и грибы не попали в чашку. После инкубирования
клеток выросшие колонии водорослей переносят в жидкую питательную среду.
Выделение водорослей методом перемещения через
агар:
Агаровые чашки могут быть использованы для
отделения нитчатых водорослей от эпифитов в качестве одного из этапов процесса
выделения. Существует много различных вариаций этой методики. Обычно при
использовании данного метода исследователи изготавливают из пипетки Пастера
крючок, и с помощью этого крючка протаскивают нить через агар. Для более
крупных нитей используется металлический крючок. Затем очищенная нить
помещается в жидкую питательную среду или в чашку с агаром.
Метод разбавления:
Метод разбавления используется уже в течение
многих лет, он эффективен для организмов, которые содержатся в образце в
большом количестве, но неэффективен для редко встречающихся организмов. Целью
метода разбавления является помещение клеток в пробирку, колбу или
"гнездо" пластиковой планшеты с последующим получением одноклеточных
изолятов в соответствии с рисунком 3. Если знать приблизительную концентрацию клеток, то можно легко
вычислить необходимое разведение, чтобы небольшой объем раствора (например,
одна капля, 50 мкл, 1мл) содержал одну клетку. Если приблизительная
концентрация клеток неизвестна и не может быть быстро вычислена, то можно
приготовить серию разбавленных растворов, уменьшая концентрацию от разведения к
разведению в 10 раз. В большинстве случаев пятое или шестое разведение имеет
необходимую концентрацию клеток (так, например, если в шестом разведении одна
капля содержит одну клетку, то концентрация в первоначальном растворе была 106
клеток *мл-1).
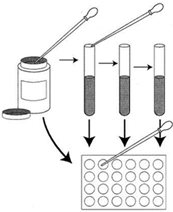
Рисунок 3 - Иллюстрация метода разбавления.
Аликвота берется из емкости с полевым образцом (слева)
и помещается в пробирки, содержащие стерильную среду. После перемешивания, одна
аликвота берется из пробирки и распределяется в планшету, содержащую стерильную
среду, вторая аликвота добавляется в средние гнезда. После перемешивания
процесс повторяется (распределение в гнезда и добавление в пробирки справа).
Каждый цикл заключается в разбавлении природного образца и увеличивает
возможность выделения отдельных клеток
Метод разбавления является наиболее
распространенным методом, используемым при культивировании случайных видов из
полевых образцов, особенно если целью исследователя является открытие новых
видов. Применяются различные варианты этой методики. Во-первых разведение может
проводится в питательной среде , дистиллированной воде (для пресноводных
организмов), морской воде (для морских организмов), отфильтрованной воде из
полевого образца, или комбинации из этих растворов. Питательная среда может
содержать все соли, необходимые для выделения широко распространенных
организмов, или же быть очень разбавленной для редких видов. Во-вторых, усилия
исследователей могут быть направлены на концентрации, при которых возможно
выделение отдельных клеток (10, 50, 100 попыток). Обычно делают большое
количество пробирок из последнего разведения, принимая во внимание, что в
некоторых пробирках клетки могут погибнуть, другие могут содержать несколько
видов, а в следующих водоросли вообще могут отсутствовать. В-третьих, в
некоторые пробирки могут быть добавлены микроэлементы (например, аммоний,
селен), если целью является выделение видов, которые нуждаются в этих добавках.
Таким же образом можно инкубировать водоросли при разной температуре и
освещенности. При помощи этой методики редко удается получить аксеничные
культуры, так как бактерии более многочисленны, чем водоросли.
) Разделение водорослей
центрифугированием и осаждением:
Разделение водорослей на основе силы тяжести
может быть эффективным для разделения организмов, различающихся по размерам.
Для этого используют два метода: центрифугирование и осаждение. Сила тяжести,
возможно, чаще используется для концентрации нужных организмов, чем для
получения одновидовых культур. Целью этой процедуры является отделение более
крупных и тяжелых клеток от более мелких клеток и бактерий. Легкая фильтрация в
течение короткого времени может использоваться для очистки диатомовых
водорослей и динофлагеллят от более мелких клеток. Эту процедуру можно
повторять до полной очистки культуры. Для быстро плавающих динофлагеллят этот
процесс нужно проводить очень быстро, так как водоросли могут уплыть обратно в
жидкость. Кроме того, сильное центрифугирование может повредить клетки,
особенно нежные организмы со стрекательными клетками. Сила и скорость
центрифугирования зависит от вида водоросли и определяется эмпирически.
Центрифугирование с использованием градиента плотности (например, силикатных
солей) также может использоваться для разделения лабораторных культур (Reardon
et al., 1979).
Метод осаждения применяется для разделения
неподвижных крупных или тяжелых клеток. Образец слегка встряхивается и
помещается в пробирку, колбу, цилиндр или другой сосуд для осаждения. Осаждение
проводят до тех пор, пока бóльшая
часть нужных клеток не осядет на дно, в то время как более мелкие клетки будут
оставаться в растворе. После этого верхняя часть раствора сливается. Этот
процесс можно повторять до получения нужного результата.
Как центрифугирование, так и осаждение
эффективны для концентрации крупных клеток, однако с помощью этих методов
трудно получить одновидовые культуры или выделить отдельные клетки. Для этих
целей нужно комбинировать центрифугирование и осаждение с другими методами
(фильтрацией, изоляцией клеток с помощью микропипеток и т.д.).
) Выделение с использованием фитотаксиса:
Фототаксис может быть использован для выделения
флагеллят. Этот метод эффективен, если образец содержит один доминирующий вид
флагеллят, обладающий фототаксисом. Если таких видов несколько, то процесс
выделения отдельных видов затрудняется. Для этого метода необходима установка,
включающая источник света. Самая простая установка представляет собой трубку со
стерильной средой, на одном конце которой находится образец с водорослями, а на
другом - источник света. После того как клетки продвинутся на достаточное
расстояние в стерильную жидкость, они могут быть отделены с помощью
микропипетки и помещены в стерильный сосуд. Для усовершенствования процесса
выделения было предложено специальное устройство, состоящее из колбы со
встроенным рукавом. Схема этого устройства изображена в соответствии с рисунком
4.

Рисунок 4 - Установка для выделения водорослей
на основе: a - флагелляты, обладающие способностью к фототаксису, засасываются
через конец пипетки и затем перемещаются через отверстия в пипетке. Конец
пипетки ломается в месте, указанном стрелкой и выбрасывается, а водоросли из
пипетки переносят в стерильную питательную среду; b - флагелляты, не способные
к фототаксису, концентрируются с помощью яркого света в узком рукаве колбы
(слева) и остаются там после выливания в результате закрывания отверстия рукава
стеклянным шариком
Образец и стерильные шарики помещаются в колбу,
рядом с которой устанавливается источник света. После того, как подвижные
клетки водорослей вследствие фототаксиса заплывают в рукав, колба наклоняется
так, что шарики закрывают рукав, в то время как оставшаяся жидкость выливается.
Более сложный метод предполагает использование
специально сконструированной микропипетки, отделяющей флагелляты от других
организмов. Часть наконечника пипетки ломается и выбрасывается, а клетки,
которые заплывают выше уровня пипетки, попадают затем в специальный сосуд.
Некоторые неподвижные клетки водорослей (например, Myxosarci-na) могут
двигаться через агар к источнику света. После миграции отдельные клетки можно
собрать и перенести в сосуд для дальнейшего культивирования.
) Специальные методы выделения водорослей:
Выделение пикопланктона:
Ультрапланктон (≤5мкм) и пикопланктон (≤2мкм)
из-за своих мелких размеров представляют трудности при выделении. Самым простым
методом изоляции мелких водорослей является выделение методов штриха на агаре.
Крошечные пресноводные водоросли достаточно легко выделяются на агаре. Сложнее
выделить океанские виды, однако для этих случаев имеются специальные
модификации этого способа. Океанские виды можно также выделить методом
разведения, однако таким образом не всегда удается выделить одиночные клетки.
Для изоляции пикопланктона можно использовать и
традиционную методику выделения с помощью микропипетки. Для очищения клеток от
разнообразных частиц необходимо иметь чистую каплю воды. Это особенно важно для
морских водорослей, так как в морской воде содержится большое число различных
примесей. Разбавленная почвенная вытяжка, рекомендованная Е.Прингшеймом,
подходит для выделения не только крупных пресноводных организмов, но и для
изоляции пикопланктона, если из нее предварительно будут удалены все частицы.
Частицы могут также образовываться на поверхности стекла при автоклавировании.
Стеклянная посуда иногда создает некоторые проблемы при выделении
пикопланктона. Для предотвращения образования частиц в жидкости (например,
морской воде, почвенной вытяжке или питательнойсреде) существует два простых
метода. Одним из методов может быть фильтрация с помощью фильтра с отверстиями
диаметром 0,2мкм. Другой метод заключается в том, что морской воде или
питательной среде дают отстояться в течение 1-3 дней, после чего надосадочную
жидкость аккуратно отбирают с помощью пластиковой пипетки.
При выделении пикопланктона следует соблюдать
условия стерильности, и ни в коем случае не допускать попадания пыли в
используемую посуду и материалы. Перед использованием посуды ее необходимо
обработать кислотой, а затем несколько раз сполоснуть бидистиллированной или
деионизированной водой. Посуду лучше стерилизовать в сухожаровом шкафу при температуре
250˚С в течение 3ч. При автоклавировании возможно образование микрочастиц
на поверхности сосуда, которые затем переходят в раствор. Лучше всего
использовать предварительно стерилизованную посуду, потому что ее поверхность
не содержит частиц. Для этой цели очень хорошо подходят стерильные чашки Петри.
Частицы могут образовываться также при стерилизации микропипетки в пламени. При
выделении водорослей частицы копоти могут попасть в каплю с водорослями и
затруднить их выделение. Таким образом, усилия исследователей должны быть
направлены на предотвращение попадания любых микрочастиц в раствор с
водорослями, потому что эти микрочастицы очень трудно отличить от
пикопланктона.
При выделении пикопланктона освещение является
критическим моментом. При работе с бинокулярной лупой освещение по методу
темного поля предпочтительнее проходящего света. При темнопольной иллюминации
крошечные клетки отражают свет таким образом, что их можно увидеть при
увеличении ×2 (рекомендуется
использовать большее увеличение). В жидкости клетки водоросли могут
переворачиваться, и даже маленькая вспышка света, исходящая от хлоропласта при
вращении клетки позволяет отличить клетку водорослей от бактерий или других
клеток. С помощью микропипетки можно захватить клетки и поместить в стерильную
каплю. Очень важным моментом является использование маленькой капли, так как
очень маленькую клетку трудно найти в большой капле. Необходимо работать очень
быстро, так как маленькая капля может быстро испариться. С помощью
инвертированного микроскопа можно легче выделить клетку.
Крошечные клетки часто бывают более
чувствительными к компонентам питательной среды, и после успешного выделения
клетка водорослей может погибнуть в питательной среде. Для океанских видов их
лучше всего поместить в каплю морской воды на несколько дней. После появления
признаков нормального роста водоросли можно перенести в питательную среду.
Выделение водорослей, прикрепленных к субстрату:
Некоторые организмы сильно прикрепляются к
поверхности, и во избежание повреждения клеток при их изоляции, необходимо
работать очень осторожно. При выделении таких необычных водорослей следует
использовать и неординарные методы изоляции. Например, обработка ультразвуком
или более сильное перемешивание в данном случае не подходят, так как клетки
могут затеряться, что сделает невозможным их дальнейшее выделение. Наиболее
простым способом выделения таких водорослей является смыв струей воды из
микропипетки. После смыва клетки следует быстро захватить, сполоснуть и
поместить в среду для культивирования.
Некоторые прикрепленные водоросли (например,
динофлагелляты) прикрепляются так сильно, что их невозможно отделить от
субстрата с помощью струи воды. Существует другой метод выделения таких
водорослей в культуру. Он основан на том, что некоторые водоросли, такие как
Amphi-dinium restudo Herdman и Spiniferodinium, образуют подвижные клетки, но,
к сожалению, период образования новых подвижных клеток сравнительно короток.
При использовании данной методики обогащенные культуры изучаются несколько раз
в течение одного дня, чтобы заметить начало образования новых, еще не
прикрепившихся к субстрату клеток. Некоторые бентосные динофлагелляты образуют
подвижные клетки через несколько часов после начала светлого периода суток. В
этот период у исследователя появляется шанс для выделения таких клеток с
помощью микропипетки.
Если перечисленные выше методы не дают нужного
результата, могут быть предприняты более решительные попытки к их выделению.
Рассмотрим пример отделения водорослей, прикрепленных к пластиковому субстрату
(например, чашки Петри или пластиковые тарелки). В этом случае нежелательный
материал может быть удален вокруг нужной клетки с помощью тонкой кисточки для
рисования (для удаления более крупных частиц) или микропипетки (для удаления
более мелких частиц). Далее, используя бритву или скальпель, осторожно вырезают
часть сосуда вокруг клетки и переносят кусочек пластика вместе с содержащимися
клетками в новый сосуд для культивирования.
Выделение аэрофильных водорослей:
Аэрофильные эпифитные водоросли растут на
субстратах, находящихся в воздушной среде (например, коре деревьев, листьях,
камнях и почве, зданиях и т.д.). Разнообразие водорослей, обитающих на этих
субстратах, удивляет. Например, Дж.Фоерстер обнаружил 77 родов в лесах
Пуэрто-Рико, другие альгологи выделили 91 вид микроорганизмов (в основном
водорослей), обитающихна гигантском водяном жуке Lethocerus. Наиболее изученной
группой водорослей являются почвенные водоросли, хотя водоросли, обитающие на
других субстратах, тоже довольно хорошо исследованы. Образцы отбирают путем
соскабливания, разделения на кусочки и т.д. Способы выделения таких водорослей
также разнообразны, но чаще всего используется метод обогащенных культур и
метод непосредственного выделения. Существует интересная методика выделения
аэрофильных водорослей, основанная на погружении водяного жука прямо в
питательную среду. При непосредственном выделении клетки могут быть помещены на
поверхность агара, а колонии, образовавшиеся позже из этих одиночных клеток,
могут быть помещены в среду для культивирования.
Водоросли, обитающие на поверхности водоемов
("seafoam"), занимают положение между субаэриальными и аэриальными
водорослями. Их можно отбирать с помощью ножа или ложки, затем поместить в
стерильный пластиковый пакет, а затем в лабораторных условиях культивировать с
использованием классических методов. Такие накопительные культуры являются
источником многочисленных водорослей, преимущественно пресноводных.
Аэриальные водоросли изучены меньше, чем
субаэриальные. Так, например, П.Смит выделил 44 вида водорослей в Ралегхе
(Северная Каролина). Методы отбора образцов аэриальных водорослей без
загрязнения подробно описаны в статье Х.Шлихтинга с соавторами.
Выделение эпифитов после обработки ультразвуком:
Эпифитные водоросли, обитающие на более крупных
водорослях или других организмах, достаточно трудно выделить с помощью
микропипетки. Если попытаться соскоблить эпифиты, то можно повредить их клетки.
В этом случае наиболее оптимальным вариантом является обработка ультразвуком.
Этот способ позволяет нужным клеткам водорослей перейти в раствор, из которого
их можно легко выделить.
Выделение водорослей, живущих в песке:
Песок является обычным субстратом для сообществ
эпипелона. В песке обитают два вида водорослей: флагелляты, которые свободно плавают
среди песчинок и водоросли, которые растут, прикрепляясь к песчинкам. Первые
намного легче выделить, чем последние, так как песчинки помимо водорослей могут
содержать и другие прикрепленные организмы.
Рассмотрим метод выделения водорослей, свободно
плавающих среди песчинок. Во время сбора образцов верхний слой песка собирается
с помощью стеклянной пробирки, бутылки с широким горлышком или маленьким
совком. Ф.Раунд предложил помещать песок и воду в чашки Петри, а затем собирать
клетки водорослей, поднявшиеся наверх, с помощью микропипетки, или позволять им
расти на плавающих покровных стеклах. Стекла потом извлекаются с помощью
пинцета и потом исследуются с помощью микроскопа. В случае обогащенных культур
покровные стекла помещаются в чашки Петри со стерильной средой, покрываются
парафильмом и инкубируются.
Существует другой метод выделения. Небольшое
количество песка помещают в прозрачную пластиковую чашку с крышкой, куда
добавляют необходимое количество питательной среды. Потом чашку наклоняют таким
образом, чтобы песчинки оказались на одной стороне. Когда песок осядет, чашку
снова переворачивают в нормальное положение. На другой стороне чашки
устанавливают преграду для песка (например, палочки для еды) таким образом,
чтобы образовалась своеобразная камера для культивирования. Затем с помощью
бинокулярной лупы изучают клетки и отделяют нужные для дальнейшего
культивирования.
М.Хоппенрат отделял прикрепленные к песку
динофлагелляты, помещая замерзшую морскую воду на фильтр (с диаметром пор 0,45
мкм). По мере таяния жидкость проходит через песок и вымывает водоросли. Этот
метод представляет собой модификацию, предложенную Г.Ухлингом.
Выделение водорослей из грязи является более
трудной задачей, потому что грязь не оседает на дно. Для выделения водорослей
можно использовать метод прикрепления к покровным стеклам и метод разведения.
Выделение с помощью микропипетки возможно только при сильном разбавлении грязи.
Выделение цист из осадков:
Осадочные образцы содержат большое количество
разрушенных органических остатков, что препятствует выделению водорослей. Для
выделения флагеллят осадки могут обогащаться питательными веществами и
инкубироваться на свету для прорастания цист. После прорастания цист водоросли
могут быть выделены с помощью методов, описанных выше. В свою очередь цисты
могут быть отделены от осадков с помощью нескольких методов. В этом случае
концентрированные цисты могут быть собраны, промыты, а затем отдельные цисты
могут быть помещены в контейнер для дальнейшей изоляции.
В некоторых случаях при прорастании цист
происходит изменение плоидности (например, диплоидные цисты делятся
митотически, производя гаплоидные клетки). Если важно выделить каждую
гаплоидную клетку (например, при изучении полового размножения), применение в
дальнейшем метода обогащенных культур невозможно. В этом случае необходимо
изолировать каждую цисту путем пересадки в отдельный сосуд для культивирования
(например, в пластиковую планшету) для того, чтобы можно было отслеживать
процесс прорастания. Наблюдение ведут через каждые 1-2 часа. После прорастания
цист четыре гаплоидные клетки должны быть выделены индивидуально и перенесены в
культуру. Штамм водоросли, полученный из этих одноклеточных изолятов, должен
содержать как женские, так и мужские клеточные линии.
Выделение водорослей, обитающих в проточных
водоемах:
Некоторые виды, особенно растущие в проточной
воде, для нормального роста требуют движения воды (то есть они погибают при
выращивании в обычных сосудах). Для культивирования таких водорослей необходимо
использовать специальные вращающиеся сосуды (например, производства Bellco.,
Inc.) в комплекте с необходимым оборудованием для создания движения. Таким же
образом можно поместить сосуд для культивирования в специальное устройство для
создания движения воды.
Таким образом, выделение водорослей представляет
некоторые сложности для начинающих исследователей, однако при наличии
достаточной практики можно быстро получить необходимые навыки. Во многих
случаях изобретательность может облегчить этот процесс как в хорошо оборудованной
лаборатории, так и полевых условиях. Наличие необходимого оборудование
позволяет сделать процесс выделения водорослей более легким и успешным. При
выделении таких водорослей оборудование может потребоваться в любой момент,
поэтому все необходимые материалы нужно хранить в стерильном состоянии.
Удаление диатомовых водорослей с помощью
диоксида германия:
Диатомовые водоросли могут создавать проблемы
для ученых, пытающихся их выделить. Диатомеи растут очень быстро, и их бурный
рост тормозит развитие других водорослей. В большинстве случаев добавление
диоксида германия в образец, накопительную культуру или выделенную культуру,
загрязненную диатомовыми водорослями, ведет к гибели большинства или всех
диатомовых водорослей. Германий замещает кремний в биохимических реакциях, что
приводит к их гибели. Для большинства других водорослей (за исключением красных
водорослей) высокие концентрации германия не являются токсичными. Эффект
диоксида германия достигается при его концентрации от 1 до 10 мг/л. Токсичность
диоксида германия во многом определяется и временем внесения. При получении
накопительных культур диоксид германия лучше всего добавлять сразу же. Если
добавлять диоксид германия уже после развития диатомовых водорослей, для
удаления диатомей понадобится больше времени.
Удаление синезеленых водорослей с помощью
антибиотиков:
Сине-зеленые водоросли могут также мешать
развитию других групп водорослей. К счастью, сине-зеленые водоросли можно
эффективно удалить с помощью антибиотиков, так как они являются прокариотами.
Однако одни антибиотики более эффективны, другие менее. Но в большинстве
случаев методом проб и ошибок можно найти нужную комбинацию антибиотиков, а
также рассчитать необходимые концентрации [3].
1.2.3 Использование микроводорослей для оценки
качества водных сред
Водоросли как древнейшие фотоавтотрофные
организмы во многом определили современный облик биосферы: первичный свободный
кислород на Земле создан водорослями в процессе фотосинтеза, водоросли
подготовили условия для создания почвы и заселения суши высшими растениями и
животными. В настоящее время водоросли продолжают участвовать в поддержании
постоянного состава атмосферы, в первичных почвообразовательных процессах.
Водоросли остаются основным поставщиком органического вещества в водоемах.
Существует множество экологических групп
водорослей. Исходной средой обитания для водорослей является водная. Водоросли
составляют основную часть фитопланктона, фитобентоса, перифитона. Фитопланктон
- растения, обитающие в толще воды; фитобентос - растения, обитающие на дне
водоемов; перифитон (обрастатели) - растения, обитающие на разнообразных
субстратах: на других организмах, скальных породах, гидротехнических
сооружениях и т.д. Многие виды водорослей заняли переходные среды обитания,
однако не утратили полностью связей с водной средой: аэрофиты (обычно населяют
зону прибоя - супралитораль), почвенные водоросли, троглобионты (обитатели
пещер), криофиты (населяют поверхность льда и снега), симбионты и паразиты.
В экосистемах водоросли играют роль продуцентов
органического вещества. Валовая первичная продукция всего Мирового океана
примерно в 2-3 раза меньше, чем валовая продукция суши. Чистая первичная
продукция гидросферы составляет примерно 50% от валовой (в разных экосистемах
колеблется от 0 до 90%).
Лимитирующее действие света в Мировом океане: в
вертикальном разрезе по отношению к количеству света водоемы делятся на 3 зоны:
эуфотическую, дисфотическую и афотическую. Только в эуфотической зоне (до
40...180 метров) валовая первичная продукция водорослей превышает их затраты на
дыхание. В более глубоких слоях воды водоросли могут существовать за счет
миксотрофного питания.
Лимитирующее действие света в континентальных
водоема: в реках и озерах доступность света определяется прозрачностью воды.
Прозрачность воды падает при наличии взвешенных неживых частиц, а также при
массовом размножении самих водорослей.
Лимитирующее действие биогенов в Мировом океане:
чистая первичная продуктивность водорослей в низких широтах достигает максимума
в экосистемах шельфов, эстуариев, коралловых рифов. Эти воды насыщены
биогенами: фосфатами и нитратами. Освещенность высокая в течение всего года. В
открытом океане в низких широтах валовая первичная продукция водорослей,
несмотря на высокую освещенность, очень низкая из-за недостатка биогенов - примерно
в 20 раз ниже, чем в районах рифов. В высоких широтах, то есть в холодных
субполярных водах обычно биогены имеются в достаточном количестве. Это связано
с перемешиванием придонных и поверхностных вод из-за отсутствия температурного
градиента, а также с выносом придонных вод на поверхность путем апвеллинга. В
условиях полярного лета валовая первичная продукция водорослей очень высокая, а
в период полярной зимы водоросли или отмирают, или переходят на гетеротрофное
питание.
Лимитирующее действие биогенов в континентальных
водоемах: в реках и озерах содержание в воде биогенов зависит от минерального
состава пород в бассейне и от активности редуцентов. Освещенность зависит от
географической широты и от прозрачности воды (в реках и водохранилищах вода обычно
мутная). Неглубокие равнинные реки обычно содержат много биогенов, такие воды
называются эутрофные. Глубокие озера на кристаллических породах обычно содержат
мало биогенов, такие воды называются олиготрофные. Промежуточное положение
занимают мезотрофные воды. Активность редуцентов зависит от температуры и
содержания кислорода. Поэтому в северных водоемах с отложениями торфа биогены
находятся в связанном состоянии - такие воды называются дистрофные. Таким
образом, продуктивность водорослей в реках и озерах колеблется в широких
пределах, но, в целом, возрастает по мере продвижения к экватору.
Эвтрофикация водоемов. При повышении содержания
биогенов в воде происходит эвтрофикация водоемов - значительное повышение
продуктивности. Существует антропогенная и естественная (неантропогенная)
эвтрофикация.
Антропогенная эвтрофикация водоемов вызывается:
сбросами биогенов (в первую очередь, фосфатов), изменением гидрологического
режима (скорость течения воды в водохранилищах замедляется; при падении уровня
озер происходит мобилизация биогенов из донных отложений), смывом
поверхностного слоя почвы и т.д. Антропогенная эвтрофикация водоемов приводит,
как правило, к нарушению биологического равновесия: изменяется альгофлора
(видовой состав водорослей), изменяется плотность популяций водорослей. Резко
возрастает плотность популяций миксотрофных видов. Плотность популяций зеленых
водорослей снижается. В дальнейшем при отмирании этих видов снижается
содержание кислорода, повышается содержание сероводорода. Кроме того, ряд водорослей
выделяет токсины, прямо убивающие гидробионтов.
Неантропогенная эвтрофикация наблюдается при
изменении направления морских течений, при сезонном изменении освещенности и
температуры. Печально известны "красные приливы" (бурное размножение
пирофитовых водорослей), которые приводят к накоплению токсинов в тканях
моллюсков и других гидробионтов. Это приводит к массовой гибели этих организмов
и к пищевым отравлениям населения, употребляющего в пищу эти организмы [4].
Водоросли водных местообитаний:
) Планктонные водоросли:
Планктон - это совокупность организмов,
населяющих толщу воды континентальных и морских водоемов и не способных
противостоять переносу течениями (т.е. как бы парящих в воде). В состав
планктона входят фито-, бактерио- и зоопланктон.
Фитопланктоном называют совокупность
свободноплавающих в толще воды мелких, преимущественно микроскопических
растений, основную массу которых составляют водоросли. Фитопланктон населяет
только эвфотическую зону водоемов (поверхностный слой воды с достаточной для
фотосинтеза освещенностью).
Планктонные водоросли обитают в самых
разнообразных водоемах - от маленькой лужи до океана. Их нет лишь в водоемах с
резко аномальным режимом, в том числе в термальных (при температуре воды выше
+80° С и заморных (зараженных сероводородом) водоемах, в чистых приледниковых
водах, не содержащих минеральных питательных веществ, а также в пещерных
озерах. Суммарная биомасса фитопланктона невелика по сравнению с биомассой
зоопланктона (соответственно 1,5 и более 20 млрд. т), но из-за быстрого
размножения его продукция в Мировом Океане составляет около 550 млрд. тонн в
год, что почти в 10 раз больше суммарной продукции всего животного населения
океана.
Фитопланктон - основной продуцент органического
вещества в водоемах, за счет которого существуют водные гетеротрофные животные
и некоторые бактерии. Фитопланктон является начальным звеном большинства
пищевых цепей в водоеме: им питаются мелкие планктонные животные, которыми
питаются более крупные. Поэтому в районах наибольшего развития фитопланктона
обильны зоопланктон и нектон.
Состав и экология отдельных представителей
водорослевого фитопланктона в разных водоемах чрезвычайно разнообразны. Общее
число видов фитопланктона во всех морских и внутренних водоемах достигает 3000.
Обилие и видовой состав фитопланктона зависит от
комплекса рассмотренных выше факторов. В связи с этим видовой состав
планктонных водорослей в разных водоемах (и даже в одном и том же водоеме, но в
разное время года) не одинаков. Он зависит от физического и химического режима
в водоеме. В каждый сезон года преобладающее развитие получает одна из групп
водорослей (диатомовые, синезеленые, золотистые, эвгленовые, зеленые и
некоторые другие), причем нередко господствует всего один вид той или иной
группы. Особенно это выражено в пресноводных водоемах. Во внутренних водоемах
существует гораздо большее разнообразие экологических условий по сравнению с
морскими водоемами, что определяет и значительно большее разнообразие видового
состава и экологических комплексов пресноводного фитопланктона по сравнению с
морским. Одной из существенных особенностей пресноводного фитопланктона
является обилие в нем временно планктонных водорослей. Ряд видов, которые
принято считать типично планктонными, в прудах и озерах имеют донную или перифитонную
(прикрепление к какому-либо предмету) фазу в своем развитии.
Морской фитопланктон состоит в основном из
диатомовых и динофитовых водорослей. Хотя морская среда на значительных
пространствах относительно однородна, в распределении морского фитопланктона
однородности не наблюдается. Различия по видовому составу и численности нередко
выражены даже на сравнительно небольших акваториях морских вод, но особенно
четко они отражаются в крупномасштабной географической зональности
распределения. Здесь проявляется действие основных факторов среды: солености
воды, температуры, освещенности и содержания питательных веществ.
Планктонные водоросли обычно имеют специальные
приспособления к обитанию в толщи воды во взвешенном состоянии. У одних видов
это разного рода выросты и придатки тела - шипы, щетинки, роговые отростки,
перепонки, парашюты; другие образуют полые или плоские колонии и обильно
выделяют слизь; третьи накапливают в своем теле вещества, удельный вес которых
меньше удельного веса воды (капли жира у диатомовых и некоторых зеленых
водорослей, газовые вакуоли у синезеленых). Эти образования гораздо сильнее
развиты у морских фитопланктеров, чем у пресноводных. Еще одним из таких
приспособлений являются мелкие размеры тела планктонных водорослей.
) Нейстонные водоросли:
Совокупность морских и пресноводных организмов,
обитающих у поверхностной пленки воды, прикрепляющихся к ней или
передвигающихся по ней называется нейстоном. Нейстонные организмы обитают как в
мелких водоемах (прудах, заполненных водой ямах, небольших заливах озер), так и
в крупных, в том числе в морях. В отдельных случаях они развиваются в таком
количестве, что покрывают воду сплошной пленкой.
В состав нейстона входят одноклеточные
водоросли, входящие в состав разных систематических групп (золотистые,
эвгленовые, зеленые, отдельные виды желтозеленых и диатомовых). Некоторые
нейстонные водоросли имеют характерные приспособления для существования у
поверхности воды (например, слизистые или чешуйчатые парашюты, удерживающие их
на поверхностной пленке).
) Бентосные водоросли:
К числу бентосных (донных) водорослей относятся
водоросли, приспособленные к существованию в прикрепленном или неприкрепленном
состоянии на дне водоемов и на разнообразных предметах, живых и мертвых
организмах, находящихся в воде.
Преобладающими бентосными водорослями
континентальных водоемов являются диатомовые, зеленые, синезеленые и
желтозеленые многоклеточные (нитчатые) водоросли, прикрепленные или
неприкрепленные к субстрату.
Основные бентосные водоросли морей и океанов -
бурые и красные, иногда зеленые макроскопические прикрепленные слоевищные
формы. Все они могут обрастать мелкими диатомовыми, синезелеными и другими
водорослями.
В зависимости от места произрастания, среди
бентосных водорослей различаются: 1) эпилиты, растущие на поверхности твердого
грунта (скалы, камни); 2) эпипелиты, населяющие поверхность рыхлых грунтов
(песок, ил); 3) эпифиты, живущие на поверхности других растений; 4) эндолиты,
или сверлящие водоросли, внедряющиеся в известковый субстрат (скал, раковин
молллюсков, панцирей ракообразных); 5) эндофиты и 6) паразиты, поселяющиеся в
слоевищах других водорослей (эндофиты имеют нормальные хлоропласты, а паразиты
таковых не имеют); 7) эндосимбионты, обитающие в клетках других организмов,
беспозвоночных или водорослей; 8) эпизоиты, обитающие на некоторых донных
животных.
Иногда водоросли, растущие на предметах,
введенных в воду человеком (суда, плоты, буи) относят к перифитону. Выделение
этой группы обосновывается тем, что входящие в ее состав организмы (водоросли и
животные) живут на предметах движущихся или обтекаемых водой. Кроме того, эти
организмы удалены от дна и, следовательно, находятся в условиях иного светового
и температурного режимов, а также в других условиях поступления биогенных
веществ. Возможность произрастания бентосных водорослей в конкретных
местообитаниях определяется как абиотическими, так и биотическими факторами.
Среди последних существенную роль играет конкуренция с другими водорослями и
присутствие животных, питающихся водорослями (морских ежей, брюхоногих
моллюсков, ракообразных, рыб). Воздействие биотических факторов приводит к
тому, что отдельные виды водорослей растут далеко не на всякой глубине и не во
всяких водоемах с подходящим световым и гидрохимическим режимом.
К абиотическим факторам относятся свет,
температура, а также содержание в воде биогенных и биологически активных
веществ, кислорода и неорганических источников углерода. Очень важна скорость
поступления этих веществ в слоевище, что находится в зависимости от концентрации
веществ и скорости движения воды.
Бентосные водоросли, растущие в условиях
движения воды, получают преимущества по сравнению с водорослями, растущими в
малоподвижных водах. Один и тот же уровень фотосинтеза может быть достигнут у
них при меньшей освещенности, что способствует росту более крупных слоевищ;
движение воды предотвращает оседание на скалы и камни илистых частиц, которые
мешают закреплению зачатков водорослей, а также смывает с поверхности грунта
питающихся водорослями животных. К тому же, несмотря на то, что при сильном
течении или сильном прибое происходит повреждение слоевищ водорослей или отрыв
их от грунта, движение воды все же не препятствует поселению микроскопических
водорослей и микроскопических стадий крупных водорослей. Поэтому места с
интенсивным движением воды (в морях это проливы с течениями, прибрежные участки
прибоя, в реках - камни на перекатах) отличаются пышным развитием бентосных
водорослей.
Влияние движения воды на развитие бентосных
водорослей особо ощутимо в реках, ручьях, горных потоках. В этих водоемах
выделяется группа бентосных организмов, предпочитающих места с постоянным
течением. В озерах, где не бывает сильных течений, основное значение
приобретает волновое движение. В морях волны также оказывают значительное
влияние на жизнь бентосных водорослей, в частности на их вертикальное
распределение.
В северных морях на распространение и
численность бентосных водорослей оказывает влияние лед. Заросли водорослей
могут быть уничтожены (стерты) движением ледников. Поэтому, например, в Арктике
многолетние водоросли легче всего найти у берега среди валунов и выступов скал,
препятствующих движению льда.
Интенсивному развитию бентосных водорослей
способствует также умеренное содержание в воде биогенных веществ. В пресных
водах такие условия создаются в неглубоких прудах, в прибрежной зоне озер, в
речных заводях, в морях - в мелких заливах. Если в таких местах существует
достаточное освещение, твердые грунты и слабое движение воды, то создаются
оптимальные условия для жизни фитобентоса. При отсутствии движения воды и ее
недостаточном обогащении биогенными веществами, бентосные водоросли растут
плохо.
) Водоросли горячих источников:
Водоросли, выдерживающие высокие температуры,
называются термофильными. В природе они поселяются в горячих источниках,
гейзерах и вулканических озерах. Нередко они обитают в водах, которые кроме
высокой температуры характеризуются повышенным содержанием солей или
органических веществ (сильно загрязненные горячие сточные воды заводов, фабрик,
электростанций или атомных станций).
Предельные температуры, при которых удавалось
находить термофильные водоросли, судя по разным источникам, колеблются от 52 до
84° С. Всего обнаружено около 200 видов термофильных водорослей, однако видов,
живущих только при высоких температурах, среди них сравнительно немного.
Большинство из них способно выдерживать высокие температуры, но обильнее
развиваются при обычных температурах. Типичными обитателями горячих вод
являются синезеленые, в меньшей степени - диатомовые и некоторые зеленые
водоросли.
) Водоросли снега и льда:
Водоросли снега и льда составляют подавляющее
большинство организмов, поселяющихся на замерзших субстратах (криобиотопах).
Общее число видов водорослей, обнаруженных на криобиотопах, достигает 350, но
истинных криофилов, способных вегетировать только при температурах, близких к
0° С, значительно меньше: немногим более 100 видов. Это микроскопические
водоросли из которых подавляющее большинство относится к зеленым водорослям
(около 100 видов); несколькими видами представлены синезеленые, желтозеленые,
золотистые, пирофитовые и диатомовые водоросли. Все эти виды обитают в
поверхностных слоях снега или льда. Их объединяет способность выдерживать
замерзание без нарушения тонких клеточных структур и затем, при оттаивании, быстро
возобновлять вегетацию, используя минимальное количество теплоты. Лишь немногие
из них имеют стадии покоя, большинство лишены каких-либо специальных
приспособлений для перенесения низких температур.
Развиваясь в массовом количестве, водоросли
способны вызывать зеленое, желтое, голубое, красное, коричневое, бурое или
черное "цветение" снега и льда.
) Водоросли соленых водоемов:
Эти водоросли вегетируют при повышенной
концентрации в воде солей, достигающей 285 г/л в озерах с преобладанием
поваренной соли и 347 г/л в глауберовых (содовых) озерах. По мере увеличения
солености количество видов водорослей уменьшается, очень высокую соленость
переносят лишь немногие из них. В крайне засоленных (гипергалинных) водоемах
преобладают одноклеточные подвижные зеленые водоросли. Нередко они вызывают
красное или зеленое "цветение" соленых водоемов. Дно гипергалинных
водоемов иногда сплошь покрыто синезелеными водорослями. они играют большую
роль в жизни соленых водоемов. Сочетание органической массы, образуемой водорослями,
и большого количества растворенных в воде солей обуславливает ряд своеобразных
биохимических процессов, свойственных этим водоемам. Например, хлороглея
сарциноидная (Chlorogloea sarcinoides) из синезеленых, в огромных количествах
развивающаяся в некоторых соленых озерах, а также ряд других массово растущих
водорослей, участвуют в процессе образования лечебных грязей[5]
Для биологической индикации качества вод могут
быть использованы практически все группы организмов, населяющие водоемы:
планктонные и бентосные беспозвоночные, простейшие, водоросли, макрофиты,
бактерии и рыбы. Каждая из них, выступая в роли биологического индикатора,
имеет свои преимущества и недостатки, которые определяют границы ее
использования при решении задач биоиндикации, так как все эти группы играют
ведущую роль в общем круговороте веществ в водоеме. Организмы, которые обычно
используют в качестве биоиндикаторов, ответственны за самоочищение водоема,
участвуют в создании первичной продукции, осуществляют трансформацию веществ и энергии
водных экосистем.
Наиболее разработанной оценкой степени
загрязненности вод по индикаторным организмам является система сапробности.
Метод учитывает относительную частоту встречаемости гидробионтов h
(от 1 до 9 или от единичных экземпляров в поле зрения микроскопа и до очень
частой встречаемости, когда их много в каждом поле зрения) и их индикационную
значимость S. Для
статистической достоверности результатов необходимо, чтобы в пробе содержалось
не менее 12 видов индикаторных организмов одной зоны сапробности с  .
Индикаторные значимости S
для соответствующих зон сапробности табулированы для многих организмов. По
рассчитанной величине S
можно судить о состоянии водоема. Заключение о степени загрязненности воды дают
обычно по системе баллов от одного до шести.
.
Индикаторные значимости S
для соответствующих зон сапробности табулированы для многих организмов. По
рассчитанной величине S
можно судить о состоянии водоема. Заключение о степени загрязненности воды дают
обычно по системе баллов от одного до шести.
Среди огромного разнообразия микроводорослей
наиболее часто для оценки действия веществ применяются обитающие в планктоне
водоросли отдела Chlorophyta, в то время как представители других отделов
остаются малоизученными, что особенно касается бентосных микроводорослей.
Загрязнение морской воды является комплексным и,
следовательно, оценку его характера и действия можно провести только с помощью
биотестирования, которое средством получения принципиально новой информации о
загрязнении. Одноклеточные водоросли, вследствие круглогодичной доступности и
высокой чувствительности, широко применяются в качестве тест-объектов при
биотестировании [6].
1.3 Методы наблюдения и описания подвижности
микроводорослей
1.3.1 Изменение подвижности микроводорослей в
присутствии антибиотиков
Проблема биологической подвижности является
одной из ключевых проблем современной биофизики. Разнообразные типы подвижности
присущи живым объектам на всех уровнях организации: от отдельных клеточных
органелл до высокоорганизованной подвижности организмов в целом. При всей
широте ее проявлений в основе любого движения в биологической системе лежит
фундаментальный процесс преобразования энергии химических связей
макроэргических молекул в механическую работу. Универсальность этого
преобразования и его высокая эффективность, с одной стороны, а также очевидная
значимость роли подвижности в функционировании биологических объектов, с другой
стороны, - вызывают и поддерживают многолетний интерес к этой проблеме
исследователей, специализирующихся не только в области биологии, но и в
биофизике, биохимии и бионике.
Первые основополагающие результаты по изучению
биологической подвижности были связаны с выяснением механизма мышечного
сокращения в 40-х - 50-х годах нашего века. И только в последние десять лет
наблюдается заметная интенсификация усилий по экспериментальному исследованию и
теоретическому моделированию различных форм немышечной подвижности: от
передвижения жгутиковых и ресничковых микроорганизмов до одной из наименее
исследованных форм - подвижности протоплазмы внутри клетки.
Подвижность протоплазмы присуще практически всем
растительным клеткам на разных стадиях их развития, а также ряду миксомицетов.
Не случайно, что наиболее интенсивное течение протоплазмы свойственно клеткам
больших размеров, таким как гигантские клетки водорослей, миксомицетам в стадии
плазмодия и т.д. Это связано, по-видимому, с необходимостью более эффективного
транспорта веществ внутри клетки таких размеров, чем это может быть обеспечено
диффузионными процессами. Другая функция подвижности протоплазмы связана с
передвижением микроорганизма в целом, что характерно, например, для плазмодия,
амеб и даже некоторых видов водорослей (диатомовых).
Несмотря на распространенность и внешнюю
простоту проявления данного процесса, единого взгляда на механизмы создания
течения протоплазмы в клетках того или иного вида в настоящее время не
существует.
Исследование немышечной подвижности имеет не
только фундаментальную, но и практическую ценность, связанную прежде всего с
ролью подвижности протоплазмы в транспорте ассимилятов в растении. Одним из
интересных практических приложений этих исследований может быть также
биологическое тестирование загрязнения окружающей среды, в частности, водоемов
[7].
Наиболее примитивные водоросли - синезеленые -
не обладают способностью к активным движениям, а среди других одноклеточных
водорослей преобладают активно подвижные. И хотя у одноклеточных растений есть
настоящие прикрепленные формы (некоторые диатомеи), тем не менее как
закономерный переход к прикрепленному образу жизни во взрослых стадиях
онтогенеза растений связан с переходом от одно- к многоклеточное.
Споры бактерий и синезеленых водорослей служат
лишь целям переживания неблагоприятного времени и поэтому не обладают активной
подвижностью. У водорослей и грибов появляются также споры, специально служащие
целям размножения, которые могут быть пассивно или, чаще, активно подвижными.
При исследовании стерилизации многоклеточных
водорослей солоноватых вод в экспериментальных целях антибиотиками,
сульфамидами и фунгицидами У.Шивер упоминает, что загрязнения стерильных низших
водорослей диатомеями и синезелеными водорослями не наблюдается. Для подавления
бактерий он также применял концентрации антибиотиков от 1000 до 10000ед/мл
пеницилиллина и от 1,0 до 10,0мг/мл стрептомицина. Ширер допускает, что
диатомеи были поражены фунгицидами, в то время как синезеленые водоросли
пoгибли от высоких концентраций пеницилллина. Согласно Галловею и Крауссу, а
также Палмеру и Малонею синезеленые водоросли уничтожаются даже очень низкими
концентрациями антибиотиков. В качестве минимальной концентрации для
Microcystis aeruginosa Шивер называет 2,0ppm пенициллина, а для Anabaena
variabilis 0,1ppm пенициллина. Для зеленых низших водорослей потребовалось
1000ppm.
До сих пор в аквариумистике не было сведений о
борьбе с сине-зелеными водорослями при помощи антибиотиков. Поэтому, чтобы
установить возможность борьбы с сине-зелеными водорослями в густо засаженном
аквариуме с рыбами при помощи пенициллина, было проведено испытание. Применялся
пенициллин Г (бензилпенициллин-натрий) в 330-литровом аквариуме.
При концентрации пенициллина 1000ед/л заметного
эффекта в подавлении роста сине-зеленых водорослей не наблюдалось. Применение
2000ед/л дало слабый эффект: распространение сине-зеленых водорослей
приостанавливалось, наслоения окрашивались в серый цвет. Но уже через 3-5 дней
они вновь начинали бурно расти. При концентрации пенициллина 5000ед/л
сине-зеленым водорослям был причинен значительный ущерб. Наслоения стали
грязно-серыми; они отпадали или свертывались и легко могли быть собраны
трубкой. Этот процесс развивался медленно и достиг наибольшей силы через 4-6
дней. Через 10 дней все видимые наслоения сине-зеленых водорослей исчезли, но
еще через 3-4 дня появились новые, которые бурно размножались. Только
применение 10000ед/л указанного пенициллина позволило получить прочный
результат. Сине-зеленые водоросли отмерли без остатка в течение 8 дней, они не
появились и через 5 месяцев. В этот период не предпринимались никакие изменения
в освещении и составе воды: впрочем, отпадавшие остатки сине-зеленых водорослей
убирали. Свежую воду не добавляли. Этот опыт успешно был проведен и в других
аквариумах.
На зеленые низшие водоросли указанная
концентрация не оказала никакого влияния. Они продолжали размножаться, хотя и
медленнее. Высшие водные растения и рыбы также не пострадали.
Так как вредное воздействие пенициллина высокой
концентрации на сине-зеленые водоросли было известно, нужно было установить минимальную
концентрацию для аквариума. Такая доза была установлена: 10000ед/л. При этом
рекомендуется через 48час. добавить 2500ед. на 1л воды.
Таким образом была установлена пригодность
пенициллина для борьбы с сине-зелеными водорослями, причем, в отличие от других
препаратов, его можно применять с большей уверенностью, хотя, конечно, не в
любом случае. Опыты по выявлению возможного сопротивления сине-зеленых
водорослей при длительном применении пенициллина и разной чувствительности к
антибиотикам различных видов низших водорослей, а также исследования
эффективности различных антибиотиков в аквариумистике еще не проводились.
Для определения чувствительности микробов к
антибиотикам существует ряд методов: метод последовательных разведений в жидкой
питательной среде или питательном агаре, метод диффузии в агар (метод дисков,
насыщенных антибиотиками) и ускоренные методы. Метод дисков прост, широко
используется, но дает лишь качественный ответ. Более надежным и точным
количественным методом является метод последовательных разведений антибиотиков
в питательной среде в стандартных условиях опыта. В большинстве случаев
корреляция данных лабораторных исследований с клиническими бывает достаточно
полной, а терапия - эффективной при изучении в динамике не только клинического
течения процесса, но и возможной смены возбудителя или его чувствительности к
антибиотикам.
Концентрация антибиотиков в тканях и жидкостях
организма, как и их антимикробная активность, относятся к основным параметрам,
определяющим эффективность антибиотикотерапии. При ее изучении наиболее широко
применяют микробиологические методы исследования, основанные на способности
антибиотика задерживать рост тест-микроба. Среди микробиологических методов
определения концентраций антибиотиков в жидкостях и тканях организма наибольшее
распространение получили метод диффузии в агар и метод серийных разведений в
жидкой питательной среде.
В настоящее время созданы микробиологические
системы, автоматизированной и полуавтоматизированной микробиологические,
идентификации и оценки антибиотикоустойчивости, позволяющие существенно
ускорить бактериологический анализ, повысить степень его точности. Имеются
ускоренные физико-химические и химические методы (иммуноферментный,
иммунофлюоресцентный и др.) изучения фармакокинетики антибиотиков, помогающие
быстро оптимизировать схемы лечения, индивидуализировать их и повысить
эффективность этиотропной терапии.
При выборе антибиотика должны использоваться
сведения о минимальных подавляющих концентрациях для отдельных возбудителей
болезни , которые могут быть разными как по отношению к виду микроба, так и к
различным тканям (средам) организма больного. На практике терапевтическая
активность достигается при назначении антибактериальных препаратов в дозах,
обеспечивающих более высокий их уровень в средах преимущественного обитания
возбудителей болезни.
1.3.2 Изменение жизнеспособности микроводорослей
в присутствии ксенобиотиков
Ксенобиотики - условная категория для
обозначения чужеродных для живых организмов химических веществ, естественно не
входящих в биотический круговорот. Как правило, повышение концентрации
ксенобиотиков в окружающей среде прямо или косвенно связано с хозяйственной
деятельностью человека. К ним в ряде случаев относят: пестициды, некоторые
моющие средства (детергенты), радионуклиды, синтетические красители,
полиароматические углеводороды и др. Попадая в окружающую природную среду, они
могут вызвать повышение частоты аллергических реакций, гибель организмов,
изменить наследственные признаки, снизить иммунитет, нарушить обмен веществ,
нарушить ход процессов в естественных экосистемах вплоть до уровня биосферы в
целом.
Ксенобиотики могут как подавлять, так и
стимулировать рост микроводорослей.
Полихлорированые бифенилы, которые применяются
как диэлектрические жидкости в трансформаторах и конденсаторах, смазки, как
присадки к пестицидам, клеи, краски, способствуют фотосинтезу и клеточному
делению при низких концентрациях, а при более высоких оказывают обратное
действие. Накопление их у водорослей представляет двухстадийный процесс: за
адсорбцией на поверхности следует поглощение клеткой за счет диффузии, а не
активного транспорта. Десорбция происходит медленнее адсорбции, т.е.
восстановление нормального состояния идет дольше, чем загрязнение. Многие
полициклические углеводороды разрушаются солнечным светом, и имеются сведения,
что это происходит активнее, когда вещества связанны с поверхностью
водорослевых клеток.
В последнее время появились обзоры работ о
влиянии на водоросли тяжелых металлов. Данные многих исследований противоречивы,
и до сих пор нельзя сделать общего вывода относительно влияния тяжелых металлов
на отдельные микроводоросли или их сообщества. Металлы снижают как
разнообразие, так и продуктивность сообществ, причем сине-зеленые и диатомовые
водоросли наименее уцстойчивы. Сравнив участки рек, загрязненные медью и
свинцом, пришли к выводу, что видовой состав определяется уровнем загрязнения,
а не конкретным металлом.
В местах многих горнорудных разработок под
действием окисляющих серу бактерий возникают сильнокислые воды. Таким образом,
с загрязнением тяжелыми металлами бывает связана кислотность и влияние этих
двух факторов часто трудно разграничить. При низких значениях рН большинство
тяжелых металлов находится в доступной для водорослей форме, поэтому они обычно
токсичнее в кислой среде. Подкисление озер вызывает снижение числа и
разнообразия видов, хотя биомасса и первичная продукция могут остаться прежними
[8].
1.3.3 Метод микроскопического подсчета
численности и подвижности микроводорослей
Собранный материал предварительно просматривают
под микроскопом в живом состоянии в день сбора, чтобы отметить качественное
состояние водорослей до наступления изменений, вызванных хранением живого
материала или фиксацией проб (образование репродуктивных клеток, переход в пальмеллевидное
состояние, разрушение клеток, колоний, потеря жгутиков и подвижности и т. д.).
В дальнейшем собранный материал продолжают изучать параллельно в живом и
фиксированном состоянии. Работа с живым материалом является необходимым
условием успешного изучения водорослей, изменяющих при фиксации форму тела,
форму и окраску хлоропластов, теряющих жгутики, подвижность или даже полностью
разрушающихся в результате воздействия фиксаторов. Чтобы сохранить собранный
материал живым, следует всячески оберегать его от перегрева, загрязнения
фиксаторами, а к изучению приступать как можно скорее.
Водоросли в живом состоянии в зависимости от их
размеров и других особенностей изучают с помощью бинокулярной стереоскопической
лупы (МБС-1) или чаще с помощью световых, микроскопов различных марок с
использованием разных систем окуляров и объективов, в проходящем свете или
методом, фазового контраста, с соблюдением обычных правил микроскопирования.
Для микроскопического изучения водорослей
готовят препараты: на предметное стекло наносят каплю исследуемой жидкости и
накрывают ее покровным стеклом. Если водоросли обитают вне воды, их помещают в
каплю водопроводной воды или оводненного глицерина. При длительном изучении
препарата жидкость под покровным стеклом постепенно подсыхает, и ее следует
добавлять. Для уменьшения испарения по краям покровного стекла наносят тонкий
слой парафина.
При необходимости длительных наблюдений над
одним и тем же объектом хороший результат дает метод висячей капли. На чистое
покровное стекло наносят маленькую каплю исследуемой жидкости, после чего
покровное стекло, края которого покрыты парафином, парафиновым маслом или
вазелином, накладывают каплей вниз на специальное предметное стекло с лункой
посередине так, чтобы капля не касалась дна лунки. Такой препарат можно изучать
в течение нескольких месяцев, сохраняя его в перерывах между работой во влажной
камере.
При изучении водорослей, имеющих монадную
структуру, серьезной помехой служит их подвижность. Однако при подсыхании
препарата движение постепенно замедляется и приостанавливается. Замедлению
движения способствует также осторожное нагревание препарата или добавление
вишневого клея. Подвижные водоросли рекомендуется фиксировать парами оксида
осмия (IV) (при этом хорошо сохраняются жгутики), кристаллического иода
(фиксация парами иода позволяет не только сохранить жгутики, но и окрасить
крахмал, если он есть, в синий цвет, что имеет диагностическое значение), 40
%-го формальдегида, слабым раствором хлоралгидрата или хлороформом.
Длительность экспозиции над парами фиксаторов устанавливают экспериментально, в
зависимости от специфики объекта. Наиболее удобны для изучения слабо
фиксированные препараты, в которых часть водорослей потеряла подвижность, а
другие продолжают медленно двигаться. Препараты следует изучать немедленно
после фиксации, так как в течении короткого периода времени водоросли (особенно
лишенные клеточных оболочек) деформируются.
Количественному учету могут подвергаться только
количественные пробы фитопланктона и фитобентоса. Данные о численности
водорослей являются исходными для определения их биомассы и пересчета других
количественных показателей (содержания пигментов, белков, жиров, углеводов,
витаминов, нуклеиновых кислот, зольных элементов, интенсивности дыхания,
фотосинтеза и т. д.) на одну клетку или на единицу биомассы. Численность
водорослей может быть выражена в количестве клеток, ценобиев, колонии, отрезков
нитей определенной длины и др.
Подсчет численности водорослей осуществляют на
специальных счетных стеклах (разграфленных на полосы и квадраты), на
поверхность которых штемпель-пипеткой определенного объема (большей частью 0,1
см3) наносят каплю воды из тщательно перемешанной исследуемой пробы.
При отсутствии счетного стекла можно пользоваться обычным предметным стеклом
при условии перемещения его на столике микроскопа с помощью препаратоводителя.
Если нет штемпель-пипетки, используют обычную градуированную пипетку, отрезав
нижнюю оттянутую ее часть, чтобы сделать входное отверстие шире. Для учета
численности водорослей применяют также счетные камеры Нажотта объемом 0,01 см3,
"Учинскую" (0,02 см3) и др. Можно пользоваться также
камерами, применяемыми для подсчета форменных элементов крови - Горяева,
объемом 0,9 мм3, Фукса-Розенталя и др. При использовании камер
Горяева и Фукса-Розенталя покровное стекло тщательно притирают к боковым
поверхностям предметного счетного стекла до появления колец Ньютона, а затем
заполняют камеру каплей исследуемой пробы с помощью пипетки. В зависимости от
количества организмов в исследуемой пробе можно просчитывать либо все, либо
часть дорожек (квадратов) на поверхности счетного стекла. Необходимо
обязательно проводить повторные подсчеты нескольких (не менее трех) капель из
одной и той же пробы, каждый раз отбирая пипеткой образец для подсчета после тщательного
взбалтывания пробы.
) Расчет численности фитопланктона.
При исследовании количественных проб
фитоплактона (или культуральной суспензии водорослей) пересчет численности
организмов на 1 л воды производят по [9] формуле:
N=n*k(A/a)*v*(100/V), (1)
где N - количество организмов в 1 л воды
исследуемого водоема (культуральной жидкости);- коэффициент, показывающий во
сколько раз объем счетной камеры меньше 1 см3;- количество
организмов, обнаруженных на просмотренных дорожках (квадратах);
А - количество дорожек (квадратов) на счетной
пластинке (в камере);
А -
количество
дорожек (квадратов). на которых производился подсчет водорослей;-
первоначальный объем отобранной пробы (см3);- объем сгущенной пробы
(см3).
) Расчет численности бентоса и
перифитона.
При изучении количественных проб фитобентоса, в
которых обычно преобладают сравнительно крупные организмы, пользуются
преимущественно штемпель-пипеткой объемом 0,1 см3. Расчет
численности водорослей в пробах бентоса и перифитона ведут на 10 см2
поверхности субстрата по [9] формуле:
N=n*10*v/S*10, (2)
где N - количество организмов на 10 см2
поверхности субстрата;- число организмов в просчитанной капле воды объемом 0,1
см3;- объем пробы (см3);- площадь сечения трубки в
микробентометре (для бентосных проб) или площадь поверхности субстрата, с
которого смыты водоросли (для проб обрастании) (см2).
Количественное содержание водорослей в пробах
наиболее полно отражают показатели их биомассы, которые определяют с помощью
счетно-объемного, весового, объемного, разнообразных химических
(радиоуглеродного, хлорофиллового и др.) методов.
Для определения биомассы водорослей
счетно-объемным методом необходимо располагать данными об их численности в
каждой конкретной пробе для каждого вида отдельно и их средних объемах (для каждого
вида из каждой конкретной пробы). Существуют разные методы определения объема
тела водорослей. Наиболее точным считается стереометрический метод, при
использовании которого тело водоросли приравнивается к какому-нибудь
геометрическому телу или комбинации таких тел, после чего объемы их вычисляют
по известным в геометрии формулам на основании линейных размеров конкретных
организмов. Иногда пользуются готовыми, вычисленными ранее средними объемами
тела для разных видов водорослей, которые приводятся в работах многих авторов.
Относительную плотность по воде пресноводных водорослей принимают обычно за
1,0-1,05. Биомассу рассчитывают для каждого вида отдельно, а затем суммируют.
Счетно-объемный метод определения биомассы широко используют в практике гидробиологических
исследований при изучении количественных соотношений различных компонентов
биоценозов, закономерностей распределения водорослей в различных биотопах
одного и того же водоема или в разных водоемах, сезонной и многолетней динамики
развития водорослей и др.
При интенсивном развитии водорослей можно
пользоваться весовым методом. При этом исследуемую пробу фильтруют через
предварительно высушенный и взвешенный бумажный фильтр (параллельно через
контрольные фильтры фильтруют дистиллированную воду). Затем фильтры взвешивают
и сушат в сушильном шкафу при 100°С до постоянной массы. На основании
полученных данных вычисляют сухую и сырую массу осадка. В дальнейшем путем
сжигания фильтров в муфельной печи можно определить содержание в осадке
органических веществ.
Недостатки этого метода заключаются в том, что
он дает представление лишь о суммарной массе всех взвешенных в пробе
органических и неорганических веществ, живых организмов и неживых примесей,
животного и растительного происхождения. Вклад представителей отдельных
таксонов в эту суммарную массу можно лишь приблизительно выразить в массовых
долях после подсчета под микроскопом их соотношения в нескольких полях зрения.
Наиболее полное представление о биомассе
водорослей можно получить, сочетая несколько разных методов исследования [9].
1.3.4 Метод цифровой фотосъемки. Фотография
может стать памятью микроскопа
Для ученого она служит незаменимым инструментом,
позволяющим регистрировать все, что хоть на секунду появится перед его глазами
в бесконечно малом мире под окуляром микроскопа. Для фотографа же мир малых
величин открывает неожиданную красоту. В увеличенных фотоизображениях знакомых
вещей возникают неожиданные сочетания линий, форм и красок: симметрическое
строение крошечных бутонов, сложная фактура поверхности щепки, переливчатая
расцветка головы стрекозы.
Ученый пользуется союзом микроскопа с
фотоаппаратом в чисто научных целях, хотя многие увеличенные изображения
прекрасны сами по себе. Мир малых величин зачастую хрупок и недолговечен:
крошечные ростки быстро вянут, зажатые между двумя стеклышками живые клетки
гибнут, атомы так неуловимы, что для фотографирования их приходится увеличивать
в миллионы раз. Фотография позволяет увековечить все эти мимолетности прежде,
чем они исчезнут. Кроме того, фотоснимок все присутствующие могут рассматривать
одновременно, а в микроскоп, как правило, они должны глядеть по очереди. Для
подробного изучения и анализа изображений с ними должны знакомиться и ученые, и
учителя, и ученики. Только фотография способна предоставить им эту возможность.
Фотосъемка с увеличением, независимо от того,
кем она выполняется - фотографами-любителями для собственного удовольствия или
учеными в научных целях - делится на две категории: макрофотосъемка и
микрофотосъемка. Граница между этими видами фотографирования с увеличением
расплывчата и, в общем, определяется размерами фотографируемого объекта,
характером применяемого оборудования и назначением снимка. Микрофотосъемку не
следует путать с микрофильмированием, то есть получением микрофильмов -
уменьшенных во много раз фотокопий.
Макрофотосъемка - это фотографирование мелких
объектов, обычно рассматриваемых в лупу, с увеличением в 10-30 раз. Роль лупы
выполняет фотообъектив, который примерно во столько же раз увеличивает, скажем,
крошечную ракушку, делая видимым ее строение. Иногда используются добавочные
насадочные линзы, но к помощи микроскопа при макросъемке не прибегают (то есть
1 сантиметр изображения на светочувствительном материале фотоаппарата
соответствует 2 - 0,05 сантиметрам объекта).
Макросъёмка - это принцип формирования
увеличенного изображения.
Объектив создаёт действительное увеличенное
изображение объекта съёмки на любом светочувствительном материале - фотоплёнка,
фотопластинка, фотобумага, киноплёнка или на электронном устройстве (матрица
цифрового фотоаппарата или видеокамеры, видикон телевизионной камеры).
Теоретически макросъёмка может быть произведена
любым съёмочным аппаратом, однако конструктивные особенности конкретной модели
могут сильно препятствовать этому.
Микрофотосъемка - это фотографирование объектов
с увеличением от 10 раз и до предельного максимума, когда снимаются объекты,
видимые лишь в сильнейшие микроскопы, увеличивающие в миллионы раз. Чтобы
передать светочувствительной пленке увеличенное изображение, оптическая система
микроскопа используется вместо объектива фотоаппарата. Иногда же фотоаппарат
просто присоединяют к микроскопу и фотографируют, не удаляя фотообъектива.
В научных исследованиях нередко применяются
сложные крупногабаритные микрофотоустановки. В одних для получения увеличенных
изображений используются световые волны, в других - пучки электронов или ионов.
Но среди самых интересных микрофотографий есть немало и таких, которые сделаны
с помощью обыкновенных "биологических" микроскопов, хорошо известных
многим поколениям школьников. Даже дешевые модели таких оптических микроскопов
стоящие 25 долларов или меньше, несмотря на относительную примитивность, можно
приспособить для микрофотографии.
Большинство таких устройств позволяет получать
темные изображения на светлом фоне (метод светлого поля) или светлые
изображения на темном фоне (метод темного поля) и открывать совершенно
неожиданные особенности строения объектов. Неожиданные цветовые эффекты дает
освещение поляризованным светом, в особенности при микросъемке некоторых
минералогических и биологических образцов.
Снимки такого рода производят странное,
смущающее глаз впечатление. На них лишь изредка можно уловить масштаб
увеличения. Фотография, вдобавок, позволяет увеличивать полученные изображения
вторично. Начальное увеличение передается на фотопленку через микроскоп. Если
этого недостаточно, полученный снимок можно еще раз увеличить с помощью
обыкновенного фотолабораторного оборудования. Если сфотографировать, скажем,
нейлоновое волокно с увеличением в 100 раз, а полученный снимок увеличить еще в
10 раз, то конечный результат даст тысячекратное увеличение.
Способность фиксировать изображения, невидимые
невооруженным глазом - бесценный вклад фотографии в науку. Недаром Роберт Кох,
знаменитый немецкий бактериолог, еще в 1870-х годах убеждал коллег отказаться
от зарисовок и пользоваться микрофотографией. "Зарисовки микроскопических
объектов редко бывают во всем схожи с оригиналом, - говорил он. - Почти всегда
они гораздо красивее". Кох был прав только в первой части своего
утверждения. Микрофотография показала, что по части художественных способностей
природа даст любому ученому сто очков вперед [10].
1.3.5 Математическое описание влияния
ингибиторов на подвижность микроводорослей
Микроводоросли совершают непрерывное движение,
состоящее из ряда прямолинейных перемещений с некоторой средней скоростью vинф
под случайным углом. Клетки в световом потоке проецируются в виде эллипсов
длиной b и шириной а.
В соответствии с рисунком 5 показан
измерительный преобразователь, функционирование которого основано на измерении
прошедшего потока.
ЛФП периодически преобразует световой поток в
электрический сигнал (один кадр), который можно представить в виде столбца U(i)
матрицы напряжений U(i,j), где i - номер фотоприёмника (ФП), а j - номер кадра.
Рисунок 5 - Структурная схема измерительного
преобразователя: 1 - точечный источник света; 2 - собирающая линза; 3 -
диафрагма; 4 - клетка, формирующая тень на поверхности линейки фотоприёмников;
5 - линейка фотоприёмников; 6 - кювета с исследуемой средой; 7 - исследуемая
среда.
Параметры сигнала ЛФП отражают концентрацию
подвижных клеток и их динамику. Каждая клетка имеет проекцию под случайным
углом на плоскости ЛФП. Некоторые проекции попадают на ЛФП. Данное событие
обозначим А. Вероятность события А - Р(А), определяется согласно решению задачи
Бюффона [11]:
 , (3)
, (3)
где d - ширина кюветы с исследуемой взвесью;
 - сумма длины
проекции клетки и расстояния, проходимого ею за время между кадрами
- сумма длины
проекции клетки и расстояния, проходимого ею за время между кадрами  [с]
при средней линейной скорости
[с]
при средней линейной скорости  м/с [11].
м/с [11].
 , (4)
, (4)
где Клин - безразмерный коэффициент
линейности движения.
Процесс движения N микроводорослей в ИП
формирует поток событий А со средним числом М пересечений за время экспозиции.
С учётом (3,4) запишем:
 (5)
(5)
где С - концентрация микроводорослей, моль/дм3;-
толщина кюветы, м;
 - высота
контролируемого объёма, м;
- высота
контролируемого объёма, м;
 - среднее число
событий А на единицу длины ЛФП и единицу концентрации, 1/(м∙м-3
);DET - безразмерный коэффициент детерминированности движения (для
учёта отклонения от модели Бюффона в случае направленного движения, когда
распределение углов движения клетки неравномерно).
- среднее число
событий А на единицу длины ЛФП и единицу концентрации, 1/(м∙м-3
);DET - безразмерный коэффициент детерминированности движения (для
учёта отклонения от модели Бюффона в случае направленного движения, когда
распределение углов движения клетки неравномерно).
При условии  пересечение
проекций клетки и ЛФП будет длиться несколько кадров, в течение
пересечение
проекций клетки и ЛФП будет длиться несколько кадров, в течение  [с].
[с].
Величина Q среднего числа событий А получена по
аналогии с формулой Литтла, применяемой в теории массового обслуживания [11].
 (6)
(6)
где KQ
-
коэффициент пропорциональности, м.
Линейная зависимость Q(C) получена без учёта
наложений проекций клеток на один и тот же участок ЛФП. Наложение двух проекций
приводит к появлению нелинейности, для учёта которой введён коэффициент Kover
[11]:
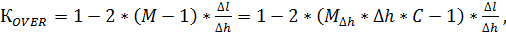 (7)
(7)
где  -
разрешающая способность системы выделения проекций клеток на ЛФП.
-
разрешающая способность системы выделения проекций клеток на ЛФП.
Тогда с учётом (5-7) запишем:
 (8)
(8)
Для определения количества и координат проекций
клеток на ЛФП необходимо провести их детектирование, конечным результатом
которого является построение матрицы событий  ,
где [11]:
,
где [11]:
 , (9)
, (9)
Среднее число проекций на ЛФП за время  определяется
выражением:
определяется
выражением:
 , (10)
, (10)
где Н и L - номера верхнего и нижнего
фотоприёмников nH
и nL соответственно;- число кадров.
Формирование случайного процесса. Столбец
выходных напряжений элементов ЛФП U(i) формируется в соответствии с выражением [11]:
 (11)
(11)
где P(i) - среднее значение транзитивной
составляющей падающего светового потока на поверхность i-го ФП за время
экспозиции  , Вт/м2;
, Вт/м2;
АФП - площадь ФП, м ;( )
- чувствительность ЛФП, В/(Вт-с).
)
- чувствительность ЛФП, В/(Вт-с).
Величина транзитивной составляющей светового
потока отражает наличие проекции клетки на ФП. При размерах ФП, сравнимых с
размером клетки, экстинкция может быть охарактеризована долей потока ,
на которую уменьшается падающий поток и выражена формулой [11]:
,
на которую уменьшается падающий поток и выражена формулой [11]:
 , (12)
, (12)
где P0 - мощность потока, падающего
на клетку,tr(x, m, ) - транзитивная
доля мощности потока, прошедшая через клетку, улавливаемая ФП под телесным
углом
) - транзитивная
доля мощности потока, прошедшая через клетку, улавливаемая ФП под телесным
углом  после
рассеяния падающего потока клеткой с относительным показателем преломления m и
коэффициентом дифракции x. Дифракционная
составляющая при рассеянии на малых углах и при размерах фотоприемника,
сравнимых с размерами клетки, не способна существенно изменить интенсивность
прошедшего потока. Общее выражение для
светового потока РФП, падающего на фотоприёмник, определяется
выражением [11]:
после
рассеяния падающего потока клеткой с относительным показателем преломления m и
коэффициентом дифракции x. Дифракционная
составляющая при рассеянии на малых углах и при размерах фотоприемника,
сравнимых с размерами клетки, не способна существенно изменить интенсивность
прошедшего потока. Общее выражение для
светового потока РФП, падающего на фотоприёмник, определяется
выражением [11]:
 , (13)
, (13)
где PN - аддитивный шум светового
потока.
Учтём возможную статическую неравномерность
освещённости элементов ЛФП путём перехода к нормированным величинам. Учитывая
выражения (12, 13), имеем:
 , (14)
, (14)
где  -
отношение величин шумового и падающего потоков.
-
отношение величин шумового и падающего потоков.
Принимая, что максимальное значение на выходе
каждого фотоприёмника соответствует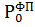 ,
согласно выражениям (11, 14) запишем:
,
согласно выражениям (11, 14) запишем:
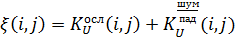 , (15)
, (15)
где  -
средний за время кадра коэффициент ослабления потока взвесью,
-
средний за время кадра коэффициент ослабления потока взвесью,
 ) - коэффициент
шума выходного напряжения фотоприёмника.
) - коэффициент
шума выходного напряжения фотоприёмника.
Матрица  является
математическим представлением случайного импульсного процесса
пространственно-временного распределения экстинкции взвеси.
является
математическим представлением случайного импульсного процесса
пространственно-временного распределения экстинкции взвеси.
Функция полезного сигнала. Эмпирически было
выявлено, что сигнал, формируемый при движении проекции клетки по ЛФП, может
быть аппроксимирован двумерным гауссовым импульсом [11]:
 , (16)
, (16)
где i0 - номер ФП, соответствующий
центру проекции клетки;0 - номер кадра, соответствующий минимуму
освещённости в центре проекции;
 - параметры
импульса по координате, В;
- параметры
импульса по координате, В;
 - временной
параметр импульса.
- временной
параметр импульса.
Сигнал от проекции клетки на одном кадре имеет
форму импульса Гаусса, и сигнал одного ФП при пересечении проекции и ЛФП во
времени также имеет вид импульса Гаусса.
На основании канонического представления сигнала
в виде импульсного случайного процесса [11]:
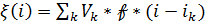 , (17)
, (17)
где Vk - случайные величины;(i) -
неслучайная функция.
На основании данных о виде функции было
обосновано применение метода вейвлет-декомпозиции для выделения полезного
сигнала. Базисом разложения был выбран вейвлет "мексиканская шляпа",
который имеет участок, по форме схожий с функцией импульса Гаусса.
Матрица событий  ,
отражающая координату клеток, получена на основании преобразования столбцов
матрицы см. (15), методом вейвлет-декомпозиции с последующим сравнением
полученных величин относительно порогового значения упор.
,
отражающая координату клеток, получена на основании преобразования столбцов
матрицы см. (15), методом вейвлет-декомпозиции с последующим сравнением
полученных величин относительно порогового значения упор.
Используя выражение (10), получаем среднее число
проекций на ЛФП.
Определение информативного параметра динамики
движения клеток. Среднее число событий Q при установленном пороговом значении,
является функцией от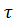 , что позволяет
получить новый параметр, отражающий динамику движения популяции. Учитывая, что
, что позволяет
получить новый параметр, отражающий динамику движения популяции. Учитывая, что  определяет
параметр
определяет
параметр  импульса
Гаусса, см. (18), можно меняя упор выявить различия Q при разных
импульса
Гаусса, см. (18), можно меняя упор выявить различия Q при разных .
.
Составляя систему из двух уравнений для разных упор
с учётом (8, 10, 16) получим величину  ,
которая связана с
,
которая связана с :
:
 , (18)
, (18)
Формирование информативного параметра
концентрации клеток. Сигнал  (15) является
случайным импульсным процессом, состоящим из двумерных гауссовых импульсов,
появляющихся с интенсивностью (6) [11]:
(15) является
случайным импульсным процессом, состоящим из двумерных гауссовых импульсов,
появляющихся с интенсивностью (6) [11]:
 , (19)
, (19)
Эта интенсивность пропорциональна концентрации,
см. (5). Зависимость (8) числа событий от концентрации клеток нелинейная. Это
связано с потерей импульсов при наложении. Рассмотрение параметров сигнала,
учитывающих это явление позволит получить линейную зависимость в широком
диапазоне концентраций.
На основе теоремы Кэмпбелла, линейно связывающей
интенсивность потока со средним значением и дисперсией пуассоновского процесса,
и выражения (19), можно утверждать:
 , (29)
, (29)
 , (30)
, (30)
где KM и KD - коэффициенты
пропорциональности [11].
1.4 Механизмы подавления подвижности клеток
1.4.1 Биоэнергетика клеток и ее связь с
подвижностью микроорганизмов
Живая клетка избегает прямого использования
энергии внешних ресурсов для совершения полезной работы. Она сначала превращает
их в одну из трех конвертируемых форм энергии ("энергетических
валют"), а именно: в АТФ, протонный или натриевый потенциал, которые затем
расходуются для осуществления различных энергоемких процессов.
Любая живая клетка обеспечивает свои
энергетические потребности за счет внешних ресурсов. Как ресурсы, так и
потребности отличаются большим разнообразием. Ресурсами могут служить свет (для
зеленых растений и некоторых бактерий) и многочисленные питательные вещества,
расщепляющиеся в клетке до менее энергетически ценных конечных продуктов. Что
касается потребностей, то они складываются из различных энергоемких процессов,
необходимых для совершения отдельных видов полезной работы клетки и организма.
Даже у простейших живых существ, каковыми являются бактерии, таких процессов
насчитывается несколько десятков. Поэтому неудивительно, что живая клетка
располагает особой "энергетической валютой", играющей роль посредника
между процессами запасания энергии и ее траты. Долгое время считалось, что
единственным типом такой "валюты" служат так называемые
высокоэнергетические химические соединения, а среди них прежде всего
аденозинтрифосфат (АТФ). Однако последние работы биоэнергетиков опровергли эту
догму. Оказалось, что клетка располагает не одним, а тремя типами
"энергетической валюты". Наряду с АТФ такую роль выполняют протонный
и натриевый потенциалы на биологических мембранах.
В результате этого учеными были сформулированы
три закона биоэнергетики. Кратко их суть сводится к следующим положениям:
Первый закон биоэнергетики:
Живая клетка не использует "впрямую"
внешние ресурсы для получения энергии, необходимой для обеспечения внутренних
процессов. Клетка "конвертирует" энергию внешних ресурсов в одну из
трех внутренних "энергетических валют": в АТФ, натриевый или
протонный (водородный) потенциал, которые затем расходуются для осуществления
различных энергоемких процессов.
Второй закон биоэнергетики:
Живая клетка в результате эволюции приобрела
способность использовать как минимум две "энергетических валюты":
водорастворимую (АТФ) и связанную с мембраной - натриевый или водородный
потенциал.
Третий закон биоэнергетики:
"Энергетические валюты" клетки могут
превращаться одна в другую. Поэтому получения хотя бы одной из них за счет
внешних ресурсов достаточно для поддержания жизнедеятельности.
В наиболее эволюционно продвинутой животной
клетке имеются все три вида "энергетической валюты" - это увеличивает
ее способность к выживанию и выполнению ответственных функций в организме.
Функции клеточного дыхания
Функции, возлагаемые на процесс легочного
дыхания, тоже достаточно разнообразны. В упрощенном виде они могут быть разбиты
на четыре группы:
запасание "энергетической валюты" в
конвертируемой форме АТФ или протонного потенциала;
выделение энергии в виде тепла;
образование веществ, необходимых клетке для ее
существования;
удаление веществ, наличие которых во внутренней
среде клетки нежелательно [12].
Нескончаемый поток энергии в клетке, поток
энергии от одной клетки к другой или от одного организма к другому и составляет
сущность жизни. Живые клетки обладают сложными и эффективными системами для
превращения одного вида энергии в другой. Превращения энергии происходят
главным образом в двух структурах - в хлоропластах, имеющихся у зеленых
растений, и в митохондриях, имеющихся в клетках как растений, так и животных.
Изучением превращений энергии в живых организмах занимается биоэнергетика.
В живом мире различают три основных вида превращения
энергии:
. Лучистая энергия солнечного света улавливается
имеющимся в зеленых растениях зеленым пигментом хлорофиллом и превращается в
процессе так называемого фотосинтеза в химическую энергию, которая используется
для синтеза из двуокиси углерода и воды углеводов и других сложных молекул.
Энергия солнечного света, представляющая собой одну из форм кинетической
энергии, превращается таким образом в один из типов потенциальной энергии.
Химическая энергия запасается в молекулах углеводов и других питательных
веществ в форме энергии связей между входящими в их состав атомами.
2. Химическая энергия углеводов и других молекул
превращается в процессе клеточного дыхания в биологически доступную энергию
макроэргических фосфатных связей. Такого рода превращения энергии
осуществляются в митохондриях.
. Превращение энергии, происходящее при
использовании клеткой химической энергии этих фосфатных связей для работы:
механической работы - при мышечном сокращении, электрической работы - при
передаче нервного импульса, осмотической работы - при передвижении молекул
против градиента концентраций, химической работы - при синтезе молекул в
процессе роста. Часть энергии при этом теряется, рассеиваясь в форме тепла.
Растения и животные выработали в процессе эволюции весьма эффективные
преобразователи энергии для осуществления этих процессов, а также весьма тонкие
регуляторные системы, дающие клетке возможность приспосабливаться к изменениям
окружающих условий.
Микроорганизмы движутся посредством жгутиков.
Источником энергии для вращения служит не АТФ, а электрическое поле или ионный
градиент на внутренней мембране бактериальной клетки [13].
1.4.2 Разобщители клеточного дыхания и
окислительного фосфолирования
Окислительное фосфолирование, синтез АТФ из
аденозиндифосфата и неорганического фосфата, осуществляющийся в живых клетках,
благодаря энергии, выделяющейся при окислении орг. в-в в процессе клеточного
дыхания. В общем виде О.ф. и его место в обмене в-в можно представить схемой в
соответствии с рисунком 6:

Рисунок 6 - Схема окислительного фосфолирования
АН2 - орг. вещества, окисляемые в
дыхательной цепи (так называемые субстраты окисления, или дыхания);
АДФ - аденозиндифосфат;
Р - неорганические фосфат.
Поскольку АТФ необходим для осуществления многих
процессов, требующих затраты энергии (биосинтез, совершение механической
работы, транспорт веществ и др.), О.ф. играет важнейшую роль в
жизнедеятельности аэробных организмов. Образование АТФ в клетке происходит
также благодаря другим процессам, например в ходе гликолиза и разложения типов
брожения, протекающих без участия кислорода. Их вклад в синтез АТФ в условиях
аэробного дыхания составляет незначительную часть от вклада О.ф. (окисление
5%).
У животных, растений и грибов О.ф. протекает в
специализированных субклеточных структурах-митохондриях в соответствии с
рисунком 7; у бактерий ферментные системы, осуществляющие этот процесс,
находятся в клеточной мембране.

Рисунок 7 - Упрощенная схема митохондрии: 1 -
внутренняя мембрана; 2 - наружная мембрана; 3 - межмембранное пространство; 4 -
матрикс; 5 - кристы.
Митохондрии окружены белково-фосфолипидной
мембраной. Внутри митохондрий (в т. наз. матриксе) идет ряд метаболических
процессов распада пищевых в-в, поставляющих субстраты окисления АН2
для О.ф. Наиб. важные из этих процессов -трикарбоновых кислот цикл и т.
называемое -окисление жирных к-т (окислит. расщепление жирной к-ты с
образованием ацетил-кофермента А и к-ты, содержащей на 2 атома С меньше, чем исходная;
вновь образующаяся жирная к-та также может подвергаться окислению).
Интермедиаты этих процессов подвергаются дегидрированию (окислению) при участии
ферментов дегидрогеназ; затем электроны передаются в дыхательную цепь
митохондрий-ансамбль окислительно-восстановительных ферментов, встроенных во
внутреннюю митохондриальную мембрану. Дыхательная цепь осуществляет
многоступенчатый экзэргонический перенос электронов (сопровождается уменьшением
свободной энергии) от субстратов к кислороду, а высвобождающаяся энергия
используется расположенным в той же мембране ферментом АТФ-синтетазой, для
фос-форилирования АДФ до АТФ. В интактной (неповрежденной) митохондриальной
мембране перенос электронов в дыхательной цепи и фосфорилирование тесно
сопряжены между собой. Так, напр., выключение фосфорилирования по исчерпании
АДФ либо неорганического фосфата сопровождается торможением дыхания (эффект
дыхательного контроля). Большое число повреждающих митохондриальную мембрану
воздействий нарушает сопряжение между окислением и фосфорилированием, разрешая
идти переносу электронов и в отсутствие синтеза АТФ (эффект разобщения) [13].

Рисунок 8 - Схема хемиосмотического механизма
окислительного фосфолирования: ДЦ - дыхательная цепь, АН2 - субстраты
дыхания. Заштрихованный фрагмент внутр. Митохондриальной мембраны в разрезе.
Механизм О.ф. можно представить схемой: Перенос
электронов (дыхание) А~В→АТФ→А~В. В-высокоэнергетические
интермедиат. Предполагалось, что А~В - химические соединения с макроэргической
связью, напр. фосфорилированный фермент дыхательной цепи (хим. гипотеза
сопряжения), или напряженная конформация к.-л. белка, участвующего в О.ф.
(конформационная гипотеза сопряжения). Однако эти гипотезы не получили
экспериментального подтверждения. Наибольшим признанием пользуется
хемиосмотическая концепция сопряжения, предложенная в 1961 П. Митчеллом (за
развитие этой концепции в 1979 ему присуждена Нобелевская премия). Согласно
этой теории, свободная энергия транспорта электронов в дыхательной цепи
затрачивается на перенос из митохондрий через митохондриальную мембрану на ее
наружную сторону ионов Н+ в соответствии с рисунком 8 (процесс 1). В
результате на мембране возникает разность электрических потенциалов и разность
хим. активностей ионов Н+ (∆рН) (внутри митохондрий рН выше,
чем снаружи). В сумме эти компоненты дают трансмембранную разность
электрохимических потенциалов ионов водорода между матриксом митохондрий и
внешней водной фазой, разделенными мембраной [14]:
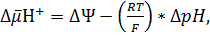 (31)
(31)
Где R-универсальная газовая постоянная,абс.
- температура,число Фарадея.
Величина  обычно
составляет около 0,25 В, причем основная часть (0,15-0,20 В) представлена
электрической составляющей
обычно
составляет около 0,25 В, причем основная часть (0,15-0,20 В) представлена
электрической составляющей  . Энергия
. Энергия  ,
выделяющаяся при движении протонов внутрь митохондрий по электрическому полю в
сторону меньшей их концентрации в соответствии с рисунком 8 (процесс 2)
используется АТФ-синтетазой для синтеза АТФ. Тобр., схему О.ф.,
согласно этой концепции, можно представить в следующем виде:
,
выделяющаяся при движении протонов внутрь митохондрий по электрическому полю в
сторону меньшей их концентрации в соответствии с рисунком 8 (процесс 2)
используется АТФ-синтетазой для синтеза АТФ. Тобр., схему О.ф.,
согласно этой концепции, можно представить в следующем виде:
Перенос электронов (дыхание)→  →АТФ
→АТФ
Сопряжение окисления и фосфорилирования через позволяет объяснить, почему О.ф., в отличие от гликолитического
("субстратного") фосфорилирования, протекающего в растворе, возможно
лишь в замкнутых мембранных структурах, а также почему все воздействия,
снижающие электрическое сопротивление и увеличивающие протонную проводимость
мембраны, подавляют ("разобщают") О.ф. Энергия
позволяет объяснить, почему О.ф., в отличие от гликолитического
("субстратного") фосфорилирования, протекающего в растворе, возможно
лишь в замкнутых мембранных структурах, а также почему все воздействия,
снижающие электрическое сопротивление и увеличивающие протонную проводимость
мембраны, подавляют ("разобщают") О.ф. Энергия  ,
помимо синтеза АТФ, может непосредственно использоваться клеткой для других
целей - транспорта метаболитов, движения (у бактерий), восстановления
никотинамидных коферментов и др.
,
помимо синтеза АТФ, может непосредственно использоваться клеткой для других
целей - транспорта метаболитов, движения (у бактерий), восстановления
никотинамидных коферментов и др.
В дыхательной цепи имеется несколько участков,
которые характеризуются значит. перепадом окислительно-восстановительного
потенциала ∆Е и сопряжены с запасанием энергии (генерацией  ).
Таких участков, называющих пунктами или точками сопряжения, обычно три:
убихинон-редуктазное звено (∆Е~0,35-0,4 В), убихинол:
цитохром-c-редуктазное звено (∆Е~0,25 В) и цитохром-с-оксидазный комплекс
(∆Е~0,6 В) - пункты сопряжения 1, 2 и 3 соотв. В соответствии с рисунком
9. Каждый из пунктов сопряжения дыхательной цепи может быть выделен из мембраны
в виде индивидуального ферментного комплекса, обладающего
окислительно-восстановительной активностью. Такой комплекс, встроенный в
фосфолипидную мембрану, способен функционировать как протонный насос [14].
).
Таких участков, называющих пунктами или точками сопряжения, обычно три:
убихинон-редуктазное звено (∆Е~0,35-0,4 В), убихинол:
цитохром-c-редуктазное звено (∆Е~0,25 В) и цитохром-с-оксидазный комплекс
(∆Е~0,6 В) - пункты сопряжения 1, 2 и 3 соотв. В соответствии с рисунком
9. Каждый из пунктов сопряжения дыхательной цепи может быть выделен из мембраны
в виде индивидуального ферментного комплекса, обладающего
окислительно-восстановительной активностью. Такой комплекс, встроенный в
фосфолипидную мембрану, способен функционировать как протонный насос [14].
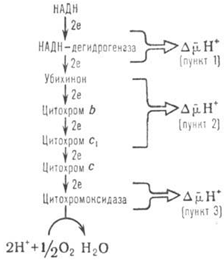
Рисунок 9 - Упрощенная схема расположения
пунктов сопряжения в цепи дыхательных ферментов; НАДН - восстановленная форма
кофермента никотинамидадениндинуклеотида.
Обычно для характеристики эффективности О.ф.
используют величины Н+/2е или q/2e, указывающие сколько протонов
(либо электрических зарядов) переносится через мембрану при транспорте пары
электронов через данный участок дыхательной цепи, а также отношение Н+/АТФ,
показывающее, сколько протонов нужно перенести снаружи внутрь митохондрий через
АТФ-синтетазу для синтеза 1 молекулы АТФ. Величина q/2e составляет для пунктов
сопряжения 1, 2 и 3 соответственно 3-4, 2 и 4. Величина Н+/АТФ при синтезе
АТФ внутри митохондрий равна 2; однако еще один Н+ может тратиться
на вынос синтезированного АТФ 4 из матрикса в цитоплазму переносчиком
адениновых нуклеотидов в обмен на АДФ 3 . Поэтому кажущаяся величина Н+/АТФнаружн
равна 3.
В организме О.ф. подавляется многими токсичными
веществами, которые по месту их действия можно разделить на три группы:
) ингибиторы дыхательной цепи, или т. наз.
дыхательные яды;
) ингибиторы АТФ-синтетазы. Наиболее
распространенные ингибиторы этого класса, употребляемые в лабораторных
исследованиях, - антибиотик олигомицин и модификатор карбоксильных групп белка
дициклогексилкарбодиимид;
) так называемые разобщители О.ф. Они не
подавляют ни перенос электронов, ни собственно фосфорилирование АДФ, но
обладают способностью уменьшать величину  на
мембране, благодаря чему нарушается энергетическое сопряжение между дыханием и
синтезом АТФ. Разобщающее действие проявляет большое число соединений самой
разнообразной химической структуры. Классические разобщители - вещества,
обладающие слабыми кислотными свойствами, способные проникать через мембрану
как в ионизованной (депротонированной), так и в нейтральной (протонированной)
формах. К таким веществам относят, напр., 1-(2-дицианометилен)гидразино-4-трифтор-метоксибензол,
или карбонилцианид-n-трифторметокси-фенилгидразон, и 2,4-динитрофенол (соотв.
формулы I и II; показаны протонированные и депротонированные формы) в
соответствии с рисунком 10.
на
мембране, благодаря чему нарушается энергетическое сопряжение между дыханием и
синтезом АТФ. Разобщающее действие проявляет большое число соединений самой
разнообразной химической структуры. Классические разобщители - вещества,
обладающие слабыми кислотными свойствами, способные проникать через мембрану
как в ионизованной (депротонированной), так и в нейтральной (протонированной)
формах. К таким веществам относят, напр., 1-(2-дицианометилен)гидразино-4-трифтор-метоксибензол,
или карбонилцианид-n-трифторметокси-фенилгидразон, и 2,4-динитрофенол (соотв.
формулы I и II; показаны протонированные и депротонированные формы) в
соответствии с рисунком 10.

Рисунок 10 - Разобщителеи окислительного
фосфолирования (2,4 - динитрофенол)
Двигаясь через мембрану в электрическое поле в
ионизованной форме, разобщитель уменьшает ∆Ѱ;
возвращаясь обратно в протонированное состоянии, разобщитель понижает ∆рН
в соответствии с рисунком 11. Таким образом, такой "челночный" тип
действия разобщителя приводит к уменьшению .
.

Рисунок 11 - Схема рабочего цикла разобщителя
"челночного" типа: ФКФ - 1-(2-дицианометилен)
гидразино-4-трифтометоксибензол
Разобщающим действием обладают также ионофоры
(напр., грамицидин), повышающие электропроводность мембраны в результате
образования ионных каналов или вещества, разрушающие мембрану (напр.,
детергенты).
О.ф. открыто В. А. Энгельгардтом в 1930 при
работе с эритроцитами птиц. В 1939 В. А. Белицер и Е. Т. Цыбакова показали, что
О.ф. сопряжено с переносом электронов в процессе дыхания; к такому же
заключению несколько позднее пришел Г. М. Калькар.
Как правило, разобщители - липофильные вещества,
легко проходящие через липидный слой мембраны. Примерами разобщителей могут
быть также некоторые лекарства, например дикумарол - антикоагулянт или
метаболиты, которые образуются в организме, билирубин - продукт катаболизма,
тироксин - гормон щитовидной железы. Все эти вещества проявляют разобщающее
действие только при их высокой концентрации [14].
2.
Экспериментальная часть
2.1 Материалы и оборудование
2.1.1 Микроорганизмы и питательные среды для
культивирования микроорганизмов
Клетки микроводоросли Euglena
glacilis из коллекции
кафедры биотехнологии и биоэкологии, сточная вода, физиологический раствор,
среда Лозино-Лозинского, стрептомицин.
Среда Лозино-Лозинского: к 1 дм3
дистилированной воды добавляли 0,1 г NaCl,
0,01 г KCl,
0.01 г MgSO4,
0.01 г CaCl2,
0.02 г NaHCO3.
Доводили рН среды до 7,0. Разливают в пробирки и стерилизуют при (121±2)°С в
течение (15±1)мин. Среду можно хранить в холодильнике при 8°С в течение недели.
Стрептомицин: раствор стрептомицина концентрации
100 г/дм3 готовят путем внесения во флакон с 0,1 г антибиотика 1 см3
стерильной дистиллированной воды.
Физиологический раствор: В 1 дм3
дистиллированной воды растворяют 8,5 г хлористого натрия, разливают раствор в
чистые пробирки по 100 см3 и стерилизуют при (121±2)°С в течение
(20±2)мин.
Оборудование. Световой микроскоп
"Биолам-2М" с фотонасадкой МФН-11, цифровая микрокамера, таймер с
точностью отсчета 0,1 с, пробирки, пипетки, капилляры, предметные стекла,
камера Горяева, чашки Петри.
2.1.2 Выделение чистых культур микроводорослей и
их идентификация.
Метод Пастёра. Пользуясь жидкими питательными
средами, можно выделить микроорганизмы из их смеси постепенным разбавлением
культуры каким-либо стерильным раствором до тех пор, пока в одной капле
останется одна клетка микроорганизма. В колбочки с небольшим количеством
питательной среды высевают по одной капле разведенной культуры. В тех
колбочках, где выросла одна колония (в виде пятна на дне), попала одна клетка и
образовалась чистая культура. В качестве питательной среды для выделения микроводорослей
Euglena glacilis
используется среда Лозино-Лозинского, в ней содержится необходимый комплекс
питательных микро- и макроэлементов, способствующий росту микроводорослей.
Систематических признаков у микроводорослей не
так моного, и их определение связанно со значительными трудностями. Важными
морфологическими признаками являются форма и размеры тела, число и длянна
жгутиков, их расположение, наличие и отсутствие хролопластов, окраска и др.
хроматофоры микроводорослей окрашиваются акридиновым оранжевым. Функциональное
состояние водорослей на разных этапах очистки также оценивают при помощи
акридинового оранжевого. Живые клетки микроводорослей окрашиваются в
ярко-красный цвет, водоросли с угнетенным процессом фотосинтеза дают
оранжево-розовую люминестенцию.
Зеленые формы Euglena
glacilis становятся
бесцветными при выращивании в темноте, но снова приобретают зеленую окраску на
свету.
.2 Методы анализа
2.2.1 Методы определения содержания
микроводорослей
Подсчет клеток в счетных камерах:
Метод прямого подсчета клеток микроорганизмов в
счетных камерах успешно применяют для определения общего количества
микроорганизмов, содержащихся во взвесях (суспензиях).
Известны счетные камеры разных конструкций
(Горяева, Фукс - Розенталя, Петрова -
Хауссера, Тома - Цейса и др.).
Метод количественного учета микроорганизмов с
помощью счетных камер имеет ограничения применения, связанные с тем, что в
счетных камерах проводится учет всех клеток микроорганизмов без их
дифференциации на живые и мертвые клетки. Кроме того, счетные камеры могут быть
использованы лишь для подсчета относительно крупных объектов - клеток
водорослей, дрожжей, спор грибов, микроскопируемых при объективе от 8 до 40´.
В качестве примера можно привести камеру
Горяева, которая внешне представляет собой толстое предметное стекло,
разделенное поперечными бороздками, образующими три поперечно расположенные
плоские площадки в соответствии с рисунком 12а. Средняя площадка продольным
прорезом разделена пополам, причем на каждой половине нанесена квадратная сетка.
Две боковые площадки расположены на 0,1 мм выше средней, они служат для
притирания покровного стекла в соответствии с рисунком 12б.
Сетка разделена на определенное число больших и
маленьких квадратов, по-разному сгруппированных. Постоянной величиной во всех
сетках является маленький квадрат АВСD
в соответствии с рисунком 12в, сторона которого равна 1/20 мм, площадь его -
1/400 мм²,
а объем при высоте камеры 1/10 мм - 1/4000 мм³
или 1/4000000 мл. Так называемый большой квадрат АВСD
состоит из 16 малых квадратиков. Камера Горяева имеет площадь 9 мм²,
объем камеры 9 мм³ и разбита
на 225 больших квадратов (15 рядов по 15 больших квадратов в каждом ряду) [15].
Заполнение камеры и подсчет клеток:
Каплю взвеси наносят капилляром или пипеткой на
сетку камеры и сверху накрывают чистым покровным стеклом. Жидкость под
покровным стеклом должна равномерно без пузырьков распределиться по всей сетки,
не выступая в желобок между стенками. Большими пальцами покровное стекло плотно
притирают к боковым площадкам камеры до появления картины интерференции (колец
Ньютона). Заполненную камеру помещают на предметный столик микроскопа и через 2
минуты микроскопируют с объективом от 8 до 40´
(в поле зрения должны быть отчетливо видны как квадратики, так и клетки
микроорганизмов). Подвижные клетки перед заполнением камеры убивают нагреванием
или 0,5%-ным раствором формалина.
а - вид сверху; б - вид сбоку; в - вид при малом
увеличении; h - высота камеры
Рисунок 12 - Счетная камера Горяева
Обычно просчитывают количество клеток в пяти
больших квадратах (т. е. в 80 малых), расположенных по диагонали. Учитывают все
клетки, размещенные внутри квадрата и на пограничных линиях, если они большей
частью лежат внутри квадрата. Клетки, разделенные пограничной линией пополам,
считают только на двух из четырех границ квадрата, а клетки, лежащие большей
своей половиной вне данного квадрата, совсем не учитывают. Количество клеток в
1 мл исследуемой суспензии вычисляют по [15] формуле:
 (31)
(31)
где М - количество клеток в 1 мл суспензии;
a - среднее
количество клеток в квадрате сетки;
h - высота камеры,
мм;
S - площадь квадрата
сетки, мм²;
³ - коэффициент
перевода см³ в мм³;
n - коэффициент
разведения исследуемой суспензии [15].
2.2.2 Методы определения подвижности клеток
Получаем растворы антибиотика стрептомицина
(1000-0,1 ед./см3).
Проводят измерение скорости движения клеток E.gracilis
в контрольном образце и в образце с химическим веществом. В приготовленные
растворы вносят культуру микроводоросли в экспоненциальной стали роста в
соотношении 9: 1 и выдерживают на протяжении 15 мин, после чего образец вводят
в капилляры. Заполненные капилляры помещают в объект микрометра, фиксируют
зажимами и наблюдают под микроскопом с объективом 20×.
Измеряют с помощью секундомера время пробега клеток в капиллярах между двумя
фиксированными метками шкалы объект микрометра в поле зрения микроскопа.
Для увеличения точности и воспроизводимости
показаний измерения проводят на 10 клетках микроводоросли, усредняя полученные
результаты.
При визуальном наблюдении движения клеток под
микроскопом определяют среднее время прохождения клетками E.gracilis
фиксированного расстояния (0,5 мм). В варианте с цифровой камерой регистрируют
треки движения микроорганизмов и определяют пути, пройденные клетками, по шкале
объект микрометра за фиксированный интервал времени.
Абсолютное значение скорости движения клеток
микроводоросли рассчитывают из следующего соотношения [15]:
 , (32)
, (32)
где l
- путь пробега, мм;
t - время пробега
клеток между фиксированными метками, с.
Среднее значение скорости находят по [15]
формуле 33:
 , (33)
, (33)
где n
- число наблюдаем клеток микроводоросли.
Среднеквадратичную ошибку среднего определяют по
следующей формуле [15]:
 , (34)
, (34)
2.2.3 Методы определения жизнеспособности клеток
Для анализа жизнедеятельности микроорганизмов
используются термограммы. Различают дифференциальную и интегральную
термограммы.
Под дифференциальной термограммой понимают
зависимость мощности тепловыделении образца от времени наблюдения.
Интегральная термограмма отражает общее
количество тепла, выделенного к определенному моменту, как функцию времени.
Микрокалориметр непосредственно регистрирует дифференциальную термограмму, и
затем рассчитывается интегральная термограмма.
Тепловыделение может быть обусловлено
физико-химическими, биохимическими, микробиологическими процессами. В последнем
случае термограмма отражает энергетический обмен микроорганизмов с окружающей
средой в процессе жизненного цикла популяции клеток.
Так как различные процессы жизнедеятельности
микроорганизмов сопровождаются выделением тепла, то мерой физиологической
активности клеток с энергетической точки зрения может являться скорость их
тепловыделения, которая отражает как интенсивность протекающих метаболических
реакций, так и скорость размножения клеток.
В основе биокалориметрии, как и других косвенных
инструментальных методов анализа живых организмов, лежит зависимость величины
регистрируемого сигнала от численности и физиологической активности клеток в
анализируемом объекте.
Для характеристики тепловыделения отдельного
вида микроорганизмов может быть использована величина удельной теплопродукции
клеток [16]:
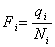 , (35)
, (35)
где qi
- мощность тепловыделения клеток i-го
вида;
Ni
- количество клеток i-го вида
[16].
Перед тем как приступить к работе с прибором,
его необходимо прогреть в течение 1ч. После чего установив параметры,
необходимые для измерения можно приступить к измерениям. К прибору прилагаются
две микрокюветы объемом 1 мл, которые заполняются раствором сравнения
(дистиллированная вода) и суспензией, изучаемых микроорганизмов. Суспензию
микроорганизмов готовят следующим образом: к полученной чистой культуре приливают
физраствор. Медленно, круговыми движениями перемешиваем. Затем отбираем 0,5 мл
и переливаем в микрокувету на 1 мл. В эту же кювету помещаем 0,5 мл среды
Лозино-Лозинского. В другую кювету помещаем дистиллированную воду. Заполненные
микрокюветы помещают в микрокалориметр и проводят измерения.
2.3 Результаты и их обсуждение
2.3.1 Описание выделения и идентификации
микроводорослей
Выделение микроводорослей производилось из пробы
сточной воды методам Пастера. Метод Пастера - последовательное разведение исследуемого
материала в жидкой питательной среде до концентрации одной клетки в объеме.
Исследуемый материал последовательно разводят в жидкой питательной среде: берут
ряд пробирок с физиологическим раствором, исследуемый материал вносят в первую
пробирку, перемешивают, из неё переносят во вторую и т.д. Проводили 5
разведений. В 4 разведении содержалась одна клетка микроводоросли Euglena
gracilis. В качестве питательной среды использовали среду Лозино-Лозинского.
Среду готовили следующим образом. К 1 дм3 дистилированной воды
добавляли 0,1 г NaCl,
0,01 г KCl,
0.01 г MgSO4,
0.01 г CaCl2,
0.02 г NaHCO3.
Доводили рН среды до 7,0. Среду можно хранить в холодильнике при 8°С в течение
недели. Выращивали микроводоросли при температуре 20°С и естественном
освещении.
Зеленые формы выделенных организмов становятся
бесцветными при выращивании в темноте, но снова приобретают зеленую окраску на
свету.
2.3.2 Изучение влияния антибиотиков на
подвижность микроводорослей
В качестве тест-объекта в работе использовали
клетки микроводоросли Euglena gracilis из коллекции кафедры биотехнологии и
биоэкологии БГТУ. Культивирование клеток микроводоросли осуществляли в среде
Лозино-Лозинского при температуре 20°С и естественном освещении. Пересев
культуры клеток в свежую среду осуществляли через каждые 3 суток для
поддержания их в состоянии логарифмического роста. Определение количества
клеток микроводоросли осуществляли в камере Горяева с помощью микроскопа.
Подсчитанное количество клеток находилось в интервале 103-104
кл./мл.
В качестве антибиотиков использовали
стрептомицин сульфат. Раствор стрептомицина концентрации 100 г/дм3
готовят путем внесения во флакон с 0,1 г антибиотика 1 см3
стерильной дистиллированной воды.
Измерение рН растворов выполняли на
рН-метре-121. Значение рН для среды Лозино-Лозинского было 7,0.
Исследования проводились на образцах,
искусственно загрязненных антибиотиками в диапазоне концентраций 0,0001-1000
ед./г. Для этого препараты антибиотиков вносили в подготовленный препарат
содержащий водоросли Euglena gracilis.
Для наблюдения за подвижностью клеток
микроводоросли Euglena gracilis использовали микроскоп производства БелОМО,
обьект-микрометр, капилляры, зажимы, цифровой таймер с точностью отсчета 0,1 с.
Для автомаизации измерений на окуляр микроскопа помещали фотонасадку с
фотодиодом ФД-256. После усиления с помощью микросхемы К140УД8А сигнал
регистрировался на самописце КСП-4.
В физиологический раствор (4 мл) добавляли 0,5
мл антибиотика соответствующей концентрации и 0,5 мл микроводоросли Euglena
gracilis, выдерживали в течение 15 мин, заполняли капилляры и измеряли
подвижность клеток с помощью микроскопа при увеличении 20x10. В качестве
контроля использовали образцы с добавлением 0,5 мл чистой среды
Лозина-Лозинского и 0,5 мл клеток. Для
увеличения точности показаний измерения проводили на 9 клетках микроводоросли.
Результаты обрабатывали статистически, используя программное обеспечение
Microsoft Excel. Во время поиска
пищи и при оптимальных условиях существования клетки микроводоросли совершают поступательные
движения в разных направлениях. В присутствии ингибирующих веществ скорость
поступательного движения клеток снижается. При воздействии токсичных веществ
поступательный характер движения клеток изменяетсяна вращательный и они теряют
жизнеспособность. Влияние
ксенобиотиков на клетки Euglena gracilis характеризовали изменением
относительного значения скорости:
 (36)
(36)
где VK - средняя скорость движения
клеток в контрольном образце;
В - относительная подвижность клеток.
Ингибирующий (IС50) эффект действия антибиотиков
определяли величиной концентраций, которые соответствовали 50%-ному изменению
относительной подвижности клеток. Порог обнаружения (Сmin) характеризовали
величиной концентрации антибиотика, вызывавшей изменение относительной
подвижности на 10%. Результаты
исследований подвижности микроорганизмов Euglena gracilis в питательной среде в
присутствии антибиотиков представлены в таблице 1 и на рисунке 13.
Чувствительность клеток микроводоросли Euglena
gracilis к антибиотикам в искусственной питательной среде находилась в
интервале 0,001-0,1 мг/л. На рисунке 13
приведен график изменения относительной подвижности клеток микроводоросли в
зависимости от логарифма концентрации антибиотика стрептомицин сульфат. Как
видно из рисунка, зависимость носит линейный характер и может быть описана
уравнением
B=−a∙lgC + b, (37)
где a, b
- экспериментально найденные константы.
Сравнительный анализ подвижности микроводоросли
Euglena gracilis в искусственной питательней среде показывает, что клетки
сохраняют высокую чувствительность к антибиотикам и в сложных средах.
Таблица 1 - Влияние антибиотиков на подвижность
микроводоросли Euglena
gracilis
|
Вещество
|
Концентрация, ед./мл
|
В,
%
|
Сmin, ед./мл
|
IC50, ед/мл
|
|
Контроль
|
-
|
100
|
-
|
-
|
|
Стрептомицин
|
1000
|
40
|
0,002
|
10
|
|
100
|
45
|
|
|
|
10
|
50
|
|
|
|
1,0
|
55
|
|
|
|
0,1
|
65
|
|
|

Рисунок 13 - Зависимость относительной
подвижности клеток Euglena
gracilis от логарифма
концентрации антибиотика стрептомицин сульфат в питательной среде
Лозино-Лозинского (Т= 20°С)
Процедура анализа антибиотиков предложенным
методом значительно проще и быстрее, чем редуктазным методом. Это позволяет
использовать данный метод для тестирования мясомолочной продукции.
В
изученной области концентрации антибиотиков клетки микроводоросли сохраняли
жизнеспособность, следовательно действие антибиотиков на данные микроорганизмы
носит ингибирующий, а не токсичный характер. При смене питательной среды клетки
быстро восстанавливали исходную активность. Для
оценки устойчивости микроводоросли Euglena
gracilis к антибиотикам
определяли значение IC50
в искусственной питательной среде. Таким
образом, в работе предложен быстрый, простой и чувствительный метод
количественного определения антибиотиков в мясомолочной продукции, основанный
на измерении подвижности клеток микроводоросли Euglena
gracilis, позволяющий в
течение 15-20 мин обнаружить присутствие антибиотиков в концентрации 0,001
ед./мл с относительной погрешностью 10%.
2.3.3 Анализ влияния разобщителей дыхания и
синтеза АТФ на подвижность клеток
В качестве препарата разобщителя дыхания и
синтеза АТФ была взята ацетилсалициловая кислота. Разобщители окислительного
фосфорилирования, являясь амфипатическими, повышают проницаемость мембраны для
протонов, тем самым снижая электрохимический потенциал и выключая АТФ-синтетазу
по типу короткого замыкания.
Для определения влияния разобщителей дыхания и
синтеза АТФ на микроводоросли были проведены измерения тепловыделения
микроводоросли Euglena
gracilis
микрокалориметрическим методам. Испытывали действие разобщителей при
концентрации клеток 104 кл/мл. Суспензию микроорганизмов готовят
следующим образом: к полученной чистой культуре приливают физраствор. Медленно,
круговыми движениями перемешиваем. Затем отбираем 0,5 мл и переливаем в
микрокувету на 1 мл. В эту же кювету помещаем 0,5 мл среды Лозино-Лозинского.
Во втором опыте в кювету дополнительно капали ацетилсалициловую кислоту. Другая
кювета оставалась пустой. Заполненные микрокюветы помещают в микрокалориметр и
проводят измерения. В ходе эксперимента установили, что в присутствии разобщителей
количество выделяющейся энергии увеличилось в среднем на 30%.
При измерении тепловыделения микроводоросли
получены следующие результаты, которые приведены в таблице 2.
Таблица 2 - Тепловыделения микроводорослей
|
n
|
0
|
1
|
2
|
3
|
4
|
6
|
7
|
8
|
9
|
10
|
|
t
|
2
|
4
|
6
|
8
|
10
|
12
|
14
|
16
|
18
|
20
|
22
|
|
Q, мДж
|
0
|
49,4
|
96,6
|
134,8
|
161,8
|
185,4
|
203
|
217,7
|
229,9
|
241,3
|
250,9
|
|
S, мкВт
|
85,02
|
126,9
|
182,4
|
232,7
|
279,3
|
323,1
|
364,3
|
403,7
|
441,5
|
478
|
513,1
|
При измерении тепловыделения микроводоросли в
присутствии разобщителей дыхания и синтезе АТФ получены следующие результаты,
которые приведены в таблице 3.
Таблица 3 - Тепловыделения микроводорослей в
присутствии разобщителей дыхания и синтеза АТФ
|
n
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
|
t
|
2
|
4
|
6
|
8
|
10
|
12
|
14
|
16
|
18
|
20
|
22
|
|
Q, мДж
|
0
|
64,2
|
125,6
|
166,4
|
209,1
|
239,6
|
365,4
|
291,2
|
298,7
|
310,9
|
326,1
|
|
S, мкВт
|
108,6
|
162,3
|
237,12
|
300,2
|
363,1
|
415,3
|
476,3
|
527,7
|
573,2
|
622,1
|
664,2
|
Для анализа жизнедеятельности микроорганизмов
используем термограммы: дифференциальную в соответствии с рисунком 14 и
интегральную в соответствии с рисунком 15.

Рисунок 13 - Графическая зависимость выделенного
тепла от времени измерения
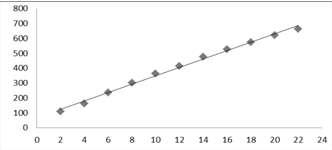
Рисунок 14 - Графическая зависимость мощности
теплового потока от времени измерения
Заключение
В данной курсовой работе были изучены методы
выделения и идентификации микроводорослей и проанализирована их
чувствительность к ингибирующим веществам. Для этого были выделены чистые
культуры микроводорослей Euglena
gracilis, определили их
общее количество в камере Горяева, которое составляет 103-104кл/мл
и провели эксперименты по влиянию антибиотиков на подвижность Euglena
gracilis. Установлено что
действие антибиотика стрептомицина носит ингибирующий, а не токсичный характер
при малых концентрациях. Так же был проведен анализ влияния разобщителей
дыхания и синтеза АТФ на подвижность клеток и установлено, что в присутствии
такого разобщителя, как ацетилсалициловая кислота, выделяется в среднем на 30%
больше энергии.
Список использованных источников
1 Гофман, В.Р. Экологические аспекты
безопасности продовольственного сырья и продуктов питания: Учебное пособие /
В.Р. Гофман.- Челябинск: ЮУрГУ, 2004.- 551 с.
Горбунова, Н.П. Альгология:
Учебное пособие для вузов по специальности "Ботаника" / Н.П,
Горбунова.- Минск: Высшая школа, 1991.- 256 с.
Гайсина, Л.А. Современные
методы выделения и культивирования водорослей: учебное пособие / Л.А. Гайсина,
А.И. Фазлутдинова, Р.Р. Кабиров.- Уфа: БГПУ, 2008.- 152 с.
Вассер, С.П. Водоросли.
Справочник / С.П. Вассер, Н.В. Кондратьева, Н.П. Масюк.- Киев: Наук. думка,
1989.- 608 с.
Федоров, А.А. Жизнь
растений. Том 3. Водоросли и лишайники / А.А. Федоров [и др.]; под ред. А.А.
Федорова.- Москва: Просвещение, 1977.- 487 с.
Мелехова,О.П. Биологический
контроль окружающей среды: биоиндикация и биотестирование: учеб. пособие для
студ. высш. учеб. заведений / О.П. Мелехова [и др.]; под ред. О.П.Мелеховой и
Е.И. Егоровой.- Минск: Издательский центр "Академия", 2007.- 288 с.
Метод биотестирования по
данным электрической реакции клеток харовых водорослей / В.М. Юрин [и др] //
Методы биотестирования вод: Сб.ст. Черноголовка.-1988 - С. 33-37
Саут, Р. Основы альгологии
/ Р. Саут, А.Уиттик.- Москва: Мир, 1990.- 597 с.
Пашкевич, М.А.
Экологический мониторинг: Учебное пособие / М.А. Пашкевич, В.Ф. Шуйский.-
Санкт-Петербург: СПб, 2002.- 89 с.
www.microhunter.ru
Захаров, И.С. Система
аппаратурного исследования структуры популяции Текст. / A.B. Завгородний, И.С.
Захаров // Материалы XII Всероссийской конференции по проблемам науки и высшей
школы.- Санкт-Петербург, 2008. - С. 271-272
Скулачев, В.П. Энергетика
биологических мембран / В.П. Скулачев.- Минск: Наука, 1989.- 288 с.
Скулачев, В.П.
Биоэнергетика. Мембранные преобразования энергии / В.П. Скулачев.- Минск:
Высшая школа, 1989.- 256 с.
Рэкер, Э. Биоэнергетические
механизмы. Новые взгляды / Э.Рэкер.- Минск: Мир, 1979.- 186 с.
Игнатенко, А.В. Сенсорный
контроль качества пищевых продуктов. Лабораторный практикум: учеб. пособие для
студентов специальностей "Физико-химические методы и приборы контроля
качества продукции", "Товароведение и экспертиза товаров" / А.В.
Игнатенко. - Минск: БГТУ,2008. - 186 с.
Игнатенко, А.В.
Микробиологические, органолептические и визуальные методы контроля качества
пищевых товаров. Микрокалориметрия: Лабораторный практикум / А.В. Игнатенко,
Н.В. Гриц. - Мн: БГТУ, 2003. - 114 с.