Изучение ретровирусов
КУРСОВАЯ
РАБОТА
Тема:
Изучение ретровирусов
Содержание
Введение
. Ретровирусы
. Подсемейства
. Морфология и морфогенез вирионов
. Генетический состав
. Спектр хозяев
. Фазы репликации
. Канцерогенез
Заключение
Список литературы
Введение
Вирус (от лат. virus - яд) - простейшая форма
жизни на нашей планете, микроскопическая частица, представляющая собой молекулы
нуклеиновых кислот (ДНК или РНК), заключенные в защитную белковую оболочку и
способные инфицировать живые организмы. Они являются облигатными паразитами,
т.е. не способны размножаться вне клетки. В настоящее время известны вирусы,
размножающиеся в клетках растений, животных, грибов и бактерий.
Честь открытия вирусов принадлежит нашему
соотечественнику Д.И.Ивановскому, который впервые в 1892 г. доказал
существование нового типа возбудителя болезней на примере мозаичной болезни
табака. Будучи студентом Петербургского университета, он выезжал на Украину и в
Бессарабию для изучения причин болезни табака, а затем, после окончания
университета, продолжал исследования в Никитском ботаническом саду под Ялтой. В
содержимом пораженного листа он не обнаружил бактерий, однако сок больного
растения вызвал поражение здоровых листьев. Ивановский профильтровал этот сок
через свечу Шамберлана, поры которой задерживали мельчайшие бактерии. В
результате он обнаружил, что возбудитель проходит даже через такие поры, так
как фильтрат продолжал вызывать заболевание листьев табака. Культивирование его
на искусственных питательных средах оказалось невозможным. Все это указывало на
необычную природу возбудителя. Д.И. Ивановский назвал новый тип возбудителя
"фильтрующиеся бактерии".
По вопросу о происхождении вирусов высказывались
разные предположения. Одни авторы считали, что вирусы являются результатом
крайнего проявления регрессивной эволюции бактерий или других одноклеточных
организмов. Однако эта гипотеза не может объяснить разнообразия генетического
материала у вирусов, неклеточной их организации и отсутствия
белок-синтезирующих систем.
Согласно второй гипотезе вирусы являются
потомками древних, доклеточных форм жизни - протобионтов, предшествовавших
появлению клеточных форм жизни, с которых и началась биологическая эволюция.
Эта гипотеза также не объясняет тех же вопросов, разрешить которые оказалась
бессильной первая.
Наконец третья гипотеза предполагает, что вирусы
произошли от генетических элементов клеток, ставших автономными, хотя не ясно,
какие из этих элементов дали начало столь большому разнообразию генетического
материалу вирусов. Эта гипотеза, которую иронически назвали гипотезой
"взбесившихся генов", находит наибольшее число сторонников, однако не
в том первоначальном виде, в каком она была высказана, так как и она не
объясняет наличие у вирусов форм генетического материала, отсутствующих в
клетках, образование капсида, существование двух форм симметрии и т.п.
Вероятно, вирусы возникали и эволюционировали
вместе с возникновением и эволюцией клеточных форм жизни. Природа как бы
испробовала на вирусах все возможные формы генетического материала прежде чем
окончательно остановила свой выбор на канонической его форме - двуниточной ДНК,
общей для всех клеточных форм организмов, начиная от бактерии и кончая
человеком. Будучи с одной стороны, автономными генетическими структурами, с
другой стороны, неспособными развиваться вне клеток, вирусы на протяжении
миллиардов лет биологической эволюции проделали настолько разнообразные пути
развития, что отдельные их группы не имеют преемственной связи между собой.
По-видимому, разные группы вирусов возникали в исторически разные времена из
разных генетических элементов и поэтому существующие в настоящее время разные
группы вирусов имеют полифилетическое происхождение, т.е. не имеют единого
общего предка. Тем не менее, универсальность генетического кода
распространяется и на вирусы, свидетельствуя тем самым, что и они являются
порождением органического мира земли.
1. Ретровирусы
Ретровирусы - семейство РНК-содержащих вирусов,
заражающих преимущественно позвоночных. Их интенсивно изучали и как вероятную
причину возникновения опухолей человека и животных, и как модель вирусного
канцерогенеза. Геномы всех хорошо изученных ретровирусов клонированы начиная с
1979 г. Для многих из них известны полные нуклеотидные последовательности.
Первые представители этого семейства вирусов были
выявлены по их способности вызывать опухоли у чувствительных животных.
Ретровирусы были первыми из обнаруженных инфекционных онкогенных агентов.
Выделение первого ретровируса описано Эллерманом и Бангом в 1908 г. Этим
датским исследователям удалось перенести одну из форм лейкоза кур от зараженных
к незараженным животным с помощью бесклеточного фильтрата лейкозных клеток.
Однако открытие первого онкогенного вируса не было признано, поскольку в то
время еще не было ясно, является ли лейкоз неопластическим заболеванием. Первым
признанным онкогенным вирусом оказался фильтрующийся агент, выделенный из
спонтанной саркомы кур (RSV). Пейтон Раус получил его в 1911 г. и показал, что
он способен вызывать саркомы у зараженных цеплят.изучен наиболее подробно из всех
ретровирусов; именно для него были сформулированы многие принципы, которые
оказались применимы к остальным ретровирусам.
2. Подсемейства
Ретровирусы широко распространены в природе. Они
найдены у многих позвоночных от птиц до человека. Есть также сведения о
ретровирусах беспозвоночных. Ретровирусы подразделяют на три неравных
подсемейства: онковирусы (от oncos - опухоль), лентивирусы (lente - медленный)
и спумафирусы (spuma - пена).
Спумавирусы исходно обнаружены как инфекционные
загрязнения первичных клеточных культур. Они получили свое название из-за
вызываемой ими характерной "пенной" дегенерации культуры. Спумавирусы
выявлены у разных представителей млекопитающих, включая кошек, коров, приматов
и человека. Они могут вызывать хроническую инфекцию.
Два наиболее изученных лентивируса - вирусы
висны и мэди - представляют собой два близкородственных вируса овец. Они
вызывают прогрессирующие неврологические изменения (висна) и хроническую
пневмонию (мэди) после исключительно продолжительных латентных периодов. Эти
заболевания называют медленной вирусной инфекцией за длительность
инкубационного периода и хронический характер. Также к лентивирусам относят
вирус иммунодефицита человека, на данный момент самый известный и активно
изучаемый.
Онковирусы представляют наиболее многочисленное
подсемейство ретровирусов. Они найдены у всех позвоночных, у которых их искали,
включая человека. Обычно вирусы относящиеся к этому подсемейству делят по их
принадлежности к виду-хозяину и по морфологии вирионов (А,В,С или D-тип).Внутри
этих широких групп классификация идет по спектру хозяев, генетическим
признакам, способу передачи и патогенности.
3. Морфология и морфогенез вирионов
Вирионы разных ретровирусов сходны по
морфологии. Они имеют диаметр 80-130 нм и содержат внутренний электроноплотный
нуклеоид (сердцевина), который окружен наружной оболочкой, представляющей собой
липидсодержащую мембрану. Нуклеоид состоит из рибонуклеопротеина, окруженного
икосаэдрическим белковым капсидом. Между капсидом и оболочкой находится внутренний
белок, покрывающий нуклеоид. Наружная поверхность оболочки несет
гликопротеиновые выросты (шипы с "булавами" на вершине), особенно
выраженные у некоторых ретровирусов. Вирусная оболочка образуется при
почковании вирусов от плазматической мембраны клетки хозяина.

Рис.1. Строение вирионов
ретровирусов (схема), а - онковирусы типов А, В, С, D; б - лентивирусы; в -
спумавирусы.
Например, различают четыре главных
морфологических типа онковирусных частиц - от А до D. Подавляющее большинство
онковирусов (таких как RSV) имеют морфологию C-типа. Формирование вирионов
этого класса заканчивается только после почкования от плазматической мембраны.
Зрелые внеклеточные частицы С-типа имеют диаметр 80-110 нм. Их нуклеокапсид расположен
в центре вириона.
Вирус молочных желез мышей или MMTV - пример
вирусов B-типа. Их внутренняя сердцевина формируется в цитоплазме и заключается
в мембрану при почковании. Зрелые частицы, имеющие 125 нм в диаметре, содержат
асимметрично расположенную электроноплотную сердцевину.
Несколько вирусов приматов отнесены к D-типу.
Подобно тому, как это происходит у вирусов B-типа, их сердцевина формируется в
цитоплазме, хотя по морфологии зрелые вирионы напоминают вирусы С-типа, с
которыми они более близки и генетически.
Частицы А-типа неинфекционны и обнаруживаются
только внутри клеток. Они отличаются отсутствием липидсодержащей оболочки,
поскольку не почкуются от мембраны. Их сердцевина кольцевидная с внутренней
электронно-оптически пустой полостью.
В дополнение к морфологическому сходству вирионы
ретровирусов имеют много общих физических, химических и ферментативных свойств.
Они состоят из 60-70% белка, 30-40% липидов, 2-4% углеводов и 1% РНК; их
плавучая плотность составляет от 1,16 до 1,18 г/мл. Они чрезвычайно
чувствительны к гидрофобным растворителям и повышенной температуре. Помимо
структурных белков, в состав вирионов ретровирусов входит ревертаза.
Вирусный геном состоит из двух идентичных
одноцепочных позитивных молекул РНК, несущих кэп на 5’- и poly(A) на 3’-конце
(как и большинство зрелых клеточных мРНК). Две цепи нековалентно связаны друг с
другом вблизи 5’-концов. Длина каждой из них от 3,5 до 9 kb в зависимости от
вида вируса. Клеточная тРНК, специфичная для конкретного вируса и необходимая
для вирусной репликации, нековалентно связана с 5’-концом вирусной РНК. Наличие
двух одинаковых цепей вирусной РНК в вирионе означает, что у ретровирусов
диплоидный геном. Хотя функциональная роль такой организации генома точно не
известна, не исключено, что образование гетерозиготных частиц при смешанной
инфекции может быть механизмом создания генетического разнообразия за счет
рекомбинации.
4. Генетический состав
ретровирус вирион генетический
репликация
Рестровирусы содержат не более четырех генов
(кодирующих белок доменов). Эти гены подразделяют на гены, необходимые для
репликации вируса, и вирусные онкогены (v-onc), определяющие высокую
онкогенность вируса, но не участвующие в репликации.
Гены репликации.
Для репликации ретровируса нужны всего три гена:
- gag (назван так, поскольку
определяет группоспецифический антиген, group specific antigen), кодирующий
белки сердцивины;
- pol, кодирующий обратную
траскриптазу (polymerase);
- env, кодирующий белки оболочки
(envelope).
Их взаимное расположение в геномах всех
ретровирусов: gag-pol-env (от 5’- к 3’-концу РНК). Вирусный геном содержит
донорный сайт сплайсинга вблизи гена gag и акцепторный - непосредственно перед
геном env. Продукт гена env синтезируется с субгеномной мРНК, представляющей
собой продукт соединения этих сайтов. Продукты генов gag и pol считываются с
мРНК, сходных с полноразмерными вирионными РНК.
Ретровирусные белки называют, исходя из размера,
определяемого по их электрофоретической подвижности в ДСН-содержащем геле, типа
модофикации (фосфорилирование или гликозилирование) и кодирующего их гена.
Например, gag-кодируемый белок с молекулярной массой 30 К называют p30gag.
Все вирионные белки - продукты процессинга полипротеинов-предшественников, в
обозначении которых присутствует приставка Pr.
Подавляющее большинство ретровирусов имеют
полноценные гены gag, pol и env и не несут гена v-onc. Их обозначают как
компетентные по репликации, но дефектные по трансформации (v-onc-,
поскольку они не трансформируют зараженные клеточные культуры). Многие вирусы
утратили один или более из трех своих генов и соответственно дефектны по
репликации. Тем не менее их дефектные РНК-геномы "одеваться"
недефектными белками, кодируемыми близкородственными вирусами. Таким образом,
вирионные белки могут поставляться со стророны. Однако, чтобы дефектный вирус
мог существовать необходимо, чтобы нетранслируемые области возле концов
вирусной РНК оставались не поврежденными, не вовлеченными в какой либо процесс:
они необходимы для синтезы вирусной ДНК, контроля экспрессии РНК и ее эффективной
упаковки.
Гены v-onc.
В связи с особой важностью генов v-onc их наличие или отсутствие в вирусном
геноме используют в качестве критерия при классификации вируса. Почти все
ретровирусы, способные вызывать трансформацию (v-onc-содержащие), дефектны по
репликации. Их траснформирующая активность - ярко выраженный селективный
маркер, поскольку клетки, зараженные v-onc-содержащим вирусом, перерастают
нормальные.
Способные к трансформации, но дефектные по
репликации вирусы всегда выделяются в виде смешанной популяции с полноценными,
способными к репликации ретровирусами. Обычно собственно вирусные
последовательности генома трансформирующего вируса (за исключением онкогена)
происходят из того полноценного вируса, вместе с которым он исходно выделен.
Хотя v-onc теоретически и может становится четвертым геном полноценного
ретровируса, обычно этого не происходит, возможно потому, что образующаяся при
этом геномная РНК слишком велика, чтобы эффективно упаковываться в вирионы.
Большинство трансформирующих вирусов несут по
одному гену v-onc, а некоторые - два. Вообще этот ген может быть локализован в
разных частях генома. Например, онкоген RSV расположен за геном env. Его
продукт транслируется со специальной субгеномной РНК - продукт сплайсинга
полноразмерного транскрипта. При этом используется донорный сайт сплайсинга,
расположенный возле 5’-конца РНК. Наиболее типична структура птичьего вируса
МС29: его онкоген "слит" с геном gag в общую открытую рамку
трансляции. В результате биосинтеза белка образуется "слитный"
продукт, состоящий из N-концевой части, кодируемой геном gag, и
v-onc-кодируемой части.
Следует отметить, что ретровирусы можно
использовать в качестве веторов для переноса селективных генных маркеров. Эту
способность можно использовать в будущем для переноса генов в клетки в
терапевтических целях.
5. Спектр хозяев
Для большинства ретровирусов характерна высокая
специфичность по отношению к клеткам-хозяевам. Спектр хозяев представляет собой
важный признак для классификации вирусов. Известны по крайней мере три
зависящих от хозяина механизма, которые могут препятствовать репликации вируса:
. отсутствие рецепторов на поверхности
клетки, необходимых для прикрепления вируса;
. неспособность вирусного генома
сохраниться в клетке после проникновения и обратной транскрипции;
. невозможность сборки инфекционных
вирионов, несмотря на экспрессию интегрированной провирусной ДНК.
Попадание ретровируса в клетку-хозяина
осуществляется в результате специфического взаимодействия между поверхностным
вирусным гликопротеином и рецептором клеточной поверхности. Ретровирусные
гликопротеины полиморфны, и вирусы, несущие разные гликопротеины, используют
разные клеточные рецепторы. Клетки не имеющие соответствующего рецептора, не
могут быть заражены ретровирусом. Специфическое взаимодействие вирус-клетка
обуславливает чувствительность или устойчивость хозяина к заражению и служит
важным критерием при классификации ретровирусов. Некоторые из них могут
заражать клетки разных видов животных, поскольку используемые ими рецепторы широко
распространены и эволюционно консервативны, в то время как спектр хозяев других
вирусов строго ограничен более редкими клеточными рецепторами.
В соответствии со способностью заражать
определенных хозяев ретровирусы обычно делят на три основные группы:
. экотропные, реплицирующиеся в клетках
вида-хозяина и близкородственных видов;
. ксенотропные, размножающиеся только в
клетках, не принадлежащих к "родительскому виду";
. амфотропные, реплицирующиеся как в
клетках природного хозяина (родительских клетках), так и других видов.
Два вируса с идентичным спектром хозяев могут
теоретически обладать разными env-кодируемыми гликопротеинами и попадать в
клетку, используя разные рецепторы.
Один из видов устойчивости клетки-хозяина к
вирусному заражению проявляется в клетках млекопитающих, зараженных
определенными вирусами птиц (после того как вирус преодолел поверхностный
барьер). Несмотря на то что в этих клетках птичьи вирусы способны осуществить
большинство стадий своего репликативного цикла, включая интеграцию и экспрессию
своих генов, сборки вирионов не происходит. Следовательно, клетки млекопитающих
непермиссивны для вирусов птиц. Вероятно, для правильной сборки вирус нуждается
в неких хозяйских факторах, отсутствующих в клетках млекопитающих.
6. Фазы репликации
Репликативный цикл ретровирусов удобно разделить
на пять фаз:
. ранние события: адсорбция,
проникновение и "раздевание";
. превращение вирусного РНК-генома в
полноразмерную неинтегрированную линейную (свободную) ДНК;
. интеграция вирусной ДНК с хозяйским геномом;
. экспрессия генов интегрированной
вирусной ДНК;
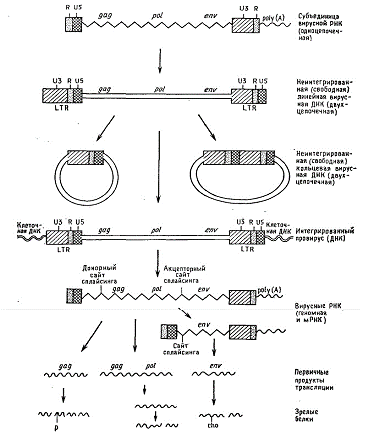
Рис.2. Репликация ретровирусов и
синтез вирусных белков.
По сравнению с другими вирусами, у ретровирусов
есть три необычных свойства репликации. Во-первых, вирус должен превратить свой
РНК-геном в ДНК. Во-вторых, эта ДНК длиннее, чем вирусная РНК. Это удлинение
обусловлено удвоением части последовательности вирусной РНК. Дуплицированные
последовательности образуют длинные концевые повторы (LTR - long terminal
repeat) вирусной ДНК. Удвоенные последовательности расположены на концах
провирусной ДНК. Размер LTR составляет от 0,3 до 1,4 kb в зависимости от вида
вируса. Большинство последовательностей, образующих LTR, представлены в РНК
лишь одной копией и расположены как на 5’-, так и на 3’-конце. Третья необычная
черта ретровирусной репликации - эффективная интеграция свободной ДНК с геномом
клетки в строго определенной ориентации, которая зависит от концевых
последовательностей обоих LTR.
Фаза I: ранние события.
Проникновению вирионов рестровирусов в клетки предшествует специфическое
взаимодействие между поверхностным гликопротеином вируса и рецептором клетки
хозяина. Сведения о способе попадания вириона внутрь клетки противоречивы:
неясно, происходит ли проникновение непосредственно через плазматическую
мембрану или путем эндоцитоза. Часть вирионов деградирует в лизосомах, однако
не известно, ведет ли этот путь к инфекции или гибели вируса. Так или иначе, на
первых этапах заражения вириона переходит в новое состояние, когда он готов
начать синтез вирусной ДНК. В какой степени происходит при этом
"раздевание" вирионов, остается неясным.
Фаза II: синтез неинтегрированной
вирусной ДНК. Главная задача этого этапа инфекции
- превратить одноцепочечный РНК-геном в линейную двухцепочечную вирусную ДНК.
Синтез вирусной ДНК, который идет в цитоплазме и требует по крайней мере
четырех часов, осуществляется обратной транскриптазой (ревертазой). В ходе
этого процесса определенные последовательности, присутствующие в виде
уникальных копий в РНК, должны быть дуплицированы, чтобы образовать LTR на
обоих концах ДНК-продукта. Поэтому главными участниками второй фазы заражения
являются ревертаза, последовательности на концах вирусной РНК и LTR.
Синтез вирусной ДНК начинается в течении первого
часа после заражения с появлением одноцепочечной ДНК, комплементарной вирусной
РНК. Это минус-цепь ДНК, поскольку вирусная РНК служит кодирующей плюс-цепью.
Минус-цепь ДНК - единая и непрерывная молекула, хотя она и синтезируется в три
этапа с трех различных матриц. Синтез минус-цепи ДНК идет справа налево
относительно РНК, поскольку косплементарная цепь имеет противоположную
полярность. Вместо того чтобы начаться у 3’-конца РНК, синтез ДНК начинается с
тРНК-затравки вблизи ее 5’-конца. На первом этапе синтезируется
последовательность, комплементарная фрагментам R и U5, расположенным перед
сайтом связывания тРНК-затравки. Эта последовательность, комплементарная самой
левой части в РНК, окажется затем самой правой в вирусной ДНК. На втором этапе
синтез минус-цепи ДНК продолжается на правом конце одной из двух вирионных РНК
и идет влево через сайт связывания тРНК-затравки (tb) возле левого конца РНК.
На этих двух этапах образуется правый LTR путем соединения последовательностей,
расположенных на левом и правом концах РНК, а также оставшаяся минус-цепь
вирусной ДНК, за исключением левого LTR. На третьем этапе образуется левый LTR
на матрице предварительно синтезированной плюс-цепи правого LTR.
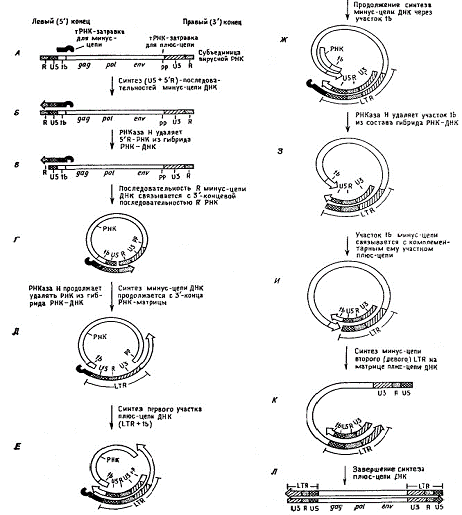
Рис.3. Этапы репликации
ретровирусного генома от РНК до свободной двухцепочечной линейной ДНК.
Фаза III: интеграция вирусной ДНК. По
крайней мере одна копия ДНК оказывается интегрированной с ДНК каждой успешно
зараженной клетки, а большинство клеток, продуцирующих вирус, содержит 4-10
копий провирусов. Внедрившись в клеточный геном, провирус в дальнейшем
реплицируется и передается дочерним клеткам вместе с остальной ДНК. Первые
интегрированные провирусы обнаруживаются через восемь часов после заражения,
большинство же копий вирусной ДНК интегрирует в течении трех дней после
заражения. Зараженная клетка может вновь заражаться тем же вирусом, пока не
приобретет резистентность к заражению в результате образования вирусного
гликопротеина. По крайней мере некоторые из провирусов не в состоянии
обеспечить продукции вируса, поскольку они не транскрибируются или оказываются
повреждены мутациями. Первое вирусное потомство появляется еще до того, как
клетка становится устойчивой к суперинфекции (обычно через 1-2 дня после
заражения). Поэтому многие зараженные клетки могут вновь инфицироваться
вирусами, появившимися в результате первого цикла репликации.
Свободные линейные провирусные ДНК представляют
собой предшественники интегрированных провирусов. Для успешного осуществления
интеграции необходимы концы LTR, поскольку мутанты, утратившие эти
последовательности, не способны к ней. Интеграция требует также неизвестных
клеточных факторов.
Анализ последовательностей клонированных
провирусов, а также сайта их интеграции с хозяйской ДНК позволил установить как
структуру провирусной ДНК, так и те изменения, которые происходят в клеточных
последовательностях, прилегающих к месту интеграции, в ходе инфекции. Вирусная
ДНК интегрирует с сохранением ДНК: LTR-gag-pol-env-LTR. Однако в клеточном
геноме существует много мест, в которые может встроиться провирусной ДНК.
Последовательности, в которые он встраивается, обычно не содержат гомологий с
вирусной ДНК. Более того, у провирусов нет тенденции включаться в уже существующих
в геноме последовательности эндогенных или экзогенных ретровирусов. Эти данные
свидетельствуют о том, что провирус может внедриться в любое место хозяйской
ДНК.
Фаза IV: экспрессия вирусной ДНК.
В хронически инфицированных клетках вирусная РНК считывается с интегрированных
провирусов. Свободная ДНК может экспрессироваться, но для сохранения провируса
необходима его интеграция. В клетках, содержащих несколько провирусов, обычно
бывает трудно разобраться, какой из них транскрибируется. Разные клетки одной
популяции могут существенно различаться по уровню экспрессии вируса.
Провирус является транскрипционной единицей с
собственными регуляторными последовательностями. Однако экспрессия конкретного
провируса зависит как от вирус-специфических, так и от хозяйских факторов, в
частности от места интеграции, физиологического состояния клетки и LTR. В
отличие от многих других вирусов у ретровирусов продукты экспрессии, а
экспрессия провируса зависит только от хозяйских ферментов.
Вирус-специфическая регуляция экспрессии
осуществляется с помощью LTR, несущих промоторов, энхансер транскрипции.
Транскрипция начинается на левом конце последовательности R левого LTR. Как и
большинство эукариотических генов, провирусы транскрибируются с помощью
клеточной РНК-полимеразы II.
В состав LTR входят также элементы, усиливающие
транскрипцию (энхансеры) и работающие независимо от своего положения и
ориентации. Относительная "сила" энхансера варьирует в зависимости от
вида животного или стадии дифференцировки клеток.
Первичным продуктом транскрипции провируса
является полноразмерная молекула РНК. Вирусная РНК обычно составляет от 0,1 до
1% тотакльной клеточной РНК. У полноценных вирусов эта РНК, как и ее
процессированные варианты, выполняют две главные функции: формирует вирионную
РНК и служит мРНК для синтеза продуктов генов gag, pol и env. Около половины
полноразмерной РНК упаковывается в вирионы, остальная служит мРНК. В клетках
обычно содержится несколько больше мРНК для gag, чем для env, причем продукта
гена gag синтезируется примерно в 20 раз больше, чем продукта гена pol. Каждый
из вирусных генов детерминирует синтез полипротеина-предшественника, который
затем разрезается на два зрелых полипептида.
мРНК для продуктов гена env - результат
сплайсинга полноразмерной РНК, из которой удалена большая часть
последовательностей генов gag и pol. Одна из интересных особенностей этой мРНК
состоит в том, что ее акцепторный сайт сплайсинга, а также часть env-кодирующих
последовательностей расположены перед терминирующим кодоном гена pol.
До сих пор не выявлено различий между вирионной
РНК и РНК, которая служит матрицей для синтеза продуктов gag и pol. Тем не
менее времена полужизни различаются, что указывается на различие их путей
метоболизма внутри клетки. Продукт гена pol синтезируется в виде длинного
слитного полипротеина gag-pol. С большинства же молекул полноразмерной мРНК
транслируется лишь продукт гена gag.
Гены v-onc экспрессируются сходно с обычными
вирусными генами, поскольку находятся под тем же вирусным и клеточным
контролем. Большинство генов v-onc являются слитными с генами gag и кодируют
гибридные продукты gag-onc, у которых N-концевая часть кодируется геном gag, а
С-концевая - онкогеном. Последовательности онкогенов в этих слитных генах могут
замещать большую или меньшую часть гена gag и соответственно их экспрессия
контролируется аналогично этому гену.
Фаза V: синтез вирусных белков и
сборка вирионов. После завершения синтеза и
процессинга РНК необходим синтез вирионных белков, которые собираются в
частицы, содержащие вирионную РНК. Оболочка вириона образуется на
плазматической мембране клетки, поскольку вирус освобождается из клетки
почкованием. Сердцевины вирусов С-типа формируются в непосредственной близости
от мембраны, тогда как у ретровирусов В- и D-типов капсиды образуются в
цитоплазме.
Синтез белков и сборка вирионов идут сходным
образом у разных видов ретровирусов, несмотря на то что молекулярные массы
белков, выполняющих одни и те же функции, могут различаться. В качестве примера
возьмем вирус, вызывающий мышиные лимфомы и лейкозы - MuLV. У вирусов этой
группы нарезание полипротеинов-предшественников происходит в основном уже после
сборки вирионов, поскольку свежесобранный вирус несет много неразрезанных
предшественников. Следовательно последовательность белков в полипротеине имеет
значение для их относительного расположения в составе вириона.
Из продуктов гена gag образуются все белки
сердцевины вириона, за исключением ревертазы. Их одни достаточно, чтобы
сформировать вирион, правда, неинфекционный. В случае MuLV белок-предшественник,
кодируемый геном gag, имеет молекулярную массу 65 кДа (Pr65gag). Он
нарезается на 4 белка. Неясно какой фермент осуществляет это нарезание -
клеточная или вирусная протеаза.
Продукты гена pol синтезируются в виде
белка-предшественника - полипротеина Pr180gag-pol. Он участвует в
сборке вирионов.
Продукт гена env Pr90env
гликолизируется и разрезается на два белка - gp70 и p15E - которые остаются
связанными друг с другом дисульфидными мостиками. Вероятно, p15E - это
трансмембранный белок, С-концевая часть которого находится внутри, а N-концевая
- снаружи оболочки вириона. Заметные на электронных фотографиях шипы
представляют собой молекулы p15E, а булавы на их вершине - это gp70.
Гликозилированный белок gp70 детерминирует спектр хозяев и свойства вируса.
Каким образом в состав вириона попадают две молекулы РНК и как формируется
димерная структура вирионной РНК, неизвестно.
7. Канцерогенез
Канцерогенез (от латинского cancerogenesis;
cancer - рак и древнегреческого γένεσις - зарождение, развитие) - сложный патофизиологический процесс
зарождения и развития опухоли (синоним онкогенез).
При онковирусной инфекции происходит не
разрушение клетки, а онкогенная ее трансформация, которая обусловлена
онкогеном. Онкоген имеет клеточное происхождение и захватывается в процессе
интеграции и вырезания ДНК-провируса. Таким образом роль вируса в онкогенезе
заключается в транспорте клеточного онкогена в такие участки генома, где он
выходит из-под контроля клетки. Это ускользание из-под контроля является исходным
моментом для превращения нормальной клетки в опухолевую. Онкоген не только не
требуется для репродукции онковирусов, но часто вирусы, содержащие этот ген,
бывают дефектными и не способными к репродукции. В то же время дефектность по
онкогену лишает онковирусы способности индуцировать опухоли. Онкогены
высококонсервативны: одинаковые последовательности обнаружены у дроздофилы,
птиц и млекопитающих, включая человека.
Различные и даже одни и те же онковирусы могут
содержать разные онкогены. Один и тот же онкоген может вызывать трансформацию
разных тканей и характер опухоли определяется видом ткани.
Теория клеточного происхождения онкогена
объясняет полиэтиологическую природу онкогенеза, возникающего при действии
различных факторов - вирусных, химических , радиационных и других. В основе
онкогенеза лежат одни и те же механизмы: онкоген ® онкобелок ®
трансформация клетки ® туморогенез (образование раковых
клеток). Активирующие факторы вызывают появление или активацию предшествующих в
геноме участков ДНК, которые начинают функционировать как онкогены.
Любая нормальная клетка содержит латентные
раковые гены, получившие название протоонкогены. Существуют две гипотезы,
объясняющие превращение протоонкогена в онкоген, одна из которых основана на
качественных, а другая - на количественных изменениях протоонкогенов. Активация
онкогена может произойти в результате точечной мутации в протоонкогене,
например, при замене гуанозина на тимидин. Модифицированный белок отличается от
исходного лишь одной аминокислотой: в нем глицин заменен валином. Вторая
гипотеза исходит из количественных изменений протоонкогенов. В том случае, если
протоонкоген оказался сопряженным с сильным промотором - участком гена,
связывающим полимеразу - начинается амплификация (усиленная транскрипция) протоонкогена.
Чрезмерная экспрессия протоонкогена включает следующие стадии: амплификация
гена может возникать либо в результате его перемещения либо в результате
встраивания в соседней области сильного промотора. Промоторы могут быть
вирусной природы. При вырезании интегрированного провируса вирусный ген может
захватить протоонкоген и вместе с ним интегрировать в другую область клеточного
генома, где происходит амплификация онкогена благодаря вирусному промотору или
соседнему сильному клеточному промотору. Таким путем протоонкоген переносится
из строго регулируемых областей клеточного генома в другие области.
Изучение процесса канцерогенеза
является ключевым моментом как для понимания природы опухолей, так и для поиска
новых и эффективных методов лечения онкологических заболеваний.
Канцерогенез - сложный многоэтапный
процесс, ведущий к глубокой опухолевой реорганизации нормальных клеток
организма.
Заключение
Ретровирусы оказались удивительным объектом
исследования. Сначала их изучали как модель вирусного канцерогенеза, и это
направление оказалось успешным во многих отношениях. Изучение ретровирусов
позволило глубоко проникнуть в механизм канцерогенеза. Благодаря им был
обнаружен набор эволюционно консервативных генов эукариот (c-onc), вероятно
играющих важную роль в нормальном развитии и дифференцировке. Было установлено,
что в разнообразных спонтанно и экспериментально индуцируемых опухолях
функционирование этих генов изменяется. Поиск ретровирусов человека привел к
открытию по крайней мере одного ретровируса (HTLV - вирус Т-клеточной лейкемии
человека), тесно ассоциированного с определенной неоплазией человека. Помимо
огромного влияния на развитие онкологии изучение репликации и обратной
транскрипции генома ретровирусов, их интеграция с клеточной ДНК и организация
регуляторных элементов (LTR) позволило обнаружить новые биологические механизмы
функционирования эукариотической клетки. В будущем исследования ретровирусов
приведут к новым открытиям в экспериментальной патологии, канцерогенезе
человека и молекулярной биологии.
Список используемой литературы
. Филдс Б., Найп Д.
Вирусология: В 3-х т. Т.1. - М.: Мир, 1989. - 492 с.
. Букринская А.Г.
Вирусология. - М.: Медицина, 1986. - 336с.
. Гловер Д. Новое в
клонировании ДНК. Методы.-М.: Мир, 1989.- 368 с.
. Мейхи Б. Вирусология.
Методы. - М.: Мир, 1988. - 344 с.
. Колешко О.И., Завезенова
Т.В. Микробиология с основами вирусологии. - Иркутск: ИГУ, 1999. - 452с.
. Рудаков Н.В. Краткий курс
лекций по медицинской микробиологии, вирусологии и иммунологии. - Омск: ОГМА,
2002. - 119 с.
. http://ru.wikipedia.org
. http://www.virology.net