Влияние физических факторов на фенотипические свойства микроорганизмов
Влияние
физических факторов на фенотипические свойства микроорганизмов
Курсовая
работа
Содержание
Перечень
сокращений
Введение
Глава 1.
Фенотипические свойства микроорганизмов
Глава 2.
Понятие « биопленка». Структура биопленки
.2 Этапы и механизмы
формирования биопленок и распада на поверхности раздела твердой и жидкой фазы,
их регуляция
.2 Скорость
образование биопленок
.3 Роль
биопленки в выживаемости микроорганизмов в окружающей среде
Глава 3
Влияние электромагнитного излучения на формирование биопленок
Глава 4
Биологическое действие ультрафиолетового излучения на микроорганизмы
Заключение
Литература
Перечень сокращений
АБ - антибаиотики
АБЧ - антибиотикочувствительность
МСПИ - молекулярные спектры излучения и поглощения
УФО - ультрафиолетовое излучение
ЭМИ - электромагнитное излучение
Bdl - biofilmdispertionlocus- extracellular polymeric
substance
Введение
Вплоть до конца прошлого века микробиология развивалась главным образом
на основе исследований чистых культур микроорганизмов,у которых были изучены
фенотипические свойства. В конце ХХ века сформировалось представление об особом
фенотипическом свойстве микрофлоры человека - хорошо организованном
взаимодействующем сообществе микроорганизмов, покрывающих поверхности кишечной
стенки, других слизистых оболочек, кожи и зубов человека. На сегодняшний день
известно, что большинство бактерий существуют в природе не в виде свободно
плавающих клеток, а виде специфически организованных биопленок. Причем сами
бактерии составляют лишь 5-35 % массы биопленки, остальная часть это
межбактериальный матрикс. Бактериальные клетки, находящиеся в биопленке,
подвергаются структурным изменениям, связанным с прикрепленным состоянием,
обладают особенностями функциональной активности, обусловленной коллективным
сосуществованием. В бактериальном сообществе-биопленке появляются клетки,
отличающиеся по морфологии от своих свободно живущих сородичей и имеют
измененные фенотипические свойства. У прикрепленных бактерий наблюдаются замена
поверхностных структур, свойственных планктонным клеткам, другими, нужными для
прикрепления к поверхности. Необходимость особой плотной упаковки клеток в
биопленке сопровождается изменением их формы и ультраструктурной
организации.[1]
Такая форма существования предоставляет бактериям массу преимуществ в
условиях воздействия неблагоприятных факторов внешней среды и
организма-хозяина: повышение устойчивости к антибиотикам (это способствует
хронизации инфекционного процесса), рефрактерности к лечению, повышение
устойчивости к антисептикам и дезинфектантам, что в результате приводит к
увеличению частоты внутрибольничных инфекций, создаются трудности в
микробиологической диагностике инфекционных заболеваний (идентификация
возбудителя и определения его антибиотикочувствительности). Фактором
устойчивости биопленок оказывается слизисто-полимерный слой, вырабатываемый
сразу после адгезии, и включающий липополисахариды, протеогликаны,
гликопротеиды, эндополисахариды, аналогичные веществу клеточной стенки,
гликокаликса и капсул бактерий.
За прошедшее десятилетие была доказана роль биопленок в развитии целого
ряда инфекций человека. По данным Центра по контролю заболеваемости (США) до
65% заболеваний человека может быть связанно с формированием биопленок.
Микроорганизмы образуют биопленки на любых биотическихи абиотических
поверхностях.В течение долгого времени считали, что биопленки образуются на
поверхности изделий медицинского назначения, таких как мочевые катетеры,
эндотрахеальные трубки, ортопедические и грудные имплантаты, контактные линзы,
внутриматочные приспособления и хирургические нити. Из-за устойчивости бактерий
в биопленке очень часто стерилизация не дает эффекта, в результате чего
приходится использовать одноразовые инструменты. С биопленками, образующимися
на поверхности стен, кроватей, полов тесно связана проблема внутрибольничных
инфекций, что создает большие проблемы в медицинской практике.Они являются
основными источниками заболеваний, которые характеризуются глубокими
бактериальными инфекциями и хроническим воспалением, например, заболевания
периодонта, фиброзы мочевого пузыря, хронические акне и остеомиелиты. Биопленки
также обнаруживают в ранах, что способствует замедляют процесс заживления и
неэффективности антибактериальной терапии. В связи с этим считают, что
биопленки являются основным фактором, способствующим возрастанию числа
хронических воспалительных заболеваний.
Наиболее важной отличительной особенностью бактерий, находящихся в
составе сообществ, является то, что бактерии внутри биопленки способны
размножаться и вновь диссеминировать после завершения курса лечения, приводя к
формированию хронических процессов и рецидивов заболевания.
В данной работе проанализированны физические методы влияния на
фенотипические свойства микроорганизмов [2].
Глава 1 Фенотипические свойства микроорганизмов.
Фенотип микроорганизмов - совокупность всех признаков и свойств,
проявляемых данной культурой. У микроорганизмов изучаются признаки и свойства в
целом всей культуры (штамма).
К фенотипическим свойствам микроорганизмов относится:
1. Биохимические свойства( способность выработки ферментов, которые
участвуют в расщеплении белков, углеводов, вызывающие восстановление или
окисление различных субстратов)
2. Тинкториальные свойства ( свойство бактерий вступать в реакцию с
красителями и окрашиваться определенным способом)
. Образование колоний на плотных питательных средах
. Морфологические свойства (окраска, размер, форма отдельно
растущих колоний)
. Чувствительность к дезинфектантам, антисептикам и
антибактериальным препаратам
. Образование биопленок
В результате влияния различных внешних факторов внешней среды
обуславливает изменение в фенотипе бактерий. К таким факторам относятся:
· Антисептики и дезинфектанты сложного состава (для обработки поверхностей,
медицинского инструментария, перевязочного материала, участков тела пациентов,
операционного поля;
· Антибактериальная терапия ( комбинированная, широкого спектра
действия, массивная терапия, парентеральная)
· Современные физические методы лечения (лазотерапия, УЗ , отрицательное
давление, УФО, токи высокой и низкой частоты, ЭМИ)
В результате микроорганизмы начинают приспосабливаться как во внешней
среде, так и в макроорганизме, меняя свои фенотипические свойства, которые
способствуют повышению их выживаемости, увеличение устойчивости к антибиотикам,
а также влияет на постановку бактериологического диагноза и определения тактики
АБ терапии.
Изменение фенотипических свойств:
1. Повышение устойчивости к антибиотикам ( что способствует хронизации
инфекционного процесса, рефрактерности к лечению)
2. Повышение устойчивости к антисептикам и дезинфектантам, что в
результате приводит к увеличению частоты внутрибольничных инфекций
. Создаются трудности в микробиологической диагностике
инфекционных заболеваний( идентификация возбудителя и определения его антибиотикочувствительности)
Важнейшим фенотипическим свойством бактерий, которое обеспечивает в
современных условиях выживаемость бактерий во внешней среде, а также в
организме пациентапри существовании инфекционного процесса является биопленка.
Глава 2 Понятие « биопленка». Структура, морфотипы биопленок
Многие бактерии и грибы способны эффективно колонизировать поверхность
кожи и слизистых. Понимание того, в какой форме там существуют микроорганизмы,
принципиально влияет на эффективность профилактики и лечения заболеваний, а
также условия сохранения нормальной микрофлоры. Установлено, что в организме
человека все бактерии и одноклеточные грибы приразмножении образуют сообщества
различной сложности, получившие название «биопленки».
Биопленки - это подвижные, непрерывно изменяющиеся гетерогенные
сообщества. Они могут состоять из одного вида бактерий или грибов или, что
встречается более часто, могут быть полимикробными, например, содержать
многочисленные разнообразные виды микроорганизмов.[1]Биопленки формируются на
поверхности раздела фаз, на которых развиваются микробные сообщества: жидкость
(водная среда) - твердая поверхность, жидкость - воздух, две несмешиваемые
жидкости и твердая поверхность - воздух. В настоящее время детально исследованы
толькобиопленки, развивающиеся на границе жидкой и твердой сред. Они имеют
следующие морфотипы:
просто слой клеток, сформированный одним или несколькими видами
микроорганизмов, без выраженной морфологической дифференциации (выделяют только
внутреннюю и наружную части) - самый примитивный тип биопленок. Такие пленки
описаны для бактерий родов Citrobacter, а также дефектных по ауторегуляции Pseudomonasaeruginosa;
маты фотосинтезирующих, метаногенных и сульфатредуцирующих бактериальных
сообществ;
зубные пленки (бляшки), образованные сложным сообществом многих
микроорганизмов. Этот тип пленок является одним из наиболее изученных. Для него
описана строгая последовательность колонизации разными микроорганизмами, типы и
механизмы взаимодействия организмов;
пленка с лентами - выростами, формированные одним или несколькими видами
микроорганизмов со специфической трех мерной структурой, особыми функционально
- морфологическими образованиями (порами, каналами, пустотами, ножками). В
образовании таких дифференцированных биопленок у P. aeruginosa важную
роль играют гены, ответственные за синтез рамнолипидов.[6];
бентосные и речные осадки, а также взвешенные в воде хлопья и различные
типы обрастаний;
.2 Этапы и механизмы формирования биопленок и распада на поверхности
раздела твердой и жидкой фазы, их регуляция
Погруженная в воду твердая поверхность немедленно покрывается так
называемой первичной пленкой (conditioningfilm), изменяющей свойства этой поверхности . Формирование такого
слоя молекул является первой стадией, предшествующей образованию собственно
бактериальной пленки. Например, образование зубных бляшек протекает полноценно
только на поверхности зубов в присутствии слюны. Белки слюны образуют слой на
поверхности, к которому прикрепляются первые бактерии-колонизаторы.
Затем следует этап собственно микробной адгезии, обратимая адгезия, когда
микроорганизмы обратимо прикрепляются к твердой поверхности. На этом этапе
действуют неспецифические физико-химические силы взаимодействия между
молекулами и структурами на поверхностях микроорганизма и твердого субстрата(
гидрофобные, электростатические, дисперсионные силы Лондона). К такому типу
адгезии способны как живые, так и убитые клетки микроорганизмов. Например,
убитые УФ-излучениемгамма - лучами или нагреванием P.fluorescens не теряют
своей способности к адгезии.
Следующая стадия необратимой адгезии наступает, когда клетка необратимо
связывается с поверхностью. Эта фаза , в свою очередь состоит из нескольких
самостоятельны этапов формирования биопленки. В течении некоторого времени
после прикрепления к поверхности клетки могут перемещать вдоль поерхности
посредством жгутиков и пилей IV
типа. Затем клетки теряют подвижность, некоторые из них слипаются друг с
другом, начинают выделять внеклеточные полимеры (полисахариды, липополисахариды,
гликопротеины, формируя внеклеточный полимерный матрикс (ВПМ). В результате
деления клеток возникает компактные микроколонии, объединенные этим матриксом.
Затем наступает пора вторичных колонизаторов, т.е. микроорганизмов,
которые прикрепляются к клеткам, локализованные на поверхности. Например, при
формировании зубной бляшки первичным колонизатором являются стрептококки, к
которым прикрепляются фузобактерии и затем уже другие бактерии, всего несколько
сот видов. Одновременно с увеличением толщины биопленки формируется ее
специфические структуры - полости ,каналы, выросты, поры. Эта стадия нарастания
зрелой биопленки в благоприятных условиях продолжается достаточно долго, а в
неблагоприятных условиях, вступает в последнюю фазу - распада, деградации, гибели
части клеток и высвобождения остальной части клеток в виде свободноплавающих(
планктонных), что было показано для P. aeruginosa, S. marscescens, Vibriocholeraи Pseudoalteromonastunicate.[7]
На процесс формирования биопленок и их свойства влияют факторы окружающей
среды и свойства клеток самого микроорганизма. Наиболее важными внешними
факторами являются величина рН, солености, осмолярности, парциальное давление
кислорода, доступность источников питания, а также гидрофобность поверхности
раздела фаз.
Основным фактором, влияющим на перемещение к поверхности раздела фаз как
подвижных, так и неспособных к движению микроорганизмов, является течение
жидкости. Адгезия бактерий к твердым поверхностям происходит как в условиях
турбулетного потока жидкости, так и при относительной неподвижности водной
фазы. Вблизи твердой поверхности существует зона малоподвижной воды («вязкий
слой»). Наряду с этим на перемещение микроорганизмов влияют капиллярные
(дренажные) силы, обусловленные давлением жидкости, протекающей между
поверхностью твердой фазы и поверхностью бактерии. Седиментация может играть
значительную роль только в слабопроточных системах с частицами значительных
размеров, таких как крупные бактерии или агрегаты из бактерий. Определенную
роль играет и собственная двигательная активность микроорганизмов, поскольку
подвижные клетки активно перемещаются по направлению к поверхности и
окончательно удерживаются притягивающими силами, действующими вблизи
поверхности. Положительным образом на адгезию и последующее формирование
биопленки влияют факторы, которые для микроорганизмов являются стрессовыми
(изменение рН, температуры, гидрофобности).[8]
В процессе формирования биопленок вовлекается ряд биохимических и
генетических механизмов. Специфическим генетическим механизмом можно считать
наличие генов, реагирующих на прикрепление и активных только в биопленках.
Несколько генов реагируют на обратимое прикрепление, в то время как необратимое
прикрепление вызывает изменение уже нескольких десятков генов. У Bacillussubtilisобразование биопленки регулируется по
типу катаболитной репрессии глюкозой. Наличие специфических регуляторных систем
биопленкообразования было показано для E. coli,
стафилококков, стрептококков.
Ряд авторов отмечают важность наличия поверхностных структур - жгутиков и
пилей IV типа, а также специфических «липких
молекул» - лектинов и адгезинов[5]. Адгезины считаются более специфическими
молекулами, обеспечивающие узнавание поверхности, к которой происходит
прикрепление, а также само прекрепление за счет гидрофобных, водородных, ионных
и ковалентных связей. Эти молекулы, естественно, локализуются на поверхностных
структурах микроорганизмов.
Процесс адгезии регулируется также путем образования антиадгезинов,
специфических внеклеточных метаболитов, предотвращающие обратимую адгезию.
Антиадгезина используются как для регуляции адгезии самого организма -
продуцента, так и для борьбы с конкурентами, не допуская их внедрения в уже
сформировавшуюся биопленку.
Межклеточная коммуникация посредством ауторегуляторов чрезвычайно важна
для развития и функционирования биопленок. Известен ряд прмеров, когда при
истощении источника питания в среде бактерии биопленки выделяют гидролитические
ферменты, позволяющие им использовать полимеры матрикса как источники питания и
одновременно высвобождающие их в виде планктонных клеток, способных найти более
благоприятные для размножения условия. Показано, что выделение сурфактанта
рамнолипида P. aeruginosa необходимо для предотвращения
плотного прикрепления вновь образованных бактерий внутри биопленки и их
удалениея из нее, и таким образом, формирования и поддержания полостей в
биопленках рис. 1.

Рис. 1 . Стадии формирования биопленки
.3 Скорость образование биопленок
Экспериментальные лабораторные исследования показали, что планктонные
бактерии, например стафилококки, стрептококки, псевдомонады, кишечная палочка
обычно:
). присоединяются друг к другу в течение нескольких минут;
). вырабатывают внеклеточные полисахариды и становятся значительно более
толерантными к биоцидам, например,к антибиотикам, антисептикам и
дезинфектантам, в течение 6-12 часов;
). вовлекаются в полноценные колонии биопленки, которые очень устойчивы к
биоцидам и теряют планктонные бактерии в течение 2-4 дней в зависимости от
видов бактерий и условий роста;
). быстро восстанавливаются после механического разрушения и вновь
формируют зрелую биопленку в течение 24 часов.
Эти факты позволяют предположить, что проведение нескольких
последовательных очищений раны может дать небольшой промежуток времени,
например, менее 24 часов, в течение которого антимикробное лечение наиболее
эффективно в отношении как планктонных микроорганизмов, так и
внутрибиопленочных клеток возбудителя в ране.
Только относительно недавно биопленки стали рассматривать как фактор,
препятствующий процессу лечения кожных ран. Как показали стандартные
микробиологические лабораторные испытания, хронические кожные ранычасто не
сопровождаются выраженными симптомами инфекции и имеют низкую бактериальную
обсемененность. Однако стандартные микробиологические тесты оптимизированы для
выращивания планктонных бактерий и адекватно неопределяют бактерии биопленок,
поэтому требуются специальные технологии для инкубации.
Биопленки - это микроскопические структуры. Однако в некоторых ситуациях,
когда им дают возможность расти беспрепятственно в течение продолжительного
периода времени, они становятся настолько плотными, что их можно увидеть
невооруженным глазом. Например, зубной налет может накапливаться и становиться
четко видимым в течение дня. Некоторые бактерии из фенотипа продуцируют
пигменты, что можетспособствовать визуальной детекции всей биопленки. Например,
P. аeruginosa, находясь в фенотипе биопленки, продуцирует молекулярный
пиоцианин зеленого цвета. Но даже в этом случае зеленое окрашивание раны не
всегда свидетельствует о присутствии биопленки, сформированной Pseudomonas sp.
Между биопленками и раневым струпом может существовать связь.Раневой
струп описан как густой желтый, относительно темный слой раневого ложа, тогда
как биопленки, обнаруженные в ранах, выглядят более гелеобразными и светлыми.
Биопленки стимулируют воспаление, которое увеличивает проницаемость сосудов,
образование раневого экссудата и формирование фибринового струпа. Таким
образом, наличие струпа может указывать на присутствие в ране биопленки. Однако
такая связь между струпом и биопленкой в хронических ранах должна быть еще
изучена более
тщательно. В настоящее время наиболее надежным методом подтверждения
наличия микробной биопленки является специальная микроскопия, например,
конфокальное лазерное сканирующее.[1,2]
.4 Роль биопленки в выживаемости микроорганизмов в окружающей среде
Биопленки существенно повышают толерантность микроорганизмов, внедренных
в ее матрикс, к иммунной системе хозяина, антимикробным агентам и стрессам
окружающей среды (например, ограничения в кислороде и питании). Эта
толерантность может способствовать полной резистентности к факторам, которые
могли бы легко уничтожить этих же самых микробов в случае их роста в
незащищенном, планктонном состоянии.
Блокировка.Один простой путь, в результате которого внеклеточный
полисахаридный матрикс защищает микробов, - предотвращение глубокого
проникновения в матрикс биопленки крупных молекул (например, антител) и клеток,
вызывающих воспаление. Зрелая биопленка может также служить диффузным барьером
даже для таких маленьких молекул, как антимикробные агенты.
Взаимная защита.Другое уникальное свойство полимикробных биопленок -
совокупныезащитные свойства, которые бактерии различных видов могут передавать
между собой.Например, антибиотикоустойчивые бактерии способны выделять защитные
энзимы или антибиотикосвязывающие протеины, которые могут защищать соседние
антибиотикочувствительные бактерии в биопленке. Также они могут передавать
другим бактериям гены, отвечающие за антибиотикорезистентность, даже между
различными видами бактерий. В исследованиях также показано, что специфические
характеристики EPS биопленок, присущие одному виду бактерий, могут играть
существенную роль в способности других видов присоединяться и внедряться в
существующую биопленку.
Бездействие (неподвижные бактерии).Другая стратегия выживания,
выработанная многими бактериями в биопленках, - это образование метаболически
неподвижных (неактивных) субпопуляций. Для того, чтобы антибиотик подействовал
на бактерии, последние должны быть метаболически активными, поэтому неактивные
бактерии в биопленках не подвергаются действию антибиотиков, уничтожающих
обычно активные
бактерии. В исследованиях показано, что наиболее низкие концентрации,
требуемые для уничтожения или удаления бактериальной биопленки, для большинства
антибиотиков фактически превышают максимальные прописываемые врачами дозы.
Таким образом, стандартные пероральные дозировки для тех антибиотиков, которые
эффективно уничтожают обычно чувствительные планктоно-выращиваемые в
клинической лаборатории бактерии, могут иметь слабое антимикробное действие или
могут быть вовсе неэффективными в отношении того же типа бактерий в биопленках,
выделенных из ран пациентов. Бактерии и грибы в биопленках выживают в
присутствии антибиотиков в количествах в 500-1000 раз больших, чем их
минимальная подавляющая концентрация invitro.
Во время освобождения поверхности раны от биопленки последняя стимулирует
хронический воспалительный ответ. Такая реакция приводит к появлению большого
количества нейтрофилов и макрофагов, окружающих биопленку. Эти воспалительные
клетки образуют большое количество реактивных окислителей и протеаз (металлопротеиназы
матрикса иэластазы). Протеазы способствуют нарушению присоединения биопленки к
тканям, удаляя ее из раны. Однако эти реактивные окислители и протеазы также
разрушают здоровые и заживающие ткани, протеины и иммунные клетки, что ухудшает
качество лечения. Хронический воспалительный ответ не всегда приводит к
успешному удалению биопленки, и была выдвинута гипотеза о том, что подобный
ответ «выгоден» биопленке. Индуцируя неэффективный воспалительный ответ,
биопленка предохраняет образующие ее микроорганизмы и усиливает выработку
экссудата, который, в свою очередь, является источником питания и средством
сохранения биопленки.
Неизвестно, существуют ли условия, способствующие образованию биопленки в
ране. Тем не менее, основные условия, ослабляющие иммунную систему или
снижающие действия антибиотиков, могут способствовать развитию биопленки вранах
(например, ишемия тканей или некрозы, плохое питание).
Биопленка может восстанавливаться в ране с помощью:
). роста фрагментов, оставшихся после очистки/иссечения;
). размножения планктонных бактерий, высвободившихся из оставшейся
биопленки;
). роста биопленки из вновь внесенных микроорганизмов[2].
Глава 3. Влияние электромагнитного излучения на формирование биопленок
Важность исследований биологического действия электромагнитного излучения
в настоящее время ни у кого не вызывает сомнений. С каждым годом растет число
публикаций в этом научном направлении, и появляются все новые и новые идеи
использования электромагнитного излучения в медицинских и биотехнологических
приложениях.
Одним из актуальных направлений современной электромагнитобиологии
является исследование физико-химических механизмов действия электромагнитного
излучения на биологические системы различного уровня организации. Некоторые
электромагнитные излучения (ЭМИ) хорошо известны и давно используются,
например, ультравысокочастотное (УВЧ), сверхвысокочастотное (СВЧ), инфракрасное
(ИК) и ультрафиолетовое (УФ) излучения. ЭМИ других частотных диапазонов,
например, крайне высоких частот (ЭМИ КВЧ), исследуются и применяются
сравнительно недавно.
Менее всего оказался изучен в этом плане терагерцовый диапазон. Освоение
так называемой «терагерцовой щели» в спектре электромагнитных волн,
расположенной между инфракрасным и микроволновым диапазонами, привлекает к себе
большое внимание исследователей, что связано с перспективами широкого
применения терагерцового излучения в фундаментальных и прикладных
исследованиях.[11]
Терагерцовый диапазон частот интересен, прежде всего тем, что именно в
нем находятся молекулярные спектры излучения и поглощения (МСПИ) различных
клеточных метаболитов (NO, CO, активные формы кислорода и др.).
Одной из проблем в освоении терагерцового диапазона является создание
достаточно интенсивных и компактных источников когерентного излучения в этом
диапазоне. Создание генераторов, работающих на частоте спектров поглощения и
излучения биологически активных молекул, открывает новые перспективы в
практическом использовании электромагнитных волн. Изучение биологических
эффектов ТГЧ-излучения представляет значительный интерес как для теоретической,
так и для практической медицины. Наибольший интерес вызывает электромагнитное
излучение на частотах МСПИ оксида азота и атмосферного кислорода.
Открытие и изучение биопленок является одним из наиболее важных
достижений медицинской и клинической микробиологии последних 20 лет. Все
представители нормальной микрофлоры в организме человека существуют в составе
биопленок. С их образования также начинается развитие любой инфекции [9].
Существование бактерий внутри биопленок обеспечивает им много преимуществ
по сравнению с изолированными клетками. Для практической медицины особенно
важно, что бактерии в биопленках обладают повышенной выживаемостью в
присутствии агрессивных веществ, факторов иммунной защиты и антибиотиков.
Бактерии и грибы в биопленках выживают в присутствии антибиотиков в количествах
в 500-1000 раз больших, чем их минимальная подавляющая концентрация invitro
[11].
В настоящее время идет интенсивное изучение причин такой удивительной
устойчивости бактерий к антибиотикам в биопленках. Установлено, что в основе
повышенной выживаемости лежат свойства клеток и внеклеточного матрикса.
Устойчивость, обусловленную свойствами клеток биопленок, связывают с
уменьшением их свободной поверхности за счет контактов друг с другом и
формированием в популяции особых клеток, получивших название «персистеры».
Персистеры находятся в состоянии полной устойчивости практически ко всем
препаратам.
В последнее время установлено, что более чем в 80 % случаев инфекционные
поражения организма проходят в форме биопленочной инфекции.
Экспериментально показано, что начальные элементы биопленки могут
сформироваться в течение двух часов инкубации, достигая максимальной
интенсивности уже через 24 часа. На данный момент с образованием биопленки
связывают особенности течения инфекционного процесса при
вентиляторассоциированной пневмонии, ангиогенном сепсисе, уроинфекциях,
инфекционном эндокардите, муковисцидозе, хроническом бактериальном простатите,
периодонтите, остром среднем отите. Среди возбудителей, образующих биопленки,
наибольшее клиническое значение имеют P.aeruginosa, S.aureus, K.pneumoniae,
Coagulasae - negativestaphylococcus(CNS), Enterococcusspp., Candidaspp.
Данные по влиянию ЭМИ на частотах МСПИ O2 и МСПИ NO на интенсивность образования
биопленок P.aeruginosa приведены на рисунках 2 и 3.
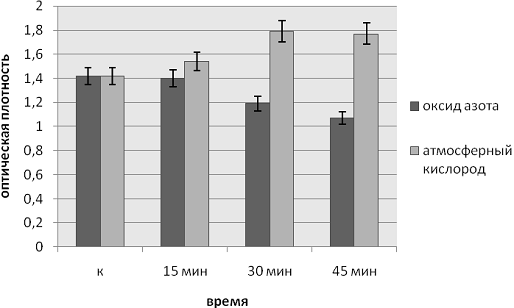
Рис.2. Влияние ЭМИ на частоте МСПИ на образование биопленок Pseudomonas
aeruginosa при облучении через 12 часов

Рис.3. Влияние ЭМИ на частоте МСПИ на образование биопленок Pseudomonas
aeruginosa при облучении через 24 часа
Облучение культуры P. aeruginosaв течение 15, 30 и 45 минут ЭМИ на частоте
МСПИ O2 на 12 и 24 часу с момента внесения инокулята влияет на формирование
биопленок. Процесс образования биопленок происходит более интенсивно при 30 и
45 минутах экспозиции.
При воздействии ЭМИ на частоте МСПИ NO на культуруP. aeruginosa в течение 15 и 30 минут
через 12 часов с момента внесения инокулята образование биопленок, напротив,
уменьшалось при 30 и 45 минутах воздействия электромагнитным излучением ЭМИ на
частоте МСПИ NO.
При облучении ЭМИ на частоте МСПИ NO синегнойной палочки через 24 часа с
момента внесения инокулята интенсивность пленкообразования уменьшилась при 30 и
45 минутной экспозиции по сравнению с необлученной культурой и культурой,
подвергнутой облучению на 12 часах с момента внесения инокулята, 15 минутное
воздействии электромагнитным излучением не влияло на процесс пленкообразования.
Облучение культуры бактерий P. aeruginosa ЭМИ на частоте МСПИ NO влияет
на процесс пленкообразования - происходит снижение пленкообразования и переход
в планктонный рост. Это согласуется с работами, в которых показано, что
сигналом для перехода от биопленки к планктонной форме является генерация
оксида азота(II) - NO. Это вещество в сублетальных концентрациях индуцирует
дисперсию биопленок. Штаммы, потерявшие способность к генерации NO в результате
потери активности нитритредуктазы, гораздо хуже диспергируются в анаэробных условиях.
И, напротив, штаммы, дефектные по NO синтазе отличаются повышенной склонностью
к планктонному существованию. Ключевую роль в нем играет регуляторный белок
BdlA (Bdl - biofilm dispertion locus).
И, напротив, облучение культурыбактерий P.aeruginosa ЭМИ на частоте МСПИ
O2 повышает их способность к пленкообразованию.Можно предположить, что
облучение ЭМИ на частоте поглощения и излучения атмосферного кислорода
активизирует не только и не столько кислород, содержащийся в питательной среде,
но главное, повышает реакционную способность не только кислорода,
диффундируемого в биомассу, но и внутриклеточного кислорода за счет образования
его реактивных форм.
Таким образом, облучение культуры P. aeruginosa ЭМИ на частоте МСПИ O2
повышает способность микроорганизмовк пленкообразованию, в то время как
облучение культуры ЭМИ на частоте МСПИ NO снижает способность к
пленкообразованию.
биопленка
микроорганизм ультрафиолетовый
Глава 4. Биологическое действие ультрафиолетового излучения на
микроорганизмы
Молекулярные механизмы биологического действия УФ-излучения могут быть
разделены на три основные группы: изменение структуры и функции ДНК,
фотоинактивация белков и повреждение биомембран. Эти процессы лежат в основе
всех фотопроцессов, развивающихся на уровне клетки и организма.
Решающее значение в биологическом действии УФ-излучения имеет его
поглощение нуклеиновыми кислотами в области 240-290 нм. Основной механизм
реализуется за счет фотолиза двойной связи ДНК, в результате чего возникают
одно- и двунитевые разрывы в молекуле ДНК.
При воздействии УФ-излучения на белкипроисходит их деструкция
аминокислотных остатков, которые входят в активный центр белка и влияют на их
конформацию.Это в свою очередь приводить к потере функциональной активности
данного белка.
Биологическое действие УФ - излучения заключается в повреждении
биомемран. Фотоповреждения белков и фосфолипидов, входящих в их состав,
взаимосвязаны и нередко усиливают друг друга. Фотоокисление липидов
представляет собой двухэтапный процесс. На первом этапе липиды под действием
ультрафиолета окисляются по свободно радикальному механизму с образованием
гидроперекисей. На второй стадии при поглощении второго кванта УФ-излучения
перекиси расщепляются с образованием стабильных продуктов, и прежде всего
альдегидов. Присутствующие в мембранах жирорастворимые антиоксиданты, такие как
токоферолы, ингибируют окисление, но сами при этом подвергаются фотодеструкции.
Повреждение фосфолипидов биомембран будет усиливать инактивацию мембранных
белков-ферментов, вызванную действием УФ-излучения, приводить к разобщению
окисления и фосфорилирования и следовательно, подавлять синтез АТФ, повышать
проницаемость мембран для различных низкомолекулярных соединений, ионов и т.д..
Находящиеся в мембранах витамины, антиоксиданты и другие биологически активные
вещества также окисляются под действием ультрафиолета и теряют свою активность.
Возникновение при воздействии УФ-излучения молекулярных повреждений ДНК,
фотодеструкция белков и биологических мембран обуславливает развитие
многочисленных биологических эффектов, которые приводят к летальному эффекту. В
механизме летального эффекта главную роль играет образование пиримидиновых
димеров в молекулах нуклеиновых кислот. Образование димеров в ДНК ведет к
гибели клетки вследствие:
. возникновения летальной мутации
. потери, хотя бы одной из молекул ДНК, способности к репликации за счет
нерепарированных сшивок ДНК - ДНК или ДНК - белок
. нарушения процесса транскрипции.
У бактерий воздействие полного спектра УФ-излучения (200 - 400 нм)
вызывает изменение темпа деления клеток и их гибель. Однако в этом процессе
наблюдается несколько фаз. Непосредственно после облучения скорость деления
уменьшается и часть клеток гибнет. Выжившие клетки повторно делятся, но потом
частота митозов вновь падает и часть клеток погибает. Лишь через 2-4 недели
наступает окончательное выздоровление или гибель. УФ-излучение области С,
соответствующее максимуму поглощения нуклеиновыми кислотами, вызывает
отсроченную гибель простейших, подверженную фотореактивации и, следовательно,
обусловленную образованием димеров. Длинноволновое УФ-излучение вызывает только
раннюю, до наступления первого митоза гибель клеток или раннюю задержку их
деления. Эти повреждения не устраняются системой фотореактивации и связаны
очевидно с денатурацией и фотолизом мембранных и цитоплазматических белков,
т.е. с изменениями паранекротического типа, индуцируемыми УФ-излучением.
Заключение
Под влиянием различных факторов внешней среды на фенотипические свойства
микроорганизмов, происходит их фенотипическая модификация. В результате
микроорганизмы начинают приспосабливаться как во внешней среде, так и в
макроорганизме, меняя свои фенотипические свойства, которые способствуют
повышению их выживаемости, увеличение устойчивости к антибиотикам, а также влияет
на постановку бактериологического диагноза и определения тактики АБ
терапии.Изменение фенотипических свойств способствует: повышению устойчивости к
антибиотикам, что в конечном итоге приводит к хронизации инфекционного процесса
и рефраткерности к лечению, повышению устойчивости к антисептикам и
дезинфектантам, что в результате приводит к увеличению частоты внутрибольничных
инфекций, создаются трудности в микробиологической диагностике инфекционных
заболеваний (идентификация возбудителя и определения его антибиотикочувствительности).
Важнейшим фенотипическим свойством бактерий, которое обеспечивает в
современных условиях выживаемость бактерий во внешней среде, а также в
организме пациента при существовании инфекционного процесса является
биопленка.Из-за наличия синтезируемого экзополисахаридного матрикса, бактерии
защищены биопленкой от иммунной системы (формируется неэффективный иммунный
ответ), действия антибактериальных препаратов, внешних воздействий, так как
полисахаридный матрикс представляет собой барьер для клеток воспаления и
антибиотиков. Необходимо отметить, что бактерии в биопленке имеют низкую
метаболическую активность, что также делает их устойчивыми к лечению. В
биопленке у микроорганизмов повышена устойчивость к антибиотикам, антисептикам,
дезинфектантам, что создает трудности в лечении и увеличивает частоту
возникновения внутрибольничных инфекций.
В связи с этим в современных условиях изучается влияние ряда физических
факторов воздействия, которые используются в лечении инфекционных патологий. У
пациентов с хроническими ранами показано, что ультразвуковая обработка
повреждает сформировавшуюся биопленку за счет очищения раны от
девитализированных тканей, дополнительно обеспечивая деконтаминацию.
Использование в процессе лечения низкодозированного отрицательного давления
приводит к удалению экссудата, что препятствует адгезии микроорганизмов, снижая
тем самым реконтаминацию раны, воздействуя на ранние этапы формирования
биопленки. В результате создается препятствие образованию биопленки. Кроме того,
неэффективный иммунный ответ, характерный для хронической раны, активизируется,
стимулируются репарационные процессы и развитие грануляционной ткани, что
способствует заживлению. Разрушение биопленки также способствует увеличению
чувствительности бактерий к антибиотикам.
В виду того, что в современной медицинской практике используется большое
количество средств, которые влияют на фенотипические свойства микроорганизмов,
является важным установление бактериологического диагноза инфекционной
патологии и определение тактики антибактериальной терапии. Важнейшим является
комплексная оценка фенотипических свойств, которые помогут идентифицировать
микроорганизм.
Литература
1. Смирнова
А.Т., Диденко Л.В., Романова Ю.М., Азизбекян Р.Р. Структурно - функциональная
характеристика бактериальных биопленок. Микробиология, том 79, 2010, №4 - с 435
- 446.
2. Мальцев
С.В., Мансурова Г.Ш. Что такое биопленка? Журнал « Практическая медицина.
Педиатрия» 2011(05)
. А.Г.
Афиногенова, Е.Н. Даровская. Микробные биопленки ран: состояние вопроса. Журнал
травматология и ортопедия для практических врачей 2011 - 3 (61)
4. Стернин
Ю.И., Тец В.В., Кнорринг. Современный взгдяд на оптимизацию антибактериальной
терапии. Журнал « Практическая медицина» 2010 (01)
. Ильина
Т.С., Романова Ю.М., Гинцбург А.Л. Биопленки как способ существования бактерий
в окружающей среде и организме хозяина: феномен, генетический контроль и
система регуляции их развития. Генетика. 2004. Т 40 С.- 1445- 1456.
6. Klausen
M., Aaes-Jorgensen A., Molin S., Tolker-Nielsen T.Involvement of bacterial
migration in the development of complex multicellular structures
inaeruginosabiofilms // Mol. Microbiol. 2003. V. 50. P. 61-68.
. Marshall
K.C. Mechanisms of bacterial adhesion at solid−water interfaces //
Bacterial adhesion (mechanisms and physiological significance) / Eds. Savage
D.C.,Fletcher M. NY- L: Plenum Press, 1985. P. 133-155.
8. Николаев
Ю.А., Плакунов В. К. Биопленка - «город микроорганизмов» или аналог
многоклеточного организма? Микробиология 2007. том 76. №2, с. 149-163
9. Тец
В.В. Бактериальные сообщества. // Клеточные сообщества / под ред. В.Теца.СПб.:
Изд-во СПбГМУ,1998.С. 15-73.
. Пронина
Е.А., Швиденко И.Г., Шуб Г.М.Формирование бактериальных биопленок под
воздействием электромагнитного излучения. Научный журнал « Фундаментальные
исследования» 2010, № 10 - стр. 40 - 45
11. Адрианов
Н.В. Биологическое действие ультрафиолетового излучения. «Электронная медицина»
2007