Использование ДНК-анализа в системе противолейкозных оздоровительных мероприятий у крупного рогатого скота
Федеральное агентство по образованию
Государственное образовательное
учреждение
Высшего профессионального образования
"КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ
УНИВЕРСИТЕТ"
Кафедра биохимии и физиологии
ДИПЛОМНАЯ РАБОТА
ИСПОЛЬЗОВАНИЕ ДНК-АНАЛИЗА В СИСТЕМЕ
ПРОТИВОЛЕЙКОЗНЫХ ОЗДОРОВИТЕЛЬНЫХ МЕРОПРИЯТИЙ У КРУПНОГО РОГАТОГО СКОТА
Работу выполнила Жевнова Н.А.
Факультет биологический
Специальность 020201 Биология
Нормоконтролёр, канд. биол. наук, доц. Хаблюк В.В.
Краснодар 2012
Реферат
Работа состоит из 3-х глав, введения и заключения общим
объемом ____ страницы. В работе содержится 4 таблицы, 1 рисунок и 2 приложения.
Количество литературных источников - 45.
Ключевые слова: ВЛКРС, ПЦР, РИД, ЛИМФОЛЕЙКОЗ, ГЕМОБЛАСТОЗ,
ЛЕЙКОЗ КРС.
Объект исследования - крупный рогатый скот.
Дипломная работа посвящена изучению роли и результативности
применения метода ПЦР в ранней диагностике лейкоза крупного рогатого скота. В
ней изложены основные вопросы, связанные с проблемой лейкоза крупного рогатого
скота и проанализирована данная ситуация в России и мире. Используя методы РИД
и ПЦР, разработаны рекомендации по очистке стад КРС от лейкоза. Определена
наиболее эффективная технология выращивания молодняка при использовании метода
ПЦР. Экспериментально подтверждена возможность снижения количества
инфицированных телят при абсолютной инфицированности матерей.
Содержание
Реферат
Введение
1. Аналитический обзор
1.1 Историческая справка
1.2 Общая характеристика заболевания вызываемого вирусом
лейкоза крупного рогатого скота
1.3 Общая характеристика вируса лейкоза крупного
рогатого скота
1.3.1 Геном ВЛКРС
1.3.2 Структурные и регуляторные белки ВЛКРС
1.4 Методы диагностики вируса лейкоза крупного рогатого
скота
1.4.1 Преимущества ДНК - технологий в ранней диагностике
лейкоза крупного рогатого скота
2.2 Исследование методом РИД
3. Использование ДНК-анализа в системе противолейкозных
оздоровительных мероприятий у крупного рогатого скота
Заключение
Список использованых источников
Приложение А
Приложение Б
Введение
Гемобластозы сельскохозяйственных животных в последние 2-3
десятилетия распространились почти во всех странах с высокоразвитым молочным
животноводством. Они наносят огромный экономический ущерб. В последние годы
внимание исследователей уделяется вопросам эпизоотологии, патогенеза,
инфекционных свойств возбудителя, диагностики и профилактики лейкоза крупного
рогатого скота.
Многочисленные публикации и данные официальной ветеринарной
статистики свидетельствует о том, что среди инфекционных болезней крупного
рогатого скота лейкоз по тяжести поражения органов, тканей, массовости
проявления и экономическим последствиям занимает лидирующее место.
Вирусный лейкоз крупного рогатого скота (ВЛКРС) в настоящее
время распространен во всех субъектах Российской Федерации. По официальным
данным в Российской Федерации имеется более 3 тысяч неблагополучных пунктов по
лейкозу крупного рогатого скота. Уровень инфицированности составляет 12 - 15 %
(в отдельных регионах значительно выше), а уровень заболеваемости 3 - 4 %.
Такая эпизоотическая ситуация сохраняется уже в течение нескольких лет
[Хусаинов, Галлеев, 2009].
Борьба с лейкозом крупного рогатого скота опирается на
выявление зараженных животных. При этом одним из сдерживающих факторов
эффективности оздоровительных мероприятий остается несвоевременная диагностика
лейкоза, связанная с использованием разноплановых методов исследования
(гематологических, клинических, патоморфологических, серологических,
молекулярно-биологических), обладающих разной чувствительностью, специфичностью
и практической значимостью [Пономарёва, Сычева, Поляков, Нургалиева, Карташова,
2010].
Больные животные снижают ежедневные удои молока в среднем на
11 %, а их репродуктивная способность заметно падает в расчете на среднее
количество годовых отелов. Биохимической и ветеринарно-санитарной экспертизой
установлено, что мясо и молоко больных животных по многим показателям являются
малоценными. Снижаются и технологические качества молока, оно содержит большое
количество свободного триптофана, метаболиты которого не разлагаются в течение
20 мин кипячения и обладают канцерогенными свойствами [Стародуб, Стародуб,
2003].
Целью дипломной работы явилось изучение роли и
результативности применения метода ПЦР в ранней диагностике лейкоза крупного
рогатого скота.
Для достижения цели работы были поставлены и решены следующие
задачи:
. Изучение и экспериментальное подтверждение
эффективности метода ПЦР для снижения уровня инфицированности телят при 100%
инфицированности матерей.
2. Определение эффективной технологии выращивания
молодняка с использованием метода ПЦР.
. Выяснение причин ложно-отрицателых результатов при
проведении ПЦР и РИД - диагностики у животных в возрасте старше 6 месяцев.
. Экспериментальное определение погрешности метода РИД
и ПЦР, оценка их роли в противолейкозных оздоровительных мероприятиях крупного
рогатого скота.
1.
Аналитический обзор
1.1
Историческая справка
Название болезни "лейкоз" происходит от греческого
слова LEUCOS, что означает белый. Начало учения о лейкозе связано с именем
известного немецкого морфолога Рудольфа Вирхова, который в впервые описал
болезнь у человека и выделил ее в самостоятельную нозологическую единицу под
названием "лейкемия" или белокровие, поскольку белые элементы крови
придают ей более или менее белую окраску. При этом автор выделил две ее формы:
селезеночную, проявляющуюся увеличением селезенки и появлением в крови больных
лейкоцитарных форм, и лимфатическую, характеризующуюся увеличением лимфоузлов и
появлением малых клеток - лимфоцитов.
Несколько позднее появились сообщения по лейкозу животных.
Первый случай лейкемии у лошади описал патологоанатом Дрезденского
ветеринарного института Лейзеринг в 1858 году. Лейкозом болеют 29 видов
животных и 15 видов домашних и диких птиц.
В процессе изучения эту болезнь называли по-разному:
лейкемия, бело-кровие, рак крови, гемобластозы, энзоотический лейкоз.В.
Эллерман предложил заменить название болезни "лейкемия" термином
"лейкоз", который более полно характеризовал патологический процесс,
развивающийся в кроветворной ткани, независимо от изменений, наблюдаемых в
периферической крови. Несколько позднее было предложено новое название болезни
"гемобластозы", т.е. опухолевые заболевания крови, так как при
лейкозе наблюдали гиперплазию клеток кроветворной и лимфоидных тканей с
развитием злокачественных опухолей. Несмотря на обоснованность термина
"гемобластозы", в нашей стране принято употреблять термин
"лейкоз" [Апалькин, Гулюкин, Петров, 2005].
противолейкозный крупный рогатый скот
Опухолевая природа лейкозов была подтверждена многими
исследователями более чем столетие тому назад, в т. ч. нашими
соотечественниками К. Славянским и А. Щастным, и в настоящее время является
общепризнанной. По характеру и месту локализации опухолевых клеток к
определенным росткам гемопоэза гемобластозы разделены на две группы:
· лейкозы - системные поражения органов
кроветворения, включающие лимфоидную, миелоидную, моноцитарную и
недифференцированную формы;
· гематосаркомы - сопровождающиеся
опухолевым ростом. К ним относятся лимфосаркома, ретикулосаркома,
лимфогрануломатоз и миеломная болезнь.
Первые отличаются системностью поражения кроветворной и
лимфоидной тканей с вовлечением в процесс костного мозга, селезенки и
лимфатических узлов. Болезни второй группы характеризуются поражением
лимфоидной ткани, т.е. лимфоузлов и селезенки. Опухоли, состоящие из клеточных
элементов, природу которых трудно установить, относятся к числу
недифференцированных лейкозов. По данным литературы, у крупного рогатого скота
наибольшее распространение имеет лимфоидный лейкоз [Бурба, Кунаков, 1983].
Важнейшим путем познания сути болезни являются
экспериментальные исследования. Первым шагом на пути эксперимента в онкологии
явились перевивка, трансплантация опухолей, впервые осуществленная нашим
соотечественником, магистром ветеринарных наук М.А. Новинским в 1876 году на
собаках.
Выдающуюся роль в развитии учения об экспериментальном
лейкозе сыграла работа Эллермана и Банга (1908). Им удалось воспроизвести
заболевание у подопытных кур не только перевивкой лейкозной ткани и крови, но и
использовании их фильтрата, впервые доказав инфекционную природу болезни.
В последующие годы для воспроизведения лейкоза крупного
рогатого скота стали использовать в качестве экспериментальных биологических
объектов телят и овец. Удалось доказать возможность их заражения путем инокуляции
различных материалов от больного лейкозом крупного рогатого скота, тем самым
позволившей утверждать, что лейкоз может передаваться от одного животного к
другому.
Известно, что патогенез каждого заболевания, прежде всего
обусловлен этиологическим фактором, а затем факторами, способствующими его
возникновению и развитию. ВЛКРС впервые удалось выделить в 1969 году, но в
экспериментальных условиях болезнь была воспроизведена ещё в 1916 году путём
введения подопытным телятам и взрослым животным крови и суспензии из
лимфатических узлов от больной коровы [Макаров, 1999].
Распространение вируса крупного рогатого скота, по-видимому,
связано с тем, что многие страны для улучшения генофонда местных
низкопродуктивных пород были завезены большие партии скота из стран с
высокопродуктивным молочным животноводством. В которых процент инфицированности
животных вирусом был очень высоким. Этиологическая (причинная) роль вируса в
развитии лейкоза была установлена сравнительно недавно, а методы выявления
инфицированных животных были разработаны лишь в 1974-1975 годы, поэтому
естественно, что происходивший раннее интенсивный обмен племенными животными
способствовал развитию инфекции [Галеев, Хусаинов, 2006].
1.2 Общая
характеристика заболевания вызываемого вирусом лейкоза крупного рогатого скота
Лейкоз крупного рогатого скота (Leucоsis bovum) - хроническая
злокачественная вирусная болезнь, характеризующаяся неопластической
пролиферацией кроветворной и лимфоидной тканей, смертельным исходом.
В естественных условиях к вирусу восприимчивы, кроме крупного
рогатого скота, овцы, зебу и буйволы. Существенное значение в распространении
болезни имеет гено - и фенотипическая предрасположенность животных к лейкозу,
например, среди красной и черно-пестрой пород скота [Барышников, 2006].
Основным фактором, обуславливающим передачу вируса лейкоза
крупного рогатого скота, является перенос возбудителя через кровь и препаратов
из нее, при ветеринарных и зоотехнических обработках, т.е. ятрогенный способ
передачи инфекции [Авилов, Нахмансон, 1999].
Несущественными факторами передачи возбудителя ВЛКРС являются
различные секреты и экскреты (слюна, моча, кал), так как вирус лейкоза в них не
обнаруживается и не может длительно сохраняться при контаминации их кровью
инфицированного ВЛКРС [Смирнов, 1999; Гулюкин, Симонян, Мироменко, 2005].
Однако передача ВЛКРС восприимчивым животным может осуществляться различными
секретами и экскретами при попадании в них лимфоцитов, зараженных ВЛКРС
[Петров, 2004].
Существует два основных пути передачи вируса: вертикальный -
от матери - плоду и горизонтальный - от одного животного - другому.
Инфицирование плода происходит трансплацентарным путем через кровь матери.
Частота заражения новорожденных телят зависит от стадии инфекционного процесса
матери [Коромыслов, Шишков, 1993].
В сперме инфицированных быков-производителей ВЛКРС не
выявлен. Не наблюдается определенного влияния передачи ВЛКРС потомству от
серопозитивных быков-производителей при естественном оплодотворении
серонегативных коров. Однако у быков с воспалением генитальных органов в сперме
могут быть лимфоциты, инфицированные ВЛКРС. Экспериментально установлено, что
коров можно инфицировать путем нанесения таких лимфоцитов на слизистую оболочку
матки. Изучение возможности передачи вируса лейкоза при эмбриопересадках
подтвердили отсутствие передачи ВЛКРС от коров доноров коровам-реципиентам
через эмбрионы [Апалькин, Гулюкин, Петров, 2005].
Механизм передачи ВЛКРС еще окончательно не изучен.
Экспериментально подтверждена возможность заражения животных путем переноса
ВЛКРС при ректальной пальпации в случае повреждения слизистой оболочки. Не
получено достаточных доказательств о влиянии жалящих и кровососущих насекомых в
распространении лейкоза [А.М. Смирнов, 2005].
Взаимодействие ВЛКРС с восприимчивым крупным рогатым скотом
происходит на уровне генетического аппарата лимфоидной клетки и обуславливает
пожизненную персистенцию вируса в макроорганизме. Репликация вируса не выявлена
в других тканях организма [Галеев, 1999; Смирнов, 1999].
В отношении роли секретов слюнных, слезных желез, мочи и кала
в распространении возбудителя большинство исследователей приходит к выводу, что
вирус лейкоза в них не обнаруживают, а при контаминации их кровью
инфицированного ВЛКРС он не может в них сохраняться длительное время, т.е. эти секреты
и экскреты не могут служить существенными факторами передачи ВЛКРС. Учитывая
все это, надо полагать, что в практических условиях основной способ заражения
восприимчивого организма сопряжен с нарушением правил асептики, т.е. с
попаданием лимфоцитов в организм восприимчивого животного при инъекциях,
нумерации, хирургических операциях, фиксации животных при проведении
ветеринарно-зоотехнических манипуляций. Совместное проведение отелов здоровых,
инфицированных ВЛКРС и больных животных способствует распространению инфекции
[Гулюкин, Симонян, Мироменко, 2005].
Лейкоз крупного рогатого скота характеризуется длительным
латентным периодом, так как интегрированный в клеточный геном провирус может не
экспрессироваться длительное время. При спонтанном заражении этот период длится
от 2 до 6 лет. Под влиянием различных экзогенных и эндогенных факторов
происходит активация возбудителя.
Клинические проявления зависят от вовлечения в патологический
процесс органов - лимфатических узлов, селезенки, сычуга, сердца, почек,
половых органов. Инфекционный процесс при лейкозе развивается медленно и
незаметно. У телят 1,5 - 3 - месячного возраста все виды гемобластозов
характеризуются обычно острым течением и заканчиваются гибелью через 1 - 2
недели после появления признаков болезни. У молодняка в возрасте 8 - 9 месяцев
или 1 - 2 года болезнь протекает в виде подострых, редко острых случаев.
Развитие заболевания у взрослых животных характеризуется на начальной стадии
появлением специфических антител к вирусу ВЛКРС (В.М. Нахмансон, М. И Гулюкин,
Е.А. Дун, 1997).
В развитии лейкозного процесса у крупного рогатого скота
различают четыре стадии:
1. Предлейкозную.
. Развернутую (клиникогематологическую).
. Терминальную (опухолевую).
Предлейкозную стадию диагностируют при помощи серологических
и вирусологических исследований, при этом никакие гематологические изменения
еще не выявляются.
Начальная стадия характеризуется отсутствием клинических
признаков болезни, но более постоянными изменениями количественного и
качественного состава крови. Увеличивается количество лейкоцитов, повышается
процент лимфоцитов, появляются малодифференцированные, незрелые, различной
величины патологические формы клеток. Гематологические изменения могут многие
годы оставаться стабильными. При этом общее состояние животного - упитанность,
молочная продуктивность и воспроизводительная функция не вызывают подозрений на
лейкоз.
Развернутая стадия характеризуется кроме гематологических
сдвигов разнообразием специфических и неспецифических клинических признаков. К
неспецифическим признакам относят ухудшение общего состояния, быструю
утомляемость, плохой аппетит, плохое усвоение кормов, снижение удоев, диарея,
цианоз и желтушность слизистых оболочек, нередко устанавливают увеличение сердца,
число пульсовых ударов достигает 120 в минуту. При сердечной слабости у
животного развиваются отеки подкожной клетчатки в области подгрудка и
межчелюстного пространства. Специфическим клиническим признаком лейкоза
крупного рогатого скота является прогрессирующее значительное увеличение
поверхностных (околоушных, нижнечелюстных, заглоточных, предлопаточных,
надвыменных) лимфатических узлов. Отмечается симметричное, но неравномерное
увеличение их. Лимфатические узлы достигают величины от 5 до 20 см и более, они
безболезненные, подвижные, эластичной или плотной консистенции.
У молодняка наряду с увеличением лимфатических узлов в
области голодной ямки, поясницы, шеи часто отмечают опухолевидные разрастания
зобной железы, обусловливающие затрудненное дыхание. Возможен разрыв селезенки,
и животное внезапно погибает вследствие внутреннего кровоизлияния. Отмечают
также увеличение печени. У некоторых больных лейкозом животных отмечают
экзофтальм.
При развернутой стадии лейкозного процесса отмечают
лейкемическую картину крови (увеличение числа лейкоцитов), увеличение числа
молодых, недифференцированных клеток в лейкоцитарной формуле Продолжительность
этой стадии варьируется от нескольких месяцев до 1-2, иногда и 3 лет.
Терминальная (опухолевая) стадия лейкоза характеризуется
дальнейшим развитием патологического процесса и более отчетливым проявлением
клинических признаков: резким увеличением лимфатических узлов, которые могут
заметно выступать на теле; отеками подкожной клетчатки в области подгрудка,
межчелюстного пространства, конечностей. Число лейкоцитов в крови иногда
снижается, при этом преобладают их патологические формы. Это приводит к
крайнему истощению органов кроветворения, блокаде иммунной системы и
заканчивается смертью животного [Бессарабов, 2007].
Инфицированию вирусом лейкоза крупного рогатого скота и
развитию болезни способствуют генетическая предрасположенность и дефекты
иммунитета, часто развивающиеся в результате нарушения технологии содержания и
кормления [Ковалюк, 2006]. Огромное значение в развитии лейкозного процесса
имеет естественная резистентность организма и иммунологическая реактивность,
особенно параметры клеточной системы (T - лимфоциты) [Шубинсий, Лозовой, 1990].
Состояние естественной резистентности зависит, в первую
очередь, от полноценного кормления с учетом возрастных потребностей,
физиологического состояния и продуктивности животных. Нарушение неспецифических
защитных механизмов может привести к расстройству клеточного взаимодействия,
необходимого для индукции иммунного ответа. Вероятность инфицирования крупного
рогатого скота вирусом лейкоза при снижении естественной резистентности
возрастает на 25-30% [Фёдоров, Верховский, 1996].
Развитие лейкоза у крупного рогатого скота, как правило,
сопровождается гипоальбуминемией и диффузной гипергаммаглобулинемией. Снижается
содержание в сыворотке крови альбуминов до 1,72% (норма около 4%), что связано
со сложным комплексом изменений их метаболизма, с патологическим нарушением
паренхимы печени, проницаемости и целостности стенок кровеносных и лимфатических
сосудов в различных частях тела, специфическим влиянием злокачественного
процесса, а в ряде случаев и с нарушением обменной функции желудочно-кишечного
тракта [Кудряшов, Петров, 1999]. У инфицированного и больного лейкозом скота
нарушается глюконеогенная функция печени. Так, содержание глюкозы в крови у
вирусоносителей и гематологически больных животных, соответственно, на 21,3 и
36,2% меньше, чем в сыворотке крови здоровых животных [Блинов, Пилипченко,
2007].
У больного лейкозом крупного рогатого скота в связи с
гликоальбуминемией, вызывающей комплекс недостаточности важных функций,
выполняемых альбуминами как переносчиков метаболитов, гормонов (тироксина,
гидрокортизона, эстрогенов) и белков, усугубляется дискоординация
физиолого-биохимических процессов в организме, обусловливая комплекс вторичных
расстройств у животных. В некоторых случаях повышается уровень
альфа-глобулинов, в основном гликопротеидов, принимающих активное участие в
ответной реакции организма.
При развитии лейкозного процесса происходит нарушение
иммунных реакций [Деринов, Овдиенко, Найманов, 2006]. Так как ВЛКРС поражает
клетки иммунной системы, снижается устойчивость животных к другим инфекциям и
инвазиям [Федотов, Иванов, Иванова, 2007].
Выявлено нарушение метаболизма аминокислот, проявляющееся в
изменении состава свободных аминокислот сыворотки крови, органов, а также
плазмы и лейкоцитов. На глубокие расстройства нормального обмена аминокислот
при лейкозе указывают результаты исследований, выявившие характерные изменения
в содержании триптофана и его метаболитов. При этом указывается, что некоторые
метаболиты триптофана обладают лейкозогенными свойствами.
Молоко и мясо животных с гематологической и опухолевой
стадиями заболевания, как показали проведенные исследования, обладает
токсичностью по отношению к культуре клеток перевиваемой почки поросенка,
причем эффект токсичности возрастает по мере развития лейкозного процесса.
Установлено, что продукты, полученные от больных лейкозом животных, содержат
вредные метаболиты триптофана и других циклических аминокислот и,
следовательно, являются экологически опасными для человека. Потенциальную
опасность для здоровья человека представляет наличие вируса или его фрагментов
в продуктах питания. Есть данные о способности некоторых онкогенных вирусов
преодолевать межвидовые барьеры [Смирнова, 2000].
Так башкирскими учеными - Галеевым.Р. Ф и Хусаиновым Р. Ф
[2006], былы проведены исследования по определению лейкозогенности молока от
инфицированных и больных лейкозом коров в эксперименте на овцах.
В эксперименте использовались 15 голов клинически здоровых
овец восьмимесячного возраста, которых подвергли предварительным
гематологическим и серологическим исследованиям на лейкоз. В неблагополучном по
лейкозу хозяйстве были подобраны коровы-доноры сероположительные в РИД на
наличие антител к ВЛКРС как по сывороткам крови, так по молочному секрету.
Гематологические показатели коров-доноров имели выраженные отклонения
характерные для лейкозного процесса. Так общее количество лейкоцитов у коровы
№1624 составило 37.3 тыс/мкл, у коровы №0080 - 14,0 тыс/ мкл, у коровы №3850 -
49,5 тыс/мкл. У каждой коровы-донора было взято по 0,5 л молока и по 5 мл крови
в антикоагулянт. Полученный материал центрифугировали при 1000 об/мин для
получения клеточного осадка. Осадок центрифугировали с антибиотиком и до
введения овцам хранили при 4°С в течение 18 часов. Клеточные суспензии
полученые от молока коров ввели 9 овцам из расчета по 3 головы на донора.
Суспензию лейкоцитов крови коров ввели 3 овцам из расчета по одной овце на
донора. Контрольная группа состояла из трёх овец. Подопытные животные
находились под наблюдением в течение трёх месяцев и каждые 30 дней подвергались
клинико-гематологическому и серологическому исследованиям на лейкоз.
Так общее количество лейкоцитов в 1 мкл крови у овец до и
после введения материала от больных лейкозом коров-доноров не превышало пределы
физиологической нормы для данного вида животного. При серологическои
исследовании крови овец в РИД с гликопротеидным антигеном ВЛКРС уже через 30 дней
были выявлены сероположительные животные. Так из трёх овец инфицированных
суспензией клеток молока коровы №1624, положительно отреагировали две овцы, что
составило 66,6%, а через 60 дней все три овцы были сероположительными, что
составляло 100% в данной группе. Овцы, инфицированные суспензией клеток молока
коровы № 3850, как через 30, так и через 60 дней оставались сероположительными
лишь на 66,6%, так как у одной овцы на протяжении всего исследования антител к
ВЛКРС не обнаружено. В группе овец, которых заражали лейкоцитами крови
коров-доноров, уже через 30 дней все животные имели антитела к ВЛКРС.
Таким образом, результаты изучения лейкозогенных свойств
молочного секрета от больных лейкозом коров на биологически чувствительных к
ВЛКРС овцах, указывают на то, что молоко может быть одним из факторов
горизонтальной передачи вируса молодняку.
При производстве молочных продуктов используются различные
режимы пастеризации. При производстве сметаны, масла, кисломолочных напитков,
йогуртов чаще всего применяют высоко температурную пастеризацию при 85-87°С с
выдержкой 5-7мин. или при 90-95°С с выдержкой 2-3мин. Однако при производстве
сыров такие температурные режимы пастеризации не приемлемы, так как ухудшают
способность молока к сычужному свертыванию. В сыроделии используется режим -
72°С с выдержкой 15с., что может быть недостаточно для инактивации ВЛКРС
[Свириденко, 2003].
Однако, на протяжении многих лет сотрудники различных научных
учреждений проводили обширные эпидемиологические и эпизоотические исследования,
в результате которых не установлена взаимосвязь заболеваемости животных
лейкозом и естественным инфицированием человека, несмотря на то, что по
структурному строению и функциональным особенностям ВЛКРС схож с вирусом
Т-клеточного лейкоза человека. Длительные наблюдения за людьми, обслуживающими
скот в неблагополучных по лейкозу хозяйствах, а также занятых на убое и
переработке больного или инфицированного скота, не выявили повышенного риска
заболеваемости [Мадисон, Мадисон, 2006].
1.3 Общая
характеристика вируса лейкоза крупного рогатого скота
Вирус лейкоза крупного рогатого скота относится к семейству
ретровирусов (в это же семейство входят родственные ВЛКРС вирусы Т - клеточного
лимфолейкоза и ВИЧ). Семейство ретровирусов (Retroviride) по данным международного
комитета по таксономии вирусов разделено на 7 родов [Смирнов, Храмцов,
Смирнова, 2000]. Определено сходство нуклеотидной последовательности белков
вируса лейкоза крупного рогатого скота и вируса Т-клеточного лейкоза человека
[Галеев, Хусаинов, 2006].
Наиболее распространенными среди домашних животных являются
представители двух родов: рода Deltaretrovirus, объединяющего вирус лейкоза крупного
рогатого скота, Т - лимфотропные вирусы человека 1 и 2 типов, вирус лейкоза
обезьян и рода Lentivirus, объединяющего 5 подродовлентивирусов (от латинского lenti - медленный). К ним
относят лентивирусы коз и овец, вирус иммунодефицита приматов, лентивирусы
лошадей, лентивирусы кошек, лентивирусы крупного рогатого скота. Ретровирусным
инфекциям свойственен ряд общих признаков: длительность инкубационного периода,
хроническое или латентное течение, прижизненная персистенция вируса и строго
ограниченный круг восприимчивых животных.
Ретровирусы проникают в клетку путем эндоцитоза, РНК
освобождается и транскрибируется в двухцепочечную ДНК - копию, которая
встраивается как провирус в ДНК клетки хозяина. В благоприятных условиях с
интегрированного провируса транскрибируется как вирусная РНК - копия, так и
РНК, которые транслируются в белки. Затем происходит сборка новых вирионов,
которые отпочковываются от клеточной мембраны для инфицирования новых клеток.
[Крикун, 2002].
В результате однократно произошедшего инфицирования, ВЛКРС
присутствует в организме животного пожизненно в виде провируса интегрированного
в ДНК клетки хозяина. Вирус поражает клетки лимфоидной ткани, то есть является
лимфотропным. Он ассоциирован с клеткой и персистирует в субполяции
периферических В-лимфоцитов, которые в результате инфекции пролиферируют,
обуславливая развитие персистентного лимфоцитоза.
Морфологическая структура зрелых вирионов представляет собой
центрально расположенный электронно-плотный нуклеотид, диаметр которого
варьирует от 50 до 90 нм. Сердцевина вириона отделена от вирусной оболочки
промежуточным слоем. Внешняя оболочка представлена двухконтурной мембраной, на
поверхности которой имеются шипики длинной 8-11 нм с пуговкообразными
утолщениями на концах [Белов, Рогожина, 1997; Альштеин, 2000].
Морфогенез (сборка вируса и механизм его выхода из клетки),
как показали исследования, проведенные в лаборатории лейкозов Московской
ветеринарной академии имени К.И. Скрябина, связан с формированием вирусных
частиц в цитоплазматических вакуолях, и очень редко идёт путём почкования на её
внешней, цитоплазматической мембране. Клетками-мишенями для вируса лейкоза
крупного рогатого скота являются В-лимфоциты, в их ядрах образуются характерные
структуры, названные ядерными карманами, которые, по мнению некоторых
исследователей, свидетельствуют о развитии лейкозной трансформации клетки
[Галлеев, Хусаинов, 2009].
Основным биохимическим признаком семейства Retroviridae является наличие в
вирионе обратной транскриптазы (ОТ) (РНК-зависимой ДНК - полимеразы)
[Прохватилова, 1998]. Обратная траскриптаза или РНК-зависимая ДНК-полимераза -
фермент, необходимый для репликации РНК-содержащих онковирусов. РНК-зависимая
ДНК-полимеразная активность связана со всеми четырьмя
дезоксирибонуклеозидтрифосфатами, а так же с ионами магния.
Установлено, что ВЛКРС чувствителен к температурным
воздействиям, разрушается при повторяющихся замораживаниях и оттаиваниях и при
прогревании при 56 "С в течение 15 мин. Пастеризация молока (74°С в
течение 16 с) разрушает ВЛКРС. Полная инактивация вируса в молоке или
вируссодержащей жидкости (кровь, молозиво) установлена при 50 "С в течение
70 с, при 70-74 "С - за 17 с, или при скисании молока (рН 4,75). Прямой
солнечный свет инактивирует ВЛКРС в течение 4 ч, Ультрафиолетовые лучи - в
течение 30 мин. Вирус полностью теряет активность в 2% растворах гидроксида
натрия и формальдегида и других дезинфектантов в общепринятых концентрациях
[Бессарабов, 2007].
1.3.1 Геном
ВЛКРС
Последовательность генома ВЛКРС расшифрована (см. приложение
А). Он имеет четыре гена: gag, pm, pol, env, а так же фланкирующие длинные терминальные
последовательности [Прохватилова 1998]. Ген gag кодирует два полипептида
66 и 44 кДа, являющихся предшественниками внутренних структурных белков.
Полипептид 66gag-pro - предшественник
матриксного белка р15, капсидного белка р24, нуклеокапсидного белка р12 и
протеиназы р14. Полипептид 44gag похож на полипептид 66gag-pro, но лишен аминокислотных
последовательностей, присущих протеазе. Белок р24 - наибольший коровый белок,
он устойчив к эфиру и был выделен с помощью различных методических приёмов. Ген
env кодирует предшественник
получивший название Pr72env. После гликозилирования и распада он даёт начало
поверхностному и трансмембранному гликопротеидам SU и TM соответственно. Оба они
остаются нековалентно связанными и имеют дисульфидные мостики. Их обозначают
как gp 51SU и gp 30TM и они являются главными гликопротеидами вирусной оболочки. Белок gp 51SU имеет девять сайтов
гликозилирования и столько же цистеиновых остатков и является главным антигеном
вируса лейкоза, ответственным за образование нейтрализующих антител. При помощи
моноклональных антител было выявлено 8 антигенных детерминант, обозначаемых как
A,B,C,D, I,F,G,H, из которых F,G,H отвечают за выработку
нейтрализующих антител. По антигенной структуре вирус лейкоза крупного рогатого
скота отличается от других представителей семейства, антигенных вариантов не
имеет [Стародуб, 2003; Прохватилова, 1998].
1.3.2
Структурные и регуляторные белки ВЛКРС
Между геном env и фланкирующими длинными терминальными
последовательностями существует район X расположенный на 3’конце генома и содержащий ряд
открытых рамок считывания, которые кодируют регуляторные белки вирусной
экспрессии (Tax, Rex, R3 и G4). Два белка Tax и Rex экспрессируются в инфицированных клетках, но не
присутствуют в частицах вируса.
Белок Tax (34-38 кДа) является транскрипционным
активатором всех вирусных белков. Трансактивация гена tax требует 21 пару
оснований на 5-терминальном конце. Белок Tax прямо не связывает ДНК,
но, взаимодействуя с некоторыми клеточными белками, увеличивает их аффинность к
21-членной "усиливающей" последовательности. Ген tax абсолютно необходим для
инфекционности вируса в условиях in vivo [Стародуб, 2003].
Белки (p10, p12, p15, p24) относятся к структурным внутренним белкам. Первым
выделенным белком был p24, этот белок является ней - тральным и умеренно
гидрофобным.
Белок p15 - слабый основной белок, не содержащий остатки метионина.
Он является главным фосфопротеином вирионов ВЛКРС, он имеет две молекулярные
формы и участвует в комплексах с гомологичными молекулами, с p10, липидами и РНК
вируса.
Белок p12 - обогащен пролином, лизином и аргинином. Его молекула
имеет низкий уровень вторичной организации и тесно связанна с вирусной РНК.
Данный белок образован 69 аминокислотами.
Белок p10 - сильный основной белок, способный связываться с
однонитевой ДНК [Da, Shanks, Stewart, Lewin, 1993].
При помощи моноклональных антител было выявлено 8 антигенных
детерминант, обозначаемых как A,B,C,D, I,F,G,H, из которых F,G,H отвечают за выработку
нейтрализующих антител. По антигенной структуре вирус лейкоза крупного рогатого
скота отличается от других представителей семейства, антигенных вариантов не
имеет.
1.4 Методы
диагностики вируса лейкоза крупного рогатого скота
Для диагностики лейкоза применяют клинический,
патологоанатомический, гистологический, гематологический, серологический и
молекулярно - биологический методы.
Клиническая диагностика осуществляется регистрацией
вышеуказанных специфических и неспецифических признаков. Большинство
исследователей указывают на первичное появление неспецифических признаков, а затем
появляются специфические, по которым можно поставить диагноз [Ковалюк, Сацук,
Мачульская, 2007].
При патологоанатомическом исследовании трупов животных
выявляют увеличение лимфатических узлов, особенно средостенных и брыжеечных,
которые не спаяны между собой. Поверхность разреза их саловидная, рисунок
строения слегка или совсем стерт. Селезенка увеличена (длиной от 48 до 100 см).
Поверхность разреза ее красная, сочная, зернистая. Увеличенные фолликулы обычно
вишнево-красного или сероватого цвета. Они возвышаются над поверхностью
разреза. У некоторых животных фолликулы могут быть малиново-красного цвета.
Макроскопических изменений в почках обычно не выявляют. Однако иногда можно
наблюдать сероватую бугристость размером от 1 до 5 мм и более.
При гистологическом исследовании выявляют системную диффузную
лейкозную инфильтрацию во всех органах кроветворения: костном мозге, селезенке,
лимфатических узлах, а также в пейеровых бляшках и солитарных фолликулах
кишечника, печени, почках, сердце, легких, скелетной мускулатуре [Бессарабов,
2007].
Гематологический метод позволят диагностировать лейкоз на
более ранних стадиях развития заболевания. Сущность его заключается в
обнаружении в периферической крови повышенного числа лейкоцитов (в основном
лимфоидного ряда), слабо дифференцированных клеток, а также полиморфных,
атипичных клеток кроветворных органов. Для оценки результатов исследований в
различных странах предложено несколько вариантов "лейкозных ключей".
В нашей стране в 1965 году был разработан отечественный "лейкозный
ключ". Все лимфоидные диагностические "ключи" основаны на
количественных показателях [Ковалюк, Сацук, Мачульская, 2007].
Заражение животных ВЛКРС сопровождается выработкой антител к
структурным белкам вируса. Антитела и вирус персистируют в организме у
зараженных животных на протяжении всей жизни. Это позволяет применять
серологические методы для диагностики инфекции, вызываемой этим вирусом.
К серологической диагностике лейкоза в стране приступили с
1985 года. При этом ежегодно увеличивается число животных, подвергаемых
серологической диагностике. Во многих хозяйствах, даже с высоким уровнем
инфицированности, этот метод хорошо себя зарекомендовал, а его использование
позволило полностью оздоровить стада [Симонян, 2007]. Однако РИД -
исследованиями проверяется по многим регионам около 50% поголовья. Лишь в
Архангельской, Курганской, Ленинградской, Вологодской, Пермской, Удмуртской и
Московской области проверяются все животные. Низкий охват серологическими
исследованиями поголовья в других регионах означает, что нет полной ясности об
уровне инфицированности стада, а значит, нет четких планов оздоровления
[Гулюкин, 1999].
Разработанная и широко применяемая в ветеринарных
лабораториях страны реакция иммунодиффузии в геле агара (РИД) с использованием
антигена ВЛ в настоящее время остается основным диагностическим методом, по
результатам которого проводят оздоровительные и профилактические мероприятия в
неблагополучных по лейкозу хозяйствах [Костенко и др., 1989; Берзяк, Ковалючко,
Гротевич, Киричук, 1990].
Как правило, в данной тест-системе используется смесь белков,
среди которых преобладают gp 51 и р 24, однако с ее помощью преимущественно
выявляются антитела к gp 51. Данный метод достаточно простой, позволяет
получить надежные результаты и, поэтому широко введен в ветеринарную практику.
Основными его недостатками являются невысокая чувствительность и длительность
анализа. Как известно, время анализа этим методом, получившим в свое время в
ветеринарной практике название метода Оухтерлони, или РИД, занимает 2-3 суток,
а результат регистрируется визуально по наличию полосы преципитации [Стародуб,
Стародуб, 2003].
Метод не прямого иммуноферментного анализа (ИФА), основанный
на применении антивидового конъюгата с использованием ферментов-маркеров,
обладает значительно большей чувствительностью, по сравнению с РИД, позволяет
автоматизировать процесс, то есть уйти от субъективной оценки результатов
реакции [Иванова, 1999]. Кроме того, с помощью ИФА можно обнаружить антитела к
ВЛКРС в молоке и моче [Джапаралиев, Прохватилова, Ломакин, Аянот, 2000].
C целью полного оздоровления популяции КРС от лейкоза,
целесообразно на последней стадии оздоровления исследовать все поголовье
методами, выявляющими непосредственно вирус или провирус у инфицированных
животных. С этой целью можно использовать прямой иммуноферментный анализ (ИФА),
позволяющий детектировать непосредственно антигенные детерминанты.
Полимеразная цепная реакция (ПЦР) - это метод амплификации в
пробирке, с помощью которого в течение нескольких часов можно выделить и
размножить определенную последовательность провирусной ДНК в количестве,
превышающем исходное в 10 миллионов раз. Такая высокая степень направленного
обогащения значительно упрощает использование имеющегося образца ДНК.
Некоторые области применения ПЦР - высокоэффективное
клонирование геномных последовательностей, анализ происхождения групп скота,
прямое сиквенирование митохондриальной и геномной ДНК, анализ вариаций
нуклеотидных последовательностей и выявление вирусных и бактериальных патогенов
[Глазко и др., 2000; Коновалова, Сельцов, Зиновьева, 2006].
Для присоединения и начала работы ДНК - полимеразы необходимо
наличие спаренного 3’ - конца. В клетке ферментом РНК - праймазой синтезируется
РНК - затравка (праймер), состоящий примерно из 10 нук-леотидов. Эти РНК -
затравки и наращивает ДНК - полимераза [Рис, Стенберг, 2002].
При амплификации с помощью ПЦР используют два
олигонуклеотидных ДНК - праймера, фланкирующие интересующий нас участок ДНК.
Процесс амплификации заключается в повторяющихся циклах температурной
денатурации ДНК, отжига праймеров с комплементарными последовательностями и
последующей достройки полинуклеотидных цепей с этих праймеров ДНК - полимеразой
(см. приложение Б). Длинные фрагменты, синтезируемые на исходной цепи,
накапливаются по формуле арифметической прогрессии. В противоположность этому -
короткие дискретные фрагменты, ограниченные на концах праймерами, которые
появляются только в конце третьего цикла, накапливаются в геометрической
прогрессии и очень скоро начинают доминировать среди продуктов амплификации.
Праймеры для амплификации выбираются в различных частях
генома: 5΄LTR, gag, env, Х - области. Именно
подбор праймеров - основных компонентов тест - систем определяет их
специфичность, точность и надежность. Основными критериями высококачественной
тест - системы являются в первую очередь степень гомологии праймеров,
отсутствие самокомплементарных участков внутри ампликона и праймеров, а так же
близость значений температуры плавления праймеров. Температура плавления
праймеров вычисляется по формуле:
Т= [ (A+T) x 2] + [ (Г+С) х 4] - 5 С, (1)
где А, Т, Г, С - количество, соответственно адениновых,
тиминовых, гуаниновых, и цитозиновых оснований в составе праймера. Термин
"100% - степень гомологии" означает, что для всех известных изолятов
(то есть для тех, которые присутствуют в базах данных EMBL, GenBank, DDBJ) уровень гомологии
составляет 100% [Лиманский, Лиманская, 2001].
Нельзя подбирать праймеры на те области, которые могут иметь
делеции при интеграции в геном хозяйской клетки. Показано, что с помощью
праймеров из области гена env GP 51 провирусную ДНК вируса лейкоза удавалось
обнаруживать как в лимфоцитах перифирической крови инфицированных животных, так
и в суспензиях из различных органов и опухолей [Прохватилова, 2001].
Украинскими учеными [Ламанский, Лиманская, 2001] представлены
результаты теоретического и экспериментального сравнения праймеров, которые
используют в различных лабораториях для выявления вируса лейкоза крупного
рогатого скота посредством ПЦР. Показано, что праймеры BLV 3/ BLV 4 (на env - ген), разработанные в
Институте экспериментальной и клинической ветеринарной медицины УААН, обладают
всеми характеристиками, необходимыми для высококачественных праймеров. Помимо
выявления провируса и вируса в крови животных, ПЦР - технологии позволяют
проводить генотипирование вируса ЛКРС. Установлено, что существуют особые
варианты вируса, при инфицировании которыми животные остаются серонегативными в
течение всего периода инфицирования, и даже в случае прогрессии заболевания.
Генотипирование вируса в этом случае производят с помощью ПЦР - Hae III ПДРФ анализа участка
гена env [Белявская, 2003].
Важной областью применения ПЦР является исследование
импортного скота, находящегося в карантине, с целью предотвращения завоза ВЛКРС
из одной страны в другую. Существенно ограничивает применение метода ПЦР - его
высокая стоимость и трудоемкость, поэтому его целесообразно использовать только
для исследования высокоценных животных. Кроме указанных выше случаев, ПЦР можно
рекомендовать для контроля вакцин из цельной крови на специфическую
стерильность [Гулюкин, 2002].
1.4.1
Преимущества ДНК - технологий в ранней диагностике лейкоза крупного рогатого
скота
Разработанная и широко применяемая в ветеринарных
лабораториях страны реакция иммунодиффузии в геле агара (РИД) с использованием
антигена ВЛ в настоящее время остается основным диагностическим методом, по
результатам которого проводят оздоровительные и профилактические мероприятия в
неблагополучных по лейкозу хозяйствах. В действующих в настоящее время
"Правилах по профилактике и борьбе с лейкозом КРС" приоритет отдается
именно серологическим исследованиям сыворотки крови. По их результатам судят об
инфицированности животных вирусом лейкоза. В зависимости от этого определяют мероприятия
по оздоровлению [Ковалюк, Сацук, Мачульская, 2007]. Однако, как и любой
диагностический метод, РИД не лишен недостатков.
Так, наличие у лейкоза латентной стадии усложняет диагностику
заболевания. Экспериментально установлено, что после заражения скрытый период
инфекции продолжается от 2 недель до нескольких месяцев, по этому постепенно
выводя из стада РИД-позитивных животных, теоретически возможно добиваться
полного оздоровления хозяйства от лейкоза. Тем не менее, в оздоровленных
стадах, не имевших контактов с другими, через несколько месяцев или даже лет
выделяют животных с антителами к ВЛКРС [Нахмансон, 1986]. Это можно объяснить
характерным для лейкоза явлением иммунологической толерантности, когда
наблюдают вирусоносительство без антителообразования. Иммунологическая
толерантность - это частичная или полная утрата способности организма вступать
в иммунную реакцию со специфическими антигеном. При лейкозе КРС состояние
толерантности может развиваться в случае внутриутробного заражения плода
инфицированными лимфоцитами матери в период до проявления иммунной компетенции,
то есть в первые 3 месяца развития эмбриона. У отдельных животных, например, у
глубоко стельных коров, когда иммуноглобулины накапливаются в секрете молочной
железы и в некоторых других случаях [Крикун, 2002]. Кроме того описаны случаи
серонегативности при наличии сопутствующих инфекций, например вирусной диареи
[Белявская, 2003].
Метод не прямого иммуноферментного анализа (ИФА) обладает
значительно большей чувствительностью, по сравнению с РИД, позволяет
автоматизировать процесс, то есть уйти от субъективной оценки результатов
реакции. Кроме того, с помощью ИФА можно обнаружить антитела к ВЛКРС в молоке и
моче [Джапаралиев, Прохватилова, Ломакин, Аянот, 2000]. Несмотря на очевидные
достоинства, достоверность ИФА все же связана с иммунологическими реакциями, и
поэтому не всегда адекватна.
В связи с изложенным выше, с целью ускорения полного
оздоровления стад КРС от лейкоза, целесообразно использовать методы, выявляющие
непосредственно вирус или провирус у инфицированных животных. Перспективной в
этом плане является полимеразная цепная реакция (ПЦР). Этот метод позволяет
выявлять провирусную ДНК или вирусную РНК в образце крови животного.
Довольно часто выявляется несоответствие результатов ПЦР и РИД.
ПЦР - позитивные особи выявляются среди РИД - отрицательных животных, а ПЦР -
негативные - среди РИД - позитивных. Вполне вероятно, что, не смотря на очень
высокую чувствительность ПЦР, в развитии лейкозного процесса бывают такие
периоды, когда уровень провирусной ДНК минимален. В таких случаях РИД
оказывается более информативна. Поэтому имеет смысл "дочищать" ПЦР
РИД - и ИФА - негативных животных: при таком комбинированном использовании
диагностических методов гарантировано эффективное оздоровление стада.
Обнадеживающие результаты получены В.В. Макаровым, Д.П. Гринишиным (2005),
которым удалось доказать, что использование комбинированной РИД/ПЦР диагностики
более чем в два раза ускоряет процесс оздоровления стада от лейкоза, в
сравнении с использованием только исследований в РИД. Авторы отмечают, что при
жесткой браковке животных, положительно реагирующих в РИД, "шлейф"
РИД - позитивных особей продолжал выявляться до 9 - го исследования, а при
совместном РИД\ПЦР - исследовании - до 4 - го [Мальцева, 2004].
. Материал и методы исследования.
В данной работе исследуемым материалом была сыворотка крови
КРС для метода РИД и кровь для метода ПЦР. Животные айрширской и голдштинской
пород (n =
.1 Исследование методом ПЦР
Выделение ДНК из крови осуществлялось методом твердофазной
сорбции. Метод заключается в добавлении лизирующего агента, сорбции ДНК на
сорбенте, многократной отмывки и ресорбции ДНК буферным раствором. Образцы
могут находится при комнатной температуре не более 2-х часов. При необходимости
более длительного хранения пробы могут быть помещены в холодильник на срок не
более суток. Более продолжительное хранение (до 2-х недель) допустимо в
замороженном виде в морозильной камере. Не допускается повторное замораживание
- оттаивание проб.
Определенное количество образца переносится в пробирку "Eppendorf". В эту же пробирку
добавляется амплификационная смесь, состоящая из воды, ПЦР-буфера, раствора
дНТФ, раствора праймеров и Taq-полимеразы (добавляется в смесь в последнюю
очередь). Затем в каждую пробирку добавляется одна капля минерального масла для
предотвращения испарения реакционной смеси в процессе амплификации.
Параллельно с опытными пробами ставятся контрольные:
положительный контроль включает в себя все компоненты реакции, но вместо
материала клинического образца вносится контрольный препарат ДНК исследуемого
возбудителя, отрицательный контроль включает в себя все компоненты реакции, но
вместо клинического образца он содержит деионизированную воду. Отрицательный
контроль необходим для проверки компонентов реакции на отсутствие ДНК и клеток
возбудителя вследствие контаминации и исключить учет ложноположительных
результатов.
Пробирки переносят в программируемый термостат и проводится
амплификация в автоматическом режиме по заданной программе. Время проведения
реакции в зависимости от заданной программы составляет 2-3 часа.
После окончания электрофореза гель переносят на стекло
трансиллюминатора и просматривают в ультрафиолетовом свете. В первую очередь
оценивают контрольные пробы. В электрофоретической дорожке, соответствующей
положительному контролю, должна присутствовать яркая оранжевая полоса. В
электрофоретической дорожке соответствующей отрицательному контролю такая
дорожка должна отсутствовать. Наличие такой полосы в отрицательном контроле
свидетельствует о контаминации реагентов исследуемой ДНК. Опытные образцы
оценивают по наличию в соответствующей дорожке полосы, которая располагается на
том же уровне, что и полоса в положительной контрольной пробе.
2.2
Исследование методом РИД
Применялись наборы для серологической диагностики лейкоза КРС
ФГУП "Курская биофабрика - фирма "Биок". В состав набора входят
следующие компоненты: лиофилизированный антиген ВЛКРС, разбавитель антигена,
специфическая преципитирующая сыворотка - СПС, отрицательная контрольная
сыворотка - ОКТ, положительная контрольная сыворотка, слабоположительная
контрольная сыворотка, положительная контрольная сыворотка с антителами к р24
антигену ВЛ - ПКС р24, смесь солевая агаровая (ССА), разбавитель смеси солевой
агаровой - ССА.
Метод основан на обнаружении в сыворотке крови животных
специфических преципитирующих антител к антигенам вируса лейкоза крупного
рогатого скота. Специфические антитела появляются в крови через 2-8 недель
после заражения животного ВЛКРС и сохраняются в организме пожизненно.
Серологическому исследованию на лейкоз подвергают животных в возрасте 6 месяцев
и старше. Пробы крови для исследований берут не ранее чем через 30 суток после
введения животным вакцин и аллергенов, у стельных животных - за 30 суток до
отела или через 30 суток после него.
Сыворотку для исследования получают из крови испытуемого
животного в количестве 2-3 мл и направляют в лабораторию с сопроводительным
документом, в котором указывают название хозяйства, номер (кличку), возраст,
пол, породу животного.
Кровь берут в бактериологические пробирки "monovet". При невозможности
быстрого исследования подготовленные сыворотки хранят в замороженном состоянии.
Разбавитель ССА и солевую смесь агара переносят в колбу и
приливают дистиллированную воду, затем колбу помещают в водяную баню и
выдерживают до полного расплавления гранул агара. Расплавленный агаровый гель,
имеющий температуру 50-70° С, разливают слоем 2-3 мм (12-15 мл) в обезжиренные
чашки Петри и оставляют их приоткрытыми при комнатной температуре в течение 1
ч. После застывания агара специальным штампом-пробойником делают лунки в геле,
не допуская образования трещин между ними и отслоения агара от дна чашки. В
каждой чашке делают по четыре фигуры, каждая из которых состоит из семи лунок:
одна в центре, остальные по периферии. Диаметр каждой лунки составляет 7 мм,
расстояние между центральной и периферическими лунками - 3 мм.
Антиген, контрольные и испытуемые сыворотки вносят в лунки
каждой фигуры автоматическими пипетками со сменными наконечниками. Антиген (А)
вносят в центральную лунку, две диаметрально противоположные лунки заполняют
контрольной сывороткой (КС). Оставшиеся в фигуре 4 периферические лунки
заполняют испытуемыми сыворотками. Лунки заполняют доверху, не допуская
переливания жидкости через край. После заполнения всех лунок чашки Петри
закрывают крышками и инкубируют во влажной камере при температуре 22-27°С.
Реакцию учитывают не ранее, чем через 48 ч и не позднее, чем
через 96 ч. Чашки просматривают на темном фоне, направляя сфокусированный луч
осветителя на дно чашки под углом 30-45°. Специфичность реакции оценивают по
контрольной линии преципитата. Если она отсутствует или слабо выражена, то
реакцию следует повторить.
Специфическая линия преципитации, формируемая преципитирующей
контрольной сывороткой и антигеном, должна быть четкой, иметь форму прямой,
располагаться на одинаковом расстоянии от лунок с антигеном и контрольной
сывороткой.
Неспецифической считают линию преципитации, которая
образуется между лунками с испытуемой сывороткой и антигеном, но не сливается с
контрольной линией преципитации, а пересекает ее или упирается в нее, образуя
угол.
В зависимости от наличия специфических антител против
антигенов ВЛКРС в испытуемой сыворотке реакцию оценивают как положительную или
отрицательную. Положительной считают реакцию, если между лунками с антигеном и
испытуемой сывороткой образуется полоса преципитации, которая соединяется с
полосой преципитации контрольной сыворотки, образуя непрерывную линию, то есть
идентична ей (рис.1, поз.1):
· если линия преципитации между лунками с
испытуемой сывороткой и антигеном отсутствует, но контрольная линия
преципитирующей сыворотки образует вблизи лунки с испытуемой линией изгиб,
направленный в сторону лунки с антигеном (рис.1, поз.2) - слабо положительная
сыворотка;
· если контрольная линия значительно
укорочена со стороны лунки с испытуемой сывороткой и имеет размытый изгиб к
лунке с антигеном или образует линию преципитации, расположенную очень близко
от лунки с антигеном (рис.1, поз.2) - резко положительная сыворотка.
Положительно реагирующая сыворотка может образовывать вторую
линию преципитации, которая располагается ближе к лунке с испытуемой
сывороткой. Эта линия указывает на наличие в сыворотке преципитирующих антител
против второго антигена (р24) ВЛКРС (рис.1, поз.3).
При образовании толстой, короткой, без загибов контрольной
линии преципитации, не доходящей до лунки с испытуемой сывороткой, необходимо
провести раститровку этой испытуемой сыворотки физраствором до получения
результата, который можно будет оценить как отрицательный, положительный или
неспецифический. Для этого необходимо физиологический раствор в объеме 100-500
мкл разлить в пробирки или в лунки стандартных пластиковых плат для постановки
серологических реакций (количество пробирок или лунок соответствует числу
необходимых разведении). В первую пробирку или лунку с физраствором внести
такой же объем сыворотки, тщательно перемешать и перенести той же пипеткой в
том же объеме в следующую пробирку или лунку, затем после перемешивания - в
следующую и т.д. В результате в первой пробирке или лунке испытуемая сыворотка
разведена в 2 раза, во второй - в 4 раза, в третьей - в 8 раз и т.д.
Реакцию считают отрицательной, если контрольная линия
продолжается до лунки с испытуемой сывороткой без загиба (рис.1, поз.4). В
случаях, когда линия преципитации плохо просматривается или имеется зона
опалесценции вокруг лунок, реакцию следует переставить.
Сдвиг контрольной линии преципитации в сторону лунки с
антигеном или с контрольной сывороткой указывает на нарушение соотношения
антигена и антител в тест-системе. В этом случае необходимо использовать
другую серию диагностического набора.
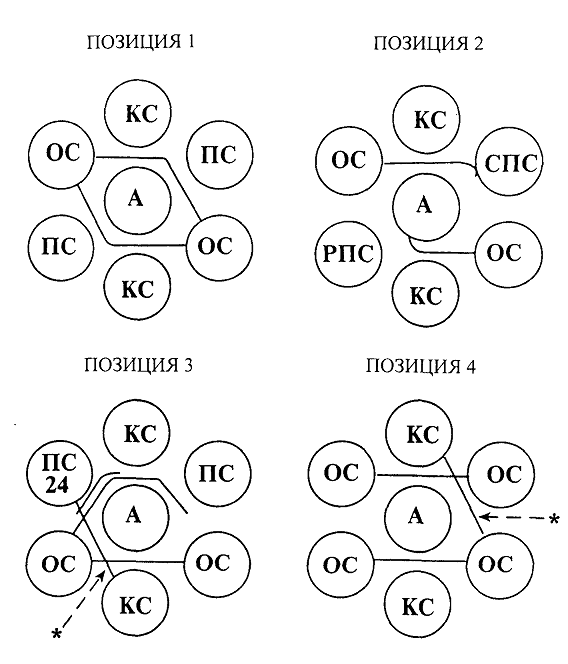
Рис.1 Результаты реакции антигена ВЛКРС с отрицательной (ОС),
положительной (ПС), слабоположительной (СПС), резко положительной (РПС) и
положительной с антителами к р24-антигену испытуемыми сыворотками в РИД. (* -
неспецифические линии преципитации)
3. Использование
ДНК-анализа в системе противолейкозных оздоровительных мероприятий у крупного
рогатого скота
С целью экспериментального подтверждения возможности снижения
количества инфицированных телят при 100 % инфицированности матерей был
поставлен эксперимент 1.
В хозяйствах ОАО "Племзавод им. Чапаева В. И."
Динского района и ЗАО АФП "Нива" Каневского района Краснодарского
края выделили по одной группе глубокостельных коров. Каждая группа состояла из
27 животных положительно реагировавших в РИД. После отёла у матери и телёнка
брали пробы крови, которые исследовали с использованием ПЦР. Процедуру
повторяли каждые полтора месяца до достижения телятами возраста 6 месяцев.
Полученные данные приведены в таблице 1.
Таблица 1. Динамика выявления инфицированных провирусом ВЛКРС
телят в зависимости от возраста
|
Хозяйство
|
Инфицировано
телят, %
|
|
|
При рождении
|
1,5 мес.
|
3 мес.
|
4,5 мес.
|
6 мес.
|
|
ОАО
"Племзавод им. Чапаева В.И. "
|
0
|
3,7
|
3,7
|
3,7
|
3,7
|
|
ЗАО АФП
"Нива"
|
0
|
7,4
|
7,4
|
7,4
|
7,4
|
Последнее ПЦР исследование совмещали с плановым
серологическим исследованием. По результатам первого исследования (при
рождении) среди телят не было выявлено ни одного носителя провирусной ДНК.
Вирусоносители в каждой из групп появились по результатам второго исследования.
Важно отметить, что в указанных выше хозяйствах животные
после рождения содержаться в индивидуальных домиках, выпаиваются молоком от
РИД-отрицательных коров-кормилиц. При обнаружении инфицированных телят, их
изолируют от здоровых. РИД - исследования в 6 месяцев дали положительный
результат именно у ПЦР-положительных телят. Таким образом, уровень
инфицированности удалось остановить на 3,7 - 7,4 % рубеже при 100%
инфицированности матерей.
Эксперимент 2 противоположный первому был поставлен в
хозяйстве ООО СК "Октябрь" Калининского района. Здесь телята после
рождения содержаться групповым способом, выпаиваются молоком и молозивом от
РИД-позитивных матерей, при достижении ими 1,5 месячного возраста их помещают
на телочную ферму, где так же содержат группами. Опытная группа состояла из 30
телят. Первое ПЦР исследование было проведено в 1,5 месяца, при поступлении на
тёлочную ферму и дало 23,3 % положительных результатов. Второе исследование
проводилось в 5 месяцев и было получено еще 10, 3 % положительных результатов.
По результатам последнего шестого ПЦР исследования количество зараженных
животных в опытной группе составляло 50% (Таблица 2).
Таблица 2 - Использование метода ПЦР для раннего выявления
вирусоносителей в ООО СК "Октябрь"
|
Хозяйство
|
Количество
инфицированных телят, %
|
|
|
1,5 мес
|
5 мес
|
6 мес
|
|
ООО СК
"Октябрь"
|
23,3
|
35
|
50
|
Таким образом, эффективность метода ПЦР при данной технологии
выращивания молодняка оказалась низка.
Для эффективного использования метода ПЦР в диагностике
лейкоза крупного рогатого скота оказываются критичными два условия:
индивидуальное содержание и выпойка молозивом от РИД-отрицательных животных.
Так при совместном содержании телят в ранние периоды жизни происходит их
контактное заражение вызванное общими поилками, кормушками, сосательным
рефлексом. Несформированный активный и пассивный иммунитет способствует
быстрому распространению инфекции. А выпойка молозивом от инфицированных
матерей увеличивает долю ложноотрицательных результатов в ПЦР, так как вместе с
таким молозивом в организм теленка поступает большое количество антител,
которые снижают уровень провирусной ДНК ниже порога чувствительности ПЦР.
Были проведены исследования по выявлению носительства
провируса ЛКРС у группы РИД - позитивных животных. Группа животных состояла из
30 особей в возрасте от 6 до 8 месяцев. Первое ПЦР исследование в этой группе
выявило 1 вирусоносителя (3, 3%), второе (через 3 недели) - 8 вирусоносителей
(26,6%), третье (ещё через неделю) - 16 вирусоносителей (53,3%). Причем 2
вирусоносителя, выявленные во втором исследовании, дали отрицательный результат
в третьем ПЦР исследовании. РИД, проведённый после третьего ПЦР исследования,
дал на 3 положительных результата меньше (10%), чем при первом РИД исследовании
(Таблица 3).
Таким образом, нельзя противопоставлять результаты ПЦР и РИД
- диагностики у животных в возрасте старше 6 месяцев, так как каждый из видов
диагностики имеет свою точку приложения (в первом случае отслеживает динамику
наличия провирусной ДНК, а во втором - антител) и в любой момент времени может
дать ложноотрицательный результат.
Таблица 3 - Динамика выявления вирусоносителей методом ПЦР в
группе РИД-позитивных животных.
|
N
|
Количество
зараженных животных при 1-ом ПЦР-исследовании
|
Количество
зараженных животных при 2-ом ПЦР-исследовании
|
Количество
зараженных животных при 3-ем ПЦР-исследовании
|
|
30
|
1
|
8
|
16
|
|
%
|
3,3
|
26,6
|
Судя по всему, выработка антител динамически процесс более
плавный, а колебания уровня провирусной ДНК происходят с более высокой
частотой.
Подобный вывод подтверждает ещё один эксперимент. Исследование
проводилось на крови взятой олновременно на РИД и ПЦР у коров (n=30), ранее давших
положительную реакцию в РИД. Отмечено сокращение реагирующих в РИД) животных на
7 голов (на 23%). Из РИД позитивных животных, положительный сигнал в ПЦР дали
19 голов (63%). Из 7 животных отрицательно реагирующих в РИД дали положительный
ПЦР результат 5 животных (70%). При использовании совместно (при одновременном
взятии крови на РИД и ПЦР) удалось выявить 28 инфицированных животных (93%).
Таким образом, погрешность метода РИД в проведённом исследовании составила -
23%, погрешность метода ПЦР - 37%, а при совместном одновременном использовании
обоих методов - 7% (Таблица 4).
Таблица 4 - Выявление вирусоносителей при совместном
использовании РИД и ПЦР в группе РИД-позитивных животных.
|
N
|
Количество
РИД-позитивных животных
|
Количество
зараженных животных выявленных при ПЦР-исследовании
|
Количество
РИД-отрицательных животных давших положительный результат в ПЦР
|
Количество
зараженных животных выявленных при совместном РИД и ПЦР исследовании
|
|
30
|
23
|
19
|
5
|
28
|
|
%
|
76,6
|
63,3
|
70
|
93
|
Так для эффективного выявления инфицированных можно
многократно исследовать животных в РИД, каждый раз изолируя положительно
реагирующих, а можно сократить количество исследований до 2 раз, проводя одновременно
РИД и ПЦР исследования.
Заключение
По результатам работы сделаны следующие выводы:
. При использовании метода ПЦР в ранней диагностике лейкоза
крупного рогатого скота значительно снижает уровень инфицированности телят при
100% инфицированности матерей.
. Метод ПЦР наиболее эффективен при индивидуальном содержании
телят, изоляции инфицированных животных от здоровых, выпойке молозивом от
здоровых коров и в возрасте около 1,5 месяцев от рождения.
3. Нельзя противопоставлять результаты ПЦР и РИД - диагностики
у животных в возрасте старше 6 месяцев, так как каждый из используемых методов
отражает свой определенный процесс в организме инфицированного животного: ПЦР
отслеживает уровень провирусной ДНК, а РИД - количество антител. Так как эти
показатели динамичны, то в любой момент времени может возникнуть
ложно-отрицательный результат.
. Погрешность метода РИД в проведённом исследовании составила
- 23%, погрешность метода ПЦР - 37%, а при совместном одновременном
использовании обоих методов - 7%. Для эффективного выявления провирусной ДНК
можно многократно исследовать животных в РИД, каждый раз изолируя положительно
реагирующих, а можно сократить количество исследований до 2 раз, проводя,
одновременно РИД и ПЦР исследования.
Список
использованых источников
1. Авилов
В.М. Нахмансон В.М. Проблемы оздоровления крупного рогатого скота от лейкоза //
Ветеринария. 1995. № 11. С.3-6.
2. Альштеин
А.Д. Подходы к созданию генно-инженерной вакцины против лейкоза на основе
вируса осповакцины // Тез. докл. II международной научн. конф.: Биотехнология в
животноводстве и ветеринарии. М., 2000. С.149 - 151.
. Апалькин
В.А. Гулюкин М.И., Петров Н.И. Лейкоз крупного рогатого скота. СПб. 2005.106 с.
. Барышников
П.И. Ветеринарная вирусология. Барнаул. 2006.116 с.
. Берзяк
А.Г. Ковалючко В.С., Гротевич В.С., Киричук Л.И. Опыт ускоренного оздоровления
племенного хозяйства от лейкоза // Ветеринария. 1990. №12. С.13-15.
. Белов
А.Д. Рогожина Г.В. О патогенезе лейкозов крупного рогатого скота //
Ветеринария. 1997. № 12. С.16 - 19.
. Белявская
В.А. Возможности и ограничения использования ПЦР в диагностике и
генотипировании вируса лейкоза крупного рогатого скота // Сб.: Актуальные
вопросы зоотехнической науки и практики как основа улучшения продуктивных
качеств и здоровья сельскохозяйственных животных. Ставрополь. 2003. С.275 -
278.
. Блинов
В.А., Пилипченко О.В. Глюконеогенная функция печени у коров, поражённых
лейкозом // Ветеринария. 2007. № 11. С.27-29.
. Бурба
Л.Г. Кунаков А.А. Диагностика лейкозов сельскохозяйственных животных. М.,
1983.191 с.
. Галлеев
Р.Ф. Вирус лейкоза КРС (культуральные, инфекционные и иммунологические
свойства). Уфа. 1999.147 с.
. Галлеев
Р. Ф Хусаинов Р.Ф. Лейкоз крупного рогатого скота. Уфа. 2009.221с.
. Глазко
В.И. Доманский Н.Н., Созинов А.А. Современные направления использования
ДНК-технологий // Цитология и генетика. 1998. №5. С.80-93.
. Гулюкин
М.И. Симонян Г.А., Мироменко А. К Особенности противолейкозных мероприятий,
обеспечивающих высокую молочную продуктивность // Сборник научных трудов.
Екатеринбург. 2005. С.28-34.
. Гулюкин
М.И. Разработка эффективных мероприятий против лейкоза крупного рогатого скота.
// Ветеринария. 2002. № 12. С.3 - 8.
. Гулюкин,
М.И. Состояние и перспективы борьбы с лейкозом крупного рогатого скота //
Ветеринария. 1999. № 12. С.3 - 8.
. Деринов
А.Н., Овдиенко Н.П., Найманов А.Х. Псевдоаллергические реакции на туберкулин
при лейкозе КРС // Ветеринария. 2006. №-11.С. 20-23.
. Джапаралиев
Н.Т. Прохватилова Л.Б., Ломакин А.И., Аянот П.К. Применение серологических
методов и ПЦР для обнаружения вируса лейкоза крупного рогатого скота в образцах
крови, молока и носовых истечений // Достижения молодых ученых - в ветеринарную
практику (Материалы конференции молодых ученых). Владимир. 2000. С.127-131.
. Иванова
Л.А. Опыт применения иммуноферментного анализа для выявления антител к вирусу
лейкоза на заключительном этапе оздоровления. // Бюл. ВИЭВ. 1999. т.72.С.
202-209.
. Ковалюк
Н.В. Селекционно-генетический способ создания высокопродуктивного и устойчивого
к персистентному лимфоцитозу крупного рогатого скота // Ветеринарный
консультант. 2006. N°15. С.67-68.
. Ковалюк
Н.В., Сацук В.Ф., Мачульская Е.В. Современные методы диагностики лейкоза
крупного рогатого скота // Ветеринария Кубани. 2007. № 1. С 23 - 28.
. Коновалова
Е.Н. Сельцов В.И., Зиновьева Н. А Характеристика симментальского скота
различного происхождения с использованием ДНК-микросателлитов // Зоотехния.
2006. № 8. С.6-9.
. Коромыслов
Г.Ф. Шишков В.П. Основы профилактики и ликвидации лейкоза крупного рогатого
скота // Ветеринария. 1993. № 4. С.15-18.
. Костенко
Т.С. Практикум по ветеринарной микробиологии и иммунологии. М., 1989.272 с.
. Крикун
В.А. Лейкоз крупного рогатого скота и иммунологическая толерантность. //
Ветеринария. 2002. № 6. С.7-9.
. Кудряшов
А.А. Петров Н.И. Патологоанатомические изменения при лимфоидном лейкозе
крупного рогатого скота // Ветеринария. 1999. № 11. С.14-15.
. Лиманский
А.П. Лиманская О.Ю. Молекулярно - генетические методы - основа программ по
искоренению лейкоза крупного рогатого скота // Биотехнология. 2001. № 3.
С.40-50.
. Мадисон
В., Мадисон Л. Лейкоз: пустые страшилки или общегосударственная проблема? //
Животноводство России. 2006. №9. С.2-8.
. Макаров
В.В. Избранные вопросы общей эпизоотологии и инфектологии. М., 1999.224 с.
. Мальцева
Н.А. Развитие и внедрение новых биотехнологий при разработке диагностических и
профилактических приемов в сфере решения проблемы лейкоза КРС // Материалы II
региональной научной конференци "Студенческая наука - экономике
России" Северо-Кавказский государственный технический университет. 2004.
С.20 - 22.
. Нахмансон
В.М., Гулюкин М.И., Дун Е.А. Серологический метод диагностики в системе
противолейкозньгх мероприятий // Ветеринария. 1997. №3. С.7-10.
. Нахмансон
В.М., Дун Е.А. Эпизоотология лейкоза крупного рогатого скота и меры борьбы с
ним // Итоги науки и техники. 1990. С.146 - 149.
. Петров
Н.И. Диагностика и меры борьбы с лейкозом крупного рогатого скота. // Материалы
Всероссийского совещания-семинара. Брянск. 2004. С.104-106.
. Пономарёва
И. С, Сычева М.В., Поляков М.А., Нургалиева Р.М., Карташова О.Л. Эффективность
диагностики лейкоза крупного рогатого скота методами РИД, ИФА и ПЦР в
хозяйствах Оренбургской области // Современные наукоёмкие технологии: материалы
кконференции. 2010. Т 9. С 134.
. Прохватилова
Л.Б. Диагностика лейкоза КРС методом ПЦР // Вестник Российской академии
сельскохозяйственных наук. 1998. № 5. С.65 - 68.
. Прохватилова
Л.Б. Применение ПЦР для раннего обнаружения провируса лейкоза крупного рогатого
скота у экспериментально инфицированных животных // Ветеринария. 2001. № 8.
С.17 - 21.
. Свириденко
Г.М. Плюсы и минусы новой технологии // Молочная промышленность. 2003. С.10-15.
. Симонян
Г.А. Разработка и совершенствование оздоровительных противолейкозных
мероприятий // Ветеринария. 2007. № 7. С.3 - 7.
. Смирнова
В.Н. Ветеринарно - санитарная оценка мяса при лейкозе крупного рогатого скота
// Сб.: Актуальные вопросы диагностики, профилактики и борьбы с лейкозами
сельскохозяйственных животных и птиц. 2000. Екатеринбург. С.236 - 239.
. Смирнов
A. M. Борьба с лейкозом крупного рогатого скота - важнейший элемент системы
обеспечения ветеринарного благополучия российского животноводства // Сборник
научных трудов. Екатеринбург. 2005. С.5-9.
. Смирнов
Ю.П. Основные пути распространения лейкоза // Ветгазета. 1999. №4. С.3-4.
. Смирнов
П.Н. Храмцов В.В., Смирнова В. В Научные и практические основы оздоровления
стад от лейкоза КРС в Сибири // Сб.: Актуальные вопросы диагностики,
профилактики и борьбы с лейкозами сельскохозяйственных животных и птиц.
Екатеринбург. 2000. С.104 - 114.
. Стародуб
Н. Ф, Стародуб В.Н. инфекционный лейкоз крупного рогатого скота и методы его
диагностики // Bio polymer sand cell 2003 №4 С 307-316.
. Федоров
Ю.Н., Верховский O. A. Иммунодефициты домашних животных // М., 1996.96 с.
. Федотов
В.П., Иванов О.В., Иванова О.Ю. Лейкоз крупного рогатого скота в Ивановской
области // Ветеринария. 2007. № 5. С.23-25.
. Шубинский
Г.З., Лозовой В. П Функциональные свойства Т-лимфоцитов у больных хроническим
лимфолейкозом // Иммунология. 1990. N°4. С.62-65.
. Shanks,
R. D.milk and fat yields decline in bovine leukemia virus - infected Holstein
cattle with persistent lymphocytosis / Shanks R. D., Steward J. A., Levin H. A.
// Agricultural Sciences. 1993. V.90. № 6. Р.6538 - 6541.
GP51
5΄LTR gag pro pol
env pX BL 3΄LTR - длинные концевые
повторы (long terminal repeat);
gag - ген, кодирующий белки сердцевины (определяет
группоспецифический антиген);
pro - ген, кодирующий протеазу;
pol - ген, кодирующий обратную транскриптазу;
env - ген, кодирующий белки оболочки;
pX BL - область, кодирующая Tax и Rex.
Рисунок А.1 - Схема организации генома ВЛКРС
Приложение Б
Диаграмма ПЦР
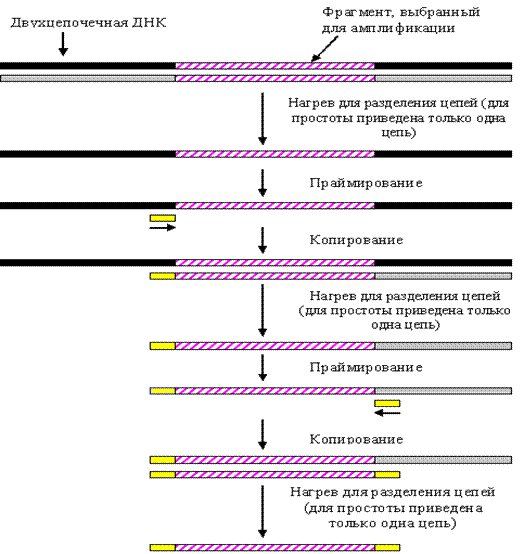
Рисунок Б.1 - Диаграмма ПЦР