Борьба с инфекционной бурсальной болезнью кур
Министерство
сельского хозяйства и продовольствия Республики Беларусь
Витебская
государственная академия ветеринарной медицины
Курсовая
работа
Борьба с
инфекционной бурсальной болезнью кур
Витебск -
2011 г.
Общие сведения о болезни
Инфекционная бурсальная болезнь (ИББ, болезнь Гамборо, инфекционный
бурсит кур) - высококонтагиозная вирусная малоизученная болезнь цыплят
2-15-недельного возраста, характеризующаяся поражением бурсы Фабрициуса,
явлениями нефрозо-нефрита, внутримышечными геморрагиями и диареей. Болезнь,
впервые зарегистрированная в округе Гамборо (шт. Делавэр, США) в 1957 году,
получило широкое распространение во многих странах Америки, Азии, Африки, в том
числе и в странах СНГ. С 1991 года заболевание регистрируется и в Республике
Беларусь.
Инфекционная бурсальная болезнь распространена преимущественно в
птицеводческих хозяйствах промышленного типа. Причиной этому считают постоянный
импорт птицы. Чаще поражаются птицы 3-6-недельного возраста. Сообщалось о самых
ранних ее вспышках среди 11-дневных цыплят и самых поздних - в возрасте 84
дней. Заболеваемоть достигает 100%, летальность в среднем составляет 20-40%.
Источником заражения служит больная и переболевшая птица, основной путь
распространения вируса - аэрогенный. Факторы передачи: продукты убоя птицы,
загрязненные корма, вода, одежда и обувь обслуживающего персонала. Различают
острое, подострое и хроническое течение болезни. При заражении цыплят
3-6-недельного возраста болезнь, как правило, протекает остро и подостро. При заболевании
цыплят до 3-недельного возраста, не содержащих материнских антител, развивается
латентная (субклиническая) форма болезни.
Экономический ущерб, наносимый болезнью, обусловлен гибелью цыплят,
снижением прироста массы тела, возрастанием процента браковки птиц и тушек.
Вирус обладает выраженным иммунодепрессивным действием, избирательно поражающим
один из центральных органов иммунной системы птиц - Фабрициеву бурсу. В
результате снижается эффективность проводимых вакцинаций против инфекционного ларинготрахеита,
ньюкаслской болезни, инфекционного бронхита, болезни Марека, активизируются
секундарные инфекции.
У большинства цыплят, зараженных вирусом инфекционной бурсальной болезни,
отмечаются признаки поражения печени, а при бактериологическом исследовании
органа выделяют возбудителя сальмонеллеза. Экономические потери в
неблагополучных по ИББ хозяйствах значительно увеличиваются из-за проявления
осложнений: нередко наблюдают дерматит с обширными некротическими поражения
перьевых фолликулов и кожного покрова в области спины и крыльев, гепатит и
некротический энтерит, повышается заболеваемость цыплят колибактериозом,
болезнью Марека, эймериозом. Опасность иммунодеппрессии данного вируса состоит
не только в снижении иммунной реакции организма птиц, но и в том, что
вырабатывающиеся к разным антигенам антитела в период болезни и после нее в
функциональном отношении неполноценны.
Вирус инфекционной бурсальной болезни
Вирус впервые открыт и описан как самостоятельный возбудитель в 1962
году. По современной классификации его относят к семейству Birnaviridae.
Устойчивость. Вирус устойчив к эфиру, хлороформу и УФ - облучению. При
температуре +56°С сохраняется 5 ч., при +60°С - 30 мин., а при 30°С в
присутствии 0,5% фенола - в течение 1 ч. При воздействии 0,5% раствора
формалина инактивируется за 6 ч., препаратами йода - за 2 мин., 0,5% хлорамином
- за 10 мин.
Антигенные вариабельность и родство. Выявлено 2 серотипа вируса: Сu- 1 (содержит белки VP- 1, VP- 2, VP- 3,
VP- 4 и VPX), выделенный от цыплят, и 23/82 (содержит белки VP- 1, VPX, VP- 3
и VP- 4), выделенный от индюшат.
Антигенное родство этих серотипов не превышает 10-30%.
Спектр патогенности. В естественных условиях вирусом ИББ поражаются куры всех
пород, но наиболее тяжело переболевают цыплята породы белый леггорн. Наиболее
чувствительна птица в возрасте 3-6 нед. При заражении кур-несушек, а таже
1-10-дневных цыплят не отмечается симптомов болезни.
Локализация вируса. На 3- й день после экспериментального заражения 3- 5-
недельных цыплят вирус накапливается в Фабрициевой бурсе, селезенке и в более
низкой концентрации - в мозгу и крови. У однодневных цыплят через 3 дня после
инокуляции вируса отмечена его высокая концентрация в бурсе Фабрициуса, печени
и почках. При экспериметальном заражении цыплят вирус удается выделять в
течение 10 дней, однако патоморфологические изменения в бурсе Фабрициуса
сохраняются в течение 10 недель после заражения.
Антигенная активность. Уже на 21-й день после заражении вирусом цыплят
3-5-недельного возраста в сыворотке крови обнаруживают вируснейтрализующие (в
титрах до 1:718) и преципитирующие антитела (в титрах до 1:640). Антитела у
кур-несушек передаются потомству трансовариально. В сыворотке крови цыплят,
полученных от иммунных кур, специфические противовирусные антитела
обнаруживаются в течение 3-4 недель после вылупления.
Экспериментальная инфекция. Экспериментальное заражение
производят на 20-30-дневных цыплятах инокуляцией вирусного материала на
коньюнктиву, а также перорально. Заражение сопровождается развитием у птиц
клинических признаков и патомофологических изменений, характерных для этой
болезни.
При интраперитонеальном и интрацеребральном заражении 1-3-дневных белых
мышей штаммом Becht отмечали зуд, атаксию, кому, а в
головном мозгу - негнойный лимфоцитарный энцефалит. Возможно интрацеребральное
заражение крыс и хомяков.
Заражение вирусом индеек сопровождается образованием вируснейтрализующих
и преципитирующих антител при отсутствии клинических признаков болезни. Голуби,
гуси, перепела и утки не восприимчивы к данной инфекции.
Культивирование. Вирус культивируют в куриных эмбрионах (КЭ), свободных от
материнских антител, при заражении их в аллантоисную полость или на
хорион-аллантоисную оболочку. Гибель эмбрионов наступает на 3-8-й день после
заражения.
Вирус хорошо репродуцируется в культуре почечных клеток куриного
эмбриона, вызывая на 3-5-й день после заражения ЦПД. В культуре фибробластов КЭ
вирус образует бляшки. Показана возможность культивирования вируса в
перевиваемой культуре клеток МА-104, Vero.
Гемагглютинирующие свойства. В обычных условиях, без
предварительной специальной обработки, вирус не обладает гемагглютинирующими
свойствами.
Патогенез
Патогенез инфекционной бурсальной болезни изучен недостаточно полно.
Установлено, что клетками-мишенями для репродукции вируса являются лимфоциты
Фабрициевой бурсы цыплят. Высокочувствительными к вирусу оказались В-лимфоциты,
несущие на поверхности иммуноглобулины класса М. Вирус обладает выраженным
цитопатическим действием, вызывая некроз лимфоидных узелков и воспалительные
процессы в интерстициальной ткани бурсы Фабрициуса. Гибель большого количества
лимфоидных элементов обуславливает развитие вторичного иммунодефицита у
переболевшей птицы.
Показано также, что латентное течение ИББ сопровождается явлениями атрофии
и делимфатизации бурсы Фабрициуса на фоне отсутствия или очень слабого
проявления воспалительной микро- и макрофагальной реакции в интерстиции органа.
Эта форма болезни также характеризуется развитием иммунодепрессивного состояния
у цыплят, связанного с явлениями некроза В-лимфоцитов.
Морфологически некроз лимфоцитов выявляется явлениями кариопикноза,
кариорексиса, вакуолизации цитоплазмы с формированием апоптотических телец.
Апоптоз, в отличие от некроза, не вызывает выраженной воспалительной реакции.
Явления некроза В-лимфоцитов у цыплят при субклинической форме болезни Гамборо
обнаруживаются не только в бурсе Фабрициуса, но и в селезенке, цекальных
миндалинах и периферической крови.
Патогенез болезни также зависит от воздействия иммунных комплексов,
циркулирующих инфицированных лимфоцитов. Кровоизлияния в скелетных мышцах,
печени и других органах обусловлены повреждением стенки кровеносных сосудов.
Присутствие уратов в почках и увеличение содержания в крови мочевой кислоты
свидетельствуют о поражении почек. Повышение активности лактатдегидрогеназы и
глутаматооксалаттрансаминазы сыворотки крови подтверждают поражение печени.
Клинические признаки
Инкубационный период инфекционной бурсальной болезни короткий. При
экспериментальном заражении цыплят клинические признаки появляются через 2-3
дня. Болезнь может протекать остро, подостро и латентно, в зависимости от
иммунного статуса поголовья. В чувствительных к болезни группах, как правило,
уровень заболеваемости может достигать 100%. При остром течении болезнь длится
обычно 4-8 дней.
Характерным симптомом ИББ является диарея, сопровождающаяся выделением
водянистого беловато-желтого помета. У больных цыплят наблюдают депрессию, а в
более поздней стадии - дрожание головы и шеи, коматозное состояние. Заболеваемость
и смертельность быстро нарастают и достигают максимума на 3-4-й день болезни.
Отличительными признаками болезни являются внезапность и высокая
заболеваемость, быстрое выздоровление поголовья. Летальность может достигать
20-40%. В последующих выводах цыплят повторяющиеся время от времени вспышки
протекают менее тяжело и часто проходят незамеченными.
В последние годы значительно увеличилось число вспышек болезни Гамборо,
протекающей латентно. При этом инфицирование цыплят ведет к развитию
иммунодефицитного состояния у птиц вследствие некроза В-лимфоцитов. В
результате снижается эффективность проводимых вакцинаций против ряда вирусных
болезней. Отмечаются вспышки хронических респираторных болезней, приводящих к
развитию синдрома опухания головы. Из пораженных тканей часто выделяют
сапрофитную микрофлору: кокки, псевдомонады и др.
Патоморфологические изменения
Трупы павших цыплят обычно хорошо упитаны. При вскрытии отмечают признаки
обезвоживания и анемии. Зоб пустой. Ярко выражены и весьма закономерны изменения
в бурсе Фабрициуса, поражения которой обнаруживаются и в случаях бессимптомной
инфекции. Орган увеличен в 1,5-2,5 раза. Серозная оболочка серо-желтого цвета.
Слизистая оболочка отечна, покрасневшая, с кровоизлияниями. В просвете бурсы
между складками слизистой оболочки обнаруживают серозно-фибринозный экссудат, в
тяжелых случаях - геморрагический экссудат и сыроподобные сгустки фибрина.
Отмечают атрофию тимуса, аплазию красного костного мозга, пищеводной и
слепокишечных миндалин, серозно- геморрагическое воспаление селезенки.
В грудных мышцах, с медиальной стороны бедер и крыльев обнаруживают
точечные и пятнистые кровоизлияния. Печень может быть слегка увеличена, на
поверхности видны следы от ребер. Почки увеличены, от светло-серого до
темно-коричневого цвета, с четким рисунком канальцев и мочеточников,
заполненных уратами. Кроме того, отмечают катаральный энтерит, геморрагии в
слизистой оболочке железистого желудка и в цекальных миндалинах.
При гистологическом исследовании Фабрициевой бурсы в начальный период
отмечают некроз лимфоцитов, а затем и ретикулярной стромы с образованием в
большинстве лимфоидных узелков некротического детрита. Могут выявляться
атрофированные узелки, железистые структуры и кисты. В тимусе в начале болезни
наблюдают делимфотизацию коркового слоя, обеднение лимфоцитами мозговой зоны с
одновременным увеличением в ней числа и размеров телец Гассаля и гиперплазией
ретикулярных клеток. В красном костном мозге обнаруживается уменьшение общего
числа клеточных элементов, активизация макрофагальной реакции. В селезенке
больных цыплят выявляют некроз отдельных лимфоцитов в периартериальных муфтах
(Т-лимфоциты) и лимфоидных узелках (В-лимфоциты), гиперемию сосудов красной
пульпы, микро- и макрофагальную реакции. Аналогичные изменения обнаруживаются в
эзофагальной и слепокишечных миндалинах.
Патологоанатомический диагноз:
1. Серозно-геморрагическое или
фибринозно-некротическое воспаление бурсы Фабрициуса.
2. Серозно-геморрагическое воспаление
селезенки.
3. Атрофия тимуса, костного мозга, пищеводной
и слепокишечных миндалин.
4. Точечные и пятнистые кровоизлияния в
мышцах бедер и крыльев (с медиальной стороны), в серозных покровах.
5. Зернистая дистрофия печени и почек,
переполнение уратами мочеточников.
6. Серозно-фибринозный перикардит, аэросаккулит,
плевроперитонит, перигепатит (осложнение).
7. Гисто: тотальный некроз лимфоцитов в
бурсе Фабрициуса, тимусе и селезенке, серозно-воспалительный отек
интерстициальной ткани, инфильтрация гистиоцитами и псевдоэозинофилами при
остром и подостром течении; атрофия и обеднение лимфоцитами бурсы Фабрициуса,
тимуса, селезенки, эзофагальной и цекальных миндалин, отсутствие микро- и
макрофагальной реакции при латентном течении болезни.
Диагностика
Диагностика инфекционной бурсальной болезни осуществляется с учетом
эпизоотологических данных, клинических симптомов, патоморфологических
изменений, а также комплекса лабораторных исследований. Следует учитывать, что
данная болезнь трудно выявляется, маскируется другими инфекциями и лишь при
типичном течении диагностируется по клиническим признакам и данным
патологоанатомического вскрытия. Поэтому на ранней стадии болезни и при
латентном течении необходимо проведение лабораторных исследований.
Лабораторная диагностика ИББ включает выделение вируса на развивающихся SPF-куриных эмбрионах (КЭ) или в
культуре фибробластов эмбрионов кур (ФЭК), его идентификацию в реакции
нейтрализации (РН) и реакции иммунодиффузии (РИД), постановку биопробы на
чувствительных цыплятах, выявление вирусного антигена реакцией иммунофлюористенции
(РИФ), реакцией торможения непрямой гемагглютинации (РТНГА), реакцией
агглютинации латекса (РАЛ), электронной микроскопией, реакцией встречного
иммуноэлектрофореза, а также обнаружение специфических антител в РН, РИД, ВИЭФ,
реакции непрямой гемагглютинации (РНГА), иммуноферментном анализе (ИФА) и
проведение гистологических исследований.
Отбор патологического материала. От 5-10-ти трупов павших или убитых с
диагностической целью больных цыплят отбирают бурсу Фабрициуса, селезенку,
печень, почки. Органы помещают в чистые, сухие, стерильные пенициллиновые
флаконы. Материал помещают в термос со льдом и хранят его до отправки в
лабораторию.
Для серологического исследования отправляют парные пробы (25-30)
сывороток крови больных птиц, взятые с интервалом в 21 день. Полученные
сыворотки помещают в чистые, сухие, стерильные пенициллиновые флаконы под
резиновыми пробками, помещают в термос со льдом.
Направляемый в лабораторию материал снабжается сопроводительным письмом.
В лаборатории материал хранят в замороженном состоянии или заливают 50%- ным
водным раствором глицерина.
В лаборатории кусочки патологического материала гомогенизируют на 0,01 М
фосфатно-солевом буфере (рН=7,2) или мясопептонном бульоне в соотношении 1:10,
трижды замораживают и оттаивают с последующим центрифугированием в течение 30
минут при 5000 об./мин. К надосадочной жидкости добавляют 100 ЕД/мл пенициллина
и 0,1 мг/мл стрептомицина, выдерживают в течение 12 часов при 4°С, проверяют на
стерильность.
Выделение вируса на куриных эмбрионах. Для выделения и титрации возбудителя
используют SPF-эмбрионы 9-суточного возраста в
количестве не менее 10. Приготовленный гомогенат в количестве 0,2 мл наносят на
хорион-аллантоисную оболочку или в аллантоисную полость эмбриона. В контроле
оставляют 5- 10 незараженных эмбрионов.
Гибель куриных эмбрионов в течение первых суток считают неспецифичной.
При наличии в исследуемом материале вируса гибель КЭ наступает на 3-5 сутки.
Погибшие эмбрионы вскрывают для обнаружения специфических патологоанатомических
изменений. Хорион-аллантоисная оболочка (ХАО) отечная. Отмечают отставание в
росте и развитии, наличие серозно- геморрагических отеков кожного покрова в
области головы, шеи, конечностей и брюшной стенки. В легких обнаруживают
застойную гиперемию и отек легких, некротический нефроз, зернистую дистрофию
миокарда, увеличение печени и селезенки. Фабрициева бурса обычно не поражается.
От павших эмбрионов с задержкой в росте и выраженными
патоморфологическими изменениями отбирают аллантоисную жидкость и ХАО в стерильные
пробирки и проверяют на стерильность путем посева 0,2 мл жикости на МПА и МПБ.
Принадлежность выделенного агента к вирусу болезни Гамборо определяют путем
постановки РН и РИД.
Заражение культур клеток. Для изоляции вируса используют 24-48-часовые культуры
фибробластов КЭ. Срок наступления ЦПД зависит от дозы вируса и числа пассажей.
При первичном его выделении специфические изменения наблюдаются после 2-3
пассажей вируссодержащего материала. ЦПД проявляется через 48-72 часа после
заражения культуры клеток и характеризуется вакуолизацией и округлением клеток,
явлениями кариопикноза и кариолизиса. Специфичность цитопатических изменений
подтверждают постановкой РН.
Биопроба на цыплятах. Для заражения используют 21-дневных SPF- цыплят или 35-40-дневную птицу из промышленного
стада с хорошо развитыми Фабрициевыми бурсами. Для этого из общего количества
цыплят, предназначенных для биопробы, произвольно вылавливают 5-10 голов,
убивают, определяют индивидуальные абсолютные массы тела и бурсы, выводят
бурсальный индекс (БИ) по формуле:
БИ
=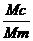 × 1000,
× 1000,
где
Мс - масса Фабрициевой бурсы (г),
Мт
- масса тела птиц
Цыплят,
в стаде которых индекс бурсы 4 и выше, используют для постановки биопробы.
Заражение цыплят с индексом ниже 4 не вызывает острого течения болезни.
Определение бурсального индекса имеет важное диагностическое значение, так как
у зараженных цыплят отмечается снижение данного показателя в 3- 9 раз.
Перед
заражением у отобранных для биопробы 10-20 птиц отбирают пробы сыворотки крови
для серологического исследования (РИД, РН, РНГА, ИФА) на наличие антител к
вирусу болезни Гамборо. Исследуемый материал вводят интраназально в дозе 0,5
мл.
Биопробу
считают положительной, если у зараженных цыплят через 2-5 суток развиваются
характерные клинические признаки болезни (диарея, обезвоживание, общее
угнетение, грязно-серый перьевой покров). При вскрытии больной и переболевшей
птицы отмечают характерные патологоанатомические изменения.
Через
15 дней после заражения у оставшихся в живых цыплят проводят повторное
серологическое исследование сыворотки крови для выделения диагностического
(4-кратного) увеличения титра специфических антител и затем их убивают с целью
установления патологоанатомических изменений.
Реакция
нейтрализации. Ее используют для
идентификации вируса болезни Гамборо и для обнаружения специфических
противовирусных антител. Реакцию ставят на куриных эмбрионах. В ней используют
нормальную и специфическую гипериммунную сыворотки, а в качестве антигена
выделенный на КЭ вирус. Перед постановкой реакции сыворотки инактивируют в
водяной бане при +56°С (30 мин), после чего в них добавляют пенициллин (1000
ЕД/ мл) и стрептомицин (1мг/мл).
Гипериммунную
и нормальную сыворотки разливают сухими стерильными пипетками по 0,5 мл в
стерильные пробирки. Затем в каждую из них по 0,5 мл испытуемого антигена в
разведениях от 10-1 до 10-9. После встряхивания пробирки
выдерживают при +37°С в течение 30 минут. Полученные смеси в дозе 0,2 мл вводят
в аллантоисную полость 9- суточных эмбрионов. Дважды в сутки проводят
овоскопию. Павшие эмбрионы вскрывают. На 10-й день для выявления специфических
изменений в органах и тканях все эмбрионы вскрывают. Результаты РН выражают
индексом нейтрализации, который определяют по общепринятой методике. Реакция
считается положительной, если разница в титрах с нормальной и гипериммунной
сыворотками составляет 2 lg и более.
Реакция
иммунофлюоресценции. Является
методом экспресс- диагностики, так как позволяет установить диагноз в течение
2-3 часов с момента доставки патологического материала.
Из
бурсы Фабрициуса павших или убитых с диагностической целью птиц на тонких,
сухих, обезжиренных предметных стеклах готовят мазки-отпечатки (не менее 3),
фиксируют 10-20 минут в ацетоне, дважды отмывают в двух сменах 0,01 М фосфатно-
солевого буфера (рН=7,2-7,4), затем высушивают и окрашивают по общепринятой
методике. Контрольные мазки- отпечатки готовят из бурсы здоровых цыплят.
Реакцию
считают положительной, если на всех препаратах обнаружено не менее 3-х
лимфоцитов со специфическим ярко- зеленым свечением антигена в цитоплазме
(мелкие гранулы или диффузный ореол вокруг ядра).
Кроме
мазков- отпечатков для РИФ можно исследовать криосрезы бурсы Фабрициуса. Для
этого орган замораживают в петролейном эфире, охлажденном до минус 76°С в смеси
ацетона и сухого льда. Затем их примораживают к блоку микротома. Срезы готовят
толщиной 4-5 мкм.
Реакция
торможения непрямой гемагглютинации. Данная
методика может применяться для индикации вирусного антигена в патологическом
материале, а также идентификации вируса, выделенного в КЭ и КК.
Из
патологического материала от больных и павших птиц, хорион-аллантоисных
оболочек павших после заражения КЭ готовят гомогенат на стерильном 0,85%-ном
растворе натрия хлорида (рН=7,2-7,4) в соотношении 1:1. После трехкратного
замораживания и оттаивания гомогенат центрифугируют при 5000 об./мин. в течение
25 минут. Надосадочную жидкость сливают для исследования в РТНГА. Пробы
аллантоисных жидкостей используются в нативном виде после центрифугирования
15-20 минут при 3000 об./мин. Таким же способом готовят суспензии от
контрольных птиц и КЭ. Кроме того, используют специфическую иммунную сыворотку
к вирусу болезни Гамборо и положительный эритроцитарный антиген из набора
диагностикумов БелНИИЭВ для серологической диагностики данной болезни в РНГА.
РТНГА
ставят микрометодом с использованием микротитратора Такачи. При этом, в первый
ряд лунок панели готовят в объеме 0,025 мл двукратное разведение испытуемого
материала от 1:2 до 1:128. Для этого в каждую лунку вносят 0,025 мл 0,85%-ного
раствора натрия хлорида, содержащего 0,5% глицерина. В первую лунку вносят
0,025 мл испытуемого материала и, перемешивая, 0,025 мл переносят в другую
лунку и т.д. (до разведения 1:128. Во втором ряду таким же образом готовят
безвирусную суспензию. К каждому разведению обоих рядов добавляют 0,025 мл
иммунной сыворотки, разведенной на 1-2-кратных разведений меньше, чем ее
предельный титр в РНГА. Панель со смесями встряхивают и помещают в термостат на
60 мин. при 37°С. Учет реакции осуществляют после оседания эритроцитов.
Реакция
считается положительной, если в первом ряду с испытуемым материалом произойдет
торможение агглютинации в первых двух-трех лунках при условии полной
агглютинации второго ряда.
Реакция
агглютинации латекса используется для
индикации вирусного антигена. Патологический материал гомогенизируют в 0,01 М
фосфатно- солевом буфере (рН=7,2) в соотношении 1:1, трижды замораживают и
оттаивают. Вируссодержащую суспензию центрифугируют при 3000 об./мин. 30 минут.
Надосадочную жидкость сливают для постановки РАЛ.
Гипериммунную
сыворотку к вирусу ИББ получают иммунизацией цыплят инактивированной
масляно-эмульсионной вакциной. Из сыворотки выделяют гамма-глобулиновую фракцию
осаждением сульфатом аммония.
Реакцию
агглютинации латекса ставят на предметном стекле. На него наносят дозатором 25
мкл антигена в разведении от 1:2 до 1:512, добавляют 25 мкл латексного
антительного диагностикума и смешивают, плавно поворачивая. Результаты реакции
учитывают через 2-5-минут по трехбалльной системе: резко положительная реакция
(+++) - четкая агглютинация, крупные хлопья в прозрачной жидкости;
положительная (++) - агглютинация видна, однако фон полностью не просветляется;
отрицательная (-) - мутная гомогенная жидкость. Контролем служат смесь латекса
с 0,85%-ным раствором натрия хлорида (контроль диагностикума), с положительным
и отрицательным антигенами (положительный и отрицательный контроль).
Реакция
иммунодиффузии (РИД). Данная методика
широко используется как с целью индикации и идентификации вируса болезни
Гамборо, так и для определения специфических антител. При постановке РИД
используют наборы для диагностики болезни Гамборо ВНИВИП или ВНИИЗЖ.
В
лаборатории патологический материал взвешивают, добавляют эквивалентное
количество 0,85%-ного раствора натрия хлорида или дистиллированной воды,
гомогенизируют, промораживают и центрифугируют при 3000 об./мин. в течение 10
минут. Надосадочную жидкость сливают и используют для исследования в РИД.
Для
постановки реакции используют 1,25%-ный агар с 8% натрия хлорида и 0,5% фенола.
Чашки Петри заполняют за 24-72 часа до использования, предварительно растворяя
агар на пару и заливают по 20 мл в чашки. Слой агара должен быть не менее 3 мм.
Для
исследования проб используют линейный порядок расположения лунок. Делают 3 ряда
вертикальных лунок диаметром 5 мм, на расстоянии 5 мм. Агаровые пробки удаляют
иглой или пинцетом.
Каждую
пробу испытуемой диагностической сыворотки разводят физиологическим раствором
(0,85% раствор натрия хлорида) сначала 1:2, а затем последовательно двукратным
шагом до 1:256.
Сухие
эталонные антигены перед использованием растворяют дистиллированной водой или
0,85%-ным раствором натрия хлорида до объема 0,5 мл. Сухие диагностические
сыворотки сначала разводят дистиллированной водой в объеме, указанном на
этикетке, а затем готовят ряд последовательных двукратных разведений.
При
исследовании патологических материалов в центральный ряд лунок вносят
положительную сыворотку в рабочем разведении в 0,05 мл, а в периферические ряды
- нормальный, положительный (по 1 лунке) и исследуемые антигены в объеме 0,05
мл. При исследовании сывороток крови птиц, в центральный ряд лунок вносят
положительный антиген в рабочем разведении в объеме 0,05 мл, а в периферические
ряды - нормальный, положительный (по 1 лунке) и исследуемые сыворотки в
разведениях в объеме 0,05 мл.
После
заполнения лунок, чашки Петри помещают в термостат при температуре 37°С. Учет
реакции проводят через 24 и 48 часов после постановки реакции. Чашки
просматривают на темном фоне в направленном луче света. Реакцию учитывают
только при наличии линий преципитации между положительным антигеном и
положительной сывороткой в контроле и отсутствии линий преципитации между
положительным антигеном и нормальной сывороткой кур, а также положительной
сывороткой и нормальным антигеном.
За
положительный результат при исследовании патологических материалов на выявление
вирусного антигена принимают образование 1-2-х линий преципитации между лунками
с исследуемым материалом и положительной сывороткой, а при выявлении
противовирусных антител - наличие линий преципитации между лунками с
исследуемой сывороткой и положительным антигеном.
Встречный
иммуноэлектрофорез используют как с
целью индикации и идентификации вируса болезни Гамборо, так и для определения
специфических антител. Сущность методики заключается в одновременном движении в
агаре белковых молекул с различной электрофоретической подвижностью с
образованием преципитата из гомологичных антигенов и антител. Для постановки
ВИЭФ используют приборы ПЭФ-3, ЭФ-2 или аналогичных марок и набор
диагностикумов для постановки РИД. Реакцию ставят на стеклянных пластинах,
покрытых 1%-ным раствором агара на 0,85 М веронал-мединаловом буфере (рН=8,6).
В агаре вырезают лунки диаметром 4 мм, на расстоянии 4 мм друг от друга.
В
лунки у анода вносят положительный антиген и исследуемые сыворотки, а у катода
- положительный антиген и исследуемый патологичекий материал. Электрофорез
проводят 1,5 ч при силе тока 4 мА/ см. Контролями служат отрицательные антиген
и сыворотка
Пластины
просматривают в косо проходящем свете на темном фоне. Реакцию считают
положительной, если между лунками с испытуемым антигеном или сывороткой и
положительной сывороткой или антигеном образуются одна или две линии
преципитации.
Реакция
непрямой гемагглютинации основана на
способности антител агглютинировать эритроциты, сенсибилизированные
специфическим антигеном. РНГА может применяться как для серологической
диагностики, так и для изучения серологической эпизоотологии болезни Гамборо.
При
постановке РНГА используют эритроцитарный антиген и контрольные (положительная
и отрицательная) сыворотки из диагностического набора БелНИИЭВ для диагностики
инфекционного бурсита (болезни Гамборо).
Реакцию
ставят микрометодом в микротитраторе Такачи. В лунках горизонтальных рядов
плексигласовых пластинок из исследуемых пластинок готовят последовательные
двукратные разведения (от 1:2 до 1:1024) на 0,85%- ном растворе натрия хлорида,
содержащем 1% глицерина, в объеме 0,025 мл (1 капля). В первые лунки вносят
0,025 мл исследуемой сыворотки, перемешивают, и 0,025 мл смеси переносят в
следующие лунки и т.д. Из последних лунок после перемешивания 0,025 мл
содержимого удаляют в дезинфицирующий раствор. В каждую лунку с соответствующим
разведением сыворотки добавляют 0,025 мл 1%-ной взвеси сенсибилизированных
вирусом эритроцитов и встряхивают.
Одновременно
готовят: контроль эритроцитарного антигена на спонтанную агглютинацию (в 2-3
лунках вносят 0,025 мл отрицательной сыворотки и 0,025 мл эритроцитарного
антигена); положительный контроль (в 2-3 лунках вносят 0,025 мл положительной
сыворотки и 0,025 мл эритроцитарного антигена); отрицательный контроль (в 2-3
лунки вносят 0,025 мл отрицательной сыворотки и 0,025 мл эритроцитарного
антигена).
Плексигласовые
пластинки с компонентами помещают в термостат на 1- 1,5 часа при t=37°С
до оседания эритроцитов.
Учет
реакции ведут только в том случае, когда контроль эритроцитарного антигена на
спонтанную агглютинацию и с заведомо отрицательной сывороткой отрицательные, а
контроль с положительной сывороткой --положительный.
Положительная
реакция характеризуется появлением осадка эритроцитов в виде зонтика на дне
лунки. Отрицательная реакция проявляется выпадением эритроцитов в осадок в виде
точки или колечка с ровными краями.
При
агглютинации эритроцитов испытуемыми сыворотками в разведении 1:8 и выше РНГА
считают положительной, а 1:4 и ниже - отрицательной.
Иммуноферментный
анализ широко применяют в качестве
наиболее специфичного теста для выявления в сыворотке крови иммунной птицы
специфических противовирусных антител. Для постановки данной реакции используют
набор диагностикумов ВНИИЗЖ для определения антител к вирусу инфекционной
бурсальной болезни (болезни Гамборо) методом ИФА. Сущность данной методики
заключается в выявлении комплекса антиген- антитело на поверхности лунок
полистиролового планшета. Образовавшийся специфический комплекс взаимодействует
с антивидовым иммунопероксидазным коньюгатом против Ig G кур
и вызывает разложение субстрата, окрашивая содержимое лунок планшета.
Перед
приготовлением рабочих растворов набор с компонентами выдерживают 30 мин. при
комнатной температуре (18-20°С).
Раствор
№1. В 1000 см3 дистиллированной воды растворяют 0,97 г трис
(оксиметил) аминометана (флакон 5.1), 6,61 г трис (оксиметил) аминометана
гидрохлорида (флакон 5.2) и 11,7 г хлорида натрия (флакон 5.3). После измерения
рН полученного раствора (которое должно быть в пределах 7,4-7,6), к нему
добавляют 1,0 мл жидкого детергента твин-20 (флакон 7). Данный раствор
используют для разведения контрольных сывороток, испытуемых проб, антивидового
коньюгата и межэтапной промывки.
Раствор
№2. Для приготовления субстратного буфера 5,37 г дигидрофосфата натрия (флакон
6.1) растворяют в 50 мл дистиллированной воды. Содержимое флакона 6.2 (1,51 г
лимонной кислоты) также растворяют в 50 мл дистиллированной воды. Затем
смешивают 224,3 мл раствора натрия дигидрофосфата с 25,7 мл раствора лимонной
кислоты, добавляют 50 мл дистиллированной воды. Полученный раствор должен иметь
рН=4,9-5,0. При необходимости добавляют кислый или щелочной компоненты.
Раствор
№3. В 0,5 мл раствора №1 растворяют 1,0 см3 цельной
леофилизированной положительной сыворотки против болезни Гамборо (флакон 1).
Допускается хранение полученного раствора в течение 3 суток при 4 °С.
Раствор
№4. В 0,5 мл раствора №1 растворяют 1,0 см3 цельной
леофилизированной отрицательной сыворотки против болезни Гамборо (флакон 1).
Допускается хранение полученного раствора в течение 3 суток при 4 °С.
Раствор
№5 Содержимое раствора 4 с антивидовым коньюгатом растворяют в 0,5 мл раствора
№1. Для получения рабочего разведения 1:200 из этого флакона отбирают 0,05 см3
на 10,0 мл раствора №1 (на 1 планшет). Готовят перед употреблением. Хранению не
подлежит.
Раствор
№6. Одну таблетку гидроперита растворяют в 20 мл дистиллированной воды. Хранят
в защищенном от света месте при 4°С не более 20 суток.
Раствор
№7. Субстратно-индикаторная смесь. Таблетку ортофенилендиамина (субстрата)
растворяют в 20 мл раствора №2, встряхивают до полного растворения и добавляют
на каждые 20 мл этого раствора по 0,4 мл раствора №6. Хранению не подлежит.
Из
комплекта набора берут планшет, в лунках которого адсорбирован очищенный
антиген вируса болезни Гамборо. Образцы исследуемых проб сывороток крови
разводят 1:100 раствором №1. С этой целью к 0,01 мл сыворотки добавляют 1 мл
раствора №1.
В
лунки рядов планшета В1-12…Н1-12 вносят по 0,1 мл раствора №1, а в лунки А2-11
вносят по 0,2 мл разведенных проб сывороток и проводят раститровку по
вертикальным рядам, 1:100 до 1:12800. В лунки А1 и А12 вносят разведения 1:100
контрольных (отрицательной и положительной) сывороток и также проводят
раститровку по вертикальным рядам. Из последних лунок Н1 и Н12 удаляют по 0,1
мл.
Планшет
осторожно встряхивают, закрывают крышкой и переносят в термостат на 2 часа при
температуре 37°С. Затем лунки планшета освобождают от содержимого путем
встряхивания и трехкратно промывают раствором №1. Во все лунки планшета вносят
по 0,1 мл раствора №5, помещают в термостат на 1 ч, трехкратно промывают
раствором №1. Затем во все лунки вносят по 0,1 мл раствора №1. Оставляют при
комнатной температуре на 10 минут. Реакцию останавливают добавлением в каждую
лунку 0,05 мл 0,5%-ного раствора серной кислоты.
Выявление
специфических антител в сыворотках крови можно проводить и без раститровки
испытуемых сывороток. При этом во все лунки планшета А2-12…Н2-12 вносят по 1 мл
сывороток крови в разведении 1:400. В лунки А1и В1 вертикального ряда вносят
положительные, в две следующие С1 и Д1 - отрицательные контрольные сыворотки в
разведении 1:400, а лунки Е1 и F1 служат контролем коньюгата - в них вносят по 1 мл
раствора №1.
Учет
результатов анализа проводят после остановки реакции одним из способов:
визуально - по интенсивности окрашивания содержимого или инструментально - с
помощью спектрофотометра с вертикальным лучом при длине волны 492 нм. При
визуальном учете сравнивают окраску содержимого лунок планшета испытуемых проб
с окраской лунок контрольных образцов. За титр испытуемой сыворотки принимают
последнее ее разведение, при котором наблюдают видимое глазом цветовое окрашивание,
более интенсивное по сравнению с отрицательной пробой. Положительными считают
пробы, начиная с разведения 1:400 и выше. При оценке результатов без
раститровок сывороток реакцию расценивают по принципу - “да”- положительная
реакция (в пробе присутствуют специфические антитела) или “нет” - отрицательная
реакция (в пробе отсутствуют специфические антитела).
Инструментальный
фотометрический учет позволяет количественно оценить титры специфических
антител путем определения экстинкции. Конечным разведением испытуемой сыворотки
считается последнее ее разведение, в котором экстинкция превышает контрольную в
2,0- 2,1 раза.
Гистологическое
исследование. От трупов павших или
вынужденно убитой птицы отбирают кусочки бурсы Фабрициуса, тимуса, селезенки,
печени, почек, сердца, скелетных мышц. Органы с этикетками помещают в
стеклянную посуду и заливают 10%-ным раствором формалина для фиксации. Объем
фиксирующей жидкости должен превышать объем фиксируемых кусочков не менее чем в
10 раз. Фиксацию проводят при комнатной температуре (18-20°С) в течение 24-48
часов. Критериями завершения фиксации являются: равномерное уплотнение органов
и одинаковый цвет с поверхности и на разрезе. Зафиксированные кусочки с
этикетками помещают в посуду с фиксирующей жидкостью или в полиэтиленовые
пакеты с ватой, смоченной фиксатором, и направляют в лабораторию с
сопроводительным письмом.
В
лаборатории материал уплотняют замораживанием жидким азотом или на
полупроводниковых столиках, а также путем заливки в парафин. Гистологические
срезы получают на замораживающем или санном микротомах, окрашивают
гематоксилин-эозином. Окрашенные срезы изучают в световом микроскопе.
В
Фабрициевой сумке в начале болезни отмечают массовый некроз лимфоцитов, а затем
и ретикулярных клеток с образованием на месте большинства лимфоидных узелков
некротического детрита. Лимфоидные узелки замещаются железистыми структурами.
Одновременно выявляется местная иммунная реакция, при которой наряду с некрозом
лимфоидных узелков происходит формирование обширных лимфоцитарных пролифератов
с образованием в них небольших лимфоидных узелков. В интерстиции наблюдают
отек, инфильтрацию псевдоэозинофилами и гистиоцитами, гиперплазию ретикулярных
клеток.
Следует
учитывать, что при латентном течении болезни в связи с некрозом лимфоцитов развивается
атрофия и делимфатизация лимфоидных узелков.
В
тимусе при остром течении болезни Гамборо находят некроз лимфоцитов в корковом,
реже в мозговом веществе долек, увеличение числа и размеров телец Гассаля.
Отмечается воспалительная гиперемия кровеносных сосудов, микро- и
макрофагальная реакции, гиперплазия ретикулярных клеток. Подострое и латентное
течение сопровождается ранней акцидентальной инволюцией органа.
В
селезенке в начале болезни обнаруживают гиперемию сосудов красной пульпы,
макрофагальную инфильтрацию, некроз лимфоцитов в периартериальных муфтах
(Т-лимфоциты) и лимфоидных узелках (В-лимфоциты). В более поздние сроки
выявляют ярко выраженную плазматизацию органа.
В
почках при остром течении болезни Гамборо регистрируют гиперемию сосудов, вакуольную
дистрофию и некроз эпителиоцитов, разрушение извитых канальцев. В отдельных
участках выявляют обширные лимфоцитарно - гистиоцитарные пролифераты.
Хроническое течение характеризуется явлениями нефросклероза, скоплением в
просветах канальцев кристаллов уратов.
В
печени отмечают гиперемию центральных вен долек, очаговые кровоизлияния,
зернистую и жировую дистрофию гепатоцитов, а также скопления лимфоцитов,
макрофагов (реже микрофагов) в интерстиции органа.
В
скелетных и сердечной мышцах выявляют гиперемию кровеносных сосудов, иногда -
зернистую дистрофию. При хроническом течении между мышечными волокнами
обнаруживают слабо выраженные лимфоцитарно - гистиоцитарные пролифераты.
Дифференциальная
диагностика
При
дифференциальной диагностике болезни Гамборо наибольшее значение имеет
исключение опухолевых болезней птиц, аденовирусной инфекции, синдрома снижения
яйценоскости (ССЯ-76), инфекционного бронхита, гриппа и ньюкаслской болезни, а
также стрептококкоза, пастереллеза, колибактериоза, эймериоза, простогонимоза,
гиповитаминоза А, алиментарной дистрофии и радиотоксикоза.
Болезнь
Марека поражает цыплят от 4- до 30- недельного возраста, протекает в виде
энзоотий, реже эпизоотий. Чаще болеют курочки, реже - петушки. При жизни у
больных птиц выявляют нарушения координации движения, парезы ног и крыльев.
Отмечают сероглазие, гиперплазию перьевых фолликулов, слабость, прогрессирующее
истощение. У павших цыплят обнаруживают диффузные или очаговые саловидные
новообразования в бурсе Фабрициуса, селезенке, печени, стенке кишечника,
отмечают утолщение седалищных нервов. При гистоисследовании в Фабрициевой бурсе
находят атрофированные лимфоидные узелки с заменой их на кисты или железы,
разрост межфолликулярной соединительной ткани. Нередко отмечают развитие
опухолей во внутренних органах, характеризующихся пролиферацией лимфобластов,
гистиоцитов и плазмоцитов.
Патологоанатомический
диагноз:
1. Разрост саловидной опухолевой ткани в
селезенке, печени, почках, яичнике семенниках, сердце, легких, стенке
железистого желудка и кишечника, тимусе, бурсе Фабрициуса или их атрофия.
2. Гиперплазия перьевых фолликулов.
3. Сероглазие, деформация зрачка.
4. Невриты с резким утолщением в
седалищных нервах и в нервах плечевого и поясничного сплетений.
5. Гисто: пролиферация лимфобластов,
гистиоцитов, плазмоцитов и ретикулоцитов в опухолевых узлах; атрофия лимфоидных
узелков бурсы Фабрициуса, замена их на кисты, железы, разрост межузелковой
соединительной ткани.
Проводят дополнительные лабораторные исследования: ставят биопробу на
цыплятах, исследуют сыворотки крови в РИД, проводят гистоисследование
пораженных органов и тканей.
Лейкоз кур протекает обычно в виде энзоотий. Заболевает птица старше 8-
12- месячного возраста. У больных кур отмечают вялость, понос, истощение. При
вскрытии павших птиц обнаруживают диффузные или очаговые саловидные разрастания
опухолевой ткани в Фабрициевой бурсе, селезенке, печени, почках, сердце и в
других органах.
При гистологическом исследовании в бурсе обнаруживают пролиферацию
опухолевых клеток, формирующих опухолевый очаг, инфильтративный рост которого
приводит к разрушению органа. В печени, почках, сердце выявляют разрост
незрелых лимфоидных клеток.
Патологоанатомический диагноз:
1. Разрост (диффузной или в виде узлов)
саловидной опухолевой ткани в бурсе Фабрициуса.
2. Опухолевидные саловидные узлы в
селезенке, печени, почках, стенке железистого желудка и тонкого кишечника,
сердце, легких
3. Истощение и общая анемия.
4. Гисто: пролиферация незрелых
лимфоидных клеток в опухолевых узлах.
Лабораторная диагностика основывается на проведении гистологического
исследования патматериала, постановке РСК и РНГА.
Саркома Рауса сопровождается прогрессирующей кахексией, снижением
яйцекладки, диареей, отвислостью живота, анемичностью кожи и видимых слизистых
оболочек. При вскрытии выявляют многочисленные опухолевые узлы в коже,
скелетной мускулатуре, а также в селезенке, брыжейке кишечника, печени, почках,
яичнике. При наличии большого числа метастазов опухоли во внутренних органах
наблюдается атрофия лимфоидных узелков бурсы Фабрициуса, делимфатизация.
Отмечается утолщение в 2-3 раза межузелковых соединительнотканных перегородок,
их гиперемия и отек.
Патологоанатомический диагноз:
1. Опухолевые узлы в коже, скелетных
мышцах, селезенке, печени, почках, в брыжейке кишечника, яичнике.
2. Истощение, общая анемия.
3. Гисто: пролиферация
слабодифференцированных полиморфных клеток в опухолевых узлах, атрофия и некроз
элементов паренхимы внутренних органов; атрофия и делимфотизация лимфоидных
узелков, гиперемия и серозный отек интерстиции в бурсе Фабрициуса.
Для подтверждения диагноза проводят вирусологическое исследование.
Аденовирусная инфекция поражает преимущественно молодняк 2-3- месячного
возраста. Возбудитель высоко контагиозен. Болезнь сопровождается сонливостью,
анемией слизистых оболочек. У павших или вынужденно убитых цыплят обнаруживают
кровоизлияния в мышцах, увеличение печени с переполнением желчью желчного
пузыря. Почки набухшие, с кровоизлияниями.
Патологоанатомический диагноз:
1. Альтеративный гепатит, переполнение
желчью желчного пузыря.
2. Острый катарально-геморрагический
энтерит.
3. Увеличение селезенки.
4. Кровоизлияния в скелетных мышцах,
печени, почках, в стенке желчного пузыря.
5. Общая анемия, истощение.
6. Гисто: печень - внутриядерные базофильные и эозинофильные включения,
вакуольная дистрофия и некроз гепатоцитов, кровоизлияния, интерстициальные
лимфоцитарно-гистиоцитарные пролифераты; поджелудочная железа - панкреатит с
наличием интрануклеарных полихроматофильных включений в клетках железистой
ткани; бурса Фабрициуса - атрофия лимфоидных узелков, обеднение лимфоцитами
мозгового слоя, интерстициальный отек, истончение складок слизистой оболочки;
селезенка - серозный спленит с внутриядерными тельцами-включениями в
ретикулоцитах.
Проводят дополнительные лабораторные исследования: выделение вируса на
куриных эмбрионах.
Синдромом снижения яйценоскости (ССЯ-76) болеют куры всех пород в период
яйцекладки. Вирус способен персистировать в организме птиц и активизироваться
при стрессе, вызванном началом яйцекладки. Болезнь сопровождается овариитом,
катаральным сальпингитом. При гистологическом исследовании маточного отдела яйцевода
в эпителиальных клетках обнаруживаются базофильные интрануклеарные включения.
Изменения в бурсе Фабрициуса не патогномоничны.
Патологоанатомический диагноз:
1. Овариит, кровоизлияния в яичнике.
2. Катаральный,
катарально-геморрагический сальпингит.
3. Уменьшение толщины скорлупы (на
30-60%) и ее депигментация (у яиц цветных пород) до слабо-желтого или белого
цвета.
4. Гангренозный дерматит (осложнение).
Учитывают снижение яйценоскости у кур, применяют раннюю и ретроспективную
диагностику с использованием РЗГА.
Инфекционный бронхит характеризуется поражением дыхательных путей
(респираторная форма) у цыплят и яйцевода у взрослой птицы со снижением
яйценоскости (репродуктивная форма). При вскрытии у павших и вынужденно убитых
цыплят отмечают острое катаральное воспаление верхних дыхательных путей,
серозно-фибринозный аэросаккулит, у кур - атрофию яичника и яйцевода,
деформацию яйцевых фолликулов. Гистологическим исследованием кроме того
обнаруживают зернистую дистрофию эпителия извитых канальцев почек.
Нефрозо-нефритную форму инфекционного бронхита регистрируют у цыплят
3-9-недельного возраста. У больной птицы наблюдают водянистую диарею,
угнетение, прострацию. Ведущие патологические процессы, обнаруживаемые при
вскрытии и гистологическом исследовании: зернистая и жировая дистрофия почек и
скопление уратов в почечных канальцах и мочеточниках, жировая дистрофия
(мелкокапельная) печени, псевдоэозинофильная реакция в интерстиции указанных
органов.
Патологоанатомический диагноз:
респираторная форма
1. Серозно-катаральный ринит,
коньюнктивит.
2. Серозно-катаральный фибринозный
трахеит и бронхит.
3. Очаговая катаральная или
катарально-фибринозная пневмония.
4. Серозно-фибринозный аэросаккулит.
5. Истощение.
нефрозо-нефритная форма
1. Нефрозо-нефрит, скопление уратов в
мочеточниках.
2. Переполнение прямой кишки и клоаки
беловатыми фекалиями с примесью уратов.
3. Висцеральный мочекислый диатез.
репродуктивная форма
1. Атрофия яичника и яйцевода.
2. Кистоз яичника с наличием в его
просвете казеозно-фибринозной массы.
3. Желточный перитонит.
Проводят дополнительные исследования: выделение вируса на КЭ и КК, ставят
биопробу на 9-суточных эмбрионах (у которых уже на 5-6-ой день после заражения
вирусом эмбрионов отмечают “эффект карликовости” - отставание в росте в 3-4
раза по сравнению с контролем), а также серологические реакции - РН, РИД, РНГА.
Грипп птиц поражает кур всех возрастов, протекает остро. Заболеваемость и
летальность могут достигать 100%. Болезнь характеризуется нервными явлениями,
отеками головы, прекращением яйценоскости, диареей, цианозом гребня и сережек с
последующим их некрозом. При вскрытии обнаруживают многочисленные точечные и
пятнистые кровоизлияния на слизистых оболочках и серозных покровах,
геморрагическое кольцо в слизистой оболочке железистого желудка на границе его
с мышечным желудком, острый катаральный энтерит. При гистоисследовании в
головном мозгу выявляют микронекрозы, в бурсе Фабрициуса, тимусе, селезенке,
пищеводной и слепокишечных миндалинах - обеднение лимфоцитами.
Патогоанатомический диагноз:
1. Геморрагический диатез.
2. Геморрагическое кольцо в слизистой
оболочке железистого желудка на границе его с мышечным желудком.
3. Цианоз гребня и сережек.
4. Серозно-фибринозный перикардит и
плевроперитонит.
5. Катаральный, катарально-геморрагический
энтерит.
6. Серозный отек подкожной клетчатки.
7. Неизмененная селезенка.
Гисто: микронекрозы в головном мозгу; делимфатизация бурсы Фабрициуса,
тимуса, селезенки, пищеводной и слепокишечных миндалин.
Лабораторная диагностика основывается на выделении вируса на куриных
эмбрионах, постановке РГА и РЗГА со специфическими гипериммунными сыворотками,
гистологического исследования патматериала.
Ньюкаслская болезнь поражает птиц всех возрастов, протекает остро,
подостро и хронически. Острое течение характеризуется повышением температуры,
угнетением, сонливостью, диареей (фекальные массы водянистые,
зеленовато-желтого цвета). При дыхании слышны свистящие хрипы и клокотание в
горле. Наблюдают цианоз гребня и сережек.
При подостром и хроническом течении наблюдают нервные симптомы, одышку,
кашель, хрипы.
Основные патологоанатомические изменения характеризуются явлениями
геморрагического диатеза, появлением геморрагического кольца в слизистой
оболочке железистого желудка на границе его с мышечным желудком. Выявляют также
фибринозно-некротический, эрозивно-язвенный энтерит с образованием
струпьев-бутонов, зернистую дистрофию паренхиматозных органов, венозную
гиперемию и отек легких. При гистоисследовании в головном мозгу обнаруживают
негнойный лимфоцитарный энцефалит; в органах иммунной системы - массовый некроз
лимфоцитов, процессы деструкции лимфоидных узелков.
Патологоанатомический диагноз:
1. Геморрагический диатез.
2. Геморрагическое кольцо в слизистой
оболочке железистого желудка на границе его с мышечным желудком.
3. Цианоз гребня и сережек.
4. Фибринозно-некротический,
эрозивно-язвенный энтерит с образованием струпьев-бутонов.
5. Серозный отек подкожной клетчатки.
6. Небольшое увеличение селезенки.
7. Гисто: негнойный лимфоцитарный
энцефалит; гибель лимфоцитов и разрушение лимфоидных узелков в бурсе Фабрициуса
и селезенке.
Для постановки окончательного диагноза проводят дополнительные
лабораторные исследования: выделение вируса на куриных эмбрионах и его
идентификацию с использованием РТГА, РН, РСК, РИФ, ИФА. Учитывают данные
гистологического исследования головного мозга.
Стрептококкоз протекает молниеносно или остро. У больной птицы наблюдают
сонливость, взъерошенность перьевого покрова, депрессию, диарею, анемичность
гребня и сережек, иногда - паралич конечностей. Патологоанатомические изменения
характеризуются серозно-геморрагическим отеком подкожной клетчатки,
серозно-фибринозным воспалением серозных покровов, гиперплазию селезенки.
Печень находится в состоянии зернистой дистрофии с милиарными очажками некроза.
Патологоанатомический диагноз:
1. Цианоз видимых слизистых оболочек и
кожи.
2. Серозно-геморрагический отек
подкожной и межмышечной клетчатки.
3. Венозная гиперемия, зернистая и
жировая дистрофия печени, очаги некроза в ней.
4. Увеличение селезенки.
5. Острая венозная гиперемия и отек
легких.
6. Острая венозная гиперемия, зернистая
дистрофия и серозный гломерулонефрит почек.
7. Острый катаральный энтерит.
8. Серозно-фибринозный перитонит,
перикардит, периспленит, овариосальпингит (при подостром и хроническом
течении).
9. Гиперемия яичника, деформация яйцевых
фолликулов и кровоизлияния в них.
Проводят лабораторные исследования: микроскопию мазков- отпечатков
органов, выделение чистой культуры возбудителя, определение его вирулентных
свойств.
При пастереллезе кур у больных птиц наблюдают вялость, жажду, повышение
температуры, угнетение, диарею, синюшность гребня и сережек, а при хроническом
течении - дифтеритическое воспаление бородок. При вскрытии павших и вынужденно
убитых цыплят обнаруживают признаки септицемии, крупозную пневмонию. При
гистоисследовании в бурсе Фабрициуса регистрируют выраженную атрофию и
делимфотизацию лимфоидных узелков с одновременным утолщением межфолликулярных
соединительно-тканных перегородок.
Патологоанатомический диагноз:
1. Цианоз гребня и сережек.
2. Крупозная плевропневмония.
3. Серозно-фибринозный перикардит.
4. Геморрагический диатез.
5. Зернистая дистрофия и милиарные
некрозы в печени и миокарде.
6. Острый катаральный,
катарально-геморрагический дуоденит.
7. Увеличение селезенки (не всегда).
хроническое течение
1. Фибринозно-некротическое воспаление
бородок, иногда отпадение их.
2. Крупозная, некротическая пневмония.
3. Зернистая дистрофия печени, почек и
миокарда.
4. Фибринозно-гнойные артриты.
5. Истощение.
Гисто: атрофия лимфоидных узелков бурсы Фабрициуса, утолщение
интерстиции. Для уточнения диагноза проводят бактериологическое исследование и
ставят биопробу на цыплятах.
Колибактериоз характеризуется повышением температуры, угнетением, диареей,
нарастающим истощением. При вскрытии обнаруживают: катаральное воспаление
тонкого кишечника, серозно-фибринозное воспаление серозных покровов,
воздухоносных мешков. Микроскопией срезов бурсы Фабрициуса выявляют очаговые
кровоизлияния, гиперемию и отек интерстиции, атрофию лимфоидных узелков.
Отмечают обеднение лимфоидными элементами корковой и мозговой зон узелков,
набухание цитоплазмы ретикулярных клеток.
Патологоанатомический диагноз:
1. Серозно-фибринозный перигепатит,
периспленит, перикардит, перитонит, аэросаккулит.
2. Точечные и пятнистые кровоизлияния в
паренхиматозных органах, слизистых и серозных оболочках.
3. Острый катаральный энтерит.
4. Увеличение селезенки.
5. Зернистая дистрофия и милиарные очаги
некроза в печени.
6. Серозно-фибринозный полиартрит (при
хроническом течении).
7. Гисто: кровоизлияния в бурсе
Фабрициуса, атрофия лимфоидных узелков, гиперемия и отек интерстиции.
Проводят дополнительные исследования: выделение культуры возбудителя,
определение его вирулентности.
Эймериозом болеют цыплята до 80-ти дневного возраста. У больной птицы
отмечают угнетение, скученность, диарею (фекалии коричневатые, с примесью
крови). При вскрытии трупов павших и вынужденно убитых цыплят регистрируют
катарально-геморрагический, эрозивно-язвенный энтерит и тифло-колит,
паразитарные узелки в стенке толстого кишечника.
При гистоисследовании узелков обнаруживаются очаговые некрозы, скопления
ооцист паразита, окруженные мощной соединительнотканной капсулой. В бурсе
Фабрициуса обнаруживают делимфатизацию и атрофию (за счет миграции лимфоцитов
за пределы органа), отек интерстиция, микро- и макрофагальную реакцию.
Патологоанатомический диагноз:
1. Катарально-геморрагический
эрозивно-язвенный тифлит и проктит.
2. Катарально-геморрагический энтерит,
паразитарные узелки в слизистой оболочке толстого кишечника.
3. Зернистая дистрофия печени, почек и
миокарда.
4. Истощение.
5. Гисто: атрофия лимфоидных узелков
бурсы Фабрициуса, отек межфолликулярной соединительной ткани, скопление
гистиоцитов, псевдоэозинофилов и эозинофилов в ней.
Для постановки окончательного диагноза проводят микроскопию фекалий или
соскобов слизистой оболочки кишечника для выявления ооцист эймерий.
Простогонимоз протекает в виде энзоотических вспышек, чаще на фермах,
расположенных вблизи водоемов. У больных птиц наблюдают угнетение, сонливость,
диарею (фекалии белого или зеленоватого цвета), снижение яйценоскости, живот
увеличен. При вскрытии павших или вынужденно убитых птиц обнаруживают овариит,
гнойно-фибринозный сальпингит и перитонит, гиперемию и отек бурсы Фабрициуса.
При микроскопии срезов бурсы выявляют серозно-воспалительный отек интерстиции,
инфильтрацию псевдоэозинофилами и эозинофилами.
Патологоанатомический диагноз:
1. Овариит, деформация и разрыв
фолликулов.
2. Гнойно-фибринозный перитонит.
3. Гнойно-фибринозный сальпингит,
яйцевые конкременты в просвете яйцевода.
4. Острый катаральный энтерит.
5. Зернистая дистрофия печени, почек,
миокарда.
6. Гиперемия и отек бурсы Фабрициуса.
7. Истощение, эксикоз.
8. Гисто: Серозно-воспалительный отек и
микрофагальная инфильтрации межузелковой соединительной ткани в бурсе
Фабрициуса.
Проводят дополнительные лабораторные исследования - микроскопирование
помета больных птиц для обнаружения яиц гельминтов.
Гиповитаминоз А регистрируют у цыплят, а также продуктивной птицы.
Симптомы: малоподвижность, отставание в росте, коньюнктивит, ларингит, общая
анемия. На слизистой оболочке глотки и пищевода при вскрытиии обнаруживают
милиарные серо-желтые узелки (гиперплазия и ороговение эпителия слизистых желез),
в почках - зернистую дистрофию и отложение уратов.
Патологоанатомический диагноз:
1. Гиперкератоз кожи, тусклость и
ломкость перьев.
2. Фибринозный коньюнктивит,
ксерофтальмия, кератомаляция, панофтальмит.
3. Катаральный ринит, ларингит, трахеит.
4. Просовидные узелки в слизистой
оболочке глотки и пищевода.
5. Висцеральный мочекислый диатез и
подагра.
6. Истощение и общая анемия.
Для установления окончательного диагноза проводят биохимическое
исследование печени, крови, желтков яиц, кормов на содержание витамина А и
каротина.
Алиментарная дистрофия, чаще наблюдаемая у цыплят 15-20-дневного
возраста, характеризуется депрессией, диареей, истощением птицы. При вскрытии
регистрируют отсутствие жира в жировом депо, атрофию скелетных мышц и
внутренних органов. При гистологическом исследовании срезов тимуса и бурсы
Фабрициуса обнаруживают раннюю инволюцию органа, сопровождающуюся атрофией и
опустошением лимфоидных узелков.
Патологоанатомический диагноз:
1. Отсутствие жира в жировом депо.
2. Атрофия скелетных мышц и внутренних
органов.
3. Серозные отеки в подкожной и
межмышечной клетчатке.
4. Общая анемия, эксикоз.
5. Гисто: акцидентальная инволюция бурсы
Фабрициуса и тимуса.
Проводят химико-токсикологическое исследование кормов. Выявляют повышение
кислотного и перекислотного чисел.
Радиотоксикоз регистрируют у птиц всех возрастов. У больных цыплят и кур
отмечается анорексия, жажда, отеки в области головы. При вскрытии обнаруживают
геморрагический диатез, серозную инфильтрацию подкожной клетчатки, а при гистоисследовании
- атрофию, некрозы лимфоидной ткани в центральных и периферических органах
иммунной системы.
Патологоанатомический диагноз:
1. Геморрагический диатез.
2. Серозные отеки подкожной клетчатки в
области головы.
3. Подострый или хронический катаральный,
эрозивно-язвенный энтерит.
4. Атрофия бурсы Фабрициуса, тимуса,
селезенки, железы Гардера.
5. Общая анемия, истощение, эксикоз.
6. Гисто: очаговые некрозы или атрофия
лимфоидной ткани в тимусе, бурсе Фабрициуса, железе Гардера, селезенке,
эзофагальной и цекальных миндалинах.
Проводят радиологическое исследование кормов.
С целью охраны птицефабрик от заноса возбудителя, ветеринарные
специалисты обязаны: использовать для инкубации яйца из благополучных по
инфекционной бурсальной болезни птицефабрик; комплектовать птичники
одновозрастной птицей; соблюдать межцикловые технологические перерывы с
проведением тщательной очистки, дезинфекции, дезинсекции и дератизации;
проводить дезинфекцию проводимых яиц и тары; обеспечивать необходимые
зооветеринарные требования по содержанию и кормлению птиц.
При установлении диагноза на ИББ на хозяйство накладывают ограничения, по
условиям которых запрещается: вывоз яйца для инкубации, молодняка и взрослой
птицы, кормов, инвентаря и оборудования в благополучные по ИББ хозяйства и для
продажи населению; комплектование стад переболевшей птицей.
Разрешается реализация яиц для пищевых целей, после дезинфекции их парами
формальдегида.
После клинического исследования всех больных и подозрительных по заболеванию
цыплят подвергают убою и утилизации. Оставшихся здоровых цыплят подвергают
вакцинации с последующим убоем всей птицы, достигшей убойных кондиций, из
помещений, где регистрировалось заболевание. Прекращают инкубацию яиц и прием
молодняка на выращивание. Проводят дезинфекцию инкубатора. Закладку яиц на
инкубацию возобновляют не ранее, чем через 10 дней после вывода последней
партии инкубируемых яиц.
За каждым птичником закрепляют отдельный обслуживающий персонал.
Спецодежду ежедневно дезинфицируют в пароформалиновой камере.
Убой птицы проводят с полным потрошением тушек. При отсутствии
патологоанатомических изменений в тушках их используют после проваривания при t=1000С (в течение 90
минут). Тушки с внутримышечными геморрагиями, отеками, отложениями мочекислых
солей направляют вместе с внутренними органами на техническую утилизацию.
Для влажной дезинфекции используют 4%-ный раствор натрия гидроокиси,
осветленный раствор хлорной извести (содержащей не менее 3% активного хлора),
2%-ный водный раствор формальдегида при экспозиции не менее 6-ти часов.
Помет и глубокую подстилку обеззараживают биотермически.
Ограничения снимают после проведения заключительных
ветеринарно-санитарных мероприятий и при отсутствии клинических и
патологоанатомических изменений не менее чем в 3-х партиях вновь выращенного до
60-ти дневного возраста молодняка после профилактического перерыва.
Специфическая профилактика
По наблюдению ряда исследователей общие ветеринарно-санитарные
мероприятия не обеспечивают полного оздоровления хозяйств от инфекционной
бурсальной болезни. Поэтому в комплексе мероприятий по профилактике и
ликвидации этой инфекции основное место уделяется специфической профилактике с
использованием живых и инактивированных вакцин.
Защита цыплят от заражения вирусом ИББ достигается путем создания
высокого уровня пассивных антител у молодняка иммунизацией ремонтного молодняка
кур инактивированными вакцинами и применением живых вирус-вакцин по мере
снижения трансовариального иммунитета.
Для иммунизации цыплят используют живые вирус-вакцины. Птиц прививают
перорально, в 7-14-ти дневном возрасте (в зависимости от уровня пассивного
иммунитета и эпизоотической ситуации), а ревакцинируют спустя 14 дней. За 6
часов до проведения иммунизации в птичниках прекращают подачу воды и корма.
Вакцину растворяют в теплой воде и выпаивают цыплятам с таким расчетом, чтобы
на одну голову приходилась одна доза вакцины (10-15 мл). Подачу воды и корма
возобновляют не ранее, чем через 2 часа после выпаивания вакцины. Устанавливают
клиническое наблюдение за состоянием птицы.
Недостатком большинства живых вирус-вакцин против инфекционной бурсальной
болезни является то, что вакцинные штаммы вируса наряду с иммуногенностью
обладают выраженными иммунодепрессивными свойствами. Поэтому живые вакцины в
зависимости от степени реактогенности делят на умеренно-, слабо- и апатогенные
с высокой иммунногенной активностью. Эффективность реактогенных штаммов
установлена при вакцинации цыплят с высоким уровнем материнских антител, они
неприемлемы для восприимчивых цыплят.
Одним из показателей реактогенности вакцинных штаммов при болезни Гамборо
служит снижение уровня антигемагглютининов у птицы, вакцинированной против
ньюкаслской болезни. Установлена коррелятивная связь между иммуногенной
активностью вакцинных штаммов вируса, его повреждающим действием на
морфологическую структуру бурсы и снижением бурсального индекса. Наиболее
иммуногенные штаммы вызывают более выраженные поражения Фабрициевой бурсы.
Снижение бурсального индекса установлено при введении реактогенных вакцин
слабоиммунной птице раннего возраста. Поэтому перед проведением вакцинации
цыплят против ИББ мы рекомендуем определять у них иммунный статус и фоновые
показатели уровня специфических антител. Для этого в лабораторию болезней птиц
и пчел БелНИИЭВ или на кафедру болезней мелких животных ВГАВМ на исследования
сыворотку крови и органы иммунитета от 10-20 цыплят.
Показано, что даже слабопатогенные вакцины против ИББ способны вызывать
патоморфологические изменения в органах иммунной системы, тем самым
обуславливая развитие у птиц иммунодефицитного состояния. Например, однократная
иммунизация цыплят сухой живой вирус-вакциной “Бурсин-2” приводит к резкому
уменьшению размеров лимфоидных узелков за счет процессов делимфотизации их
коркового слоя. В мозговом слое регистрируется фагоцитоз разрушенных клеток с
образованием множества округлых полостей типа пчелиных сот. У дважды привитых
данной вакциной цыплят поражения бурсы Фабрициуса усиливаются. Наблюдается
почти полное исчезновение лимфоцитов, атрофия и деструкция лимфоидных узелков,
фиброплазия и превращение органа в железистую структуру. В тимусе отмечается
атрофия коркового вещества.
Двукратная вакцинация цыплят аттеинуированными вакцинами “Гамбовак” и
“Гумборал-СТ” (производства Франции) вызывает почти полную атрофию бурсы
Фабрициуса с утратой ее функциональной части.
Результаты наших исследований показали, что при пероральном введении
сухой живой вирус-вакцины из шт. “Д 78” (производства Голландии) у иммунных
цыплят развиваются процессы атрофии и делимфатизации в тимусе, бурсе Фабрициуса
и слепокишечных миндалинах, приводящие к иммуносупрессии.
Нами также установлено, что пероральная иммунизация птиц против болезни
Гамборо сухой живой вирус-вакциной из шт. “Винтерфильд 2512” (производства
ВНИИЗЖ, г. Владимир) сопровождается активной иммуноморфологической перестройкой
в органах иммунной системы и не вызывает иммунодефицитного состояния. В костном
мозгу цыплят, иммунизированных данной вакциной, мы регистрировали увеличение
количества клеток миелобластического ряда, повышение показателей
лейкоэритробластического индекса, а также костномозгового индекса созревания
эозинофилов и псевдоэозинофилов. В тимусе иммунных цыплят отмечалось увеличение
удельного объема лимфоидной ткани, а в бурсе Фабрициуса - гиперплазию
лимфоидных узелков. В селезенке и слепокишечных миндалинах цыплят,
иммунизированных данной вакциной, нами выявлено повышение плотности узелковой
лимфоидной ткани, увеличение размеров лимфоидных узелков, а также активное
накопление плазматических клеток. В связи с этим использование сухой живой
вирус-вакцины из шт. “Винтерфильд 2512” (производства ВНИИЗЖ) для иммунизации
цыплят против болезни Гамборо наиболее предпочтительно, учитывая высокую
иммуногенность, и низкую реактогенность данного биопрепарата.
В БелНИИЭВе разработана живая эмбриональная вирус-вакцина против болезни
Гамборо из штамма «КМИЭВ-15». В настоящее время проводятся ее широкие
производственные испытания. Изучение эффективности данного биопрепарата
представляет особый интерес, учитывая антигенное родство вакцинного и
эпизоотических штаммов вируса, циркулирующих в Республике Беларусь.
В возрасте 110-120 суток ремонтному молодняку применяют инактивированные
вакцины. Их вводят однократно, внутримышечно, в область грудной мышцы в дозе
0,5 мл. Место введения вакцины обрабатывают 70%- ным этанолом. Установлено, что
введение инактивированных вакцин повышает титр антител у птицы,
иммунизированной ранее живыми вакцинами. Иммунизирующий эффект при этом более
выражен, чем позже была использована инактивированная вакцина. Иммунизация
ремонтного молодняка кур инактивированными вакцинами создает более напряженный
и длительный иммунитет, чем при использовании живых вакцин.
Несмотря на иммунизацию ремонтного молодняка кур, часто наблюдается
значительная вариабельность пассивных антител в стаде цыплят, что создает
условия для заболевания птиц со слабым уровнем трансовариального иммунитета.
Это обуславливает необходимость стимулирования поствакцинального иммунного
ответа путем применения иммунотропных средств.
Нами проведены исследования по изучению влияния ряда иммуностимуляторов
(натрия тиосульфат, тималин, АСД-2, левамизол) на иммуногенные свойства жидкой
сорбированной инактивированной вакцины ВНИИЗЖ против инфекционной бурсальной
болезни (производства г. Владимир, Россия). Установлено, что иммунизация
ремонтного молодняка кур совместно с натрия тиосульфатом и тималином
способствует созданию более напряженного противовирусного иммунитета, чем при
использовании одной вакцины. Препараты АСД-2 и левамизол существенно не влияли
на иммуногенность указанной вакцины.
Способ иммунизации ремонтного молодняка кур против ИББ жидкой
сорбированной инактивированной вакциной ВНИИЗЖ совместно с натрия тиосульфатом:
Птицу вакцинируют в 110- 120- дневном возрасте. Предварительно готовят
свежий 35%-ный раствор натрия тиосульфата. Полученный раствор стерилизуют
кипячением в течение 30 минут, и, после остывания 50 мл 35%-ного водного
раствора натрия тиосульфата смешивают с 200 мл (флакон - 400 доз) вакцины.
Полученную смесь (содержащую 7% натрия тиосульфата) вводят однократно,
внутримышечно, в область грудной мышцы, в дозе 0,6 мл (таким образом, объем
вводимой вакцины увеличивается на 0,1 мл). Место введения обрабатывают 70%- ным
этанолом.
Нами установлено, что иммунизация ремонтного молодняка против болезни
Гамборо жидкой сорбированной инактивированной вакциной (производства ВНИИЗЖ, г.
Владимир) совместно с иммуностимулятором натрия тиосульфатом (в 7%-ной водной
концентрации) активизирует процессы иммуноморфологической перестройки в
центральных (красный костный мозг, тимус, бурса Фабрициуса) и периферических
(селезенка, кровь) органах иммунной системы птиц, что способствует повышению
уровня специфических антител на 20-50%., созданию более напряженного
поствакцинального иммунитета у маточного поголовья, и тем самым усилению
иммунной защиты у цыплят за счет высокого уровня трансовариального иммунитета.
Способ иммунизации ремонтного молодняка кур против ИББ жидкой
сорбированной инактивированной вакциной ВНИИЗЖ совместно с тималином:
Птицу иммунизируют в 110-120- дневном возрасте. В день проведения
вакцинации проводят выборочное взвешивание 10-20 голов ремонтного молодняка кур
для установления средней массы птиц. Тималин вводят совместно с вакциной в дозе
1 мг/кг тела птиц. Препарат выпускают в виде порошка во флаконах по 10 мг.
Пример. Средний вес птиц составляет 2 кг. Следовательно, 1 доза вакцины
должна содержать 2 мг тималина. Во флаконе вакцины (200 мл - 400 доз)
растворяют 800 мг (80 флаконов) тималина. Полученную смесь вводят однократно,
внутримышечно, в область грудной мышцы, в дозе 0,5 мл. Место введения
обрабатывают 70%-ным этанолом.
Наши исследования показали, что иммунизация птиц совместно с тималином
способствует возрастанию специфических антител в крови в 1,5-4,4 раза по
сравнению с применением вакцины без иммуностимулятора.
Вместе с тем, натрия тиосульфат является более дешевым и доступным
препаратом. Поэтому его применение в период иммунизации ремонтного молодняка
кур предпочтительнее.
Оценка напряженности поствакцинального иммунитета. Для оценки напряженности иммунитета
при болезни Гамборо используют серологические методики: РИД, ВИЭФ, РН, РНГА и
ИФА. У всех цыплят, привитых живыми вирус-вакцинами, антитела в сыворотке крови
обнаруживаются, начиная с 20- 30- ти дневного возраста. Специфические
противовирусные антитела у ремонтного молодняка кур, вакцинированного в
возрасте 110-120 суток, выявляются у кур до 46-недельного возраста. Материнские
антитела обнаруживаются у цыплят до 17- 20- ти дневного возраста.
Литература
инфекционная бурсальная болезнь птица
1. Алиев А.С. Специфическая профилактика
инфекционного бурсита кур // Ветеринария-1991.-№ 3.-С.36- 39.
2. Бакулин В.А. Патоморфогенез и
патоморфологическая диагностика инфекционной бурсальной болезни птиц: Автореф.
дисс… док. вет. наук, Санкт- Петербург. - 1992. - 35с.
3. Бирман Б.Я., Голубничий В.П., Литвяк
В.С., Насонов И.В., Захарик Н.В. Методические указания по диагностике
инфекционной бурсальной болезни. - Минск, 1998. - 46 с.
4. Борисов А.В., Кузнецов В.Н., Кузнецов
Ю.В., Гусев А.А., Смоленский В.Н., Коркина С.Н. Иммуногенность различных живых
вакцин против инфекционной бурсальной болезни птиц // Вирус. болезни с.- х.
животных: Тез. докл. Всерос. науч.- практ. конф., Владимир, 17- 21 апр. 1995 г.
- Владимир, 1995. - С. 233.
5. Борисов А.В., Кузнецов В.Н., Харин
В.М. Оценка эффективности различных живых вакцин против инфекционной бурсальной
болезни птиц // Вирус. болезни с.- х. животных: Тез. докл. Всерос. науч.-
практ. конф., Владимир, 17- 21 апр. 1995 г. - Владимир, 1995. - С. 232.
6. Вскрытие животных и дифференциальная
патоморфологическая диагностика болезней: Учеб. пособие / Жаков М.С., Прудников
В.С., Анисим И.А. и др. - Мн.: Ураджай, 1998. - 263с.
7. Герман В.В., Ольховик Л.А., Берхане
И.И. О специфической профилактике инфекционной бурсальной болезни птиц (болезнь
Гамборо) // Вирус. болезни с.- х. животных: Тез. докл. Всерос. науч.- практ.
конф., Владимир, 17- 21 апр. 1995 г. - Владимир, 1995. - С. 252.
8. Дудников Л.А., Сарбасов А.Б.,
Федосеев К.Ю., Борисов А.В. Оптимальные условия определения антител к вирусу
инфекционной бурсальной болезни в реакции встречного иммуноэлектрофореза //
Вирус. болезни с.- х. животных: Тез. докл. Всерос. науч.- практ. конф.,
Владимир, 17- 21 апр. 1995 г. - Владимир, 1995. - С. 240.
9. Красников Г.А., Герман В.В., Берхане
И.И., Ольховик Л.А. Гистологические исследования Фабрициевой бурсы при болезни
Гамборо // Ветеринария. - 1996. - № 2. - С. 21- 25.
10.Кудрявцев Ф.
С., Барышников С. А., Радчук Л. А. Ингибирующее действие вируса болезни Гамборо
// Ветеринария. - 1981. - № 3. - С. 36- 37.
11.Меркулов Г.А.
Курс патологогистологической техники. - Л., 1969. - 432 с.
12.Михалишина
З.Я., Борисов А.В., Кузнецов Ф.Н., Федосеев К.Ю., Гусев А.А. Иммунологическая
активность экспериментальных образцов инактивированной сорбированной вакцины
против ИББ птиц // Вирус. болезни с.- х. животных: Тез. докл. Всерос. науч.-
практ. конф., Владимир, 17- 21 апр. 1995 г. - Владимир, 1995. - С. 252.
13.Мудрак Н.С.,
Федосеев К.Ю., Оковытая Т.В., Кузнецов В.Н., Борисов А.В. Сравнительная оценка
ИФА и РДП в диагностике ИББ // Вирус. болезни с.- х. животных: Тез. докл.
Всерос. науч.- практ. конф., Владимир, 17- 21 апр. 1995 г. - Владимир, 1995. -
С. 246.
14.Новиков В. Б.,
Дмитриенко В. В. Влияние вируса болезни Гамборо на формирование иммунитета у
цыплят против ньюкаслской болезни // Вопр. вет. вирусол. микробиол. и
эпизоотол.: Матер. науч. конф. ВНИИ вет. вирусологии и микробиологии, окт. 1992
г.- Покров, 1992. - С. 166- 167.
15.Щербакова Л.О.,
Колосов С.Н., Щербаков А.В., Дрыгин В.В., Борисов А.В., Гусев А.А. Антигенная
вариабельность штаммов вируса инфекционной бурсальной болезни птиц (ИББ),
использующихся в качестве вакцин // Вирус. болезни с.- х. животных: Тез. докл.
Всерос. науч.- практ. конф., Владимир, 17- 21 апр. 1995 г. - Владимир, 1995. -
С. 237- 238.
16.Allan W. H., Faragher J. T., Gullen G. A. Immunosupression
the infectious bursal agent in chickens immunized against Newcastle disease //
Vet. Rec.. - 1972. - Vol. 90. - P. 511- 512.
17.Asakawa J., Tsiagbe V.K., Thorbecke G.J. Protection against
apoptosis in chicken bursa cells by phorbol ester in vitro // Cellular
Immunology. - 1993. - Vol. 147. - P. 180- 187.
18.Auttti
M. M. Infectious bursal disease (Gumboro) and vaccinations // Poultry Guide.
1987. - Vol. 24. - № 11-12. - P. 217-219.
19.Bayyary G.R., Story J.D., Beasley J.N., Skeeles J.K.
Antigenic characterization of an Arkansas isolate of infectious bursal disease
virus // Avian Dis. - 1996. - Vol. 40. - № 3. - P. 588- 599.
20.Burkhart E., Muller H. Susceptibility of chicken blood
lymphoblasts and monocytes to infectious bursal disease virus (IBDV) //
Archives of virology. - 1987. - Vol. 94. - P. 297- 303.
21.Chandravanshi R.R. Strategic planning of IBD control //
Poultry Adviser. - 1993. - Vol. 26. - P. 25- 27.
22.Cloud
S.S., Lillehoj H.S., Rosenberger J.K. Immune disjunction following infection
with chicken anemia agent and infectious bursal disease virus: kinetic
alterations of avian lymphocyte subpopulations // Veter. Immunol. Immunopathol.
- 1992. - Vol. 34. - № 3/4. - P. 337- 352.
23.Cohen J.J. Programmed cell death in the immune system //
Advances in Immunology. - 1991. - Vol. 50. - P. 55- 85.
24.Goddard R.D., Wyeth P.J., Varney W.C. Vaccination of
commercial layer chicks against infectious bursal disease with maternally
derived antibodies // Vet. Rec. - 1994. - Vol. 135. - № 12. - P. 273- 274.
25.Hassan
M.K., Al- Natour M.Q., Ward L.A., Saif Y.M. Pathogenicity, attenuation, and
immunogenicity of infectious bursal disease virus // Avian. Dis. - 1996. - Vol.
40. - № 3. - P. 567- 571.
26.Hassan M.K., Saif Y.M. Influence of the host system on the
pathogenicity, immunogenicity, and antigenicity of infectious bursal disease
virus // Avian Dis. - 1996. - Vol. 40. - № 3. - P. 553- 561.
27.Hassan M.K., Saif Y.M., Shawky S. Comparison between antigen-
capture ELISA and conventional methods used for titration of infectious bursal
disease virus // Avian Dis. - 1996. - Vol. 40. - № 3. - P. 562- 566.
28.Lam K.M. Lysis of chicken lymphocytes by infectious bursal
disease viruses // Avian Dis.. - 1988. - Vol. 32. - P. 818- 821.
29.Lam K.M. Morphological evidence of apoptosis in chickens
infected with infectious bursal disease virus // J.- comp.- pathol. - 1996. -
Vol. 116. - № 4. - P. 367- 377.
30.Lasher H.N., Davis V.S. History of infectious bursal disease
in the U.S.A - the first two decades // Avian-dis. - 1997. - Vol. 41. - № 1. -
P.11- 19.
31.Lucio B., Hitchner S.B. Infectious bursal disease emulsified
vaccine: effect upon neutralizing antibody levels in the dam and subsequent
protection of the progeny // Avian Dis. - 1979. - Vol. 23. - P. 466- 468.
32.Lucio B. Why infectious bursal disease (Gumboro) vaccines
fail // Cornell Poultry Pointers. - 1994. - Vol. 44. - N. 3. - P. 18- 19.
33.Lukert P.D., Saif Y.M. Infectious bursal disease // Diseases
of Poultry. - 1991. - Vol. 9. - P. 648- 663.
34.McCabe M.J., Orrenius S. Deletion and depletion : the
involvement of viruses and environmental factors in T- lymphocyte apoptosis //
Laboratore Investigation . - 1992. - Vol. 66. - P. 403- 406.
35.Motyka B., Reynolds J.D. Apoptosis is assotiated with the
extensive B cell death in the sheep ileal Peyer's Patch and the chicken bursa of
Fabricius : a possible role in B cell selection // European Journal of
Immunology. - 1991. - Vol. 21. - P. 1951- 1958.
36.Nieper H., Muller H. Susceptibility of chicken lymphoid cells
to infectious bursal disease virus does not correlate with the presence of
specific binding sites // J.- gen.- virol. - 1996. - Vol. 77. - № 6. - P. 1229-
1237.
37.Nunoya T., Otaki Y., Tajima M. Occurrence of acute infectious
bursal disease with high mortality in Japan and pathogenicity of field isolates
in specific- pathogen- free chickens // Avian Dis. - 1992. - Vol. 36. - № 3. -
P. 597- 609.
39.Rosenberger J.K., Cloud S.S., Metz A. Use of infectious
bursal disease virus variant vaccines in broilers and broiler breeders // Proc.
36 th Western Poultry Dis. Conf. - P. 105.
40.Tham K.M., Moon C.D. Apoptosis in cell cultures induced by
infectious bursal disease virus following in vitro infection // Avian Dis. -
1996. - Vol. 40. - № 1. - P. 109- 113.