Охрана Водных Экосистем
ІОН-СЕЛЕКТИВНІ ЕЛЕКТРОДИ
ДЛЯ
ВИЗНАЧЕННЯ МЕЛОКСИКАМУ
Зміст
ПЕРЕЛІК УМОВНИХ
ПОЗНАЧЕНЬ, СИМВОЛІВ, ТЕРМІНІВ
Вступ
Розділ 1 Класифікація Нпзп, ЗАГАЛЬНА Характеристика
Мелоксикаму та методи його визначення
.1 Класифікація
нестероїдних протизапальних препаратів
.2 Мелоксикам, як
лікарський засіб
.2.1 Фізичні та
хімічні властивості мелоксикаму
.2.2 Фармацевтичні
властивості мелоксикаму
.2.3 Застосування
мелоксикаму
.2.4 Форми випуску
лікарських засобів на основі мелоксикаму
.3 Методи визначення
мелоксикаму
.3.1 Хроматографічні
методики визначення
.3.2
Спектрофотометричні методики визначення
.3.3 Інші методи
визначення мелоксикаму
.4 Лікарський засіб,
рівні якості
Висновки до розділу 1
Розділ 2 Методика
та техніка експерименту
.1 Приготування
стандартних розчинів
.2 Синтез іонних
асоціатів для іоноселективних електродів
.3 Приготування
полівінілхлоридної мембрани
Висновки до розділу 2
Розділ 3. Іоноселективні електроди на основі іонних
асоціатів як електродоактивних речовин для визначення мелоксикаму
3.1
Основні електрохімічні характеристики іоноселективних електродів
3.1.1
Нижня межа виявлення
3.1.2
Вивчення залежності потенціалу від рН розчину
3.1.3
Відтворюваність та дрейф потенціалу
3.1.4
Час відгуку
3.1.5
Коефіцієнт селективності
3.2
Встановлення оптимальних умов роботи мелоксикам-селективного сенсора
3.2.1
Вплив природи і вмісту пластифікатора на основні електродні характеристики ІСЕ
3.2.2
Вплив природи ЕАР на основні електродні характеристики мелоксикам селективних
електродів
3.2.3
Вплив вмісту електродоактивної речовини в мембрані
3.2.4
Вплив рН розчину
3.2.5
Час відклику
3.2.6
Селективність
3.2.7
Відтворюваність основних електродних характеристик мелоксикам-чутливих сенсорів
Висновки
до розділу 3
Висновки
Література
ПЕРЕЛІК УМОВНИХ
ПОЗНАЧЕНЬ, СИМВОЛІВ, ТЕРМІНІВ
ВЕРХ - високо ефективна рідинна
хроматографія;
ЕАР - електродоактивна речовина;
ІА - іонний асоціат;
ІСЕ - іон-селективний електрод;
Мел - мелоксикам;
НПЗП - нестероїдні протизапальні
препарати;
ОБ - основний барвник;
ОФ ВЕРХ - обернено фазова високо ефективна
рідинна хроматографія;
ПВХ - полівінілхлорид;
РХ - рідинна хроматографія;
ТШХ - тонкошарова хроматографія;
ЦОГ-2 - циклооксигеназа.
Вступ
Сучасна медицина немислима без використання лікарських
препаратів, але вони повинні бути не лише ефективними, але й безпечними.
Причиною небезпеки може бути: невідповідність кількісного вмісту субстанції
згідно специфікації, наявність домішок, продуктів розкладу тощо. У зв’язку із
цим і існує потреба постійного строгого контролю якості фармацевтичної
продукції на всіх стадіях виробництва - від сировини до готових лікарських
форм.
Один із методів, який дозволяє з високою точністю, чутливістю
та селективністю визначати речовини в багатокомпонентних сумішах є
потенціометрія з використанням іон-селектривних електродів (ІСЕ). Проте, на
даний час, для більшості лікарських засобів, не існує потенціометричних
методик, за допомогою яких можна було б проводити такі визначення.
В останні роки у літературі з’являються дані щодо ефективного
використання іонних асоціатів (ІА) основних барвників (ОБ) як електродоактивних
речовин для іоноселективних електродів [ ]. Такі сполуки відповідають основним
вимогам, які ставляться до електродоактивних речовин, а саме: вони краще
розчинні в органічному розчиннику у порівнянні з водним розчином і здатні до
часткової дисоціації в органічній фазі з утворенням потенціалвизначуваних
іонів.
Актуальність розробки ІСЕ для визначення мелоксикаму обумовлена, з одного
боку, очевидними перевагами методу потенціометрії (простота, експресність,
чутливість, селективність, можливість проведення аналізу в каламутних і
забарвлених середовищах і т.п.), а з іншого боку, тією роллю, яку відіграє
мелоксикам у сучасній фармації. Адже, на сьогодні, мелоксикам є одним із
найбільш ефективних нестероїдних протизапальних препаратів (НПЗП), які
використовуються у медичній практиці для лікування різного роду запальних
процесів.
Зв’язок роботи із науковими програмами, планами, темами. Робота виконана згідно з
напрямом кафедри аналітичної хімії Волинського національного університету імені
Лесі Українки відповідно до програми прикладних досліджень за держбюджетною
темою Міністерства освіти і науки України “Сполуки на основі органічних
катіонів для аналізу фармацевтичних препаратів та інших об’єктів” (2008-2009
рр., номер держ. реєстрації - 0108U000404), міжнародних проектів № М/177-2006
“Іонні асоціати на основі органічних основ як електрохімічні сенсори в
іонометрії” (2006-2007 рр., номер держ. реєстрації - 0106U005822), № М/82-2008
“Нові аналітичні форми для визначення деяких органічних та неорганічних речовин
у фармацевтичних препаратах” (2008-2009 рр., номер держ. реєстрації -
0108U003119).
Мета та завдання дослідження. Метa роботи - обґрунтувати
можливість аналітичного застосування ІА мелоксикаму з ОБ (як протиіонів), а
також розробити й апробувати нові чутливі, селективні та експресні
потенціометричні методики визначення цього НПЗП.
Для досягнення поставленої мети необхідно вирішити такі завдання:
- виготовити іоноселективні електроди (ІСЕ), що містять виділені
у твердому вигляді ІА як електродоактивну речовину (ЕАР), із
полівінілхлоридними мембранами, що відрізняються за вмістом і природою
пластифікатора, електродоактивної речовини;
вивчити вплив складу мембрани на основні хіміко-аналітичні
характеристики (рН-діапазон функціонування, чутливість, нахил і межі лінійного
нахилу електродної функції, відтворюваність потенціалу, час відклику та життя),
а також на потенціометричну селективність таких ІСЕ щодо ряду іонів й
органічних речовин;
розробити методику потенціометричного із використанням ІСЕ на
основі ІА методу визначення мелоксикаму та, визначивши його основні
метрологічні характеристики, дати порівняльну оцінку розробленої методики з
відомими на сьогодні аналогами, а також методиками, що пропонуються фармакопеями.
Об’єкт дослідження - іонні асоціати мелоксикаму з основними
барвниками; ІСЕ на основі ІА оборотні до аніону мелоксикаму.
Предмет дослідження - електро-аналітичні характеристики
мелоксикам селективних електродів.
Наукова новизна одержаних результатів. У результаті проведених нами
досліджень показано, що мелоксикам з ОБ утворює іонні асоціати. Встановлено, що
дані ІА можуть бути виділені у твердому вигляді й використані як
електродоактивні речовини для створення іоноселективних електродів для визначення
мелоксикаму. На їх основі виготовлено електроди різного складу. Вивчено вплив
природи і вмісту електродоактивної речовини, пластифікатора й інших факторів на
хіміко-аналітичні характеристики розроблених електродів.
Практичне значення одержаних результатів полягає у використанні
досліджених аналітичних форм для розробки доступних чутливих і селективних
методик потенціометричного визначення мелоксикаму в фармацевтичних препаратах.
Особистий внесок дипломанта у дослідження полягає в аналізі
літературних даних щодо методів виявлення та визначення мелоксикаму, проведенні
експериментальних досліджень та розробці аналітичної методики. Постановка
завдань досліджень, обговорення й узагальнення результатів експерименту,
формулювання загальних висновків здійснювалася науковим керівником старшим
викладачем Гунькою І. П за участю дипломанта.
Структура й обсяг випускної роботи. Випускна робота складається
зі вступу, 3 розділів, висновків, списку використаної літератури. Текст
дипломної роботи викладено на 37 сторінках та містить 6 таблиць, 7 рисунків.
Мелоксикам розроблений на межі 1980-1990-х років.
Упровадження його в медичну практику стало значним здобутком у фармакології
кінця ХХ століття, оскільки це суттєво вплинуло на зниження частоти розвитку
гастроінтестинальних ускладнень.
Таблиця
1.1
Хімічна
класифікація, назви, структурні формули НПЗП
|
Речовина
|
Структурні формули
|
|
1. Карбоксильні кислоти
|
|
Саліцилати 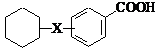
|
|
Ацетилсаліцилова кислота
(торгова назва: Аспірин)
|
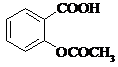 Мr = 180,04 Мr = 180,04
|
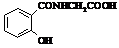 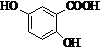 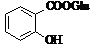 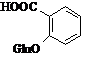 Метаболіти
аспірину Метаболіти
аспірину
|
|
Дифлунізан (торгова назва:
Долобід)
|
 Мr = 250,04 Мr = 250,04
|
Інші саліцилати:
Алокспірин, Амоксіпрім, Фаісламін, Бенорилат, Салсалат
|
|
Пропіонати (“профени”) 
|
|
Ібупрофен (торгові марки:
Акт-3, Адвіл, Бруфен, Мотрін, Нупрін, Нурофен)
|
 Мr = 206,13 Мr = 206,13
|
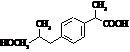    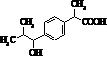 Метаболіти ібупрофену Метаболіти ібупрофену
|
|
Фенопрофен (торгова назва:
Налфон)
|
 Мr = 242,09 Мr = 242,09
|
  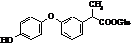 Метаболіти фенопрофену Метаболіти фенопрофену
|
|
Кетопрофен (торгові назви:
Орудіс, Оруваіл)
|
 Мr =254,09 Мr =254,09
|
 Метаболіт кетопрофену Метаболіт кетопрофену
|
|
Напроксен (торгові марки:
Алеве, Анапрокс та ін.)
|
 Мr
=230,09 Мr
=230,09
|
  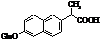 Метаболіти напроксену Метаболіти напроксену
|
|
|
|
|
|
|
|
Оцтові кислоти 
|
|
Індометацин (торгові марки:
Індоцин, Індоцид)
|
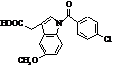 Мr =343,06 Мr =343,06
|
|
Кеторолак (торгова марка:
Торадол)
|
 Мr = 255,06 Мr = 255,06
|
|
Диклофенак (торгові марки:
Вольтарен, Вольтарол та ін.)
|
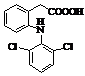 Мr = 295,01 Мr = 295,01
|
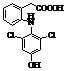 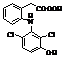   Метаболіти диклофенаку Метаболіти диклофенаку
|
|
Антранілати 
|
|
Мекофленамікова кислота
(Мекломен)
|
 Мr = 295,02 Мr = 295,02
|
Мефенамінова кислота
(Понстел)
|
 Мr = 241,11 Мr = 241,11
|
|
2. Енолінові кислоти
|
|
Оксиками
|
|
Піроксикам (Фелдене)
|
 Мr = 331,06 Мr = 331,06
|
Мелоксикам (Мобік)
|
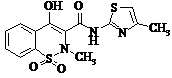 Мr = 351,03 Мr = 351,03
|
|
Піразолони
|
|
Фенілбутазон або Буте
|
 Мr = 308,15 Мr = 308,15
|
Інші піразоліни:
Оксифенілбутазон, Азапропазон
|
|
3. Аніліни
|
|
Ацетоамінофен або
парацетамол (Панадол, Тиленол та ін.)
|
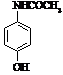 Мr = 151,06 Мr = 151,06
|
Фенацетин або
ацетофенетідин
|
 Мr = 179,09 Мr = 179,09
|
|
|
|
|
|
|
|
1.2 Мелоксикам, як лікарський
засіб
Мелоксикам, як і всі речовини, володіє фізичними, хімічними
та іншими властивостями, які є специфічними і відрізняють його від інших.
1.2.1 Фізичні та хімічні
властивості мелоксикаму
Мелоксикам (C14H13N3O4S2)-(4-гідрокси-2-метил
N-(5-метил-2-тіазоліл)-2Н-1,2-бензотіазин-3-карбоксамід-1,1-діоксид). Похідна
оксикаму. Світло-жовта речовина, практично не розчинна у воді, дуже добре
розчинна в сильних кислотах, лугах, дещо розчинна в метанолі. Значення pKa
мелоксикаму 1,1 і 4,2. Молекулярна маса- 351,41 [].
1.2.2 Фармацевтичні
властивості мелоксикаму
Метааналіз дванадцяти досліджень, в яких мелоксикам
призначали понад 20 тис. пацієнтів, показав зниження ризику виникнення
серйозних гастроінтестинальних ускладнень (виразок, перфорацій, кровотеч) на 36 % і 48 % порівняно з терапією
диклофенаку натрію, піроксикаму та напроксену.
Дослідження показують, що його переносимість виявилася досить
високою у більшості пацієнтів із ревматичними захворюваннями. При цьому
кількість побічних ефектів, у тому числі шлунково-кишкових, незначна.
Терапевтична ефективність і безпека мелоксикаму, зокрема
Мовалісу, вивчена у численних рандомізованих дослідженнях, проведених в Україні
та поза її межами. Мелоксикам порівняно з такими традиційними НПЗП, як
диклофенак натрію, піроксикам та інші, при тривалому застосуванні відрізняється
меншою гепато- та нефротоксичністю. Мелоксикам практично не чинить негативного
впливу при його одночасному застосуванні зі серцевими глікозидами,
адреноблокаторами, діуретиками, цитостатиками, що має велике значення при
призначенні цих лікарських засобів пацієнтам із відповідними захворюваннями [].
1.2.3 Застосування
мелоксикаму
Мелоксикам застосовується при запальних і дегенеративних
захворюваннях суглобів, що супроводжуються больовим синдромом: артрити, в тому
числі ревматоідний артрит, гострий остеоартрит, хронічний поліартрит; спондиліт
(хвороба Бехтерева), больовий синдром при остеоартрозах і радикулітах [].
1.2.4 Форми випуску лікарських
засобів на основі мелоксикаму
Мелоксикам, як нестероїдний протизапальний засіб широко застосовується
у медичній практиці. На основі його субстанції розроблена значна кількість
препаратів різної форми випуску таких як: пігулки, гелі, свічки, креми,
таблетки. На фармацевтичному ринку України зустрічається у широкому асортименті
лікарських форм, а саме: Моваліс (Movalis)
<#"55866.files/image041.gif">
Рис. 1.1. Аналітичні методи для визначення мелоксикаму
1.3.1 Хроматографічні
методики визначення
Можливість визначення мелоксикаму
найбільш повніше описано методами хроматографії. Більшість із цих методик
присвячені визначенню препарату у людській плазмі [ ], причому
зазвичай використовують метод високоефективної рідинної хроматографії (ВЕРХ).
Для визначення мелоксикаму у людській плазмі описаний простий і
чутливий метод високоефективної рідинної хроматографії з УФ детектуванням
(ВЕРХ-УФ) [11;16]. Згідно методики, після екстракції з діетиловим ефіром,
хроматографічне відділення мелоксикаму здійснювалося з використанням
зворотно-фазової колонки (150 мм x 4.6 мм, 5 мкм) Sunfire C18
із рухомою фазою ацетонітрил - 20 мM калій гідрогенфосфат (40:60, pH 3,5) і УФ-детектуванням при довжині хвилі 355 нм.
Швидкість потоку рухомої фази складала 1,2 мл/хв., а час утримання мелоксикаму
і внутрішнього стандарту, піроксикаму - 11,6 та 6,3 хв, відповідно.
Калібрувальний графік лінійний у межах концентраційного ряду 10 - 240 нг/мл (r2>0,9999) мелоксикаму. Нижня межа
визначення становить 10 нг/мл мелоксикаму, що є свідченням того, що дана
методика є менш чутливою на відміну від хроматографічної методики, описаної в [15], де чутливість визначення мелоксикаму становить 8,96 нг/мл,
а лінійність - 8,96 - 2059 нг/мл. Дана
методика дозволила покращити чутливість визначення мікрокількостей мелоксикаму
в плазмі крові з використанням ВЕРХ-УФ. Середня точність аналізу - 98-114 %.
Коефіцієнт варіації (точність) в intra- і inter-дні - 1,6 - 4,3 і 2,4 - 7,3 %, відповідно
[11].
Також можливе інше детектування сигналу при визначенні
мелоксикаму методами хроматографії. Так мас-спектрометричний спосіб
детектування використано в [12] для визначення невеликих концентрацій
мелоксикаму в плазмі. Рухома фаза в описаній методиці складається з суміші
ацетонітрил-вода-мурашина кислота у об’ємних співвідношеннях 80:20:0,2, нижня
межа визначення мелоксикаму складає 0,10 нг/мл. Калібрувальний графік лінійний
в межах 0,10-50,0 нг/мл мелоксикаму.
Градієнтна мас-спектрофотометрія
застосована для одночасного визначення мелоксикаму, піроксикаму і теноксикаму в
плазмі []. Піроксикам, мелоксикам, теноксикам й ізоксикам як
внутрішній стандарт екстрагували з людської плазми етилацетатом у кислому
середовищі й аналізували на колонці Sunfire з рухомою фазою
метанол-амоній форміат (15 мM, pH 3,0) (60:40, об’ємні
співвідношення). Лінійність калібрації в даній у методиці (r=1,000) - 0,50 -
200 нг/мл мелоксикаму. Коефіцієнт вибірковості та відносної похибки для
мелоксикаму становить - 1,0 для 5,4 % і 5,9 для 2,8 %.
Зустрічаються, також, методики визначення мелоксикаму у
синтетичних сумішах [], тваринних тканинах (м’язах та печінці) [] тощо.
Так, у [18] описана методика одночасного визначення мелоксикаму та pridinol mesylate в їх синтетичних сумішах. Як рухому фазу
використовували суміш метанолу, ізопропанолу та 50 мМ калій фосфатного
буферу (pH 5,9) у об’ємному співвідношенні 51:9:40.
УФ-детектування здійснюється при 225 нм. Метод застосовний в концентраційних
межах 33,7 - 61,8 мг/л мелоксикаму.
Також описано методику визначення мелоксикаму у плазмі методом ОФ ВЕРХ
із звичайним елююванням [14]. Автори застосовували колонку з алкіл-діол
сіліцієм. Перевагою даного методу є можливість
прямого дослідження плазми, без попередньої екстракції. Зразки плазми були
введені у конку з алкіл-діол сіліцієм,
використавши 0,05 М фосфатний буфер, pH 6,0. За рухому фазу вокористано суміш 0,05 М фосфатнго
буферу - 30 % ацетонітрилу - 25 мM т-бутиламіну при pH
7,0. Лінійність калібрувальної кривої виконується в межах 5-3500 нг/мл
мелоксикаму.
Простий і швидкий метод ВЕРХ для виявлення мелоксикаму у
плазмі описаний у [16]. Дана методика повністю відкидає
процедуру екстракції органічними розчинниками. Протеїни плазми були добуті,
використовуючи хлоридну кислоту (70 %) і ацетонітрил (1:1). Хроматографічна
колонка містила рухому фазу - суміш натрій ацетатного буферу (pH 3,3; 170 ммоль) і ацетонітрилу (62:38).
УФ-детектування проводять при λ=355 нм. Отримана калібрувальна крива
лінійна в межах 50-1500 нг/мл мелоксикаму.
Визначення мелоксикаму у чистій формі, а також у
фармацевтичних препаратах за допомогою ВЕРХ викладено у роботі []. Мелоксикам визначають за наявності його продуктів розкладу в
межах 100-500 мкг/мл з середньою процентною точністю 100,13 ± 0,53.
Детектування проводять при 365 нм. Як рухому фазу використовуєть метанол і
ацетатний буферний із pH 4,3
(45:55).
Основні хіміко-аналітичні характеристики описаних
хроматографічних методик визначення мелоксикаму подано у таблиці 1.2.
Таблиця
1.2
Основні
характеристики хроматографічних методик визначення мелоксикаму
|
Препарат
|
Вид хро-ї
|
Спосіб
детектування
|
Рухома фаза
|
Л-ть, нг/мл
|
Сmin, нг/мл
|
Л-ра
|
|
Мелоксикам pridinol mesylate
|
ОФ ВЕРХ
|
УФ, λ=225
нм
|
Метанол-ізопрпанол-50
мМ К3РО4 (51:9:40), рН=5,9
|
-
|
-
|
[18]
|
|
Мелоксикам
|
ВЕРХ
|
УФ, λ=355
нм
|
Ацетонітрил-20 мМ
КН2РО4 (40:60), рН=3,5
|
10-2400
|
10
|
[11]
|
|
Мелоксикам
|
РХ
|
Мас-спектрометрія
|
Ацетонітрил-вода-мурашина
к-та (80:20:0,2)
|
0,10-50
|
0,10
|
[12]
|
|
Мелоксикам,
Піроксикам, Теноксикам
|
РХ
|
Мас-спектрометрія
|
Метанол- 15 мМ
амоній форміат (60:40), рН=3,0
|
0,5-200
|
0,5
|
[17]
|
|
Мелоксикам, Капрофен, Толметінова к-та
|
РХ
|
Мас-спектрометрія
(електронного захвату)
|
10 мМ
форміатна к-та-метанол (50:50)
|
-
|
-
|
[19]
|
|
Мелоксикам
|
РХ
|
УФ, λ=364
нм
|
0,05 М фосфатний
буфер-30% ацетонітрил-25 мМ т-бутиламін, рН=7
|
5-3500, 50-3500
|
3
|
[14]
|
|
Мелоксикам
|
РХ
|
Мас-спектрометрія
|
Ацетонітрил-0,2 %
форміатна к-та (65:35), рН=3,1
|
8,96-2059
|
8,96
|
[15]
|
|
Мелоксикам
|
ВЕРХ
|
УФ, λ=355
нм
|
Натрій ацетатний буфер
(рН=3,3;170 ммоль)-ацетонітрил(62:38)
|
50-1500
|
50
|
[16]
|
|
Мелоксикам
|
УФ, λ=365
нм
|
Метанол-ацетатний
буфер рН=4,3 (45:55)
|
100-500 мкг/мл
|
|
[20]
|
Проте
суттєвим недоліком хроматографічних методів аналізу все ж залишається висока
вартість обладнання, яке, на жаль, доступне не усім аналітичним лабораторіям.
1.3.2 Спектрофотометричні
методики визначення
У літературних джерелах
дані, що ґрунтуються на методах спектрофотометричного визначення мелоксикаму у
фармацевтичних препаратах або зразках біологічних рідин, є практично
відсутніми.
Знайдена методика [], яка
присвячена колориметричному визначенню мелоксикаму у дозованих лікарських
формах у присутності його продукту розкладання. Цей метод комбінований із ТШХ
на силіцієвому гелі GE 254 з детектуванням сигналу при 365 нм.
Метод спектрофотометрії
для кількісного визначення мелоксикаму, що ґрунтується на утворенні ним сполуки
з 5-метил-2-амінотіазолом і бензотіазін карбоновою кислотою в 0,1 М NAOH і реєстрації
сигналу при 338 нм, запропонований автором []. Крім того, в методиці описане
визначення мелоксикаму в таблетках і свічках, використовуючи утворення його
комплексу з сафраніном
T.
Добре відомо, що аніони деяких органічних кислот здатні утворювати з
катіонами основних барвників сполуки типу іонних асоціатів, що може служити
основою для їх спектрофотометричного визначення. Так, в [21]
описано методику визначення мелоксикаму, що основана на утворенні його
комплексного асоціату з сафраніном Т, який добре екстрагується
хлороформом, і подальшим вимірюванням поглинання при λ=518
нм.
Ефективність екстракції іонного асоціату хлороформом залежить від pH середовища (оптимальне значення pH=8,0) (метод С). Поряд
з цією методикою описано ще дві: метод А -
оснований на вимірюванні частин спектра мелоксикаму при 339,9 - 384,7 нм, метод B - на реєстрації
основного і похідного спектрів мелоксикаму в етанолі та 0,1 М хлористоводневій
кислоті. Калібрувальний графік виконується в межах 2 - 10 мкг/мл (метод А),
1 - 10 мкг/мл (метод В), 4 - 12 мкг/мл (метод С). Межі визначення
становлять 0,11; 0,07 і 0,10; 0,33 для методів А, В і С,
відповідно.
Автори [] описують
спектрофотометричне визначення мелоксикаму у фармпрепаратах з використанням
інжекційної процедури. Метод заснований на
утворенні зеленого комплексу між мелоксикамом і Fe(III) (2-мелоксикам/Fe(III)) у метанолі.
Калібрувальні графіки, отримані вимірюванням поглинання світла при 570 нм, є
лінійними в інтервалі 2,0 - 200 та 5,0 - 250 мг/л мелоксикаму і межею виявлення
0,47 і 0,72 мг/л, відповідно. Також запропонований інжекційний метод
спектрофотометрії, що включає вимірювання поглинання світла при 362 нм в 0,1 М
NaOH. Лінійність калібрувального графіка становить 0,5 - 20 мг/л, чутливість -
0,04 мг/л мелоксикаму.
Метод заснований на вимірюванні поглинання світла
формованого нейтрального комплексу між ОБ метиловим синім і мелоксикамом в
фосфатному буфері (pH 8) при λ=653,5 нм викладено в роботі [20]. Лінійність
калібрувального графіка в даному методі виконується при 1 - 5 мкг/мл
мелоксикаму.
Розроблений і
затверджений спектрофотометричний метод визначення іона уранілу UO22+, в присутності
інших іонів, оснований на утворенні координаційного комплексу урану (VI) з
мелоксикамом через β-дикетон.
Утворений жовтий комплекс поглинає світло при λ=398 нм. Калібрувальний графік виконується в межах
5-60 мкм/мл з чутливістю 5,02Ч104 л моль-1 см-1
[].
У таблиці 1.3 подано реагенти та
основні хіміко-аналітичні характеристики спектрофотометричних методик
визначення мелоксикаму.
Таблиця
1.3
Основні характеристики
спектрофотометричних методик визначення мелоксикаму
|
Реагент
|
рН
|
λmax, нм
|
ε, 104
|
Сmin, мкг/мл
|
а,
мкг/мл
|
Л-ра
|
|
U(VI), 1,4-діоксан
|
-
|
398
|
5,02
|
0,370
|
5-60
|
[24]
|
|
Fe(III)-Мел, метанол Fe(III)-Мел,
інжекц. Мел-0,1 М NaOH, інжекц.
|
-
|
570 570
362
|
0,1194
1,570
|
|
2-200
5-250 0,5-20
|
[23]
|
|
Сафранін
Т (СНСl3, екстракція)
|
8
|
518
|
2,5
|
0,33
|
4-12
|
[21]
|
|
Метиловий
синій (СНСl3, екстракція)
|
8
|
653,5
|
|
2,7
нг/мл
|
1-5
|
[20]
|
Описані екстракційно-фотометричні
методики ґрунтуються на використанні шкідливих розчинників й не забезпечують
достатньої чутливості визначення. Все це потребує удосконалення, пошуку нових
більш ефективних методик спектрофотометричного визначення мелоксикаму.
1.3.3 Інші методи визначення
мелоксикаму
Крім хроматографічних та
спектрофотометричних методів для визначення мелоксикаму у літературі описані
також інші методи, зокрема врльтамперометрії та інших.
У роботі [] подано методику
полярографічного визначення мелоксикаму у дозованих лікарських формах і плазмі.
Вольамперометрична поведінка мелоксикаму вивчалася,
використовуючи постійний струм, змінну полярографію і циклічну
вольтамперометрію. Вплив природи буфера, рН, концентрації і інших чинників
розглядалися у методі пульсуючої полярографії. Кращий результат був отриманий в
ацетатному буферному розчині при рН=4,88. Максимальне значення ЕРС виміряне з
крапельним ртутним електродом - 1,49 на проти
Ag/AgCl. Калібрувальний графік є лінійним в межах концентраційного ряду 0,38 -
15 мкг/мл мелоксикаму. Чутливість методу - 0,02 мкг/мл мелоксикаму. Метод може
бути застосований для визначення даного препарату у плазмі, є простим і швидким
без стадій екстракції та випаровування.
Для визначення мелоксикаму у
таблетках запропоновано капілярний зонний електрофорез []. Вплив
природи буферу, pH, органічного розчинника, температури,
прикладеної напруги та часу випробування досліджені для силіцієвого капіляра
(діаметр 50 мкм, загальна довжина 44 см, активна довжина 35,5 см). Оптимальний
результат отриманий для 0,01 М боратного буферу (pH 8,5), що містить 5 %
метанолу, капілярна температура 25˚C, прикладена напруга 20
кВ і час випробування 3 сек. Визначення проводили при λ=205 нм. Дифлунізан використовувався як внутрішній стандарт. Метод
застосований для шести фармацевтичних препаратів і показав хорошу вибірковість,
точність, лінійність (0,5 - 150 мкг/мл) і чутливість. Межа визначення становить
0,3 мкг/мл, відносне середнє квадратичне відхилення - 0,66 %.
Результати були порівняні з методом спектрофотометрії, що відомі в літературі,
при цьому ніякої статистичної різниці не виявлено.
Описаний швидкий і
чутливий метод інжекційної хемілюмінісценсії для визначення мелоксикаму, який
заснований на його відгуку з N - бромсукцинімідом
(С4Н4BrNO2) у лужному середовищі. При
оптимальних умовах (0,01 моль/л NaOH) запропонований метод дозволяє отримати
лінійність в межах концентраційного ряду від 2,2∙10-7 до 2,8∙10-5
моль/л з межею виявлення 7,7∙10-8 моль/л мелоксикаму. Відносне
середнє квадратичне відхилення для 11 паралельних вимірювань 2,8∙10-6
моль/л мелоксикаму складає 2,14 %. Метод успішно застосовний до визначення
мелоксикаму у фармацевтичних препаратах, не вимагає спеціальних
реактивів і устаткування [].
Колориметричний метод, заснований на відгуку з
2,3-дихлоро-5,6-диціано-п-бензохіноном, що приводить до утворення
інтенсивного оранжево-червоного продукту після нагрівання на водяній бані
протягом 5 хв подано у [20]. Утворена сполука дає максимум поглинання при 455 нм.
Лінійність калібрувального графіка виконується від 40 до 160 мкг/мл із
середньою процентною точністю 100,53±1,04. Межа визначення мелоксикаму -
3,38 мкг/мл.
Зважаючи на велику кількість НПЗП, великий обсяг їхнього
виробництва і широке використання в медичній практиці, методи їх кількісного
визначення є недостатніми і не завжди задовольняють вимоги фармакопейного
аналізу. Крім того, існує велика проблема фальсифікації лікарських засобів [; ], що не лише потребує, а й вимагає
чіткого контролю їх якості.
Тому актуальним є пошук і розробка нових більш досконалих,
порівняно з відомими і затвердженими на даний час, методів кількісного аналізу
препарату мелоксикаму, що може бути реалізовано методом потенціометрії при
розробці і використанні іоноселективних електродів на основі іонних асоціатів з
основними барвниками як електродоактивних речовин.
.4 Лікарський засіб, рівні
якості
Згідно визначення, приведеного в Законі України „Про
лікарські засоби” (1996), якість лікарського препарату - це сукупність
властивостей, які надають лікарським препаратам здатність задовольняти
споживачів в відповідності до своєї приналежності і відповідають вимогам, що
встановленні законодавством. Однак, це визначення є надто широким і охоплює три
різних рівні якості лікарських засобів [22]:
-й рівень - характеризує ефективність і безпеку (а також
співвідношення користь/ризик) самої фармацевтичної речовини (разом із схемою її
застосування).
-й рівень - характеризує рівень вимог до якості специфікації
на субстанцію і готовий лікарський засіб, а також рівень розробки, виробництва
і контролю якості лікарських засобів (наприклад, належної виробничої практики -
Good Manufacturing Practice / GMP), тобто характеризує відмінність в
якості між різними виробниками одного і того ж лікарського засобу. Головним із
основних критеріїв є відповідність вимог специфікації на препарат відповідно до
вимог Державної Фармакопеї України, яка і встановлює державний стандарт якості
лікарських препаратів.
3-й рівень - характеризує відповідність конкретного зразку препарату
вимогам власної специфікації (що є частиною реєстраційного досьє). З точки зору
третього рівня якості, препарат, що відповідає вимогам своєї специфікації, є
стандартним, тобто якісним. Препарат, що не відповідає вимогам своєї
специфікації, є субстандартним, тобто неякісним. На відміну від 1-го та 2-го
рівнів, споживач при купівлі не знає, чи відповідає препарат 3-му рівню якості,
є він стандартним чи субстандартним.
Останній, третій рівень, по суті й говорить про
необхідність ефективних, надійних методів аналітично-фармацевтичного контролю
якості лікарських засобів (кількісний вміст, однорідність маси, здатність до
розпадання, механічні доміши тощо).
Висновки до розділу 1
Здійснено огляд та аналіз літературних даних щодо наявних на
сьогоднішній день методів виявлення та визначення мелоксикаму.
Обґрунтовано необхідність розробки нових іонометричних
методик для визначення мелоксикаму з допомогою іоноселективних електродів на
основі іонних асоціатів з основними барвниками.
Описано основні фізичні та хімічні,
фармакологічні властивості індометацину, методи його застосування у медицині та
інше.
Розділ 2. Методика та техніка експерименту
2.1 Приготування стандартних
розчинів
Використано вихідні 1∙10-2 - 1∙10-7
моль/л розчини мелоксикаму, які готували шляхом розчинення точної наважки цього
препарату фармакопейної чистоти у дистильованій воді. Розчини мелоксикаму з меншими
концентраціями готували відповідним розведенням вихідних розчинів у день
експерименту.
Використано торгові
препарати основних барвників - бутил родамін, родамін 6Ж,
малахітовий зелений та кристалічний фіолетовий (рис. 2.1). Водні розчини барвника (1∙10-2
моль/л) готували розчиненням точної наважки його солі. Важкорозчинні барвники
розчиняли у водно-етанольних сумішах. Загальну структурну формулу досліджених
ОБ, їх повні хімічні назви та скороченні позначення показано на рисунку 2.1.
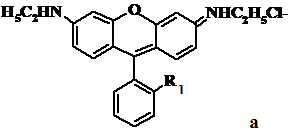

Рис. 2.1. Структурні
формули ОБ, використаних для синтезу ІА:
а) ОБ класу родамінів: родамін 6Ж (Р6Ж) - R1: -СООС2Н5; бутил родамін (БР) - R1: -СООС4Н9;
Кислотність середовища регулювали універсальним буферним розчином, який готували шляхом змішування суміші 0,04 моль/л ацетатної, боратної і фосфатної кислот
у певному
співвідношенні з 0,2 моль/л NaOH, і контролювали за допомогою потенціометра І-160 [].
2.2 Синтез іонних асоціатів
для іоноселективних електродів
Для моделювання складу мембран іоноселективних сенсорів використовували:
інертну матрицю - полівінілхлорид різного ступеня полімеризації (600-1700)
виробнцтва Росії або Франції; розчинники-пластифікатори - дибутилфталат (ДБФ),
диоктилфталат (ДОФ), дибутилсебаценат (ДБС), динонілфталат (ДНФ),
трикрезилфосфат (ТКФ). Електродоактивні речовини: основний барвник -
мелоксикам.
Іонні асоціати із ОБ синтезовані за достатньо простою методикою. Спочатку
приготували 10-2 моль/л розчину відповідного основного барвника і
мелоксикаму (органічний аніон ОА).
По краплях при постійному перемішуванні до ОБ додали розчин
ОА і залишили при кімнатній температурі на 2 год для відстоювання. Осад, що
випав, профільтрували та декілька разів промили холодною дистильованою водою
для відмивання іонного асоціату від залишків ОБ, після чого сушили при
кімнатній температурі на повітрі протягом 48 год.
2.3 Приготування
полівінілхлоридної мембрани
Пластифіковані полівінілхлоридні мембрани готували згідно з
рекомендаціями []. Загальновизнаним є метод отримання пластифікованих мембран
Муді, Оке, Томаса [ ], згідно з яким електродоактивні речовини ретельно
перемішують із ПВХ, розчиненого в циклогексаноні (ЦГН) або тетрагідрофурані
(ТГФ), із наступним випаровуванням розчинника у скляному кільці. Зважували 0,1 г ПВХ, відповідну кількість
виділеного ІА (щоб його концентрація в мембрані складала 5 - 25 % від загальної маси мембрани), а
потім суміш ретельно перемішували для гомогенізації. Після цього вводили 0,1 мл
пластифікатора (ДБФ, ДОФ, ДБС, ТКФ, ДНФ), 0,5 мл розчинника пластифікатора (ЦГН
або ТГФ). Отриманий
розчин переносили у скляну круглу форму діаметром 1,7 см, яку попередньо
відшліфували, і приклеювали до скляної підложки та сушили на повітрі протягом 1
- 2 доби.
Для виготовлення класичного мембранного електрода, після випаровування
розчинника з одержаних плівок різцем для гумових корків вирізали диски
діаметром 0,5 - 1,0 см і приклеювали їх до торця полівінілхлоридної трубки 10 % розчином полівінілхлориду у циклогексаноні. Трубку
заповнювали відповідним концентрованим стандартним розчином (10-2
моль/л) та занурювали в нього мідну дротину. Після цього електрод
використовували для дослідження.
Для регулювання та підтримання іонної сили розчину використовували 1 н NaCl марки “о.с.ч.”, розчин якого
готували розчиненням його наважки у дистильованій воді.
Потенціометричне вимірювання проводили на іономірі И-160М (похибка
вимірювання ± 0,1 мВ); як електрод порівняння використовували хлорсрібний
електрод ЭВЛ-1МЗ при кімнатній температурі 25 ± 1 oC. Під час вимірювання користувалися класичною схемою будови
електрохімічного кола:
Ag,AgCl׀KCl(нас) / досл. роз. (1×10-7-1×10-2 М) // мембрана //
внутр. роз / (1×10-2)/ Cu дротина
Âèñíîâêè
äî ðîçä³ëó 2
Îïèñàíî ñïîñîáè
ïðèãîòóâàííÿ
âèõ³äíèõ ñòàíäàðòíèõ
ðîç÷èí³â òà ðåàêòèâ³â
ó ïîòåíö³îìåòðè÷íîìó
àíàë³ç³.
Ðîçãëÿíóòî ìåòîäèêó
òà òåõí³êó åêñïåðèìåíòó,
âèêîðèñòàíó
àïàðàòóðó äëÿ
ïîòåíö³îìåòðè÷íîãî
àíàë³çó ç âèêîðèñòàííÿì
²ÑÅ. Òàêîæ ñèíòåç
³îííèõ àñîö³àò³â
îñíîâíèõ
áàðâíèê³â ³ç ìåëîêñèêàìîì,
ñïîñîá³â ïðèãîòóâàííÿ
ìåìáðàí.
Ðîçä³ë
3. ²îíîñåëåêòèâí³
åëåêòðîäè íà îñíîâ³
³îííèõ àñîö³àò³â
ÿê åëåêòðîäîàêòèâíèõ
ðå÷îâèí äëÿ âèçíà÷åííÿ
ìåëîêñèêàìó
ʳëüê³ñíå
âèçíà÷åííÿ îðãàí³÷íèõ
ñïîëóê - âàæëèâà
çàäà÷à õ³ì³¿,
ôàðìàöåâòè÷íî¿
ïðîìèñëîâîñò³,
ìåäèêî-á³îëîã³÷íî¿
ïðàêòèêè []. Äëÿ
ö³º¿ ö³ë³ øèðîêî
âèêîðèñòîâóþòüñÿ
òàê³ ìåòîäè àíàë³òè÷íî¿
õ³ì³¿, ÿê õðîìàòîãðàô³ÿ,
ñïåêòðîôîòîìåòð³ÿ,
ëþì³íåñöåíö³ÿ,
åëåêòðîõ³ì³÷í³
ìåòîäè àíàë³çó.
Ñåðåä
îñòàíí³õ îäíå
ç ïåðøèõ ì³ñöü
çàéìຠ³îíîìåòð³ÿ
- ïðÿìà ïîòåíö³îìåòð³ÿ
ç âèêîðèñòàííÿì
³îíñåëåêòèâíèõ
åëåêòðîä³â [].
Ó öüîìó ðîçä³ë³
ïîäàíî õ³ì³êî-àíàë³òè÷í³
õàðàêòåðèñòèêè
âèä³ëåíèõ ó òâåðäîìó
âèãëÿä³ ³îííèõ
àñîö³àò³â ìåëîêñèêàìó,
à òàêîæ äîñë³äæåíî
âïëèâ ïðèðîäè
ÅÀÐ, ÿêà âèêîðèñòîâóºòüñÿ,
ðÍ ðîç÷èíó, ÿêèé
àíàë³çóºòüñÿ,
âëàñòèâîñò³
ìåìáðàííîãî
ðîç÷èííèêà òîùî.
Ñóêóïí³ñòü öèõ
ôàêòîð³â ³ âèçíà÷àþòü
îñíîâí³ åëåêòðîõ³ì³÷í³
õàðàêòåðèñòèêè
²ÑÅ - öå ä³àïàçîí
êîíöåíòðàö³¿
âèçíà÷óâàíîãî
³îíà, ìåæà âèÿâëåííÿ
³îíà, äðåéô ïîòåíö³àëó,
÷àñ æèòòÿ åëåêòðîäó
òîùî. Äîñë³äæåííÿ
öèõ ôàêòîð³â,
âñòàíîâëåííÿ
çâ’ÿçê³â ì³æ ïåâíèìè
ïàðàìåòðàìè
òà ¿õ âðàõóâàííÿ
äàñòü çìîãó, íà
íàø ïîãëÿä, ïîêðàùèòè
åëåêòðîõ³ì³÷í³
õàðàêòåðèñòèêè
åëåêòðîä³â ³ ìîæëèâ³ñòü
ïðîãíîçóâàòè
âëàñòèâîñò³
³íøèõ ²ÑÅ ï³ä
÷àñ ðîçðîáêè
äëÿ íîâèõ êëàñ³â
ðå÷îâèí [].
3.1 Îñíîâí³
åëåêòðîõ³ì³÷í³
õàðàêòåðèñòèêè
³îíîñåëåêòèâíèõ
åëåêòðîä³â
Äî õ³ì³êî-àíàë³òè÷íèõ
õàðàêòåðèñòèê
³îíîñåëåêòèâíèõ
åëåêòðîä³â íàëåæàòü
[]:
– êðóòèçíà åëåêòðîäíî¿
ôóíêö³¿, ÿêà õàðàêòåðèçóºòüñÿ
çì³íîþ ïîòåíö³àëó
ïðè çì³í³ àêòèâíîñò³
³îíó â 10 ðàç, S=ΔE/ΔðÑ;
– ñåëåêòèâí³ñòü
åëåêòðîäà, ùî îö³íþþòü
êîåô³ö³ºíòîì
ñåëåêòèâíîñò³,
Êi/j;
– ìåæà âèÿâëåííÿ,
Ñmin, ìîëü/ë;
– ä³àïàçîí ë³í³éíîñò³
ôóíêö³¿ - ìåæ³
êîíöåíòðàö³é
ðå÷îâèíè, â ÿêèõ
ñïîñòåð³ãàºòüñÿ
ë³í³éí³ñòü êàë³áðóâàëüíîãî
ãðàô³êà;
– äðåéô ïîòåíö³àëó
- çì³íà ïîòåíö³àëó
åëåêòðîäó ïðîòÿãîì
ïåâíîãî ÷àñó
(ãîäèí-ä³á), çàíóðåíîãî
â ðîç÷èí ³ç çàäàíîþ
àêòèâí³ñòþ ³îíó;
– ÷àñ â³äãóêó
åëåêòðîäó - ÷àñ
(ñ, õâ.) ÿêèé ïðîõîäèòü
ï³ñëÿ çàíóðåííÿ
åëåêòðîäó â ðîç÷èí
³ç ³íøîþ àêòèâí³ñòþ
³îíà äî âñòàíîâëåííÿ
ð³âíîâàæíîãî
ïîòåíö³àëó;
– ÷àñ æèòòÿ åëåêòðîäó
- ïåð³îä, ïðîòÿãîì
ÿêîãî åëåêòðîä
ïðîÿâëÿº ÷óòëèâ³ñòü
äî âèçíà÷óâàíîãî
³îíó ç³ çáåðåæåííÿì,
àáî ç íåçíà÷íîþ
çì³íîþ éîãî ³íøèõ
õ³ì³êî-àíàë³òè÷íèõ
õàðàêòåðèñòèê;
– îïòèìàëüíà
äëÿ ðîáîòè îáëàñòü
ðÍ.
3.1.1 Íèæíÿ
ìåæà âèÿâëåííÿ
×óòëèâ³ñòü
ìåìáðàí ²ÑÅ ùîäî
òîãî ÷è ³íøîãî
³îíó, îö³íþþòü
çà ìåæåþ âèÿâëåííÿ
- íàéìåíøîþ êîíöåíòðàö³ºþ
öüîãî ³îíó, ÿêó
ìîæíà âèçíà÷èòè
çà äîïîìîãîþ
äàíîãî åëåêòðîäó
[;]. Äëÿ âèçíà÷åííÿ
íèæíüî¿ ìåæ³
âèÿâëåííÿ âèãîòîâëåíîãî
ìåëîêñèêàì-÷óòëèâîãî
åëåêòðîäà âñ³
ðîç÷èíè ãîòóâàëè
íà äèñòèëüîâàí³é
âîä³. Äëÿ çìåíøåííÿ
ñèñòåìàòè÷íî¿
ïîõèáêè â³äá³ð
àë³êâîòè ðîç÷èíó
(5 ìë äëÿ ïîäàëüøîãî
äîâåäåííÿ äî 50
ìë) â³äáèðàëè îäí³ºþ
ï³ïåòêîþ, îáïîë³ñêóþ÷è
¿¿ âîäîþ ï³ñëÿ
ðîç÷èíó ³ âèäàëÿþ÷è
íàäëèøêè âîëîãè
ô³ëüòðóâàëüíèì
ïàïåðîì.

Ðèñ.
3.1. Çíàõîäæåííÿ
ìåæ³ âèÿâëåííÿ
ßê
âíóòð³øí³é ðîç÷èí
ïîð³âíÿííÿ â åëåêòðîäàõ
âèãîòîâëåííÿ
ç ìåìáðàí, ïëàñòèô³êîâàíèìè
ÄÁÔ, ÄÎÔ, ÄÍÔ, ÄÁÑ
òà ÒÊÔ, âèêîðèñòîâóâàëè
ðîç÷èí 1·10-2 ìîëü/ë
ìåëîêñèêàìó.
Äëÿ çíàõîäæåííÿ
íèæíüî¿ ìåæ³
âèÿâëåííÿ âèì³ðþâàëè
ð³çíèöþ ïîòåíö³àëó
ñå𳿠ñòàíäàðòíèõ
ðîç÷èí³â ìåëîêñèêàìó
ç êîíöåíòðàö³ÿìè
â³ä 1∙10-7 äî 1∙10-2 ìîëü/ë
÷åðåç êîæíó äåêàäó
òà íà îòðèìàí³é
çàëåæíîñò³ (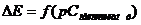 ) åêñòðàïîëÿö³ºþ
ïðÿìèõ, äîòè÷íèõ
äî ãðàô³êà, çíàõîäèëè
òî÷êó ¿õ ïåðåòèíó
(ðèñ. 3.1).
) åêñòðàïîëÿö³ºþ
ïðÿìèõ, äîòè÷íèõ
äî ãðàô³êà, çíàõîäèëè
òî÷êó ¿õ ïåðåòèíó
(ðèñ. 3.1).
Òàêèé ìåòîä
ïðîïîíóºòüñÿ
êîì³ñ³ºþ ²ÞÏÀÊ
[]. Äàë³ îïóñêàëè
ïåðïåíäèêóëÿð
³ç ö³º¿ òî÷êè
íà â³ñü àáñöèñ.
Àíòèëîãàðèôìóâàííÿì
îòðèìàíî¿ âåëè÷èíè,
îòðèìóâàëè çíà÷åííÿ
íèæíüî¿ ìåæ³
âèÿâëåííÿ ³îí³â
ìåëîêñèêàìó.
Åëåêòðîäíó ôóíêö³þ
çí³ìàëè äî òèõ
ï³ð, ïîêè â³äì³ííîñò³
ïîòåíö³àëó äâîõ
ñóñ³äí³õ âèì³ð³â
ñòàâàëè íå á³ëüøå
2 ìÂ, ùî ñâ³ä÷èëî
ïðî âèõ³ä ôóíêö³¿
íà ïëàòî, äå ïîòåíö³àë
íå çàëåæèòü â³ä
àêòèâíîñò³ àíàë³çîâàíîãî
³îíà.
×àñ âñòàíîâëåííÿ
ïîñò³éíîãî çíà÷åííÿ
ïîòåíö³àëó çàëåæàâ
â³ä êîíöåíòðàö³¿
ðîç÷èíó. Ó ä³àïàçîí³
â³ä 1·10-2 äî ~5·10-4 ìîëü/ë
âîíî ñêëàäàëî
ìåíøå 30 ñåê - 2 õâ, à ïðè íèæ÷èõ
çíà÷åííÿõ êîíöåíòðàö³¿
ìåëîêñèêàìó
á³ëüøå 5 õâèëèí
(ïîáëèçó íèæíüî¿
ìåæ³ âèÿâëåííÿ
äî 3 õâ).
3.1.2 Âèâ÷åííÿ
çàëåæíîñò³ ïîòåíö³àëó
â³ä ðÍ ðîç÷èíó
 ³íñòðóêö³¿
ç âèêîðèñòàííÿ
²ÑÅ îáîâ’ÿçêîâî
âêàçóþòü ä³àïàçîíè
ðÍ äëÿ íîðìàëüíî¿
ðîáîòè åëåêòðîäó.
Öå òàêîæ ñòîñóºòüñÿ
²ÑÅ, ÷óòëèâèõ
äî îðãàí³÷íèõ
³îí³â, ÿê³, ÿê â³äîìî,
ìîæóòü ³ñíóâàòè
ó ð³çíèõ ôîðìàõ
ó çàëåæíîñò³
â³ä êèñëîòíîñò³
ñåðåäîâèùà.
Çíà÷åííÿ ðÍ
àíàë³çóþ÷èõ
ðîç÷èí³â äîñèòü
âàæëèâà ïðè ïîòåíö³îìåòðè÷íèõ
âèì³ðþâàííÿõ
ó ðîç÷èíàõ îðãàí³÷íèõ
ðå÷îâèí, îñê³ëüêè,
÷àñòî, âèçíà÷àþ÷èé
ïîòåíö³àë º ¿õíüîþ
êàò³îííîþ ÷è
àí³îííîþ ôîðìîþ.
Ïðè öüîìó äîïóñòèìèé
(ïðèäàòíèé äëÿ
êîðåêòíèõ âèì³ðþâàíü)
ä³àïàçîí êèñëîòíîñò³
ðîç÷èí³â äëÿ ð³çíèõ
ðîç÷èí³â ð³çíèé,
ó çàëåæíîñò³
â³ä âåëè÷èíè
ðÊà ðå÷îâèíè
[;].
×àñ âñòàíîâëåííÿ
ïîòåíö³àëó çàëåæàëî
â³ä âåëè÷èíè
ðÍ ðîç÷èíà ³ ñêëàäàëî
â³ä 0,5 õâ â ñèëüíîêèñë³é
îáëàñò³ äî 3 õâ
â íåéòðàëüí³é
³ ëóæí³é. Çà îòðèìàíèìè
äàíèìè áóäóâàëè
ãðàô³ê E=f(pH).  íàñòóïíèõ
ïîòåíö³îìåòðè÷íèõ
âèì³ðþâàííÿõ
ðÍ ï³äòðèìóâàëè
â ìåæàõ ä³àïàçîíó,
â ÿêîìó â³äñóòí³
âïëèâ ðÍ íà ïîòåíö³àë
âèì³ðþâàííÿ.
3.1.3 ³äòâîðþâàí³ñòü
òà äðåéô ïîòåíö³àëó
Ïðè ðîçðîáö³ ìåòîäèêè
âàæëèâîþ õàðàêòåðèñòèêîþ
º â³äòâîðþâàí³ñòü
ðåçóëüòàò³â. Ñóòü
ïðîöåäóðè ïîëÿãàº
â âèì³ðþâàíí³
ð³çíèö³ ïîòåíö³àëó
åëåêòðîä³â ó ðîç÷èíàõ
ìåëîêñèêàìó
ç ð³çíèìè éîãî
êîíöåíòðàö³ÿìè
çâè÷àéíî íå ìåíøå
10 ðàç ï³äðÿä ³ç ïåâíèì
ïðîì³æêîì ÷àñó.
Äðåéô ïîòåíö³àëó
º âàæëèâèì ôàêòîðîì
ïðè âèêîðèñòàíí³
åëåêòðîä³â äëÿ
ìàñîâèõ àíàë³ç³â,
ÿêèé âèçíà÷àº
ïåð³îäè÷í³ñòü
êàë³áðóâàííÿ
³îíîì³ðó â îäèíèöÿõ
ðÑ = -lgC ïðîòÿãîì
ðîáî÷îãî äíÿ,
òèæíÿ, ì³ñÿöÿ.
Äëÿ âèçíà÷åííÿ
äðåéôó ïîòåíö³àëó
çàíóðþþòü åëåêòðîä
ó ðîç÷èí ç ïåâíîþ
àêòèâí³ñòþ âèçíà÷óâàíîãî
³îíó ³ ÷åðåç ð³âí³
ïðîì³æêè ÷àñó
ô³êñóþòü ïîòåíö³àë
²ÑÅ. Äðåéôîì ïîòåíö³àëó
âèçíà÷àºòüñÿ
ïðàâèëüí³ñòü
òà â³äòâîðþâàí³ñòü
ðåçóëüòàò³â àíàë³çó
[].
3.1.4 ×àñ
â³äãóêó
Ïîðÿä ³ç
ë³í³éíîþ åëåêòðîäíîþ
ôóíêö³ºþ òà ñåëåêòèâí³ñòþ
âàæëèâèì ôàêòîðîì,
ÿêèé âèçíà÷àº
ìîæëèâ³ñòü çàñòîñóâàííÿ
³îí-ñåëåêòèâíîãî
åëåêòðîäà îñîáëèâî
â ïðàêòè÷íîìó
âèêîðèñòàíí³,
º ÷àñ â³äãóêó
åëåêòðîäà (âñòàíîâëåííÿ
ïîòåíö³àëó) íà
çì³íó êîíöåíòðàö³¿
ðîç÷èíó.
ßê ïðàâèëî,
â åëåêòðîä³â ³ç
ð³äêèìè ³îíîîáì³ííèìè
ìåìáðàíàìè ÷àñ
â³äãóêó á³ëüøèé,
í³æ ó òâåðäèõ
åëåêòðîä³â []. ×àñ
â³äãóêó çâè÷àéíî
âèçíà÷àþòü çà
çàëåæí³ñòþ å.ð.ñ.
â³ä ÷àñó àáî ç
òîãî ìîìåíòó,
êîëè åëåêòðîä
çàíóðþºòüñÿ â
äîñë³äæóâàíèé
ðîç÷èí, àáî ï³ñëÿ
øâèäêîãî âëèâàííÿ
ðîç÷èíó ç òî÷íî
â³äîìîþ êîíöåíòðàö³ºþ
â ñèñòåìó, â ÿê³é
óæå çíàõîäèòüñÿ
³îí-ñåëåêòèâíèé
åëåêòðîä.
×àñ â³äãóêó
åëåêòðîäà ë³ì³òóº
ïðîâåäåííÿ àíàë³çó,
à òàêîæ âèçíà÷àº
ïðèäàòí³ñòü ²ÑÅ
äëÿ ïðîâåäåííÿ
âèì³ðþâàíü ó
äèíàì³÷íèõ óìîâàõ,
íàïðèêëàä, ïðîâåäåííÿ
âèçíà÷åíü ïðè
òåõíîëîã³÷íîìó
âèãîòîâëåíí³
ë³ê³â, àáî â óìîâàõ
ïðîòî÷íî-³íæåêòîðíîãî
àíàë³çó. ×èì
ìåíøèì º ÷àñ
â³äãóêó åëåêòðîäó,
òèì êðàùå â³í
ïðàöþº ó çàçíà÷åíèõ
âèùå óìîâàõ
[].
3.1.5 Êîåô³ö³ºíò
ñåëåêòèâíîñò³
Âèð³øàëüíèì
ôàêòîðîì, ÿêèé
âèçíà÷ຠîáëàñò³
âèêîðèñòàííÿ
²ÑÅ º éîãî ñåëåêòèâí³ñòü,
òîáòî íèçüêà
÷óòëèâ³ñòü äî
ñòîðîíí³õ ³îí³â,
ðå÷îâèí. Êîæåí
ç ²ÑÅ ðåàãóº íà
âì³ñò ñòîðîíí³õ
ðå÷îâèí, ùî ïðîÿâëÿºòüñÿ
â çì³í³ éîãî ïîòåíö³àëó.
Ó âèïàäêó ïðèñóòíîñò³
â äîñë³äæóâàíîìó
ðîç÷èí³ ðå÷îâèí,
ÿê³ âïëèâàþòü
íà ïîòåíö³àë
²ÑÅ, ðåçóëüòàòè
âèçíà÷åííÿ îñíîâíî¿
ðå÷îâèíè âèÿâëÿþòüñÿ
íåäîñòîâ³ðíèìè
(íàÿâíà ïîçèòèâíà
÷è íåãàòèâíà
ïîõèáêà ðåçóëüòàò³â)
[; ; ].
Êîåô³ö³ºíò ñåëåêòèâíîñò³
(Êi/j) - íàéâàæëèâ³øà
õàðàêòåðèñòèêà
²ÑÅ, ÿêà áàãàòî
â ÷îìó é âèçíà÷àº
ìîæëèâîñò³ ¿õ
ïðàêòè÷íîãî
âèêîðèñòàííÿ.
Òîìó, âèçíà÷åííÿ
çíà÷åíü (Êi/j)
º ïåðøî÷åðãîâèì
çàâäàííÿì ï³ä
÷àñ äîñë³äæåííÿ
âëàñòèâîñòåé
²ÑÅ.
гâíÿííÿ
ïîòåíö³àëó ìåìáðàííîãî
åëåêòðîäà äëÿ
îäíîçàðÿäíèõ
êàò³îí³â:
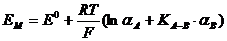 , (3.1)
, (3.1)
äå
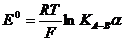 . (3.2)
. (3.2)
Ìåìáðàíí³
ïîòåíö³àëè åëåêòðîä³â
÷óòëèâèõ äî q
âèä³â ³îí³â ç
åëåêòðè÷íèì
çàðÿäîì 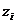 (âñ³
îäíîãî çíàêó),
âèçíà÷àþòüñÿ
ð³âíÿííÿì òèïó:
(âñ³
îäíîãî çíàêó),
âèçíà÷àþòüñÿ
ð³âíÿííÿì òèïó:
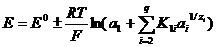 , (3.3)
, (3.3)
³äîìî ïðèíàéìí³
äâà ìåòîäè âèçíà÷åííÿ
êîåô³ö³ºíòà ñåëåêòèâíîñò³
[].
Çã³äíî ìåòîäó
„÷èñòèõ ðîç÷èí³â”
ïî ÷åðç³ âèì³ðþþòü
ïîòåíö³àëè ñåð³¿
ðîç÷èí³â ³ç ð³çíîþ
êîíöåíòðàö³ºþ
âèçíà÷óâàíî¿
òà ñòîðîííüî¿
ðå÷îâèíè. Çà îäåðæàíèìè
äàíèìè áóäóþòü
çàëåæí³ñòü Å=f(lga),
ç ÿêî¿ çíàõîäÿòü
ð³çíèöþ ïîòåíö³àë³â
²ÑÅ ïðè ð³âí³é
àêòèâíîñò³ ñòîðîííüî¿
òà âèçíà÷óâàíî¿
ðå÷îâèí ³ çà ôîðìóëîþ:
lg Ki/j = ΔE/S, (3.4)
ðîçðàõîâóþòü
êîåô³ö³ºíò ñåëåêòèâíîñò³
àáî æ ïðè ïåâíîìó
çíà÷åíí³ ïîòåíö³àëó
åëåêòðîäó â îáîõ
ðîç÷èíàõ çà ãðàô³êîì
çíàõîäÿòü çíà÷åííÿ
à³ òà àj ³
çà ôîðìóëîþ:
Ki/j=ai/aj, (3.5)
ðîçðàõîâóþòü
çíà÷åííÿ êîåô³ö³ºíòà
ñåëåêòèâíîñò³.
²íøèé ìåòîä,
ÿêèé íàçèâàºòüñÿ
„ìåòîäîì çì³øàíèõ
ðîç÷èí³â” ïåðåäáà÷àº
âèì³ðþâàííÿ ïîòåíö³àë³â
²ÑÅ ñå𳿠ðîç÷èí³â
ç ô³êñîâàíèì
çíà÷åííÿì àêòèâíîñò³
ñòîðîííüî¿ ðå÷îâèíè
(àj) (âèçíà÷óâàíî¿
ðå÷îâèíè) â òî÷ö³
ïåðåòèíó äîòè÷íèõ
äî äâîõ ïðÿìîë³í³éíèõ
ä³ëÿíîê çàëåæíîñò³
ïîáóäîâàíèõ
íà îñíîâ³ Å=f(lga)
³ çà ôîðìóëîþ:
i/j=ai/aj, (3.6)
ðîçðàõîâóþòü
çíà÷åííÿ êîåô³ö³ºíòó
ñåëåêòèâíîñò³.
Êîì³ñ³ºþ
²ÞÏÀÊ êîåô³ö³ºíò
ñåëåêòèâíîñò³
ïðîïîíóºòüñÿ
ðîçðàõîâóâàòè
çà ðåçóëüòàòàìè,
îòðèìàíèìè „ìåòîäîì
çì³øàíèõ ðîç÷èí³â”
[;]. Ó ö³é ðîáîò³ êîåô³ö³ºíò
ñåëåêòèâíîñò³
ðîçðàõîâóâàëè
„ìåòîäîì îêðåìèõ
ðîç÷èí³â”, ÿêèé,
ó ïîð³âíÿíí³ ³ç
„ìåòîäîì çì³øàíèõ
ðîç÷èí³â”, º äåùî
íàáëèæåíèì, àëå
äîçâîëÿº ïðîâîäèòè
âèçíà÷åííÿ ç
åêîíî쳺þ ðåàêòèâ³â
òà ÷àñó.
3.2 Âñòàíîâëåííÿ
îïòèìàëüíèõ
óìîâ ðîáîòè ìåëîêñèêàì-ñåëåêòèâíîãî
ñåíñîðà
Äëÿ ïðîãíîçóâàííÿ
òà ³íòåðïðåòàö³¿
åëåêòðîäíèõ âëàñòèâîñòåé
ìåìáðàí íà îñíîâ³
³îííèõ àñîö³àò³â
âàæëèâî çíàòè
¿õ ô³çèêî-õ³ì³÷í³
òà àíàë³òè÷í³
õàðàêòåðèñòèêè,
ñòåõ³îìåòðè÷íå
ñï³ââ³äíîøåííÿ
êîìïîíåíò³â,
ùî â âõîäÿòü äî
¿õ ñêëàäó é ³íø³
[;]. Ðîáîòà çàïðîïîíîâàíîãî
ñåíñîðà íà ìåëîêñèêàì
îö³íþâàëàñÿ ç
òî÷êè çîðó âïëèâó
íà íüîãî ñêëàäó
ìåìáðàíè (âì³ñòó
³ ïðèðîäè ïëàñòèô³êàòîðà,
÷àñó â³äãóêó,
êîíöåíòðàö³¿
âíóòð³øíüîãî
ðîç÷èíó, â³äòâîðþâàíîñò³
êàë³áðóâàëüíîãî
ãðàô³êó òîùî.
3.2.1 Âïëèâ
ïðèðîäè ³ âì³ñòó
ïëàñòèô³êàòîðà
íà îñíîâí³ åëåêòðîäí³
õàðàêòåðèñòèêè
²ÑÅ
²ç ë³òåðàòóðíèõ
äæåðåë [] â³äîì³
ñïðîáè âèêîðèñòàííÿ
²ÑÅ íà îñíîâ³
ÏÂÕ ïëàñòèô³êîâàíèõ
ð³çíèìè ïëàñòèô³êàòîðàìè,
íàé÷àñò³øå ïðè
öüîìó âèêîðèñòîâóâàëè
í³òðîáåíçåí
òà éîãî ãîìîëîãè.
Òàêîæ º â³äîìîñò³
óñï³øíîãî âèêîðèñòàííÿ
ÿê ïëàñòèô³êàòîð³â
äëÿ ²ÑÅ åñòåð³â
ôòàëåâî¿ êèñëîòè.
Ùîá âèçíà÷èòè
âïëèâ ïðèðîäè
ïëàñòèô³êàòîðà,
íàìè äîñë³äæåíî
²ÑÅ ïëàñòèô³êîâàí³
ÄÁÔ, ÄÁÑ, ÒÊÔ íà
îñíîâ³ ²À
(ÁÐ+)(Ìåë-). Ïðè
öüîìó ³îííà ñèëà
ðîç÷èí³â ï³äòðèìóâàëàñü
0,1 í ÊCl. Ó òàáëèöÿõ
3.1 - 3.2 (ãðàô³÷íà
çàëåæí³ñòü - ðèñ.
3.1) ïîäàíî îñíîâí³
åëåêòðîõ³ì³÷í³
õàðàêòåðèñòèêè
ìåìáðàí âèãîòîâëåíèõ
íà îñíîâ³ âèä³ëåíèõ
ó òâåðäîìó âèãëÿä³
²À ìåëîêñèêàìó
ç ÎÁ ðîäàì³íîì
6Æ.
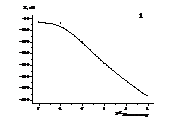


Ðèñ. 3.1. Âïëèâ ïðèðîäè
ïëàñòèô³êàòîðà
íà îñíîâí³ åëåêòðîäí³
õàðàêòåðèñòèêè
ìåëîêñèêàì-÷óòëèâèõ
åëåêòðîä³â:
1 - ÄÁÑ, 2 - ÄÁÔ, 3 - ÒÊÔ;
(0,075ã ÏÂÕ,
0,015ã ²À (ÁÐ+)(Ìåë-),
0,15ìë ï-ðà, 0,5ìë ÒÃÔ)
Òàáëèöÿ
3.1
Âïëèâ
ïðèðîäè ïëàñòèô³êàòîðà
íà îñíîâí³ åëåêòðîäí³
õàðàêòåðèñòèêè
Ìåë-÷óòëèâîãî
åëåêòðîäà íà îñíîâ³
²À (ÁÐ+)(Ìåë-)
(0,075ã
ÏÂÕ, 0,015ã ²À, 0,15ìë ïëàñòèô³êàòîðà,
0,5ìë ÒÃÔ)
|
Ïëàñòèô³êàòîð
|
Åëåêòðîäí³
õàðàêòåðèñòèêè
²ÑÅ
|
|
Ñmin, ìîëü/ë
|
à, ìîëü/ë
|
S, ìÂ/ðÑ
|
|
ÄÁÑ ÄÁÔ
ÒÊÔ
|
7,94∙10-7 7,94∙10-7
7,94∙10-7
|
1∙10-2 - 5∙10-6
1∙10-2 - 5∙10-6 1∙10-2
- 5∙10-6
|
Âñòàíîâëåíî,
ùî íàéêðàùèìè
åëåêòðîäíèìè
õàðàêòåðèñòèêàìè
ùîäî êðóòèçíè
äëÿ âèçíà÷åííÿ
ìåëîêñèêàìó
âîëîä³þòü ìåìáðàíè
ïëàñòèô³êîâàí³
ÄÁÑ, ïðè÷îìó, ÷èñëîâå
çíà÷åííÿ åëåêòðîäíî¿
ôóíêö³¿ áëèçüêå
äî òåîðåòè÷íîãî
çíà÷åííÿ Íåðíñò³âñüêî¿
ôóíêö³¿ äëÿ îäíîçàðÿäíèõ
³îí³â (ïðè 25 ºÑ). Ïðèáëèçíî
ð³âíèìè, ïðîòå
çíà÷íî ã³ðøèìè
ùîäî ÄÁÑ, âëàñòèâîñòÿìè
âîëîä³þòü ìåìáðàíè
ïëàñòèô³êîâàí³
ÄÁÔ òà ÒÊÔ, äëÿ
ÿêèõ êðóòèçíà
åëåêòðîäíèõ ôóíêö³é
íå äîñÿãຠòåîðåòè÷íîãî
çíà÷åííÿ. Ùî æ
ñòîñóºòüñÿ ³íøèõ
åëåêòðîäíèõ õàðàêòåðèñòèê,
òî ÷óòëèâ³ñòü
âèçíà÷åííÿ ìåëîêñèêàì
³îí³â äëÿ ìåìáðàí
íåçàëåæíî â³ä
ïëàñòèô³êàòîðà
ó äàíîìó âèïàäêó
ñòàíîâèòü
7,94∙10-7 ìîëü/ë.
Òàêèì ÷èíîì
âñòàíîâëåíî,
ùî ïðèðîäà ïëàñòèô³êàòîðà
(ε - éîãî ïîëÿðí³ñòü)
íå âïëèâຠíà
÷óòëèâ³ñòü âèçíà÷åííÿ
ìåëîêñèêàì ³îí³â,
ïðîòå âíîñèòü
íåàáèÿêèé âïëèâ
íà êðóòèçíó, ùî
º íå ìåíø âàæëèâèì
ï³ä ÷àñ îáðàííÿ
îïòèìàëüíèõ
óìîâ çà âèêîðèñòàííÿ
²ÑÅ.
ϳä ÷àñ âèãîòîâëåííÿ
ìåìáðàí äëÿ ²ÑÅ
âèêîðèñòîâóâàëè
îðãàí³÷í³ ðîç÷èííèêè
öèêëîãåêñàíîí
³ òåòðàã³äðîôóðàí.
Îñíîâí³ åëåêòðîõ³ì³÷í³
õàðàêòåðèñòèêè
äëÿ íèõ çáåð³ãàþòüñÿ.
Äëÿ ìàñîâîãî
àíàë³çó çðó÷í³øå
âèêîðèñòîâóâàòè
ÒÃÔ, ÿêèé, íà â³äì³íó
â³ä ÖÃÍ, øâèäøå
âèïàðîâóºòüñÿ.
Òàêîæ äîñë³äæåíî
³ âïëèâ âì³ñòó
ñàìîãî ïëàñòèô³êàòîðà
íà êðóòèçíó åëåêòðîäíî¿
ôóíêö³¿, ¿¿ ë³í³éí³ñòü
òà ìåæó âèÿâëåííÿ
³îí³â ìåëîêñèêàìó.
Ïðè öüîìó ê³ëüê³ñòü
ïëàñòèô³êàòîðà
ï³ä ÷àñ âèãîòîâëåííÿ
ìåìáðàíè çì³íþâàëè
â³ä 1 äî 4 êðàòíîãî
íàäëèøêó ïî â³äíîøåííþ
äî ê³ëüêîñò³ âíåñåíîãî
ÏÂÕ. Ïðè öüîìó âèÿâèëîñü,
ùî íàéêðàùå ñï³ââ³äíîøåííÿ
êîìïîíåíò³â
ñòàíîâèòü 1,0 - 2,0
ïëàñòèô³êàòîðà
äî 1,0 ÏÂÕ. Ïðè ³íøèõ
ñï³ââ³äíîøåííÿõ
êîìïîíåíò³â
îòðèìàòè ìåìáðàíè
äîñòàòíüî¿ åëàñòè÷íîñò³
òà ãîìîãåííîñò³
íå âäàºòüñÿ.
Òàáëèöÿ
3.2
Âïëèâ
âì³ñòó ïëàñòèô³êàòîðà
íà îñíîâí³ åëåêòðîäí³
õàðàêòåðèñòèêè
Ìåë-÷óòëèâîãî
åëåêòðîäà íà îñíîâ³
²À (Ð6Æ+)(Ìåë-)
(0,1ã
ÏÂÕ, 0,01ã ²À (Ð6Æ+)(Ìåë-),
0,5ìë ÒÃÔ);
|
Ïëàñòèô³êàòîð
- ÒÊÔ, ìë
|
Åëåêòðîäí³
õàðàêòåðèñòèêè
²ÑÅ
|
|
Ñmin, ìîëü/ë
|
à, ìîëü/ë
|
S, ìÂ/ðÑ
|
|
0,1 0,2 0,3 0,4
|
3,16∙10-6 7,94∙10-7
7,94∙10-6 1,26∙10-5
|
1∙10-2 - 1∙10-5
1∙10-2 - 5∙10-6 1∙10-2
- 1∙10-5 1∙10-2 - 5∙10-4
|
38,38 32,68 28,39 22,31
|
²ç âì³ñòîì ïëàñòèô³êàòîðà
ïîâ’ÿçóºòüñÿ ³
÷àñ æèòòÿ åëåêòðîäà,
ÿêèé âèçíà÷àºòüñÿ
÷àñòîòîþ éîãî
âèêîðèñòàííÿ.
Åëåêòðîäè ç ìåíøèì
óì³ñòîì ïëàñòèô³êàòîðà
ïðàöþþòü äåùî
ìåíøèé ÷àñ, í³æ
åëåêòðîäè ç á³ëüøèì
éîãî âì³ñòîì.
²ç ÷àñîì âì³ñò
ðîç÷èííèêà â
ìåìáðàí³ (ïàñò³)
çìåíøóºòüñÿ
³ öå ïðèçâîäèòü
äî ïîðóøåííÿ ¿õ
ñòðóêòóðè, âòðàòè
åëàñòè÷íîñò³
òà äî îáìåæåííÿ
÷àñó æèòòÿ åëåêòðîä³â.
3.2.2 Âïëèâ
ïðèðîäè ÅÀÐ íà
îñíîâí³ åëåêòðîäí³
õàðàêòåðèñòèêè
ìåëîêñèêàì - ñåëåêòèâíèõ
åëåêòðîä³â
Äëÿ äîñë³äæåííÿ
âïëèâó ïðèðîäè
ÅÀÐ â ìåìáðàíí³
íà ñòàíäàðòíèõ
ðîç÷èíàõ ìåëîêñèêàìó
áóëè çíÿò³ êàë³áðóâàëüí³
êðèâ³ âèãîòîâëåíèõ
³îí-ñåëåêòèâíèõ
åëåêòðîä³â, ÿê³
â³äð³çíÿëèñÿ
ïðîòè³îíîì îñíîâíîãî
áàðâíèêà, ÿêèé
âõîäèòü äî ñêëàäó
³îííîãî àñîö³àòó.
Ïðè öüîìó, äëÿ ñèíòåçó
²À âèêîðèñòîâóâàëè
êîìåðö³éí³ ïðåïàðàòè
îñíîâíèõ áàðâíèê³â
ð³çíèõ êëàñ³â:
êëàñó òðèôåí³ëìåòàíîâèõ
ÎÁ (êðèñòàë³÷íèé
ô³îëåòîâèé, ìàëàõ³òîâèé
çåëåíèé) òà òàêîæ
êñàíòåíîâ³ ÎÁ
ãðóïè ðîäàì³íó
(ðîäàì³í 6Æ, áóòèëîâèé
åô³ð ðîäàì³íó
Á).
Îòðèìàí³ ðåçóëüòàòè
âïëèâó ïðèðîäè
åëåêòðîäîàêòèâíî¿
ðå÷îâèíè íà îñíîâí³
åëåêòðîäí³ õàðàêòåðèñòèêè
âèãîòîâëåíèõ
íàìè ìåëîêñèêàì-÷óòëèâèõ
åëåêòðîä³â ïîäàíî
ó òàáëèö³ 3.3.
Òàáëèöÿ
3.3
Âïëèâ
ïðèðîäè ÅÀÐ íà
îñíîâí³ åëåêòðîäí³
õàðàêòåðèñòèêè
Ìåë-÷óòëèâîãî
åëåêòðîäà
(0,075ã
ÏÂÕ, 0,015ã ²À, 0,15ìë ïëàñòèô³êàòîðà,
0,5ìë ÒÃÔ)
|
²À
|
Ïëàñòè-
ô³êàòîð
|
Åëåêòðîäí³
õàðàêòåðèñòèêè
²ÑÅ
|
|
|
|
Ñmin, ìîëü/ë
|
à, ìîëü/ë
|
S, ìÂ/ðÑ
|
|
(ÁÐ+)(Ìåë-)
|
ÄÁÑ ÄÁÔ
ÒÊÔ
|
7,94∙10-7 7,94∙10-7
7,94∙10-7
|
1∙10-2 - 5∙10-6
1∙10-2 - 5∙10-6 1∙10-2
- 5∙10-6
|
48,78 38,80 32,68
|
|
(Ð6Æ+)(Ìåë-)
|
ÒÊÔ ÄÎÔ
ÄÁÔ ÄÁÑ ÄÍÔ
|
3,16∙10-6 2,00∙10-5
1,00∙10-5 1,00∙10-5 2,51∙10-5
|
1∙10-2 - 1∙10-5
1∙10-2 - 1∙10-4 1∙10-2
- 1∙10-4 1∙10-2 - 5∙10-4 1∙10-2
- 5∙10-4
|
31,43 22,22 40,00 18,67
18,46
|
|
(ÌÇ+)(Ìåë-)
|
ÄÁÔ ÒÊÔ
|
1,00∙10-5 7,94∙10-6
|
1∙10-2 - 1∙10-4
1∙10-2 - 1∙10-5
|
26,67 25,16
|
|
(ÊÔ+)(Ìåë-)
|
ÒÊÔ
|
2,00∙10-6
|
1∙10-2 - 1∙10-4
|
23,70
|
Òàêèì ÷èíîì,
ÿêùî ñïîñòåð³ãàòè
çà çì³íîþ êðóòèçíè
åëåêòðîäíî¿ ôóíêö³¿
â ìåæàõ îäíîãî
ðîç÷èííèêà, àëå
ç ð³çíèìè ïðîòè³îíàìè
ÎÁ, ÿêèé âõîäèòü
äî ñêëàäó ²À, òî
ìîæíà çðîáèòè
âèñíîâîê, ùî öÿ
âåëè÷èíà ñóòòºâî
íå çàëåæèòü â³ä
ïðèðîäè êàò³îíà
áàðâíèêà, éîãî
çíà÷åííÿ Êïðîò
é, â³äïîâ³äíî, â³ä
ðîç÷èííîñò³
²À ìåëîêñèêàìó
ó âîä³, ÿêà ê³ëüê³ñíî
õàðàêòåðèçóºòüñÿ
âåëè÷èíîþ ³îííîãî
äîáóòêó. Á³ëüøèé
âïëèâ âíîñèòü,
çíîâó æ òàêè,
ïðèðîäà ïëàñòèô³êàòîðà.
3.2.3 Âïëèâ
âì³ñòó åëåêòðîäîàêòèâíî¿
ðå÷îâèíè â ìåìáðàí³
Íà
åëåêòðîäí³ õàðàêòåðèñòèêè
²ÑÅ ³ñòîòíî âïëèâàº
êîíöåíòðàö³ÿ
ÅÀÐ ó ìåìáðàí³.
Äëÿ òîãî, ùîá ñóäèòè
ïðî îïòèìàëüíèé
âì³ñò ÅÀÐ â ìåìáðàí³,
ïîòð³áíî çíÿòè
êàë³áðóâàëüí³
êðèâ³ äîñë³äæóâàíèõ
ìåìáðàí ³ç ð³çíèì
âì³ñòîì ÅÀÐ (2 %,
5 %, 10 %, 15 %, 20 %, 25 %, 35 %, 45 %). Ïðîòå, âèõîäÿ÷è
ç òîãî, ùî ï³ä ÷àñ
ñèíòåçó ²À ìåëîêñèêàìó,
éîãî âèõ³ä º íåâåëèêèì,
à ñóáñòàíö³ÿ
ìåëîêñèêàìó
äîñèòü äîðîãà,
òîìó âïëèâ öüîãî
ôàêòîðó íàìè
äîñë³äæåíèé íå
áóâ. Ïðè îáðàíí³
îïòèìàëüíî¿
ðîáîòè âèãîòîâëåíîãî
ìåëîêñèêàì-÷óòëèâîãî
åëåêòðîäà, îïòèìàëüíèì
âì³ñòîì ââàæàëè
âì³ñò ÅÀÐ â ìåìáðàí³
5 - 20 %, ïðè ÿêîìó êîíöåíòðàö³ÿ
ÅÀÐ ïðàêòè÷íî
íå âïëèâຠíà
êðóòèçíó åëåêòðîäíî¿
ôóíêö³¿, à òàêîæ
íà ÷óòëèâ³ñòü
âèçíà÷åííÿ ³íøèõ
îðãàí³÷íèõ ³îí³â
[]. ßê îïèñàíî â
ðîáîò³ [56], ìåìáðàíè,
ÿê³ ì³ñòÿòü ïîíàä
20 % ÅÀÐ â ìåìáðàí³,
êóò íàõèëó êàë³áðóâàëüíî¿
êðèâî¿ ñêëàäàº
40 - 57 ìÂ/ðÑ, à ìåæà âèÿâëåííÿ
ç çá³ëüøåííÿì
âì³ñòó ²À ñòàº
âñå íèæ÷îþ. Ìåìáðàíè
³ç êîíöåíòðàö³ºþ
ÅÀÐ ïîíàä 25 %, âòðà÷àþòü
âåëè÷èíó êðóòèçíè
åëåêòðîäíî¿ ôóíêö³¿,
õàðàêòåðíî¿
äëÿ îäíîçàðÿäíèõ
³îí³â, à òàêîæ
çà ñâî¿ìè ô³çè÷íèìè
âëàñòèâîñòÿìè
º æîðñòê³øèìè,
òâåðä³øèìè òà
ìàëîïðèäàòíèìè
äëÿ âèêîðèñòàííÿ.
Îòæå, îïòèìàëüíèì
âì³ñòîì ²À â ìåìáðàí³
äëÿ âèçíà÷åííÿ
ìåëîêñèêàìó
ââàæàºìî 5 - 20 % â³ä
çàãàëüíî¿ ìàñè
íàâàæêè ïðè âèãîòîâëåíí³
ìåìáðàíè.
3.2.4 Âïëèâ
ðÍ ðîç÷èíó
Êèñëîòí³ñòü
ñåðåäîâèùà, ÿêó
îö³íþþòü çíà÷åííÿì
ðÍ - º ôàêòîðîì,
ÿêèé íàéá³ëüøîþ
ì³ðîþ âïëèâàº
íà ôóíêö³îíóâàííÿ
ïðàêòè÷íî âñ³õ
³îí-ñåëåêòèâíèõ
åëåêòðîä³â. Ó ³íñòðóêö³¿
ïî âèêîðèñòàííþ
²ÑÅ îáîâ'ÿçêîâî
âêàçóþòüñÿ ä³àïàçîíè
ðÍ äëÿ íîðìàëüíî¿
ðîáîòè åëåêòðîäó.
Âïëèâ ðÍ ðîç÷èíó
äîñë³äæóâàëè
âèêîðèñòîâóþ÷è
óí³âåðñàëüíó
áóôåðíó ñóì³ø
â ³íòåðâàë³ â³ä
3,0 äî 12,0 îäèíèöü ðÍ.
Ðèñóíîê 3.2 ïîêàçóº
âïëèâ êèñëîòíîñò³
ñåðåäîâèùà íà
â³äãóê ìåëîêñèêàì - ÷óòëèâèõ
åëåêòðîä³â íà
îñíîâ³ ²À (Ð6Æ+)(Ìåë-)
òà ²À (ÌÇ+)(Ìåë-).
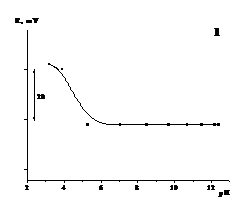

Ðèñ. 3.2. Âïëèâ ðÍ ðîç÷èíó
íà â³äãóê ìåëîêñèêàì-ñåëåêòèâíîãî
åëåêòðîäà íà îñíîâ³
:1 - ²À (Ð6Æ+)(Ìåë-),
2 - ²À (ÌÇ+)(Ìåë-)
Âçàãàë³, êèñëîòí³ñòü
ñåðåäîâèùà âïëèâàº
íà ñòàí ³îííîãî
àñîö³àòó òà ³íøèõ
êîìïîíåíò³â
ìåìáðàíè, òîáòî,
íà ãðàíèö³ ðîçä³ëó
ôàç: ìåìáðàíà
- ðîç÷èí ìîæóòü
ïðîò³êàòè ðÿä
ïàðàëåëüíèõ ïðîòåîë³òè÷íèõ
ïðîöåñ³â, îïèñ
ÿêèõ ìîæå áóòè
äîñòàòíüî ñêëàäíèì.
Çàãàëîì, ðîáî÷à îáëàñòü
ôóíêö³îíóâàííÿ ²ÑÅ íà îñíîâ³ ²À âèçíà÷àºòüñÿ ïðîòåîë³òè÷íèìè âëàñòèâîñòÿìè êðóïíèõ ³îí³â, ùî
âõîäÿòü äî ñêëàäó
²À [].
3.2.5 ×àñ
â³äêëèêó
Âàæëèâîþ õàðàêòåðèñòèêîþ
êîæíîãî ñåíñîðà
º çäàòí³ñòü éîãî
øâèäêî (çà ë³÷åí³
ñåêóíäè) ðåàãóâàòè
íà çì³íó êîíöåíòðàö³¿
ïîòåíö³àëâèçíà÷àþ÷îãî
³îíà. Äëÿ öüîãî
äîñë³äæóâàëè
÷àñ â³äêëèêó
ñåíñîð³â ïðè ð³çí³é
êîíöåíòðàö³¿
ìåëîêñèêàìó
(ðèñ. 3.3).
Âèì³ðþâàëè ñåðåäí³é
÷àñ, íåîáõ³äíèé
äëÿ òîãî, ùîá ïîòåíö³àë
ìåìáðàííîãî
åëåêòðîäó äîñÿãíóâ
çíà÷åííÿ, ùî â³äð³çíÿºòüñÿ
íà ± 1 ì â³ä ê³íöåâîãî
ð³âíîâàæíîãî
çíà÷åííÿ ï³ñëÿ
çàíóðåííÿ åëåêòðîäà
â ðîç÷èíè ìåëîêñèêàìó,
ùî â³äð³çíÿþòüñÿ
çà êîíöåíòðàö³ºþ
â 10 ðàç. Ñòàòèñòè÷íèé
÷àñ â³äêëèêó
äëÿ êîíöåíòðàö³é
á³ëüøå 10-4 ìîëü/ë
áóâ 5 ñ; ïîòåíö³àë
çàëèøàâñÿ ïîñò³éíèì
ïðîòÿãîì 5 õâ.

Ðèñ. 3.3. ×àñ â³äãóêó
åëåêòðîäà íà çì³íó
êîíöåíòðàö³¿
ñòàíäàðòíèõ
ðîç÷èí³â ìåëîêñèêàìó
×àñ â³äêëèêó
äëÿ ðîç÷èí³â ç
êîíöåíòðàö³ºþ
1·10-4 - 1·10-2 ìîëü/ë
ñêëàäàâ 2 - 3 ñ òà 15 - 20 ñ äëÿ ðîç÷èí³â
ç êîíöåíòðàö³ºþ
1·10-7 -1·10-6 ìîëü/ë
ìåëîêñèêàìó
(ðèñ. 3.3).
3.2.6 Ñåëåêòèâí³ñòü
Íå ìåíø âàæëèâèì
ôàêòîðîì, ùî âïëèâàº
íà åëåêòðîäí³
õàðàêòåðèñòèêè
åëåêòðîäó º ñåëåêòèâí³ñòü,
ÿêà õàðàêòåðèçóº
ìîæëèâ³ñòü âèçíà÷åííÿ
íåîáõ³äíîãî
êîìïîíåíòà â
ïðèñóòíîñò³
³íøèõ.
Êîåô³ö³ºíò
ñåëåêòèâíîñò³
ÊÀ, Ì åëåêòðîä³â
äëÿ ð³çíèõ êàò³îí³â
òà àí³îí³â îö³íþâàâñÿ
ìåòîäîì îêðåìèõ
ðîç÷èí³â [45], ÿêèé
áàçóºòüñÿ íà
âèì³ðþâàíí³ ïîòåíö³àëó
åëåêòðîäà â ðîç÷èíàõ,
ÿê³ ì³ñòÿòü ò³ëüêè
äîñë³äæóâàíèé
³îí. Öå, áåçóìîâíî,
îäíà ç âàæëèâèõ
õàðàêòåðèñòèê
²ÑÅ, ÿêà áàãàòî
â ÷îìó é âèçíà÷àº
ìîæëèâîñò³ ¿õ
ïðàêòè÷íîãî
âèêîðèñòàííÿ.
Òîìó âèçíà÷åííÿ
çíà÷åíü êîåô³ö³ºíò³â
ñåëåêòèâíîñò³
º ïåðøî÷åðãîâèì
çàâäàííÿì ïðè
äîñë³äæåíí³ âëàñòèâîñòåé
²ÑÅ.
Îòðèìàí³
çíà÷åííÿ êîåô³ö³ºíò³â
ñåëåêòèâíîñò³,
îá÷èñëåí³ ³ç
åêñïåðèìåíòàëüíèõ
êðèâèõ, ïðèâåäåí³
íà ðèñ. 3.4.

Ðèñ. 3.4. Êîåô³ö³ºíòè
ñåëåêòèâíîñò³ ìåëîêñèêàì-÷óòëèâîãî
ñåíñîðà
Âñòàíîâëåíî,
ùî á³ëüø³ñòü äîñë³äæåíèõ
³îí³â òà ðå÷îâèí
íå çàâàæàþòü
ïðè ðîáîò³ âèãîòîâëåíèõ
ìåìáðàííèõ ñåíñîð³â.
Î÷åâèäíî, ùî ñåíñîðè
ó âèñîê³é ì³ð³
ñåëåêòèâí³ ïî
â³äíîøåííþ äî
ìåëîêñèêàìó,
à òàêîæ ðå÷îâèí
òà ³îí³â, ÿê³ ìîæóòü
áóòè ïðèñóòí³ìè
ó ôàðìàöåâòè÷íèõ
ïðåïàðàòàõ.
3.2.7 ³äòâîðþâàí³ñòü
îñíîâíèõ åëåêòðîäíèõ
õàðàêòåðèñòèê
ìåëîêñèêàì-÷óòëèâèõ
ñåíñîð³â
Äîñë³äæóâàëè
÷àñ æèòòÿ åëåêòðîä³â.
Äëÿ öüîãî ÷åðåç
ïåâí³ ïðîì³æêè
÷àñó çí³ìàëè
êàë³áðóâàëüí³
êðèâ³ âèãîòîâëåíèõ
ìåìáðàí íà îñíîâ³
ð³çíèõ ïëàñòèô³êàòîð³â.
Ó òàáëèö³
3.4 ïîäàí³ ðåçóëüòàòè
âèì³ðþâàíü, îòðèìàíèõ
ó äåíü âèãîòîâëåííÿ
ñåíñîð³â, à òàêîæ
ðåçóëüòàòè, ÿê³
îòðèìàëè ÷åðåç
2 ì³ñÿö³ ï³ñëÿ ¿õ
âèãîòîâëåííÿ
(çí³ìàëè ïîêàçè
ç îäíèõ òèõ æå
ìåìáðàí).
Òàáëèöÿ
3.4
Âïëèâ
÷àñó íà îñíîâí³
åëåêòðîäí³ õàðàêòåðèñòèêè
Ìåë-÷óòëèâîãî
åëåêòðîäà
(0,075ã
ÏÂÕ, 0,015ã ²À (Á6Æ+)(Ìåë-),
0,15ìë ï-ðà, 0.5ìë ÒÃÔ)
|
Ïëàñòèô³êàòîð
|
|
Ñmin, ìîëü/ë
|
à, ìîëü/ë
|
S, ìÂ/ðÑ
|
|
ÒÊÔ ÄÎÔ
ÄÁÔ ÄÁÑ ÄÍÔ
|
3,16∙10-6 2,00∙10-5
1,00∙10-5 1,00∙10-5 2,51∙10-5
|
1∙10-2 - 1∙10-5
1∙10-2 - 1∙10-4 1∙10-2
- 1∙10-4 1∙10-2 - 5∙10-4 1∙10-2
- 5∙10-4
|
31,43 22,22 40,00 18,67
18,46
|
|
Ïëàñòèô³êàòîð
|
Åëåêòðîäí³
õàðàêòåðèñòèêè
²ÑÅ ÷åðåç 2 ì³ñÿö³
ï³ñëÿ âèãîòîâëåííÿ
²ÑÅ
|
|
Ñmin, ìîëü/ë
|
à, ìîëü/ë
|
S, ìÂ/ðÑ
|
|
ÒÊÔ ÄÎÔ
ÄÁÔ ÄÁÑ ÄÍÔ
|
3,11∙10-6 1,93∙10-5
1,00∙10-5 1,00∙10-5 2,51∙10-5
|
1∙10-2 - 1∙10-5
1∙10-2 - 1∙10-4 1∙10-2
- 1∙10-4 1∙10-2 - 5∙10-4 1∙10-2
- 5∙10-4
|
30,43 20,22 41,00 16,67
18,46
|
Âñòàíîâëåíî,
ùî ÷àñ æèòòÿ åëåêòðîä³â
âèçíà÷àºòüñÿ
â îñíîâíîìó ÷àñòîòîþ
éîãî âèêîðèñòàííÿ.
Îñíîâí³ åëåêòðîäí³
õàðàêòåðèñòèêè
ìåëîêñèêàì-÷óòëèâèõ
åëåêòðîä³â ï³ñëÿ
äâîõ ì³ñÿö³â ¿õ
âèêîðèñòàííÿ
çáåð³ãàþòü ñâî¿
åëåêòðîäí³ õàðàêòåðèñòèêè.
Íåçíà÷í³ çì³íè
ïîì³òí³ ó êðóòèçí³
åëåêòðîäíî¿ ôóíêö³¿.
Âèñíîâêè
äî ðîçä³ëó 3
Ó òâåðäîìó âèãëÿä³
âèä³ëåíî ²À ìåëîêñèêàìó ç îñíîâíèìè
áàðâíèêàìè. Ïîêàçàíî
ìîæëèâ³ñòü ñòâîðåííÿ
íà ¿õ îñíîâ³ ìåìáðàííèõ
³ç âíóòð³øí³ì
ðîç÷èíîì ïîð³âíÿííÿ
²ÑÅ. Åêñïåðèìåíòàëüíî
âñòàíîâëåíî,
ùî íà åëåêòðîäí³
õàðàêòåðèñòèêè
âèãîòîâëåíèõ
²ÑÅ íà îñíîâ³
²À âïëèâຠïðèðîäà
ïëàñòèô³êàòîðà
â ìåìáðàí³.
Âèâ÷åíî ïèòàííÿ
ñåëåêòèâíîñò³
çàïðîïîíîâàíèõ
²ÑÅ. Ïîêàçàíî,
ùî ðîáî÷èé ä³àïàçîí
ðÍ ôóíêö³îíóâàííÿ
åëåêòðîä³â ëåæèòü
ó ìåæàõ 6-10.
Âèñíîâêè
1. Ðîçãëÿíóòî
çàãàëüíó õàðàêòåðèñòèêó,
ô³çè÷í³, õ³ì³÷í³,
ôàðìàöåâòè÷í³
òà ìåäè÷í³ âëàñòèâîñò³
ìåëîêñèêàìó.
2. Îõàðàêòåðèçîâàíî
íàÿâíó íà ñüîãîäí³
³íôîðìàö³þ ïðî
ìåòîäè âèçíà÷åííÿ
ìåëîêñèêàìó.
3. Ñèíòåçîâàíî
³îíí³ àñîö³àòè
ìåëîêñèêàìó
ç îñíîâíèìè áàðâíèêàìè
êëàñó òðèôåí³ëìåòàíîâèõ
(êðèñòàë³÷íèé
ô³îëåòîâèé, ìàëàõ³òîâèé
çåëåíèé) òà êñàíòåíîâèìè
- ãðóïè ðîäàì³íó
(ðîäàì³í 6Æ, áóòèëîâèé
åô³ð ðîäàì³íó
Á), ÿê³ óñï³øíî
âèêîðèñòàíî
ÿê åëåêòðîäîàêòèâí³
ðå÷îâèíè äëÿ âèãîòîâëåííÿ
ìåëîêñèêàì-÷óòëèâèõ
åëåêòðîä³â.
4. Äîñë³äæåíî
îñíîâí³ õ³ì³êî-àíàë³òè÷í³
õàðàêòåðèñòèêè,
à ñàìå: âïëèâ ïðèðîäè
òà âì³ñòó ïëàñòèô³êàòîðà,
ðÍ ðîç÷èíó, ÷àñó
â³äêëèêó, ïðèðîäè
ïðîòè³îíà òà
³íøèõ ÷èííèê³â,
ùî âïëèâàþòü
íà ðîáîòó ðîçðîáëåíèõ
åëåêòðîä³â.
5. Âèâ÷åíî ïèòàííÿ
ñåëåêòèâíîñò³
ìåìáðàííèõ ñåíñîð³â.
Âñòàíîâëåíî,
ùî âèçíà÷åííÿ
ìîæíà ïðîâîäèòè
â ïðèñóòíîñò³
ñóëüôàò, í³òðàò,
îêñàëàò, áðîì³ä,
õëîðèä, ôîñôàò,
àöåòàò, òàðòðàò
³îí³â, ãëþêîçè
òà ³íøèõ.
. Âèãîòîâëåí³
ìåëîêñèêàì-ñåëåêòèâí³
åëåêòðîäè âîëîä³þòü
õîðîøèìè åëåêòðîäíèìè
õàðàêòåðèñòèêàìè
³ ìîæóòü áóòè
êîðèñíèìè ïðè
âèçíà÷åíí³ ìàêðîê³ëüêîñòåé
ìåëîêñèêàìó
ó ôàðìàöåâòè÷íèõ
ïðåïàðàòàõ.
˳òåðàòóðà
1. Êîðìîø
Æ.Î. Ñïåêòðîôîòîìåòðè÷íå
âèçíà÷åííÿ äèêëîôåíàêó
ç âèêîðèñòàííÿì
àñòðàôëîêñèíó
/ Æ.Î. Êîðìîø, ².Ï. Ãóíüêà,
ß.Ð. Áàçåëü // Óêð.
Õ³ì. æóðí. - 2008. - Ò. 74, ¹1.
- Ñ. 64-68.
2. Kormosh
Zh. Preparation and ñharacterization of a diclofenac sensitive electrode
based on a PVC matrix membrane / Zh. Kormosh, I. Hunka, Ya. Bazel // Acta Chimica
Slovenica. - 2008. - Vol. 55, ¹ 2. - P. 261-267.
3. Êîðìîø Æ.Î. Ñåíñîð äëÿ âèçíà÷åííÿ äèêëîôåíàêó / Æ.Î. Êîðìîø, ².Ï. Ãóíüêà, ß.Ð. Áàçåëü // Óêð. Õ³ì. æóðí. - 2008. - Ò. 74, ¹10. - Ñ. 91-95.
4. Íèêîëåíêî
Â.Â. Îáîñíîâàíèå
âûáîðà íàèáîëåå
÷àñòî ïðèìåíÿåìûõ
íåñòåðîèäíûõ
ïðîòèâîâîñïàëèòåëüíûõ
ñðåäñòâ ïðè âîñïàëèòåëüíûõ
çàáîëåâàíèÿõ
/ Â.Â. Íèêîëåíêî
// Óêð. ôàðì. æóðí. - 1997.
- Ñ 14.
. ³êòîðîâ
À.Ï. Áåçîïàñíîñòü
ñîâðåìåííûõ
íåñòåðîèäíûõ
ïðîòèâîñïàëèòåëüíûõ
ïðåïàðàòîâ: ìåæäó
ñöèëëîé è õàðèäáîé
/ À.Ï. ³êòîðîâ // Óêð.
ðåâìàò. æóðí. -
2002. - T. 10, ¹ 4. - C. 12-22.
. Çåë³íñüêà
Î.Ì. Ôàðìàêîåêîíîì³÷íèé
àíàë³ç íåñòåðî¿äíèõ
ïðîòèçàïàëüíèõ
ïðåïàðàò³â äëÿ
ë³êóâàííÿ õâîðèõ
íà ðåâìàòî¿äíèé
àðòðèò â Óêðà¿í³
/ Î.Ì. Çàë³íñüêà
// Óêð. ðåâìàò. æóðí.
- 2002. - T. 9, ¹3. - C. 27-31.
. Êîâàëåíêî
Â.Í. Ðåâìàòîëîãèÿ
êàê îäíà èç âàæíåéøèõ
ïðîáëåì ìåäèöèíû
/ Â.Í. Êîâàëåíêî,
À.Ã. Êàìèíñüêèé
// Óêð. ðåâìàò. æóðí.
- 2000. - ¹ 1. - C.
3-8.
. Ìàøêîâñüêèé
Ì.Ä. Ëåêàðñòâåííûå
ñðåäñòâà: Â 2 ò. Ò.1.
/ Ìàøêîâñüêèé
Ì.Ä. - 14-å èçä., ïåðåðàá.,
èñïð. è äîï. - Ì.: ÎÎÎ
«Èçä. Íîâàÿ âîëíà»;
Èçä. Ñ.Á. Äèâîâ,
2002. - 540 ñ.: 8 ñ.
. ³êòîðîâ Î.Ï. Ìåëîêñèêàì:
áåçïåêà ïðè ìåäè÷íîìó
çàñòîñóâàíí³
ÿê îñíîâà ðàö³îíàëüíî¿
ôàðìàêîòåðàﳿ
/ Î.Ï. ³êòîðîâ, Â.Ã.
Êó÷åð, Î.Â. Êàøóáà
// Óêð. Õ³ì. æóðí.
- 2006. - Ò. 54, ¹1. - Ñ. 56-59.
. Ìåëîêñèêàì
ó ë³êóâàíí³ õâîðèõ
íà ðåâìàòî¿äíèé
àðòðèò ³ îñòåîàðòðîç
/ Ã.Â. Äçÿê, Ò.À. Ñèìîíîâà,
Ì.Ã. Ãåòüìàí [òà
³í.] // Óêðà¿íñüêèé
íåâðîëîã³÷íèé
æóðíàë. - 2008. - ¹ 3. - Ñ.
110-111.
11. Determination of meloxicam in human plasma using a HPLC method
with UV detection and its application to a pharmacokinetic study / J. Bae, M.
Kim, Ch. Jang, S. Lee // Journal of Chromatography B. - 2007. - Vol. 859. - P.
69-73.
12. Yuan
Yu. Determination of meloxicam in human plasma by liquid chromatography-tandem mass
spectrometry
following
transdermal administration / Yu. Yuan, X. Chen, D. Zhong // Journal
of Chromatography B. - 2007. - Vol. 852. - P. 650-654.
13. Simultaneous
determination of piroxicam, meloxicam and tenoxicam in human plasma by liquid
chromatography with tandem mass spectrometry / Ji Young , H.W. Lee, Yo. H. Kim
[et al] // Journal of Chromatography B. - 2005. - Vol. 826. - P. 214-219.
14. Application of an alkyl-diol silica precolumn in a column-switching system for the determination of meloxicam in plasma / W.R.G. Baeyens, G. Van der Weken, E.D’haeninck [et al] // Journal of Pharmaceutical and Biomedical Analysis. - 2003. - Vol. 32. - P. 839-846.
15. Sensitive
and rapid liquid chromatography-tandem mass spectrometry method for the
determination of meloxicam in human Plasma / J.L. Wiesner, A.D. de Jager, F.C.W.
Sutherland [et al] // Journal of Chromatography B. - 2003. - Vol. 785. - P.
115-121.
16. LC
determination and pharmacokinetics of meloxicam / B. Dasandi, Shivaprakash, H.
Saroj, K. M. Bhat // Journal of Pharmaceutical and Biomedical Analysis. - 2002.
- Vol. 28. - P. 999-1004.
17. Simultaneous
determination of piroxicam, meloxicam and tenoxicam in human plasma by liquid
chromatography with tandem mass spectrometry / H. Yo. Ji, H. W. Lee, Yo. H. Kim
[et al] // Journal of Chromatography B. - 2005. - Vol. 826. - P. 219-221.
18. Vignaduzzo
S.E. Method development and validation for the simultaneous determination of meloxicam and
pridinol mesylate using RP-HPLC and its application in drug
formulations / S.E. Vignaduzzo, P.M. Castellano, T.S. Kaufman // Journal of
Pharmaceutical and Biomedical Analysis. - 2008. - Vol. 46. - P. 219-225.
19. Igualada
C. Rapid method for the determination of non-steroidal anti-inflammatory drugs in animal tissue by
liquid chromatography-mass spectrometry with ion-trap detector / C.
Igualada, F. Moragues, J. Pitarch // Analytica Chimica Acta. - 2007. - Vol. 586. - P. 432-439.
20. Determination
of meloxicam in bulk and pharmaceutical formulations / N.H. Zawilla,
M.A. Mohammad, N.M. El kousy, S.M. El-Moghazy Aly // Journal of
Pharmaceutical and Biomedical Analysis. - 2003. - Vol. 32. - P. 1135-1144.
21. Hassan
E.M. Spectrophotometric and fluorimetric methods for the determination of
meloxicam in dosage forms / E.M. Hassan // Journal of Pharmaceutical and
Biomedical Analysis. - 2002. - Vol. 27. - P. 771-777.
22. Rao R.N. An
overview of the recent developments in analytical methodologies for determination of COX-2 inhibitors in
bulk drugs,
pharmaceuticals and biological
matrices / R.N. Rao, S. Meena, A.R. Rao // Journal of Pharmaceutical and
Biomedical Analysis. - 2005. - Vol. 39. - P. 349-363.
23. Spectrophotometric
methods for determining meloxicam in pharmaceuticals using batch and
flow-injection procedures / M.S. García, C. Sanchez-Pedreno, M.I.
Albero, J. Martí // European Journal of Pharmaceutical Sciences. - 2000.
- Vol. 9. - P. 311-316.
24. Optimized
and validated spectrophotometric method for the determination of uranium(VI)
via complexation with meloxicam / Lutfullah, M.N. Alam, N.
Rahman [et al] // Journal
of Hazardous Materials. - 2008. - Vol. 155. -P. 261-268.
25. Altınöz
S. Polarographic behaviour of meloxicam and its determination in tablet
preparations and spiked plasma / S. Altınöz, E. Nemutlu, S. Kır
// IL Farmaco. - 2002. - Vol. 57. - P. 463-468.
26. Nemutlu E. Method development and validation for the
analysis of meloxicam in tablets by CZE / E. Nemutlu, S. Kir // Journal of
Pharmaceutical and Biomedical Analysis.- 2003. - Vol. 31. - P. 393-400.
27. Liu
H. Flow-injection chemiluminescence determination of meloxicam by oxidation
with N-bromosuccinimide / H. Liu, L. Zhang, Yu.
Hao // Analytica Chimica Acta. - 2005. - Vol. 541. - P. 187-192.
28. Ãðèçîäóá À. ². Ïðîáëåìû
êà÷åñòâà è ôàëüñèôèêàöèè
ëåêàðñòâåííûõ
ñðåäñòâ / À.².
Ãðèçîäóá,
Ñ.Â. Ñóð // Óêð.
ìåä. ÷àñîï. - 2007. - ¹
3 (59). - C. 137-144.
. Êîíòðîëü
çà áåçïåêîþ ë³êàðñüêèõ
çàñîá³â â Óêðà¿í³:
ñèñòåìà ôàðìàêîëîã³÷íîãî
íàãëÿäó / Î.Â. Ñòåôàíîâ,
Î.Ï. ³êòîðîâ, Â.².
Ìàëüöåâ [òà ³í.]
// Óêð. ðåâìàò. æóðí.
- 2002. - ¹ 3 (9). - Ñ. 3-9.
. Ëóðüå Þ.Þ. Ñïðàâî÷íèê
ïî àíàëèòè÷åñêîé
õèìèè / Þ.Þ. Ëóðüå - Ì.: Õèìèÿ,
1979. - 480 ñ.
. Êàììàí Ê. Ðîáîòà ñ
èîíîñåëåêòèâíûìè
ýëåêòðîäàìè
/ Ê. Êàììàí.
- Ì.: Ìèð, 1980. - 283 ñ.
32. Davies I.E.W. Nitrate ion selective electrodes
based on poly(vinilchloride) matrix membranes / I.E.W. Davies, G.J. Moody, I.D.R. Thomas // Analyst. - 1972. - Vol. 71. - P. 87-94.
. Moody G.C. A calcium-sensitive electrode based on a liquids ion exchanger in a poly(vinil-chloride) matrix / G.C. Moody, R.B. Oke, I.D.R. Thomas // Analyst. - 1970. -Vol. 95. - P. 910-914.
34. Hiiro K. A clorate ion-selective electrode based on poly(vinilchloride) matrix membrane / K. Hiiro, G.J. Moody, I.D.R. Thomas // Talanta. - 1975. - Vol. 22. - P. 918-919.
35. Ãðàíæàí À.Â. Ïðèìåíåíèå
èîíñåëåêòèâíåíûõ
ýëåêòðîäîâ â ôàðìàöåâòè÷åñêîì
àíàëèçå (îáçîð)
/ À.Â. Ãðàíæàí,
À.Ê. ×àðûêîâ
// Õèì.- ôàðìàö. æóðí.
- 1993. - Ò. 27, ¹ 7. - Ñ. 51-56.
. Çîëîòîâà Þ.À. Îñíîâû
àíàëèòè÷åñêîé
õèìèè / Þ.À. Çîëîòîâà, Å.Í. Äîðîõîâà, Â.È. Ôàäååâà. - .Ì.:
2000. - 494 ñ.
37. Áàçåëü ß.Ð. Ïðàêòè÷íèé
êóðñ àíàë³òè÷íî¿
õ³ì³¿. / ß.Ð. Áàçåëü,
Î.Ã. Âîðîíè÷, Æ.Î. Êîðìîø.
- Ë.: Âåæà, 2004. - ×.1. - 260 ñ.
. Ëàêøìèíàðàíàéàõ Í. Ìåìáðàííûå
åëåêòðîäû / Í. Ëàêøìèíàðàíàéàõ. - Ë.: Õèìèÿ,
1979. - 430 ñ.
. Íèêîëüñüêèé Á.Ï. Èîíîñåëåêòèâíûå
ýëåêòðîäû / Á.Ï. Íèêîëüñüêèé,
Å. Â. Ìàòòåðîâà.
- Ë.: Õèìèÿ, 1980. - 240 ñ
. Ïåòðóõèí Î.Ì. Èîíî - ñåëåêòèâíûå
ýëåêòðîäû / Î.Ì. Ïåòðóõèí. - Ì.: Çíàíèå,
1932.- 32 ñ.
41. Umezawa Y. Potentiometric selectivity
coefficients of ion - selective electrodes / Y. Umezawa, Ph. Buhlmann, K. Umezawa // Pure Appl. Chem.
- 2000. - Vol 72, ¹ 10, P - 1851 - 2082.
. Ìîðô Â. Ïðèíöèïû
ðàáîòû èîíîñåëåêòèâíûõ
ýëåêòðîäîâ è ìåìáðàííûé
òðàíñïîðò / Â. Ìîðô. - Ì.: Ìèð,
1985. - 280 ñ.
. Ñïðàâî÷íîå
ðóêîâîäñòâî ïî
ïðèìèíåíèþ èîíîñåëåêòèâíûõ
ýëåêòðîäîâ. - Ì.:
Ìèð, 1986. -
231 ñ.
44. Áàçåëü ß.Ð. Ýëåêòðîäíîàêòèâíûå
âåùåñòâà íà îñíîâå
èîííûõ àññîöèàòîâ
ñ êàòèîííûìè
êðàñèòåëÿìè
â èîíîìåòðèè
/ ß.Ð. Áàçåëü
// Æóðí. àíàëèò.
õèìèè. -
2002. - Ò. 57, ¹ 12. - C. 1252 - 1256.
45. Êàììàí Ê. Ðîáîòà
ñ èîíîñåëåêòèâíûìè
ýëåêòðîäàìè
/ Ê. Êàììàí. - Ì.: Ìèð,
1980. - 283 ñ.