Обзор полужесткокрылых Челябинской области
Содержание
Вступление
. Общая часть
1.1
Физико-химические свойства образца, который исследуется
.2
Существующие методы анализа, их характеристика
.2.1
Химические методы анализа
.2.2
Инструментальные методы анализа
.3
Выбор метода анализа и его обоснование
2. Экспериментальная часть
2.1
Сущность и теоретические основы метода анализа
.2
Оборудование, реактивы и материалы
.3
Методика выполнения анализа
.4
Правила техники безопасности при работе в химической лаборатории
.5
Результаты анализа
.6
Математическая обработка результатов анализа
Выводы
Литература
Введение
Хлорид натрия - химическое соединение NaCl,
натриевая соль соляной кислоты, хлористый натрий. Чистый хлорид натрия имеет
вид бесцветных кристаллов, но с различными примесями его цвет может принимать
голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Хлорид натрия известен в быту под названием
поваренной соли, основным компонентом которой он является. В значительном
количестве содержится в морской воде, создавая её солёный вкус.
Хлорид натрия жизненно необходим для
жизнедеятельности человека, равно как всех прочих живых существ. Он участвует в
поддержании и регулировании водно-солевого баланса в организме,
натрий-калиевого ионного обмена.
В пищевой промышленности и кулинарии используют
хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как
вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия
имеет товарное название поваренная соль, порой также употребляются названия
пищевая, столовая, а также уточнение названия в зависимости от её происхождения
- каменная, морская, и по составу добавок - йодированная, фторированная и так
далее. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом
без привкуса, без запаха (за исключением йодированной соли).
Наиболее вероятно, что первое знакомство
человека с солью произошло в лагунах теплых морей или на соляных озёрах, где на
мелководье соленая вода интенсивно испарялась под действием высокой температуры
и ветра, а в осадке накапливалась соль. По образному выражению Пифагора, «соль
была рождена благородными родителями: солнцем и морем».
В природе хлорид натрия встречается в виде
минерала галита, который образует залежи каменной соли среди осадочных горных
пород, прослойки и линзы на берегах солёных озёр и лиманов, соляные корки в
солончаках и на стенках кратеров вулканов и в сольфатарах. Огромное количество
хлорида натрия растворено в морской воде. Образуется при осаждении в замкнутых
водоемах, а также как продукт сгона на стенках кратеров вулканов.
В химической промышленности поваренная соль
используется для получения соды, хлора, соляной кислоты, гидроксида натрия и
металлического натрия.
В медицине изотонический раствор хлорида натрия
в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции
состояния систем организма в случае обезвоживания, как растворитель других
лекарственных препаратов.
Зимой хлорид натрия, смешанный с другими солями,
песком или глиной - так называемая техническая соль - применяется как антифриз
против гололеда. Ею посыпают тротуары.
1 ОБЩАЯ ЧАСТЬ
1.1 Физико-химические свойства анализируемого
материала
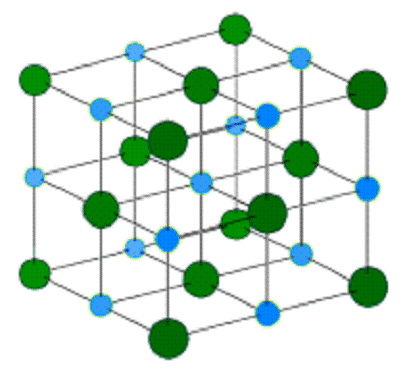
Рисунок 1.1- Кристаллическая решётка хлорида
натрия.
Голубой цвет = Na+
Зелёный цвет = Cl-
Хлорид натрия образует бесцветные кристаллы
кубической сингонии. Каждый из ионов Cl− окружен шестью ионами Na+ в
октаедральний конфигурации, и наоборот. Если мысленно отбросить, например, ионы
Na+, то останется плотно упакованная кубическая структура с ионов Cl−,
называемая гранецентрированной кубической решеткой. Ионы Na+ тоже образуют
плотно упакованную кубическую решетку. Таким образом, кристалл состоит из двух
подрешеток, сдвинутых друг относительно друга на полупериод. Такая же решетка
характерна для многих других минералов.
В кристаллической решетке между атомами
преобладает ионная химическая связь, что является следствием действия
электростатического взаимодействия противоположных по заряду ионов.
Температура плавления NaCl
- 800,8 С, кипения 1465 С.
Умеренно растворяется в воде, растворимость мало
зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды)
равен 35,9 при 21 °C и 38,1 при 80 °C. Растворимость хлорида натрия существенно
снижается в присутствии хлороводорода, гидроксида натрия, солей - хлоридов
металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом
виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена
примесями (преимущественно ионами Ca2+, Mg2+ и SO42-),
и такая соль на воздухе сыреет. Кристаллогидрат NaCl · 2H2O можно
выделить при температуре ниже +0,15 ° C.
Смесь измельченного льда с мелким порошком
хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl
на 100 г льда охлаждается до температуры −20 ° C. Это происходит потому,
что водный раствор соли замерзает при температуре ниже 0 ° C. Лед, имеющий
температуру около 0 ° C, плавится в таком растворе, поглощая тепло окружающей
среды.
Таблица 1.1- Плотность и концентрация водных
растворов NaCl
|
Концентрация,
%
|
Концентрация,
г/л
|
Плотность,
г/мл
|
|
1
|
10,05
|
1,005
|
|
2
|
20,25
|
1,012
|
|
4
|
41,07
|
1,027
|
|
6
|
62,47
|
1,041
|
|
8
|
84,47
|
1,056
|
|
10
|
107,1
|
1,071
|
|
12
|
130,2
|
1,086
|
|
14
|
154,1
|
1,101
|
|
16
|
178,5
|
1,116
|
|
18
|
1,132
|
|
20
|
229,5
|
1,148
|
|
22
|
256
|
1,164
|
|
24
|
283,2
|
1,18
|
|
26
|
311,2
|
1,197
|
В природе хлорид натрия чаще всего встречается в
виде минерала галита. Он имеет гранецентрированную кубическую решетку и
содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в
состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca,
S, O.
Морская соль является смесью солей (хлориды,
карбонаты, сульфаты и т. д.), образующегося при полном испарении морской воды.
Среднее содержание солей в морской воде приведено в таблице 1.2
Таблица 1.2- Среднее содержание солей в морской
воде
|
Соединение
|
Масс.
доля, %
|
|
NaCl
|
77,8
|
|
MgCl2
|
10,9
|
|
MgSO4
|
4,7
|
|
KCl
|
2,5
|
|
K2SO4
|
2,5
|
|
CaCO3
|
0,3
|
|
Ca(HCO3)2
|
0,3
|
|
другие
соли
|
0,2
|
В пищевой промышленности выделяют четыре сорта
поваренной соли: экстра, высший, первый и второй.
Массовая доля хлористого натрия в сортах, %:
экстра - не менее 99,5;
высший - 98,2;
первый - 97,5;
второй - 97,0.
Массовая доля примесей приведена на рисунке 1.2.
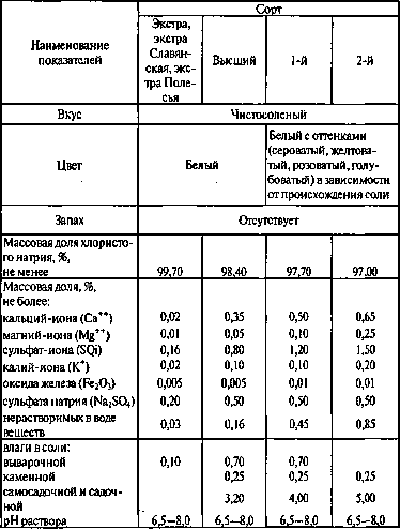
Рисунок 1.2- Показатели некоторых параметров в
сортах поваренной соли
.2 Существующие методы анализа, их
характеристика
Анализ выполняется посредством определения
хлорид-ионов.
Осуществляется химическими и инструментальными
методами анализа.
.2.1 Химические методы анализа
Требования к титриметрическим методам
определения
Титриметрические определения хлоридов, основаны
на реакциях образования осадков малорастворимых соединений. Не все реакции
сопровождающиеся выпадением осадков применимы в объемном анализе. В этих
реакциях пригодны только некоторые реакции, удовлетворяющие определенным
условиям. Реакция должна протекать строго по уравнению и без побочных
процессов. Образующийся осадок должен быть практически нерастворимым и выпадать
достаточно быстро, без образования пересыщенных растворов. К тому же необходимо
иметь возможность определять конечную точку титрования с помощью индикатора.
Наконец, явления адсорбции (соосаждения) должны быть выражены при титровании
настолько слабо, чтобы результат определения не искажался.
Наименования отдельных методов осаждения
происходят от названий применяемых растворов. Метод, использующий раствор
нитрата серебра, называют аргентометрией. Тиоцианатометрия основана на
применении раствора тиоцианата аммония NH4SCN (или калия KSCN) и
служит для определения следов С1- в сильнощелочных и кислых
растворах. Дорогостоящий аргентометрический метод определения галогенидов по
возможности стараются заменять меркурометрическим. В последнем используют
раствор нитрата ртути (I) Hg2(NO3)2.
Аргентометрия
Объемный аналитический метод, основанный на
реакциях осаждения ионов галогенов катионами серебра с образованием
малорастворимых галогенидов:
Cl-+Ag+=
AgCl↓
При этом используют раствор нитрата серебра.
Если же анализируют вещество на содержание серебра, то пользуются раствором
хлорида натрия (или калия).
Для понимания метода аргентометрии большое
значение имеют кривые титрования. В качестве примера рассмотрим случай
титрования 10,00 мл 0,1 н. раствора хлорида натрия 0,1 н. раствором нитрита
серебра (без учета изменения объема раствора).
До начала титрования концентрации хлорид-ионов в
растворе равна общей концентрации хлорида натрия, т.е. 0,1 моль/л или [Cl-]=l0-1.
Обозначив отрицательный логарифм концентрации
(или активности) определяемых хлорид-ионов через рСl,
можно написать:
рCl = - lg [Cl-]
= - lg l0-1= 1.
Когда к титруемому раствору хлорида натрия будет
прибавлено 9,00 мл раствора нитрата серебра и 90% хлорид-ионов будут осаждены,
концентрация их в растворе уменьшится в 10 раз и станет равна 10-2
моль/л, а рС1 будет равен 2. Поскольку же величина ПР AgCl=10-10,
концентрация ионов серебра при этом составит:
[Ag+] = 10-10/[С1-]
= 10-10/10-2 = 10-8 моль/л,
или pAg=
- lg[Ag+]
= - lgl0-8
= 8.
Аналогичным образом вычисляют все остальные
точки для построения кривой титрования. В точке эквивалентности pCl=pAg= 5 (см.
табл. 2.1).
Таблица 1.3 - Изменение рСl
и pAg при титровании 10,00 мл 0,1 н. раствора хлорида натрия 0,1 н. раствором
нитрата серебра
|
Прибавлено
раствора AgNO3, мл
|
[С1-]
|
[Ag+]
|
рСl
|
pAg
|
|
0
|
10-1
|
1
|
-
|
|
9.00
|
10-2
|
10-8
|
2
|
8
|
|
9.90
|
10-3
|
10-7
|
3
|
7
|
|
9.99
|
10-4
|
10-6
|
4
|
6
|
|
10.00 (точка
эквивалентности)
|
10-5
|
10-5
|
5
|
5
|
|
10,01
|
10-6
|
10-4
|
6
|
4
|
|
10,10
|
10-7
|
10-3
|
7
|
3
|
|
11,00
|
10-8
|
10-2
|
8
|
2
|
|
20,00
|
10-9
|
10-1
|
9
|
1
|
Интервал скачка при аргентометрическом
титровании зависит от концентрации растворов и от значения произведения
растворимости осадка. Чем меньше величина ПР получающегося в результате
титрования соединения, тем шире интервал скачка на кривой титрования и тем
легче фиксировать конечную точку титрования с помощью индикатора.
Наиболее распространено аргентометрическое
определение хлора по методу Мора. Сущность его состоит в прямом титровании
жидкости раствором нитрата серебра с индикатором хроматом калия до побурения
белого осадка.
Индикатор метода Мора - раствор К2СгО4
дает с нитратом серебра красный осадок хромата серебра Ag2CrO4,
но растворимость осадка (0,65*10-4Э/л) гораздо больше растворимости
хлорида серебра (1.25*10-5 Э/л). Поэтому при титровании раствором
нитрата серебра в присутствии хромата калия красный осадок хромата серебра
появляется лишь после добавления избытка ионов Ag+, когда все
хлорид-ионы уже осаждены. При этом всегда к анализируемой жидкости приливают
раствор нитрата серебра, а не наоборот.
Возможности применения аргентометрии довольно
ограничены. Её используют только при титровании нейтральных или слабощелочных растворов
(рН от 7 до 10). В кислой среде осадок хромата серебра растворяется.
В сильнощелочных растворах нитрат серебра
разлагается с выделением нерастворимого оксида Ag2O. Метод
непригоден и для анализа растворов, содержащих ион NH4+,
так как при этом образуется с катионом Ag+ аммиачный комплекс [Ag(NH3)]+.
Анализируемый раствор не должен содержать Ва2+, Sr2+, Pb2+,
Bi2+ и других ионов, дающих осадки с хроматом калия. Тем не менее
аргентометрия удобна при анализе бесцветных растворов, содержащих С1 -
- ионы. Растворы, содержащие Ag+, не выливают в раковину, а собирают
в специальную склянку, так как серебро из них регенерируют.
Кроме метода Мора при определении хлоридов
аргентометрическим титрованием применяется также метод Фаянса. Он основан на
прямом титровании растворов содержащих галогенид ионы стандартным раствором AgNO3
в присутствии адсорбционных индикаторов:
Ag+
+ Cl-→
AgCl
mAgCl + n
Ag+(изб)→
(AgCl)mAg+n
(AgCl)mAgn+
+ Ind- → [(AgCl)mAg+n] Ind-
Титрование хлоридов в присутствии флуоресцеина
проводят в нейтральной среде. При повышенной концентрации ионов водорода
флуоресцеин, являющийся кислотой (HInd),
диссоциирует слабо вследствие подавления его диссоциации кислотой. Поэтому
концентрация Ind-ионов
становится очень малой. В щелочном растворе осаждается Ag2O.
В умеренно кислой среде обычно титруют в присутствии других индикаторов:
дихлорфлуоресцеина и эозина. Титрование в кислых средах выгодно отличается от
титрования в нейтральных растворах, так как дает возможность вести определение
в присутствии гидролизующихся солей, разлагающихся водой с образованием осадков
гидроокисей и оксихлоридов (Al3+,
Fe3+
и др.).
В мерную колбу и вносят аликвоту пробы. После
чего доводят объем раствора до метки и тщательно перемешивают. Для определения
хлорида отбирают аликвотные части исследуемого раствора (по 25 мл), переносят
их в конические колбы, прибавляют по 5 капель раствора флуоресцеина и титруют
стандартным раствором AgNO3, непрерывно перемешивая. По мере
прибавления по каплям раствора AgNO3 титруемая смесь мутнеет. Вблизи
точки эквивалентности наблюдается частичная коагуляция коллоидного осадка AgCl.
В этот момент титруют еще более внимательно и осторожно, сильно перемешивая
содержимое колбы, титрование заканчивают, когда белый осадок AgCl окрашивается
в красный цвет. Титрование выполняют 3 - 4 раза и, получив три сходящихся
результата, вычисляют результаты анализа.
Роданометрия
Роданометрический метод (метод Фольгарда)
титриметрического анализа основан на применении в качестве осадителя
титрованного раствора, содержащего SCN--ионы:
Ag+
+ SCN-
→ AgSCN
В качестве стандартных растворов используют: для
определения ионов роданид аммония; для определения галогенидов и других ионов -
нитрат серебра и роданид аммония.
Роданометрическим методом пользуются для
определения галоген-ионов и серебра в серебряных сплавах. В роданометрии в
качестве индикатора для определения точки эквивалентности. применяют насыщенный
раствор железо-аммонийных квасцов.
Метод Фольгарда обладает рядом достоинств по
сравнению с методом Мора. Роданометрический метод применим для определения
хлоридов, бромидов, иодидов, роданидов и ионов серебра.
Метод применим для титрования кислых растворов
так как осадок AgSCN нерастворим в кислотах. Эта особенность метода делает
очень удобным при анализе серебряных сплавов, которые растворяют в кислотах, и
количественном определении галогенидов в сильнокислых средах, так как
галогениды в указанных средах нельзя титровать по методу Мора или в присутствии
адсорбционных индикаторов. Другие ионы (Ва2+, РЬ2+ и
др.), мешающие определению по методу Мора, в большинстве случаев не мешают
определению по методу Фольгарда.
Определение С1--ионов по методу
Фольгарда основано на применении метода обратного титрования. Хлорид-ионы
сначала осаждают определенным объемом стандартного раствора AgNO3,
взятого с избытком. Затем оттитровывают не вступивший в реакцию с хлоридом
избыток AgNO3 стандартным раствором NH4SCN в присутствии
железо-аммонийных квасцов в качестве индикатора. По разности результатов двух
титрований определяют объем раствора AgNO3, израсходованного на
осаждение С1- Таким образом, последовательно протекают три реакции:
Ag+
+ Cl-
→ AgCl
Ag+
+ SCN-
→ AgSCN
SCN-
+ Fe3+
→ Fe(SCN)3
Однако в тот момент, когда избыток Ag+
будет оттитрован роданидом, избыток SCN - вступает, кроме того, в
реакцию с AgCl:
AgCI+ SCN-
↔ AgSCN + Сl-
Так как роданид серебра (ПPAgSCN
= 10-12) менее растворим, чем хлорид серебра (ПPAgCl=.
1,7*10-10), то указанное равновесие сдвигается слева направо.
В момент равновесия отношение [C1-]/[SCN-]
равно отношению ПPAgCl/ПPAgSCN.
Следовательно:
[Cl-]/[SCN-]
= ПPAgC/
ПPAgSCN
= 170
т.е. равновесие устанавливается тогда, когда
[SCN»] станет в 170 раз меньше [С1-].
Таким образом, равновесие установится тогда,
когда практически весь избыток SCN - вступит в реакцию двойного
обмена с AgCl. Поэтому конечную точку титрования трудно заметить, так как
появившееся розово-красное окрашивание, вызываемое образованием Fe(SCN)3,
быстро исчезает вследствие обменной реакции:
Fe(SCN)3
+ 3AgCl →
Fe3+
+ ЗСl-
+ 3AgSCN
Для предупреждения этой реакции применяют
различные способы. Наиболее эффективно отделение осадка AgCl фильтрованием. При
этом С1- ионы осаждают избытком раствора AgNO3 в мерной
колбе, доводят объем раствора до метки, смесь взбалтывают 5-10 мин и
отфильтровывают по частям через сухой фильтр. Первые порции фильтрата
отбрасывают. Аликвотные части фильтрата (25 мл из 250 мл) титруют роданидом.
Для проведения анализа по методу Фольгарда,
берут 100 см3 раствора. Титрованные растворы нитрата серебра и
роданида аммония помещают в две различные бюретки. Отбирают из мерной колбы в
коническую колбу аликвотное количество раствора, добавляют 2 капли азотной
кислоты, 1 мл раствора индикатора и прибавляют отмеренный избыток раствора
нитрата серебра (50 мл). Затем приступают к титрованию полученной смеси
титрованным раствором роданида аммония до появления красного окрашивания
раствора. Определение повторяют до тех пор, пока результаты трех титрований
будут расходиться не более чем на 0,05 мл.
В случае необходимости выпавший осадок
отфильтровывают или добавляют в анализируемый раствор бензол и ведут
определение, как указано выше.
При известном навыке определение не занимает
много времени и приводит к достаточно точным результатам.
Метод основан на применении в качестве титранта
раствора солей ртути (II).
При взаимодействии Hg2+
с хлорид ионами образуется слабо диссоциированное соединение:
Hg2+
+ Cl-
→ [HgCl]+
После достижения точки эквивалентности, в
титруемом растворе появляются избыточные Нg2+-ионы,
которые обнаруживают при помощи соответствующего индикатора, образующего с Hg2+
характерные соединения.
В качестве стандартных растворов для определения
галогенидов, цианидов и роданидов применяют нитрат или перхлорат ртути(II), а
для определения ионов хорошо диссоциирующих солей ртути - роданид аммония.
В меркуриметрии в качестве индикаторов применяют
нитропруссид натрия, дающий бесцветный осадок с Hg2+, дифенилкарбазон,
образующий синий осадок, р-нитрозо-нафтол, внутрикомплексное соединение
которого с Hg2+ красного цвета. И.С. Мустафин и О.В. Сиванова в 1964
г. предложили для этой же цели применять нитрозооксин в смеси с красителем
кислотным синим антрахиноновым; последний прибавляется в качестве светофильтра.
Такой индикаторный раствор, названный авторами гидрон III, при избытке
галогенидов окрашен в зеленый цвет, переходящий в красный при избытке Hg2+.
Индикатор позволяет работать с 2,5*10-3 н. раствором Hg2+
и определять, например, 0,03 мг хлоридов в 10 мл титруемого раствора.
Меркуриметрический метод широко применяется
благодаря многим преимуществам по сравнению с аргентометрическими методами.
.Меркуриметрический метод позволяет вести прямое
определение анионов в кислой среде.
.Этот метод применяется не только для
определения галогенидов, цианидов и роданидов, но и для определения ионов
окисной ртути.
.Многие ионы, мешающие определению по методу
Мора и Фольгарда, не оказывают влияния на точность определений с помощью
нитрата или перхлората окисной ртути.
.Соединения ртути являются менее дефицитными,
чем соли серебра, и легко регенерируются.
Меркуриметрическое определение хлоридов
выполняется методом прямого титрования анализируемого раствора раствором
нитрата ртути (ІІ) в присутствии индикатора нитропруссида натрия или
дифенилкарбазона. Титрование ведётся до появления сине-фиолетового окрашивания.
Меркуриметрический метод, равно как и другие
методы, основанные на применении солей ртути, имеет весьма существенный недостаток:
соли ртути ядовиты, работа с ними требует большой аккуратности и применения
необходимых мер предосторожности.
Меркурометрия (рабочий раствор Hg+)
Меркуриметрический метод титриметрического
анализа основан на применении титрованных растворов солей ртути(I)
(меркуро-ионов).
При взаимодействии [Hg2]2+-ионов
с хлоридами, бромидами, иодидами и т.д. образуются осадки малорастворимых
галогенидов Hg2Cl2, Hg2Br2, Hg2I2,
например:
[Hg2]2+ + 2Сl- →
Hg2Cl2
Меркуриметрический метод по сравнению с
аргентометрическим дает некоторые преимущества.
.При меркурометрическом методе не требуется
ценных препаратов серебра.
.Соли ртути (I) менее растворимы, чем
соответствующие соли серебра, и поэтому при титровании хлоридов нитратом
ртути(I) наблюдается резкий скачок титрования вблизи точки эквивалентности.
.Определение меркурометрическим методом можно
проводить в кислых растворах методом прямого титрования.
Недостатком меркурометрического метода является
ядовитость солей ртути. Поэтому при работе с этими солями следует соблюдать
большую осторожность.
Применение меркурометрического метода при
количественных определениях растворимых хлоридов и бромидов пока ограничено.
В меркурометрическом методе титрования в
качестве индикаторов применяют:
Дифенилкарбазон, образующий с [Нg2]2+-ионами
осадок синего цвета.
Роданид железа Fe(SCN)3. При
титровании (например, хлоридов) растворами солей ртути(I) в точке
эквивалентности раствор обесцвечивается. Избыток [Hg2]2+-ионов
реагирует с Fe(SCN)3 по уравнению:
[Hg2]2+
+ 2 Fe(SCN)3
→ 3Hg2(SCN)2
+ 2Fe3+
.2.2 Инструментальные методы анализа
Нефелометрическое определение хлоридов
При прохождении пучка света через дисперсные
системы наблюдается рассеяние или поглощение света твердыми частицами. Это
явление положено в основу нефелометрии и турбидиметрии.
Интенсивность светового потока, рассеиваемого
небольшими твердыми частицами взвеси, описывается уравнением Рэлея:
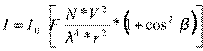 ()
()
где I
и I0
- интенсивности рассеянного и падающего света соответственно;- функция,
зависящая от показателя преломления частиц в растворе;- общее число частиц во
взвеси;- объем частицы;
λ - длина волны
падающего света;
г - расстояние до наблюдателя;
β - угол между
направлениями падающего и рассеянного света.
При нефелометрических определениях все измерения
проводят при определенных значениях F, V, г, р. Поэтому, объединяя их в одну
константу, можно записать:
= I0KN = I0KC
Отсюда интенсивность рассеянного светового
потока прямо пропорциональна числу частиц во взвесях, т.е. концентрации частиц,
находящихся в растворе. Из приведенной выше формулы следует, что интенсивности
рассеянного света в двух растворах с частицами одинаковой формы и размеров
относятся между собой, как концентрации частиц определяемого вещества.
Это уравнение лежит в основе нефелометрических
определений. При нефелометрических определениях измеряют интенсивность
рассеянного света в направлении, перпендикулярном к направлению первичного
пучка света. Турбидиметрические измерения производятся в направлении
распространения светового потока.
Приведенные уравнения справедливы только для
очень разбавленных суспензий (не более 100 мг на 1 л). Турбидиметрические и
нефелометрические методы обладают высокой чувствительностью. Однако применяются
они не широко, что объясняется трудностью получения взвесей с одинаковыми
размерами частиц. Количественные нефелометрические и турбидиметрические
определения проводят, пользуясь калибровочной кривой.
Свет от лампы накаливания 1 проходит через
стеклянную пластинку 2, конденсор 3 и попадает в кювету 4, помещенную в камеру
с дистиллированной водой. Камеру с водой применяют для того, чтобы уменьшить
рассеивание света стенками кюветы. Световой поток, прошедший через кювету,
гасится в светоловушке 5, а части светового потока, рассеянного частицами
взвеси в кювете 4 и стеклянным рассеивателем 17, собираются насадочными линзами
6 и 16. Образовавшиеся два пучка проходят через диафрагмы 7 и 15, связанные с
отсчетными барабанами и объективами 8 и 14, направляются в ромбические призмы 9
и 13. Бипризма 10 лает возможность наблюдать в поле зрения окуляра 12
интенсивность двух пучков света.
При нефелометрических определениях на пути
пучков света вводят светофильтры 11, применение которых нивелирует разницу в
оттенках двух световых потоков.
Нефелометрическое определение хлорид-ионов
основано на реакции осаждения хлоридов нитратом серебра:
+
+ Cl-
→ AgCl
При малых концентрациях хлорид-ионов выпадение
осадка не происходит, а возникает помутнение раствора. Степень помутнения
зависит от концентрации хлоридов в растворе. Для стабилизации растворов вводят
стабилизирующие компоненты.
Анализ проводится следующим образом. Из
анализируемого раствора отбирают микропипеткой 5 мл раствора и помещают в
мерную колбу емкостью 50 мл. В нее же прибавляют 10 мл 0,1 н. раствора азотной
кислоты, 2 мл 0,5%-ного раствора желатины, дистиллированной воды до общего
объема приблизительно 30 мл, 10 мл 0,005 М раствора AgCl
и
доливают водой до метки. Содержимое колбы тщательно перемешивают. Через 5 мин
раствор переносят в кювету нефелометра и измеряют рассеивание света не менее 3
раз. Из полученных отсчетов вычисляют среднее значение и по калибровочной
кривой определяют содержание хлорид-ионов.
Калибровочный график строят следующим образом.
Из эталонного раствора КС1 (вводят 0,1 г КС1 в мерную колбу емкостью 500 мл и
доводят водой до метки) отбирают в четыре мерные колбы емкостью по 50 мл
микропипеткой соответственно 2,0; 4,0; 6,0; 8,0 мл и приготавливают стандартные
растворы, добавляя в них все реактивы, указанные выше.
Начинают измерения с пробы, имеющей наибольшую
концентрацию. Раствор помещают в кювету. Устанавливают светофильтр, цвет
которого близок к окраске исследуемого раствора в рассеянном свете. Если
жидкость бесцветна, устанавливают зеленый светофильтр. Оба отсчетные барабаны
ставят на «0» и подбирают такой рассеиватель, при котором в окуляре левое
фотометрическое поле будет несколько светлее правого. Вращением правого
барабана уравнивают фотометрические поля по яркости и отсчитывают «кажущуюся»
оптическую плотность.
Потенциометрическое определение хлорид ионов
Потенциометрические методы анализа делятся на
потенциометрическое титрование и прямую потенциометрию. Потенциометрическое
титрование преследует чисто прикладную цель количественного определения данного
вещества в растворе путем его титрования стандартным раствором соответствующего
реагента. При титровании в исследуемый раствор опускают индикаторный электрод,
возникновение потенциала на котором обусловливается определяемым веществом
непосредственно (если оно электроактивно) или косвенно (если оно
неэлектроактивно) в результате химического взаимодействия его с каким-либо
другим потенциалопределяющим компонентом. В процессе химической реакции
(например, титрования) за изменением концентрации определяемого вещества следят
по изменению потенциала индикаторного электрода.
Потенциометрическое титрование при прочих равных
условиях имеет ряд преимуществ по сравнению с визуальными титриметрическими
методами анализа. К применяемым в потенциометрическом титровании химическим
реакциям предъявляются те же требования, что и при обычном титриметрическом
анализе.
В отличие от обычного титриметрического метода,
основанного на применении цветных индикаторов, в потенциометрическом методе
титрования индикатором является электрод, на котором протекает индикаторная
электрохимическая реакция. Скачок потенциала в точке эквивалентности или вблизи
нее дает возможность найти конечную точку титрования по кривым титрования или
сам скачок принимается как показатель момента завершения реакции.
Для определения хлорид ионов применяется метод
осадительного титрования. Определение ведётся титрованием раствором с ионами
серебра. Индикаторный электрод - серебро металлическое.
Химическая реакция выражается уравнением:
Ag+
+ Cl-
→ AgCl↓
Разность равновесных потенциалов между двумя
точками титрования, отвечающая скачку потенциала, равна:
ΔЕ = Е2 -
Е1 = Е20 - Е10
+ υ lg 10-3
= υlg 10-8
- υlg ПPAgСl
Измерение потенциала возникающего в цепи
измеряется потенциометрами. Почти все приборы для измерения э.д.с.
потенциометрической ячейки - потенциометры - имеют следующую схему (рис. 1.5).
Один полюс внешнего источника постоянного тока через переключатель неподвижно
присоединен к одному из концов (Л) делителя напряжения с равномерным сечением
проволоки и с небольшим сопротивлением (10 - 100 ом). Делитель напряжения
обычно снабжен шкалой с равномерными 1100 делениями. Другой полюс источника
тока присоединен к переменному сопротивлению малой величины, с которым второй
конец (В) делителя напряжения соединяется с помощью подвижного контакта. Таким
образом, напряжение источника падает на постоянном участке А В и на некотором
участке переменного сопротивления ав. Конец В делителя напряжения присоединяют
к одному из электродов Э, ячейки, соблюдая при этом полярность соединения, т.е.
полюс источника тока и электрод тем же знаком должны быть присоединены к одному
и тому же концу делителя. Второй электрод Э2 подключают последовательно
через переключатель, прерыватель тока и индикатор тока к подвижному контакту,
свободно перемещаемому на делителе напряжения. Дополнительно к концу В делителя
напряжения подключают один из полюсов стандартного элемента Вестона (соблюдая
тот же порядок полярности соединения, см. выше), другой полюс которого может
быть соединен с помощью переключателя с подвижным контактом. Следовательно, при
одном положении переключателя замыкается через прерыватель тока цепь,
содержащая элемент Вестона, а при другом - цепь, содержащая потенциометрическую
ячейку.
Элемент Вестона устанавливается для контроля
цены одного деления шкалы делителя напряжения (в милливольтах), так как э. д.
с. внешних источников тока известна с недостаточной точностью и со временем
самопроизвольно падает (источник тока разряжается).
Определение С1- в растворе проводят
титрованием 0,05 н. стандартным раствором нитрата серебра с серебряным
индикаторным электродом и Нас.КЭ сравнения. Э. д. с. потенциометрической ячейки
измеряют компенсационным методом. Теоретически скачок наступает несколько
раньше точки эквивалентности, но практически точка эквивалентности и конечная
точка титрования совпадают.
При аргентометрическом титровании недопустимо
применение электролитических ключей, заполненных насыщенным раствором хлорида
калия; его следует заменить насыщенным раствором KNO3,
не реагирующим с Ag+-ионами.
Вся предварительная настройка потенциометра,
приемы работы и записи результатов аналогичны изложенным выше, но перед началом
титрования раствор должен быть приблизительно 10%-ным относительно нитрата
бария. Так как система гетерогенна и происходит адсорбция осадком титрующего и
титруемого ионов, потенциал устанавливается не быстро, особенно вблизи конечной
точки титрования. Поэтому следует ждать достижения более или менее постоянного
значения Е. обычно пользуются данными которые за 1 мин изменяются не более чем
на 3-5 мВ.
Кондуктометрическое определение хлорид ионов
Кондуктометрия - электрохимический метод
анализа, связывающий электропроводность раствора с его составом. Электрическая
проводимость растворов обусловлена наличием в них носителей электрического
заряда - ионов. Все растворимые соли диссоциируют на ионы, поэтому проводимость
ионных раствором значительно выше молекулярных.
Кондуктометрическое титрование используется при
определении индивидуальных веществ и анализе разнообразных смесей. Точку
эквивалентности при кондуктометрическом титровании определяют по изменению
электропроводности раствора. Электропроводность измеряют после добавления
каждой порции титранта. Зависимость электропроводности раствора от количества
добавленного титранта изображают графически. Полученный график называют кривой
кондуктометрического титрования. Кондуктометрические кривые имеют излом,
соответствующий точке эквивалентности.
Кривые подобного типа могут быть использованы
для аналитических целей только в том случае, если перед точкой зквивалентности
наблюдается линейное изменение проводимости.
При титровании следует проводить большое число
измерений электропроводности. Для определения точки эквивалентности используют
близкие к ней участки кривых.
В методе кондуктометрического титрования могут
применяться реакции осаждения:
Ag+ +NО3-
+ Na+ + Cl- → ↓AgCI + Na+ + NO3-
Изменение состава ионов приводит к изменению
электропроводности раствора.
Поскольку реакции осаждения часто протекают не
мгновенно, измерение сопротивления раствора при титровании следует проводить
после достижения постоянной проводимости.
При кондуктометрическом титровании необходимо,
прежде всего, чтобы излом кондуктометрической кривой позволял устанавливать
точку эквивалентности с достаточной точностью. Чем острее угол излома, тем выше
точность. Когда угол излома очень тупой, установление точки эквивалентности
затруднено.
Для кондуктометрического определения хлорид
ионов широко применяется титрование нитратом серебра. Однако этот реагент
осаждает также Br-, I-, SCN-, СгО4
- С2О42-, тартрат, цитрат и другие
анионы. Титрование сопровождается образованием малорастворимых солей серебра.
Изменение проводимости растворов при титровании до точки эквивалентности,
зависит от сравнительной подвижности осаждаемых анионов и заменяющих их в
растворе NO3 ионов. При титровании С1 -
(λ0= 76,4), Вr
-
(λ0=78,1), I -
(λ0=78,8) и CrO42
-
(λ0= 85) проводимость
понижается, так как подвижности этих ионов выше подвижности NO3
-
(λ0=71,5). Однако при
титровании SCN - (λ0=57,4),
наоборот, происходит небольшое повышение проводимости, так как его подвижность
ниже подвижности NO3-.
В зависимости от растворимости солей серебра
изменяются концентрации титруемых растворов, при которых удается проводить
определения с достаточно высокой точностью. Так, титрование хлоридов можно
проводить и в очень разбавленных растворах при концентрации С1 -
0,025 мг/мл и меньше. Это титрование используется для определения С1-
в питьевой воде. Между тем I
-
можно титровать, в растворах, концентрация которых больше 0,005 н., а цитраты
только при концентрации не ниже 0,1 н.
Электропроводность растворов может быть найдена,
если измерить сопротивление электролитической ячейки. Для измерения
сопротивления используют переменный ток звуковой частоты, так как постоянный
вызывает разложение веществ находящихся в растворе.
Сопротивление раствора определяют путём
сравнения с эталонным сопротивлением. Для этого служит мостик Уитстона (рисунок
1.6). Сопротивления Z1,
Z2,
Z3,
Z4
можно подобрать так, чтобы ток в диагонали моста отсутствовал, т.е.
сопротивления каждой ветви были пропорциональны.
.3 Выбор метода анализа и его обоснование
Для определения основного содержания поваренной
соли нами был выбран метод аргентометрии. Несмотря на то, что многие
гравиметрические методы анализа по своей основе более точны, чем объемные
методы; тем не менее часто предпочитают применять именно объемные методы. Это
объясняется тем, что они обычно менее трудоемки и занимают меньше времени, ведь
в весовом анализе результат можно получить через несколько часов, а часто
только на второй день. А также объемные методы не требуют использование
большого количества аппаратуры. Ведь большинство аппаратуры, применяемой в
гравиметрическом анализе, да и во многих других более трудоемких анализах, чем
объемный, используют дорогостоящую, часто которую не могут себе позволить
большинство лабораторий.
Также одним из преимуществ определения титриметрическим
методом анализа является то, что определение выполняется довольно быстро, что
позволяет проводить несколько параллельных определений и получать более точное
среднее арифметическое. Тем более и сам аргентометрический метод имеет много
преимуществ перед другими объемными методами анализа. Он точен, не требует для
своего выполнения много времени. Поэтому этот метод практически применяют во
всех случаях там, где раньше использовали менее точные или требующие для своего
выполнения много времени другие методы анализа.
2 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
.1 Сущность и теоретические основы метода
анализа
Метод основан на титровании хлористого натрия в
нейтральной среде раствором азотнокислого серебра в присутствии хромовокислого
калия в качестве индикатора.
Ag+
+ NaCl →↓AgCl
+ Na+
Концентрация индикатора должна быть такой, чтобы
осадок Ag2CrO4
образовался только тогда, когда все хлорид ионы практически окажутся
оттитрованными. Так как осадок Ag2CrO4
хорошо растворим в кислотах, титрование следует вести при pH
= 7 - 10,5, то есть в нейтральной или слабо щелочной среде. В точке
эквивалентности будет образование осадка Ag2CrO4.
AgCl + CrO4
→↓Ag2CrO4
+ 2Cl-
.2 Оборудование, реактивы и материалы
• поваренная соль
• стандартный раствор азотнокислого серебра
• индикатор - 10 % раствор K2CrO4
• мерная колба - 250 мл
• пипетка - 20-25 мл
• бюкс.
2.3 Методика выполнения анализа
Точный объём раствора поваренной соли перенести
пипеткой в коническую колбу, добавить к нему 1-2 мл раствора индикатора K2CrO4
и оттитровать рабочим раствором.
При титровании раствор AgNO3
добавлять осторожно по каплям, энергично перемешивая содержимое колбы.
Титрование ведут до появления неисчезающего красного осадка Ag2CrO4.
.4 Правила техники безопасности при работе в
химической лаборатории
Работа в химической лаборатории всегда сопряжена
с определенным риском. Но при грамотной и осторожной работе этот риск сводится
к минимуму, ведь большинство пожаров, отравлений, ожогов и травм происходит
исключительно по причине пренебрежения правилами техники безопасности или
просто незнанию их.
Общие требования при работе в химической
лаборатории:
Работать одному в лаборатории категорически
запрещается, так как в ситуации несчастного случая некому будет оказать помощь
пострадавшему.
В лаборатории категорически запрещается
принимать пищу и пить воду.
Опыты нужно проводить только в чистой посуде.
Нюхать вещества можно, лишь осторожно направляя
на себя пары легким движением руки.
Запрещается выливать в раковину
концентрированные растворы кислот и щелочей.
Категорически запрещается затягивать ртом в
пипетки растворы веществ.
Работа с кислотами и щелочами
При работе с концентрированными кислотами и
щелочами нужно быть осторожным и следить за тем, чтобы они не попали на кожу
или одежду, так как это вызывает ожоги тела и порчу одежды.
При переливании кислот и щелочей нужно одеть
резиновые перчатки и защитные очки, пользоваться резиновой грушей.
При разбавлении концентрированной серной кислоты
медленно и осторожно приливать кислоту в воду, но не наоборот, так как может
произойти разбрызгивание кислоты.
Твердую щелочь из банок отбирают щипцами или
пинцетом.
Посуда для хранения щелочи и кислот должна быть
обязательно подписана водостойким маркером.
. Когда вы смешиваете сухой порошок с водой, не
вдыхайте пары, они опасны для жизни.
.5 Результаты анализа
Масса навески рассчитывается по формуле:
m(NaCl)
= = = 0,2925
Таблица 2.1 - Данные взятия навески
|
№
|
Масса
бюкса (г)
|
Масса
бюкса с навеской (г)
|
Масса
навески (г)
|
|
1
|
5,2928
|
5,5855
|
0,2927
|
|
2
|
5,4251
|
5,7181
|
0,2930
|
|
3
|
5,6402
|
5,9327
|
0,2925
|
Таблица 2.2 - Результаты аргентометрического
титрования пробы поваренной соли
|
№
|
,мл
|
|
1
|
10
|
9,80
|
|
2
|
10
|
9,90
|
|
3
|
10
|
9,85
|
По результатам титрования (таблица 2,2)
рассчитываем концентрацию NaCl:
С1э(NaCl)
= = 0,049
С2э(NaCl)
= = 0,0495
C3э(NaCl)
= = 0,0493
Рассчитаем массу основного вещества (NaCl):
m1
= = 0,2867
m2
= = 0,2896
m3
= = 0,2884
.6 Математическая обработка результатов анализа
Среднеарифметическое значение параллельных
определений:
Х= = 98,4626
Погрешность определения:
∆Хi = |Хi - Х|
∆Х1 = | 97,9501 - 98,4626 | =
0,5125
∆Х2 = | 98,8395 - 98,4626 | =
0,3769
∆Х3 = | 98,5983 - 98,4626 | =
0,1357
Среднеарифметическая абсолютная погрешность:
Чабс = = 0,3417
Среднеарифметическая относительная погрешность:
Чотн = ∙ 100%
Чотн = ∙ 100% = 0,3470 %
Среднеквадратичная абсолютная погрешность:
∆= 0,51252 = 0,2627
∆= 0,37692 = 0,1421
∆= 0,13572 = 0,0184
∑∆= 0,2627 + 0,1421 + 0,0184 =
0,4232= 0,46
Среднеквадратичная относительная погрешность:= ∙
100%= ∙ 100% = 0,4672
Точность определения:
Е = tα; f
∙
где: tα; f -
коэффициент
Стьюдентаα; f =
4,30= 4,30 ∙ = 1,14
Доверительный интервал:
Е t. f
,4626 1,14
,3226 < x < 99,6026
ВЫВОДЫ
химический хлорид натрий лаборатория
В данной курсовой работе был проведен анализ
поваренной соли на содержание основного вещества аргентометрическим методом.
Содержание NaCl составило
98,4626%, что соответствует нормам ДСТУ. Изучены физические и химические
свойства хлорида натрия. Рассмотрены существующие химические и инструментальные
методы определения хлорид ионов. В экспериментальной части изложены сущность и
теоретические основы аргентометрического метода анализа, представлена методика
выполнения определения, изучены правила техники безопасности, выполнена
математическая обработка полученных результатов анализа.
ЛИТЕРАТУРА
1.Назаров
Р.И. Химия и микробиология воды. Учебный справочник - Харьков: Консум, 2007г.
.Золотов
Ю.А. Основы аналитической химии - М., 2007 г.
3.
<http://standartgost.ru/>
.
<http://ru.wikipedia.org/>
.Крешков
А.П., Ярославцев А.А. Курс аналитической химии. Количественный анализ. - М.:
Химия, 1982.
.Васильев
В.П. Аналитическая химия. Кн. 1: Титриметрические и гравиметрические методы
анализа. - М.: Дрофа,2005.