Ультраструктурные изменения костной ткани при огнестрельных ранениях и пути их коррекции
ФГВОУ ВПО «ВОЕННО-МЕДИЦИНСКАЯ
АКАДЕМИЯ имени С.М. КИРОВА» МО РФ
На правах рукописи
УЛЬТРАСТРУКТУРНЫЕ ИЗМЕНЕНИЯ КОСТНОЙ
ТКАНИ ПРИ ОГНЕСТРЕЛЬНЫХ РАНЕНИЯХ И ПУТИ ИХ КОРРЕКЦИИ
(экспериментально-клиническое
исследование)
Диссертация на соискание ученой
степени кандидата медицинских наук
ДЕНИСОВ
Алексей Викторович
14.01.17 - хирургия
03.03.04 - клеточная биология, цитология, гистология
Научные руководители:
доктор медицинских наук профессор Самохвалов И.М.
доктор медицинских наук Гайдаш А.А.
Санкт-Петербург
СОДЕРЖАНИЕ
СПИСОК СОКРАЩЕНИЙ
ВВЕДЕНИЕ
ГЛАВА 1. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О
РАЗРУШЕНИИ И РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ ПРИ ДЕЙСТВИИ ОГНЕСТРЕЛЬНЫХ РАНЯЩИХ
СНАРЯДОВ (Обзор литературы)
.1 Огнестрельные переломы длинных
костей конечностей: статистические данные, классификация
.2 Структурная организация и
регенерация костной ткани
.2.1 Гистоструктура костной ткани
.2.2 Нанообъекты костной ткани
.3 Раневая баллистика огнестрельных
переломов
.4 Регенерация огнестрельных
переломов
.5 Современные подходы к лечению
огнестрельных переломов длинных костей конечностей
ГЛАВА 2. МАТЕРИАЛ И МЕТОДЫ
.1 Планирование исследования
.2 Общая характеристика материала
исследования
.3 Общая характеристика методов
исследования
.3.1 Общеклинические исследования
.3.2 Лабораторные исследования
.3.3 Микробиологическое исследование
.3.4 Рентгенологическое исследование
.3.5 Гистологическое исследование
.3.6 Сканирующая зондовая
электронная микроскопия
.3.7 Атомно-силовая микроскопия
.3.8 Рентген-структурный анализ
.3.9 Микротвердометрия
ГЛАВА 3. УЛЬТРАСТРУКТУРНЫЕ
ИССЛЕДОВАНИЯ МОРФОЛОГИИ ОГНЕСТРЕЛЬНЫХ ПЕРЕЛОМОВ
3.1 Методика проведения эксперимента
на биоманекенах
.2 Изучение морфологии огнестрельных
переломов методом сканирующей электронной микроскопии
.3 Изучение морфологии огнестрельных
переломов методом атомно-силовой микроскопии
.4 Изучение морфологии огнестрельных
переломов методом рентген-структурного анализа
.5 Изучение морфологии огнестрельных
переломов методом микротвердометрии
ГЛАВА 4. ВЛИЯНИЕ СТРОНЦИЯ РАНЕЛАТА
НА СТРУКТУРУ КОСТНОГО МАТРИКСА ПРИ КОНСОЛИДАЦИИ ОГНЕСТРЕЛЬНЫХ ПЕРЕЛОМОВ ДЛИННЫХ
ТРУБЧАТЫХ КОСТЕЙ КОНЕЧНОСТЕЙ
4.1 Обоснование выбора модели для
исследования влияния стронция ранелата на структуру костного матрикса при
консолидации огнестрельных переломов длинных трубчатых костей конечностей
.1.1 Обоснование применения стронция
ранелата
.1.2 Обоснование модели
огнестрельного перелома длинных трубчатых костей конечностей
.2 Методика проведения эксперимента
на биообъектах
.3 Результаты собственных
исследований
.3.1 Результаты общеклинических
исследований
.3.2 Результаты лабораторных
исследований
.3.3 Результаты микробиологического
исследования
.3.4 Результаты рентгенологического
исследования
.3.5 Результаты морфологических
исследований влияния ранелата стронция на структуру костной ткани в периоде
посттравматической регенерации
ЗАКЛЮЧЕНИЕ
ВЫВОДЫ
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
СПИСОК ЛИТЕРАТУРЫ
СПИСОК СОКРАЩЕНИЙ
|
АГВ
|
- агар Гювенталя-Ведьминой
(среда);
|
|
АЛТ
|
- аланинаминотрансфераза;
|
|
АОС
|
- антиоксидантная система;
|
|
АСМ
|
- атомно-силовая
микроскопия;
|
|
АСТ
|
- аспартатаминотрансфераза;
|
|
АЧТВ
|
- активированное частичное
тромбопластиновое время;
|
|
ВНО
|
- внеочаговый остеосинтез;
|
|
ГАП
|
- гидроксиапатит;
|
|
ДРА
|
- двухэнергетическая
абсорбциометрия;
|
|
КСТ-1
|
- комплект универсальных
стержневых аппаратов и хирургических устройств;
|
|
КФ
|
- кальциофосфаты;
|
|
ЛДГ
|
- лактатдегидрогеназа;
|
|
МПКТ
|
- минеральная плотность
костной ткани;
|
|
ОАА
|
- антиоксидазная
активность;
|
|
ООА
|
- общеоксидазная
активность;
|
|
ПВХ
|
- поливинилхлорид;
|
|
ПГ
|
- простагландины;
|
|
ПВ
|
- протромбиновое время;
|
|
ПХО
|
- первичная хирургическая
обработка;
|
|
РС
|
- ранящий снаряд;
|
|
СКС
|
- самозарядный карабин
Симонова;
|
|
СРО
|
- свободнорадикальное
окисление;
|
|
СЭМ
|
- сканирующая электронная
микроскопия;
|
|
ТВ
|
- тромбиновое время;
|
|
ЧСС
|
- частота сердечных
сокращений;
|
|
ЩФ
|
- щелочная фосфатаза.
|
ВВЕДЕНИЕ
Проблема лечения огнестрельных ранений и их
последствий была и остаётся одной из наиболее сложных и актуальных задач
военно-полевой хирургии. Со времён изобретения пороха огнестрельное оружие
постоянно совершенствуется, создаются новые виды ранящих снарядов, обладающие
всё более значительной разрушительной силой (Косачев И.Д., 2001; Озерецковский
Л.Б. с соавт., 2006; Белевитин А.Б. с соавт., 2010).
Одним из видов боевой травмы являются огнестрельные
ранения конечностей, доля которых в современных военных конфликтах составляет
62 - 72% санитарных потерь хирургического профиля. Среди них особое место
занимают огнестрельные переломы, лечение которых, несмотря на достижения
военно-полевой хирургии, является серьезной проблемой (Беркутов А.Н., 1974;
Дедушкин В.С., 1985, Самохвалов И.М. с соавт., 2006).
По характеру 76,4% огнестрельных переломов, полученных
при ранениях современными видами оружия, преимущественно носят оскольчатый
(35,1%) или раздробленный (41,3%) характер. Первичные дефекты костей выявляются
у 79,3% раненых, из них у 48,7% выявлены дефекты на протяжении более 3 см
диафиза, а у 30,6% более 5 см (Шаповалов В.М., 1999).
В общей структуре ранений конечностей преобладают
лёгкие ранения и ранения средней степени тяжести (40,5% и 33,3%
соответственно). Однако среди пострадавших с огнестрельными переломами лёгкие
ранения и ранения средней тяжести составляют менее 10%, преобладают тяжёлые
(85,4%) и крайне тяжёлые (5,5%) ранения (Ерюхин И.А., 1992).
К сожалению, и в настоящее время лечение огнестрельных
переломов костей конечностей нередко сопровождается неудовлетворительными
результатами: укорочение конечностей, ложные суставы, остеомиелит с нарушением
функции конечностей в 8 - 19,6% и ампутации - в 11,8% случаев (Шаповалов В.М.,
Ерохов А.Н., 2006; Овденко А.Г., 2010).
Все это диктует необходимость проведения исследований,
направленных на улучшение результатов лечения.
Актуальность темы.
Фундаментальные исследования, проведенные за последние годы в области
раневой баллистики и регенерации костной ткани, показали специфичность
высокоэнергетического воздействия ранящего снаряда на костную ткань с её
разрушением, как на микро-, так и на ультраструктурном уровне, а также
возможность воздействия на скорость и качество консолидации с помощью
применения принципиально новых материалов и лекарственных препаратов -
коллаген-апатитовых интерфейсов (Кавалерский Г.М. с соавт., 2010), имплантов с
наноструктурными керамическими покрытиями (Карлов А.В., Шахов В.П., 2001;
Ланцов Ю.А. с соавт., 2010), антиостеопоротических препаратов - соединений
стронция (Гайдаш А.А. с соавт., 2009). Однако характер ультраструктурных
изменений костной ткани при огнестрельных переломах остается не до конца
изученным, как и возможности воздействия на консолидацию таких переломов
антиостеопоротическими препаратами. Таким образом, тема исследования является
актуальной и клинически значимой.
Цель исследования.
На основе анализа данных, полученных с помощью современных
исследовательских нанотехнологий, изучить в эксперименте возможность применения
стронция ранелата для коррекции ультраструктурных изменений костного матрикса в
зоне «молекулярного сотрясения» при огнестрельных переломах длинных трубчатых
костей конечностей.
Задачи исследования.
. Выявить основные ультраструктурные изменения костной ткани при
воздействии высокоскоростных огнестрельных ранящих снарядов.
. Обосновать применение препарата, корригирующего выявленные изменения
тонкой структуры костного матрикса при огнестрельных переломах.
. Изучить действие стронция ранелата на ультраструктурные свойства
костного матрикса при регенерации огнестрельных диафизарных переломов длинных
трубчатых костей конечностей в эксперименте на животных.
Научная новизна исследования.
Впервые с помощью ультраструктурных методов исследования выявлены
изменения тонкой структуры костного матрикса после огнестрельных переломов и во
время их консолидации.
Охарактеризован возможный вклад ударно-волновой остеопорозоподобной
трансформации костного матрикса в течение раневого процесса при огнестрельной
травме.
Патогенетически обоснованы возможные пути коррекции остеопорозоподобных
изменений костного матрикса при огнестрельных переломах.
Практическая значимость.
Разработана модель огнестрельного перелома длинных трубчатых костей
конечностей на биообъектах (баранах), которая может быть рекомендована к
использованию при проведении экспериментальных исследований по разработке новых
методов диагностики и лечения данной боевой хирургической патологии.
Использованный в исследовании комплекс современных исследовательских
нанотехнологий позволяет выявить ультраструктурные изменения костного матрикса
после огнестрельных переломов и в процессе их консолидации, что было недоступно
ранее при использовании традиционных методов исследования.
В эксперименте доказана высокая эффективность препарата стронция в
уменьшении аморфизации гидроксиапатита и упрочнении костного матрикса в лечении
пострадавших с огнестрельными переломами, что может улучшить качество
консолидации у данной группы пострадавших.
Реализация результатов исследования.
Предложенный методологический комплекс используется для выполнения задач,
поставленных в НИР ВМедА № 03.05.01.1011/0267, шифр «Ультраструктура», а также
применяется в работе, проводимой в рамках программы «Изучение наноструктуры и
физико-химических механизмов повреждения и репарации органов и тканей при
действии поражающих факторов современных видов оружия с целью разработки
методов ранней диагностики и лечения огнестрельных ран», утверждённой
Начальником ГВМУ - НМС ВС РФ 3 февраля 2009 г.
Результаты исследования применяются в исследованиях НИЛ военной хирургии
при кафедре военно-полевой хирургии Военно-медицинской академии им. С.М. Кирова
при проведении экспериментов на животных по моделированию огнестрельных
ранений, их диагностике и лечению. Кроме того, полученные данные используются в
учебном процессе на кафедре военно-полевой хирургии при изложении материалов по
огнестрельной травме.
Апробация.
Материалы научного исследования доложены на VI Всероссийской конференции
«Фундаментальные и прикладные проблемы современной механики» (Томск, 2008);
итоговой научно-практической конференции ТВМедИ (Томск, 2009); Всероссийской
научной конференции «Современные технологии в травматологии и ортопедии»
(Санкт-Петербург, 2010).
Публикации.
Основной материал диссертационного исследования опубликован в 17-ти
работах в виде научных статей (в том числе в 3-х журналах, рецензируемых ВАК),
тезисов докладов и главы монографии.
Структура и объём диссертационного исследования.
Диссертация состоит из введения, 4-х глав, заключения, выводов и
практических рекомендаций. Работа изложена на 140 страницах машинописного
текста, содержит 6 таблиц и 60 рисунков. Список использованных литературных
источников включает 220 наименований (154 отечественных и 66 иностранных).
Положения, выносимые на защиту.
. Ультраструктурные свойства костной ткани, связанные с анатомическим
типом строения кости, влияют на характер разрушения костной ткани при
воздействии огнестрельных ранящих снарядов, что выявляется при изучении изменений
тонкой структуры костного матрикса.
. Универсальным механизмом разрушения кости на ультраструктурном уровне
при огнестрельной травме является остеопорозоподобная трансформация костного
матрикса с расширением нанопор до мезо- и микропор, а также аморфизация
кристаллов гидроксиапатита.
. Стронция ранелат в эксперименте на животных уменьшает аморфизацию
гидроксиапатита и корригирует остеопорозоподобные изменения костного матрикса в
зоне «молекулярного сотрясения», что может способствовать улучшению консолидации
при лечении раненых с огнестрельными переломами костей конечностей.
ГЛАВА 1. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О РАЗРУШЕНИИ И РЕГЕНЕРАЦИИ КОСТНОЙ
ТКАНИ ПРИ ДЕЙСТВИИ ОГНЕСТРЕЛЬНЫХ РАНЯЩИХ СНАРЯДОВ
(Обзор литературы)
1.1 Огнестрельные переломы длинных костей
конечностей: статистические данные, классификация
перелом кость регенерация
огнестрельный
Частота повреждений конечностей в общей структуре боевой хирургической
травмы во время второй мировой войны превышала 70%, а в современных войнах и
локальных конфликтах составляет более 50%. При этом более чем в трети случаев
(38%) встречались огнестрельные переломы (Шаповалов В.М., 2001; Ли А.Д.,
Баширов Р.С., 2002; Быков И.Ю., Ефименко Н.А., Гуманенко Е.К., 2009).
Характерно, что огнестрельные переломы, полученные при ранениях
современными видами оружия, носят преимущественно оскольчатый (35,1%) или
раздробленный (41,3%) характер. Первичные дефекты костей выявляются у 79,3%
раненых, из них у 48,7% выявлены дефекты на протяжении более 3см диафиза, а у
30,6% - более 5см. В общей структуре ранений конечностей преобладают лёгкие
ранения и ранения средней степени тяжести (40,5 и 33,3% соответственно). Однако
среди пострадавших данной группы лёгкие ранения и ранения средней тяжести
составляют менее 10%, преобладают тяжёлые (85,4%) и крайне тяжёлые ранения
(5,5%). При этом переломы костей в пределах одного сегмента встречались в 63,8%
случаев (переломы костей нижних конечностей - 35,7%, переломы костей верхних
конечностей - 28,1%). Переломы костей в пределах двух и более сегментов
составили 36,2%. Среди них доминировали диафизарные переломы (83%), а
метафизарные и внутрисуставные переломы встречались лишь у 17% раненых (Брюсов
П.Г., 1996; Шаповалов В.М., 2001; Быков И.Ю., Ефименко Н.А., Гуманенко Е.К.,
2009) (табл. 1).
Таблица 1 Структура огнестрельных переломов длинных трубчатых костей
конечностей (по данным вооружённых конфликтов на Северном Кавказе в период с
1994 по 2002 годы).
|
Локализация перелома
|
%
|
|
Плечевая кость
|
14,3
|
|
Кости предплечья
|
13,8
|
|
Бедренная кость
|
16,2
|
|
Кости голени
|
19,5
|
|
Итого (переломы костей
одного сегмента конечности)
|
63,8
|
|
Переломы костей двух и
более сегментов конечностей
|
36,2
|
|
Всего:
|
100,0
|
Огнестрельные переломы делятся на две основные группы: неполные
(дырчатые, краевые) - 7,3% и полные, которые разделяют ещё на две подгруппы:
простые (поперечные, косые) - 16,3% и оскольчатые (многооскольчатые,
раздробленные) - 76,4%.
Особенностью огнестрельных переломов трубчатых костей является их
оскольчатый характер, обширное поражение костного мозга, наличие свободных
костных фрагментов, а также частое развитие осложнений, что сопровождается
неудовлетворительными исходами лечения, такими как укорочение конечностей,
ложные суставы в 8,0-19,6% и ампутациями в 11,8% случаев (Шаповалов В.М., 2001;
Овденко А.Г., 2010).
1.2 Структурная организация и регенерация
костной ткани
1.2.1 Гистоструктура костной ткани
Согласно современным представлениям, костная ткань представляет собой
минерально-органический композит с развитой пористой структурой, подвергающийся
постоянному процессу ремоделирования под действием клеток остеобластического
дифферона (Афанасьев Ю.И., Юрина Н.А., 1999; Данилов Р.К., 2006, 2007).
По мнению ряда авторов (Денисов-Никольский И.Ю. с соавт., 2002; Аврунин
А.С. с соавт., 2010) в скелете млекопитающих необходимо различать следующие
уровни или элементы его иерархической организации:
. Молекулярный - органические молекулы.
.Надмолекулярный - надмолекулярные комплексы органических молекул и
минералов в перицеллюлярном пространстве.
. Тканевой - ретикулофиброзные и пластинчатые структуры.
. Структурно-функциональный - остеоны и трабекулы (полуостеоны).
. Органообразующих структур - компактное и губчатое вещество.
. Органный - кость как орган.
. Суперорганный - скелет.
Только при полном понимании всех процессов, происходящих на каждом
вышеизложенном уровне возможно формирование адекватных представлений о
механизмах как нормального функционирования, так разрушения и репарации костной
ткани. Однако следует признать, что функционирование костной ткани, особенно на
первых четырёх уровнях организации остаётся ещё малоизученным процессом.
Костная ткань примерно на 50% состоит из органического компонента,
представленного в основном коллагеновыми волокнами, и на 47% - из
неорганического матрикса, образованного, в основном, кальций-фосфатными
соединениями (КФ) типа гидроксиапатита (ГАП), и другими микроэлементами (Mg,
Sr, Sn, Со, Cr, Fe, Сu и др.). Она находится в динамическом равновесии за счет
протекания единовременных процессов образования и резорбции (Мажуга П.М., 1978;
Грант В., 1991; Кораго А.А., 1992; Чайкина М.В., 2002).
В настоящее время принято выделять два основных типа костной ткани:
компактную и губчатую.
Губчатая кость, менее твердая, входит в состав большинства плоских
костей, эктопических очагов костеобразования и костной мозоли на ранней стадии
ее развития. Она состоит из сети трабекул (спикул), образующих большие
костномозговые пространства, содержащие гемопоэтические клетки и жир. Трабекулы
содержат остеоциты, окруженные монослоем остеобластов.
Компактная (плотная, ламеллярная) кость не содержит трабекул и образует
диафизы всех трубчатых костей. Здесь имеется круговое расположение «гаверсовых»
систем (Образцов И.Ф., Ханин М.Ф., 1989; Улумбеков Э.Г., Челышев Ю.А., 1997;
Афанасьев Ю.И., Юрина Н.А., 1999).
Костная ткань состоит из клеточных элементов, представленных
остеобластами, остеокластами и остеоцитами, и экстрацеллюлярного матрикса,
который содержит органические и неорганические (минеральные) вещества и воду.
Костные клетки функционируют в среде, получившей название «костный матрикс». По
своему качественному составу «костный матрикс» является видом соединительной
ткани с выраженной минеральной составляющей (Хэм А., Кормак Д.,1983; Быков
В.Л., 2000).
Ключевую роль в процессе минерализации костного матрикса играют
«матриксные пузырьки» остеобластов, имеющие диаметр от 30 до 1000 нм и стенку,
идентичную наружной мембране. Первоначально именно в них образуется аморфный Са3(РО4)2,
а затем - гидроксиапатит (ГАП). Вышедшие в экстрацеллюлярное пространство матриксные
пузырьки вступают во взаимодействие с протеогликанами, остеонектином и
коллагеном, встраиваясь в их структуру (Кораго А.А, 1992; Anderson Y.C., 1976).
Остеобласты секретируют и наслаивают новый костный матрикс, располагаясь
на поверхности уже существующего материала. Часть из них постепенно погружается
в него, постепенно дифференцируясь в остеоциты. Остеобласты формируют новую
костную ткань в виде концентрических слоев, в центре которых располагается
кровеносный сосуд, образуя систему размером около 80-200 мкм, называемую
остеоном (Фриденштейн А.Я., Лалыкина К.С., 1973; Хэм А., Кормак Д., 1983;
Афанасьев Ю.И., Юрина Н.А., 1999).
Остеоциты находятся в замкнутых лакунах костного матрикса и не
пролиферируют, но частично сохраняют способность продуцировать коллаген и
протеогликаны. Между собой они соединены узкими каналами, через которые
регулируются процессы минерализации костной ткани и скорость остеогенеза.
Остеоциты играют большую роль в кругообороте костной ткани и кальция. Через
массивные клеточно-матричные контакты они принимают активное участие в обмене
ионов, а также выступают в роли механических биосенсоров, реагирующих на
изменение нагрузки на костную ткань (Аврунин А.С. с соавт., 2010; Van der Plas
A., Aarden E.M. et al., 1994).
В противоположность остеобластам и остеоцитам, которые образуют костный
матрикс, остеокласты разрушают его с помощью специализированного мембранного
комплекса (гофрированной каемки), посредством секреции кислот, растворяющих
кристаллы гидроксиапатита, и различных ферментов типа коллагеназы и эластазы
(Учитель И.Я. 1978; Kurihara N. et al.,1990; Girasole G. et al., 1992). Обычно
остеокласты группируются и прокладывают глубокие туннели со скоростью около 50
мкм в сутки. Вслед за ними устремляются остеобласты, которые выстилают стенки
каналов, а в сам канал прорастают сосуды и нервные окончания, через которые
происходит доставка питательных веществ и кислорода к ткани. Остеокласты
являются очень мобильными клетками, которые мигрируют и легко присоединяются к
гидроксиапатиту с помощью молекул адгезии - интегринов (Маянский А.Н., 1991;
Альбертс Б. с соавт., 1994; Marcus R. 1987; Nesbitt S.A. et al., 1993; Key L.L.
et al., 1994; Wada S. et al., 1995).
Экстрацеллюлярный матрикс на 60% состоит из минеральных веществ
(доминирует гидроксиапатит), на 30% - из органических субстанций (коллагеновые
волокна - до 90-95%, протеогликаны, гликозаминогликаны, фибронектин,
остеонектин и др.), и на 10% - из воды, находящейся в связанном и свободном
состоянии. Внеклеточный матрикс костной ткани является результатом продукции
остеобластов и остеокластов, на 95% состоит из коллагена преимущественно 1-го
типа и неколлагеновых протеинов (5%), которые образуют единую
структурно-функциональную систему. Различают минеральную (неорганическую) и
неминеральную (органическую) составляющие внеклеточного вещества костной ткани
(Альбертс С. с соавт., 1994; Улумбеков Э.Г., Челышев Ю.А., 1997).
Около 85% воды содержится в органической матрице вокруг волокон коллагена
и основного вещества и в гидратной оболочке, окружающей кристаллы ГАП. Другие
15% находятся в каналах и полостях, по которым питательные вещества
доставляются тканям кости. Вода придает упругие свойства костной ткани. В
компактной кости содержится около 10% воды, а в губчатой - около 5-15% (Ньюман
У. с соавт., 1961; Омельянченко Н.П. с соавт., 1997).
Основными химическими элементами неорганической части кости являются
кальций и фосфор, составляющие 35 и 50%, соответственно. Именно они придают
кости присущую ей плотность. Необходимо отметить, что в организме человека
кость служит и резервуаром основных минералов, в частности кальция (98%),
фосфора (85%), магния (50%) и натрия (45%). Остальные 15% приходятся на
бикарбонаты, цитраты, фториды, различные соли и микроэлементы (Гайер Г., 1974;
Кораго А.А., 1992; Омельянченко Н.П. с соавт., 1997).
Кальций-фосфаты (КФ) в тканях и органах человека представлены аморфными
фосфатами кальция, брушитами, монетитами, витлокитами, дигидратом пирофосфата
кальция и гидроксиапатитом. Биологические апатиты не являются чистым
гидроксиапатитом, а, как правило, являются карбонатзамещенными апатитами с
дефицитом кальция. Гидроксиапатит является главным неорганическим компонентом
костей, эмали зубов и дентина. Около 50-60% от массы всей костной ткани
приходится на минеральное вещество, преимущественно состоящее из кристаллов и
(в меньшей степени) коллоидных растворов ГАП.
Нерастворимые фосфаты кальция присутствуют в кости в виде стабильных и
лабильных (аморфных) фосфатов. Последние покрывают поверхность ГАП. Процессы
рекристаллизации и кристаллизации происходят как за счет поглощения костными
клетками КФ, а затем встраиванием их в структуру новообразованных кристаллов
ГАП, что происходит примерно за 35 часов, так и за счёт прямого быстрого
встраивания части экзогенного кальция в структуру кальциофосфатов кости
(Carneiro J., Leblond С. et al., 1959).
Процесс образования ГАП происходит по типу селективной эндогенной
кристаллизации в насыщенных растворах. Известно, что часть ГАП способна
продолжать свой рост в костной ткани и после их высвобождения из везикул
остеобластов, путем адсорбции на своей поверхности кальция и фосфора из
окружающих его жидкостей (Ткаченко С.С, Руцкий В.В., 1989).
Кристаллы гидроксиапатита имеют преимущественно гексагональную форму,
построенную из колонок Са2+ и атомов О, принадлежащих фосфатным
группам, которые образуют стенки каналов, идущих параллельно гексагональным
осям (Корбридж Д., 1982). В костной ткани средние размеры элементарной ячейки
составляют около 20x5x1,5 нм, а длинная ось ее ориентирована параллельно осям
коллагеновых фибрилл. Кристаллы сгруппированы в виде стержней (диаметром около
5 нм, длина - 200 нм) и соединяются с коллагеном через остеонектин (Касавина
Б.С, Торбенко В.П., 1975).
По современным представлениям, минерализация костного матрикса происходит
за счет первоначального образования аморфного кальциофосфатного соединения с
последующей его кристаллизацией в гидроксиапатит внутри коллагеновых волокон,
когда отпочковавшиеся в экстрацеллюлярное пространство кристаллы ГАП,
продолжают увеличиваться в размерах за счет адсорбции на себе кальциофосфатов
из окружающего их лабильного слоя и из тканевой жидкости. Таким образом, синтез
коллаген-апатитового комплекса начинается в остеобластах, а окончательный этап
его формирования происходит уже в экстрацеллюлярном матриксе. Поэтому влияние
на формирующиеся кристаллы гидроксиапатита можно оказывать как на
внутриклеточном уровне, так и путём введения определённых веществ
непосредственно в окружающую их тканевую жидкость (Гайер Г., 1974; Корбридж Д.,
1982; Улумбеков Э.Г., Челышев Ю.А., 1997).
В костной ткани кристаллы ГАП, как правило, полиморфны и могут иметь
игольчатую или пластинчатую структуру различной толщины, ширины и длины.
Существует зависимость между структурой кристаллов ГАП и возрастом, обменом минералов,
физической нагрузкой, состоянием коллагеновой матрицы и рядом других факторов
(Омельянченко Н.П. с соавт., 1997; Денисов-Никольский Ю.И. с соавт, 2002;
Аврунин А.С. с соавт., 2010).
Считается, что центры кристаллизации гидроксиапатита образуются в
участках поперечных полос коллагена через молекулы остеонектина, который имеет
высокое сродство к коллагену 1 типа и ГАП. В этом процессе активную роль играют
различные ионы (Mn, Sr, Сu, Va, F, Pb, Со, Al, Sn и др.), остеокальцин,
полипептидные факторы, витамины и клетки остеона. Однако фундаментальные
причины столь строгой локальной избирательности до конца не ясны (Скоблин А.П.,
Белоус A.M., 1968; Кораго А.А., 1992).
Вместе с коллагеном кристаллы гидроксиапатита формируют сложную прочную
архитектуру костной ткани, обладающей огромной активной поверхностью,
составляющей около 130-270 м2 на 1 г матрикса, площадь которой у
взрослого человека может достигать 2000 км2. Микроэлементы выступают
в роли катализаторов или активаторов ферментов, гормонов, витаминов с других
биоактивных молекул. В костной ткани обнаружено свыше 30 микроэлементов. Так,
магний и цинк являются активаторами щелочной фосфатазы. Избыток бериллия,
алюминия, марганца и стронция приводит к развитию рахитоподобных состояний.
Стронций конкурирует с кальцием за место в кристаллах ГАП. В губчатой кости
стронция в 3 раза больше, чем в компактной. Магний, барий и кобальт могут
встраиваться в структуру ГАП, изменяя его физико-химические и биологические
свойства. Из этого можно заключить, что изменяя микроэлементный состав костной
ткани, можно целенаправленно воздействовать на ее состояние (Касавина Б.С,
Торбенко В.П., 1979; Корбридж Д., 1982).
Органическая часть костного матрикса состоит из коллагена (98%) и
неколлагеновых белков (2%). Однако именно коллаген является основным
строительным белком костной ткани, определяющим ее конструкцию, прочность,
упругость, жесткость, устойчивость к нагрузкам и деформациям. Коллаген -
сложный белок, состоящий из трех про-α-цепей. Длина спиралей около 300 нм,
диаметр 1,5 нм. В настоящее время известно около 17 видов коллагенов, среди
которых в костной ткани наиболее распространены I (около 90-95%) и V (около 5%)
(Афанасьев Ю.И., Юрина Н.А., 1999; Данилов Р.К., 2006).
Тип I образует видимые фибриллы с периодичностью 67 нм. Волокна
синтезируются остеобластами, фибробластами, гладкомышечными клетками,
эпителием. Длительность секреции коллагена в остеобластах от момента начала
сборки молекулы до включения его в структуру костного матрикса составляет около
35 часов. Молекулы проколлагена накапливаются в везикулах остеобластов и
секретируются во внеклеточное пространство в виде тропоколлагена, молекулы
которого при сборке фибрилл выстраивают параллельно расположенные цепи
последовательно конец в конец и сторона к стороне таким образом, чтобы между
головными и концевыми участками оставалась щель диаметром около 35 нм. Каждая
молекула в цепи смещена относительно молекулы в соседней цепи на четверть ее
длины, что морфологически определяется в виде поперечной исчерченности волокон.
Этим достигается конструктивная прочность, упругость и эластичность соединения.
Коллагеновая сеть, состоящая из многочисленных волокон, погружена в
макромолекулярные агрегаты протеогликанов и тесно взаимодействует с
межклеточным матриксом и кристаллическими молекулами гидроксиапатита, образуя
прочную биомеханическую систему (Carneiro J., Leblond С. et al., 1959).
Необходимо отметить, что коллагеновые волокна в костной ткани имеют
строго определенную ориентацию. В компактной части трубчатых костей коллагеновые
волокна входят в состав концентрических костных пластинок остеона, вставочных
пластин и костных трабекул. Как правило, в составе остеона коллагеновые волокна
располагаются в виде концентрических слоев, расположенных под определенным
углом друг к другу, что обеспечивает биомеханическую устойчивость системы (Хэм
А., Кормак Д., 1983; Данилов Р.К., 2006; Аврунин с соавт., 2010).
Морфофункциональной единицей костной ткани является остеон (Гаверсова
система). Гаверсова система во взрослой кости постоянно обновляется. Считается,
что для формирования остеона и его минерализации в нормальных условиях
необходимо не менее 130 дней, однако этот срок может значительно варьировать
при старении, различных патологических состояниях, ведущих к нарушению
нормального функционирования костной ткани (Демпстер Д.В., 2000). Процессы
минерализации остеонов протекают параллельно процессам их деминерализации, что
имеет важный биологический смысл (Belanger L.F., 1969). При этом всегда можно
выделить несколько типов остеонов - зрелые (50-75%), развивающиеся (5-10%),
дегенерирующие (10-20%), реконструирующиеся (5-10%) и нежизнеспособные (5-10%).
Считается, что границы Гаверсовой системы, ограниченные линией цементации, у
молодых, развивающихся и реконструирующихся, остеонов составляют 80-150 мкм, у
зрелых - 120-300, а у инволюционирующих, дегенерирующих - менее 200 мкм. Эти
данные необходимо учитывать при изучении тонкой структуры кости (Хэм А., Кормак
Д., 1983; Гюнтер В.Э., с соавт., 1998; Barbos M.P. et al., 1983).
Таким образом, костная ткань является сложноорганизованной и постоянно
обновляющейся системой организма, состоящей из клеточных элементов, окруженных
костным матриксом, что необходимо учитывать для проведения исследований, так
как только изучение всех её элементов в совокупности позволит в полной мере
выявить закономерности её регенерации в норме и патологии.
1.2.2 Нанообъекты костной ткани
Исходя из стандартизированного определения, под нанообъектом понимается
объект, содержащий структурные элементы, геометрические размеры которых, хотя
бы в одном измерении, не превышают 100 нм, и, благодаря этому, обладающий
качественно новыми свойствами, в том числе заданными функциональными и
потребительскими характеристиками (Реестр ИСО НТК № 229 по нанотехнологиям).
Фундаментальной причиной выделения объектов в нанометровом диапазоне
являются их особые размерные эффекты, среди которых наиболее важное
методологическое значение имеют структурные и термодинамические изменения,
фазовые изменения и квантовые ограничения (Глушко В.П. с соавт., 1978).
Изменение структурных свойств обусловлено тем, что при размерах меньше 10
нм изменяется межатомное расстояние в структурах и проявляется зависимость
структурных параметров от него, а в некоторых случаях происходит и кардинальная
перестройка наноструктуры частицы (Dubreuil N., et al., 1995).
Изменения термодинамических свойств обусловлены тем, что характерный
размер наноструктуры играет роль дополнительного термодинамического фактора.
Рост теплоемкости при уменьшении размера наночастиц приводит к снижению
температуры плавления, при этом в диапазоне 1-10 нм в нанокристаллах
стабилизируются высокотемпературные фазы, при этом может возникнуть и
аморфизация поверхности. Эффект квантового ограничения особенно значим в
ультратонких каналах, где влияние «стенок» на молекулы является столь сильным,
что в их поведении появляется бимодальность. В итоге, вещества в ультратонких
каналах, могут обладать и свойствами жидкостей (разупорядоченностью и
подвижностью) и твердых фаз (анизотропией) (Габуда С.П. с соавт., 2005; Fritz
M. et al., 1991; Chernoff E.A. et al., 1992; Gathercole L. et al., 1993).
С учетом вышеназванных стандартизированных критериев, был составлен
перечень структур, классифицируемых как нанообъекты костной ткани (Гайдаш А.А.
с соавт., 2008).
Учитывая размерный критерий, к плотным 1-мерным нанообъектам отнесены
коллагеновые волокна 1 типа и кристаллизующиеся ортофосфаты.
К плотным 3-мерным нанообъектам - отнесены моно- и триклинные кристаллы
гидроксиапатита.
К гетероморфным 1-мерным нанообъектам причислены протяженные нитчатые
структуры внутреннего скелета клеток.
К гетероморфным 2-мерным нанообъектам - поверхностные структуры в
интерфейсах «вода-апатит», «вода-коллаген» и «вода-апатит-коллаген».
К гетероморфным 3-мерным нанообъектам - сетевые коллагены базальных
мембран и ажурные конструкции решеток Десцемета.
К разряженным 1-мерным нанообъектам - продольные нанокапилляры и
поперечные наноцистерны, формирующиеся в щелях между нитями тропоколлагенов,
нанощели и наноканальцы костного матрикса.
К разряженным 3-мерным нанообъектам - гидроклатраты Д-периодичности
фибриллярных коллагенов кости.
Мы считаем, что изучение указанных структур позволит не только углубить
понимание механизмов разрушения кости, но и будет способствовать созданию новых
технологий, оптимизирующих регенерацию кости при лечении огнестрельных
переломов.
1.3 Раневая баллистика огнестрельных переломов
Раневая баллистика - это научное направление, в задачи которого входит
исследование поведения PC в теле, его повреждающего действия на ткани, динамики
и механизма формирования огнестрельной раны с её специфическими особенностями.
По современным представлениям, поражающие свойства PC зависят, с одной
стороны, от его свойств: скорости полёта, массы, площади поперечного сечения,
степени устойчивости при попадании в ткани, склонности к деформации и
фрагментации, величины кинетической энергии в момент ранения, а с другой - от
структуры и физических свойств повреждаемых им тканей, их плотности, упругости,
эластичности и содержания воды. Однако результирующим при этом является
количество кинетической энергии PC, передаваемой тканям (потеря энергии)
(Шерешевский М.С., 1985; Озерецковский Л.Б., 1989, 2006; Callender, G.R.,1935;
Coates, J.B., 1962).
Необходимо подчеркнуть, что при ранениях конечностей с повреждением
трубчатых костей возрастает вероятность и частота фрагментации и деформации
пуль, что существенно увеличивает степень передачи кинетической энергии тканям,
а значит и их разрушение (Дыскин Е.А., Озерецковский Л.Б. с соавт., 1992;
Озерецковский Л.Б., Гуманенко Е.К., Бояринцев В.В., 2006; Callender G.R.,
1943).
Следовательно, повреждения, наносимые ранящим снарядом кости, будут
больше, чем мягким тканям, так как кость имеет большую плотность и более
эффективно тормозит пулю и, соответственно получает от неё больше энергии, чем
менее компактное вещество (Иванов Г.С., 1891; Ткаченко С. С., 1981; Шаповалов
В.М., 1989, 2004; Harvey E.N., 1945, Adams D.B., 1982). Кроме того, губчатая
кость эпифизов длинных костей, будет повреждаться меньше, чем более компактная
кортикальная кость диафизов, потому что кинетическая энергия может легче
рассеиваться в ячеистых структурах губчатой кости. Это объясняет формирование
дырчатых переломов метафизов и оскольчатых - диафизов (Быстров В.Ф., 1894;
Белоусов А.Е., 1976; Belkin M., 1978).
Немаловажным является факт того, при передаче кинетической энергии тканям
в зоне формирующегося огнестрельного канала начинают действовать специфические
ударно-волновые процессы, в виде волн деформации («ударных» волн),
распространяющихся впереди движущейся пули со скоростью звука. В тканях ударная
волна начинается с фазы положительного давления, характеризующейся высоким
положительным давлением (более 1000 кПа) и малой продолжительностью (порядка
0,05-0,5 мс), которая переходит в короткую, незначительную по величине, фазу
отрицательного давления. Ударная волна по времени соответствует времени
прохождения РС через ткани и регистрируется на больших расстояниях от места
ранения. Вслед за ударной регистрируются значительно меньшие по величине
(десятки кПа), но имеющие большую продолжительность (до 30-40 мс)
низкочастотные волны, называемые волнами сжатия или сдвига.
А.Н. Максименков при действии высокоскоростного ранящего снаряда на кость
выделил 2 фазы. Первая - фаза взаимодействия пули с костью, продолжительностью
30-70 мкс. Вторая - фаза колебания костного вещества, которое наблюдается в
течение 8х104 мкс, т.е. почти в 260 раз превышает время прохождения
пули через кость (Максименков А.Н., 1958).
Примечательно, что на удалении от раневого канала основной вклад в
повреждение тканей и в формирование огнестрельной раны вносят именно длительно
существующие волны сжатия, а не кратковременно действующая ударная волна.
Однако описанные выше механизмы ударно-волнового разрушения костной ткани
при воздействии огнестрельного ранящего снаряда изучены недостаточно и требуют
проведения дальнейших исследований с привлечением специалистов различных
областей науки (Смольянников А.В., 1952; Петров В.П., 1958; Максименков А.Н.,
Дыскин Е.А. с соавт., 1960; Озерецковский Л.Б. с соавт., 2006; Callender G.,
1935; Harvey E.N., 1945).
Механизм образования огнестрельной костно-мышечной раны.
Огнестрельная рана образуется в результате сложного воздействия на ткани
факторов. В настоящее время в образовании огнестрельной раны основную роль
отдают следующим четырём факторам огнестрельного ранящего снаряда (Гирголав
С.С., 1955; Беркутов А.Н., Дыскин Е.А., 1979; Косачев И.Д., 1982; Озерецковский
Л.Б. с соавт., 2006):
. Воздействие ударно-волновых процессов, которые мгновенно возникают при
соприкосновении пули с поверхностью поражаемых тканей в месте контакта из-за
инерционности тканевой массы.
. Воздействие ранящего снаряда. Основной баллистической характеристикой
ранящих снарядов является их начальная скорость.
. Воздействие энергии бокового удара (основной и специфический механизм
для огнестрельной раны). Кинетическая энергия, переданная тканям ранящим
снарядом, приводит к смещению частичек среды в прямом и радиальных направлениях
от раневого канала, образуя в тканях временную пульсирующую полость.
. Воздействие вихревого следа (турбулентного потока частиц тканей),
возникающего позади ранящего снаряда.
Всё это приводит к формированию собственно раневого канала, а также зоны
повреждения клеточных структур вокруг него, размеры которых значительно
превышают калибр пули (Максименков А.Н., 1958, 1960; Огарков И.Ф., 1958;
Жирновой В.М., 1989; Ревской А.К. с соавт., 2007).
В соответствии с морфофункциональными изменениями в пределах раневого
канала принято выделять три зоны огнестрельной раны, впервые описанные М.
Борстом, что играет немаловажную роль в определении лечебной тактики (Borst
M.,1921):
. Зона раневого дефекта. Она представляет собой неправильной формы
извилистую щель, заполненную раневым детритом, кровяными сгустками, инородными
телами, костными осколками и образуется в результате прямого действия ранящего
снаряда. По этой зоне определяют направление выполнения первичной хирургической
обработки, а её содержимое подлежит тщательному удалению.
. Зона первичного некроза. Представляет собой зону полностью утративших
жизнеспособность тканей, прилежащую к зоне раневого дефекта и возникающую в
результате действия всех факторов образования огнестрельной раны. Погибшие
ткани должны быть полностью иссечены и удалены во время первичной хирургической
обработки. Костные осколки, потерявшие связь с надкостницей и мягкими тканями,
также считаются нежизнеспособными и должны быть удалены.
. Зона вторичного некроза («молекулярного сотрясения»). Основоположник
отечественной военно-полевой хирургии Н.И. Пирогов, анализируя огромный личный
опыт лечения раненных с огнестрельными переломами, в своём фундаментальном
труде «Начала общей военно-полевой хирургии» в 1848 году отметил: «Что особливо
отличает в моих глазах действие огнестрельного снаряда на ткани, это есть
именно молекулярное сотрясение, которое он им сообщает; его границы и степень
мы никогда не в состоянии определить точно» (Пирогов Н.И., 1941).
Об этой зоне до сих пор существуют противоречивые мнения, так как она не
имеет чёткого морфологического субстрата и формируется в результате действия
энергии бокового удара PC и образования временной пульсирующей полости.
Образование в ней очагов вторичного некроза носит мозаичный характер, что
определяется различной резистентностью тканей, выраженностью развития
некробиоза и нарушений макро - и микроциркуляции в области ранения, а также
адекватностью и своевременностью лечебных мероприятий (Косачев И.Д., 1982;
Жирновой В.М., 1989; Ерюхин И.А., 1992; Шапошников Ю.Г., 1995; Озерецковский
Л.Б., 2006; Ревской А.К. с соавт., 2007).
Таким образом, в настоящее время нет чёткого представления о механогенезе
огнестрельного перелома. В особенности это касается характеристики
ультраструктурных изменений костной ткани, происходящих в зоне «молекулярного
сотрясения», что не позволяет в полной мере оценить вклад этого феномена в
патогенез огнестрельного перелома. Лишь совместными усилиями специалистов
различных областей науки с применением современных исследовательских технологии
можно продвинуться вперёд в понимании этого процесса.
1.4 Регенерация огнестрельных переломов
Репаративная регенерация костной ткани - это сложный динамический процесс
истинной реституции кости, вызванный разрушением костных структур,
количественно превосходящий допустимые пределы физиологической регенерации. В
этом процессе принципиально можно выделить три основные стадии - повреждение,
восстановление и ремоделирование кости.
Стадия повреждения сопровождается развитием острых циркуляторных
расстройств, ишемией и некрозом ткани, воспалением. Происходит дезорганизация
структурно-функциональных и биомеханических свойств кости. В стадию
восстановления идут процессы внутримембранного и (или) энхондрального
окостенения. Для благоприятного течения данной стадии необходимо выполнение
ряда принципов, таких как точное сопоставление (аксиальное выравнивание)
отломков, стабильная фиксация и реваскуляризации некротических фрагментов
(Омельянченко Н.П. с соавт., 1997; Chao E.Y.S., Aro H.T. 1991).
Стадия ремоделирования кости начинается с формирования между отломками
костных мостиков. В этот период происходит перестройка костной мозоли, которая
сначала представлена в виде веретенообразной массы губчатой кости вокруг
костных фрагментов, некротические участки которых в большей массе уже
утилизированы. Постепенно костная мозоль трансформируется в губчатую кость
(Лаврищева Г.И., Оноприенко Г.А., 1996; Гололобов В.Г., 1997; Данилов Р.К.,
2007; Black J. et al., 1984; Aro H.T. et al., 1993).
Считается, что скорость регенерации костной ткани в норме является постоянной
величиной, которую до настоящего времени не удалось ускорить (Виноградова Т.П.,
Лаврищева Г.И., 1974; Мюллер М.Е. с соавт., 1996). А такие факторы, как
нестабильность костных отломков, нарушение оксигенации, развитие воспаления и
другие неблагоприятные факторы только замедляют процессы пролиферации и
дифференцировки остеогенных клеток относительно нормы (Илизаров Г.А., 1983,
1986; Фриденштейн А.Я., с соавт., 1999; Шевцов В.И., 2000; Chao E.Y.S., Aro
H.T., 1991). Однако существует целый ряд исследований по ускорению
остеорепарации переломов с помощью различных физических и биологических
факторов (Богданович У.Я., 1976; Жирновой В.М., 1989; Грачев И.Р., 1992; Деев
Р.В., 2006).
Сращение огнестрельных переломов длинных костей протекает, как правило,
по вторичному типу - с образованием преимущественно периостальной мозоли и в
течении остеорепарации огнестрельных переломов, ввиду высокоэнергетического
воздействия факторов ранящего снаряда на структуру кости, имеется определённая
специфика (Григорьев В.В. с соавт., 1983; Гололобов В.Г., 1995; Баширов Р.С.,
1997).
Особенности репаративной регенерации костной ткани после огнестрельных
переломов заключаются в массивности повреждения с гибелью большого числа
костных клеток, выраженности воспалительных и дегенеративных процессов с
развитием явлений остеопороза, особенно выраженные в дистальном отломке. Авторы
отмечают, что часть оставленных в ране костных осколков, преимущественно самые
мелкие, претерпевают явления некроза, деструкции и лизиса. Большинство же крупных
осколков сохраняет свою жизнеспособность и в них отмечаются признаки
новообразования костной ткани. Также обращает на себя внимание преобладание в
гистоструктуре регенерата соединительно-тканной компоненты, а также замедление
формирования костной ткани по сравнению с регенерацией обычного перелома - лишь
к 45-м суткам начинают обнаруживаться очаги формирования первичных остеонов,
лишенных упорядоченного строения и ориентации. К 90-м суткам отмечается наличие
небольшого по объёму периостального регенерата, преобладание между осколками
гиалиновой и волокнистой хрящевой, а также плотной волокнистой соединительной
ткани.
В регенерате даже на 120-е сутки преобладает плотная волокнистая
соединительная ткань с наличием зон имеющих высокую степень упорядоченности
расположения коллагеновых волокон, а также с наличием участков волокнистого
хряща. В ретикулофиброзной ткани отмечается наличие неактивных остеобластов и
остеоцитов, а также, напротив, активных остеокластов, что свидетельствует о
продолжающихся процессах резорбции и ремоделирования.
Таким образом, в результате исследований, проведённых учёными
Военно-медицинской академии им. С.М. Кирова и Томского военно-медицинского
института было выявлено, что костные осколки в месте огнестрельного перелома
выполняют роль не только аутотрансплантата, помогающего заполнить дефект кости,
но и являются носителями сохранивших свою жизнеспособность камбиальных
элементов, играющих положительную роль в процессе консолидации перелома.
Обнаруженные данные позволили обосновать рекомендации по щадящей хирургической
обработке огнестрельной костной раны при оказании медицинской помощи раненым на
этапах медицинской эвакуации (Дедушкин В.С., Артемьев А.А., 1991, Гололобов
В.Г., 1997; Ли А.Д., Баширов Р.С., 2002; Данилов Р.К., 2008).
Тем не менее, следует подчеркнуть, что используемые в настоящее время
гистологические методы исследования кости в области огнестрельного перелома и
его регенерации требуют выполнения довольно разрушительных методов
пробоподготовки, предполагающих практически полное удаление из образцов
минеральной фазы костного матрикса (Ремейс Б., 1953; Меркулов Г.А., 1961;
Волкова О.В., Елецкий Ю.К., 1982; Карпов Ю.А., 2003; Кларк Э.Р. с соавт.,
2007). Это не может не сказываться на полноте получаемой информации, так как в данном
случае практически не учитывается состояние минерального компонента, а значит и
изменение взаимоотношения коллаген-апатитового интерфейса в целом. По мнению
многих авторов, в решении данной проблемы может помочь более широкое
использование исследовательских методик, требующих выполнения лишь минимально
разрушающей, щадящей пробоподготовки. В частности, к ряду таких методов можно
отнести различные виды сканирующей зондовой электронной микроскопии (Елецкий
Ю.К., 1982; Миронов В.Л., 2004; Гоулдстейн Дж. с соавт., 2005; Габуда С.П.,
Гайдаш А.А. с соавт., 2005, 2008).
1.5 Современные подходы к лечению огнестрельных
переломов длинных костей конечностей
По современным представлениям лечение огнестрельных переломов длинных
костей конечностей должно состоять из первичной хирургической обработки (ПХО),
с определением её объёма по показаниям и лечебной иммобилизации. (Шапошников
Ю.Г., 1986; Дулаев А.К., 1991; Шаповалов В.М., 2004; Быков И.Ю., Ефименко Н.А.,
Гуманенко Е.К., 2008).
Первичная хирургическая обработка огнестрельной костно-мышечной раны
конечности в «классическом» понимании состоит из достаточно широкого рассечения
входного и выходного отверстий, удаления содержимого раневого канала и явно
нежизнеспособных тканей (с обязательным удалением всех, не связанных с мягкими
тканями, костных осколков), а также тканей с сомнительной жизнеспособностью из
зоны вторичного некроза, достижения гемостаза. Операцию заканчивают полноценным
дренированием, большеобъёмной околораневой противовоспалительной блокадой по
И.И. Дерябину - А.С. Рожкову, адекватной иммобилизацией конечности
(преимущественно внешним остеосинтезом). В дальнейшем проводится
антибактериальная, противовоспалительная, анальгетическая терапия, физиотерапия
и местное лечение (Жирновой В.М., 1989; Ткаченко С.С.,1991; Ерюхин И.А., 1992;
Вовченко В.И., 1994; Рожков А.С., 1995).
Однако выполнение всех этапов ПХО не всегда является необходимым,
особенно ввиду того, что никогда нельзя чётко определить весь объём повреждении
тканей и выполнить адекватное их удаление. Поэтому во время войны в Афганистане
1979-1989 гг. отечественными травматологами была выдвинута концепция
«сберегательной» первичной хирургической обработки огнестрельных переломов,
направленной на улучшение функциональных результатов лечения огнестрельных
переломов и ориентированной на раннюю специализированную медицинскую помощь
(Дедушкин B.C., Артемьев А.А., 1991; Шаповалов В.М., Ерохов А.Н., 2006). Этому
способствовало значительное изменение условий оказания помощи раненым, а именно
возможность антибиотикопрофилактики, ранней эвакуация авиатранспортом в
многопрофильный госпиталь и, при необходимости, возможность наблюдения раненого
до определившегося исхода.
Данная концепция сводится к следующим основным положениям:
ПХО огнестрельных переломов не показана без значительного смещения
отломков, с точечными (до 1 см) входным и выходным отверстиями раневого канала,
без кровотечения и напряжённых гематом. В данном случае может выполняться
жёсткая иммобилизация перелома с адекватным дренированием и противовоспалительными
блокадами в послеоперационном периоде;
в ходе ПХО при огнестрельных переломах максимально сохраняется костная
ткань, а удаляются только мелкие свободно лежащие костные осколки;
завершающим этапом сберегательной ПХО оскольчатых переломов с обширным
повреждением мягких тканей должен быть стабильный чрескостный внеочаговый
остеосинтез;
обязательным элементом ПХО является декомпрессии тканей в виде
фасциотомии и введения в рану гидрофильных сорбентов, а также восстановления
микроциркуляции;
рана после выполнения ПХО либо ведётся открыто с использованием
водорастворимых мазей и закрывается первичным отсроченным швом, либо возможно
её ушивание первичным швом при условии налаживания адекватного
приливно-отливного дренирования.
Таким образом, в условиях ведения современных локальных войн и
конфликтов, показания к проведению первичной хирургической обработки
огнестрельных переломов длинных трубчатых костей в полном объёме на этапе
оказания квалифицированной хирургической помощи должны быть максимально сокращены.
(Брюсов П.Г. с соавт., 1996; Иванов П.А., 2002; Ефименко Н.А. с соавт., 2003;
Шаповалов В.М., 2004; Самохвалов И.М. с соавт., 2006).
Медицинская помощь на этапе эвакуации должна ограничиваться тщательным
туалетом ран, пассивным дренированием через раневой канал и
противовоспалительной блокадой.
На этапе оказания квалифицированной хирургической помощи, если возникает
необходимость в выполнении ПХО при огнестрельных переломах костей, методика
операции должна осуществляться по сберегательному типу, а обработанная рана
должна оставаться открытой. Обязательным является выполнение
лечебно-транспортной иммобилизации по завершении оперативного вмешательства.
В данном случае, под лечебно-транспортной иммобилизацией переломов
длинных трубчатых костей, должна пониматься временная иммобилизация костных
отломков в фиксационном режиме стержневыми аппаратами внешней фиксации либо
спицевыми аппаратами упрощённой конструкции (Ли А.Д., Баширов Р.С., 2002; Быков
И.Ю., Ефименко Н.А., Гуманенко Е.К., 2008).
В военно-полевой хирургии основной целью выполнения лечебно-транспортной
иммобилизации при огнестрельных переломах является надёжное и прочное
обездвижение костных отломков повреждённой конечности для обеспечения
безопасной транспортировки раненого на следующий этап эвакуации, предупреждения
развития травматического шока, профилактики раневой инфекции и создания
благоприятных условий для заживления раны (Самохвалов И.М. с соавт., 2006).
В настоящее время, для выполнения адекватной лечебно-транспортной
иммобилизации наиболее эффективными считаются стержневые аппараты внеочагового
остеосинтеза, которые просты в использовании, а продолжительность остеосинтеза,
проводимого с их помощью, не превышает 15-20 минут (Шаповалов В.М., Ерохов
А.Н., 2006; Быков И.Ю., Ефименко Н.А., Гуманенко Е.К., 2008).
Таким образом, используемая на современном этапе методология лечения
огнестрельных переломов направлена в основном на устранение жизнеугрожающих
последствий ранения и создание оптимальных условий для консолидации без учёта
необходимости коррекции изменений костного матрикса на ультраструктурном
уровне, таких как остеопорозоподобное его перерождение.
Под остеопорозом принято понимать метаболическое заболевание костной
системы, характеризующееся снижением костной массы в единице объёма и
нарушением микроархитектоники костной ткани, приводящее к повышенной хрупкости
костей и увеличению риска переломов (Новик А.А. с соавт., 2003; Котельников
Г.П., Булгаков С.В., 2010).
«Золотым» стандартом диагностики остеопороза считается количественное исследование
минеральной плотности костной ткани - остеоденситометрия. Существуют различные
методики определения МПКТ, такие как монофотонная и дифотонная абсорбциометрия,
моноэнергетическая и двухэнергетическая абсорбциометрия (ДРА), количественная
компьютерная томография, радиографическая абсорбциометрия. Однако, по мнению
многих специалистов данной области, именно ДРА позволяет при минимальной
лучевой нагрузке проводить сканирование кости с высокой точностью и большой
скоростью и является сравнительно недорогим методом. С его помощью можно
исследовать МПКТ любого отдела скелета и оценить риск перелома любой
локализации. Тем не менее, авторы отмечают, что помимо показателей минеральной
плотности (количественный показатель) прочность кости напрямую зависит также и
от её качественного состояния (микроархитектоники, состояния обменных
процессов, накопления повреждений и т.д.) (Денисов-Никольский И.Ю. с соавт.,
2002; Новик А.А., с соавт., 2003; Аврунин А.С. с соавт., 2010).
В настоящее время для лечения остеопороза применяются препараты следующих
групп (Рожинская Л.Я., 2002; Цыган Е.Н., Деев Р.В., 2007; Лесняк О.М.,
Беневоленская Л.И., 2009):
. Препараты, замедляющие костную резорбцию.
2. Препараты, стимулирующие костеобразование.
. Препараты многопланового действия.
К последней группе относятся препараты, содержащие фосфаты, стронций,
кремний, алюминий.
С 2001 года в России прошёл регистрацию и поступил в аптечную сеть
препарат стронция - стронция ранелат, который выпускается Лабораторией Сервье
(Les Laboratoires SERVIER) под торговой маркой БИВАЛОС (BIVALOS) в виде порошка
(безводной субстанции strontium ranelat) для приготовления суспензии для приема
внутрь в саше по 2 г. В настоящее время «Бивалос» зарегистрирован в РФ как
препарат, применяемый при остеопорозе у женщин в постменопаузе.
Его доступность, удобство применения, а также возможность свободного
приобретения в розничной аптечной сети и послужили основным мотивом применения
именно этого препарата в нашем исследовании.
По данным, предоставленным представительством Производителя, стронция
ранелат стимулирует образование кости в культуре костной ткани, а также
стимулирует репликацию предшественников остеобластов и синтез коллагена в
культуре костных клеток; уменьшает резорбцию костной ткани путем подавления дифференцировки
остеокластов, а также их резорбтивной активности.
В экспериментальных исследованиях на лабораторных животных применение
стронция ранелата приводило к увеличению массы трабекулярной части кости, числа
трабекул и их толщины, в результате этого улучшались механические свойства
кости.
В костной ткани человека основное количество стронция ранелата
абсорбировалось на поверхности кристаллов гидроксиапатита и лишь в
незначительной степени замещало кальций в этих кристаллах в новообразованной
кости. Стронция ранелат не изменяет характеристики кристаллизации костной
ткани. По данным биопсии гребня подвздошной кости, полученной в клинических
исследованиях в разные по длительности периоды (до 60 месяцев) лечения стронция
ранелатом в дозе 2 г, какого-либо неблагоприятного влияния на качество костной
ткани или минерализацию установлено не было.
Комбинированные эффекты распределения стронция в костной ткани и
повышенная, по данным рентгенографии, абсорбция стронция по сравнению с
кальцием, приводят к повышению минеральной плотности костной ткани, которая
измеряется путем ДРА. В клинических исследованиях III фазы, начиная с третьего
месяца до завершения наблюдения в течение 3 лет, уровни биохимических маркеров
образования кости (ЩФ костной ткани и С-терминальный пропептид проколлагена I
типа) возрастали по сравнению с плацебо, при этом уровни маркеров резорбции
костной ткани (С-телопептидные поперечные мостики в сыворотке и N-телопептидные
поперечные мостики в моче) снижались.
В составе лекарственной формулы стронция ранелата содержатся два атома
стабильного стронция и 1 молекула ранеловой кислоты, а также органическая
часть. Ранеловая кислота не кумулирует и не проявляет метаболической активности
в организме лабораторных животных и человека.
После приема препарата внутрь в разовой дозе 2 г максимальная
концентрация в плазме крови достигается через 3-5 ч. Абсолютная биодоступность
стронция составляет 25% (диапазон 19-27%).
Равновесное состояние достигается через 2 недели терапии. Связывание
стронция с белками плазмы человека низкое и составляет 25%, при этом стронций
характеризуется высоким сродством к костной ткани. Измерения концентраций
стронция при биопсии подвздошной кости у больных, получавших стронция ранелат в
дозе 2 г в течение длительного времени (до 60 мес.), показывают, что
концентрации стронция в костной ткани могут достигать плато примерно через 3
года терапии.
Представляя собой двухвалентный катион, стронций не метаболизируется в
организме человека.
Эффективный T1/2 стронция составляет примерно 60 ч. Стронций выводится
почками и через кишечник. Плазменный клиренс стронция составляет около 12
мл/мин, почечный клиренс - около 7 мл/мин. Абсорбированная ранеловая кислота
быстро и в неизмененном виде выводится почками.
В настоящее время Бивалос предназначен только для лечения женщин в
постменопаузном периоде с целью снижения риска переломов позвонков и шейки
бедра.
Препарат принимают внутрь в виде суспензии, получаемой после размешивания
порошка в стакане воды в течение длительного времени. Рекомендуемая доза
составляет 2 г (1 саше).
В последнее время ведутся работы по воздействию на скорость и качество
консолидации переломов у пострадавших с политравмой с помощью применения
принципиально новых материалов и лекарственных препаратов. В данном направлении
ведутся исследования по применению в лечении переломов коллаген-апатитовых
интерфейсов (Кавалерский Г.М. с соавт., 2010), препаратов на основе стронция
(Гайдаш А.А. с соавт., 2009), замещению дефектов костей имплантами с
наноструктурными керамическими покрытиями (Карлов А.В., Шахов В.П., 2001;
Ланцов Ю.А. с соавт., 2010), а также использованию клеточных технологий (Деев
Р.В., Исаев А.А., Кочиш А.Ю., 2008).
Таким образом, представленные данные показывают, что в настоящее время
достижения военно-полевой хирургии позволили значительно улучшить результаты
лечения раненных с огнестрельными переломами длинных трубчатых костей
конечностей, однако частота неудовлетворительных исходов остаётся высокой.
Отчасти это может объясняться теми специфическими изменениями в костной
ткани, формирующимися при воздействии факторов огнестрельного ранящего снаряда
и, следовательно, требующими особых подходов к диагностике и лечению данной
патологии.
Однако, проведённый анализ литературы, показал недостаточную изученность
ультраструктурных изменений костного матрикса в зоне «молекулярного
сотрясения», изучение которой, по мнению Дыскина Е.А., должно базироваться на
широком применении гистологических, гистохимических,
электронно-микроскопических, биохимических и других методов исследования (Дыскин
Е.А., 1991).
Соответственно, для уточнения патогенеза и разработки новых методов
лечения раненных с огнестрельными переломами, необходимо проведение
дополнительных исследований с использованием современных и перспективных
диагностических и лечебных методик.
ГЛАВА 2. МАТЕРИАЛ И МЕТОДЫ
2.1 Планирование исследования
В связи с тем, что проблема изменения тонкой структуры костного матрикса
при действии факторов огнестрельного ранящего снаряда в настоящее время изучена
недостаточно, а комплексное лечение огнестрельных переломов без воздействия на
все патологические механизмы течения раневого процесса является неполным, была
обоснована необходимость проведения экспериментальных исследований, перед
которыми были поставлены цели: выявить фундаментальные механизмы разрушения
костной ткани при огнестрельных переломах и апробировать предложенные пути их
коррекции.
Для выявления особенностей пространственной организации тонкой структуры
костного матрикса, а также выявления его ультраструктурных изменений при огнестрельных
переломах, был спланирован первый этап экспериментальных работ, заключавшийся в
проведении исследований на постмортальных образцах костной ткани человека, как
в норме (30 образцов), так и с наличием огнестрельных переломов плоских костей
черепа и диафизарных переломов костей бедра и голени (100 образцов).
Исследования на данном этапе были представлены следующими методами:
. Исследования тонкой структуры костного матрикса пластинчатых и
трубчатых костей в норме методом сканирующей электронной микроскопии (10
образцов).
2. Исследования тонкой структуры костного матрикса пластинчатых и
трубчатых костей в норме методом атомно-силовой микроскопии (10 образцов).
. Исследования тонкой структуры костного матрикса пластинчатых и
трубчатых костей в норме методом рентген-структурного анализа (10 образцов).
. Исследования тонкой структуры костного матрикса пластинчатых и
трубчатых костей в норме методом микротвердометрии (50 образцов).
. Исследование морфологии огнестрельных переломов пластинчатых и
трубчатых костей методом сканирующей электронной микроскопии (50 образцов).
. Исследование морфологии огнестрельных переломов пластинчатых и
трубчатых костей методом атомно-силовой микроскопии (25 образцов).
. Исследование морфологии огнестрельных переломов пластинчатых и
трубчатых костей методом рентген-структурного анализа (25 образцов).
. Исследование морфологии огнестрельных переломов пластинчатых и
трубчатых костей методом микротвердометрии (50 образцов).
Второй этап эксперимента имел целью изучение влияния выбранного способа
коррекции выявленных ультраструктурных изменений костного матрикса в
эксперименте на биообъектах (10 баранах). На данном этапе, после нанесения
биообъектам огнестрельного перелома диафиза большеберцовой кости, проводилась
традиционная схема лечения огнестрельных переломов с добавлением в рацион
животных стронция ранелата. В последующем, после выведения животных из
эксперимента на 15-е, 30-е и 60-е сутки лечения, производился забор костных
образцов из зоны костного регенерата и их исследование.
На данном этапе с образцами костной ткани проводились следующие
исследования:
. Исследования тонкой структуры костного матрикса области регенерата
методом сканирующей электронной микроскопии (10 образцов).
2. Исследования тонкой структуры костного матрикса области
регенерата методом атомно-силовой микроскопии (10 образцов).
. Исследования тонкой структуры костного матрикса области
регенерата методом рентген-структурного анализа (10 образцов).
. Исследование тонкой структуры костного матрикса области регенерата
методом микротвердометрии (10 образцов).
2.2 Общая характеристика материала исследования
Исследования были проведены на образцах костной ткани, основными
источниками которых явились:
1. Образцы зоны огнестрельного перелома костей черепа и диафизов
трубчатых костей человека, полученные в музее кафедры судебной медицины ВМА им.
С.М. Кирова (100 образцов).
2. Образцы плоских и трубчатых костей в норме от людей, погибших
при дорожно-транспортных происшествиях, полученные на кафедре судебной медицины
в Сибирском государственном медицинском университете (30 образцов).
. Образцы зоны огнестрельного перелома трубчатых костей
конечностей, полученные в эксперименте на лабораторных животных (2 барана),
которым был нанесён огнестрельный перелом большеберцовой кости, выстрелом из
карабина СКС пулей калибра 7,62 мм (20 образцов).
. Образцы зоны регенерата огнестрельного перелома трубчатых костей
конечностей, полученные в эксперименте на лабораторных животных (5 баранов)
после огнестрельного перелома большеберцовой кости, которым проводилось
традиционное лечение (50 образцов).
. Образцы зоны регенерата огнестрельного перелома трубчатых костей
конечностей, полученные в эксперименте на лабораторных животных (5 баранов)
после огнестрельного перелома большеберцовой кости, которым к традиционному
лечению был добавлен стронция ранелат (50 образцов).
Общее количество и краткая характеристика материала исследования
представлены в таблице 2.
Таблица 2. Характеристика материала исследования.
|
№
|
Характеристика
|
Количество
|
Цели
|
|
объектов
|
биообъектов
|
проб
|
образцов
|
|
|
I
|
Человеческие кости в норме
|
Мужчины 20-40 лет (5)
|
10 (5/5)
|
30 (15/15)
|
Контроль
|
|
Человеческие кости после
огнестрельного перелома
|
Мужчины 20-40 лет (25)
|
25 (15/10)
|
100 (60/40)
|
Изучение ультраструктуры
огнестрельных переломов
|
|
II
|
Трубчатые кости барана в
норме и после ранения
|
Бараны-самцы (2)
|
2
|
20
|
Контроль
|
|
Трубчатые кости барана
после огнестрельного перелома
|
Бараны-самцы (1-я опытная
группа) (5)
|
5
|
Изучение ультраструктуры
регенерата
|
|
Трубчатые кости барана
после огнестрельного перелома
|
Бараны-самцы (2-я опытная
группа) (5)
|
5
|
50
|
Изучение действия стронция
ранелата
|
2.3 Общая характеристика методов исследования
2.3.1 Общеклинические исследования
Наблюдение за экспериментальными животными осуществляли ежедневно 2 раза
в сутки с помощью как визуальных и физикальных методов, так и с использованием
прикроватного монитора «Тритон-Б». Учитывались следующие параметры:
реакция животного на травму (поведение, частота пульса, ректальная
температура, выраженность пищевого рефлекса, масса тела, нагрузка на
поврежденную поверхность);
продолжительность и характер наружного кровотечения;
размеры входного и выходного отверстий, площадь кожных ран;
данные местных изменений в поврежденной конечности (характер и количество
раневого отделяемого, выраженность отека паравульнарных тканей, характер и
сроки заживления ран);
сроки и клинические проявления общих и местных осложнений.
2.3.2 Лабораторные исследования
Лабораторные исследования включали забор образцов крови для аппаратного
определения показателей общего и биохимического анализов. Забор крови для
лабораторных исследований производился до начала проведения опыта, а также на
1, 3, 10, 30 и 60 сутки наблюдения.
Для определения объёма возможной кровопотери и возможности развития
анемического синдрома в крови животных оценивали исходные показатели и динамику
количества эритроцитов, содержания гемоглобина и показатели гематокрита.
Содержание лейкоцитов контролировали для оценки воспалительного ответа, а также
для контроля возможности развития гнойных осложнений.
Для оценки степени развития стресс-реакции организма у подопытных
животных (бараны породы «Меринос» массой 50-57 кг) на травматическое
воздействие было проведено исследование в плазме крови уровня глюкозы и общих
липидов биохимическими наборами фирмы «ЛАХЕМА» (Чешская Республика).
Метаболические нарушения белкового обмена определялись путем исследования
содержания общего белка и уровня мочевой кислоты в сыворотке крови
биохимическим набором фирмы «ЛАХЕМА» (Чешская Республика).
Интенсивность свободнорадикального окисления (СРО) и активность
антиоксидантной системы (АОС) в организме животных после воздействия оценивали
методом индуцированной биохемилюминесценции, а также по уровню общеоксидазной и
антиоксидазной активности (ООА и ОАА) в сыворотке крови.
Степень повреждения (деструкции) клеточных и субклеточных мембран органов
и тканей определяли путем исследования в сыворотке крови животных активности
ряда мембрансвязанных ферментов - щелочной фосфатазы (ЩФ),
аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ) и
лактатдегидрогеназы (ЛДГ) с помощью биохимических наборов фирмы «ЛАХЕМА»
(Чешская Республика).
Для оценки внутреннего пути свертывания крови определяли активированное
частичное тромбопластиновое время (АЧТВ), внешнего пути свертывания крови -
протромбиновое время (ПВ), конечного этапа процесса свертывания крови
(превращение фибриногена в фибрин под действием тромбина) - тромбиновое время
(ТВ), а также количественное содержание фибриногена. Все тесты проводили при
помощи наборов НПО «Ренам» (Россия) на гемокоагулографе Throbotimer (Германия).
Состояние минерального обмена оценивали по уровню Ca и неорганического
фосфора (Р) с помощью биохимических наборов фирмы «ЛАХЕМА» (Чешская Республика,
что наряду с рентгенологической и макро- и микроскопической картиной костного
регенерата, позволило выполнить комплексную оценку качества остеорепаративных
процессов.
2.3.3 Микробиологические исследования
Для определения раневой микрофлоры в динамике и коррекции
антибактериальной терапии, брались посевы из ран на 10-е сутки (по окончании
антибактериальной терапии цефазолином), а также на 15-е и 20-е сутки при
наличии патологического отделяемого из ран.
Забор материала производили в стерильные пробирки с транспортной средой,
которые доставляли в микробиологическую лабораторию в течение 2-х часов от
момента отбора проб. Все микробиологические исследования проводили в
соответствии с действующими нормативными документами (Приказом МЗ СССР № 535 от
1985 г. и Методическими указаниями по определению чувствительности
микроорганизмов к антибактериальным препаратам МУК 4.2.1890-04 от 2004 г.).
Посев проб осуществляли на 5% кровяной агар полуколичественным методом,
позволяющим определять титр бактерий. Через 18-24 часа все разновидности
выросших колоний микроорганизмов подсчитывали, затем изучали тинкториальные
свойства, морфологию бактерий и производили биохимическую идентификацию
выделенных штаммов.
Определение чувствительности к антибиотикам осуществляли диско-диффузным
методом на среде АГВ (агар Гювенталя-Ведьминой) с использованием наборов дисков
с антибактериальными препаратами производства ЗАО НИЦФ (Санкт-Петербург). При
интерпретации результатов - штамм, имеющий зону задержки роста, оценивался как
чувствительный.
Исследование завершалось выдачей заключения о видовой или родовой
принадлежности высеянного микроорганизма, его титра и чувствительности к
антибактериальным препаратам.
2.3.4 Рентгенологические исследования
Рентгенографию выполняли на рентгеновском диагностическом переносном
аппарате 10L-6-01 Арман-6-02. Всем животным производили рентгенографию голени в
двух проекциях при одинаковых физико-технических условиях (фокусное расстояние
- 50 см, напряжение - 40 кВ, установка реле количества электричества - 40 mАs,
экспозиция - 0,4 с) и стандартных условиях фотообработки. Снимки выполняли
сразу после ранения, непосредственно после первичной хирургической обработки и
наложения аппарата внешней фиксации, а также на 10-е, 30-е и 60-е сутки.
С целью оценки минерализации костных регенератов в зоне огнестрельного
перелома использовали метод количественной оценки минеральной плотности костной
ткани (МПКТ) с помощью аппарата двухэнергетической костной денситометрии
Norland XR-46. Данная методика заключается в оценке поглощаемости участком
кости ионизирующего излучения от источника, что пропорционально количеству
минеральных веществ на единицу объёма кости (г/см2). Считается, что
ошибка при данной методике измерения не превышает 2%. Измерения
костных образцов производили до ранения, сразу после ранения, а также на 14-е,
30-е и 60-е сутки лечения. Полученные данные переводили в проценты, принимая за
100% усреднённый показатель минеральной плотности препаратов диафизов
большеберцовых костей, полученных от животных контрольной группы.
.3.5 Гистологические исследования
Гистологические исследования включали приготовление и микроскопирование
гистологических препаратов идентичных участков костных регенератов в зонах
огнестрельных переломов большеберцовых костей баранов. Забор тканей для
гистологического исследования осуществляли после выведения животных из
эксперимента на 14, 30, 60 сутки от начала опыта. Голени задних конечностей
вычленяли из суставов, от кости отделяли мягкие ткани и затем выпиливали
фрагмент диафиза, включающий регенерат с прилежащими отделами костных отломков
и фиксировали в 12% растворе нейтрального формалина в течение 10 суток. С целью
декальцинации фрагменты костной ткани помещали в 5 % раствор трихлоруксусной
кислоты на 30-40 суток. Дегидратацию материала проводили с помощью этилового
спирта в постепенно возрастающих концентрациях. Далее из фрагментов диафиза
вырезали стандартные блоки кости, которые заливали в целлоидин по стандартной
методике. Срезы толщиной 10-20 мкм окрашивали гематоксилин-эозином по обычной
схеме. Микроскопирование и фоторегистрацию осуществляли с помощью
светооптического микроскопа «Leica DMLA» c цифровой фотокамерой «Leica DC-500».
Электронно-микроскопические исследования.
Морфогенез огнестрельных ранений, помимо общепринятых гистологических
методов исследования, был также изучен методами сканирующей зондовой
электронной и атомно-силовой микроскопии. Выбор данных методов электронной
микроскопии обусловлен следующими обстоятельствами:
. Высокая разрешающая способность: сканирующих микроскопов в пределах
10-15 нанометров, атомно-силовых - до 2 нм.
. Минимальная пробоподготовка дает возможность изучения состояния
структур костного матрикса в условиях близких к физиологическим (режим
«естественной среды»).
. Возможность определения локального химического состава методом энергодисперсионного
анализа в сканирующих зондовых микроскопах и проведения локальных
микромеханических испытаний методом адгезиометрии в атомно-силовой микроскопии.
. Возможность получить информацию о тонкой структурно-функциональной
организации поверхности тканевых структур и оценить практически не изученную
роль поверхностных эффектов в морфогенезе раневых повреждений.
. Возможность исследовать структуру образца в режиме локальных тонких
срезов. Это важно при изучении структуры, пространственной ориентации и
смещений нанокристаллов гидроксиапатита в интерфейсе коллаген-вода-апатит
(Миронов В.Л., 2005).
2.3.6 Сканирующая зондовая электронная
микроскопия
Сканирующая зондовая электронная микроскопия выполнена на аппарате
Philips SEM-515.
Использование данной методики дало возможность получить объёмные
сканограммы тонкой структуры костного матрикса, выявить расположение
ультратонких каналов и укладку нитей коллагена, покрытых кристаллами апатита
как до, так и после воздействия ударной волны. Было выполнено определение
локального химического состава методом энергодисперсионного анализа, для
определения концентрации определённых химических веществ в раневом канале и на
отдалении от него.
2.3.7 Атомно-силовая микроскопия
Исследования с применением атомно-силовой микроскопии выполнены с помощью
зондовой нанолаборатории INTEGRA.
Данный метод исследования, благодаря своей крайне высокой разрешающей
способности и чувствительности, позволил выявить пространственное
взаиморасположение волокон коллагена и кристаллов гидроксиапатита, их форму, а
также с его помощью были выполнены локальные микромеханические испытания
(адгезиометрия), как в интактной кости, так и в зоне огнестрельного перелома.
2.3.8 Рентген-структурный анализ
Количественный анализ фазового состава минерального компонента кости
проведен методом рентгеноструктурного анализа на дифрактометре «Shimadzu
XRD-6000» с использованием фокусирующего пирографитового монохроматора на
вторичном (рассеянном) пучке.
Обработка полученных рентгенограмм от поликристаллических образцов
проводилась с использованием базы дифракционных данных ICDD и программы
полнопрофильного анализа HOWDER CELL 2.4.
2.3.9 Микротвердометрия
Измерение локальной микротвёрдости костных образцов выполнялось с помощью
промышленного микротвердомера ПМТ-2, что позволило выявить различия в
микротвёрдости разных участков Гаверсовой системы в целом и остеона в
частности, а также изменение этих показателей после воздействия на костную
ткань факторов огнестрельного ранящего снаряда.
Методика данного исследования заключается в измерении следа, оставленного
алмазной пирамидкой на определённом участке образца при давлении на неё груза
(рис. 1) с определённой массой и расчетом показателей микротвёрдости по
специальным таблицам.

Рис. 1. Измерение размера вдавления от пирамидки в костной ткани с
помощью микротвердомера ПМТ-2
Общая характеристика использованных методов исследования представлена в
таб. 3.
Таблица 3. Характеристика использованных методов исследования
|
№ п/п
|
Метод исследования
|
Количество исследованных
образцов
|
|
1.
|
Общеклинические и
физикальные исследования
|
2 раза в сутки
|
|
2.
|
Лабораторные исследования
|
До начала проведения опыта
и на 1, 3, 10, 30 и 60 сутки
|
|
3.
|
Рентгенологические
исследования
|
После ранения, после ПХО и ВНО,
10-е, 30-е и 60-е сутки
|
|
4.
|
Микробиологические
исследования
|
10-е (15-е и 20-е) сутки
|
|
5.
|
Гистологические
исследования
|
12
|
|
6.
|
СЭМ
|
250
|
До и после ранения, а также
на 14-е, 30-е и 60-е сутки
|
|
7.
|
Атомно-силовая микроскопия
|
55
|
|
|
8.
|
Рентген-структурный анализ
|
55
|
|
|
9.
|
Микротвердометрия
|
35
|
|
|
10.
|
Денситометрия
|
24
|
|
ГЛАВА 3. УЛЬТРАСТРУКТУРНЫЕ ИССЛЕДОВАНИЯ МОРФОЛОГИИ ОГНЕСТРЕЛЬНЫХ
ПЕРЕЛОМОВ
3.1 Методика проведения эксперимента на
биоманекенах
Для выявления особенностей пространственной организации тонкой структуры
костного матрикса, а также выявления фундаментальных механизмов его разрушения
был спланирован первый этап экспериментальных работ, заключающийся в проведении
исследований на постмортальных образцах костной ткани человека, как в норме (30
образцов костной ткани лиц, погибших от неогнестрельных травм), так и с
наличием огнестрельных переломов плоских костей черепа и диафизарных переломов
костей бедра и голени (100 образцов).
Исследования на данном этапе состояли из следующих подэтапов:
. Исследования тонкой структуры костного матрикса пластинчатых и
трубчатых костей в норме методом сканирующей электронной микроскопии (10
образцов).
2. Исследования тонкой структуры костного матрикса пластинчатых и
трубчатых костей в норме методом атомно-силовой микроскопии (10 образцов).
. Исследования тонкой структуры костного матрикса пластинчатых и
трубчатых костей в норме методом рентген-структурного анализа (10 образцов).
. Исследование морфологии огнестрельных переломов пластинчатых и
трубчатых костей методом сканирующей электронной микроскопии (50 образцов).
. Исследование морфологии огнестрельных переломов пластинчатых и
трубчатых костей методом атомно-силовой микроскопии (25 образцов).
. Исследование морфологии огнестрельных переломов пластинчатых и
трубчатых костей методом рентген-структурного анализа (25 образцов).
С целью получения экспериментального материала для вышеописанных
исследований производили выпиливание костных образцов из скелетированных
черепов и длинных трубчатых костей, как интактных, так и подвергшихся
воздействию огнестрельных ранящих снарядов.
Выпиливание производилось с захватом раневого канала, вблизи и на
отдалении от него (рис. 2).
А Б
Рис. 2. Забор образца затылочной кости. А - зоны огнестрельного перелома;
Б - на отдалении от раневого канала
3.2 Изучение морфологии огнестрельных переломов
методом сканирующей электронной микроскопии
Структурные механизмы разрушения плоских костей.
Электронно-микроскопические исследования образцов теменной кости в норме
показали, что основной структурно-функциональной единицей плоской кости
является остеон, который представляет собой канал, образованный путем
прокладывания туннелей остеокластами с последующим их заполнением
концентрическими слоями коллагена и протеогликанов, секретируемых остеобластами
и связанных линиями цемента (спайновыми линиями) (рис. 3).

Рис. 3. Сканирующая электронная микроскопия кости. Система гаверсовых
каналов здоровой теменной кости
На сканограммах сколов, производимых в продольном относительно укладки
большинства остеонов направлении, определяется, что коллагеновые волокна в
компактной части трубчатых костей имеют строго определенную ориентацию.
Коллагеновые волокна входят в состав концентрических костных пластинок остеона,
вставочных пластин и костных трабекул. Как правило, в составе остеона
коллагеновые волокна располагаются в виде концентрических слоев, расположенных
под определенным углом друг к другу, что обеспечивает биомеханическую
устойчивость системы (рис. 4).
По данным сканирующей электронной микроскопии образцов области
огнестрельного перелома наиболее значимыми механизмами разрушения плоских
костей являются разрывы компактного вещества и деформации смещения пластов
костного матрикса.

Рис. 4. Сканирующая электронная микроскопия кости. Минерализованные
коллагеновые волокна в матриксе здоровой теменной кости
Морфологически разрывы компактного вещества представляют собой
микротрещины в основном линейной формы, которые происходят преимущественно
вокруг спайновых линий остеонов (рис. 5).
Непосредственно на поверхности раневых каналов, как входного, так и
выходного пулевых отверстий, наблюдается «обтекание» микротрещинами смещения
костного матрикса по ходу траектории движения пули, что вызывает фрагментацию
его на островки (рис. 6).
Деформации смещения пластов занимают второе место по объему разрушения
костного матрикса плоских костей черепа. Этот вид деформации довольно
распространён на поверхностях раневых каналов как в области входных так и
выходных пулевых отверстий.

Рис. 5. Микротрещины в теменной кости в зоне огнестрельного перелома

Рис. 6. Множественные микротрещины костного матрикса в области
огнестрельного перелома теменной кости
Морфологически деформации смещения пластов выявляются в виде сносов
поверхностных слоев компактного вещества кости, вызванных, по нашему мнению,
воздействием избыточного давления ударной волны (рис. 7).

Рис. 7. Деформация смещения пластов по типу упорядоченного сноса
компактного вещества на поверхности раневого канала входного пулевого отверстия
При этом структура поверхности раневого канала на месте сноса имеет более
упорядоченный вид в области входных пулевых отверстий, чем в области выходных,
что может быть обусловлено характером движения огнестрельного ранящего снаряда.
Так, показано, что снос поверхностных слоев компактного вещества в области
выходных отверстий более турбулирован, а форма дефектов имеет полиморфную
структуру (рис. 8).

Рис. 8. Деформация смещения пластов по типу турбулентного сноса
компактного вещества на поверхности раневого канала выходного пулевого
отверстия теменной кости
Что же касается характера деформации смещения вне непосредственной
близости к раневым дефектам, то в глубине компактного вещества плоских костей
черепа на отдалении 3-5 см от раневых каналов, деформации имеют вид разрывов
стенок ячеистых структур.
Данные деформационные разрывы костного матрикса могут иметь вид как
простых разрывов (рис. 9), так и разрывов со смещением слоёв костного матрикса
(рис. 10).
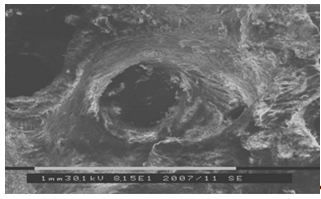
Рис. 9. Трещины в стенке гаверсова канала в глубине компактного вещества
теменной кости в зоне огнестрельного перелома

Рис. 10. Трещины и деформации смещения в стенке гаверсова канала в
глубине компактного вещества теменной кости в зоне огнестрельного перелома
На месте вышеописанных деформаций смещения выявляется образование лакуно-
и каверноподобных очагов, которые могут иметь достаточно полиморфные края и
дно.
Основной объём лакун, находящихся непосредственно на поверхности раневых
каналов, имеют ровные, как бы оплавленные края, и однородное дно с разрыхленным
костным матриксом и одиночными микротрещинами (рис. 11).

Рис. 11. Лакуна на поверхности раневого канала входного пулевого
отверстия теменной кости. Края лакуны ровные, как бы оплавленные. В дне лакуны
микротрещины
Морфологически данный вид лакун представляет собой не что иное, как
разлитые поверхности воздушно-ударных эрозий в раневом канале.
В особую форму можно выделить лакуны с ассиметричными краями, один из
которых пологий, а противоположный - более крутой и подрытый (рис. 12).

Рис. 12. Лакуна на поверхности раневого канала входного пулевого
отверстия теменной кости. Имеются подрытый и пологий край. Матрикс в дне полого
края подвержен деформации смещения и разрывов
В подрытом крае дном лакуны является впадина или глубокая расщелина,
которые могут уходить вглубь костного матрикса. В пологих же краях дно лакун
выполнено напластованными друг на друга смещёнными слоями костного матрикса,
которые зачастую имеют вид гофрированных, а иногда и ступенчатоподобных
структур на поверхности раневых каналов. Лакуны данного типа достаточно склонны
к группированию и, нередко сливаясь, углубляются в компактное вещество на 3-5
миллиметров, что было обнаружено на послойных сколах образцов.
Было зафиксировано, что в глубине компактного вещества микрокаверны имеют
аналогичную лакунам овальную форму и могут достигать диаметра до 300 мкм.
Большая часть из них образуется в очагах разрежения костного матрикса или же по
продолжению поверхностных дефектов.
В зоне воздействия ударных волн в плоских костях наблюдается лизис
цемента и микропористая трансформация костного матрикса, что особенно выражено
в области входных и выходных пулевых отверстии (рис. 13).

Рис.13. Микропористая трансформация костного матрикса теменной кости в
области огнестрельного перелома
Стоит отметить, что в целом для плоских костей черепа кавернообразование
вдали от раневого канала не является характерным механизмом разрушения.
Структурные механизмы разрушения диафиза длинных трубчатых костей.
Сканирующая электронная микроскопия образцов костной ткани диафиза
трубчатой кости показала, что структурно-функциональной единицей трубчатой
кости на ультраструктурном уровне в норме является темплат, представляющий
собой дискретную структуру, состоящую из определенным образом
взаиморасположенных фибриллярного белка коллагена и кристаллов гидроксиапатита.
Канальцы костного матрикса имеют мембраны, представленные муфтами уплотненного
матрикса толщиной от 1 до 5-7 мкм (рис. 14).

Рис. 14. Структура поверхности гаверсового канала интактной
большеберцовой кости барана
Мембраны костных канальцев со стороны просвета густо пронизаны множеством
отверстий диаметром от 100 до 300-450 нм. Поверхность данных наноотверстий
имеет сетчатую структуру и состоит из слабо минерализованных нитей коллагена,
имеющих слабо выраженную минерализацию.
При этом отмечено, что основная часть данных нитей имеет строго
упорядоченное расположение с формированием пространственных структур наподобие
винтовой резьбы, имеющих шаг 15-20 нм. Описанные отверстия дают начало
наноканалам, которые прогрессивно уменьшаясь в диаметре, направляются вглубь
компактного вещества кости (рис. 15).

Рис. 15. Наноканальцы, уходящие вглубь костного матрикса в интактной
большеберцовой кости барана
Как показывают данные электронно-микроскопических исследований образцов
огнестрельных переломов диафизов трубчатых костей, ведущую роль в разрушении
костного матрикса диафиза трубчатых костей играет кавернообразование.
При этом установлено, что данные каверны располагаются на поверхности
раневого канала и в глубине компактного вещества и не имеют непосредственной
анатомической связи с костными канальцами. На поверхности раневого канала
каверны имеют вид лакун с разреженным дном и приподнятыми краями (рис 16).

Рис. 16. Лакуна с приподнятыми краями на поверхности раневого канала
большеберцовой кости барана
На отдалении от раневого дефекта кости, в глубине компактного вещества,
они имеют вид замкнутых полостей диаметром до 500 мкм, которые образуются путем
роста и слияния расширенных пор (рис. 17).
Костный матрикс претерпевает эктазии своей нанопористой структуры с
трансформацией нанопор в мезо- и микропоры, диаметрами от 100 нм и более 1500
нм, соответственно (рис. 18).

Рис. 17. Каверна с приподнятыми краями, расположенная в глубине
компактного вещества области огнестрельного перелома большеберцовой кости
барана

Рис. 18. Слияние микрополостей в крупную каверну в глубине компактного
вещества области огнестрельного перелома большеберцовой кости барана
В коллагеновых волокнах, расположенных в очагах разрежения костного
матрикса, утрачивается свойственное им чередование «широких» и «узких»
участков. К обнаженным волокнам агрегируются форменные элементы крови (рис. 19).

Рис. 19. Микропористая трансформация костного матрикса большеберцовой
кости барана в зоне огнестрельного перелома
Проведённый энергодисперсионный анализ выявил концентрирование в дне
лакун кислорода - 2,4Ат% и железа - 1,9%Ат% (в контроле 0,6Ат% и 0,09Ат%,
соответственно), которые выделяются из гемоглобина разрушенных эритроцитов, а
также натрия - 1,754% и магния - 0,974% (в контроле 0,027 Ат% и 0,125 Ат%,
соответственно). Причиной этого, по-видимому, является тканевой отек. На краях
лакун и в области спайновых линий обнаружено повышение содержания кальция -
90,6Ат% (в контроле 79,3 Ат%) и снижение содержания фосфора до 0,3Ат%, (в
контроле 19,6Ат%). Приведённые данные локального химического анализа явно
показывают, что в периферических участках каверн происходит концентрирование
вещества костного матрикса, что может быть обусловлено действием ударной волны.
Логично предположить, что в данном случае края лакун являются зонами сжатия
распространяющейся ударной волны. Микротрещины, склонные к росту и слиянию,
являются наиболее важным структурным элементом деформации костного матрикса в
краях лакун костного матрикса трубчатых костей.
3.3 Изучение морфологии огнестрельных переломов
методом атомно-силовой микроскопии
Исследования, проведённые методом атомно-силовой микроскопии (АСМ),
показали, что в норме в плоских костях толщина минерализованных коллагеновых
волокон составляет около 100 нм, и имеется чёткая D-периодичность (рис. 20).

Рис. 20. АСМ интактной затылочной кости. Размер скана 2000 нм.
Изображение минерализованных коллагеновых волокон с выраженной D-периодичностью
(период 65-67 нм)
На поверхности волокон хорошо выявляются кристаллы гидроксиапатита,
имеющие размер 20-25 нм, покрытые гидратной оболочкой и располагающиеся вокруг
главных участков коллагена в виде черепицеподобных структур (рис. 21).

Рис. 21. АСМ интактной затылочной кости. Размер скана 10 000 нм.
Изображение черепицеподобной укладки кристаллов апатита
Коллагеновые волокна в интактных трубчатых костях покрыты муфтами,
образованными агрегированными кристаллами апатита и имеющими укладку в виде
зерен. Данные апатитовые агрегаты определенным образом располагаются вокруг
главных участков D-периодов коллагеновых волокон, придавая им вид сплюснутых с
обеих сторон сфер (рис. 22).

Рис. 22. АСМ интактной трубчатой кости. Размер скана 15 000 нм.
Изображение структуры рельефа поверхности минерализованных коллагеновых волокон
с четко выраженной D-периодичностью (период 65-67 нм) и непропорционально
широкими главными участками за счет отложения кристаллов апатита
В трубчатых костях протяженность апатитовых сфер, расположенных по
длиннику коллагеновых волокон, достигает 175 нм, а диаметр 200-250 нм. Главные
участки D-периодов выступают в виде ступенек высотой 25-50 нм (рис. 23).
При атомно-силовой микроскопии образцов костей, взятых непосредственно в
зоне огнестрельных переломов, регистрируется почти полное исчезновение
черепицеподобной укладки кристаллов апатита. Коллагеновые волокна лишаются
апатитовых темплат, происходит обнажение нитей тропоколлагена и регистрируется
расширение до 72-75 нм периодов «главных» и узких участков (в норме 65-67 нм)
(рис. 24).
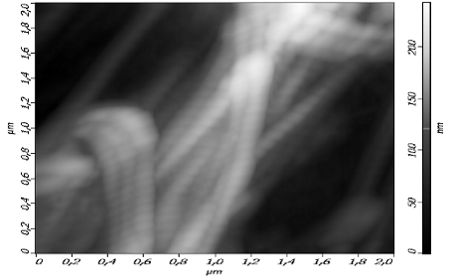
Рис. 23. АСМ интактной затылочной кости. Размер скана 2000 нм.
Изображение поверхности минерализованных коллагеновых волокон с четко
выраженной D-периодичностью (период 65-67 нм) и выступающими главными участками
в виде ступенек высотой в пределах 100 нм

Рис. 24. АСМ в области входного пулевого отверстия затылочной кости.
Размер скана 10 000 нм. Демонстрируется участок с неполной дезинтеграцией
коллагеновых волокон. Стрелкой указано коллагеновое волокно с сохраненной
D-периодичностью
При исследовании структуры коллагеновых волокон на протяжении
обнаруживаются многочисленные очаги истончения и прореживания нанофибрилл, а
также объёмные очаги дезинтеграции структур D-периодичности (рис. 25).

Рис. 25. АСМ затылочной кости. Размер скана 10 000 нм. Изображение
структуры рельефа поверхности минерализованных коллагеновых волокон теменной
кости в области пулевого входного отверстия. Демонстрируется участок полной
дезинтеграции коллагеновых волокон
При этом в зоне огнестрельного перелома определяется «замусоривание»
свободного пространства интерстиция костного матрикса обломками
аморфизированной минеральной фазы и обрывками разрушенных коллагеновых волокон
(рис. 26).

Рис. 26. АСМ затылочной кости. Размер скана 20 000 нм. Демонстрируется
участок полной дезинтеграции коллагеновых волокон и замусоривание обломками
аморфной фазы костного матрикса в области входного пулевого отверстия
При огнестрельных переломах регистрируется значительное увеличение
адгезионных сил твердой фазы костного матрикса с 16,0 до 53,0 нН. В области же
неструктурированной фазы костных образцов, анатомически соответствующей
свободному пространству нанощелей, расположенных между коллагеновыми волокнами
и нанокристаллами апатита, наблюдалось практически двукратное увеличение
адгезионной силы (с 25,4 до 41,0 нН).
Полученные локальным микроинденсированием данные, свидетельствуют об
увеличении толщины гидратной оболочки нанокристаллов гидроксиапатита и
накоплении в расширенных порах компактного вещества более вязкой воды с
повышенным уровнем сил межмолекулярного взаимодействия.
3.4 Изучение морфологии огнестрельных переломов
методом рентген-структурного анализа
Анализ данных, полученных с помощью рентген-структурного анализа,
показал, что для контрольных образцов костных тканей интактных костей, а также
образцов, взятых из областей, отдаленных на 5-10 см от раневого канала,
основной кристаллической фазой гидроксиапатита является его гексагональная
модификация - Ca5(PO4)3(OH). Кроме того, в
образцах присутствует моноклинная модификация апатита - Ca10(PO4)6(OH)2
в количестве 8 ± 2 объемных процента и около 20 объемных процентов аморфной
фазы.
В пробах взятых непосредственно вблизи входного и выходного отверстий
раневого канала моноклинная модификация гидроксиапатита практически отсутствует
и значительно возрастает доля аморфной фазы. По мере удаления от этой области
возрастает количество моноклинной модификации и падает содержание фазы
аморфной.
Указанные обстоятельства, и, прежде всего, аморфизация твердой фазы
свидетельствуют о проявлении размерных эффектов нанообъектов, обусловленных, в
данном случае, уменьшением диаметра нанокристаллов апатита.
3.5 Изучение морфологии огнестрельных переломов
методом микротвердометрии
По данным микротвердометрии твердость наружной кортикальной пластинки
теменной кости в норме колеблется в пределах 61,1 кг/мм2, губчатого
вещества - 51,8 кг/мм2 и внутренней кортикальной пластинки - 51,6
кг/мм2. Указанные показатели свидетельствуют о том, что наружная
кортикальная пластинка теменных костей в сравнении с подлежащими анатомическими
слоями более хрупкая. При исследовании образцов теменной кости в области
входного раневого канала обнаружено существенное снижение показателя
микротвердости наружной кортикальной пластинки до 47,7±0,9кг/мм2 (в
интактной кости - 61,1±1,6кг/мм2). При этом показатели
микротвердости губчатого вещества и внутренней кортикальной пластинки
сохраняются в пределах контрольных значений, составляя 51,0 кг/мм2 и
50,6 кг/мм2, соответственно.
По данным микротвердометрии зоны огнестрельного перелома диафизов длинных
трубчатых костей регистрируется падение показателей во всех макроанатомических
зонах (таблица 4). Так, в наружной кортикальной пластинке показатель снижается
с 59,2±1,0 кг/мм2 в контроле - до 51,5± 1,3 кг/мм2 в
зоне, прилегающей к раневому каналу; в губчатом веществе, соответственно: с
61,2±1,2 кг/мм2 до 50,7±0,9 кг/мм2 и во внутренней
кортикальной пластинке - с 67,1±1,0 кг/мм2 до 57,2±0,8 кг/мм2.
В целом снижение показателей колеблется в пределах 20% во всех анатомических
отделах трубчатой кости. На отдалении до 10 см также регистрируются тенденции
снижения показателей твердости, но преимущественно в кортикальных пластинках.
Так в наружной кортикальной пластинке показатель микротвердости снизился до
54,4±1,8 кг/мм2 (в контроле 59,2±1,0 кг/мм2), в губчатом
веществе удерживался в пределах контрольных значений - 59,4±1,8 кг/мм2
(в контроле 61,2±1,2 кг/мм2). Более заметно изменение показателя
микротвердости во внутренней кортикальной пластинке, который снизился до
59,2±1,3 кг/мм2 (в интактной кости - 67,1±1,0 кг/мм2).
Таблица 4. Показатели твердости трубчатых костей, (М ± m), кг/мм2
|
Зона (ткань) трубчатой кости
|
В зоне раневого канала
|
На отдалении 10 см
|
|
Контроль
|
Опыт
|
Контроль
|
Опыт
|
|
Наружная кортикальная
пластинка
|
51,5 ± 1,3
|
59,2 ± 1,0*
|
59,2 ± 1,0
|
54,4 ± 1,8
|
|
Зона, прилегающая к
раневому каналу (губчатое вещество)
|
50,7 ± 0,9
|
61,2 ± 1,2*
|
61,2 ± 1,2
|
59,4 ± 1,8
|
|
Внутренняя кортикальная
пластинка
|
57,2 ± 0,8
|
67,1 ± 1,0*
|
67,1 ± 1,0
|
59,2 ± 1,3
|
Примечание:
* - достоверно для р < 0,05 относительно контрольной группы.
В итоге, в зоне раневого канала компактное вещество трубчатых костей
разупрочняется достаточно равномерно во всех анатомических зонах. Однако на
отдалении от раневого канала разупрочняющее действие ударной волны
распространяется преимущественно по кортикальным пластинкам.
В целом анализ данных, полученных при выполнении данного этапа
исследования огнестрельных переломов, показал, что костная ткань, в зависимости
от её структурных и микромеханических свойств, при воздействии огнестрельного
ранящего снаряда разрушается по-разному.
Так, плоские кости черепа разрушаются преимущественно по вязкому типу с
образованием в большинстве случаев дырчатых переломов с ровными краями.
Основными механизмами разрушения костного матрикса при этом являются деформация
смещения пластов и его разрывы.
Разрушение трубчатых костей в области диафиза происходит преимущественно
по вязко-хрупкому типу с образованием оскольчатых переломов. Здесь основными
механизмами разрушения являются трещины, разрывы, лакунарно-кавернозные
деформации, а также гомогенизация и уплотнение костного матрикса в области
канальцевых мембран.
При этом был выявлен и общий механизм разрушения обоих
структурно-анатомических типов кости - пористая трансформация костного матрикса
с формированием нано-, мезо- и микропор. Под воздействием факторов
огнестрельных ранящих снарядов, как в плоских, так и в трубчатых костях,
происходит аморфизация гидроксиапатита, что проявляется, прежде всего, в
уменьшении размеров его нанокристаллов. Наряду с этим проведение
рентген-структурного анализа показало увеличение напряженности в
кристаллической решетке апатита.
Немаловажным явилось выявление того факта, что все патологические
деформации костного матрикса анатомически не были связаны с системой костных
канальцев и преимущественно располагались непосредственно на территории
костного матрикса. Этот топологический фактор указывает на то, что разрушение
происходит не только за счёт прямого аэро- и гидродинамического удара.
Вероятно, когда при огнестрельной травме под действием энергии бокового удара
формируется временная пульсирующая полость, происходят фазовые переходы
матриксной воды, изменяется степень её упорядоченности. При этом появляется так
называемый расклинивающий эффект и утрачиваются свойства воды, необходимые для
поддержания нормального течения всех процессов жизнедеятельности костной ткани.
В целом, предложенный системный методологический подход, опирающийся на
активное использование современных исследовательских нанотехнологий, позволил
получить принципиально новые данные о тонких структурных механизмах разрушения
костной ткани при действии факторов огнестрельного ранящего снаряда, которые не
были изучены ранее.
ГЛАВА 4. ВЛИЯНИЕ РАНЕЛАТА СТРОНЦИЯ НА СТРУКТУРУ КОСТНОГО МАТРИКСА ПРИ
КОНСОЛИДАЦИИ ОГНЕСТРЕЛЬНЫХ ПЕРЕЛОМОВ ДЛИННЫХ ТРУБЧАТЫХ КОСТЕЙ КОНЕЧНОСТЕЙ
4.1 Обоснование выбора модели для исследования
влияния стронция ранелата на структуру костного матрикса при консолидации
огнестрельных переломов длинных трубчатых костей конечностей
4.1.1 Обоснование применения стронция ранелата
Согласно представленным в предыдущих главах диссертации результатам,
основным физико-химическим эффектом разрушающего действия ударной волны на
костную ткань является аморфизация гидроксиапатита. Это подтверждается, прежде
всего, данными рентген-структурного анализа, в соответствии с которыми как в
зоне раневого канала, так и в пределах его ближайшего окружения (зона
«молекулярного сотрясения»), в костном матриксе появляются рентгенаморфные
частицы гидроксиапатита - доля аморфной фазы ГАП увеличивается практически в 2
раза (с 8 до 20%). Кроме того, по данным атомно-силовой микроскопии в
интерстициальных щелях костного матрикса в зоне «молекулярного сотрясения»
появляются аморфные частицы с высоким уровнем адгезионных сил и морфологически
отличающиеся двойными контурами. Это свидетельствует об утолщении гидратной
оболочки вокруг кристаллов гидроксиапатита и в целом о чрезмерной гидратации
костного матрикса. Учитывая эти обстоятельства, появляется мотив препятствовать
аморфизации гидроксиапатита путём направленного упрочнения кристаллической
решетки гидроксиапатита с помощью химических веществ (Glimcher M.C. et
al.,1981).
В данном случае, таким наиболее подходящим способом химического
упрочнения является внедрение в формирующиеся кристаллы гидроксиапатита атомов
стронция. Стронций, как и кальций, является элементом главной группы второй
подгруппы периодической системы и, как и кальций содержит в наружном слое атома
2 электрона, которые и способен отдавать. Необходимо отметить, что атомы
стронция несколько больше атомов кальция (0,215 и 0,197 нм соответственно),
что, с одной стороны, предопределяет похожее их поведение в физиологической
среде - стронций легко встраивается вместо кальция в формирующуюся
кристаллическую решетку гидроксиапатита, а с другой - уже на ранних стадиях
формирования ГАП может способствовать более быстрому оформлению его катионной
подрешетки. Под воздействием атомов стронция в наночастицах гидроксиапатита уже
на ранних стадиях появляется огранённость, а сам кристалл по своим механическим
свойствам становится более прочным. На органических носителях, таких как
ранеловая кислота, стронций легко попадает в цитоплазму остеобластов, где
ранеловая кислота под воздействием липаз сбрасывается и высвобождающийся
ионизированный стронций проникает в микровезикулы эндоплазматического
ретикулума, где осуществляются начальные реакции кристаллизации химических
прекурсоров гидроксиапатита (Глинка Н.Л., 1967; Скоблин А.П., Белоус A.M.,
1968; Егоров- Фадеева В.И., с соавт., 2001; Тисменко Ю.К., 2005; Беневоленская
Л.И., 2007).
4.1.2 Обоснование модели огнестрельного перелома
длинных трубчатых костей конечностей
На этапе планирования эксперимента, помимо выбора метода лечения и
лекарственных препаратов, была поставлена цель разработки стандартной модели
огнестрельного перелома на лабораторных животных, отличающейся технической
доступностью нанесения ранения в эксперименте, простотой её воспроизведения в
серии опытов и стабильностью основных параметров, принятых в раневой баллистике
в качестве контрольных.
В данном случае, основными факторами выбора для создания «стандартной»
модели огнестрельного перелома, явились постоянство баллистических
характеристик ранящего снаряда, возможность нанесения ранения необходимой
тяжести и локализации, а также удобство биообъектов для выполнения
хирургического и терапевтического этапов лечения.
В настоящее время в исследованиях по боевой травме и раневой баллистике
уделяется значительное внимание оценке различных подходов к экспериментальному
воспроизведению в лабораторных условиях реальных (или близких по характеру к
боевым) огнестрельных ранений. Успешное решение этой проблемы зависит от
правильного выбора подопытного животного, оружия и ранящего снаряда, а также от
баллистически обоснованной методики постановки эксперимента (Штейнле А.В.,
Алябьев Ф.В., Дудузинский К.Ю., 2008).
Одним из направлений научной составляющей военно-полевой хирургии
является изучение в эксперименте общебиологических проблем и патофизиологии
раневого процесса, эффективности различных методов лечения огнестрельных ран и
коррекции их клинических, биохимических и морфофункциональных проявлений. Для
этого необходимы особые условия в постановке опытов, методике нанесения ранений
и выборе объектов исследования. Здесь определяющим является не сам объем
огнестрельного повреждения, а данные о биологической сущности раневого
процесса, особенностях его течения под влиянием различных гомеостатических и
лечебных факторов. При этом в обязательном порядке должно учитываться такое
условие, как получение статистически выверенных данных.
В связи с этим для получения репрезентативных данных (особенно при
изучении новых методов лечения огнестрельных ран) предпочтение отдается крупным
лабораторным животным, таким как крупные собаки, овцы и свиньи. В качестве
места для нанесения типового огнестрельного перелома обычно выбирается средняя
треть голени одной из задних конечностей ввиду наличия там приемлемого объёма
мягкотканых образований и удобства выполнения хирургического этапа лечения и
ухода за раной в послеоперационном периоде.
Необходимо отметить, что за всю историю раневой баллистики в качестве
биологических объектов находили применение трупы людей (биоманекены) и
животных, живые лошади, телята, быки, козы, овцы, собаки и такие мелкие
подопытные животные, как кошки и кролики (Shantz B., 1979; Ragsdale B.D.,
Josselson A., 1988).
Однако для проведения объёмных и длительных медико-биологических
экспериментов необходимы лабораторные животные, которые без агрессии могут
переносить проведение послеоперационного лечения, удобны для наблюдения и
контроля, послушны, относительно недороги, а главное, при лечении которых
возможно использование стандартных хирургических методик, инструментов,
оборудования и аппаратов. В настоящее время в экспериментах, связанных с
исследованием опорно-двигательного аппарата такими подопытными животными, по
мнению многих исследователей, являются овцы пород средних размеров. Это
обусловлено как удобством моделирования огнестрельных и неогнестрельных
переломов с проведением оперативного пособия с возможностью иммобилизации
штатными аппаратами и инструментами, так и более приемлемой, в сравнении со
свиньями, стоимостью и удобством содержания. Немаловажной в данном случае
является и этическая сторона вопроса, ввиду того, что овцы, в отличие от собак,
являются сельскохозяйственными животными (Штейнле А.В., Алябьев Ф.В.,
Дудузинский К.Ю., 2008).
По нашему мнению, в настоящее время оптимальным биообъектом для такого
рода исследований могут явиться половозрелые бараны-самцы породы «Советский
меринос» массой 55-60 кг без признаков повреждений и заболеваний.
Достаточно сложным и не до конца решенным является вопрос о выборе
оптимального оружия. Совершенно очевидно, что для моделирования боевой травмы
наиболее приемлемо применение именно боевого оружия и штатных боеприпасов с
известными боевыми характеристиками и необходимой для формирования всех зон
огнестрельной раны скоростью и энергией.
В нашем эксперименте для нанесения биообъектам огнестрельного перелома
был выбран 7,62 мм карабин СКС со стандартной пулей патрона обр. 1943 г.
Выбор данного оружия и ранящего снаряда был обусловлен тем, что 7,62 мм
карабин СКС является штатным боевым длинноствольным оружием со стандартными
баллистическими характеристиками, обладающим необходимой для лабораторных
опытов кучностью стрельбы. При выборе ранящего снаряда мы остановились на
промежуточной 7,62 мм пуле патрона 1943 г. с плакированной тампаком стальной
оболочкой и стальным сердечником, получившим современный индекс 57Н231. Данная
пуля является высокоскоростной (при выстреле из СКС её начальная скорость
составляет 735 м/с) и обладает массой 7,9 г и длиной 26,5 мм, что обуславливает
высокую кинетическую энергию ранящего снаряда, достаточную для нанесения
биообъекту высокоэнергетического ранения. Однако, благодаря прочности пули и
стабильности её полёта, данный вид оружия не наносит чрезмерных разрушений
кости и мягких тканей, что зачастую наблюдается при использовании
высокоскоростных малокалиберных пуль современного боевого стрелкового оружия
типа АК-74 и М-16 (Эйдлин Л.М., 1963; Жук А.Б., 1993; Озерецковский Л.Б., 1989;
Озерецковский Л.Б., Гуманенко Е.К., Бояринцев В.В., 2006).
В целом, можно отметить, что степень и характер повреждения кости у
лабораторных животных в проведённом нами эксперименте были сопоставимы с
данными, полученными Озерецковским Л.Б. (1989) в эксперименте по моделированию
огнестрельного перелома плеча на человеческих трупных конечностях (табл. 5).
Таблица 5. Характеристика огнестрельных переломов трупных человеческих
конечностей и большеберцовой кости барана в эксперименте
|
Ранящий снаряд
|
Объект исследования
|
Количество опытов
|
Дальность стрельбы, м
|
Размеры ран на коже
|
Объём повреждения кости
|
|
|
|
|
Входное отверстие
|
Выходное отверстие
|
Дефект кости, см
|
Длина трещин, см
|
|
7,62 мм пуля обр. 43 г.
|
Плечевая кость трупной
человеческой конечности (по данным Озерецковского Л.Б.)
|
3
|
10
|
0,5х0,6
|
0,9х1,2
|
3,5±0,8
|
8,3±0,7
|
|
Бедренная кость трупной
человеческой конечности (по данным Озерецковского Л.Б.)
|
3
|
10
|
0,7х0,8
|
5,0х7,5
|
3,0х0,8
|
13,2х0,9
|
|
Большеберцовая кость барана
(по данным настоящего эксперимента)
|
10
|
10
|
0,6х0,6
|
2,0х1,5
|
3,5±0,5
|
8,0±0,5
|
Из представленных в таблице данных видно, что при использовании в
качестве ранящего снаряда 7,62 мм пули обр. 43 г., диаметр входных и выходных
отверстий на коже, а также размер дефекта огнестрельного перелома
большеберцовой кости задней конечности барана схожи с таковыми, полученными при
моделировании огнестрельного перелома плечевой кости трупной человеческой
конечности, и, таким образом, данная модель может быть использована как
адекватная для проведения экспериментальных исследований по разработке и
совершенствованию методов диагностики и лечения огнестрельных переломов
конечностей.
4.2 Методика проведения эксперимента на
биообъектах
Учитывая факт того, что проведённые на предыдущем этапе исследования
показали, что основным механизмом разрушения костного матрикса при
огнестрельном переломе является его остеопорозоподобная трансформация в зоне
«молекулярного сотрясения», в основе которой лежит аморфизация кристаллов
гидроксиапатита, что позволило теоретически обосновать возможность направленной
химической коррекции данного патологического процесса, было принято решение о
проведении второго этапа экспериментальных исследований с использованием
лабораторных животных. Данный этап включал в себя нанесение огнестрельного
перелома диафиза правой большеберцовой кости, первичную хирургическую обработку
перелома и наложение аппарата внеочаговой внешней фиксации с последующим
лечением 1 группы животных по стандартной схеме, а другой - с добавлением к
общепринятому комплексному лечению стронция ранелата в дозе 1 гр. в сутки.
Животных выводили из эксперимента на 14-е, 30-е и 60-е сутки лечения с забором
костных образцов для оценки характера изменения тонкой структуры кости.
Эксперимент был выполнен на баранах-самцах породы «Советский меринос»
массой 50-57 кг без признаков повреждений и заболеваний.
Всего в эксперименте было задействовано 12 животных (баранов). При этом
контрольная группа, созданная для забора как интактных, так и образцов из
области огнестрельного перелома в остром опыте, составила 2 животных.
Во время проведения эксперимента проводились общеклинические,
макроскопические, рентгенологические, микробиологические исследования. После
вывода животных из эксперимента полученные костные образцы были подвергнуты
гистологическим, электронно-микроскопическим (сканирующая электронная и
атомно-силовая микроскопия) исследованиям, рентген-структурному анализу,
микротвердометрии и денситометрии.
Проведение эксперимента осуществлялось в соответствии с «Правилами
проведения работ с использованием экспериментальных животных», введённых в
действие Приказом Министра Здравоохранения СССР № 755 от 12.08.1977 г.,
«Правилами проведения научных исследований с использованием экспериментальных
животных» (Распоряжение Президиума АН СССР № 120002496 от 02.04.1980 г.),
«Правилами проведения качественных клинических испытаний в Российской
Федерации», утверждённых МЗ РФ 29.12.98 г., «Рекомендациями комитетам по этике,
проводящим экспертизу биомедицинских исследований» (ВОЗ, 2000 г.) и
«Директивами Европейского сообщества» (86-609 ЕЕС).
Перед нанесением огнестрельной травмы животных вводили в наркоз путём
внутримышечного введения раствора Золетил 100 в дозе 10 мг/кг, что обеспечивало
эффект около 2 часов. Глубина наркоза контролировалась по выраженности
роговичных рефлексов и тонусу скелетных мышц.
После достижения необходимой глубины наркоза и внешнего осмотра животные
закреплялись в специально сконструированном станке в физиологическом положении
на стрелковой трассе. Крепление животных осуществлялось матерчатыми лямками за
рога и живот с опорой на 3 конечности и отведением задней левой конечности
кзади.
Достигнутое положение позволяло передвигать животное вместе со станком,
надёжно крепить датчики измерительной аппаратуры, обеспечивало оптимальный
доступ для стрельбы и оказания неотложных мероприятий медицинской помощи, а также
не вызывало у животного выраженных патологических изменений со стороны
сердечнососудистой и дыхательной систем.
После выполнения всех подготовительных мероприятий в специальном
помещении для отстрела наносили ранение из 7,62 мм карабина СКС пулей патрона
обр. 1943 г. с расстояния 5 метров. Точкой прицеливания на голени являлась
середина линии - проекции большеберцовой кости на внутренней поверхности правой
голени, направление полета пули - изнутри-кнаружи. Данное направление
траектории полёта пули диктовалось стремлением нанести минимальную травму
сосудисто-нервному пучку для недопущения профузного артериального кровотечения
и последующих нейротрофических расстройств. Для более точного определения точки
прицеливания перед выстрелом в области планируемой раны выполнялось бинтование
голени марлевым бинтом. Для максимального приближения условий ранения к
реальным, выбривания и антисептической обработки конечности не выполнялось.
Сразу же после ранения, проведя макроскопическую оценку области ранения,
накладывали кровоостанавливающую повязку (или жгут - при необходимости),
выбривали и обрабатывали повреждённую конечность антисептиками и, через 30-40
минут, выполняли первичную хирургическую обработку ран (ПХО) в «щадящем»
режиме.
Объём ПХО огнестрельных переломов у животных состоял в рассечении
входного и выходного отверстий, фасциотомии и удалении некротизированных мягких
тканей, удалении свободнолежащих, лишенных связи с надкостницей и мышцами
костных осколков посредством вымывания их из раны струёй стерильного
физиологического раствора. Костные осколки, не потерявшие связи с мягкими
тканями, по возможности укладывались в материнское ложе и укрывались мягкими
тканями. В результате ПХО образовывались краевые дефекты большеберцовых костей,
которые не требовали выполнения операций по их замещению. С целью профилактики
развития гнойных осложнений производили паравульнарное обкалывание 60 мл 0,5 %
раствора новокаина с разведённым в нём 1 гр цефазолина. Раневой канал
дренировали ПВХ трубкой с отверстиями для промывания раны растворами
антисептиков в послеоперационном периоде.
Операцию заканчивали наложением на голень аппарата Илизарова с
формированием баз из двух полных и двух полуколец, чего было достаточно для
полноценной внеочаговой фиксации огнестрельного перелома.
Данная методика давала возможность контроля раны, выполнения полноценных
перевязок, а также мобильности животного и ранней его активизации с
дозированной опорой на повреждённую конечность.
В последующем каждому животному проводили анальгетическую и противовоспалительную
терапию (Кетанов по 2,0 внутримышечно 2 раза в сутки в течение 5 дней),
антибактериальную терапию (цефазолин 1,0 внутримышечно 2 раза в сутки в течение
10 суток), ежедневные перевязки с антибактериальными мазями на водной основе
(Левомеколь, Левосин). По закрытию ран и появлению признаков полноценной
консолидации перелома производили снятие аппарата внешней фиксации.
К вышеописанному лечению 5-ти животным второй опытной группы с третьего
дня эксперимента к рациону добавляли пероральное введение стронция ранелата (в
виде саше Бивалос) в дозе 1 грамм в сутки, который они получали вплоть до
вывода из эксперимента.
В дальнейшем, после гуманного вывода животных из эксперимента
производился забор образцов костной ткани от животных каждой группы через 14,
30 и 60 суток после получения огнестрельного перелома, с целью их дальнейшего
морфологического исследования.
4.3 Результаты собственных исследований
4.3.1 Результаты общеклинических исследований
В целом, анализируя данные общеклинических и физикальных методов
исследования, можно заключить, что, несмотря на полученную тяжелую травму (2
балла по шкале ВПХ-П (ОР), у животных не наблюдалось развития шока и
выраженного кровотечения. Тахикардия, достигающая 185-190 ударов в минуту уже
через 10-15 минут наблюдения купировалась до нормальных цифр ЧСС (75-80). В
последующем уже к концу первых суток наблюдения животные начинали
самостоятельно пить и принимать пищу, на 2-3-е сутки начинали вставать, сначала
щадя повреждённую конечность, а к 10-12 суткам - с опорой на неё. Течение
раневого процесса в целом было типично, выраженная экссудация из ран
прекращалась к концу 10-х суток, раны начинали гранулировать и, к концу 3-й
недели лечения закрывались путём вторичного натяжения. Жизнеугрожающие
последствия и осложнения были отмечены лишь у 2-х животных: в виде
незначительного артериального кровотечения из мышечных сосудов, которое было
остановлено путём перевязки кровоточащего сосуда при выполнении ПХО, и в виде
инфекционных осложнений, которые были купированы путём коррекции
антибиотикотерапии по результатам посевов.
4.3.2 Результаты лабораторных исследований
Результаты исследования биохимических показателей в сыворотке крови
экспериментальных животных
Исследование биохимических показателей сыворотки крови у экспериментальных
животных обеих опытных групп после нанесения огнестрельного перелома и в
процессе дальнейшего лечения показало как однотипность, так и различие по
некоторым биохимическим показателям сыворотки крови.
Однотипность в обеих опытных группах проявлялась в увеличении уровня
глюкозы на 18- 40 % через 1 час, а также на 3-е и 15-е сутки лечения и снижении
ее содержания на 30-53 % на10-е, 30-е и 60-е сутки; снижении содержания общих
липидов на 29-63сразу после воздействия, а также через 1 ч, 1-е, 30-е и 60-е
сутки наблюдения; увеличении уровня общего белка на 20-45 % сразу после
воздействия и на 10-е и 30-е сутки, а также снижении его на 15 % и 24 % на 1-е
и 60-е сутки наблюдения, соответственно; повышении содержания мочевой кислоты
на 12 % и 89 % на 3-е и 10-е и 15-е сутки, соответственно, и снижении её на
18-46 % сразу и через 1 ч после воздействия, а также на 30-е сутки лечения;
повышении активности аспартатаминотрансферазы (АСТ) на 57-168 % сразу и через 1
час после воздействия, и на 3-е и 10-е сутки лечения, а также в увеличении
активности аланинаминотрансферазы (АЛТ) на 48-259 % сразу, через 1 час и 60
суток после огнестрельного ранения. Что касается лактатдегидрогеназы (ЛДГ), то
ее активность в обеих группах была повышена на 38-273 %, начиная с первых суток
лечения, и нормализовалась лишь к концу 2-го месяца.
Но у животных получавших и не получавших в процессе лечения стронция
ранелат имелись и некоторые различия в биохимических показателях крови, а
именно в активности щелочной фосфатазы (ЩФ), концентрации ионов Са и Р,
интенсивности свободнорадикального окисления (СРО), а также в показателях
общеоксидазной активности (ООА), антиоксидазной активности (ОАА) и
антиоксидантной системы (АОС).
Так, после воздействия травмирующего фактора, в сыворотке крови у
баранов, не получавших препарат стронция, выявлялось достоверное увеличение
активности ЩФ на 21-85 % (кроме 1 и 30 сут), а также снижение активности
фермента на 35 % через 1 ч после воздействия. Применение препарата привело к
увеличению активности ЩФ на 95 % и 267 % на 15 и 10 сут наблюдения,
соответственно, а также снижению ее активности на 45-47 % сразу после
воздействия и на 1 сут обследования (рис. 27).
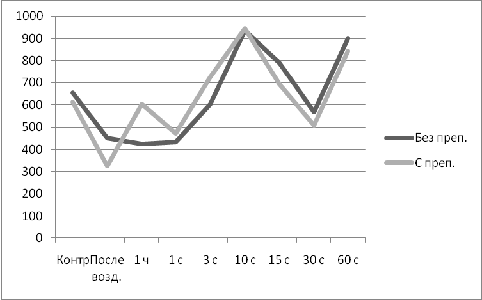
Рис. 27. Динамика активности ЩФ у животных обеих опытных групп
Концентрация ионов Ca у животных, не получавших препарат, была повышена
на 53 % сразу после воздействия травмирующего фактора, а в другие сроки
наблюдения (1 и 3 сут) - снижена на 18-20 %. У животных, принимавших препарат
«Бивалос», отмечалось аналогичное повышение Ca сразу после воздействия на 40 %
и на 37 % на 10 сут обследования (рис. 28).
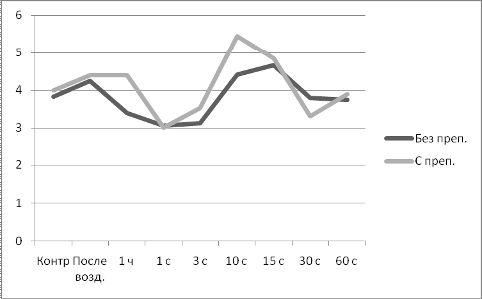
Рис. 28. Динамика содержания Са у животных обеих опытных групп
При этом уровень Р у животных, не получавших препарат, был снижен на
22-36 % до 1 сут наблюдения и повышен на 21-58 % с 15 сут обследования. У
животных на фоне применения препарата, наблюдалось достоверное снижение уровня
Р сразу после воздействия на 37 % и его повышение на 42-82 % с 10 по 30 сут
наблюдения (рис. 29).
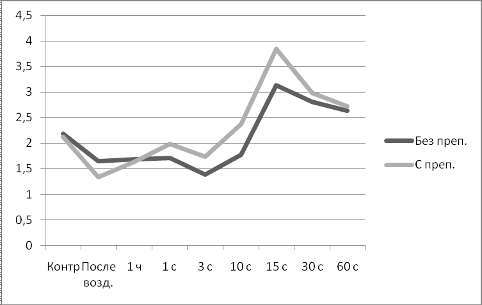
Рис. 29. Динамика содержания Р у животных обеих опытных групп
Интенсивность СРО по показателю хемилюминесценции (Imax/ОЛ) была
увеличена в сыворотке крови животных, не получавших препарат на 64-90 % (1 ч, 1
сут, 30 и 60 сут), а у животных на фоне приема препарата на 43-111 % (в ранние
сроки до 1 сут, на 30 и 60 сут) (рис. 30).
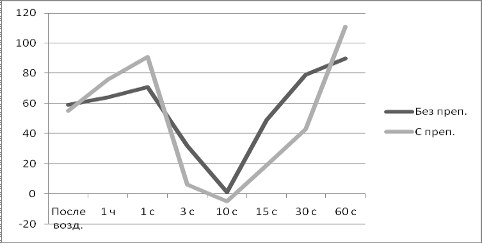
Рис. 30. Динамика интенсивности СРО у
животных обеих опытных групп
Аналогичным образом изменялась и активность АОС по показателю
хемилюминесценции (S/STmax/ОЛ). У животных, принимавших препарат, она была
повышена на 44-62 % (1 ч, 1 сут, 15 и 30 сут), а у животных на фоне приема
препарата - на 28-82 % кроме 3 и 60 сут обследования (рис. 31).
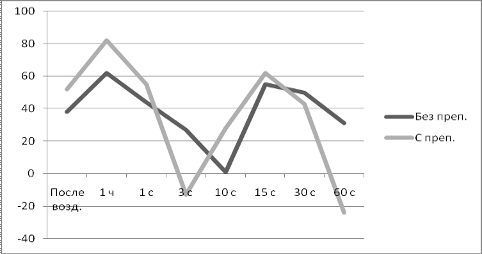
Рис. 31. Динамика уровня АОС у животных обеих опытных групп
Уровень ООА сыворотки крови у всех подопытных животных, не принимавших
препарат, был увеличен на 169-423 %, а у животных на фоне приема препарата - на
116-508 % (рис. 32).
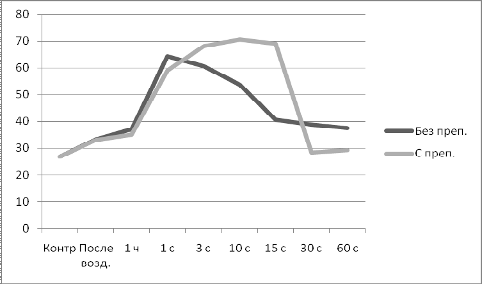
Рис. 32. Динамика уровня ООА у животных обеих опытных групп
При этом уровень ОАА сыворотки крови почти у всех подопытных животных, не
принимавших препарат, был также повышен на 13-65 % (кроме 10 суток), а у
животных, принимавших препарат, величина ОАА была увеличена на 30-100 % вплоть
до 15-х суток (рис. 33).

Рис. 33. Динамика уровня ОАА у
животных обеих опытных групп
Таким образом, в сыворотке крови животных получавших и не получавших
стронция ранелат в процессе лечения выявлялось в основном однотипное поведение
биохимических показателей за исключением повышения активности ЩФ и содержания
Са и Р, что вероятно связано со стимулирующим влиянием препарата на
интенсивность обменных процессов в костной ткани экспериментальных животных 2-й
опытной группы.
Результаты исследования показателей свертывающей системы крови
экспериментальных животных
После воздействия травмирующего фактора в плазме крови у баранов, не
получавших стронция ранелат, выявлялось достоверное увеличение АЧТВ на 65-108 %
(сразу и через 1 ч после воздействия), а также его снижение на 29-48 % (1 сут,
30 и 60 сут). Применение препарата приводило к аналогичному увеличению АЧТВ на
83-92 % (сразу и через 1 ч после воздействия) и снижению данного показателя на
26-65 % с 3 сут наблюдения (рис. 34).
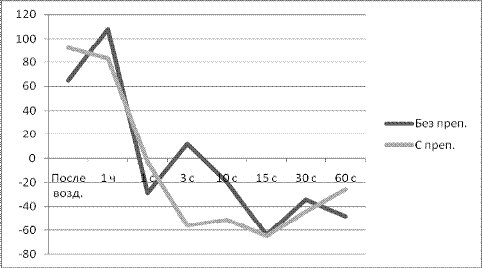
Рис. 34. Динамика АЧТВ у животных обеих опытных групп
Отмечалось увеличение ПВ на 55-130 % во все сроки наблюдения, кроме 3
сут, 15 и 60 сут в плазме крови подопытных животных, не получавших препарат. У
баранов на фоне применения препарата наблюдалось аналогичное повышение ПВ на
48-134 % в те же периоды обследования (рис. 35).

Рис. 35. Динамика ПВ у животных обеих
опытных групп
У экспериментальных животных, не получавших препарат стронция, выявлялось
достоверное снижение ТВ на 42-73 % до 3 сут наблюдения, а у животных,
получавших препарат, снижение данного показателя определялось до 30 сут
наблюдения на 25-64 % (рис. 36).
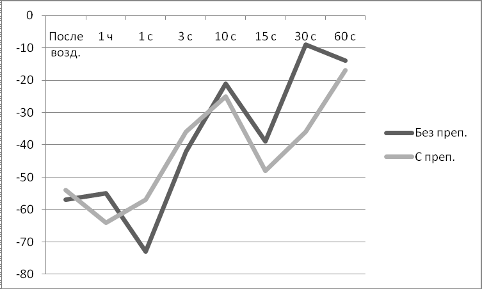
Рис. 36. Динамика ТВ у животных обеих опытных групп
Содержание фибриногена у животных, лечившихся по классической схеме, было
повышено на 134-288 % через 1 ч и первые сутки после воздействия. Наблюдалось
также снижение содержания фибриногена у животных, не принимавших препарат, на
30 сутки наблюдения на 45 %. На фоне применения препарата уровень фибриногена
был повышен на 62-200 % в те же сроки наблюдения, а также на 15 сут
обследования (рис. 37).

Рис. 37. Динамика содержания фибриногена у животных обеих опытных групп
Следовательно, при исследовании данных коагулограммы выявлены наиболее
выраженные различия показателей свертывающей системы крови, у животных, получавших
и не получавших стронция ранелат: на 3 сутки наблюдения (АЧТВ), 10 сутки (АЧТВ,
фибриноген), 15 сутки (ПВ, фибриноген), 30 сутки (ТВ, фибриноген) и 60 сутки
(ПВ, ТВ). Однако выраженного повышения свёртываемости крови у животных 2-й
группы по сравнению с 1-й не наблюдалось.
Таким образом, анализ лабораторных данных, полученных в эксперименте, не
выявил выраженного патологического влияния стронция ранелата на систему крови
экспериментальных животных и на их клиническое состояние в целом. Однако отмечалось
стимулирующее влияние препарата на остеорепаративные процессы. Необходимо
отметить, что в целом различие показателей у животных обеих опытных групп было
либо незначительным, либо самостоятельно нивелировалось в процессе лечения, что
не требовало проведения дополнительных лечебно-профилактических мероприятий.
4.3.3 Результаты микробиологического
исследования
Общие результаты посевов отделяемого из ран экспериментальных животных
представлены в таблице 6.
Таблица 6 Результаты микробиологического исследования отделяемого из ран
экспериментальных животных
Дата забора
|
№ пробы
|
Антибиотик
|
Название микроорганизма
|
Число КОЕ/мл
|
Чувствительность к
антибиотикам
|
|
|
|
|
|
|
ампициллин
|
амоксиклав
|
амикацин
|
гентамицин
|
полимиксин
|
цефазолин
|
цефатоксим
|
доксициклин
|
ЦФ
|
|
3
|
26.01
|
3-1
|
ЦЗ
|
E.faecalis
|
10*5
|
S
|
S
|
R
|
R
|
R
|
R
|
R
|
S
|
S
|
|
4
|
26.01
|
4-1
|
ЦЗ
|
E.faecalis
|
10*5
|
S
|
S
|
R
|
R
|
R
|
R
|
R
|
S
|
S
|
|
5
|
26.01
|
5-1
|
ЦЗ
|
Роста нет
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
01.02
|
5-2
|
-
|
Bacillus sp.
|
10*3
|
R
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
|
|
|
|
Staph. epiderm.
|
10*4
|
R
|
S
|
S
|
S
|
R
|
S
|
-
|
S
|
S
|
|
6
|
26.01
|
6-1
|
ЦЗ
|
Роста нет
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
01.02
|
6-2
|
-
|
E.faecalis
|
10*4
|
R
|
S
|
S
|
R
|
R
|
R
|
R
|
S
|
S
|
|
7
|
26.01
|
7-1
|
ЦЗ
|
E.coli
|
10*6
|
I
|
I
|
S
|
S
|
S
|
R
|
S
|
I
|
S
|
|
|
|
|
E.faecalis
|
10*6
|
S
|
S
|
R
|
R
|
R
|
-
|
-
|
S
|
S
|
|
|
7-2
|
|
Enterobacter sp.
|
10*6
|
R
|
R
|
S
|
S
|
S
|
R
|
S
|
I
|
S
|
|
01.02
|
7-3
|
ОТ АМ
|
E.coli
|
10*2
|
S
|
S
|
R
|
R
|
S
|
R
|
S
|
I
|
S
|
|
|
|
|
Staph. epiderm.
|
10*4
|
R
|
R
|
S
|
S
|
R
|
S
|
-
|
R
|
S
|
|
8
|
26.01
|
8-1
|
ЦЗ
|
Bacillus sp.
|
10*3
|
S
|
S
|
S
|
S
|
R
|
S
|
S
|
S
|
S
|
|
|
8-2
|
|
Bacillus sp.
|
10*6
|
R
|
R
|
S
|
S
|
R
|
R
|
R
|
I
|
S
|
|
|
|
|
E.faecalis
|
10*6
|
S
|
S
|
R
|
R
|
R
|
R
|
R
|
S
|
I
|
|
01.02
|
8-3
|
-
|
Staph. epiderm.
|
10*4
|
S
|
S
|
S
|
S
|
R
|
S
|
S
|
S
|
S
|
|
|
|
|
E.faecalis
|
10*4
|
S
|
S
|
R
|
R
|
R
|
R
|
R
|
S
|
S
|
|
|
8-4
|
-
|
Bacillus sp.
|
10*3
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
|
|
|
|
E.faecalis
|
10*5
|
S
|
S
|
R
|
R
|
R
|
R
|
R
|
S
|
S
|
|
9
|
26.01
|
9-1
|
ЦЗ
|
E.faecalis
|
10*5
|
S
|
S
|
R
|
R
|
R
|
R
|
R
|
S
|
S
|
|
|
|
|
Staph. epiderm.
|
10*3
|
S
|
S
|
S
|
S
|
R
|
S
|
S
|
S
|
S
|
|
01.02
|
9-2
|
-
|
Staph. epiderm.
|
10*3
|
R
|
S
|
S
|
S
|
R
|
S
|
-
|
S
|
S
|
|
|
|
|
E.faecalis
|
10*4
|
S
|
S
|
R
|
R
|
R
|
R
|
R
|
S
|
S
|
|
10
|
26.01
|
10-1
|
ЦЗ
|
Staph. epiderm.
|
10*3
|
S
|
S
|
S
|
S
|
R
|
S
|
S
|
S
|
S
|
|
|
|
|
E.faecalis
|
10*5
|
S
|
S
|
R
|
R
|
R
|
R
|
R
|
S
|
S
|
|
01.02
|
10-2
|
-
|
E.faecalis
|
10*5
|
S
|
S
|
R
|
R
|
R
|
R
|
S
|
S
|
|
11
|
26.01
|
11-1
|
ЦЗ
|
Роста нет
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
01.02
|
11-2
|
-
|
E. faecium
|
10*5
|
R
|
R
|
R
|
R
|
R
|
R
|
R
|
R
|
R
|
|
12
|
26.01
|
12-1
|
ЦЗ
|
E. faecium
|
10*5
|
R
|
R
|
R
|
R
|
R
|
R
|
R
|
R
|
R
|
|
|
|
|
E.faecalis
|
10*5
|
S
|
S
|
R
|
R
|
R
|
R
|
R
|
R
|
R
|
|
01.02
|
12-2
|
-
|
Роста нет
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
Примечание. S - чувствительный; R - резистентный; I - промежуточный.
АМ - амикацин; ЦФ - ципрофлоксацин; ЦЗ - цефазолин; ОТ - оритаксим.
Анализ данных, полученных при микробиологических исследованиях
отделяемого из ран экспериментальных животных, проведённых как на фоне
антибиотикотерапии цефазолином (забор проб 26.01.10г.), так и после её
окончания (забор проб 01.02.10г.), показал, что в значимых титрах были высеяны
следующие микроорганизмы: Enterococus faecalis, Enterococus faecium, Bacillus
sp., Staphilococus epidermalis, Escherichia coli, Enterobacter sp.,
Corynebacterium, при этом, признаки раневой инфекции определялись лишь при
титре, превышающем 105. Анализируя бактериограмму животного № 7, у
которого развились выраженные признаки раневой инфекции, можно заметить, что
возбудителем данной инфекции явилась, скорее всего, ассоциация Escherichia coli
и Corynebacterium, которая не встречалась у остальных животных. Немаловажным
является и то, что появление в ране штаммов Enterococus faecalis, Enterococus
faecium, Bacillus sp., Staphylococcus epidermalis даже в титрах превышающих
10*5, не приводило к развитию клинически значимого инфекционного процесса, а
раны заживали вторичным натяжением на фоне местного лечения без использования
дополнительных антибиотиков. В целом, можно сделать вывод, что бараны обладают
оптимальной для лабораторных животных противоинфекционной резистентностью, и
для профилактики инфекционных осложнений огнестрельного ранения вполне
адекватным является соблюдение основных принципов асептики и антисептики,
выполнение адекватной ПХО с применением местного лечения и недорогостоящей антибиотикотерапии
(Цефазолин в дозе 1,0 2 раза в сутки внутримышечно).
Таким образом, в виду технической доступности, простоты воспроизведения
ранения, а также стабильности основных параметров, можно рекомендовать данную
модель огнестрельного перелома для проведения экспериментальных исследований в
этой области.
4.3.4 Результаты рентгенологического
исследования
Данные динамического рентгенографического исследования показали, что, в
целом, консолидация огнестрельных переломов протекала однотипно в обеих опытных
группах. После проведения ПХО и наложения аппарата Илизарова с последующим
местным и общим лечением, первые признаки формирования костной мозоли
появляются к началу третьей недели после перелома, а образование плотной
костной мозоли, достаточной для восстановления опорной функции конечности без
дополнительной иммобилизации, наступало к концу 2-го месяца лечения, при
условии отсутствия осложнений.
Однако имели место и некоторые отличия между качеством консолидации
перелома у животных, получавших традиционное лечение, и животных, к рациону
которых был добавлен стронция ранелат.
Так, сравнивая рентгеновские снимки животных, получивших однотипные
огнестрельные оскольчатые переломы средней трети диафизов большеберцовых костей
задней правой конечности (рис. 38),
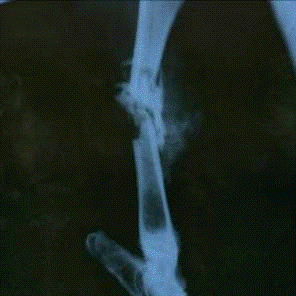
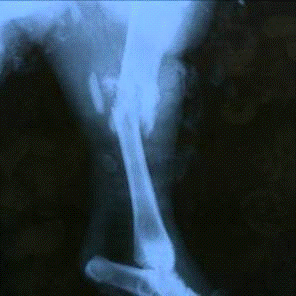
Рис. 38. Огнестрельные оскольчатые переломы средней трети диафизов
большеберцовых костей задней правой конечности биообъектов
в динамике, можно сделать вывод, что уже на 10-е сутки начинает
прослеживаться формирование соединительнотканной мозоли, причём при применении
стронция ранелата её плотность была несколько выше (рис. 39).
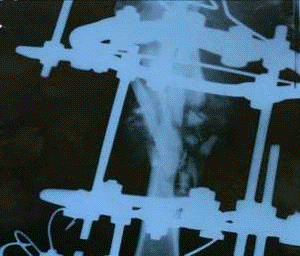

А Б
Рис. 39. Рентгенография голени на 15-е сутки после огнестрельного
перелома.
А - со стандартной схемой лечения; Б - с добавлением стронция ранелата
При поведении исследования на 30-е сутки лечения наблюдается формирование
периостальной и эндостальной костной мозоли, с более выраженной оссификацией у
животных второй - опытной группы (рис. 40).


А Б
Рис. 40. Рентгенография голени на 30-е сутки после огнестрельного
перелома.
А - со стандартной схемой лечения; Б - с добавлением стронция ранелата
На рентгенограммах, сделанных на 60-е сутки по снятии аппаратов внешней
фиксации, видно, что у животных обеих групп произошло формирование полноценной
костной мозоли с консолидацией, достаточной для выполнения опорной функции
конечности без дополнительной иммобилизации, однако у животных 2-й (опытной)
группы качество сформировавшейся костной мозоли имеет более высокие показатели
(рис. 41).
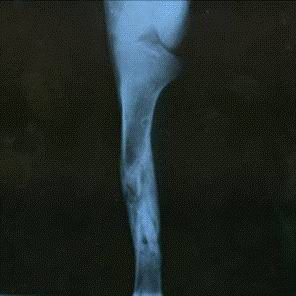

А
Б
Рис. 41. Рентгенография голени на 60-е сутки после огнестрельного
перелома.
А - со стандартной схемой лечения; Б
- с добавлением стронция ранелата
Результаты денситометрии
Данные денситометрии, полученные с помощью выполнения двухэнергетической
костной абсорбциометрии области регенератов, свидетельствуют о более высоких
показателях МПКТ у животных второй - опытной группы (р < 0,05), получавших
наряду с общепринятым лечением, стронция ранелат в дозе 1 гр в сутки (рис. 48).
Необходимо отметить, что исходные показатели МПКТ диафиза большеберцовой кости
у баранов были выше на 1015%, чем у человека и составили в среднем 1, 567±0,043
г/см2, что необходимо учитывать при анализе и интерпретации
экспериментальных данных. У 25-летнего мужчины этот показатель в норме
составляет в среднем 1,363 г/см2 (Свешников К.А., 2009).
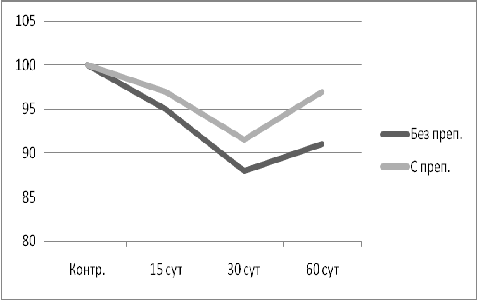
Рис. 42. Динамика МПКТ у животных обеих групп (%)
Как видно из вышеприведённого графика, в обеих группах отмечалось
развитие остеопороза со снижением минерализации до 5%, но у животных 2-й
(опытной) группы, получавших препарат стронция, уже на 15-е сутки наблюдалось
повышение показателей МПКТ до 2 %.
На 30-е сутки разница в МПКТ между группами составила 3,5%. Также
выявляется прогрессирование посттравматического остеопороза - общие показатели
МПКТ снизились в среднем на 12 %.
К 60-м суткам данные денситометрии показали, что на фоне некоторой
регрессии остеопоротических явлений (МПКТ опытных образцов на 9 % ниже по
сравнению с интактными), определяется более выраженная минерализация у животных
2-й опытной группы (до 6 %).
Таким образом, выполненные рентгенологические исследования показали, что
применение стронция ранелата в лечении огнестрельных переломов оказывает
благоприятное воздействие на остеорепаративные процессы путём упрочнения
костного матрикса регенерата, что подтверждается улучшением количественных
показателей минеральной фазы костного матрикса (МПКТ).
4.3.5 Результаты морфологических исследований
влияния ранелата стронция на структуру костной ткани в периоде
посттравматической регенерации
Исследование регенератов области огнестрельного перелома с применением
гистологических методов исследования
Гистологическое исследование препаратов костных образцов области
регенератов огнестрельных переломов диафизов большеберцовых костей баранов
показало, что в целом остеорепаративная картина здесь соответствует картине,
выявленной при регенерации переломов костей у других видов млекопитающих. На
рисунке 43 представлены фотографии препаратов костных образцов диафиза
интактной большеберцовой кости барана, окрашенных гематоксилином и эозином по
стандартной схеме.
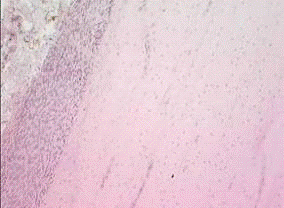
А Б
Рис. 43. Диафиз интактной большеберцовой кости барана, гематоксилин и
эозин. А - увеличение х100; Б - увеличение - х400
При исследовании костных образцов после нанесения экспериментальным
животным огнестрельного перелома выявлялось, что уже через 6 часов с момента
травмы в зоне огнестрельного перелома обнаруживаются признаки клеточного
повреждения в виде массивной гибели костных клеток с пикнозом их ядер (рис.
44).

А Б
Рис. 44. Зона огнестрельного перелома через 6 часов после ранения.
Гематоксилин и эозин. А - увеличение х100; Б - увеличение х400
На 14-е сутки зона повреждения была преимущественно замещена рубцующейся
грануляционной тканью, в которой определялись небольшие участки
некротизированной костной ткани, окружённые остеокластами. В прилежащей костной
ткани выявлялись костные балки, окружённые большим количеством остеобластов,
разделенные широкими лакунами (рис. 45, 46).
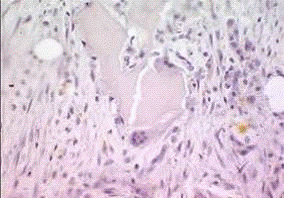
А
Б
Рис. 45. Область регенерата на 14-е
сутки лечения по стандартной схеме. Гематоксилин и эозин. А - увеличение х100;
Б - увеличение х400
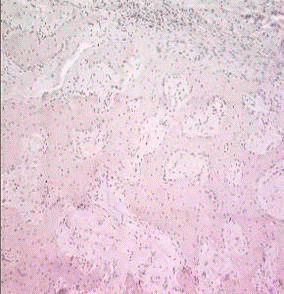
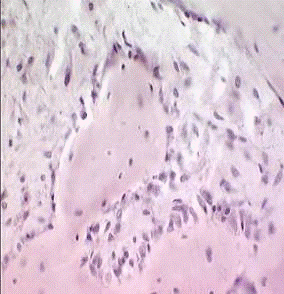
А
Б
Рис. 46. Область регенерата на 14-е сутки лечения с добавлением стронция
ранелата. Гематоксилин и эозин. А - увеличение х100; Б - увеличение х400
На 30-е сутки в зоне повреждения обнаруживалась плотная рубцовая ткань
без воспалительных клеток. Отмечалось увеличение объёма костных балок и
неравномерное уменьшение объёма лакун между ними, а также изменение
микроархитектоники в виде расширения каналов остеонов, вдоль стенок которых
располагались активные остеокласты и макрофаги. В регенерате со стороны эндоста
преобладала грубоволокнистая соединительная ткань с разупорядоченным
расположением коллагеновых волокон, которая окружала и костные осколки.
Наблюдался фиброз и инфильтрация стенок кровеносных сосудов, рост разрозненных
островков ретикулофиброзной костной ткани, пикноз ядер большинства остеоцитов и
наличие полостей, лишенных костных клеток. В костных осколках формировались
многочисленные лакуны, формируемые резорбцией матрикса остеокластами.
Периостальный и интрамедиарный остеогенез практически не определялся (рис. 47,
48).
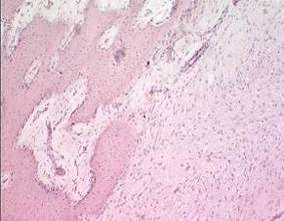
Рис. 47. Область регенерата на 30-е сутки лечения по стандартной схеме.
Гематоксилин и эозин. А - увеличение х100
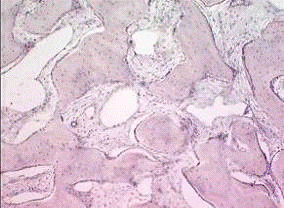

А Б
Рис. 48. Область регенерата на 30-е сутки лечения с добавлением стронция
ранелата. Гематоксилин и эозин. А - увеличение х100; Б - увеличение х400
На 60-е сутки определялось ещё большее увеличение объёма костных балок и
сужение лакун. Отмечалось уменьшение количества и уплощение остеобластов по
периферии костных балок. В препаратах регенерата между островками хрящевой
ткани наблюдалось увеличение сосудистого компонента, рост массивных участков
грубоволокнистой костной ткани, укрепления связей между костными отломками.
Количество межклеточного вещества снижалось. Отмечались расширенные и
деформированные каналы остеонов с врастанием в них новых кровеносных сосудов.
Кортикальная пластинка под действием остеокластов резко истончалась, но при
этом, за счёт гиперплазии элементов волокнистого слоя, происходило утолщение
надкостницы. Обнаруживались очаги формирования первичных остеонов, лишенных
упорядоченного строения и ориентации.

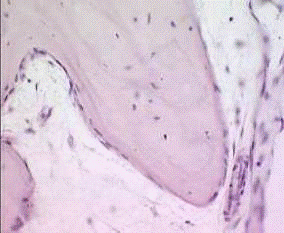
А Б
Рис. 49. Область регенерата на 60-е сутки лечения по стандартной схеме.
Гематоксилин и эозин. А - увеличение х100; Б - увеличение х400
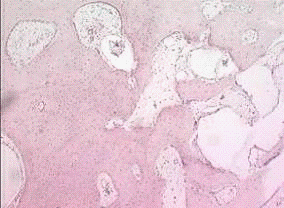

А
Б
Рис. 50. Область регенерата на 60-е сутки лечения с добавлением стронция
ранелата. Гематоксилин и эозин. А - увеличение х100; Б - увеличение х400
Таким образом, гистологическое исследование образцов костной ткани
области регенератов показало, что у животных обеих опытных групп, как при
лечении по общепринятой схеме лечения, так и с добавлением стронция ранелата,
гистологическая картина регенерации огнестрельных переломов была практически
идентична. Это можно объяснить как проборазрушающей подготовкой препаратов с
удалением большей части минеральной компоненты костного матрикса, так и
недостаточной для выявления тонкой структуры кости разрешающей способности
световых микроскопов. Необходимо отметить, что данный факт говорит о
правильности нашего выбора в пользу применения современных методов
исследования, позволяющих изучать ультраструктуру костной ткани в условиях
максимально приближенным к физиологическим.
В целом результаты данного эксперимента соответствовали данным по
регенерации огнестрельных переломов длинных костей конечностей, полученным в
ранее проведённых исследованиях Гололобова В.Г., Данилова Р.К. и Баширова Р.С.
(Гололобов В.Г., 1997; Данилов Р.К., 2008; Ли А.Д., Баширов Р.С., 2002).
Исследование регенератов области огнестрельного перелома с применением
методов сканирующей электронной микроскопии
Методами сканирующей электронной микроскопии изучены образцы бедренной
кости баранов, взятые через 2 месяца после огнестрельных переломов. Параллельно
с помощью EDS-приставки был проведен локальный химический анализ образцов.
На рис. 51 представлены электроннограммы сканирующей электронной
микроскопии костных образцов, взятых от баранов через 2 месяца и содержавшихся
на стандартном рационе без добавления препарата стронция. Как следует из
рисунка, в кортикальных пластинках на данном сроке эксперимента четко
выявляются очаги разрыхления костной ткани и неполной организации остеонов.

Рис. 51. Сканирующая электронная микроскопия костного образца зоны
регенерата огнестрельного перелома диафиза бедренной кости барана на 60-е сутки
лечения по стандартной схеме. Демонстрируется деформация внутриканальцевых
мембран. Стрелкой указаны очаги разрыхления костного матрикса
Обращает на себя внимание структура костных канальцев. Как следует из
рисунка 51, на данном сроке нет полного восстановления структурных компонентов
канальцев. В частности сохраняются разрывы мембран некоторых канальцев (рис.
52).
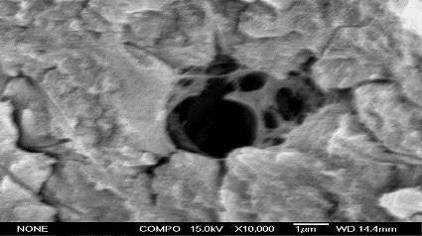
Рис. 52. Сканирующая электронная микроскопия костного образца зоны
регенерата огнестрельного перелома диафиза бедренной кости барана на 60-е сутки
лечения по стандартной схеме. Стрелкой указан участок деформации
внутриканальцевых мембран
По данным микротвердометрии прочность наружной кортикальной пластинки на
сроке регенерации 2 месяца составляет 47 кг/мм2 , что достоверно
отстает от нормы (в контроле прочность наружной кортикальной пластинки диафиза
бедренной кости колеблется в пределах 58-62 кг/мм2).
По данным рентгендифрактометрии доля аморфной фазы в костном матриксе в
зоне регенерации кости колеблется в пределах 15%, что остается значительно
выше, чем в контроле.
Под влиянием стронция ранелата в регенерирующей кости увеличивается
толщина костных балок и мембран канальцев, подвергаются гипертрофии складки
наружной поверхности канальцев, утолщаются поперечные шторки и увеличивается
высота гребней спайновых линий (рис. 53).

Рис. 53. Сканирующая электронная микроскопия костного образца зоны
регенерата огнестрельного перелома диафиза бедренной кости барана на 60-е сутки
лечения с добавлением стронция ранелата. Демонстрируется восстановление тонкой
структуры костного матрикса
Поверхность сколов костного матрикса имеет мелкозернистый вид, что
свидетельствует о равномерности слияния частиц гидроксиапатита. В целом на всем
протяжении компактное вещество кости в зоне регенерации представлено плотным
матриксом, образованным минерализованными коллагеновыми волокнами. В режиме
фазового контраста (COMPO) видно, что зернистая структура костного матрикса
состоит из сферических гранул, плотно прилежащих друг к другу (рис. 54).

Рис. 54. Сканирующая электронная микроскопия костного образца зоны
регенерата огнестрельного перелома диафиза бедренной кости барана на 60-е сутки
лечения с добавлением стронция ранелата. Демонстрируется мелкозернистая
структура костного матрикса
Это указывает на то, что стронций не оказывает гиперминерализующего
воздействия на структуру гидроксиапатита, и слияние их частиц происходит
достаточно равномерно. По-видимому, эти обстоятельства создают предпосылки для
упрочнения кости, на что указывает восстановление показателей твердости до
55,2±2,1кг/мм2 (в контроле - 62,1±5,6 кг/мм2 ).
По данным спектроскопии комбинационного рассеяния через 2 недели
регенерации кости с применением стронция ранелата наблюдается достоверная
(P<0,05) стабилизация концентрации ГАП до 49,2±5,1 об.% (в контроле
47,8±4,1об.%). Рост количества ГАП наблюдается на протяжении 1 месяца и
достигает 65,2±6,1 об.%. Однако далее концентрация ГАП в костях стабилизируется
и через 2 месяца содержание ГАП снижается до 52,0±5,1 об.%.
Такую же динамику имеют и карбонатные группы в решеточных структурах ГАП,
относительное содержание которых через 1 месяц достоверно (для P<0,05)
увеличивается до 11,1±0,8 об.%, (в контроле 8,1±0,7 об.%), а через 2 месяца
наблюдается снижение до исходного уровня - 8,8±0,7 об.%. Увеличение количества
карбонатов в решетке ГАП («мелование» кости) можно объяснить ощелачиванием
плазмы крови, рН которой повышается до 7,52 (в норме 7,34), что, вероятно,
обусловлено химическими свойствами катионов стронция. Как известно, в гидроксиапатитовых
системах с относительно высоким содержанием кальция (модуль Ca/P практически в
2 раза выше, чем в контроле, составляя 3,5 и 1,6 соответственно) при увеличении
pH образуются апатиты так называемого щелочного типа. Это минералы с дефектной
структурой и широким спектром замещений в анионной подрешетке, где замещение
фосфата карбонатом происходит по типу [CO3]2- ® [HPO4]2-
и [CO2F]- ® [H2PO4]- ®. В результате костный
гидроксиапатит превращается в более кислый карбонат гидроксиапатит со
свойствами, которые близки к природному минералу даллиту, являющемуся
кислотоустойчивой формой континентального апатита. Подобные апатиты образуют
вытянутые кристаллы с игольчатыми оконечностями, решетка которых при
механических нагрузках более подвержена деформационным, нежели диффузионным
преобразованиям (Чайкина М.В., 2002).
По данным локального энергодисперсионного анализа EDAX (значения
концентраций химических элементов приведены в единицах экстиниации EDAX), в
костях регистрируется достоверное (P<0,05) увеличение концентраций кальция
до 15,00±0,05 (в контроле 11,10±0,02), кремния до 0,400±0,004 (в контроле
0,200±0,002) и фосфора до 10,6±0,4 (в контроле 8,2±0,2), стронция до
11,200±0,002 (в контроле 0,200±0,001). Результаты химического анализа
свидетельствует о гиперминерализованном состоянии костного матрикса. Это
обстоятельство следует иметь в виду при сверхдлительном введении препаратов
стронция, так как это может привести к минеральной облитерации нанопористой
структуры костного матрикса.
При этом отметим, что накопление кремния создает предпосылки для
замещений в анионной подрешетке ГАП с участием [SiO4]n- и
делает кристаллы гидроксиапатита более эластичными. В целом же увеличение
количества кристаллов такого типа, вероятно, способствует сохранению глубинной
структуры кости, на что указывает удержание модуля упругости в пределах
38,4±0,6 ГПа (в контроле 34,6±0,9 ГПа).
Таким образом, под влиянием стронция ускоряются процессы восстановления
тонкой структуры костного матрикса в ходе посттравматической регенерации кости.
Структурной основой данного эффекта являются:
· увеличение толщины костных балок,
· увеличение высоты гребней спайновых линий,
· сохранение структуры мембран костных канальцев в виде
гипертрофии складок наружной поверхности канальцев и утолщения поперечных
шторок.
В целом, под влиянием стронция ранелата костный матрикс формирующейся
костной мозоли упрочняется быстрее, чем при регенерации на фоне лечения по
общепринятой схеме.
ЗАКЛЮЧЕНИЕ
Таким образом, проведенный анализ литературы показал, что в настоящее
время достижения военно-полевой хирургии позволили значительно улучшить
результаты лечения раненых с огнестрельными переломами длинных трубчатых костей
конечностей, однако частота неудовлетворительных исходов остаётся сравнительно
высокой.
Отчасти это может объясняться специфическими изменениями в костной ткани,
формирующимися при воздействии факторов огнестрельного ранящего снаряда и,
следовательно, требующими особых подходов к диагностике и лечению данной
патологии.
Проведённый анализ литературы, показал недостаточную изученность
ультраструктурных изменений костного матрикса в зоне «молекулярного
сотрясения». Соответственно, для уточнения патогенеза и разработки новых
методов лечения раненых с огнестрельными переломами, необходимо проведение
дополнительных исследований с использованием современных и перспективных
диагностических и лечебных методик.
Анализ данных, полученных при применении исследовательских
нанотехнологий, показал, что костная ткань, в зависимости от её структурных и
микромеханических свойств, при воздействии огнестрельного ранящего снаряда
разрушается по-разному.
Так, нами было установлено, что плоские кости черепа разрушаются
преимущественно по вязкому типу с образованием в основном дырчатых переломов с
ровными краями. Основными механизмами разрушения костного матрикса при этом
являются деформация смещения пластов и его разрывы. Тогда как разрушение
трубчатых костей в области диафиза происходит преимущественно по вязко-хрупкому
типу, с образованием оскольчатых переломов. Здесь основными механизмами
разрушения являются трещины, разрывы, лакунарно-кавернозные деформации, а также
гомогенизация и уплотнение костного матрикса в области канальцевых мембран.
При этом нами был выявлен и общий механизм разрушения обоих
структурно-анатомических типов кости - пористая трансформация костного матрикса
с формированием нано-, мезо- и микропор. Под воздействием факторов
огнестрельных ранящих снарядов, как в плоских, так и в трубчатых костях,
происходит аморфизация гидроксиапатита, что проявляется, прежде всего, в
уменьшении размеров его нанокристаллов. Наряду с этим проведение
рентген-структурного анализа показало увеличение напряженности в
кристаллической решетке апатита.
Необходимо отметить, что все выявленные нами патологические деформации
костного матрикса анатомически не были связаны с системой костных канальцев и
располагались преимущественно непосредственно на территории костного матрикса.
Этот топологический фактор указывает на то, что разрушение происходит не только
за счёт прямого аэро- и гидродинамического удара. В данном же случае
трансформация нанопор в мезо- и микропоры и полости вероятнее всего связана с
поведением циркулирующей в костном цементе и коллаген-апатитовом интерфейсе
нановоды. Вероятно, когда под действием энергии бокового удара формируется
временная пульсирующая полость, происходят фазовые переходы матриксной воды,
изменяется степень её упорядоченности. При этом появляется так называемый
расклинивающий эффект и утрачиваются свойства воды, необходимые для поддержания
нормального течения всех процессов жизнедеятельности костной ткани.
Осмысление полученных данных, позволило нам сформировать представления о
возможном механизме широкопористой остеопорозоподобной трансформации костного
матрикса после огнестрельных переломов.
Проведение эксперимента по выявлению влияния стронция ранелата на
консолидацию огнестрельного перелома и динамику костного матрикса в процессе
регенерации, позволило сделать вывод, что под действием стронция ускоряются
процессы восстановления тонкой структуры костного матрикса в ходе
посттравматической регенерации кости. Структурной основой данного эффекта
является увеличение толщины костных балок, увеличение высоты гребней спайновых
линий, сохранение структуры мембран костных канальцев в виде гипертрофии
складок наружной поверхности канальцев и утолщения поперечных шторок.
Разработанную и использованную нами модель огнестрельного перелома
длинных трубчатых костей конечностей, ввиду технической доступности и простоты
воспроизведения ранения, а также стабильности основных параметров, можно
рекомендовать для проведения экспериментальных исследований в этой области.
В целом, использованный в работе системный методологический подход,
опирающийся на современные исследовательские технологиии, позволил получить
принципиально новые данные о тех тонких структурных механизмах разрушения
костной ткани при действии факторов огнестрельного ранящего снаряда, которые не
были изучены ранее. Выявлены специфические изменения тонкой структуры костного
матрикса после огнестрельных переломов и во время их консолидации,
охарактеризован возможный вклад ударно-волновой остеопорозоподобной
трансформации костного матрикса в течение раневого процесса, а также
патогенетически обоснован и апробирован в эксперименте на лабораторных животных
возможный путь коррекции данного патологического состояния.
ВЫВОДЫ
. С помощью применения методов исследовательских нанотехнологий
(сканирующей электронной микроскопии, атомно-силовой микроскопии,
микротвердометрии) установлено, что общим структурным механизмом деструкции
кости при огнестрельных переломах является широкопористая остеопорозоподобная
трансформация костного матрикса с расширением его нанопор и аморфизацией
гидроксиапатита.
. Характер ультраструктурных изменений костной ткани при огнестрельных
переломах определяется анатомическим типом строения кости. Плоские кости черепа
разрушаются преимущественно по вязкому типу с образованием в большинстве
случаев дырчатых переломов с ровными краями. Основными механизмами разрушения
костного матрикса при этом являются смещение пластов и его разрывы. Разрушение
длинных трубчатых костей в области диафиза происходит преимущественно по
вязко-хрупкому типу, с образованием оскольчатых переломов. Здесь основными
механизмами разрушения костного матрикса являются трещины, разрывы,
лакунарно-кавернозные деформации, а также гомогенизация и уплотнение костного
матрикса в области канальцевых мембран.
. Учитывая обнаруженную широкопористую остеопорозоподобную трансформацию
костей после огнестрельных переломов, с целью коррекции физико-химических
свойств минеральной фазы костного матрикса при огнестрельных переломах длинных
костей показано применение антиостеопоротических препаратов. Наиболее
подходящим способом направленного упрочнения кристаллической решетки
гидроксиапатита является внедрение в формирующиеся кристаллы атомов стронция
путем применения стронция ранелата.
. В эксперименте с нанесением огнестрельных переломов экспериментальным
животным (баранам) при сравнительном изучении ультраструктурных изменений
костного вещества установлено, что под действием стронция ранелата
увеличивается толщина костных балок и высота гребней спайновых линий,
гипертрофируются складки наружной поверхности, упрочняется кристаллическая
решетка гидроксиапатита.
. Стронция ранелат, оказывая стабилизирующее воздействие на кристаллы
гидроксиапатита в регенерате, препятствует их аморфизации и способствует
упрочнению костного матрикса костной мозоли, что улучшает качество консолидации
огнестрельных переломов длинных костей конечностей (показатели минеральной
плотности костной ткани по данным денситометрии увеличились на 6%).
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
. Применение комплекса современных исследовательских нанотехнологий, с
использованием методов сканирующей электронной и атомно-силовой микроскопии в
сочетании с рентгеноструктурным анализом, позволяет наглядно выявить
ультраструктурные изменения костного матрикса при действии на кость факторов
огнестрельного ранящего снаряда.
. Использованная в исследовании экспериментальная модель огнестрельного
перелома у биообъекта (барана), характеризуется технической доступностью
нанесения ранения, простотой его воспроизведения в серии опытов, стабильностью
основных параметров, и может быть рекомендована в качестве стандартной модели
огнестрельного перелома длинных трубчатых костей конечностей.
. С целью улучшения качества консолидации перелома путем уменьшения
степени аморфизации гидроксиапатита и упрочнения костного матрикса в зоне
регенерата, рекомендуется применение стронция ранелата в лечении огнестрельных
переломов длинных трубчатых костей конечностей.
СПИСОК ЛИТЕРАТУРЫ
1. Аврунин А.С. Формирование остеопоротических сдвигов в
структуре костной ткани (костные органы, структура костной ткани и её
ремоделирование, концепция патогенеза остеопороза, его диагностики и лечения).
- СПб.: Ольга, 1998. - 67 с.
2. Аврунин А.С., Корнилов Н.В., Марин Ю.Б. Гипотеза о
роли клеток остеоцитарного ряда в формировании стабильной морфологической
структуры минералов костного матрикса // Морфология. - 2002. - № 6. - С. 74-77.
. Аврунин А.С., Тихилов Р.М., Аболин А.Б., Щербак И.Г.
Уровни организации минерального матрикса костной ткани и механизмы,
определяющие параметры их формирования (аналитический обзор) // Морфология. -
2005. - № 2. - С. 78-82.
. Аврунин А.С., Тихилов Р.М., Паршин Л.К., Мельников
Б.Е. Иерархическая организация скелета - фактор, регламентирующий структуру
усталостных повреждений (Часть I) // Травматология и ортопедия России. - 2010.
- № 3(53). - С. 50-58.
. Аврунин А.С., Тихилов Р.М., Паршин Л.К., Мельников
Б.Е. Иерархическая организация скелета - фактор, регламентирующий структуру
усталостных повреждений (Часть II) // Травматология и ортопедия России. - 2010.
- №1(55). - С. 48-57.
. Александров Л.Н., Дыскин Е.А., Озерецковский Л.Б. Об
одной ошибочной теории образования огнестрельных ран // Вестник хирургии. -
1964. - Т.5. - С. 59-63.
. Алексеев А.В., Озерецковский Л.Б., Тюрин М.В.
Огнестрельные ранения пулями калибра 5,56 мм // Воен. - мед. журн. - 1989. -
№8. - С.73 - 76.
. Альбертс Б., Брей Д., Льюис Дж. и др. Молекулярная
биология клетки: Пер. с англ. - М.: Мир, 1994. - Т. 3. - 504 с.
. Афанасьев Ю.И., Юрина Н.А. Гистология. - М.:
Медицина, 1999.- 744 с.
. Баширов Р.С. Лечение хирургических последствий
огнестрельных и неогнестрельных переломов длинных костей методом чрескостного
компрессионно-дистракционного остеосинтеза: Дис. … д-ра мед. наук - Томск,
1997. - 239 с.
. Белевитин А.Б., Переходов С.Н., Самохвалов И.М.
Военно-полевая хирургия в XXI веке // Мат. I Европейского конгресса по военной
медицине. - Светлогорск, 2010. - С. 16.
. Белов Н.Н., Югов Н.Т., Копаница Д.Г., Югов А.А.
Динамика высокоскоростного удара и сопутствующие физические явления.
-Northampton; Томск: STT, - 2005. - 356 с.
. Белоусов А.Е. Особенности огнестрельных диафизарных
переломов костей голени, нанесенных высокоскоростными ранящими снарядами, и
способы фиксации костных отломков: Дис. … канд. мед. наук - Л., 1976.- 246с.
. Беневоленская Л.И., «Бивалос (стронция ранелат) -
новое поколение препаратов в лечении остеопороза» // Научно-практическая ревматология.
- 2007. - № 1. - С. 75-77.
. Беркутов А.Н. Особенности современных огнестрельных
ран // Объедин. научн. сессия по современным проблемам травматологии. - Л.,
1974. - С. 25-26.
. Беркутов А.Н., Дыскин Е.А. Современное учение об
огнестрельной ране // Вестн. АМН СССР. - 1979. - № 3. - С. 11-17.
. Богданович У.Я., Арбендина Д.Л. Репаративная
регенерация костей (некоторые нерешенные проблемы) // Ортопедия, травматология
и протезирование. - 1976. - № 3. - С. 69-74.
. Бояринцев В.В., Баширов Р.С., Гайдаш А.А.
Перспективы нанотехнологий в решении актуальных проблем военно-полевой хирургии
// Военно-медицинский журнал. - 2009. - №5. - С. 33-36.
. Брюсов П.Г., Хрупкин В.И. Современная огнестрельная
травма // Воен.-мед. журн. - 1996. - №2. - С. 23-27.
. Брюсов П.Г., Шаповалов В.М., Артемьев А.А. и др.
Боевые повреждения конечностей. - М.: ГЭОТАР, 1996. - 126 с.
. Булгаков Н.П. Боевые огнестрельные ранения черепа и
головного мозга высокоскоростными снарядами и стреловидными элементами: Дисс.
…д - ра мед. наук. - Л., 1981. - 403 с.
. Быков В.Л. Цитология и общая гистология. - СПб:
СОТИС, 2000, 520 с.
. Быстров В.Ф. Огнестрельные ранения губчатых частей
длинных костей пулями из 3-х линейной русской винтовки обр. 1891 г.: Дис. …д-ра
мед. наук. - СПб.,1894. - 115 с.
. Верин В.К. Гистогенез и реактивность печени в
гистогенезе: Автореф. дис. …канд. мед. наук. - Л.,1973. - 31 с.
. Виноградова Т.П., Лаврищева Г.И. Регенерация и
пересадка костей. - М.: Медицина, 1974. - 247 с.
. Вовченко В.И. Лечение раненых с огнестрельными
переломами, осложненными дефектами бедренной и большеберцовой костей: Дисс.
…канд. мед. наук. - СПб., 1994. - 208 с.
. Военно-полевая хирургия: Национальное руководство /
под ред. И.Ю. Быкова, Н.А. Ефименко, Е.К. Гуманенко,- М.: ГЭОТАР-Медиа, 2008. -
816 с.
. Волкова О.В., Елецкий Ю.К. Основы гистологии и
гистологической техники. 2-е изд.- М.: Медицина, 1982. - 304 с. ил.
. Габуда С.П., Гайдаш А.А., Дребущак В.А., Козлова
С.Г. Физические свойства и структура связанной воды в фибриллярных белках
коллагенового типа по данным сканирующей калориметрии // Письма в Журнал
экспериментальной и теоретической физики. - 2005. - № 82 (9),. - С. 697-700.
. Габуда С.П., Гайдаш А.А., Вязовая Е.А. Структура
коллагена и разупорядоченность водной подсистемы в фибриллярных белках по
данным {2}H-ЯМР // Биофизика. - 2005. - № 2. - С. 231 - 235.
. Гайдаш А.А., Баширов Р.С., Найден Е.П., Синица Л.Н.,
Колкутин В.В., Волков А.В., Денисов А.В., Новиков В.А., Бабенко О.А.
Наноструктуры костного матрикса при воздействии огнестрельных ранящих снарядов
по данным АСМ и рентгеноструктурного анализа // Вестник Российской
Военно-медицинской академии. - 2008. - N.4(24). - С.10-11.
. Гайдаш А.А., Баширов Р.С., Колкутин В.В., Волков
А.В., Денисов А.В., Горелик И.Э., Мишин И.П., Бабенко О.А., Зимина О.В.
Структура и локальный химический состав костного матрикса при воздействии
огнестрельных ранящих снарядов по данным сканирующей зондовой электронной
микроскопии // Вестник Российской Военно-медицинской академии. - 2008. -
N.4(24). - С.11-12.
. Гайдаш А.А., Синица Л.Н., Баширов Р.С., Колкутин
В.В., Волков А.В., Белый В.И., Денисов А.В., Тарбоков В.А., Радищевская Н.И.,
Бабенко О.А. Исследование пористой структуры и особенностей химических связей
минеральной и органической фаз костного матрикса при огнестрельных переломах
методом ИК-спектроскопии // Вестник Российской Военно-медицинской академии. -
2008. - N.4(24). - С.12-13.
. Гайдаш А.А., Баширов Р.С., Колкутин В.В., Волков
А.В., Белый В.И., Денисов А.В., Горелик И.Э., Мишин И.П., Бабенко О.А., Зимина
О.В. Морфологические особенности разрушения анатомически различных типов кости
при воздействии огнестрельных ранящих снарядов по данным сканирующей
электронной микроскопии // Медицина в Кузбассе. - 2008. - N.7. - С.17-19.
. Гайдаш А.А., Найден Е.П., Синица Л.Н., Баширов Р.С.,
Белый В.И., Колкутин В.В., Волков А.В., Денисов А.В., Новиков В.А., Бабенко
О.А., Радищевская Н.И., Тарбоков В.А. Коллаген-апатитовый интерфейс костных
тканей при воздействии огнестрельных ранящих снарядов // Медицина в Кузбассе. -
2008. - N.7. - С.19-20.
. Гайдаш А.А., Синица Л.Н., Баширов Р.С., Белый В.И.,
Бабенко О.А., Колкутин В.В., Волков А.В., Денисов А.В., Радищевская Н.И.,
Тарбоков В.А. Наноканальцы, пористость и структурные свойства воды и
минеральной фазы костного матрикса при огнестрельных переломах // Медицина в
Кузбассе. - 2008. - N.7. - С.21-22.
. Гайдаш А.А., Баширов Р.С., Денисов А.В., Райн М.М.,
Найден Е.П., Синица Л.Н., Колкутин В.В., Волков А.В., Бабенко О.А., Новиков
В.А. Нанообъекты костного матрикса при огнестрельных переломах и
информативность некоторых методологических подходов // Мат.VI Всеросс. конф.
«Фундаментальные и прикладные проблемы современной механики». - Томск, 2008. -
С.97-99.
. Гайдаш А.А., Баширов Р.С., Колкутин В.В., Денисов
А.В., Райн М.М., Бабенко О.А., Волков А.В., Белый В.И., Горелик И.Э., Мишин
И.П., Зимина О.В. К проблеме структурных механизмов разрушения кости при
действии огнестрельных ранящих снарядов // Мат. VI Всеросс. конф.
«Фундаментальные и прикладные проблемы современной механики». - Томск, 2008. -
С.99-101.
. Гайдаш А.А., Синица Л.Н., Баширов Р.С., Денисов
А.В., Райн М.М., Колкутин В.В., Волков А.В., Белый В.И., Тарбоков В.А.,
Радищевская Н.И., Бабенко О.А. Особенности физических свойств воды и структуры
химических связей в минеральном матриксе костной ткани при огнестрельных
переломах // Мат. VI Всеросс. конф. «Фундаментальные и прикладные проблемы
современной механики». - Томск, 2008. - С.101-103.
. Гайдаш А.А., Баширов Р.С., Денисов А.В., Бабенко
О.А., Козяев В.А, Коробов С.В. Структурные механизмы разрушения плоских костей
черепа при огнестрельных переломах // Мат. съезда «III съезд хирургов Сибири и
Дальнего востока». - Томск., 2009. - С.244.
. Гайдаш А.А., Карачёва Ю.В., Прохоренков В.И.,
Новиков А.И., Синица Л.Н., Семёнова О.И., Щеглов Д.В., Белый В.И., Новиков
Д.А., Чигодайкин Г.П., Денисов А.В., Бабенко О.А., Безвинный М.Ю.
Коллаген-протеогликановый комплекс кожи при акантолитической пузырчатке по
данным атомно-силовой микроскопии и ИК-спектроскопии // Вестник дерматологии и венерологии.
- 2009. - №2. - С. 4-12.
. Гайдаш А.А., Баширов Р.С., Полковов С.В, Денисов
А.В., Бабенко О.А. Тонкая структура кости и разрушение костной ткани при
импульсном нагружении (к проблеме ударно-волнового остеопороза) // Мат.
Всеросс. науч. конф. «Современная баллистика и смежные вопросы механики». -
Томск., 2010. - С.11-14.
. Гайдаш А.А., Самохвалов И.М., Тюрин М.В., Баширов
Р.С., Синица Л.Н., Денисов А.В., Бабенко О.А. Новые представления о морфогенезе
огнестрельных переломов // Мат. науч. конф. «Современные технологии в
травматологии и ортопедии». - СПб., 2010. - С. 101-102.
. Гайдаш А.А., Баширов Р.С., Колкутин В.В., Толмачёв
И.А., Тюрин М.В., Божченко А.П., Денисов А.В. Новые данные о морфогенезе
огнестрельного повреждения костей // Судебно-медицинская экспертиза. - 2010. -
N.4(53). - С.4-7.
. Гайдаш А.А., Денисов А.В., Тюрин М.В., Самохвалов
И.М. Новый взгляд на морфогенез огнестрельных переломов. //
Медико-биологические и социально-психологические проблемы безопасности в
чрезвычайных ситуациях. - 2010. - № 4, вып. 1. - С.81-87.
. Гайер Г. Электронная гистохимия: Пер. с англ. - М.:
Мир, 1974. - 448с.
. Гирголав С.С. Механизм и структура огнестрельной
раны // Вестн. Хирургии. - 1955. - №1. - С.86.
. Гирголав С.С. Огнестрельная рана. - Л., 1956. - 331
с.
. Гирголав С.С. Огнестрельные раны // Опыт Сов. мед. в
ВОВ 1941-45гг. - М., 1952. - Т.1 - С.15-60.
. Глинка Н.Л. Общая химия: изд. 14-е. - Изд-во «Химия»
Ленингр. отд-е, 1967. - 688 с.
. Гололобов В.Г., Дулаев А.К. Гистологические аспекты
консолидации огнестрельных переломов // Проблемы морфологии: матер. конф. -
Чолпон-Ата, 1991. - Ч. 1. - С. 55.
. Гололобов В.Г. Регенерация костной ткани при
заживлении механических и огнестрельных переломов. // Дис. …д-ра. мед. наук. -
СПб., 1995. - 346 с.
. Гололобов В.Г. Регенерация костной ткани при
заживлении огнестрельных переломов. - СПБ.: Петербург - XXI век, 1997. - 160с.
. Гоулдстейн Дж., Ньюбери Д., Эчлин П., Джой Д., Фиори
Ч., Лифшин Э. Растровая электронная микроскопия и рентгеновский микроанализ:
Пер. с англ. - М.: Мир, 1984. Т.1. - 303 с.
. Гоулдстейн Дж., Ньюбери Д., Эчлин П., Джой Д., Фиори
Ч., Лифшин Э. Растровая электронная микроскопия и рентгеновский микроанализ:
Пер. с англ. М.: Мир, 1984. Т.2. - 348 с.
. Грант В. Эволюционный процесс: критический обзор
эволюционной теории: Пер. с англ. - М.: Мир, 1991. - 488 с.
. Грачев И.Р. Комплексная оптимизация остеорепарации
при лечении переломов длинных костей конечностей (клинико-экспериментальное
исследование): Дис. …канд. мед. наук. - СПб., 1992. - 138 с.
. Григорьев В.В., Зайцева К.К., Косачев И.Д.
Морфология заживления огнестрельной раны после первичной хирургической
обработки в эксперименте // Арх. патологии. - 1983. - Т. 45, № 8. - С. 64-72.
. Гуманенко Е.К., Бояринцев В.В., Супрун Т.Ю., Ляшедько
П.П. Объективная оценка тяжести травмы. - СПб.: ВМедА, 1999. - 110 с.
. Гюнтер В.Э., Дамбаев Г.Ц., Сысотин П.Г. и др.
Медицинские материалы и имплантаты с памятью формы. - Томск: ТГК., 1998. - 487
с.
. Давыдовский И.В. Огнестрельная рана человека. - М.,
1952. - Т.1. - С. 11-65.
. Данилов Р. К. Гистология, эмбриология, цитология. -
М.:, МИА, 2006. - 456 с.
. Данилов Р.К. Раневой процесс: гистогенетические
основы - СПб: ВМедА им. С.М. Кирова, 2007. - 380 с.; ил.
. Дедушкин В.С. Огнестрельные ранения конечностей
современными высокоскоростными снарядами: Дис. …д - ра мед. наук. - Л., 1985. -
504 с.
. Дедушкин В.С., Артемьев А.А. Всегда ли нужна
хирургическая обработка огнестрельных переломов? // Огнестрельная рана и
раневая инфекция. - Л., 1991. - С. 131-133.
. Деев Р.В. Посттравматическая регенерация костной
ткани при трансплантации культуры костно-мозговых стромальных клеток: Дис.
…канд. мед. наук. - СПб., 2006. - 175 с.
. Деев Р.В., Исаев А.А., Кочиш А.Ю., Тихилов Р.М. Пути
развития клеточных технологий в костной хирургии // Травматология и ортопедия
России. - 2008. - № 1 (47). - С. 65 - 74.
. Денисов А.В., Бабенко О.А. Структурные механизмы
разрушения плоских и трубчатых костей при действии огнестрельных ранящих
снарядов по данным сканирующей электронной микроскопии // Вестник РГМУ. - 2009.
- N.3. - С.13.
. Денисов А.В., Гайдаш А.А., Баширов Р.С. Структурные
особенности разрушения различных анатомических типов кости при действии
огнестрельных ранящих снарядов // Мат. итог. науч.-практич. конф. ТВМедИ. - Томск,
2009. - С.41-42.
. Денисов А.В., Баширов Р.С. К вопросу возможности
прогнозирования местных осложнений огнестрельных переломов длинных трубчатых
костей // Мат. съезда «III съезд хирургов Сибири и Дальнего востока». - Томск,
2009. - С.174-175.
. Денисов-Никольский Б.А., Жилкин Б.А., Докторов А.А.,
Матвейчук И.В. Ультраструктурная организация минерального компонента
пластинчатой кости у людей зрелого и старческого возраста // Морфология. -
2002. № 5 - С. 79 -83.
. Денисов-Никольский Б.А., Миронов С.П., Омельяненко
Н.П., Матвейчук И.В. Актуальные проблемы теоретической и клинической
остеоартрологии. - М., 2005. - 336 с.
. Демпстер Д.В. Ремоделирование кости // Остеопороз.
Этиология, диагностика, лечение: Пер. с англ. - СПб., 2000. - С. 85-108.
. Дулаев А.К. Особенности лечения раненых с
множественными огнестрельными переломами длинных костей конечностей на ЭМЭ:
Дис. …канд. мед. наук. - Л., 1991. - 229 с.
. Дыскин Е.А. Развитие идеи Н.И, Пирогова о роли
"молекулярного сотрясения" в патогенезе огнестрельной раны // Тез
докл. научн. конф. ВМедА. - Л., 1991. - С. 22-24.
. Дыскин Е.А. Современные проблемы раневой баллистики
// Тез. докл. научн. конф. ВМедА. - Л., 1981г.- С. 21.
. Дыскин Е.А., Озерецковский Л.Б., Попов В.Л, Тюрин
М.В. Ранения современным стрелковым оружием и МГП // Воен. мед. журн. - 1992. -
№1. - С.4 - 10.
. Егоров-Тисменко Ю.К. Кристаллография и
кристаллохимия. -М.: Университет. Книжный дом, 2005- 325 с.
. Егорова О.В. Техническая микроскопия. М.:
Техносфера, 2007. - 360 с.
. Ершов К.И. Протеогликаны и минеральный состав
костной ткани крыс в норме и при развитии остеопороза // Автореф. дис. … канд.
биол. наук. - Новосибирск, 2008. - 27 с.
. Ерюхин И.А. О хирургической обработке огнестрельных
ран // Воен. - мед. журн.. - 1992. - №1. - с. 25.
. Ефименко Н.А., Шаповалов В.М., Дудаев А.К.
Характеристика боевой травмы и лечебные мероприятия при огнестрельных переломах
длинных костей конечностей // Воен.-мед. журн. - 2003. - Т. 324, № 5. - С.
4-12.
. Жирновой В.М. Коррекция огнестрельного раневого
процесса посредством влияния физических факторов на патогенез вторичного
некроза: Дисс. канд. мед. наук. - Л., 1989. - 173 с.
. Жук А.Б. Винтовки и автоматы. - М.: Воениздат, 1988.
- 222 с., ил.
. Жук А.Б. Справочник по стрелковому оружию. - М.:
Воениздат, 1993. - 735 с., ил.
. Иванов Г.С. Огнестрельные ранения диафизов костей
человека пулями из 3-х линейной винтовки обр. 1891 г.: Дис. …д-ра мед.наук. -
СПб.,1894. - 69 с.
. Иванов П.А. Оптимизация ортопедо-травматологической
помощи раненым с огнестрельными переломами длинных костей конечностей на этапах
медицинской эвакуации в вооружённом конфликте: Дисс. канд. мед. наук. - СПб.,
2002. - 237 с.
. Илизаров Г.А. Значение комплекса оптимальных
механических и физиологических факторов в регенеративном процессе при чрескостном
остеосинтезе / Эксперим. теорет. и клинические аспекты разрабатываемого в
КНИИИЭ-КОТ метода чрескостного остеосинтеза. - Курган, 1983. - С. 5-15.
. Илизаров Г.А. Экспериментальные, теоретические и
клинические аспекты чрескостного остеосинтеза, разработанного в Институте. -
Курган: КНИИЭ-КОТ., 1986.-С. 18-20.
. Кавалерский Г.М., Гордеев Г.Г., Германов В.Г.,
Проценко Д.Н., Ярошевский А.И. Применение ГАП-содержащего материала в
хирургическом лечении пациентов с политравмой // Мат. науч. конф. «Современные
технологии в травматологии и ортопедии».- СПб.,2010.-С.45-46.
. Карлов А.В., Шахов В.П. Системы внешней фиксации и
регулярные механизмы оптимальной биомеханики. - Томск: STT, 2001. - 480 с.
. Карпов Ю.А. Методы пробоотбора и пробоподготовки.
М.: БИНОМ. Лаборатория знаний, 2003.- 243 с.
. Касавина Б.С, Торбенко В.П. Минеральные ресурсы
организма. - М.: Наука, 1975. - 197 с.
. Кларк Э.Р., Эберхардт К.Н. Микроскопические методы
исследования материалов: Пер. с англ. - М.: Техносфера, 2007. - 376 с.
. Косачев И.Д. Некоторые параллели оказания
медицинской помощи в Великой Отечественной войне и Афганской кампании // Воен.
- мед. журн. - 2001. - № 6. - с. 74 - 78.
. Косачев И.Д. Течение раневого процесса и стимуляция
репарации в огнестрельной ране на фоне поражения ФОВ: Дис. …д-ра мед. наук. -
Л., 1982. - 469 с.
. Кораго А.А. Введение в биоминералогию.- СПб: Недра,
1992.-280с.
. Корбридж Д. Фосфор: Основы химии, биохимии и
технологии: Пер. с англ. - М.: Мир, 1982. - 680 с.
. Котельников Г.П., Булгаков С.В. Остеопороз. - М.:
Гэотар-Медиа, 2010. - 504 с.
. Лаврищева Г.И., Оноприенко Г.А. Морфологические и
клинические аспекты репаративной регенерации опорных органов и тканей. М.:
Медицина, 1996. - 207 с.
. Ланцов Ю.А., Калита В.И., Маланин Д.А., Деревянко
И.В. Биомеханика границы раздела «костная ткань-имплант» с наноструктурными
керамическими покрытиями // Мат. науч. конф. «Современные технологии в
травматологии и ортопедии».- СПб., 2010.- С.47-48.
. Лежнев Э.И., Попова И.И., Кузьмина С.В., Слащев С.М.
Конфокальная лазерная сканирующая микроскопия: принципы, устройство, применение
(часть 1) // Научное приборостроение. -2001. - Т. 11. №2. - С. 3-20.
. Лесняк О.М., Беневоленская Л.И. Остеопороз:
диагностика, профилактика и лечение. - М.: Гэотар-Медиа, 2009. - 269 с.
. Ли А.Д., Баширов Р.С. Руководство по чрескостному
компрессионно-дистракционному остеосинтезу. - Томск: Изд-во «Красное знамя»,
2002. - 307 с.
. Мажуга П.М. Мононуклеары и мультинуклеарные клетки
резорбируемых тканей и их функциональные характеристики // Цитолог., генет. -
1995. - Т. 29. - С. 9-18.
. Мак-Куин Р., Марш С., Тейлор Дж. Уравнения состояния
твердых тел по результатам исследований ударных волн // Высокоскоростные
ударные явления: Пер. с англ. - М.: Мир, 1973. - С. 299-427.
. Максименков А.Н. О механизме огнестрельных ранений
// Вестн. хирургии. - 1958. - Т1. - С. 7-20.
. Максименков А.Н., Дыксин Е.А., Константинова В.П.,
Александров Л.Н., Золоташко М.И. О механизме огнестрельных ранений. Тр. ВМОЛА,
1960. - Т.111. - С.59-67.
. Маянский А.Н., Маянский Д.Н. Очерки о нейтрофиле и
макрофаге. - Новосибирск: Наука, 1989. - 344 с.
. Меркулов Г.А. Курс патогистологической техники: 4-е
изд. перераб. и доп. - Ленинград: Медгиз, 1961. - 339 с.
. Микроскопическая техника: Рук. для врачей и
лаборантов / Под ред. Д.С. Саркисова, Ю.Л. Петрова. - М.: Медицина, 1996. - 543
с.
. Миронов В.Л. Основы сканирующей зондовой
микроскопии. - Нижний Новгород: Изд. Техносфера, 2004. - 114 с.
. Мюллер М.Е., Алльговер М., Шнайдер Р., Вилленгер X.
Руководство по внутреннему остеосинтезу: Пер. с нем. - М.:
Спрингер-Верлаг,1996. - 750 с.
. Нанотехнологии в решении актуальных проблем
военно-полевой хирургии / Под ред. проф. Р.С. Баширова, А.А. Гайдаш. - Томск.
Изд-во ТПУ, 2008.- 100 с.: ил.
. Новик А.А., Довгань И.А., Цыган Е.Н. Остеопороз
(клиника, диагностика, лечение): Учебное пособие. - СПб, ВМедА, 2003. - 20 с.
. Ньюман У., Ньюман М. Минеральный обмен кости: Пер. с
англ. - М.: Иностр. лит., 1961. - 270 с.
. Образцов И.Ф., Ханин М.Ф. Оптимальные
биомеханические системы. - М.: Медицина, 1989. - 272 с.
. Овденко А.Г. Огнестрельные ранения и огнестрельный
остеомиелит конечностей. - СПб, 2010. - 240 с.
. Огарков И.Ф. К механизму образования входных и
выходных раневых отверстий / Тр. Воен. - мед. акад. - 1958. -Т.84. - С.22-31.
. Озерецковский Л.Б. Механизм огнестрельных ранений и
особенности повреждений современными ранящими снарядами // Дис. … д-ра. мед.
наук. - Л.,1989. - 347 с.
. Озерецковский Л.Б. Сравнительная характеристика
повреждающего действия 7,62 мм пуль образца 1943, и 5,6 мм американских пуль
Ремингтон: Дис…канд. мед наук. - Л.,1966. - 186 с.
. Озерецковский Л.Б., Гуманенко Е.К., Бояринцев В.В.
Раневая баллистика. - СПб., 2006. - 374 с.
. Озерецковский Л.Б., Ерюхин И.А., Тулин Д.В., Тюрин
М.В. Особенности травматогенеза и баллистическая характеристика ранений мирного
времени // Вест. хирургии. - 1998. - № 5. - С. 68-73.
. Озерецковский Л.Б., Логаткин С.М. Так ли страшен
малый калибр // Калашников. - 2001. - № 5. - С. 52-55.
. Озерецковский Л.Б., Мицкевич М.И. К вопросу использования
феномена временной полости в исслед. убойного действия боеприпасов // Оборонная
техника. - 1976. - № 9. - С.18-25.
. Омельянченко Н.П., Илизаров Г.А., Стецулла В.И.
Регенерация костной ткани. Травматология и ортопедия. Руководство для врачей /
Под. ред. Ю.Г. Шапошникова. - М.: Медицина, 1997. - С.393-482.
. Петров В.П. К вопросу о механизме образования
огнестрельного повреждения / Тр. Воен. - мед. акад. - 1958. - Т.84. - С.10-20.
. Пирогов Н.И. Начала общей военно-полевой хирургии. -
М.; Медгиз, 1941. - Ч.1. - 337с.
. Попов В.Л., Дыскин Е.А. Раневая баллистика: Судеб.-
мед. экспертиза. - СПб.: ВМедА, 1994. 162 с.
. Ревской А.К., Люфинг А.А., Николенко В.К.
Огнестрельные ранения конечностей: Руководство для врачей. - М.: ОАО
«Издательство «Медицина», 2007. - 272 с.: ил.
. Риггз Б.Л., Мелтон III Л. Дж. Остеопороз: Пер. с
англ. - СПб.: Бином «Невский диалект», 2000. - 560 с.: ил.
. Рожинская Л.Я. Системный остеопороз: Практ.
руководство для врачей. - М.: Издатель Мокеев, 2000. - 196 с.: ил.
. Рожинская Л.Я. Бивалос (стронция ранелат) -
инновационный препарат в лечении постменопаузального остеопороза // Фарматека.
- 2007. - № 12. - С. 10 - 15.
. Рожков А.С. Инфекционные осложнения тяжелых
механических травм (вопросы патогенеза, профилактики и лечения) // Дис. … канд.
мед. наук. - Спб.,1995. - 247с.
. Ромейс Б. Микроскопическая техника: Пер. с нем. -
М.: Изд-во иностр. лит-ры, 1953. - 476 с.
. Самохвалов И.М., Завражнов А.А., Корнилов Е.А.,
Маргарян С.А. Хирургическая тактика при сочетанных огнестрельных ранениях
конечностей // Вестн. хирургии им. И.И. Грекова. - 2006. Т. 165, № 5. - С. 45 -
49.
. Свешников К.А. Изменение минеральной плотности
костей нижних конечностей после переломов у больных остеопорозом
(клинико-экспериментальное исследование): Автореф. дис. …канд. мед. наук. -
Саранск, 2009. - 22 с.
. Сергеева Н. Е. Введение в электронную микроскопию
минералов. - М.: Изд-во Моск. ун-та, 1977. - 144 с.
. Скоблин А.П., Белоус A.M. Микроэлементы в костной
ткани. - М.: Медицина, 1968. - 213 с.
. Смольянников А.В. Механизм действия огнестрельного
снаряда // Опыт Сов. мед. в ВОВ 1941-45 гг. - М., 1952. - Т.34 - С. 17-54.
. Термодинамические свойства индивидуальных веществ. /
Справочн. изд.; Отв. ред. В.П. Глушко. Том 1, Кн. 2. - М.: Наука, 1978.
. Ткаченко С. С. Военная травматология и ортопедия. -
Л.: ВМедА.. 1985. - 599 с.
. Ткаченко С.С. Огнестрельные диафизарные переломы
костей // Ортопедия, травматология и протезирование. - 1981. - N 3. - С. 15-17.
. Ткаченко С.С, Руцкий В.В. Электростимуляция
остеорепарации. - М.: Медицина, 1989. - 208 с.
. Ткаченко С.С., Николенко В.К., Ерохов А.Н. Общее и
местное лечение раненых с огнестрельными переломами на этапах медицинской
эвакуации // Воен.-мед. журн. - 1991. - N 2. - С. 24-26.
. Травматология и ортопедия: Учебник / Под ред. проф.
В.М. Шаповалова, проф. А.И. Грицанова, доц. А.Н. Ерохова. - СПб: ООО
«Издательство Фолиант», 2004. - 544 с.: ил.
. Уикли Б. Электронная микроскопия для начинающих:
Пер. с англ. - М.: Мир, 1975. - 319 с.
. Улумбеков Э.Г., Челышев Ю.А. Гистология (введение в
патологию). - М.: ГЭОТАР, 1997. - 960 с.
. Учитель И.Я. Система мононуклеарных фагоцитов. - М.:
Медицина, 1978. - 200 с.
. Фадеева В.И., Шеховцова Т.Н., Иванов В.М. Основы
аналитической химии. Практическое руководство: Под. ред. Ю.А. Золотова. - М.:
Высш. шк., 2001. - 463с.
. Фриденштейн А.Я., Горская Ю.Ф., Лациник Н.В. Влияние
сред кондицинированных костномозговых клеток на пролиферативную активность
стромальных клоногенных клеток // Бюлл. эксперим. биол. и мед. - 1999. - Т.
127. - № 2. - С.218-220.
. Фриденштейн А.Я., Лалыкина К.С. Индукция костной
ткани и остеогенные клетки-предшественники. - М.: Медицина, 1973. - 220 с.
. Хрупкин В.И.. Самохвалов И.М. Современные методы
лечения огнестрельных ран // Огнестрельная рана и раневая инфекция. - Л., 1991.
- С 117-118.
. Хэм А., Кормак Д. Гистология: Пер. с англ. - М.:
Мир, 1983. - Т. 3. - 292 с.
. Цыган Е.Н., Деев Р.В. Морфофункциональные основы
остеопороза.- СПб.: ВМедА, 2007. - 120с.
. Чайкина М.В. Механохимия природных и синтетических
апатитов. - Новосибирск: Изд-во СО РАН, филиал «Гео», 2002. - 223с.
. Чиж И.М., Хрупкий В.И., Писаренко Л.В., Савостьянов
В.В. Современные представления о механизмах формирования огнестрельной раны //
Воен.-мед. журн. - 2004. - № 8. - С. 12-21.
. Чупроунов Е.В., Хохлов А.Ф., Фадеев Н.А.
Кристаллография.- М.: Издательство физико-химической литературы, 2000.-142 с.
. Шаповалов В.М. Физические методы обработки гнойных
ран конечностей (клинико-экспериментальное исследование): Дисс. …канд. мед.
наук - Л., 1981. - 295 с.
. Шаповалов В.М. Взрывные повреждения конечностей и их
профилактика. Обоснование и внедрение индивидуальных средств защиты ног
военнослужащих (клинико-экспериментальное исследование): Дисс. …д-ра мед. наук
- Л., 1989. - 316 с.
. Шаповалов В.М., Ерохов А.Н. Боевые повреждения
конечностей: сберегательная первичная хирургическая обработка огнестрельной
костно-мышечной раны. // Травматология и ортопедия России (научно-практический
журнал). - 2006, №12. - С. 305-306
. Шаповалов В.М., Овденко А.Г., Капилевич Б.Я. Терминальная
баллистика современных РС и особенности огнестрельных переломов длинных костей
// Тез. Всесоюзн. научн. конф. «Актуальные проблемы современной тяжелой
травмы». - СПб. - 2001. - С. 139.
. Шапошников Ю.Г. Огнестрельная рана (патогенез) //
Вестник травматологии и ортопедии. - 1995. - №1-2. - с.58 - 64.
. Шапошников Ю.Г. Повреждения и ранения конечностей //
Диагностика и лечение ранений. - М.. 1984. - С. 297-326.
. Шевцов В.И. Регенерация и рост ткани в условиях
воздействий на них дозированных направленных механических нагрузок // Вестник
РАМН. - 2000. - №2. - С. 19-23.
. Шерешевский М.С. Раневая баллистика // ЦНИИНТИ. -
М.: Б.и. 1985. - 408 с.
. Штейнле А.В., Алябьев Ф.В., Дудузинский К.Ю.
Методология моделирования огнестрельных ранений конечностей // Сибирский
медицинский журнал. - 2008. - Т. 23, № 1. - С. 74-81.
. Эйдлин Л.М. Огнестрельные повреждения: (Врачебное и
криминалистическое распознавание и оценка): 2-е изд., доп. и перераб. -Ташкент:
Медгиз УзССР, 1963.-332 с.
. Adams D.B. Wound ballistics: A Review. Military
Medicine. 1982 - 147:831-835.
. Anderson Y.C. Calcification of rachitic cartilage to
study matrix vesicle function // Fed. Proc. - 1976. -V. 35. - P. 147.
. Aro H.T., Markel M.D., Chao E.Y.S. Cortical bone
reactions at the interface of external fixation half-pins under different
loading condition // The J. Of Trauma. -1993. - V. 35. - No. 5. - P. 776-785.
. Barbos M.P., Bianco P., Ascenzi A. Distribution of
osteonic and interstitial components in the human femoral shaft with reference
to structure, calcification and mechanical properties // Acta Anat. . - 1983. -
Vol. 115. - P. 178-186.
. Belanger N.F. Osteocytic osteolisys // Calcif. Tiss.
Res. - 1969. - Vol. 4, N 1. - P. 1-12.
. Belkin M. Wound ballistics. Progress in Surgery.
1978 - 16:7-24.
. Black J. Biological Performance of Tantalum Clinical
Materials. - 1994. - V. 16. -P. 167-173.
. Borst M. Allgemeines uber die Wirkung der Geschosse,
Waffen. in «Handb. d. Arztl. Erfahrungen im Weltkriege 1914-1918 Jahr.». -
Leipzig., - 1921, Bd.8. - s.206-235.
. Bruijn J.D. Calcium phosphate biomaterials:
Bone-bonding and biodegradation properties. - Leiden, 1993. - 170 p.
. Bruijn J.D., Klein СР., de Groot K., Blitterswijk
CA. The ultrastructure of the bone hydroxyapatite interface in vitro // 6m
World biomaterials congress. - Hawaii, 2000. - P. 454.
. Callender G., Frech R. Wounds ballistics // Mil.
Surg. - 1935. - №77. - P. 177-201
. Callender G.R. Wound ballistics. // War Medicine. -
1943. - №3. - P. 337-350.
. Carneiro J., Leblond С. Role of osteoblasts and
odontoblasts in secreting the collagen of bone and dentin, as shown by
radioautography in mice given tritium-labelled glycin // Exp. Cell Res. - 1959.
- V. 18. - No. 2. - P. 291.
. Celeste A.J., lanazzi J.A., Taylor R.C et al.
Identification of transforming growth factor p family members present in
bone-inductive protein purified from boving bone // Proc. Natl. Acad. Sci. USA.
- 1990. - V. 87. - P. 43-47.
. Chao E.Y.S., Aro H.T. Biomechanics of fracture
fixation // Basic Orthopedic Biomechanics. - N.Y.: Raven Press Ltd, 1991. - P.
293-336.
. Chernoff E.A., Chernoff D.A. (1992) Atomic force
microscope images of collagen fibers// J. Vac. Sci. Technol. A. 10(4) 596-599.
. Coates, J.B., and J.C. Beyer. Wound Ballistics.
Office of The Surgeon General Department of the Army, Washington. 1962. - 470
p.
. Datta Y., Manning P., Rathing H., McNeil C.J. Effect
of calcitonin, elevated calcium and extracellular matrices on superoxide anion
production by rat osteoclasts // Exp. Physiol. - 1995. - V. 80. - P. 713-719.
. DeJong W.F. La substance minerale dans les os //
Tec. Trav. Chim. - 1926. -V.45. - P. 445-458.
. Demuth W.E., Smith J.M. High-velocity bullet wound
of muscle and bone: The basis of early treatment // J. Trauma. - 1966. - Vol.
6, № 6. - P. 222-232.
. Dubreuil N., Alexandre S., Foil C., Sommer F.,
Valleton J.-M. Characterization of enzymatic structures in mixed Langmuir-Blodgett
films by scanning force microscopy // Langmuir. 1995/ 11(6) 2098-2102.
. Fackler M., Bellamy R., Malinowski J. The wound
profile // J. Trauma. - 1988. - Suppl. 28. - P. 21-29.
. Fritz M., Radmacher M., Cleveland J.P. Allersma
M.W., Stewart R.J., Gieselmann R., Janmey P., Schmidt C.F., Hansma P. (1995)
Imaging globular and filamentous proteins in physiological buffer solutions
with tapping mode atomic force microscopy // Langmuir. 11(9) 3529-3535.
. Frost H.M. In vivo osteocyte death // J/ Bone Joint
Surg. - 1960. - Vol. 42-A, N 1. - P. 138-143.
. Frost H. Mathematical elements of lamella bone
remodeling. - Springfield: Thomas books? 1964. - 127p.
. Gathercole L., Miles M.J., McMaster T.J. (1993)
Scanning Probe Microscopy of collagen I and pN-collagen I Assemblies and
Relevance to Scanning Tunneling Microscopy Contrast Generation in Proteins //
J. Chem. Soc. Faraday Trans. 89(15) 2589-2594.
. Girasole G., Passeri G., Knutson S. et al.
Up-regulation of osteoclastic potential of the marrow induced by orhiectomy and
is reversed by testosterone replacement // J. Bone Min. - 1992. - V. 7. - P.
96.
. Goertz M. P., Houston J. E., Zhu X.-Y.
Hydrophilicity and the viscosity of interfacial water. // Langmuir - 2007. -
Vol. 23. - P. 5491-5497.
. Gururaja S., Kim H.J., Swan C.C., Brand R.A.J. Lakes
R.S. Modeling deformation-induced fluid flow in cortical bone's
canilicuiar-lacunar system // Annals of biomedical engineering. - 2005. - Vol.
33, №1. - P. 7-25.
. Hahn M., Strauss E., Yang E. Gunshot wounds to the
forearm // Orthop. Clin. North. Am. - 1995. - Vol. 26, № 1. - P. 85-93.
. Horton W.A. The biology of bone growth // Growth
Genet. Horm. - 1990. - Vol. 6. - N. 2. - P. 1-3.
. Jowsey J., Riggs B.L. Mineral metabolism in
osteocytes // Mayo Clin. Proc. - 1964. - Vol. 39, N 7. - P. 480-484.
. Key L.L., Wolf W.C., Gunberg C.V., Ries W.L.
Superoxide and bone resorption // Bone. - 1994. - V. 15. - P. 431-436.
. King G.J., Holtrop M.E. Actin-like filaments in bone
cells of culture mouse calvaria as demonstrated by binding to heavy meromyosin
// J. Cell Biol. - 1975. - V. 66. -P. 445.
. Currey J.D. stress concentration in bone //
Microscope/ Sci/ - 1962. - V. 103, Part 1. - P. 111-133.
. Kurihara N., Chenu C, Miller M. et al.
Identification of committed mononuclear precursors for osteoclast-like cells in
long term human culture // Endocrin. -1990. -V. 126. - P. 2733-2741.
. Leblond C, Belanger L., Robinson J. Radio
autographic visualization of bone formation in the rat // Am. J. Anat. - 1950.
- V. 86. - P. 289.
. Li T.D., Gao J., Szoszkiewicz R., Landman U., Riedo
E. Structured and viscous water in subnanometer gaps // Phys. Rev. - 2007. -
Vol. 75. - 1154-1165.
. Lyons K.M., Pelton R.W., Hogan B.L.M. Organogenesis
and pattern formation in the mouse RNA distribution patterns suggest a role for
bone morphogenetic protein-2A // Development. - 1990. - V. 109. - P. 833-844.
. Major R. C., Houston J. E., McGrath M. J., Siepmann
J. I., Zhu X.-Y. Viscous water meniscus under nanoconfinement. // Phys. Rev.
Lett. - 2006. - Vol. 96. - P. 177-183.
. Marcus R. Normal and abnormal bone remodeling in man
// Ann. Rev. Med. -1987. - V. 38. - P. 129-141.
. Nesbitt S.A., Nesbit M., Helfric V., Horton M.
Biochemical characterization of human osteoclast integrins. Osteoclasts express
// J. Biol. Chem. - 1993. - V. 268. - P. 16737-16745.
. Ragsdale B.D., Josselson A. Experimental gunshot
fractures // J. Trauma. - 1988. - Vol. 28, N 6. - P. 301-315.
. Rich N.M. Wounding power of missiles used in the
Republic of Vietnam // JAMA. - 1967. - Vol. 199, N 1. - P. 157-168.
. Roux W. Beitrage zur morphologie der functionellen
anpassung. 3 / Beschreibung und Erlauterung einer knochernen Knigelensankylose
/ Arch. Anat. Physiol. (Anat. Abt). - 1885. - Bd. 9. - S. 120-158.
. Roux W. Gesammetle Abhandlungen uber
entwicklungsmechanik der organismen.-Leipzig: Engelmann, 1889. - Bd. 1-2. -
1891 S.
. Urist M.R. et al. Purification of bone morphogenetic
protein by hydroxyapatite chromatography // Proc. Natl. Acad. Sci. USA. - 1984.
- V. 81. - P. 371-375.
. Van der Plas A., Aarden E.M., Feijen J.H., de Boer
A.H., Wiltink A., Alblas M.J., de Leij L, Nijweide P.J. Characteristics and
properties of osteocytes in culture // J. Bone Miner. Res. - 1994. - V. 9. -
No. 11. - P. 1697-1704.
. Wada S., Martin T.J., Findlay D.M. Homologous
regulation of the calcitonin receptor in mouse osteoclast-like cells and human
breast cancer T47D cells // Endocrinology. - 1995. - V. 36. - P. 2611-2621.
. Watkins F.P., Pearce B.P., Stainer M.C. Physical
effects of the penetration of head simulants by steel spheres // J. Trauma. -
1988. - Vol. 28, N 1. - P. 40-54.
. Wolf J. Das gesertz der transformation der knochen.
- Berlin: A Hirchwild, 1892. -152 s.