Вирус иммунодефицита человека: история изучения, строение, взаимодействие с клеткой, патогенез, методы профилактики и лечения
Министерство образования и науки,
молодёжи и спорта Украины
Харьковский национальный университет
им. В.Н. Каразина
Кафедра микологии и фитоиммунологии
Курсовая работа
по нормативному курсу вирусология на
тему:
Вирус иммунодефицита человека.
История изучения, строение, взаимодействие с клеткой, патогенез, методы
профилактики и лечения
Выполнила:
Студентка 2-го курса
Биологического ф-та
Группы БГ-22
Пуковецкая О.А.
Харьков 2012
Содержание
Введение
История изучения
Строение вируса иммунодефицита человека
Жизненный цикл возбудителя ВИЧ-инфекции
Механизм взаимодействия с клеткой. Патогенез ВИЧ-инфекции
Пути передачи и методы профилактики ВИЧ
Лечение ВИЧ-инфекции
Список использованной литературы
Введение
ВИЧ - вирус иммунодефицита человека, вызывающий заболевание -
ВИЧ-инфекцию, последняя стадия которой известна как синдром приобретённого
иммунодефицита (СПИД) - в отличие от врождённого иммунодефицита.
Распространение ВИЧ-инфекции связано, прежде всего, с
незащищенными половыми контактами, использованием зараженных вирусом шприцев,
игл и других медицинских и парамедицинских инструментов, передачей вируса от
инфицированной матери ребенку во время родов или при грудном вскармливании. В
развитых странах заболевание ВИЧ-инфекцией сократились за счёт проверки доноров
крови на ВИЧ.
ВИЧ заражает в первую очередь клетки иммунной системы (CD4+
Т-лимфоциты, макрофаги и дендритные клетки), а также некоторые другие типы
клеток. Инфицированные ВИЧ CD4+ Т-лимфоциты постепенно гибнут. Их гибель
обусловлена главным образом тремя факторами:
· Непосредственное разрушение клеток вирусом
· Запрограммированная клеточная смерть
· Убийство инфицированных клеток CD8+
Т-лимфоцитами. Постепенно субпопуляция CD4+ Т-лимфоцитов сокращается, в
результате чего клеточный иммунитет снижается, и при достижении критического
уровня количества CD4+ Т-лимфоцитов организм становится восприимчивым к
оппортунистическим (условно-патогенным) инфекциям.
Глядя на оценки одной из международных программ, с 1981 по
2006 от болезней, связанных с ВИЧ-инфекцией и СПИД умерли 25 миллионов человек.
Глядя на эти числа, можно сказать, что ВИЧ является самой губительной пандемией
за всю историю человечества. Только в 2006 году ВИЧ-инфекция стала причиной
смерти около 2,9 миллиона человек. К началу 2007 года во всем мире около 40
миллионов человек (0,66 % населения Земли) являлись носителями ВИЧ. Две трети
из общего числа ВИЧ-инфицированных живут в странах Африки к югу от пустыни
Сахары. В наиболее пострадавших от пандемии ВИЧ-инфекции и СПИД странах эпидемия
препятствует экономическому росту и увеличивает бедность населения [1].
История
изучения
Впервые врачи встретились с больными СПИД в 1980 году в
Атланте (США), когда пятеро мужчин молодого возраста (29-36 лет), находились в
больнице с диагнозом пневмония. Больные имели отношения с мужчинами (МСМ) и
относились к потребителям инъекционных наркотиков (ПИН).
К концу 1981 года о наличии СПИД во Всемирной Организации
Здравоохранения (ВОЗ) сообщили 20 государств, с 1983 года стали говорить об
эпидемии, а затем о пандемии СПИД. 1981 год считается годом официального
сообщения о новой инфекционной болезни СПИД.
Исследователи Л. Монтанье и Р. Гало (1983 г.) явились
первооткрывателями возбудителя СПИДа. По их мнению, вирус мог существовать
десятки и сотни лет в изолированных популяциях людей, и, в связи с небольшими
контактами людей в тот период широко не распространялся. Изменения условий
жизни людей, интенсивная миграция их, "сексуальная революция",
наркомания создали условия для широкого распространения вируса.
В 1996 году Бергер открыл корецептор для ВИЧ. Этот рецептор
вместе с CD4 опосредует инфицирование СО-вариантами ВИЧ-1, адаптированных к
росту в Т-хелперах, но не в макрофагах. На сегодня известно около 10
хемокиновых рецепторов. [6]
Место появления вируса СПИД также не определено и является
спорным. Одна группа ученых считает, что вирус мог сформироваться в Центральной
Африке, другая - в США, третья - на острове Гаити.
В.М. Жданов - российский вирусолог, поддерживает африканское
происхождение СПИДа, но уточняет, что болезнь существовала еще в давние
исторические времена. Первое появление болезни, по его мнению, имело место в
этап работорговли. Часть исследователей убеждена, что вирус приобретен
человеком у обезьян - африканских зеленых мартышек, у которых он клинически не
проявляется, и с которыми человек имел контакт, употребляя их в пищу. При
разделке тушек обезьян охотник мог поранить руку, а через эту рану занести
вирус в организм.
Однако японские ученые отрицают эту версию, основываясь на
том, что вирус, вызывающий СПИД у человека и вирус, выявленный у обезьян,
принадлежит к различным семействам.
Некоторые считают, что вирус СПИДа - результат генетической
гибридизации между лентивирусами животных и онковирусами.
Вирус иммунодефицита человека был открыт Робертом Галло и
Люком Монтенье.
Вирус иммунодефицита человека (ВИЧ) впервые был описан этими
учеными в середине 70 годов 20века, как первый ретровирус человека. С этого
началась история изучения ВИЧ, сегодня геном этого вируса - одна из самых
изучаемых последовательностей нуклеиновых кислот на Земле.
Лишь в 1981 году была установлена ассоциации этого вируса с
пневмонией и саркомой Капоши, обнаруженными среди ранее здоровых молодых людей
- гомосексуалистов из Нью-Йорка, Лос-Анджелеса, Сан-Франциско. В последствие
были установлены аналогичные случаи среди больных гемофилией, у лиц
употребляющих инъекционные наркотики и их половых партнеров. Только к концу
1983 года был установлен и описан этот инфекционный агент, им оказался вирус
иммунодефицита человека I типа (ВИЧ-1).
ВИЧ - ретровирус, в качестве генетического материала имеет
две одноцепочечные молекулы РНК. В них содержатся гены, кодирующие различные
белки, необходимые для жизнедеятельности вируса - всего 9 генов, имеющих общую
длину 9000 пар нуклеотидов.
Установлено, что ВИЧ имеет округлую форму и содержит 72
наружных выступа, образованных белками оболочки ВИЧ.
Вирус иммунодефицита человека I генетически очень изменчив,
он постоянно мутирует, образуя различные типы и субтипы. Всего различают три
группы ВИЧ-1: М, N и О. Наиболее часто встречается ВИЧ-1 группы М, который, в
свою очередь, делится на 8 субтипов. В определенных географических районах и
этнических группах преобладают свои субтипы. Коинфекция, т.е. одновременное
заражение человека двумя и более субтипами вируса, приводит к смешению их
генетических материалов и образованию так называемых рекомбинантных форм. [2]
Строение
вируса иммунодефицита человека
ВИЧ имеет суперкапсид сферической формы, образованный двойным
липидным слоем с гликопротеиновыми "шипами". "Шипы"
образованы гликопротеином gp 160 (gp - glycoprotein; 160 - молекулярная масса
белка в килодальтонах), состоящим из 2 субъединиц.120 - высокоиммуногенный
белок, содержащий консервативные и гипервариабельные участки, а также область,
связывающую молекулу CD4 Т-лимфоцитов (рецептор Т-хелперов). Белок gp 120
расположен на поверхности вируса.41 - пронизывает липидный бислой насквозь и
нековалентно связан с gp 120. Он обусловливает слияние вируса с Т-лимфоцитом
(после того как gp 120 связался с CD4). Кроме того, gp 41 может опосредовать
проникновение вируса в клетки с дефицитом рецепторов CD4.
Под суперкапсидом расположен матриксный белок p 17 (p -
протеин). Глубже всего располагается сердцевина, имеющая форму усеченного
цилиндра - это нуклеокапсид. Капсид образует белок p 24. Внутри капсида
находится геном вируса, представленный двумя идентичными нефрагментарными
нитями РНК+, соединенными вблизи их 5' концов.
В состав ВИЧ входят следующий ферменты: обратная
транскриптаза, состоящая из 3 доменов - обратной транскриптазы, РНК-азы и ДНК
зависимой ДНК-полимеразы и эндонуклеаза. Собственно геном вируса состоит из 9
генов, часть которых перекрывается между собой и имеет экзон-интронную
структуру.9 генов вируса контролируют синтез 9 структурных и 6 регуляторных
белков.
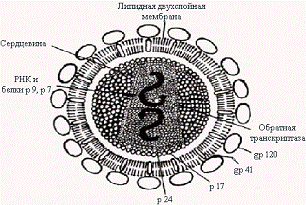
Рис.1. Вирус иммунодефицита человека. [3]
Жизненный
цикл возбудителя ВИЧ-инфекции
I. Вирус связывается со специфическими рецепторными
молекулами на поверхности Т-лимфоцита (СD4-клетки) и проникает в клетку,
сбрасывая оболочку.. На матрице вирусной РНК с помощью
фермента обратной транскриптазы синтезируется ДНК-копия,
которая затем достраивается в двух цепочную ДНК-копию.. ДНК-копия перемещается
в ядро клетки (действующий фермент на данном этапе - интеграза). Там она
образует кольцевую структуру и встраивается в ДНК клетки. ДНК-копия может
сохраняться в клетке в течение нескольких лет. Ее присутствие обнаруживается в
крови со специфическими антителами.. Вторичная инфекция организма стимулирует
транскрипцию ДНК-копии - синтез вирусной матричной РНК.. На вирусной матричной
РНК клеточные рибосомы осуществляют синтез вирусных белков.. Из вновь
синтезированных вирусных белков и вирусной РНК происходит сборка новых вирусных
частиц; выход их из клетки часто заканчивается гибелью клетки. [4]
Механизм
взаимодействия с клеткой. Патогенез ВИЧ-инфекции
Вирусы являются патогенами внутриклеточными, каждый вирус
имеет тропность к определенному типу клеток. Его тропизм определяется наличием
на клетке-мишени рецептора для данного вируса и возможностью генома вируса
встроиться в геном клетки. Рецепторы могут быть на клетках различных типов.
Рецепторную функцию выполняют лиганды: белки, липиды, углеводные компоненты
белков и липидов. Они локализованы на плазматической мембране обеспечивают
проникновение в клетку гормонов, питательных веществ, факторов роста и
регуляции и т.п.
Рецепторы имеют общую структурную характеристику, то есть
состоят из участка, расположенного вне клетки, локализованного внутримембранно
участка, и участка, погруженного в цитоплазму.
Рецепторами для ВИЧ являются дифференцировочный антиген CD4 и
не зависящие от наличия CD4 компоненты. CD4 - гликопротеид с молекулярной
массой 55 000, по своему строению имеющий гомологии с определенными участками
иммуноглобулинов. Фиксация вируса через gp120 ВИЧ-1 с мембранным рецептором CD4
клетки хозяина блокирует восприятие сигналов от анти-генпрезентирующих клеток.
Дальнейшая репликация вируса приводит к гибели клеток, нарушению выполняемой
ими функции и последующему развитию иммунодефицита.
В человеческом организме имеется ряд клеток, имеющих
рецепторы для ВИЧ (CD4+ лимфоциты, CD8+ лимфоциты, дендритные клетки, моноциты,
эозинофилы, мега-кариоциты, нейроны, микроглия, сперматозоиды), и в случае
проникновения вируса наблюдается цитопатический эффект во многих из них.
Кроме основного рецептора - CD4, имеется еще ряд
корецепторов, в частности, хемокиновые рецепторы, необходимые для проникновения
ВИЧ в клетку. Хемокины - полипептиды, вызывающие движение клеток в определенной
направленности. У человека выделено около 40 отдельных подобных белков, их
подразделили на альфа- и бета-хемокины. В лаборатории Р. Галло в 1995 году были
выделены хемокины из CD8-лимфоцитов и два белка из макрофагов. Они блокируют
инфицирование CD+ мононуклеаров макрофаготропными, но не лимфотропными
вариантами ВИЧ-1.
Таким образом, выделены белки - хемокины, блокирующие
проникновение ВИЧ в макрофаги с антигеном CD4, и белки - корецепторы,
способствующие инфицированию. При этом корецепторы - это рецепторы для
хемокинов, но их использует ВИЧ в качестве рецептора, с помощью которого
проникает внутрь клетки.
Проникнув в СD4+ клетки, ВИЧ сразу же начинает репликацию,
при этом, чем активнее CD4+ клетки, тем выше процесс репродукции вируса. Все
регуляторы, активирующие СD4+клетки, обеспечивают увеличение репликации вируса.
К подобным регуляторам относятся фактор некроза опухолей (ФНО), фактор,
стимулирующий колонии гранулоцитов/макрофагов, интер-лейкин-6 (ИЛ-6). К
негативным регуляторам, тормозящим репликацию вируса, относятся интерферон (ИФ)
и трансформирующий фактор роста. [6]
Вирус оказывает разнонаправленные действия не только на
Т-лимфоциты, но и на клетки киллеры. Активность последних по мере
прогрессирования заболевания неуклонно снижается, т.е. организм становится по
мере прогрессирования заболевания всё менее устойчив к воспалительным
процессам. Дефицит ИЛ-2 и γ-интерферона даже при
нормальном количестве NK-клеток ведет к снижению функциональной активности их у
больных ВИЧ-инфекцией (Ковальчук Л.В., Чередеев А.Н., 1991).
Выделено два типа CD4+клеток: Т-хелперы-1 (Th1) и Т-хелперы-2
(Th2). Тh1 продуцируют цитокины, стимулирующие клеточный иммунитет, а Тh2 -
цитокины, усиливающие антителогенез. Соотношение Тh1 и Тh2 взвешенно и
конкурентно; суперэкспрессия цитокинов одного типа клеток ведет к супрессии
другого. У больных ВИЧ-инфекцией идет угнетение Тh1, чем обеспечиваются и
вирусная патология, и онкогенез. [6]
Сродство вирусного мембранного гликопротеида gp120 (gp105 в
случае ВИЧ-2) к клеточному рецептору CD4 определяет высокую степень
избирательного поражения клеточных структур, поэтому в патологический процесс
вовлекаются, в первую очередь, и в большей степени CD4+ лимфоциты, моноциты
крови, макрофаги тканей, дендритные клетки крови, лимфатических узлов, селезенки,
кожи, альвеолярных и интерстициальных макрофагов легких, микроглия и другие
клетки нервной системы, имеющие CD4 - рецепторы. Так же поражаются В - и
О-лимфоциты, ретикулярные клетки, эпителиальные клетки кишечника, клетки
Лангерганса, причем последние инфицируются даже легче, чем CD4+ лимфоциты.
Именно клеткам Лангерганса придается большое значение в распространении ВИЧ по
организму, ибо в них вирус сохраняется длительное время, иногда годы.
Наличие CD4 рецептора на многих и не только иммунокомпетентных
клетках, возможность поражать и клетки, не имеющие этого рецептора, определяют
политропность ВИЧ и полиморфизм клинической картины. Степень поражения тех или
иных, содержащих СD4 рецепторы, клеток зависит от плотности этих рецепторов на
мембране клеток. Наиболее высока плотность на Т-хелперной субпопуляции
лимфоцитов, что и определяет во мно-гом патогенез болезни. Но степень поражения
клеток-мишеней вирусом зависит также и от возможности репликации вируса в том
или ином виде клеток. Очевидно, осуществляется репликация в основном в
лимфоцитах с CD4+ фенотипом и моноцитах/макрофагах.
Если на CD4+ лимфоциты вирус оказывает цитопатическое
действие с лизисом клетки или слиянием в синцитий, то в моноцитах/макрофагах
ВИЧ реплицируется с умеренной интенсивностью; вирионы оформляются в округлые
частицы еще в цитоплазме клетки и по выходе из нее не оказывают
цитонекротического действия. С гиперпродукцией ФНО-a, ИЛ-1b и ИЛ-6 связывают
развитие при ВИЧ-инфекции лихорадки, анемии, диареи, кахексии, патологических
изменений на коже и слизистых при саркоме Капоши, церебральных симптомов. ФНОa
при этом оказывает прямое цитопатическое действие на инфицированные ВИЧ
Т-хелперы. В то же время было установлено, что ВИЧ ингибирует продукцию ИЛ-2 и γ-ИФ, синтезируемым Т-хелперами первого типа, и не ингибирует
функцию Т-хелперов второго типа. Следовательно, играя важную роль в регуляции
синтеза цитокинов, ВИЧ за счет переключения иммунного ответа с Т-хелперов
первого типа на Т-хелперы второго типа, стимулирует гуморальное звено иммунитета.
После инфицирования клетки вирусом происходит соединение
вирусной оболочки с помощью белка gp41 с мембраной клетки. Помимо того,
вирусный белок gp41 обеспечивает слияние мембран соседних клеток между собой с
образованием одной многоядерной клетки - синцития. При этом слияние может быть
как зараженных клеток между собой, так и зараженных с незараженными. Но
синцитий в основном индуцируют вирусы, выделенные от больных с клиническими
проявлениям ВИЧ-инфекции, и не образуют выделенные от инфицированных людей, не
имеющих клинических проявлений. [6]
Когда геном вируса интегрируется в геном клетки начинается
стадия латентной инфекции. В это время вирус находится в клетке в виде
интегрированного в геном ДНК - провируса. Последние исследования показали, что
сразу после проникновения вируса в клетку начинаются и трансляция, и
транскрипция.
Состояние латентной инфекции без клинических признаков
болезни может длиться от 2 до 11 лет. Активация длинных концевых повторов и
экспрессия генов ВИЧ, кодирующих белки вируса, знаменуют собой манифестацию
болезни. [6]
Выявлен ряд факторов, которые активируют экспрессию генов
ВИЧ. К ним относятся факторы, активирующие Т-лимфоциты: специфические антигены
(например, вирусы группы Herpes), неспецифические антигены (например, митогены
типа фитогемаглютинина), цитокины (например, фактор некроза опухолей, некоторые
интерлейкины, гамма-интерферон), бактериальные иммуномодуляторы (например,
монофосфат липида из сальмонелл). К активаторам экспрессии ВИЧ можно отнести
глюкокортикостероидные гормоны, такие как дексаметазон и гидрокортизон,
ультрафиолетовое облучение, перекись водорода, свободные кислородные радикалы.
Активирует также инфекционный процесс беременность; Более прогрессивно
развивается ВИЧ у людей психически неуравновешенных, дезадаптированных, по
сравнению с людьми, имеющими уравновешенную психику. [6]
Механизм репоикации вируса в клетке до сих пор до конца не
известен. Известно только то, что в цитоплазме информация с вирусной РНК
посредством обратной ревертазы переписывается на ДНК, первоначально образуется
однонитевая структура; затем та же обратная транскриптаза обеспечивает
образование второй нити, и линейная промежуточная форма ДНК-транскриптаза
вируса - транспортируется в ядро, где с помощью фермента интегразы интегрирует
в хромосому клетки, превращаясь в провирус.
Исключительно важный этап патогенеза болезни - сборка
вирусных частиц и выход нового потомства вируса из инфицированной клетки.
Сборка происходит на плазматической мембране лимфоцита, куда поступают все
компоненты вирусной частицы, в том числе и белки-предшественники. Вирусы
почкуются на поверхности клетки. Отличительной чертой ВИЧ является взрывной
характер процессов активации транскрипции, синтеза белков-предшественников,
сборки вирионов и их почкования: за 5 мин одна лимфоцитарная клетка может
образовать до 5000 вирусных частиц.
Ключевой вопрос патогенеза ВИЧ-инфекции - механизм иммунного
повреждения. В составе белков gp120, главного комплекса гистосовместимости
(HLA) класса II и CD4-рецепторов имеются сходные участки, что определяет
перекрестное реагирование образующихся к ВИЧ антител с этими структурами. На
всех ядросодержащих клетках имеются антигены HLA I; вирус же нарушает синтез
этих антигенов, участвующих в распознавании CD8+ лимфоцитами зараженных вирусом
клеток, что тормозит процесс лизиса инфицированных клеток. [6]
Для изменений В-звена иммунитета характерна активация
В-лимфоцитов. Изменение их метаболизма сопровождается уменьшением времени
полуобмена иммуноглобулиновых рецепторов с повышением в крови концентрации
клеточных рецепторов (Р-белки). Суммарная концентрация сывороточных
иммуноглобулинов растет, но выявляется диспропорция уровней подклассов
иммуноглобулинов. Так, содержание IgG1 и IgG3 у больных увеличивается, а
концентрация IgG2 и IgG4 существенно уменьшается. Очевидно, повышение уровня
IgG2 связано с высокой восприимчивостью больных к стафилококкам, пневмококкам,
палочке инфлюэнцы. Несмотря на гипергаммаглобулинемию, увеличение количества
циркулирующих в крови В-лимфоцитов, их функциональная активность на митогены
остаются относительно сниженными, что позволяет В-систему иммунитета у
ВИЧ-больных расценивать как супрессированную. К тому же, количество В-клеток в
периферической крови больных в стадии СПИДа может быть снижено в три и более
раз.
Многочисленными исследованиями показано, что взаимодействие
gp120 ВИЧ-1 с мембраной CD4+ лимфоцитов определяет не только отрицательные
реакции инфицированных клеток, но и приводит к программированной клеточной
гибели - апоптозу зрелых CD4+ лимфоцитов или CD34+ гемопоэтических
клеток-предшественников даже при отсутствии их инфицирования вирусом.
Локализуясь в иммуноците, вирус проникает в органы и ткани,
пребывая вне доступности для иммунной системы. Активация инфекционного процесса
ведет к гуморальному иммунному ответу с образованием антител. Но в связи с наличием
в составе вирусного белка gp120, HLA класса II и CD4-рецептора лимфоцита
сходных участков образующиеся антитела перекрестно реагируют с ними, чем
обусловливают нарушение кооперативных взаимодействий в функционировании
иммунной системы. Все это определяет формирование аутоаллергических реакций.
Именно поэтому в ходе развития инфекционного процесса формируется
гиперчувствительность замедленного и немедленного типов, преимущественно к
антигенам ВИЧ, в частности, gр41 и gp120. У половины больных развиваются
манифестные формы аллергии, преимущественно в виде ринита, лекарственной
аллергии, крапивницы, атопического дерматита, ангионевротического отека с
повышением у них уровня специфических IgE к бытовым, эпидермальным, пыльцевым и
пищевым аллергенам с положительной коррелятивной связью между общим уровнем IgE
и содержанием СD8+ лимфоцитов (Ю.А. Митин, 1997).
Формирование иммунодефицита при ВИЧ-инфекции не
ограничивается только поражением лимфоцитов с CD4-фенотипом. Нарушение синтеза
белков HLA I ведет к ингибированию функции лимфоцитов с CD8-фенотипа, то есть
Т-супрессоров. Белок вируса р15 оказывает супрессивное действие на продукцию
Т-клетками ИЛ-2 и γ-интерферона. Известно,
что для дифференцировки Т-эффекторов из Т-предшественников необходимы ИЛ-2, γ-интерферон и ИЛ-6. А с продукцией ИЛ-2 и других цитокинов тесно
связана функция цитотоксических Т-лимфоцитов, ответственных за противовирусную
и противоопухолевую защиту организма.
Наряду с поражением иммунной системы в патологический процесс
вовлекается и кроветворная ткань. Для заболевания характерны лейкопения,
анемия, тромбоцитопения. Угнетается функциональная активность гранулоцитов. У
больных ВИЧ-инфекцией в костном мозге резко снижается содержание
колониеобразующих единиц гранулоцитов, макрофагов, мегакариоцитов. На данный
момент нет однозначного мнения о причинах ингибиции пролиферативной активности
стволовых клеток, хотя и установлено, что различные изоляты ВИЧ, воздействуя на
CD34+ клетки, угнетают их функциональную активность. Также установлено, что подавление
кроветворения в результате действия ВИЧ связано с усилением продукции
костномозговыми моноцитами/макрофагами фактора некроза опухолей.
Таким образом, поражение иммунной системы при ВИЧ-инфекции
носит системный характер, проявляясь глубокой супрессией Т - и В-звеньев
клеточного иммунитета. В ходе развития ВИЧ-инфекции происходят закономерные
изменения гиперчувствительности немедленного и замедленного типа, гуморального
иммунитета и факторов неспецифической защиты, функциональной активности лимфоцитов
и моноцитов/макрофагов. Нарастает уровень сывороточных иммуноглобулинов,
циркулирующих иммунных комплексов. Наряду с дефицитом CD4+ лимфоцитов в
динамике болезни нарастает функциональная недостаточность СD8+ лимфоцитов,
NK-клеток, нейтрофилов. Нарушение иммунного статуса клинически проявляется
инфекционным, аллергическим, аутоиммунным и лимфопролиферативным синдромами
иммунологической недостаточности, синдромом, свойственным болезни иммунных
комплексов. Все это определяет в целом клинику ВИЧ-инфекции. [6]

Схема проникновения ВИЧ в клетку и его
размножения
Пути передачи
и методы профилактики ВИЧ
На сегодняшний день пути передачи ВИЧ медикам известны. Он
может передаваться через кровь зараженного, при незащищенных половых контактах
и от инфицированной матери ребёнку (вертикально).
ВИЧ можно заразиться, если во время инъекций использовались
неоднократно шприцы или при любых контактах "кровь в кровь",
например, при нестерильных инструментах для маникюра.
Гомосексуалисты тоже относятся к объектам повышенного риска,
если имеет место быть анальным половым контактам без такого метода контрацепции
как презервативы.
В разных странах наблюдается разное преобладание путей
передачи ВИЧ. В Украине по последним данным преобладают инъекционный и
гетеросексуальный пути. На данный момент наша страна является первой в Европе
по количеству больных СПИДом.
Заражение СПИДом через кровь происходило и в тех случаях,
когда переливалась инфицированная кровь в медицинском учреждении. Такие случаи
можно отнести к халатности и недобросовестности медработников.
Передача ВИЧ половым путем происходит во время контакта
человека с инфицированной спермой или влагалищным секретом зараженного
партнера.
Следует отметить, что в настоящее время такой путь передачи
СПИД (ВИЧ) инфекции является одним из самых распространенных. По-прежнему самым
надежным средством защиты, в данном случае, является презерватив.
На сегодняшний день профилактика ВИЧ инфекции относится к
самым действенным способам борьбы с опасной болезнью. Одним из самых важных
направлений профилактики ВИЧ можно считается профилактика вертикальной передачи
ВИЧ инфекции, то есть - прохождение профилактического курса лечения беременными
женщинами, являющимися носителями вируса иммунодефицита человека. Кесарево
сечение, искусственное вскармливание младенца, появившегося на свет от
инфицированной матери - это также способы профилактики ВИЧ.
Для выявления инфицированных беременных женщин, в
обязательном порядке проводится тестирование.
В повышенной зоне риска заражения ВИЧ-инфекцией является
молодое поколение. В связи с активной половой жизнью, риск заражения очень
велик. Поэтому имеет место быть контрацепции, такой как презервативы или
воздержание от незащищённых половых контактов в целом.
Профилактика инфицирования через кровь прежде всего основана
на личной гигиене. Не следует давать или брать чужие бритвы, ножницы, зубные
щётки и т.д. Так же следует следить за тем, чтобы при вакцинации или при
анализах использовались одноразовые шприцы и иглы.
Профилактические мероприятия должны нести характер
пропаганды. Это должны быть массовые рекламы, акции, проведение семинаров.
Лечение
ВИЧ-инфекции
На данный момент, вакцины от ВИЧ не существует. Это связано с
тем, что вирус постоянно мутирует, образуя различные типы и субтипы. ВИЧ быстро
приобретает лекарственную устойчивость, и эффективные ранее препараты
становятся почти бесполезны.
В разных странах ведутся интенсивные исследования с целью
обнаружить эффективные лечебные средства против СПИДа. Основное направление -
поиск противовирусных препаратов, влияющих на ВИЧ в разные стадии его
размножения, и применение методов восстановления нарушенных при СПИДе функций
иммунитета. [5]
Основной перспективной задачей остаётся изыскание препаратов,
которые блокировали бы синтез обратной транскриптазы - процесс переписывания
генетической информации с РНК на ДНК. Одним из первых более или менее
эффективных препаратов стал азидотимидин (зидовудин, AZT). Он продлевает жизнь
тяжело больных приблизительно на год. Но данный препарат является токсичным для
организма человека, так как от него страдает костный мозг, что приводит к
анемии. Вот перечень основных препаратов, которые на май 1997 года находились в
стадии клинических испытаний и давали наиболее эффективные результаты:
· Adefovirdipivoxil - отличается ацикличным
остатком сахара и одной фосфатной группой, в связи с чем легче фосфорилируется
в клетке, чем другие аналоги нуклеотидов.
· Beta-fluoro-ddA - флюороаналог
диданозина; благодаря атому фтора усваивается лучше, чем диданозин. Эффективен
против тех штаммов вируса, которые имеют множественную устойчивость к
дидеоксинуклеотидам из-за мутации в 151 триплете гена обратной транскриптазы.
· Didanozine - менее токсичный чем
AZT, аналог нуклеотида; лучше метаболизирует в клетке.
Есть ещё одно направление противовирусных препаратов -
вещества, ингибирующие протеазу ВИЧ; таким образом подавляется процесс
созревания вирусных белков и происходит формирование неполноценных,
неинфекционных вирусных частиц. Вот наиболее эффективные из них:
· Ritonavir, ABT-378 (в 10 раз сильнее Ritonavir),
Saquinavir, Indinavir. Эффективно комплексное использование этих препаратов. [5]
Разрабатываются и методы симптоматической и патогенетической
терапии. Одна из обнадеживающих разработок - препарат из растворимых молекул
CD4, способных связываться с ВИЧ и препятствовать его адсорбции на мембранах
специфических клеток.
Попытки восстановления иммунной системы с помощью ИЛ-2,
интерферонов, тимусных факторов или трансплантации косного мозга не имеют
значительного успеха. Наблюдаются лишь временные улучшения. При этом,
иммунотерапия может спровоцировать усиление репликации ВИЧ, так как вирус
размножается в основном в делящихся клетках. [5]
вирус иммунодефицит инфекция препарат
Список
использованной литературы
1. Greener,
R. "AIDS and macroeconomic impact", in S, Forsyth (ed.): State of The
Art: AIDS and Economics, IAEN, - 2002, p.49-55.
2. <http://open-heart-center.ru/articles/13-abouthiv.html>
. <http://gradusnik.ru/rus/doctor/inf/w-struct/>
. http://aidsomsk.ru/index.
php? option=com_content&view=article&id=43:
2011-05-04-04-32-25&catid=34: 2011-05-04-04-30-22&Itemid=66
<http://aidsomsk.ru/index.php?option=com_content&view=article&id=43:2011-05-04-04-32-25&catid=34:2011-05-04-04-30-22&Itemid=66>
5. <http://policlinica.ru/def6_347.html>
. <http://www.rae.ru/ru/publishing/mono07_63.html>