Анализ структуры и свойств композиционных материалов на основе циркониевой керамики и кальций-фосфатных соединений
Курсовая
работа
Анализ
структуры и свойств композиционных материалов на основе циркониевой керамики и
кальций-фосфатных соединений
Введение
Повреждения и заболевания опорно-двигательного
аппарата занимают одно из первых мест среди причин смертности, временной
нетрудоспособности развития инвалидности, а их удельный вес неуклонно растет и
принимает характер эпидемии. Все это дает толчок развитию такому направлению в
медицине, как эндопротезирование.
Эндопротезы - вживляемые в организм механические
приспособления, которые заменяют отсутствующие органы и части тела. Создание
эндопротезов - одно из величайших достижений человеческого разума, сравнимое с
освоением мирового океана и космоса. Немногие новшества современной медицины
могут сравниться с эндопротезированием по улучшению качества жизни людей.
Эндопротезирование суставов - современный наиболее эффективный метод
восстановления подвижности суставов путем их полной или частичной замены
искусственными компонентами
Современные успехи эндопротезирования являются
результатом не только возросшего мастерства хирургов, но и большего понимания
того, как ткани организма взаимодействуют с имплантатами. Эндопротезы суставов
стали изготавливать из материалов, которые сами, а также продукты их коррозии и
изнашивания не вызывают в живых тканях острую реакцию отторжения. Биологическое
воздействие организма на имплантированные материалы, обусловливающее их
старение, а значит - снижение прочности и ухудшение триботехнических
характеристик подвижных сопряжений, происходит в пределах, не приводящих к
неплановому отказу эндопротезов.
Ткани живого организма в контакте с инородными
материалами формируют поверхность раздела, на которой они могут агрессивно
воздействовать на имплантат. Жидкости организма содержат активные биологические
вещества, например, ферменты - биологические катализаторы на основе белков,
присутствующие во всех живых клетках. Они могут вырабатывать радикалы,
разрушающие полимерные имплантаты. Сложные электролиты, входящие в состав
биологических жидкостей, инициируют электрохимическую коррозию металлов и могут
вызвать растворение керамических материалов. Поэтому немногие материалы
остаются нетронутыми после имплантации. В чрезвычайных случаях организм
инициирует комплексные реакции, «атакующие» имплантат в результате чего
возникает воспаление. Поэтому в современном эндопротезировании большое
распространение получили композиционные материалы на основе циркониевой
керамики и кальций-фосфатных соединений.
Эти материалы высокобиосовместимы, не вызывают
отрицательных аллергических, иммунологических реакций, не обладают
канцерогенным и мутагенным эффектами и хорошо интегрируются с костной тканью.
Не менее важными также являются вопросы,
касающиеся обеспечения жесткости фиксации костных фрагментов. Поэтому огромное
значение имеет пористость материала. Костная ткань человека, также как и
животных способна к регенерации и через некоторое время после операции
прорастает в поры имплантата, повышая жесткость фиксации в несколько раз. С
появлением пористости изменяется не только прочность и способность к
деформированию, но и характер зависимости между напряжением и деформацией. На
деформационных диаграммах, в этом случае, присутствует участок с нелинейным
характером зависимости s=f(e). В
материалах такого рода наблюдается довольно медленное распространение трещины,
которую можно остановить путём разгрузки испытательной машины.
1.
Эндопротезирование костной ткани
1.1 Материал, используемый в
эндопротезах
В эндопротезировании используется множество
материалов в зависимости от их биологических и прочностных свойств.
Металлы и их сплавы используют в эндопротезах в
виде литых и кованых изделий. Их биомеханические характеристики и химические
свойства являются важным фактором, определяющим конструкцию эндопротезов
суставов.
Была сделана попытка применить в эндопротезах
сплавы на основе меди, никеля, железа и кобальта, используемые для изготовления
морского такелажа [1]. Их биоинертность, в отличие от благородных металлов,
зависела от свойств пассивирующих пленок, которые возникали на поверхности
изделий в солевой среде. Эксперименты на лабораторных животных показали, что
промышленные латуни, бронзы, хромо-никелевые и углеродистые стали не применимы
для имплантации из-за плохой биосовместимости и потери прочности вследствие коррозии.
Литые изделия из сплава CoCrMo под названием
Стеллит (Stellite) и кованые - из нержавеющей стали, т.е. из сплава FeCrNi,
были применены в качестве имплантатов в 40-е годы ХХ в. В работе [2] автор
отмечает, что их биоинертность также определялась свойствами пассивирующей
пленки на поверхности изделий. В 50-е годы появились имплантаты на основе
титана, циркония и их сплавов.
Литьевые сплавы на основе кобальта происходят из
группы материалов, называемых Стеллитами. Самый технологичный метод их переработки
в изделия - литье по выплавляемым моделям на воздухе. После того, как кобальт,
как компонент сплавов, подвергают исходной промышленной очистке, в нем остается
около 1% никеля. Последний оказывает определенное влияние на свойства литьевых
сплавов, т.к. кобальт является их основным компонентом, образуя матрицу, в
которой располагаются фазы на основе хрома и молибдена. Хром придает сплавам
прочность и, что наиболее важно, химическую инертность, благодаря формированию
на поверхности имплантатов пассивирующей оксидной пленки. Молибден обеспечивает
стойкость к коррозии (сплошной, питтинговой и локальной), а также длительную
прочность и надежность имплантатов.
Железо и другие примеси взаимодействуют с
основными компонентами кобальтовых сплавов, образуя карбиды и прочие вторичные
фазы, придающие матрице стойкость к абразивному изнашиванию. Концентрация
углерода в сплаве должна быть низкой, чтобы предотвратить чрезмерный рост
карбидной фазы, т.к. это уменьшает прочность и вязкость сплавов. Изделия из
литьевых сплавов подвергают отжигу, в результате чего карбидная фаза
приобретает сферическую структуру, улучшая упругость сплавов.
Достоинствами кобальтовых сплавов являются
высокие жесткость и износостойкость, а также хорошая полируемость, позволяющая
получать имплантаты с очень гладкой поверхностью. Поэтому большинство головок,
а также сферических и конических чашек эндопротезов тазобедренного сустава
изготавливают литьем из сплавов Со (66%) - Cr (27%) - Mo (7%) по стандарту ISO
5832-4. В 1950-60-е годы из этого сплава стали изготавливать ножки эндопротезов
Мура, Томпсона и Мюллера, которые часто ломались из-за ограниченной усталостной
прочности. Поломки прекратились после перехода на кованые ножки.
Таблица 1. Свойства металлов и сплавов,
применяемых для изготовления эндопротезов суставов [2]
|
Состав
материала (% масс.)
|
Модуль
упругости, ГН/м2
|
Предел
прочности при растяжении, МН/м2
|
Относительное
удлинение при разрыве, %
|
Состав
поверхностного слоя образца
|
|
Тi
(99)
|
97
|
240-550
|
>
15
|
ТiО2
|
|
Ti
(90) + Al(6)+V(4) кованый
|
117
|
860-896
|
>
12
|
ТiО2
|
|
Ti
(90) + Al(6)+ V(4) литьевой
|
117
|
860
|
>
8
|
TiO2
|
|
Нержавеющая
сталь Fe (70)+Cr(18)+Ni(12)
|
193
|
480-1000
|
>
30
|
Cr2O3
|
|
Co(66)+Cr(27)+Mo(7)
литьевой
|
235
|
655
|
>
8
|
Cr2O3
|
|
Сo(55)+Cr(20)+W(15)+Ni(10)
|
235
|
860
|
>
30
|
Cr2O3
|
|
Co(45)+Ni(35)+Cr(20)+Mo(10)
|
235
|
793-1793
|
50-8
|
Cr2O3
|
|
Co(52)+Ni(20)+Cr(20)+Mo(4)+W(4)
|
235
|
600-1310
|
50-12
|
Cr2O3
|
|
Zr(99)
|
97
|
552
|
20
|
ZrO2
|
|
Au(99)
|
207-310
|
>
30
|
Au
|
Поковочные сплавы перерабатывают в изделия
прокаткой, ковкой, штамповкой и волочением.
Кованые изделия из кобальтовых сплавов
превосходят литые по прочности и вязкости. Аналогичная закономерность
характерна и для сплавов на основе железа. Нержавеющая сталь подвержена
коррозии (межкристаллитная и питтинговая), если пассивирующая пленка на
поверхности имплантата растворилась или растрескалась под действием циклических
нагрузок. Чтобы не создавать концентраторы напряжения в пассивирующей пленке,
не применяют стальные имплантаты с грубо обработанной или пористой
поверхностью.
Титановые сплавы сочетают высокие прочность и
вязкость с коррозионной стойкостью. При экспозиции на воздухе и в контакте с
живыми тканями на титановых имплантатах образуется оксидная пленка. Титановые
сплавы, в отличие от сплавов на основе кобальта и нержавеющих сталей, очень
чувствительны к фреттинг-коррозии (возникает при колебательном перемещении
сопряженных элементов в коррозионной среде). Поэтому на поверхности титановых
имплантатов часто образуются задиры, а контактирующие с ними ткани
обесцвечиваются. С целью повышения износостойкости детали из титановых сплавов
подвергают азотированию или ионной имплантации азотом.
ПОЛИМЕРЫ
К настоящему времени ортопедия накопила опыт
применения в эндопротезах суставов практически всех конструкционных полимерных
материалов, которыми располагает техника [1, 4, 5]. Одни из них (полиамиды,
полистиролы, поливинилхлориды) недостаточно отвечают критериям биосовместимости
из-за миграции в контактирующие с имплантатом ткани технологических добавок
(пластификаторов, низкомолекулярных компонентов, стабилизаторов и др.). Вторая
группа пластиков, признанных биосовместимыми (большинство полиолефинов,
фторопласты, силиконовые полимеры) не пригодна для использования в узлах трения
эндопротезов из-за низкой износостойкости или неблагоприятного (проявляющегося
в разные сроки) влияния на организм продуктов их изнашивания. На рубеже ХХ и
ХХI веков в эндопротезах суставов нашли постоянное применение только три типа
полимеров: сверхвысокомолекулярный полиэтилен (СВМПЭ), полиметилметакрилат
(ПММА) и силиконовая резина. СВМПЭ, который предложил использовать в
эндопротезах еще Дж. Чанли, до сих пор остается непревзойденным материалом
трения в парах с металлами и керамикой из-за in vivo присущих этому материалу
износостойкости, инертности продуктов изнашивания, низкого коэффициента трения
и свойства самосмазывания. ПММА, являющийся основой костного цемента, также был
впервые применен Чанли при эндопротезировании суставов. Из силиконовых
эластомеров изготавливают имплантаты в виде гибких стержней, выполняющих
функции мелких суставов на пальцах рук и ног.
Сверхвысокомолекулярный полиэтилен получают
путем полимеризации мономеров этилена по специальной технологии [4]. Рост длины
молекулярных цепей при полимеризации может сопровождаться их ветвлением с
образованием боковых звеньев. Полиэтилены низкой плотности (молекулярная масса
30000-40000) имеют много боковых звеньев, и соответственно, значительный
свободный объем. Полиэтилены высокой плотности (50000-600000) и СВМПЭ
(молекулярная масса 3000000 и выше) имеют очень мало боковых звеньев.
Полиметилметакрилат составляет основу
ортопедического костного цемента.
В клиники его поставляют в виде порошкообразного
и жидкого компонентов (2:1 по массе), которые смешивают для приготовления
цементной пасты. Порошок (диаметр частиц 30-150 мкм) состоит из ПММА или его
сополимера со стиролом, а также из небольшого количества инициатора
полимеризации (пероксид бензоила) и, если необходимо, рентгеноконтрастных
добавок (сульфат бария). В состав жидкости входят мономер (метилметакрилат),
ингибитор (гидрохинон) и активатор (диметил-р-толуол) полимеризации. Ингибитор
препятствует полимеризации мономера во время хранения, а активатор инициирует
его полимеризацию после смешения с порошком.
Силиконовый эластомер - кремнийорганический
полимер, обладающий каучукоподобными свойствами, имеет структурную формулу

Силиконовый эластомер - кремнийорганический
полимер, обладающий каучукоподобными свойствами, имеет структурную формулу
В низкомолекулярной форме он представляет собой
силиконовую жидкость. Основу силиконовых эластомеров, применяемых для
изготовления эндопротезов, составляют макромолекулы полидиметилсилоксана (R =
R' = - CH3, молекулярная масса - 750000), содержащие некоторое количество
метилвинилсилоксановых звеньев (R' = - CH = CH2), способных образовывать
поперечные связи. Это связующее наполняют вспененным кремнием, имеющим большую
удельную площадь поверхности (400 м2/г), а затем вулканизируют в присутствии
катализаторов (редких металлов и пероксидов). Плотность поперечных сшивок между
макромолекулами после вулканизации - одна на 325 атомов кремния. Конечный
продукт имеет вид гигантской трехмерной молекулы, из которой удаляют летучие
остатки [9].
КЕРАМИКА
Хотя некоторые виды керамических материалов
используются в медицине более 25 лет, широкое применение керамики для
изготовления эндопротезов суставов началось только в 90-е годы ХХ в. В
ортопедии имеется положительный опыт использования в эндопротезах следующих
видов керамики: на основе оксида алюминия Al2O3, оксида циркония ZrO2 и на
основе фосфатов кальция - Сa3(PO4)2 и Сa5(PO4)3OH (гидроксиапатит).
Привлекательными свойствами керамики являются высокая химическая стабильность,
твердость, незначительная деформация под нагрузкой, износостойкость,
выносливость и отсутствие проблем со старением в биологическом окружении.
Фосфатную керамику относят к биоактивным, медленно растворимым in vivo
материалам, в которые врастает костная ткань. Главным недостатком керамики
считают ее хрупкость, и поэтому не всегда предсказуемое поведение керамических
имплантатов под нагрузкой [10].
Алюминиевая керамика один из широко применяемых
материалов медицинской техники. Она характеризуется очень высокой прочностью
при сжатии (предел прочности - 4500 МПа, модуль упругости - 380 ГПа), в то
время как показатели прочности при изгибе (предел прочности - 550 МПа) и
растяжении - гораздо ниже. Биологический ответ in vivo на имплантаты из
алюминиевой керамики минимален [10]. Снижение механических характеристик,
зарегистрированное при моделировании влияния биологического окружения in vivo
на прочность керамики, объясняют проникновением растворов в поры недостаточно
плотного имплантата.
С позиций дислокационной теории прочности
хрупкое разрушение керамики объясняется ростом имеющихся в образце трещин,
вследствие отсутствия у их вершин локальных зон пластической деформации. В
отличие от металлов, при растяжении которых края трещин округляются из-за
пластического течения всего образца, керамика практически не деформируется,
края трещин в ней остаются острыми, и при нагружении образца трещина растет в
длину.
Имплантаты из алюминиевой керамики получают по
технологии порошковой металлургии спеканием при 1600 оС заготовок,
спрессованных из порошка Al2O3. В качестве добавки, улучшающей спекание,
применяют магнезию MgO. Порошок Al2O3 мелкого помола должен иметь min
количество примесей, т.к. только чистая керамика обеспечивает требуемую степень
биосовместимости [11]. Такие примеси, как силикаты, щелочные оксиды и
известковые включения образуют на границах зерен стекловидную фазу с низкой
химической стабильностью. Появление стекловидной фазы уменьшает показатели
предельной и усталостной прочности имплантатов. Одной из лучших марок
алюминиевых керамик для эндопротезов суставов считают Biolox® производства
фирмы CeramTec (Германия) [20]. Обработку керамических деталей эндопротезов
проводят в «чистых» помещениях.
Таблица 2. Составы и механические свойства
керамических материалов [12]
|
Характеристика
|
Керамика
|
|
Алюминиевая
марки
|
Циркониевая,
марок
|
|
BIOLOX
forte
|
Y-TZP
ZIOLOX forte
|
Mg
- PSZ
|
|
Стандарт
|
ISO
6474
|
ISO/DIS
13356
|
-
|
|
Химический
состав
|
Al2O3
+ MgO
|
ZrO2
+ Y2O3
|
ZrO2
+ MgO
|
|
Тип
материала
|
Корунд
поликристаллический
|
Поликристаллический тетрагональный
ZrO2
|
Частично
стабилизированный ZrO2
|
|
Модуль
упругости при сжатии, ГПа
|
380
|
210
|
210
|
|
Твердость
по Виккерсу, ед.
|
2000
|
1250
|
1250
|
|
Предел
прочности при изгибе, МПа
|
>500
|
>900
|
>500
|
|
Размер
зерна, мкм
|
<2
|
<0,5
|
30
|
Типичные детали эндопротеза тазобедренного
сустава, выполняемые из керамики - шаровая головка бедренного и вкладыш
тазового компонентов. Сферические поверхности трения этих деталей подвергают
чистовой обработке с помощью алмазного инструмента. После такой обработки узел
трения эндопротеза хорошо смачивается синовиальной жидкостью и имеет низкий
коэффициент трения.
Основные свойства алюминиевой и других
конструкционных керамик медицинского назначения приведены в табл. 2 [12].
Циркониевая керамика - материал, полученный
спеканием порошкообразного оксида циркония ZrO2. Об этом виде соединения будет
указано позже.
Керамика на основе фосфата кальция CaP
характеризуется самой высокой среди технических материалов степенью
биосовместимости. Ее химическая структура подобна структуре эндогенной
(образовавшейся внутри организма) кости, поэтому вокруг имплантата не
образуется фиброзная капсула, отсутствуют воспаление и реакция организма на
инородное тело, имплантат не оказывает токсического действия на ткани и
находится в тесном контакте с костью. Керамика на основе фосфата кальция
взаимодействует с контактирующей с ней костной тканью, образуя химические
связи.
В ортопедии нашли применение два
кальций-фосфатных керамических материала: на основе фосфорнокислого кальция
Ca(PO4)2 и на основе гидроксиапатита Ca5(PO4)3OH. Они оба биоактивны и хорошо
воспринимаются организмом in vivo. Наибольшее сходство с естественной костной
тканью имеет химическая и кристаллическая структура гидроксиапатита. Свойства
выпускаемого химической промышленностью апатитового сырья для производства
материалов медицинского назначения приведены в таблице 3
Таблица 3.
Свойства
гидроксиапатита [16, 18]
|
Характеристика
|
Значение,
размерность
|
Примечание
|
|
Плотность
|
3,16
г/см3
|
Пористый
материал
|
|
Удельная
поверхность
|
50
м2/г
|
100-200
МПа
|
Зависит
от пористости
|
|
Предел
прочности при изгибе
|
<100 МПа
|
Зависит
от пористости
|
|
Модуль
упругости
|
100
ГПа
|
Зависит
от пористости
|
|
Твердость
по Виккерсу
|
500
ед.
|
Как
у оконного стекла
|
|
Коэффициент
теплового
Расширения
|
11× 10-5 К-1
|
|
|
Температура
плавления
|
1650
оС
|
Превышает
температуру разложения, температура спекания не выше 1350 оС.
|
|
Цвет
|
белый,
голубоватый
|
Зависит
от вида сырья и режимов переработки
|
В работе автор отмечает, что скорость
растворения фосфатной керамики в биологических жидкостях in vivo достаточно
высока и зависит от удельной поверхности имплантатов. Ca(PO4)3 растворяется в
кислых средах в 12,3 раза быстрее, а в щелочных - в 22,3 раза быстрее, чем
гидроксиапатит. Поскольку прочность блочных образцов фосфатной керамики
невысока, последнюю применяют преимущественно в виде покрытий на металлических
деталях эндопротезов. В этом качестве более предпочтителен гидроксиапатит,
который лучше взаимодействует с костной тканью и медленнее растворяется in
vivo, обеспечивая благоприятные условия для передачи нагрузки от эндопротеза на
костно-мышечный аппарат.
Нанесение фосфатно-керамических покрытий на
детали эндопротезов осуществляют методом плазменного напыления в регулируемых
газовых средах, например Ar/H2 или Ar/N2 [23]. Порошковые частицы керамики
увлекаются потоком газа, расплавляются в плазме, движутся к подложке и
осаждаются на ней в виде покрытия. Под действием температуры плазмы
керамические частицы частично разлагаются, поэтому микроструктура, фазовый
состав, кристалличность, содержание гидроксилов, молярное отношение Ca / P
покрытия существенно отличаются от состава исходной керамики и зависят от
параметров напыления. При температуре 1400 oС в отсутствие воды гидроксиапатит
разлагается:
Сa5
(PO4)3 OH
= 2Сa3 (PO4)2
+ Сa4 P2O9
+ H2O.
Толщина покрытий на металлических деталях
эндопротезов должна быть оптимизирована по критериям прочности и времени
растворения фосфатной керамики in vivo. Тонкие покрытия (до 10-15 мкм) имеют
высокие показатели адгезионной и механической прочности, но растворяются в
короткие сроки после имплантации. Более толстые покрытия обеспечивают
длительное контактное взаимодействие с костной тканью, но могут разрушаться под
сдвиговой нагрузкой, приводя к расшатыванию эндопротеза. Оптимальная толщина
покрытий составляет 50-100 мкм .
К сожалению, в литературе можно найти очень мало
информации о физико-химических характеристиках как исходных порошков фосфатной
керамики, так и конечных биосовместимых покрытий, тем более, в зависимости от
технологических параметров их формирования. Эта информация, как правило,
является конфиденциальной, содержащей секреты (know-how) производителей
эндопротезов. Знание этих секретов позволяет устранить отказы эндопротезов,
вызванные недостаточной биосовместимостью покрытий и прочностью фиксации
эндопротезов при имплантации.
КОМПОЗИТЫ
Композиционные материалы или композиты
представляют собой многофазные системы, которые состоят их двух или более
компонентов (фаз), сохраняющих индивидуальность (структуру и свойства) своего
вещества в составе композита. На рис. 2.5 схематически показана структура
композиционного материала. Компонент, непрерывный в объеме композита, называют
матрицей или связующим.
Рис. 2. Схема композиционного материала: 1 -
матрица, 2 - армирующие компоненты, 3 - переходный слой на границе раздела
компонентов
Другие, чаще всего, упрочняющие или армирующие
компоненты распределены в матрице в определенном порядке. Переходные
поверхностные слои расположены на границах раздела матрицы и других
компонентов. Свойства вещества переходного слоя (третьей фазы) отличаются от
свойств основных фаз. Переходный слой определяет прочность сцепления (адгезию)
матрицы и других компонентов и в большой мере - служебные свойства композита и
их постоянство во времени. При механическом нагружении композита напряжение
достигает max значений на границах раздела компонентов.
Углеродные композиты, применяемые в
эндопротезах, содержат углеродные волокна как армирующие элементы углеродных
матриц.
Чаще всего заготовку эндопротеза формуют из
высокомодульных углеродных волокон или нитей, используя методы ткачества,
послойной укладки скрепленных прошивкой углеродных тканей, лент или пучков
углеродных волокон.
Таблица 4. Прочность биологических тканей и
материалов для изготовления эндопротезов суставов [21]
|
Материал
|
Предел
текучести, МПа
|
Предел
прочности, МПа
|
Относительное
удлинение при разрыве, %
|
Модуль
упругости, ГПа
|
|
Керамика
Алюминиевая Циркониевая - полученная методом ГИП - спеченная
|
|
550
1200 900
|
|
380
200 200
|
|
Металлические
сплавы Протасул-10, кованый Нержавеющая сталь - холодная обработка -
отожженная Сплав Ti (6%) - Al (4%) - V
|
1000
750 170 890
|
1200
1000 400 1000
|
10
9 45 12
|
200
200 200 105
|
|
Углерод
и композиты Углерод, осажденный из газовой фазы Углеродные волокна -
низкомодульные - высокомодульные Композит углерод-углерод - волокна
параллельны - взаимно перпендикулярны Композит полисульфон-углерод, волокна
параллельны
|
|
350-700
1720 2760 1200 500 2130
|
2-5
0,75 1,4 1,4
|
14-21
380 240 140 60 134
|
|
Биологические
ткани Гидроксиапатит Кость Коллаген
|
|
100
80-150 50
|
0,001
1,5
|
114-130
18-20 1,2
|
|
Полимеры
ПММА костный цемент СВМПЭ Силиконовая резина
|
23
|
75
40 7-10
|
3,5
500 600
|
2,8
0,5 0,0003
|
Матричную композицию вводят в заготовку путем
пропитки или осаждают на волокнах в виде покрытий.
Полимерные композиты состоят из углеродных
армирующих длинных или коротких волокон, заключенных в полимерную матрицу.
Короткие волокна придают матрице меньшую прочность, чем длинные, но
обеспечивают возможность переработки композитов в изделия
высокопроизводительными методами экструзии и литья под давлением. Детали
эндопротезов из композитов, содержащих углеродные волокна, формуют «горячим»
прессованием стопки листов, которые состоят из пропитанных полимерным связующим
углеродных волокон (препреги) или из чередующихся углеродных и полимерных
волокон. Направления углеродных волокон в каждом слое параллельны или
составляют некоторый угол с осью формуемой детали эндопротеза (от 0 до 90о).
Заготовка образуется в результате сплавления полимерного связующего,
содержащегося в разных слоях.
Краткий обзор совокупности материалов,
применяемых для изготовления эндопротезов суставов, завершим анализом табл. 4,
в которой сопоставлены показатели прочности искусственных материалов и
биологических тканей. Хотя показатели текучести приведены в таблице только для
металлов и СВМПЭ, это не значит, что прочие материалы подвержены исключительно
хрупкому разрушению. Биоткани имеют достаточно стабильную структуру, которая не
повреждается практически до разрушения. Это подтверждает высказанную ранее
мысль, что биоткани и металлы - принципиально разные материалы.
Самые твердые из анализируемых материалов -
керамика и углерод. Они же вместе с металлами являются самыми прочными, гораздо
прочнее биотканей. Это никак не умаляет достоинств искусственных материалов,
т.к. прочность конструкций, к которым относятся эндопротезы, никогда не бывает
излишней. Тем не менее, биоткани, значительно уступающие искусственным
материалам по прочности, образуют естественные суставы, с которыми по
трибологическим параметрам не могут сравниться никакие технические узлы трения,
в том числе, искусственные суставы
Таким образом, анализ данных табл. 4 приводит к
выводу о несовершенстве технических материалов как аналогов биотканей. Первые
служат лишь для восприятия и передачи механических нагрузок, вторые являются
управляемыми биологическими системами, свойства которых зависят от
распределения биопотенциалов и наполнения биологическими жидкостями. Создание
подобных систем с использованием в качестве компонентов технических материалов
- благородная цель разработчиков искусственных суставов.
эндопротез костный ткань
композиционный
1.2 Требования, предъявляемые к
эндопротезам
Современные представления о механизме реакций
живых тканей на имплантат предполагают, что граница между ними динамична и
сложна, рис.3. В результате механической обработки, экспозиции на воздухе,
стерилизации и воздействия биологического окружения поверхностный слой
имплантата приобретает новую структуру. Его состав всегда отличается от состава
материала в объеме имплантата. Поверхность металлических имплантатов
покрывается оксидным слоем. Первой в контакт с ним обычно вступает сыворотка
крови, белки которой адсорбируются на оксидах.В работе[14] указывается на то,
что состав белкового адсорбированного слоя может изменяться в широких пределах
в течение длительного времени .
Адсорбированные белковые молекулы вступают в
донорно-акцепторное взаимодействие с оксидами имплантата, образуя комплексные
химические соединения - лиганды. Рецепторы клеточных мембран избирательно
взаимодействуют с этими лигандами. После того, как произойдет образование
достаточного количества комплексов рецептор - лиганд, посылаются сигналы в ядро
клетки в виде каскадов межклеточных химических реакций. Последние регулируют
функции клеток, контактирующих с имплантатом - адгезию, видоизменение,
осаждение матрикса (вещества, заполняющего внутриклеточные структуры) и т.п.
Адгезия макрофагов (клеток соединительной ткани)
к имплантату и их слияние на его поверхности с образованием гигантских клеток
является ответом ткани на инородное тело. Ответ зависит от таких факторов, как
ориентация пептидов (веществ, синтезируемых клетками из аминокислот) [15] или
длина углеводородных цепей, иммобилизованных на поверхности имплантата.
Регулируя ответ ткани, можно предупредить хронические и неблагоприятные реакции
заживающей раны, от которых зависит, приживется ли имплантат.
Четыре типа реакций на имплантат [16]:
Тип 1. Необходимо, чтобы имплантат не вызывал
токсического действия, убивающего клетки тканей или высвобождающего химические
соединения, которые могут мигрировать с кровью, лимфой и тканевыми жидкостями и
вызывать системные повреждения организма.
Тип 2. Формирование вокруг имплантата фиброзной
капсулы, является одной из самых распространенных реакций живой ткани. Капсула
образуется для изоляции и последующего вытеснения чужеродного тела из
организма. Эта защитная реакция возникает в результате воспалительного
процесса, реагирующего на химическую структуру имплантированного материала.
Тип 3. Через границу раздела между имплантатом и
тканью образуется связь. Такая структура, называемая «биоактивной» границей
раздела, предотвращает массоперенос между тканью и имплантатом. На границе
восстанавливается структура исходной ткани. Поскольку система имплантат-ткань
находится в состоянии динамического равновесия, этот тип реакции зависит от
скорости электрохимических и биологических процессов, протекающих в ней.
Тип 4. Скорость изменения биоактивной границы
достаточно быстрая, материал имплантата растворяется (резорбирует) и замещается
тканью. Иными словами, резорбируемый материал химически деградирует под
действием крови, лимфы, тканевых жидкостей или легко переваривается
макрофагами. Продукты деградации нетоксичны и усваиваются клетками.
Биоматериал - нежизнеспособный материал,
предназначенный для контакта с живой тканью с целью выполнения функций
медицинского назначения. Биоматериал должен быть биосовместимым и может быть
биодеградируемым.
Биосовместимость - способность имплантата
вызывать адекватную реакцию организма - хозяина в конкретных условиях их
взаимодействия. Это - не свойство материала, из которого сделан имплантат, а
характеристика системы имплантат-организм, соответствующая определенным
условиям их контактирования. Биосовместимость не означает, что имплантант
абсолютно не токсичен и не имеет других отрицательных свойств. Это - свойство
имплантированного материала вызывать такую реакцию организма, которая позволяет
решить поставленную задачу. Биосовместимые материалы взаимодействуют с
организмом согласованно и органично, не вызывая заболеваний.
Биодеградируемые материалы при контактировании с
живыми организмами частично или полностью растворяются (поглощаются
макрофагами, включаются в метаболические или биохимические процессы) и
заменяются живой тканью.
Биоустойчивость материалов - свойство,
противоположное биодеградируемости - способность материалов противостоять
воздействию биологической среды, сохраняя функциональные свойства.
Для характеристики биосовместимых материалов,
имплантируемых в костную ткань, используют термины: биотолерантные, биоинертные
и биоактивные [29].
Биотолерантные материалы взаимодействуют с
костью посредством дальнего остеогенеза, т.е. они отделяются от костной ткани
прорастающим фиброзным слоем.
Биоинертные материалы практически не
взаимодействуют с тканями, находящимися с ними в контакте, не вызывают
образования явно выраженного фиброзного слоя (толщина капсулы не превышает 50
мкм) и не стимулируют остеогенез. Кость может формироваться вблизи поверхности
биоинертного имплантата. Последняя, как правило, имеет защитный слой, который
препятствует выходу из имплантата ионов и диффузии в него биологической
жидкости. Интеграция биоинертных материалов с костью осуществляется путем
проникновения соединительной ткани в поры имплантата. Абсолютно биоинертных
материалов не существует, т.к. на границе ткань-имплантат всегда регистрируется
биологический отклик, интенсивность которого зависит от многих факторов (табл.
7).
Таблица 7. Факторы, влияющие на биологический
отклик костной ткани при контактировании с ортопедическим имплантатом [29]
|
Реакции
со стороны ткани зависят от:
|
Реакции
со стороны имплантата зависят от:
|
|
Типа
ткани
|
Состава
имплантата
|
|
Повреждения
ткани
|
Фаз
в имплантате
|
|
Возраста
ткани
|
Границ
между фазами
|
|
Циркуляции
крови и лимфы в ткани
|
Структуры
поверхности
|
|
Движения
ткани на границе с имплантатом
|
Электрохимических
реакций
|
|
Соответствия
места установки имплантата анатомо-физиологическим критериям
|
Точности
установки имплантата
|
|
Механической
нагрузки на ткань
|
Интенсивности
нагрузок
|
|
Общих
реакций организма (иммунологических, аллергических, нейроэндокринных)
|
Выполнения
функций организмом
|
Биоактивные материалы вызывают биологический
отклик в организме, обусловливающий интеграцию материала и организма. Они
предназначены для связывания с биологическими системами, имея целью повышение
эффективности лечения, образование или замещение любой ткани или органа, для
выполнения тех или иных функций организма. Все биоактивные имплантаты, применяемые
в травматологии и ортопедии, объединяет наличие на их поверхности карбонатного
слоя, эквивалентного по составу и структуре минеральной фазе кости. Такой слой
имеет структуру поликристаллических агломератов, в состав которых при
контактировании с костью включаются коллагеновые фибриллы.
1.3 Циркониевая керамика в
эндопротезировании
Размер зерна циркониевой керамики (0,5 мкм)
меньше, чем алюминиевой. Это обусловливает лучшую полируемость и высокую
износостойкость циркониевых имплантатов.
Кристаллическую структуру циркониевой керамики
стабилизируют введением 3-9% магнезии MgO или оксида иттрия Y2O3.В работе[41]
рассматривается керамика марки ziolox
forte. Благодаря ее
высоким механическим свойствам она широко применяется при производстве
эндопротезов [41]. Ее более ранним аналогом является керамика марки Mg-PSZ
(partially stabilized zirconia - частично стабилизированная двуокисью магния
керамика на основе оксида циркония). Обе марки выпускаются фирмой CeramTec,
Германия. Введение стабилизаторов преследует следующую цель. Исходный ZrO2
может находиться в трех кристаллических фазах - моноклинной, тетрагональной и
кубической. Превращения фаз, происходящие при остывании спеченного имплантата,
сопровождаются изменениями их объема и образованием трещин. Добавки стабилизаторов
инициируют оптимальное протекание фазовых превращений. В вершинах трещин
возникают локальные напряжения сжатия, препятствующие росту трещин.
Циркониевая керамика уступает алюминиевой по
параметрам прочности при сжатии, но значительно прочнее ее при изгибе. Ее
модуль упругости при сжатии выше, чем у сплавов Co-Cr. Спекание имплантатов
методом «горячего» изостатического прессования (ГИП) позволяет повысить их
плотность и механические свойства. Биологический ответ на имплантаты из
циркониевой керамики такой же спокойный, как и на имплантаты из алюминиевой.
Испытания in vivo показали, что эндопротезы из циркониевой керамики сохраняют
биосовместимость в течение десятков лет. Можно сказать,что надлежащим образом
изготовленные керамические детали эндопротезов, несмотря на хрупкость керамики,
достаточно надежны. Их отказы из-за поломок случаются гораздо реже, чем по
другим причинам.
Из данных литературы в области теоретических
исследований деформации пористых тел видно, что интенсивные исследования процессов
деформирования пористых тел привели к возникновению в области порошкового
материаловедения нового направления - механики деформируемых порошковых тел.
Созданное направление, основанное на континуальных представлениях, в свою
очередь, обусловило формирование новой системы взглядов на процессы
консолидации порошков и пористых металлов. В противоположность воззрениям,
существовавшим ранее и связанным с дискретными представлениями, новые
представления используют понятия и методы механики сплошной среды - порошки и
пористые тела рассматриваются как сплошные микронеоднородные тела, наделённые
определёнными эффективными свойствами, главным из которых является необратимая
макроскопическая объёмная сжимаемость. Иными словами механика пористых тел
основана на ряде положений, среди которых особое место занимает принцип
эквивалентности: свойства беспористого порошкового материала в микрообъёмах
аналогичны свойствам поликристаллического материала.
Хрупкое разрушение пористой керамики протекает в
две стадии: образование и рост трещины критического размера. При этом рост
трещины может быть контролируемым и неконтролируемым. Типичный график такого
вида разрушения представлен на рис. 4. На участке ОА в материале происходит
постепенное накопление энергии, приводящее к зарождению трещины или началу
движения имеющейся трещины и дальнейшему контролируемому её росту (участок АB).
Далее, на участке BC происходит быстрый неконтролируемый рост трещины, на этот
процесс расходуется часть запасённой в материале энергии. На заключительном
этапе (участок CD) снова наблюдается контролируемый рост трещины вплоть до
разрушения образца. Согласно критерию Грифитса, неконтролируемый рост трещины
происходит, когда
sк³ c (2gE/ak)1/2
(1.1),
где sк - номинальное
критическое разрушающее напряжение, g -эффективная
поверхностная энергия разрушения, E - модуль упругости, ak - критический размер
трещины, c - коэффициент, характеризующий геометрию нагружения. Для обеспечения
контролируемого (медленного) роста трещины необходимо, чтобы напряжения в материале
были меньше sк. С присутствием пор процесс деформирования
керамики приобретает характер “относительно хрупкого” материала.

Рис.4. Общий вид диаграммы при относительно
хрупком разрушении материала .
Медленное распространение трещин может быть
обусловлено их взаимодействием с порами.
По типу структуры пористая керамика
подразделяется на ячеистую и зернистую . Ячеистая керамика может иметь
пористость до 90%, зернистая - до 40%. Материалы этих типов существенно различаются
и по свойствам. Структура керамики зернистого строения представляется более
регулируемой. Поэтому улучшения свойств и приближения к свойствам
конструкционного материала можно ожидать в этом классе керамики.
2. Механическое
поведение композитов ZrO2
- ГАП
На рисунках 5-9 представлены деформационные
диаграммы при активной деформации сжатием композиционных материалов ГАП-ZrO2,
полученных при температуре спекания 1400оС с изотермической выдержкой в течение
7 часов. Из рисунка видно, что в процессе нагружения композитов наряду с чисто
упругим деформированием происходит постепенное накопление микроповреждений
(нелинейный участок). В отличие от беспористых керамик процесс разрушения
происходит постепенно
Рис.5. Структура композиционных материалов ГАП-ZrO2,
полученных при температуре спекания 1400оС с изотермической выдержкой в течение
7 часов, состава: 10% ГАП - 90% ZrO2.
Рис.6. Структура композиционных материалов
ГАП-ZrO2, полученных при температуре спекания 1400оС с изотермической выдержкой
в течение 7 часов, состава: 20% ГАП - 80% ZrO2
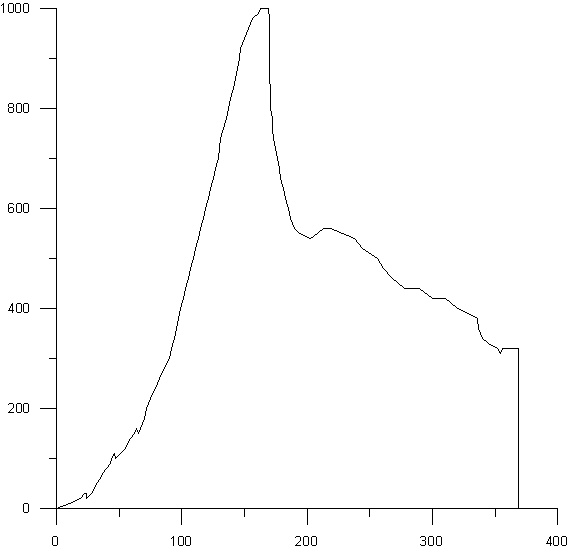
Рис.7. Структура композиционных
материалов ГАП-ZrO2, полученных при температуре спекания 1400оС с
изотермической выдержкой в течение 7 часов, состава: 30% ГАП - 70% ZrO2
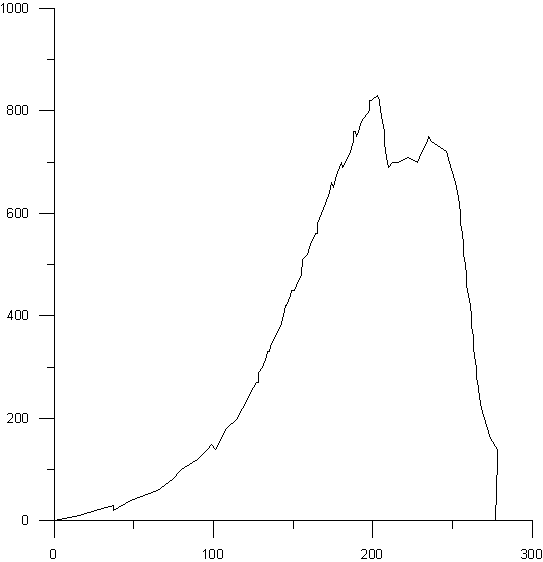
Рис.8. Структура композиционных
материалов ГАП-ZrO2, полученных при температуре спекания 1400оС с
изотермической выдержкой в течение 7 часов, состава: 40% ГАП - 60% ZrO2
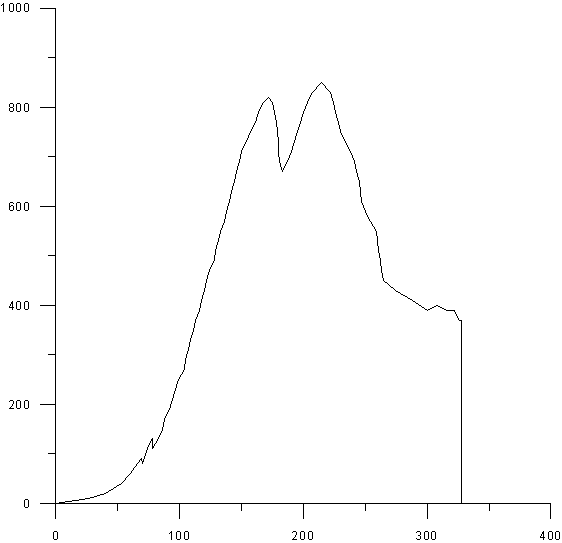
Рис.9. Структура композиционных
материалов ГАП-ZrO2, полученных при температуре спекания 1400оС с
изотермической выдержкой в течение 7 часов, состава: 50% ГАП - 50% ZrO2
Вывод
В данной работе проводились исследования
механического поведения композиционных материалов ZrO2-ГАП
в испытаниях на сжатие. В ходе оцифровки диаграмм была выявлена зависимость
прочностных свойств от процентного содержания ГАП и циркониевой керамики. Не
смотря на то, что композиционные материалы диаграммы которых приведены на
рисунках незначительно отличаются по объёму порового пространства видно, что
прочность композита с большим количеством диоксида циркония существенно больше,
чем прочность композита с большим содержанием ГАП.
Список литературы
1.
Ройтберг
Г.И. Исследование работоспособности конструкционных термопластов для
эндопротезирования суставов. - Дис. … канд. мед. наук. - М., 1972.
2.
Мовшович
И.А., Виленский В.Я. Полимеры в травматологии и медицине. - М.: Медицина, 1978.
- 320 с.
3. Structural
Biological Materials: design and structure - property relationships / Ed. by M.
Elices. - Amsterdam: Pergamon, 2000. - 362 p.
4.
Андреева
И.Н., Веселовская Е.В., Наливайко Е.И., Печенкин А.Д., Бухгалтер В.И., Поляков
А.В. Сверхвысокомолекулярный полиэтилен высокой плотности. - Л.: Химия, 1982. -
80 с.
5.
Проспект
фирмы Hoechst, 1993. - 8 c.
6. Petty
W. Fixation methods // In: Total Joint Replacement / Ed. by W. Petty,
Phyladelphia: W.B. Saunders Co., 1991, p. 61-74.
7. Brown
S.A., Bargar W.L. The influence of temperature and specimen size on the
flexural properties on PMMA bone cement // J. Biomed. Mater. Res., 1984, V. 18,
p. 523 - 536.
8.
Гаврюшенко
Н.С. Влияние различных физико-механических факторов на судьбу эндопротеза
сустава и его функциональные возможности // Вестник травматологии и ортопедии
им. Н.Н. Приорова, 1994, N
4, с. 30-34.
9. Frisch
E.E. Technology of silicone in biomedical applications // In: Biomaterials in
Reconstructive Surgery / Ed. by L.R. Rubin, St. Louis: C.V. Mosby, 1983, p.
73-90.
10. Black
J. Biological performance of materials. - New York: Marcel Dekker, Inc., 1992.
- 470 p.
11.
ISO 6474. Implants for surgery -
Ceramic materials based on high - purity alumina. 2-nd
ed.
1994-02-01.
12. Willmann
G. Hip - joint replacement - still a challenge to orthoplaedists, tribologists
and designer // In: Industrial and Automotive Lubrication, 11-th Int. Coll.,
Esslingen, V. 1, 1998, p. 7-20.
13. Liu
D.M., Chou H.M., Wu J.D., Tung M.S. Hydroxyl apatite coating via amorphous
calcium phosphate // Mater. Chemistry and Physics, 1994, V.37, N 1, p. 39-44.
15. Kao
W.J. Evaluation of protein - modulated macrophage behavior on biomaterials:
designing biomimetic materials for cellular engineering // Biomaterials, 1999,
V.20, p. 2213-2221.
16.
Карлов
А.В., Шахов В.П. Системы внешней фиксации и регуляторные механизмы оптимальной
биомеханики. - Томск: STT, 2001. - 480 с.
17. Ratner
B.D. Biocompatibility: the convoluted path to a working definition // Trends in
Рolymer
Science, 1994, V.2, N 12, p. 402-403.
18. Zirconia
ceramic heads for modular total hip femoral component : Advice to users on
resterilization. Safety Notice MDA SN 97617, 1996.