Феноксиуксусная кислота
Ведение
арендиазониевый соль
фенол кислота
Феноксиуксусная кислота относится к
производным фенола, а также уксусной кислоты.

Рис.
Аминные соли феноксиуксуной и
трихлорфеноксиуксусной кислот являются гербицидами, они были приняты на
вооружение армией США вскоре после войны с Японией. Одновременно эти кислоты,
их соли и эфиры стали использоваться для химической прополки сорняков в посевах
злаковых культур, а смеси эфиров (2,4,5-трихлорофенокси)- и
(2,4-дихлорофенокси)уксусной кислот - для уничтожения нежелательной древесной и
кустарниковой растительности. Это позволило военно-промышленным кругам США
создать крупнотоннажные производства 2,4-дихлор-, 2,4,5-трихлорфенолов, а на их
основе кислот 2,4-Д и 2,4,5-Т.


,4,5 -Т 2,4 -Д
Рис.
Цель работы: синтез феноксиуксусной кислоты и рассмотрение литературы по
способам получения и химическим свойствам фенолов.
1. Литературный обзор.
Синтез и свойства фенолов
.1 Методы получения
фенолов
Фенолы
выделяют из легкого масла каменноугольной смолы. Кроме того, существует целый ряд синтетических методов получения
фенолов.
1.1.1 Сплавление аренсульфоновых кислот со щелочами
При
нагревании аренсульфоновых кислот с гидроксидами щелочных металлов до 300 °С получаются фенолы. Например, из
нафталин-2-сульфокислоты таким путем получают нафтол-2 [1]:

Рис.
При
сплавлении со щелочами протекает нуклеофильное замещение по механизму присоединения-отщепления.
1.1.2 Гидролиз галогенаренов
В
отличие от галогеналканов, для гидролиза
галогенаренов требуются сильные основания, высокие темпе ратуры и давления. Например, фенол получают
обработкой хлорбензола 10%-ным
водным едким натром при 300 °С и 200 кгс/см2 (~2-107 Па)
[1]:

Рис.
Щелочной
гидролиз хлорбензола протекает по механизму отщепления-присоединения. Введение в орто- и пара-положения заместителей
с - М - эффектом облегчает процесс
гидролиза, но в этом случае реакция протекает
так же, как и в случае сплавления аренсульфоновых кислот со щелочами, т. е. по механизму
присоединения-отщепления.
1.1.3 Кипячение
арендиазониевых солей
Если водный раствор соли диазония
подвергнуть нагреванию, то образуется фенол. Считают, что при этом происходит
нуклеофильное замещение по механизму SN1. При работе преимущественно исходят из растворов сульфатов, так
как из галогенидов солей диазония образуются также и арилгалогениды [2]:

Рис.
В присутствии спиртов помимо
образования простых эфиров фенолов по механизму SN1 происходит также
и свободно-радикальное восстановление с образованием аренов.

Рис.
1.1.4 Окисление арилмагнийгалогенидов
При
автоокислении или взаимодействии
с эфирами борной кислоты с последующим окислением пероксидом водорода реактивы Гриньяра также
дают фенолы [2]. Напри мер:
1.2
Реакции фенолов
При
реакциях фенолов также могут разрываться связи О- Н или С - О. Часть реакций приводит к изменениям в
арильном остатке.
.2.1 Кислотно-основные реакции
Термодинамическая
кислотность фенолов значительно выше, чем у
спиртов, поскольку фенолят-ионы за счет
участия электронной пары атома кислорода мезомерно стабилизованы:

Рис.
Из
сравнения значений рКа фенола, изомерных нитрофенолов, 2,4-динитрофенола и пикриновой кислоты
(2,4,6-тринитрофенол) видно, что электроноакцепторные заместители повышают
кислотность фенольной
гидроксильной группы.
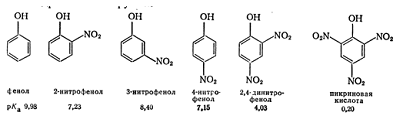
Рис.
1.2.2 Ацилирование
При этерификации
фенолов непосредственно кислотой выходы
эфиров обычно невелики. Поэтому соответствующие сложные эфиры лучше получать ацилированием фенолов с помощью ангидридов или хлорангидридов кислот [1]:

Рис.
При
повышенных температурах в присутствии хлорида алюминия сложные эфиры фенолов претерпевают перегруппировку
Фриса (1908г.) в
о- или п-оксифенилкетоны [3]:

Рис.
При
температуре около 60 °С предпочтительнее образуются п-изомеры, при 160 °С - преимущественно о-замещенные
соединения.
1.2.3 Образование простых эфиров фенолов
При SN2-реакции между
алкоголятом или фенолятом и галогеналканом образуются диалкиловые или же
алкил-арилобые эфиры [1]. Например:

Вместо
галогеналкана можно использовать в этой реакции диалкилсульфаты или эфиры
толуол-4-сульфокислоты [1]:

1.2.4 Нуклеофильное замещение гидроксильной группы
При
взаимодействии фенола с хлоидом фосфора (V) образуется лишь немного хлорбензола, а основным
продуктом является трифенилфосфат [2]:

Рис.
При таком
нуклеофильном замещении гидроксильной группы на атом хлора, протекающем по механизму присоединения-отщепления, электроноакцепторные заместители в орто- и/или пара-
положении повышают реакционную
способность соединения; так, пикриновая кислота в тех же условиях гладко
превращается в пикрилхлорид (2,4,6-тринитрохлорбензол) [2]:

Рис.
При
нагревании фенолов с аммиаком и хлоридом алюминия до 400 °С образуются амины [2], например:
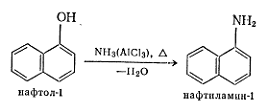
.2.5 Электрофильное замещение
Гидроксильная
группа относится к
ориентантам первого рода и поэтому облегчает электрофильное замещение. В моноядерных фенолах заместители
вступают в орто- и пара-положения.
Особенно легко осуществляется бромирование фенола [4]:

Рис.
При
избытке брома образуется 2,4,4,6-тетрабромциклогексади-ен-2,5-он-1. Для синтеза 2- или 4-бромфенолов
бромирование следует вести
при 0°С в сероуглероде, или же вообще выбрать другой путь синтеза.
Фенолы
вступают также в реакции нитрования, сульфирования, азосочетания, алкилирования
и ацилирования по Фриделю - Крафтсу. Например, при взаимодействии фенола с аллилбромидом в
присутствии хлорида алюминия
образуется 2-аллилфенол [4]:

Кроме того,
следует отметить реакции Кольбе - Шмитта, а
также оксиметилирования (реакция Ледерер - Манассе, 1894 г.), по которой фенолы
обрабатывают формальдегидом в присутствии
разбавленных кислот или щелочей. Из самого фенола при этом получается смесь салицилового спирта
(2-оксиметилфепол) и 4-оксиметилфенола.
Механизм этой реакции разбирается ниже на примере образования салицилового спирта [1]:
Кислотный
катализ

Рис.
Основный катализ

Рис.
При избытке
формальдегида получают бис- и трис(оксиметил) фенолы:
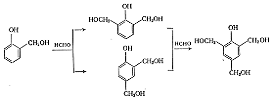
Рис.

Рис.
Образовавшиеся
оксиметилфенолы могут реагировать с фенолом, давая диоксидифенилметан [1],
например:

Рис.
1.2.6 Гидрирование
Фенол может быть каталитически
прогидрирован до циклогексанола [4]:

Рис.
1.2.7 Окисление
Такие способные к переносу электрона
соли, как хлорид железа (III) или гексацианоферрат (III) калия, окисляют фенолы
до арилоксирадикалов. Поскольку свободный электрон в них делокализован, то
такие радикалы, как правило, особенно реакционноспособны и димеризуются с
образованием связей С-С или, реже, С-О, например [5]:
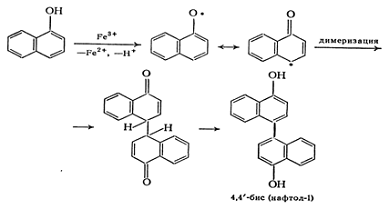
Рис.
Если по стерическим соображениям
сочетание ароксильных радикалов невозможно, то такие радикалы стабильны. Так,
из 2,4,6-три-трет-бутилфенола получают 2,4,6-три-трет-бутилфеноксильный радикал
в виде темно-голубого кристаллического соединения с т. пл. 96 °С [6].

Рис.
При
окислении одноатомных фенолов в щелочном растворе пероксидисульфатом образуются двухатомные фенолы
(реакция Эльбса, 1890
г.). Обычно при этом окисляется пара-положение, если же оно занято, то получаются 1,2-диоксипроизводные
[7,8].

Рис.
Обсуждение
результатов
Механизм реакции:

Рис.
Для получения феноксиуксуной кислоты
по выбранной методике синтеза в круглодонной колбе смешала 3 г фенола, 30 мл
25%-ного раствора гидроксида натрия (раствор гидроксида натрия получила из
кристаллического NaOH) и 7,2 г хлоуксусной кислоты.
Смесь нагревала на кипящей водяной
бане с воздушным обратным холодильником в течение одного часа, а затем охладила
и добавила 18 мл 10% HСl до pH 3-5 и экстрагировала дважды хлористым метиленом порциями по 15
мл. Эфирные вытяжки (нижний слой) осторожно слила в стакан с 30 мл 5%-ного
раствора Na2CO3. После прекращения
выделения газа смесь встряхнула в делительной воронке, эфирный слой отбросила а
водный (верхний слой) медленно и осторожно при перемешивании в стакане
подкислила концентрированной HCl до pH 3-5. Выпавшую кислоту отфильтровала, промыла водой и сушила на
воздухе . Перекристаллизовывала из воды.
3. Экспериментальная
часть
.1 Реагенты и
оборудование
Таблица
|
Брутто формула
|
Молекулярный вес, г /
моль
|
Температура плавления, 0С
|
Температура кипения, 0С
|
Плотность, г /
мл
|
|
Фенол
|
С6Н6О
|
94.11
|
40.8
|
181.84
|
1.07
|
|
Хлоруксусная кислота
|
C2H3ClO2
|
94.5
|
63
|
189
|
1.58
|
|
Соляная кислота (10%)
|
НСl
|
36.5
|
-18
|
103
|
1.048
|
|
Гидроксид натрия (25%)
|
NaOH
|
40
|
323
|
1403
|
1.27
|
|
Карбонат натрия
|
Na2CO3
|
106
|
1600
|
|
|
Диэтиловый эфир
|
C4H10O
|
74.12
|
-116.3
|
34.6
|
0.714
|
3.2 Методика
эксперимента

Рис.
В круглодонной колбе
смешивают 1 г фенола, 10 мл 25%-ного раствора гидроксида натрия и 2,4 г
хлоруксусной кислоты.
Смесь нагревают на
кипящей водяной бане с воздушным обратным холодильником в течение 1 ч, а затем
охлаждают 6 мл 10%-ной соляной кислоты до рН 3-5 и экстрагируют дважды эфиром
порциями по 5 мл. Хлористый метилен осторожно смешивают в стакане с 10 мл
раствора карбоната натрия. После прекращения выделения углекислого газа смесь
встряхивают в делительной воронке. Эфирный слой отбрасывают, а водный медленно
и осторожно при перемешивании в стакане подкисляют концентрированной соляной
кислотой до рН 3-5. Выпавшую феноксиуксусную кислоту отфильтровывают, промывают
водой и сушат на воздухе. Перекристаллизовывают из воды.
Феноксиуксусная кислота
представляет собой бесцветные пластинки или иглы. Т. пл. 90 °С, плохо
растворима в воде, хорошо - в этиловом спирте, диэтиловом эфире, бензоле,
уксусной кислоте.
Выводы
1. Рассмотрена литература по
способам получения и химическим свойствам фенолов
. Произведен синтез феноксиуксусной
кислоты
Библиографический список
1. З. Гауптман, Ю. Грефе, Х. Ремане Органическая химия. М.: Химия,
1979.
. А.Н.Несмеянов, Н.А.Несмеянов Начала Органической Химии. М.:
Химия, 1969, т.1.
. Р. Моррисон, Р. Бойд Органическая химия. М.: Мир, 1974.
. П. Каррер Курс Органической Химии, Л.: Государственное -
научнотехническое издательство Химической литературы, 1960.
5. Робертс Дж., Касерио М. Основы органической химии: Пер. с англ.
М.: Мир, 1978, Т.2.
. Терней А.Современная органическая химия: В 2т.: Пер. с англ. /
Под ред. Суворова Н.Н. М.: Мир, 1981. Т.1.
. Нейланд О.Я. Органическая химия. М.: Высшая школа, 1990.
. Кери Ф., Сандберг Р. Углубленный курс органической химии: в 2т.
Пер. с англ. / Под ред. Потапова В.М. М.: Химия, 1981.