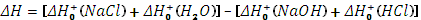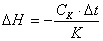Тепловой эффект (энтальпия) химической реакции
СПб ГУАП
ОТЧЕТ О ЛАБОРАТОРНОЙ РАБОТЕ
Тепловой эффект (энтальпия) химической реакции.
по курсу: Химии
работу выполнил
студент гр.
Салий Н.Л.
преподаватель
Огурцова И.В.
Санкт-Петербург 2012 г.
1.
Теоретическая часть
Энтальпия - термодинамическая функция состояния,
характеризирующая полную энергию системы в условиях постоянного давления и
температуры, и представляет собой сумму внутренней энергии и работы против
внешних сил.
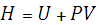
К другим термодинамическим функциям состояния относят:
) Внутренняя энергия

 ,
,
где Q-теплота, сообщенная системе, A-работа, совершенная системой.
) Энтропия
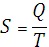
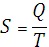 ,
,
где T-температура системы.
) Потенциал Гиббса


Энтальпия образования сложного вещества из простого есть тепловой
эффект хим. реакции образования данного вещества из простых в стандартных
состояниях, отнесенный к одному молю образовавшегося вещества.
Стандартное состояние в-ва - это такое его агрегатное состояние,
которое наиболее устойчиво (имеет наименьшую энтальпию) в стандартных условиях.
Закон Гесса.
Изменение энтальпии в хим. реакции есть разность между суммами
энтальпий образования продуктов реакции и исходных в-в с соответствующими
стехиометрическими коэффициентами.
2.
Цель работы
Определить энтальпию реакции нейтрализации HCl + NaOH = NaCl + H2O, сравнить измеренное
значение с теоретическим и вычислить относительную ошибку измерения.
3.
Описание эксперимента
Взвешиваем внутренний стакан калориметра, опускаем в него
мешалку и взвешиваем внутренний стакан с мешалкой. Наливаем в стакан щелочь.
Взвешиваем стакан с объемом щелочи. Собираем калориметрическую установку
согласно рисунку. Включаем магнитную мешалку. Проводим предварительный период
реакции, регистрируя изменение температуры через 1 минуту в течение 5 минут.
После вводим через воронку раствор кислоты. Регистрируем температуру в течение
главного периода реакции каждые 15 секунд в течение одной минуты. Продолжаем
регистрацию температуры каждую минуту в течение 5 минут заключительного периода
реакции. Взвешиваем стакан с продуктами реакции.
Таблица
|
Масса стакана m1, г
|
Масса стакана с
мешалкой m2, г
|
Масса мешалки mмеш=m2-m1,
г
|
Масса стакана с
мешалкой и раствором щелочи m3, г
|
Масса стакана с
содержимым после опыта m4, г
|
Масса раствора
после опыта mp= m4
- m2, г
|
Масса раствора
кислоты mк= m4 - m3,
г
|
|
47,89
|
48,29
|
0,40
|
96,08
|
134,2
|
85,91
|
38,12
|
энтальпия тепловой эффект реакция
|
Время от начала
опыта мин.
|
Предварительный
период
|
Главный период
|
Заключительный
период
|
|
0
|
1,0
|
2,0
|
3,0
|
4,0
|
4,25
|
4,5
|
4,75
|
5,0
|
6,0
|
7,0
|
8,0
|
9,0
|
10
|
|
Температура,°C
|
22,8
|
22,6
|
22,6
|
22,6
|
22,7
|
29,6
|
31,6
|
33,8
|
35,4
|
34,9
|
34,2
|
34
|
33,8
|
33,6
|
Обработка результатов.
Изменение энтальпии реакции DН рассчитывать по
уравнению
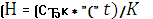
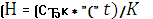 =
=
Где
Ск - теплоемкость всех частей калориметрической
системы, кал/t°C; Dt - изменение температуры
в ходе реакции, °C; Ск * Dt - количество выделившегося при реакции тепла,
кал; К - число молей эквивалентов кислоты в заданном объеме.
. Теплоемкость калориметрической системы вычислять по
приближенной формуле
Ск=Сстакана+Стермометра+Смешалки+Сраствора
Теплоемкостью термометра пренебречь, а теплоемкости остальных
частей определить по формулам:
Сстакана= Сстекла*m1=0,2 * 47,29= 9,368 кал/t°C
Сраствора=Сраствора*mp=1 * 85,91=85,91 кал/t°C
Смешалки=Сстали*mмеш=0,107 *0,4=0,0428 кал/t°C
. Изменение температуры в ходе реакции определить графически
в соответствии с рис.3.2 на миллиметровой бумаге.
3. Определить числа молей кислоты в растворах
К=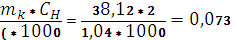
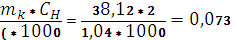
. По построенному графику определяем Δt и находим изменение энтальпии
NaOH + HCl = NaCl + H2O