Сравнение реакторов идеального вытеснения и полного смешения в изотермическом режиме работы
Задание на курсовой проект
Процесс - синтез аммиака.
Исследовать влияния соотношения начальных
концентраций J=P(NH2/N2)
на процесс в изотермическом режиме идеального вытеснения и полного смешения.
Сравнить изменение соотношения объёмов реакторов (объёмов катализатора) в
различных режимах.
Построить графики зависимости:
/V1 = f(J),
где V1 u V2 - объемные расходы газового потока
на входе и выходе из реактора (м3/сек)
Хр = f
(T),
где Xp
- равновесная степень превращения. Т - температура (К), диапазон температур 500
- 900 (К)
U = f(H),
где Н - высота реакционной зоны (м), U
- скорость процесса
Х = f
(S),
где Х - текущая степень превращения,S
- время реакции (с).
Vрив =
f (T),
где Vрив
- объем реактора идеального вытеснения, м3
Vрпс =
f (T),
где Vрпс
- объем реактора полного смешения, м3
Vрпс/
Vрив =
f (T),
Условия и исходные данные процесса:
Температура процесса Т = 500-600 К
Производительность реактора по аммиаку - 1360
т/сут. Исходная смесь состоит из азота и водорода в соотношении 1:3; Р=300атм;
линейная скорость газа ω=1 м/с.
Принять конечную степень превращения Х2=0,9Хр. Остальные
данные взять из литературы.
Содержание
Введение
I. Краткие
сведения о технологическом процессе
II. Материальные
модели химических реакторов
.1
Химические реакторы
.1.1
Модель реактора идеального вытеснения
.1.2
Модель реактора полного смешения
III.
Программы расчёта. Результаты
Заключение
Список
использованной литературы
Введение
Одним из основных элементов любой
химико-технологической системы является химический реактор. Химический реактор
- это аппарат, в котором осуществляются химические процессы, состоящие из
реакций массо- и теплопереноса. К реакторам относятся, например промышленные
печи, реакторы с механическим, пневматическим и струйным перемешиванием,
варочные котлы, гидрататоры.
Все аппараты, расположенные до реактора,
необходимы для подготовки сырья к химической обработке; аппараты после реактора
- для разделения получившихся продуктов. От правильности выбора реактора и его
совершенства зависит эффективность всего технологического процесса.
Основные требования к промышленным
реакторам.
1. Максимальная производительность и
интенсивность работы.
2. Высокий выход продукта и наибольшая
селективность процесса. Они обеспечиваются оптимальным режимом работы реактора:
температурой, давлением, концентрацией исходных веществ и продуктов реакции.
. Минимальные энергетические затраты на
перемешивание и транспортировку материалов через реактор, а также наилучшее
использование теплоты, подводимой в реактор для нагрева реагирующих веществ до
оптимальных температур
. Легкая управляемость и безопасность работы.
Эти условия обеспечиваются рациональной конструкцией реактора и малыми
колебаниями параметров технологического режима.
. Низкая стоимость изготовления реактора и
ремонта его.
. Устойчивость работы реактора при значительных
изменениях основных параметров режима.
Обычно не удается реализовать процесс в реакторе
таким образом, чтобы были удовлетворены одновременно все предъявляемые к нему
требования в виду их противоречивости. Приходится вырабатывать наиболее
рациональные и экономичные решения, обеспечивающие поддержание заданных
значений основных параметров процесса [1].
При исследовании работы реакторов составляется
математическое описание, под которым понимается система уравнений, позволяющих
определить изменение в нём концентраций, температуры, давления и других
параметров. Химические реакторы отличаются друг от друга по конструктивным
особенностям, размеру, внешнему виду. Наиболее значимы следующие признаки классификации
химических реакторов и режимов работы: режим движения реакционной смеси,
условия теплообмена в реакторе, фазовый состав, способ организации процесса,
характер изменения параметров процесса во времени, конструктивные
характеристики.
Так в зависимости от режима движения реакционной
смеси существуют реакторы смешения и вытеснения. Реакторы смешения - ёмкостные
аппараты с механическим перемешивающим устройством (мешалкой) или
циркуляционным насосом. Реакторы вытеснения - трубчатые аппараты, имеющие вид удлинённого
канала.
При отсутствии теплообмена с окружающей средой
химический реактор называется адиабатическим. Вся теплота, выделившаяся или
поглотившаяся в нём, идёт на обогрев или охлаждение реакционной смеси.
Существуют изотермические реакторы, в которых обеспечивается постоянство
температуры за счёт теплообмена с окружающей средой.
Также можно выделить политермический режим, в
нём часть тепловой энергии химической реакции идёт на изменение теплосодержания
системы, а часть - на теплообмен с окружающей средой.
При проектировании реактора необходимы сведения
о кинетике химической реакции и производительности реактора. Разрабатывая схему
реактора, нужно решить, будет ли реактор работать непрерывно или периодически,
определить модель реактора и указать способы подвода или отвода теплоты.
І. Краткие
сведения о технологическом процессе
Физико-химические основы процесса.
Синтез аммиака из элементов осуществляется по уравнению реакции:
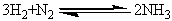 ,
,
∆Н<0
Реакция обратимая, экзотермическая,
характеризуется большим отрицательным энтальпийным эффектом (∆Н298
= -91,96 кДж/моль) и при высоких температурах становится еще более
экзотермической (∆Н725=-112,86 кДж/моль). Согласно принципу Ле
Шателье при нагревании равновесие смещается влево, в сторону уменьшения выхода
аммиака, а при повышении давления реакция и непрерывном отводе тепла -
сдвигается вправо. В зависимости от условий процесса она может протекать слева
направо и наоборот. При определенных условиях скорости образования аммиака и
его разложения становятся равными друг другу. Такое состояние, при котором в
газе устанавливается определенный и неизменяющийся процент аммиака,
соответствующий данной температуре и давлению, называется состоянием
равновесия. Реакция синтеза аммиака протекает с уменьшением объема. Основываясь
на принципе Ле Шателье, можно сделать вывод, что в условиях равновесия
содержание аммиака в смеси будет больше при высоком давлении, чем при низком.
В промышленных условиях синтез
аммиака возможно осуществить только при высоких давлениях и температурах и в
присутствии катализатора. Эти условия обеспечивают большую скорость реакции и
достаточно высокие выходы аммиака. Использование константы равновесия
позволяет количественно оценить степень предсказываемых изменений.
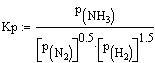 (1)
(1)
Для реакции синтеза константа
равновесия
рассчитана
по равновесным данным, определенным экспериментально. Если провести расчет
констант для разных температур и давлений можно сделать вывод что, с
увеличением температуры константа равновесия будет падать, а с увеличением
давления - расти.
Зная числовые значения константы
равновесия, можно вычислить равновесную концентрацию аммиака при любых
температурах и давлениях. Обозначив через z молярную
долю аммиака в равновесной смеси, согласно уравнению реакции будем иметь в
момент равновесия 1/2(1-z) моль N2, 3/2 (1-z) моль Н2,
z моль NH3. Всего в
равновесной смеси будет находиться моль
1/2(1-z)+ 3/2 (1-z)+z=2-z
Парциальные давления отдельных
компонентов смеси:
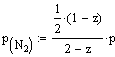
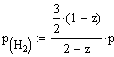
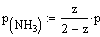 ,
,
где р - общее давление равновесной
смеси.
После подстановки значений
парциальных давлений в уравнение (1) получим
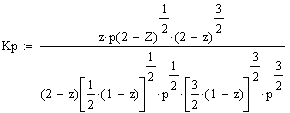
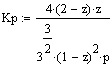 (2)
(2)
Решив уравнение (2) относительно z, получим
расчетное уравнение для определения равновесной концентрации аммиака при
различных температурах и давлениях:
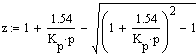 (3)
(3)
Итак, качественная и количественная
оценки условий термодинамического равновесия позволяют сделать вывод, что
максимального выхода аммиака можно достичь, проводя процесс при высоком
давлении и низких температурах. Однако даже при очень высоких температурах
(выше 1000°С) процесс синтеза в гомогенной газовой фазе практически
неосуществим.
Синтез аммиака протекает с заметной
скоростью только в присутствии катализатора, причем катализаторами данной
реакции служат твердые вещества. Гетерогенно-каталитический процесс синтеза
аммиака имеет сложный механизм, который может быть описан следующими стадиями:
) диффузия молекул азота и водорода
к поверхности катализатора;
) хемосорбция молекул реагентов
(адсорбатов) на поверхности катализатора;
) поверхностная химическая реакция с
образованием неустойчивых промежуточных комплексов и взаимодействие между ними;
) десорбция продукта;
Исследование кинетики и механизма
реакции синтеза позволило сделать вывод, что лимитирующей стадией процесса
является хемосорбция азота. Этот вывод дает возможность описать механизм
синтеза аммиака сокращенной схемой:
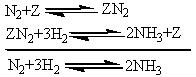
где Z - свободный
центр поверхности катализатора; ZN2 -
хемо-сорбированная частица (адсорбат).
Скорость обратимой реакции получения
аммиака из элементов на большинстве известных катализаторов описывается
уравнением Темкина-Пыжева
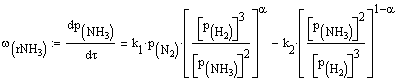 (4)
(4)
где k1 и k2 - константы
скоростей соответственно образования и разложения аммиака; р - парциальные
давления, α-
постоянная,
удовлетворяющая неравенству 0 < α < 1 и
характеризующая степень покрытия поверхности катализатора азотом.
При проведении процесса при
атмосферном давлении и температуре от 400 до 5000С для промышленных
катализаторов величина α
= 0,5.
Скорость реакции синтеза аммиака
зависит от температуры, давления и состава реакционной смеси. Оптимальными
считают такие значения указанных параметров, при которых скорость процесса
максимальна. Чтобы определить оптимальную температуру синтеза Тm, надо
продифференцировать по температуре кинетическое уравнение (4), приравнять
полученное выражение нулю и найти Тm. Выполнив
эти действия, получим формулу
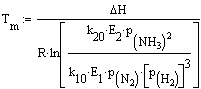 (5)
(5)
Из формулы (5) следует, что с
увеличением содержания в циркуляционном газе аммиака и уменьшением содержания
азото-водородной
смеси оптимальная температура падает.
Из уравнения Темкина-Пыжева
видно, что скорость прямой реакции синтеза пропорциональна р1,5, а
скорость обратной реакции - р0,5. Отсюда очевидно, что с ростом
давления наблюдаемая скорость процесса увеличивается.
И термодинамические, и кинетические
факторы свидетельствуют в пользу проведения процесса при высоких давлениях
(увеличивается равновесный выход, повышается скорость синтеза). Конденсация
аммиака также улучшается при высоком давлении. Вместе с тем рост давления
увеличивает расход электроэнергии на компрессию, повышает требования к машинам
и аппаратам. При понижении давления упрощается аппаратурное оформление
процесса, снижается расход энергии, но при этом увеличиваются размеры
аппаратов, возрастают энергозатраты на циркуляцию газа и выделение аммиака,
повышаются требования к чистоте синтез-газа.
Для определения оптимального
давления синтеза была использована комплексная математическая модель агрегата
синтеза аммиака. В качестве критерия оптимизации в ней приняты приведенные
затраты, руб./т
3= С+ ЕК/П, (6)
Где С -
себестоимость аммиака, руб./т;
Е- нормативный коэффициент
эффективности, год-1;
К - капитальные затраты, руб.;
П- производительность агрегата по
аммиаку, т/год.
Расчеты показали, что приведенные
удельные энергоматериальные и капитальные затраты с повышением давления
уменьшаются. На основании проведенного анализа определено, что для современных
схем наиболее эффективным является давление приблизительно 30 МПа.
Поскольку присутствие инертных
примесей в реакционной смеси равносильно снижению общего давления, то с
увеличением содержания метана, аргона и гелия в смеси скорость реакции синтеза
уменьшается.
Анализируя кинетическое уравнение
(3), видим, что скорость прямой реакции обратно пропорциональна парциальному
давлению аммиака, а для обратной реакции характерна прямая пропорциональность.
Таким образом, с повышением содержания аммиака общая скорость реакции падает.
Увеличение объемной скорости смеси приводит к уменьшению прироста содержания
аммиака и, тем самым к росту средней скорости и повышению производительности
процесса.
Реакция синтеза аммиака обратима, поэтому
полного превращения азота и водорода в аммиак за время их однократного
прохождения через аппарат не происходит. Условия равновесия процесса и
кинетические закономерности его протекания на железных катализаторах
обусловливают возможность превращения в аммиак только 20-40% исходной
реакционной смеси. Для более полного использования реагентов необходима их
многократная циркуляция через колонну синтеза. Все современные схемы синтеза
аммиака являются циркуляционными, предусматривающими выделение возвращение
непрореагировавшей азотоводородной смеси в цикл синтеза.
Чтобы выделить аммиак,
азотоводородную смесь вместе с аммиаком охлаждают до температуры сжижения
аммиака. Достичь полной конденсации аммиака не удается; наибольшая часть его
остается в азотоводородной смеси. Концентрация аммиака (объемные доли, %) в
азотоводородной смеси, содержащей инертные газы, в состоянии насыщения при
давлении 30 МПа и различных температурах приведена ниже:
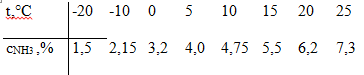
Приведенные данные показывают, что
при давлении 30 МПа газ необходимо охлаждать до -5-0°С. Для этого помимо
водяного или воздушного охлаждения азотоводородную смесь охлаждают кипящим
жидким аммиаком. В системах, работающих при более высоком давлении (например,
60-100 МПа), для выделения аммиака из азотоводородной смеси можно ограничиться
воздушным или водяным охлаждением. Непрореагировавшая азотоводородная смесь с
остаточным аммиаком вновь возвращается на синтез аммиака.
Катализаторы синтеза аммиака. Высокую
каталитическую активность в процессе синтеза аммиака проявляют металлы VI, VII и VIII групп
периодической системы. Наибольшей активностью обладают Fe, Ru, Re, Os. В
промышленности нашли применение железные катализаторы, получаемые сплавлением
оксидов железа с активаторами (промоторами) и последующим восстановлением
оксидов железа. В качестве активаторов применяют оксиды кислотного и
амфотерного характера - А12О3, SiO2, TiO2 и др., а
также оксиды щелочных и щелочно-земельных металлов - К2О, Na2O, CaO, MgO и др.
Процесс восстановления катализатора
можно описать суммарным уравнением
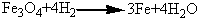 ,
,
∆Н>0
Катализаторы синтеза аммиака
необратимо отравляются сернистыми соединениями и хлором. Их концентрация в газе
в сумме не должна превышать 5∙105 %.
Кислородсодержащие соединения (Н2О,
СО, СО2) и кислород, присутствующие в азотоводородной смеси,
являются сильными каталитическими ядами, снижающими активность катализатора
обратимо. Их отравляющее действие пропорционально содержанию в них кислорода.
Если в составе свежего газа имеются кислородсодержащие примеси или масло, газ
следует вводить в цикл перед вторичной конденсацией для удаления вредных
соединений конденсирующимся NH3.
Технологическое оформление процесса
синтеза аммиака.
Агрегаты синтеза аммиака в зависимости от применяемого давления можно разделить
на три группы: низкого (10,0-16,0 МПа), высокого (80,0-100,0 МПа), среднего
(20,0-50,0 МПа) давлений.
Раньше на установках низкого
давления процесс проводили под давлением 10,0 МПа и при низкой температуре
(400°С). Благодаря применению активного катализатора, состоящего из комплексной
соли, содержащей цианид железа, получали 8-13% аммиака. В настоящее время схемы
синтеза под низким давлением связывают с перспективой снижения энергозатрат,
так как одной из главных статей расхода в производстве аммиака является
компрессия технологического газа и его рециркуляция. В ряде новых схем синтез
аммиака предусматривается вести при том же давлении, что и получение
технологического газа (ниже 10 МПа).
Установки высокого давления имели
широкое распространение в 30-40-е годы XX в. Процесс
вели под давлением 90-100 МПа, что позволило получить высокую степень
превращения азото-водородной
смеси в аммиак (40%). Системы высокого давления сейчас не строятся.
В мировой азотной промышленности наибольшее
распространение получили установки среднего давления. В России эксплуатируются
системы, работающие под давлением 30-36 МПа, а также несколько агрегатов под
давлением 45 МПа. Строящиеся системы рассчитаны преимущественно на давление 32
МПа.
В современных агрегатах синтеза
аммиака большой единичной мощности процесс ведут на плавленых железных
катализаторах при температуре 420-500°С, давлении 25-32 МПа, объемной скорости
15-25 тыс.ч.-1. Съем аммиака с 1 м3 катализатора
составляет 20-40 т/сут.
При синтезе аммиака в агрегате
мощностью 1360 т/сут. на отечественном оборудовании (рис.1) свежая азото-водородная
смесь после очистки метанированием сжимается в центробежном компрессоре до
давления 32 МПа и после охлаждения в воздушном холодильнике (на схеме не показан)
поступает в нижнюю часть конденсационной колонны 8 для очистки от остаточных
примесей СО2, Н2О и следов масла. Свежий газ барботирует
через слой скорденсировавшегося жидкого аммиака, освобождается от водяных паров
и следов СО2 и масла, насыщается аммиаком до 3-5% и смешивается с
циркуляционным газом ЦГ. Полученная смесь проходит по трубкам теплообменника
конденсационной колонны и направляется в межтрубное пространство выносного
теплообменника 4 , где нагревается до 185-195°С теплотой газа, выходящего из
колонны синтеза 2. Для дополнительного нагрева газа, поступающего в колонну
синтеза 2, может использоваться подогреватель газа 1.
В колонне синтеза газ проходит
снизу вверх по кольцевой щели между корпусом колонны и кожухом насадки и
поступает в межтрубное пространство внутреннего теплообменника, размещенного в
горловине корпуса колонны синтеза. В теплообменнике циркуляционный газ
нагревается до температуры начала реакции 400-440°С теплотой конвертированного
газа и затем последовательно проходит четыре слоя катализатора, в результате
чего концентрация аммиака в газе повышается до 15%. Пройдя через центральную
трубу, при температуре 500-515°С азотоводородно-аммиачная смесь направляется во
внутренний теплообменник, где охлаждается до300°С. Дальнейшее охлаждение
газовой смеси до 215°С происходит в трубном пространстве подогревателя
питательной водой 3, в трубном пространстве выносного теплообменника 4 до 65°С
холодным циркулирующим газом, идущим по межтрубному пространству , и затем в
аппаратах воздушного охлаждения 7 до 40°С, при этом часть аммиака
конденсируется. Жидкий аммиак, сконденсировавшийся при охлаждении, отделяется в
сепараторе 6, а затем смесь, содержащая 10-12% аммиака, идет на циркуляционное
колесо компрессора 5 азотоводородной смеси, где сжимается до 32 МПа.
II.
Материальные модели химических реакторов
.1 Химические
реакторы
реактор химический аммиак смешение
Одним из основных элементов
любой химико-технологической системы (ХТС) является химический реактор.
Химическим реактором называется аппарат, в котором осуществляются химические
процессы, сочетающие химические реакции с массо- и теплопереносом. Типичные
реакторы - промышленные печи, контактные аппараты, реакторы с механическим,
пневматическим и струйным перемешиванием, варочные котлы, гидрататоры и т. п.
Все аппараты, расположенные до
реактора, предназначены для подготовки сырья к химической переработке; всё то,
что находится после реактора, необходимо для разделения получающихся в реакторе
продуктов. От правильности выбора реактора и его совершенства зависит
эффективность всего технологического процесса.
Основные требования
к промышленным реакторам:
1. Максимальная
производительность и интенсивность работы.
. Высокий выход продукта и
наибольшая селективность процесса. Они обеспечиваются оптимальным режимом
работы реактора: температурой, давлением, концентрацией исходных веществ и
продуктов реакции. Каталитический реактор должен так же обеспечить эффективное
применение катализатора.
. Минимальные энергетические
затраты на перемешивание и транспортировку материалов через реактор, а также
наилучшее использование теплоты экзотермических реакций или теплоты, подводимой
в реактор для нагрева реагирующих веществ до оптимальных температур.
. Легкая управляемость и
безопасность работы. Эти условия обеспечиваются рациональной конструкцией
реактора и малыми колебаниями параметров технологического режима, позволяющими
легко автоматизировать работу реактора.
. Низкая стоимость изготовления
реактора и ремонта его. Это достигается простотой конструкции и применением
дешевых конструкционных материалов: черных металлов, силикатных изделий,
наиболее дешевых пластмасс.
6. Устойчивость работы реактора при значительных
изменениях основных параметров режима (С, Т, Р, ω и
др.). Перечисленные требования взаимосвязаны и в значительной степени
противоречивы; рациональность их определяется влиянием на себестоимость и
качество продукции. Обычно не удается реализовать процесс в реакторе таким
образом, чтобы были удовлетворены одновременно все предъявляемые к нему требования
в виду их противоречивости. Приходится вырабатывать наиболее рациональные и
экономичные решения, обеспечивающие поддержание заданных значений основных
параметров процесса: времени реакции, температуры в различных точках
реакционной зоны, давления, степени перемешивания реагирующих веществ,
изменения концентраций реагентов по высоте (длине) реактора.
.1.1 Модель реактора идеального
вытеснения
К реакторам идеального вытеснения относятся те
аппараты, в которых отсутствует радиальное и продольное перемешивание.
Реактор идеального вытеснения представляет собой
длинный канал, через который реакционная смесь движется в поршневом режиме
(рис. 5.4). Каждый элемент потока, условно выделенный двумя плоскостями,
перпендикулярными оси канала, движется через него как твердый поршень, вытесняя
предыдущие элементы потока и не перемешиваясь ни с предыдущими, ни со
следующими за ним элементами.
Естественно, что при проведении химической
реакции, например реакции, в которой участвуют два или более реагентов,
перемешивание участников реакции является необходимым условием ее
осуществления, иначе невозможным будет контакт между разноименными молекулами,
в результате которого и происходит элементарный акт реакции. Если в реакторе
полного смешения перемешивание носит глобальный характер и благодаря ему
параметры процесса полностью выравниваются по объему аппарата, в реакторе
идеального вытеснения перемешивание является локальным: оно происходит в каждом
элементе потока, а между соседними по оси реактора элементами, как уже указывалось,
перемешивания нет.
Материальный баланс
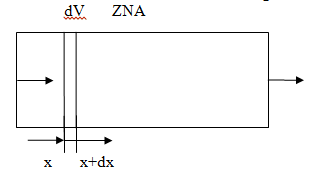
Длина аппарата больше диаметра, поршневой режим.
Изменение концентрации происходит по длине. Выделим элементарный объем dV,
для которого считается материальный баланс. ZNA
- концентрация ключевого реагента.
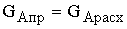
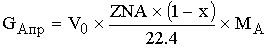
[кг/c]=[(м^3/с)*(м^3/кмоль)*(кг/кмоль)]
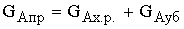 - расход
- расход
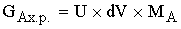 -массовый расход
химической реакции
-массовый расход
химической реакции
[кг/с] = [( кмоль / м^3*с) * (м^3) * (кг/кмоль)
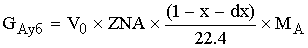 -массовый расход на
убыль
-массовый расход на
убыль
Приход:
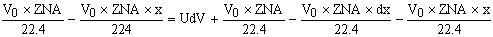
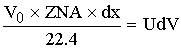
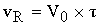 - объем реактора
- объем реактора
[м^3]=[(м^3/c)*(c)]
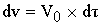
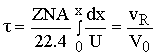 - время пребывания
реакционной смеси в реакторе для получения заданной степени превращения x.
Из этого уравнения можно рассчитать объем реактора.
- время пребывания
реакционной смеси в реакторе для получения заданной степени превращения x.
Из этого уравнения можно рассчитать объем реактора.
Тепловой баланс
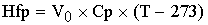 -теплота
физического прихода, где Cp-теплоемкость.
-теплота
физического прихода, где Cp-теплоемкость.
[кДж/с]=[(м^3/c)*(кДж/м^3/град)*(град)]
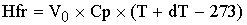 - теплота
физического расхода.
- теплота
физического расхода.
[кДж/с]=[(м^3/c)*(кДж/м^3/град)*(град)]
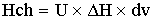 - теплота
химической реакции.
- теплота
химической реакции.
[кДж/c]=[(кмоль/м^3*c)*(кДж/кмоль)*(м^3)]
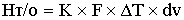 -теплота
теплообменника, где К-коэффициент теплопередачи
-теплота
теплообменника, где К-коэффициент теплопередачи
[кДж/c]=[(кДж/м^2*град*с)*(м^2/м^3)*(град)*(м^3)]
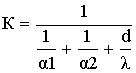 ,где d-толщина
стенки.
,где d-толщина
стенки.
Приход:
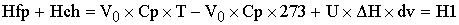
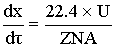
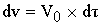
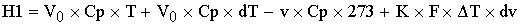
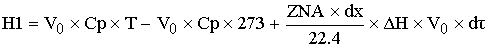
Расход:
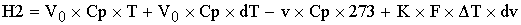
По закону сохранения энергии:
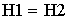
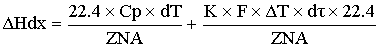 - уравнение
политермы, в котором учитывается часть теплоты химической реакции, которая идет
на изменение температур в химической реакции, и часть, которая уходит на
теплоту, которую уводит теплообменник.
- уравнение
политермы, в котором учитывается часть теплоты химической реакции, которая идет
на изменение температур в химической реакции, и часть, которая уходит на
теплоту, которую уводит теплообменник.
В адиабатическом режиме теплообменник отсутствует:
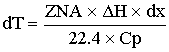 - уравнение
адиабаты.
- уравнение
адиабаты.
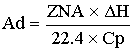 -адиабатический
коэффициент.
-адиабатический
коэффициент.
Физический смысл адиабатического коэффициента:
на столько градусов изменится температура реакционной смеси, если степень
превращения будет равна 1, то есть, если ключевой реагент прореагировал
полностью.
Изотермический режим характеризуется постоянной
температурой:
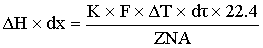
2.1.2 Модель реактора полного
смешения
Работа реактора полного смешения осуществляется
вследствие быстроты перемешивания происходящей химической реакции, и компоненты
мгновенно меняются до конца.
Для модели полного смешения принимается ряд
допущений. Допускается, что в результате интенсивного перемешивания
устанавливаются абсолютно одинаковые условия в любой точке реактора:
концентрации реагентов и продуктов, степени превращения реагентов, температура,
скорость химической реакции и т. д.
В проточном реакторе идеального смешения
концентрации участников реакции в выходном потоке в рассматриваемый момент
времени т,. строго равны концентрациям тех же веществ в реакторе.
Материальный баланс.
GAFP

GAFR
GАch
Приход:
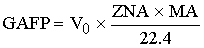 -массовый расход
ключевого реагента, пришедшего в реактор.
-массовый расход
ключевого реагента, пришедшего в реактор.
[кг/c]=[(м^3/c)*(м^3/кмоль)*(кг/кмоль)]
Расход:
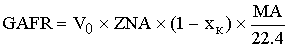 -массовый расход
ключевого реагента, ушедшего из реактора.
-массовый расход
ключевого реагента, ушедшего из реактора.
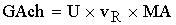 - массовый расход
ключевого реагента в химической реакции.
- массовый расход
ключевого реагента в химической реакции.
[кг/c]=[(кмоль/м^3*c)*(м^3)*(кг/кмоль)]
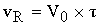
По закону сохранения материи:
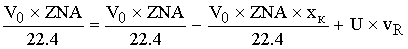
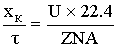 -уравнение
материального баланса для реактора полного смешения.
-уравнение
материального баланса для реактора полного смешения.
Тепловой баланс
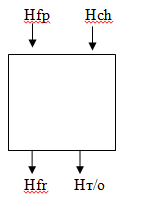
Hfp
Hch
Hfr
Hт/о
Приход:
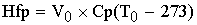 -теплота
физического прихода, где Cp-теплоемкость
-теплота
физического прихода, где Cp-теплоемкость
[кДж/с]=[(м^3/c)*(кДж/м^3/град)*(град)]
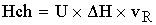 теплота химической
реакции.
теплота химической
реакции.
[кДж/c]=[(кмоль/м^3*c)*(кДж/кмоль)*(м^3)]
Расход:
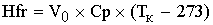 - теплота
физического расхода
- теплота
физического расхода
[кДж/с]=[(м^3/c)*(кДж/м^3/град)*(град)]
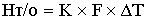 -теплота
теплообменника, где К-коэффициент теплопередачи
-теплота
теплообменника, где К-коэффициент теплопередачи
[кДж/c]=[(кДж/м^2*c*град)*(м^2)*(град)]
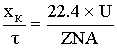
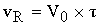
По закону сохранения энергии:
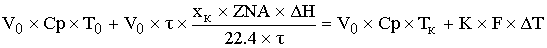
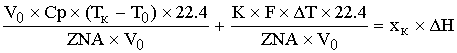 -уравнение
политермы
-уравнение
политермы
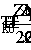
-уравнение адиабаты, то есть теплообмен с
окружающей среды отсутствует
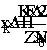
уравнение изотермы
Программы расчета.
Химическое равновесие

Рис.1 Kp=f(T)
Выводы:
реакция является экзотермической т.к. Кр уменьшается с увеличением Т, а значит ∆
Е>0. Рассмотрим формулу Кр=Аe(Е2-Е1)/RT
с ростом Т, (Е2-Е1)/RT
уменьшается (Е2-Е1)>0, что приводит к уменьшению Аe(Е2-Е1)/RT,
а следовательно и Кр уменьшается.
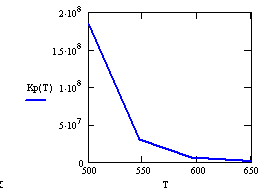
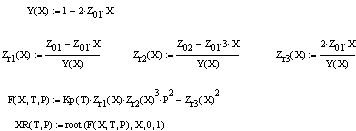
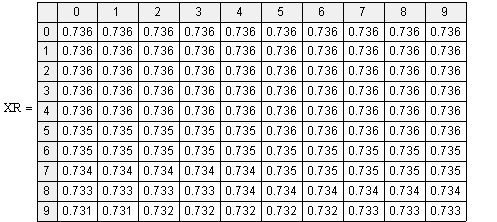
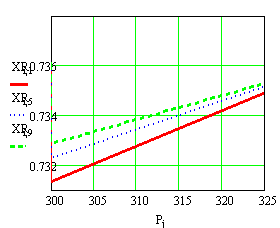
Рис.2 XR=f(T,P)
Выводы: Рассмотрим
формулу 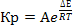
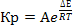 = =zr3p-1/zr1zr2 с
увеличением Т, (Е2-Е1)/RT уменьшается (Е2-Е1)>0,
= =zr3p-1/zr1zr2 с
увеличением Т, (Е2-Е1)/RT уменьшается (Е2-Е1)>0,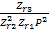 Аe(Е2-Е1)/RT
уменьшается, а следовательно и Кр, но чтобы сохранить равенство и zr3 должен
уменьш-ся, т.к. zr3 пропорционален
XR, значит и XR уменьшается
с увеличением Т. Т.к. Кр не зависит от Р, то чтобы сохранить равенство с
увеличением Р, zr3 тоже
увеличивается, а т.к. XR= zr3, то XR, zr3, zr1 тоже
увеличиваются.
Аe(Е2-Е1)/RT
уменьшается, а следовательно и Кр, но чтобы сохранить равенство и zr3 должен
уменьш-ся, т.к. zr3 пропорционален
XR, значит и XR уменьшается
с увеличением Т. Т.к. Кр не зависит от Р, то чтобы сохранить равенство с
увеличением Р, zr3 тоже
увеличивается, а т.к. XR= zr3, то XR, zr3, zr1 тоже
увеличиваются.
Рис.3 Zпродукт
= f(P,T)
Выводы:
Рассмотрим формулу
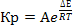
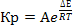 = =zr3p-1/zr1zr2
= =zr3p-1/zr1zr2
с увеличением давления (т.к. Кр =f(P) не явл.
функцией дввления) чтобы сохранить равенство z продукт
также увеличивается
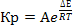
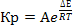 = =zr3p-1/zr1zr2.
= =zr3p-1/zr1zr2.
С увеличением Т, Кр уменьшается и
чтобы сохранить равенство, zr3 должно
уменьшатся.
Кинетика
Дано:

Решение:

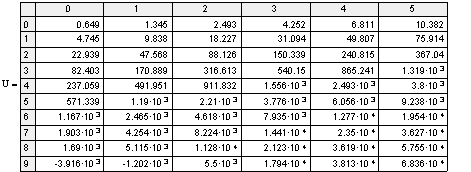
Рис.1 U,U1,U2 = f(T)
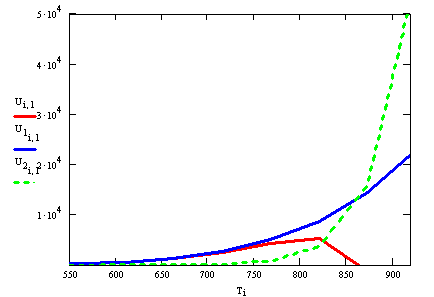
Выводы:
Т.к. Е2>E1,U2
будет сильнее реагировать на увеличение Т, U2
будет сильнее изогнута кривой U1.
U=К1Ро z01(1-хА(1+1/Кр)),
∆С= Ро z01(1-хА(1+1/Кр)),
с увеличением Т, Кр уменьшается, 1/Кр
увеличивается, ∆С уменьшается, Umax
уменьшается.
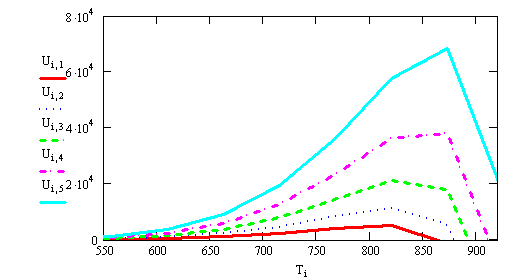
Рис.2 U = f(T,Р)
Выводы:
С увеличением Т, U
увеличивается и проходит через
max Ui,j=K1i·P1j·
(P2j)3 -K2i·(P3j)2,
К=К0e-Е/RT,
из формулы
∆Р=Рт-РА*, РА*
уменьшается, Рт увеличивается, значит U
увеличивается.
Вычисления параметров для сравнения
реакторов.
Дано:
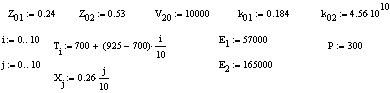
Решение:

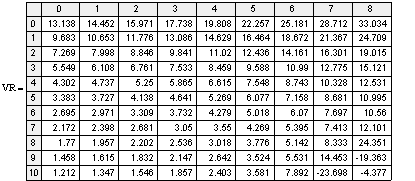
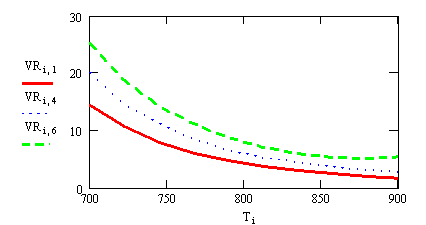
Рис 1. V
рив = f (P)
Выводы:1.
Рассмотрим формулу 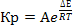
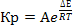 =zr3p-1/zr1zr2 с
увеличением давления (т.к. Кр =f(P) не
является функцией давления) zr3 также
увеличивается, а т.к. объем реактора обратно пропорционален равновесной степени
превращения, то Vрив уменьшается с ростом Р.
=zr3p-1/zr1zr2 с
увеличением давления (т.к. Кр =f(P) не
является функцией давления) zr3 также
увеличивается, а т.к. объем реактора обратно пропорционален равновесной степени
превращения, то Vрив уменьшается с ростом Р.
. U=К1Рz01(1-хА(1+1/Кр))=
К∆С из нее следует, что с ростом Х, ∆С убывает и скорость U убывает.
Проанализировав формулу
получаем,
что с увеличением скорости 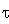 и Vрив
увеличивается.
и Vрив
увеличивается.
Рис 1. X = f (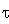 )
)
Вывод: при увеличении суммарной скорости
реакции, зависящей от степени превращения, для сохранения равенства 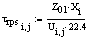 должна
увеличиваться равновесная концентрация, также от нее зависящая, а поскольку она
уменьшается, чтобы равновесие сохранилось, время пребывания увеличивается.
Изогнутость кривой объясняется тем, что скорость реакции проходит через
максимум.
должна
увеличиваться равновесная концентрация, также от нее зависящая, а поскольку она
уменьшается, чтобы равновесие сохранилось, время пребывания увеличивается.
Изогнутость кривой объясняется тем, что скорость реакции проходит через
максимум.
Расчет высоты реактора построение
графика T
= f(h).
Высота
реактора
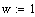
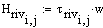

Рис 3. T
= f (h)
Вывод:
При увеличении суммарной скорости реакции для сохранения равенства уравнения 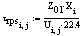 должна
увеличиваться равновесная концентрация, а поскольку уменьшается температура,
пропорциональная степени превращения, и поскольку все параметры приведенного
уравнения зависят от степени превращения, чтобы равновесие сохранилось. Высота
реактора, пропорциональная времени пребывания, в зависимости от температуры
сначала увеличивается, затем уменьшается.
должна
увеличиваться равновесная концентрация, а поскольку уменьшается температура,
пропорциональная степени превращения, и поскольку все параметры приведенного
уравнения зависят от степени превращения, чтобы равновесие сохранилось. Высота
реактора, пропорциональная времени пребывания, в зависимости от температуры
сначала увеличивается, затем уменьшается.
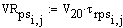
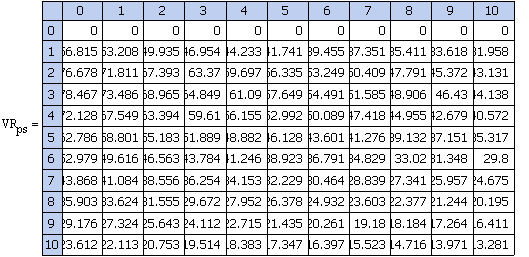
Рис 2. V
рпс = f (P)
Вывод:1.
Рассмотрим формулу
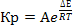
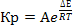 =zr3p-1/zr1zr2
=zr3p-1/zr1zr2
с увеличением давления (т.к. Кр =f(P) не
является функцией давления) zr3 также
увеличивается, а т.к. объем реактора обратно пропорционален равновесной степени
превращения, то Vрпс уменьшается с ростом Р.
2. U=К1Рz01(1-хА(1+1/Кр))=
К∆С
из нее следует, что с ростом Х, ∆С убывает
и скорость U убывает.
Проанализировав формулу
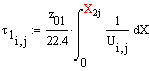
получаем, что с увеличением скорости
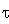 и Vрпс.
увеличивается.
и Vрпс.
увеличивается.
Расчет высоты реактора построение
графика T
= f(h).
Вычислим
высоту реактора полного смешения

Вывод:
При увеличении суммарной скорости реакции для сохранения равенства уравнения 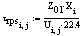 должна
увеличиваться равновесная концентрация. А поскольку уменьшается температура,
пропорциональная степени превращения, и поскольку все параметры приведенного
уравнения зависят от степени превращения, чтобы равновесие сохранилось, высота
реактора, пропорциональная времени пребывания, в зависимости от температуры
сначала увеличивается, затем уменьшается.
должна
увеличиваться равновесная концентрация. А поскольку уменьшается температура,
пропорциональная степени превращения, и поскольку все параметры приведенного
уравнения зависят от степени превращения, чтобы равновесие сохранилось, высота
реактора, пропорциональная времени пребывания, в зависимости от температуры
сначала увеличивается, затем уменьшается.
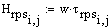
Определение отношения объемов
реакторов полного смешения и идеального вытеснения.
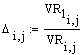
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
0
|
11.634
|
3.471
|
2.232
|
1.735
|
1.47
|
1.306
|
1.197
|
1.12
|
|
1
|
11.634
|
3.471
|
2.232
|
1.735
|
1.47
|
1.306
|
1.197
|
1.12
|
|
2
|
11.634
|
3.471
|
2.232
|
1.735
|
1.47
|
1.306
|
1.197
|
1.12
|
|
3
|
11.634
|
3.471
|
2.232
|
1.735
|
1.47
|
1.306
|
1.197
|
1.12
|
|
4
|
11.634
|
3.471
|
2.232
|
1.735
|
1.47
|
1.306
|
1.197
|
1.12
|
|
5
|
11.634
|
3.471
|
2.232
|
1.735
|
1.47
|
1.306
|
1.197
|
1.12
|
|
6
|
11.634
|
3.471
|
2.232
|
1.735
|
1.47
|
1.306
|
1.12
|
|
7
|
11.634
|
3.471
|
2.232
|
1.735
|
1.47
|
1.306
|
1.197
|
1.12
|
|
8
|
11.634
|
3.471
|
2.232
|
1.735
|
1.47
|
1.306
|
1.197
|
1.12
|
|
9
|
11.634
|
3.471
|
2.232
|
1.735
|
1.47
|
1.306
|
1.197
|
1.12
|

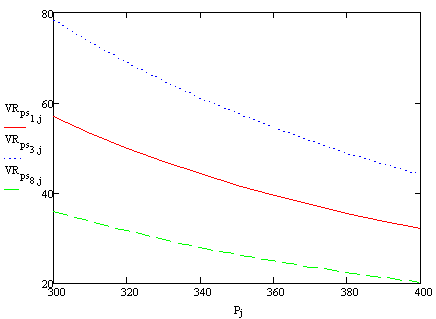
Рис1. Vрпс/Vрив
= f(P)
Вывод:
При увеличении Р наблюдается уменьшение объема реактора идеального вытеснения (Vрив.)
и объема реактора полного смешения (Vрпс.)
одинаково интенсивно, что видно из значений ∆. С увеличением Р разность
между величинами объемов реакторов уменьшается.
Заключение
Зависимость степени превращения от времени и в
реакторе полного смешения, и в реакторе вытеснения имеет возрастающий характер,
так как чем дольше время пребывания реакционной смеси в реакторе, тем более
вещества образуется. Рассмотрим как изменяется время τ
при
постоянной степени превращения х. Видно, что при одной степени превращения τriv<
τrps,
следовательно, за меньшее время РИВ быстрей достигает степени превращения и
объем реактора при этом будет меньше, что экономичней. Таким образом, для
синтеза аммиака применяют реактор идеального вытеснения.
Список использованной литературы
1. Мухлёнов
И. П., Авербух А. Я. ,Тумаркина Е. С. Общая химическая технология. Высшая
школа, 1984.
. Туболкин
Ф.Т., Тумаркина.Е.С., Расчеты химико-технологических процессов.Л.1982.
. Луцко
Ф.Н. Сороко В.Е. Прокопенко А.Н. химико-технологические расчеты
с
применением MathCAD.
Учебное пособие.СПб,2006.
.
Курс
лекций по ОХТ