Редокс-титрование растворами окислителей
Введение
В аналитической химии применяется
множество методов количественного анализа, одним из которых является
титриметрия. Титриметрия основана на измерении количества реагента,
необходимого для взаимодействия с определяемым компонентом в растворе в соответствии
со стехиометрией химической реакции между ними. При проведении эксперимента
контролируют объем добавляемого титранта с точно известной концентрацией
реагента. Наибольшее распространение получила титриметрия для экспрессного
определения высоких и средних концентраций веществ в растворах, в том числе и
неводных. Точно известный объем V анализируемого раствора с помощью пипетки
помещают в колбу и к нему прибавляют небольшими порциями титрант из бюретки,
тщательно перемешивая раствор в колбе. Эту операцию называют титрованием.
В титриметрии применяют различные
химические реакции: кислотно-основные, комплексообразования,
окисления-восстановления. Реакция должна протекать не только стехиометрически,
но также быстро и количественно (правильные результаты можно получить лишь в
том случае, если при прибавлении стехиометрического кол-ва титранта полнота
протекания р-ции не менее 99,9%). Кроме того, в каждом конкретном случае должен
быть подходящий способ фиксирования КТТ (конечной точки титрования).
Более подробно рассмотрим метод редоксметрии. В
его основе лежат реакции окисления-восстановления. Это титрование
сопровождается переходом одного или большего числа электронов от восстановителя
к окислителю.
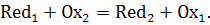
Восстановленная форма одного вещества Red1,
отдавая электроны, переходит в окисленную форму Ox1
того же вещества. Обе эти форму образуют редокс-пару Ox1|Red1.
Окисленная форма Ox2
второго вещества, принимая электроны, переходит в восстановленную форму Red2
того же вещества. Обе эти формы так же образуют редокс-пару Ox2|Red2.
Чем выше окислительно-восстановительный потенциал редокс-пары Ox2|Red2,
окисленная форма которой играет роль окислителя в данной реакции, тем большее
число восстановителей Red1 можно оттитровать и определить с помощью данного
окислителя Ox2. В
редоксметрии в качестве титрантов применяют окислители, стандартные
окислительно-восстановительные потенциалы редокс-пар которых имеют как можно
более высокие значения (например, Ce4+ -  ;
MnO4- -
;
MnO4- -  Если
же определяемые вещества - окислители, то для их титрования применяют
восстановители, стандартный окислительно-восстановительный потенциал которых
имеет минимальное значение (например,
Если
же определяемые вещества - окислители, то для их титрования применяют
восстановители, стандартный окислительно-восстановительный потенциал которых
имеет минимальное значение (например,  )
)
. Особенности
и классификация окислительно-восстановительного титрования
Редоксметрия имеет следующие особенности:
. Сравнительно низкие скорости реакций.
. Сложный механизм протекания реакций.
. Критерий применимости реакции для титрования: ΔE0
= E0Ox - E0Red
не менее 0,2В, в этом случае константа равновесия оказывается достаточно
высокой.
В окислительно-восстановительном титровании
используют индикаторы двух типов:
. Дающие окрашенные соединения с окисленной или
восстановленной формой.
. Редоксиндикаторы, изменяющие окраску при
изменении потенциала системы (слабые окислители или восстановители, имеющие
различную окраску окисленной и воссстановленной формы).
Также используют безиндикаторное титрование,
если одна из форм (или обе) имеют окраску. По
применяемому в окислительно-восстановительном титровании титранту различают:
. Перманганатометрию (титрант - перманганат
калия KMnO4);
. Иодометрию (титрант - раствор иода J2 в иодиде
калия KJ - комплекс K[J(J2)]
и тиосульфат натрия Na2S2O3);
. Хлориодометрию (титрант - хлорид иода JCl)
. Хроматометрию (титрант - бихромат калия K2Cr2O7);
. Броматометрию (титрант - бромат калия KBrO3);
. Цериметрию (титрант - сульфат церия (IV)
Ce(SO4)2);
. Ванадатометрию (титрант - ванадат аммония NH4VO3).
Редокс-титрование может быть выполнено
различными способами: прямое титрование, обратное титрование и заместительное
титрование. Прямое титрование
проводят при ЭДС ≥ 0,4 В, что обеспечивает необходимую полноту и скорость
протекания реакции. Прямым титрованием
можно определить:
а) ионы Fe2+ - титрант - раствор KMnO4 (ЭДС =
0,74 В; К = 10 )
10 FeSO4 + 2 KMnO4 + 8 H2SO4 = 5
Fe2(SO4)3 + 2 MnSO4 + К2SO4
+ 8 Н2О
ν(1/z* FeSO4 ) = ν(1/z*
KMnO4 )
б) J2 - титрант - раствор Na2S2O3 (ЭДС = 0,42 В,
К = 10 )
J2 + 2 Na2S2O3 = 2 NaJ + Na2S4O6
ν(1/z* J2 ) = ν(1/z*
Na2S2O3 )
Метод обратного титрования основан на применении
двух рабочих растворов. Сначала к титруемому раствору приливают заведомый
избыток первого рабочего раствора, который содержит реактив, непосредственно
реагирующий с определяемым ионом. Объем прилитого первого рабочего раствора
точно измеряют с помощью пипетки или бюретки, концентрация его также должна
быть точно определена. Не вошедший в реакцию с определяемым ионом избыток
реактива, введенного с первым рабочим раствором, далее титруют вторым рабочим
раствором, который реагирует с первым. Например, при определении сульфидов
добавляют известное заведомо избыточное количество первого рабочего раствора J2,
избыток которого затем оттитровывают раствором Na2S2O3.
Na2S+ J2 (изб.)
+ 2 НС1
= S↓ + 2 NaС1
+ 2 НJ(остаток)
+ 2 Na2S2O3 = 2 NaJ + Na2S4O6
ν(1/z* Na2S) = ν(1/z*
J2 ) = ν(1/z*
Na2S2O3);
ν(1/z* Na2S) = ν(1/z*
Na2S2O3);
При определение содержания свободного или
связанного формальдегида в разнообразных технических продуктах титрантом
является пероксид водорода. Образующуюся метановую кислоту оттитровывают
заведомо известным избытком щелочи, которую затем титруют соляной кислотой.
НСНО + H2O2
= НСООН + Н2O
НСООН + NaОН(избыток) = НСООNa + Н2OОН(остаток)
+ НС1 = NaС1 + Н2O
ν(1/z* НСНО) = ν(1/z*
NaОН)
= ν(1/z*
НС1);
ν(1/z* НСНО) = ν(1/z*
НС1);
Заместительное титрование - определяют
заместитель - продукт реакции, выделяющийся в эквивалентном количестве при
взаимодействии определяемого вещества с каким-либо реактивом.
Таким образом, например, можно определять
вещества, не вступающие в окислительно-восстановительные реакции, или
реагирующие с титрантом в нестехиометрических соотношениях
Примеры заместительного титрования:
а) определение карбоната кальция:
СаСО3 + 2 НCl
= СаС12 + Н2O+ CO2↑
СаС12 + (NН4 )2С2О4 = СаС2О4 + 2 NH4С1
CaC2O4
+ Н2SO4 = СаSO4↓+ Н2С2О4
5 Н2С2О4 + 2 KMnO4 + 2 Н2SO4 = 2 MnSO4 + 10 СО2↑+
8 Н2О
ν(1/z* СаСО3
) = ν(1/z* KMnO4 )
б) определение диоксида марганца в пиролюзите:
MnO2 + 4 НС1(к) = MnС12 + Сl2↑+
2 Н2 О
С12 + КJ
= J2↓+ 2 КС1+
2 Na2S2O3 = 2 NaJ + Na2S4O6
ν(1/z* MnO2 ) = ν(1/z*
Na2S2O3 )
Более подробно особенности редокс-титрования
рассмотрим на примере цериметрии.
Цериметрия - метод анализа, основанный на
титровании определяемого вещества раствором сульфата церия (IV)
Ce(SO4)2.
Методом цериметрии можно определять многие вещества-восстановители - соединения
олова Sn(II),
мышьяка As(III),
иодиды J-, нитриты NO2-,
амины RNH2, гидразин N2H4.
Метод обладает рядом достоинств: высокий стандартный
потенциал редокс-пары Ce(IV)/Ce(III),
что позволяет определять широкий круг восстановителей; устойчивость растворов
титранта; простая стехиометрия реакций с участием ионов церия; возможность
проведения титрования в присутствии хлорид-ионов, что неприемлемо в
перманганатометрии.
К недостаткам метода можно отнести его
непригодность для титрования нейтральных и щелочных растворов, необходимость
использования индикаторов, что не требуется, например, в перманганатометрии;
высокая стоимость соединений церия.
2. Цериметрия
Сущность метода.
В основе метода лежит полуреакция
Ce4+ + e-
→ Ce3+
Ce(IV)
- сильный окислитель. В растворах Ce(IV)
присутствует в форме комплексных соединений. Обычно в качестве титранта
используют кислые растворы церия (IV),
причем окислительно-восстановительный потенциал  сильно
зависит от природы используемой кислоты, анионы которой образуют комплексы с Ce(IV).
Значения стандартных окислительно-восстановительных потенциалов E0 этой
редокс-пары при комнатной температуре для растворов Ce(IV)
в различных кислотах с концентрацией эквивалента 1 моль/л равны:
сильно
зависит от природы используемой кислоты, анионы которой образуют комплексы с Ce(IV).
Значения стандартных окислительно-восстановительных потенциалов E0 этой
редокс-пары при комнатной температуре для растворов Ce(IV)
в различных кислотах с концентрацией эквивалента 1 моль/л равны:

Цериметрическое титрование проводят в кислой
среде. В полуреакции Ce4+
+ e- → Ce3+
участвует один электрон, следовательно, 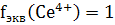 .
.
3. Титрование
соли железа (II) сульфатом церия (IV)
Расчёт потенциала в процессе
окислительно-восстановительного титрования.
. Расчёт величины потенциала в начале
титрования.
При титровании солей Fe(II) сульфатом церия Ce(SO4)2
ионы Fe2+
окисляются в ионы Fe3+.
Возникает система
Fe2+ - e-
↔ Fe3+
Если для титрования взято 100 мл 0,1н раствора
соли Fe(II), то при добавлении первой капли (~10-3 мл) 0,1н стандартного
раствора сульфата церия (IV)
образуется эквивалентное количество Fe(III). Тогда в начале титрования
отношение
 .
.
Значит, потенциал системы составит
Реакция окисления Fe(II)
церием (IV) идёт по уравнению

(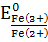 =0,771B,
=0,771B,
 =1,45B).
=1,45B).
Реакция обратима и во время титрования после
каждого прибавления стандартного раствора Ce(SO4)2 устанавливается равновесие
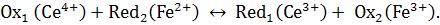
Окислительно-восстановительные потенциалы систем
Fe3+ + e-
↔ Fe2+ и Ce4+
+ e- ↔ Ce3+
при установившемся равновесии равны друг другу, следовательно, расчёт
потенциала в данный момент титрования можно будет выполнить по одному из
следующих уравнений:


. Расчёт величины потенциала в процессе
титрования до точки эквивалентности.
При добавлении к 100 мл 0,1н раствора соли Fe(II)
0,1н раствора Ce(SO4)2 происходит окисление Fe2+
до Fe3+ в количестве, эквивалентном его содержанию в 0,1мл 0,1н раствора. В
этот момент
 ,
,
следовательно,
 .
.
При добавлении 1 мл стандартного раствора Ce(SO4)2
образуется эквивалентное количество Fe3+
и  .
Тогда
.
Тогда
 .
.
При приливании 10 мл 0,1н раствора сульфата
церия (IV)  .
Значит,
.
Значит,

После добавления 50 мл раствора Ce(SO4)2
половина, т.е. 50 мл, первоначально взятого объёма раствора Fe(II) будет
окислена, и [Fe3+]=[Fe2+].
Следовательно, 
Когда прибавили 90 мл раствора титранта, то
неокисленными остались ионы Fe(II) в количестве, соответствующем 10 мл 0,1н
раствора, и 
В этом случае 
После прибавления 99 мл Ce(SO4)2
 ,
,
при этом 
После прибавления 99,9 мл раствора сульфата
церия (IV)  .
.

3. Расчёт величины потенциала в точке
эквивалентности.
Когда 100 мл 0,1н раствора сульфата церия (IV)
прибавили к 100 мл 0,1н раствора железа(II), наступает точка эквивалентности и
устанавливаются следующие равновесия: [Ce3+]=[Fe3+],
[Ce4+]=[Fe2+]
(или  ).
).
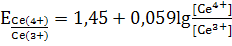 ,
,  .
.
Для установившегося равновесия 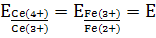 можно
написать:
можно
написать:


Так как  ,
то множитель под знаком логарифма равен 1, lg
1=0, =>
,
то множитель под знаком логарифма равен 1, lg
1=0, => 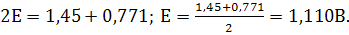
В точке эквивалентности  и
и
 .
В нашем случае n=1,
.
В нашем случае n=1, 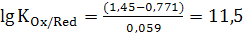 , =>
, =>  .
Поэтому в ТЭ
.
Поэтому в ТЭ  . Это означает, что
реакция будет протекать практически до конца слева направо, и что в момент
равновесия в ТЭ концентрация [Fe2+]
в растворе будет более чем в миллион раз меньше концентрации [Fe3+],
т.е. ионы [Fe2+] будут
практически полностью оттитрованы.
. Это означает, что
реакция будет протекать практически до конца слева направо, и что в момент
равновесия в ТЭ концентрация [Fe2+]
в растворе будет более чем в миллион раз меньше концентрации [Fe3+],
т.е. ионы [Fe2+] будут
практически полностью оттитрованы.
. Расчёт величины потенциала после точки
эквивалентности
Окислительный потенциал после ТЭ можно вычислить
по уравнению
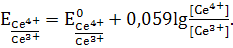
Нормальный потенциал этой системы 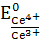 =1,45В.
Прибавление
избытка 0,1мл 0,1н раствора соли Ce(IV) создаёт отношение
=1,45В.
Прибавление
избытка 0,1мл 0,1н раствора соли Ce(IV) создаёт отношение

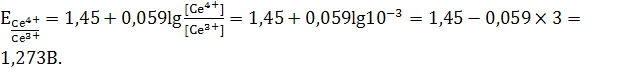
Добавление 1 мл 0,1н раствора Ce(SO4)2 создает
отношение  .
.
В этом случае потенциал составит 
Прибавление 10 мл избытка 0,1н раствора сульфата
церия (IV) создаёт отношение  . Следовательно,
. Следовательно,

Таким образом, в начальный момент после
достижения точки эквивалентности значение потенциала продолжает резко
повышаться при добавлении первых капель раствора титранта-окислителя, а затем
изменяется в меньшей степени.
Полученные данные представим в виде таблицы.
Таблица 1. Титрование 100 мл 0,1н раствора ионов
Fe(II) 0,1н раствором ионов Ce(IV).
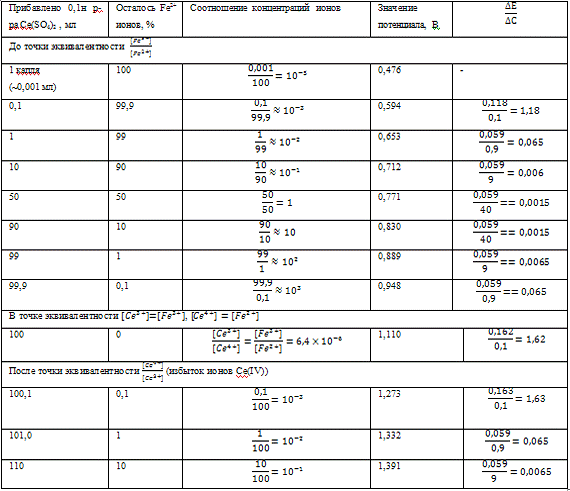
Таким образом, данный расчет позволяет построить
кривую титрования.
4. Кривая титрования
Кривая титрования - это график зависимости
потенциала, pH, оптической плотности или каких-либо других характеристик
титруемого раствора (ось ординат) от объема добавленного титранта (ось
абсцисс). Масштаб оси абсцисс всегда линейный, а оси ординат может быть
линейным или логарифмическим. Линейный масштаб удобен для тех методов контроля
за титрованием (спектрофотометрия, амперометрия), в которых контролируемый
параметр меняется с концентрацией линейно, а логарифмический - в случае
логарифмического изменения (например, при потенциометрии с ионоселективным
электродом). Логарифмический масштаб часто используют при визуальном
определении конечной точки титрования, поскольку именно в этом масштабе
наиболее наглядно проявляется резкое изменение свойств раствора вблизи точки
эквивалентности.
На рис.1 отображена часть кривой титрования 0,1н
раствора FeSO4 0,1н раствором Ce(SO4)2
.
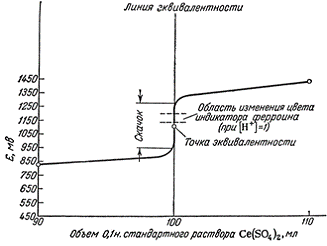
Рис.1. Кривая титрования
Для построения кривой титрования необходимо
рассчитать значения потенциала в следующие моменты титрования:
· До точки эквивалентности
· В точке эквивалентности
· После точки эквивалентности
В начале титрования в растворе находится
значительное количество восстановителя, кривая изменяется плавно, величина
потенциала E изменяется медленно. Вблизи точки эквивалентности потенциал резко
изменяется даже при прибавлении малых количеств реагента. По резкому скачку
кривой титрования устанавливают точку эквивалентности, которая не всегда лежит
на середине скачка. Характер кривых в методах окисления-восстановления не
зависит от разбавления раствора, если стехиометрические коэффициенты у
окислителя и восстановителя одинаковы.
Величина скачка увеличивается:
. При увеличении концентрации реагирующих
веществ.
. При увеличении разности стандартных
потенциалов редокс-пар.
. При увеличении температуры титрования.
. Величина скачка зависит от концентрации ионов
гидроксония в соответствии с уравнением Нернста.
5. Индикаторы
Как видно из рис.1, в точке эквивалентности при
окислительно-восстановительном титровании наблюдается значительный скачок
потенциала. Обнаружить изменение потенциала можно с помощью индикаторов.
Индикаторы, используемые в редоксметрии, бывают
двух типов: специфические индикаторы-вещества, вступающие в химическую реакцию
с одним из участников титрования, и окислительно-восстановительные индикаторы,
реагирующие на изменение потенциала системы.
Индикаторы первого типа образуют окрашенные
соединения с определяемым веществом или титрантом. Точку эквивалентности с
помощью индикаторов этого типа устанавливают по исчезновению окраски раствора,
если окрашенное соединение было образовано определяемым веществом с
индикатором, или по появлению окраски, если окрашенное соединение возникает при
взаимодействии индикатора с титрантом. Наиболее известным специфическим
индикатором является крахмал, образующий с трииодид-ионами комплекс синего
цвета.
Ко второму типу относятся
окислительно-восстановительные индикаторы, которые находят более широкое
применение, поскольку их поведение зависит только от изменения потенциала
системы.
К примеру, в цериметрии при титровании
применяется индикатор ферроин. Это комплекс о-фенантролинсульфата с железом
(2+) Fe(C12H8N2)3(SO4).
Ферроин (1,10-фенантролина сульфат C12H8N2×H2SO4)
-окислительно-восстановительный индикатор изменения кислотности (рН) химических
растворов в цериметрии. Порошок белого цвета с желтоватым оттенком. Растворим в
воде, практически нерастворим в 95% EtOH.
Химическая формула: Fe(C12H8N2)3SO4 - комплекс о-фенантролинсульфата с железом.
Окраска окисленной формы бледно-голубая, восстановительной формы - красная.
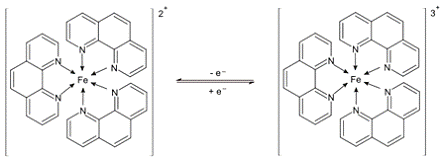
Раствор индикатора готовят непосредственно перед
употреблением. Для этого 0,7 г гептагидрата сульфата железа FeSO4×7H2O
растворяют в 100 мл воды, прибавляют 2,2г о-фенантролина сульфата и
перемешивают до растворения. Окраска окисленной формы - бледно-голубая,
восстановленной - красная. Из всех окислительно-восстановительных индикаторов
лишь один ферроин обладает почти идеальными свойствами: резким переходом
окраски, легкостью приготовления его растворов и их устойчивостью.
В присутствии сильного окислителя
дифениламин подвергается следующим превращениям:

В ходе реакции выделяются два протона и
образуется бесцветный дифенилбензидин. Эта реакция необратима. Далее
дифенилбензидин окисляется, образуя дифенилдифенохинондиимин (фиолетового
цвета) и два протона. Этот переход является обратимым.

Переход дифенилбензидина в
дифенилдифенохинондиимин вследствие внутримолекулярной перегруппировки является
обратимым и представляет истинно индикаторную реакцию.
Окислительно-восстановительный потенциал для второй реакции равен +0,76 В.
Несмотря на то, что в результате реакции выделяются ионы водорода, изменение
кислотности мало влияет на величину потенциала, что можно объяснить ассоциацией
ионов водорода с окрашенным продуктом реакции.
Как индикатор дифениламин имеет недостатки - его
применению мешают вольфрамат-ион и ионы ртути (II);
кроме того, его готовят в довольно концентрированных растворах серной кислоты,
т.к. его растворимость в воде незначительна. Вместо дифениламина удобнее
применять дифениламиносульфокислоту в виде ее Na-соли.
Она лишена этих недостатков. Переход окраски соли выражен более резко и
соответствует ее изменению от бесцветной через зеленую в темно-фиолетовую. Потенциал
перехода окраски равен примерно +0,8В и не зависит от концентрации кислоты.
Сульфопроизводные в настоящее время широко применяются в качестве
редокс-индикаторов.
6. Применение
редоксметрии
Применение редоксметрии рассмотрим на примере
определения окисляемости воды.
В анализируемой пробе воды могут содержаться
органические соединения. При наличии в пробе воды сильных окислителей и
соответствующих условий протекают химические реакции окисления органических
веществ, причем характеристикой процесса химического окисления, а также мерой
содержания в пробе органических веществ является потребление в реакции
кислорода, химически связанного в окислителях. Показатель, характеризующий
суммарное содержание в воде органических веществ по количеству израсходованного
на окисление химически связанного кислорода, называется химическим потреблением
кислорода (ХПК).
ХПК (или окисляемость) характеризует общее
количество содержащихся в воде восстановителей (органических и неорганических),
реагирующих с сильными окислителями. В качестве таких окислителей обычно
используют бихромат- и перманганат-анионы, и соответственно называются основные
методы определения ХПК - бихроматный и перманганатный. Следует отметить, что
результаты определения окисляемости одной и той же воды с помощью разных
окислителей обычно неоднозначны из-за неодинаковой степени окисления веществ,
присутствующих в воде. Результаты зависят также от свойств окислителя, его
концентрации, температуры, рН, продолжительности окисления и др. Получаемые
результаты сопоставимы только в том случае, когда точно соблюдены все условия
проведения анализа.
Бихроматная окисляемость позволяет получить
значение ХПК, наиболее приближенное к ХПКтеор, т.е. наиболее полное окисление
достигается бихроматом калия. Поэтому определение бихроматной окисляемости
является основным методом определения ХПК. Именно бихроматную окисляемость
часто называют "химическим потреблением кислорода". В условиях этого
метода большинство органических соединений окисляется на 95% и более, однако
окисляются не все соединения (толуол, бензол, пиридин, парафин и др.
практически не окисляются). Катализатором окисления является сульфат серебра,
который добавляется в аналитическую рецептуру для ускорения реакции и повышения
полноты окисления органических веществ. Избыток бихромата оттитровывается
раствором соли Мора. Реакцию проводят в жестких условиях - в 50%-ной
(18-нормальной, разбавление 1:1) серной кислоте при кипячении. Содержание
неорганических восстановителей в пробе определяют отдельно специальными методами
и вычитают из ХПК пробы.
Бихромат при этом восстанавливается согласно
уравнению:
Cr2O72-
+ 14 H+ +6e-
→ 2 Cr3+ + 7H2O.
В таких условиях получаемый результат обычно
составляет 95-98% от ХПК(теор).
Бихроматная окисляемость
определяется методом титрования. Избыток бихромата калия после окисления
оттитровывают солью Мора в присутствии индикатора, в качестве которого обычно
используется ферроин. При этом катион Fe2+ в титранте реагирует с катионом
хрома. Индикатор образует интенсивно окрашенное соединение с Fe2+, и бесцветное
- с Fe3+. По этой причине, когда восстановление Cr6+ до Cr3+ завершено, Fe2+
реагирует с индикатором с образованием ферроинового комплекса. При этом окраска
раствора отчетливо изменяется от синевато-зеленой до красно-коричневой, что указывает
момент окончания титрования. Момент окончания титрования может быть установлен
также потенциометрически.
Другой пример применения
редокс-метрии - определение содержания аскорбиновой кислоты в прохладительных
напитках. Аналитическое определение аскорбиновой кислоты основано на том, что
она проявляет восстановительные свойства, окисляясь до дегидроаскорбиновой
кислоты, и может быть оттитрована такими мягкими окислителями, как иод J2, гексацианоферрат калия (III) K3[Fe(CN)6] и некоторыми
другими. В качестве индикатора используется вариаминовый синий в виде 0,5%
водного раствора. К исследуемому раствору добавляют 1-2 капли индикатора и
титруют 0,005н раствором J2 в KJ.
В общем виде реакцию между
аскорбиновой кислотой и иодом можно записать так:
C6H8O6 + J2 → C6H6O6 + 2HJ.
После достижения точки
эквивалентности первая капля иода реагирует с вариаминовым синим
C6H5NHC6H4N2·HSO4 и окрашивает его в сине-фиолетовый цвет, что свидетельствует
о завершении титрования.
Заключение
Редокс-титрование является методом
количественного определения веществ, проявляющих восстановительные свойства.
Соответственно, титрантами в данном методе служат растворы окислителей -
перманганата калия, бихромата калия, сульфата церия (IV).
Титрование можно производить вручную или
автоматически, конечную точку титрования можно определять инструментально
(методами потенциометрии, вольтамперометрии ) или визуально ( в случае, когда
продукты реакции имеют окраску, отличную от окраски исходных реагентов).
Окислительно-восстановительное титрование может быть выполнено различными
способами; так, выделяют прямое, обратное, заместительное титрование.
Окислительно-восстановительное титрование
применяется в фармацевтическом анализе, при определении окисляемости воды,
определении многих органических соединений (таких, как глюкоза C6H12O6,
ацетилацетон СН3-СО-СН2-СО-СН3, карбоновые многоосновные кислоты R(COOH)n,
витамины) и др.
Таким образом, редоксметрия является одним из
важнейших практических приложений аналитической химии.
окислительный титрование редокс
цериметрия
Список литературы
. Харитонов Ю.Я. Аналитическая химия
(аналитика), том 2.. - М.: Высшая школа, 2001. - 615с.
. Крешков А.П. Основы аналитической
химии, том 2. - М.: Просвещение, 1971. - 458с.
. Болотов В.В., Дынник Е.В., Жукова
Т.В. Количественный анализ. - Х.: Издательство НФАУ, 2002. - 164 с.
. Золотов Ю.А. Основы аналитической
химии, том 2. - второе издание. - М.:Высшая школа, 1999.
. Васильев В. П. Аналитическая
химия. . - М.: Высшая школа. 1989. Часть 1. Гравиметрический и титриметрический
методы анализа. - 320 с.
. Пилипенко А. Т., Пятницкий И. В.
Аналитическая химия. Книга 1. М.: Химия. 1990. - 480с.
. Муравьев А.Г. Руководство по
определению показателей качества воды полевыми ме-тодами. 3-е изд., доп. и
перераб. - СПб.: "Крисмас+", 2004. - 248 с.