Производство серной кислоты
Содержание
Введение
. Аналитический обзор
.1 Физические и химические свойства серной кислоты
.2 Сырьевые источники для сернокислотного производства
.3 Методы получения серной кислоты
. Технологическая схема получения серной кислоты контактным
методом на колчедане
. Технологические расчеты оборудования
.1 Технологический расчет печи обжига колчедана
.2 Технологический расчет котла-утилизатора
.3 Технологический расчет контактного аппарата
. Техника безопасности
Заключение
Литература
Введение
серная кислота производство колчедан
Серная кислота является одним из важнейших продуктов химической
промышленности. По объему производства с серной кислотой можно сравнить лишь
соду и связанный азот, а по разнообразию областей применения серная кислота
несомненно занимает первое место. Серную кислоту применяют не только в
многочисленных химических, но и других отраслях народного хозяйства.
Серную кислоту применяют [1]:
в производстве минеральных удобрений;
как электролит в свинцовых аккумуляторах;
для получения различных минеральных кислот и солей;
в производстве химических волокон, красителей, дымообразующих веществ и
взрывчатых веществ;
в нефтяной (очистка нефти), металлообрабатывающий (получение меди, цинка,
кобальта, никеля, серебра), текстильной (отбелка тканей),кожевенной, и др.
отраслях промышленности;
в пищевой промышленности - зарегистрирована в качестве пищевой добавки
Е513 (эмульгатор);
в промышленном органическом синтезе в реакциях:
дегидратации ( получение диэтилового эфира, сложных эфиров);
гидратации ( этанол из этилена);
сульфирования (синтетические моющие средства и промежуточные продукты в
производстве красителей);
алкилирования ( получение изооктана, полиэтилен глюколя).
В химической промышленности серную кислоту используют для производства
удобрений, кислот (соляной, фосфорной, плавиковой и т.д.), сернокислых солей,
пластических масс, для осушки различных газов, концентрирования азотной кислоты
и для других целей.
Последние годы российский рынок серной кислоты был крайне нестабилен.
Крайне негативно на рынке кислоты отразился и мировой финансовый кризис.
Продажи серной кислоты за 2008 - 2009 годы упали на 11,5 % до 8,5 млн. т. В
2010 году рынок быстро пошел вверх, к концу года продажи выросли до 9,3 млн. т.
Структура потребления серной кислоты на мировом рынке по данным ICIS показана на рисунке 1.
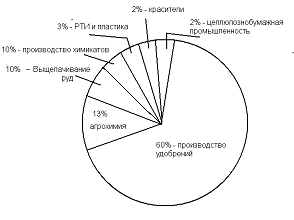
Рисунок 1-Структура потребления серной кислоты на мировом рынке [2]
По сравнению с 2005 годом объем потребления серной кислоты вырос на 9,2
%, среднегодовой темп роста потребления - 1,8%. Серную кислоту получают на
заводах цветной металлургии, заводах по производству фосфорных удобрений и
заводах - производителях серной кислоты.
Динамика производства серной кислоты представлена диаграммой на рисунке
2.
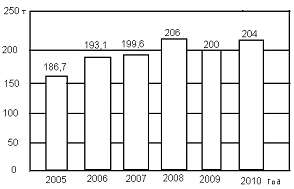
Рисунок
2-Динамика производства серной кислоты [2]
Необходимо
отметить, что большая часть серной кислоты, поставляемой на мировой рынок,
является побочным продуктом предприятий цветной металлургии, в то время как
основное производство и потребление серной кислоты приходится на производителей
фосфорных удобрений, которые получают серную кислоту из серы. Основные мировые
экспортеры серной кислоты - Республика Корея, Япония и Канада.
Таблица 1 - Экспорт серной кислоты странами мира [2] В тоннах
|
Год
|
2005
|
2006
|
2007
|
2008
|
2009
|
2010
|
|
Страна
|
|
|
Республика Корея
|
1746456
|
1950460
|
2127026
|
2369618
|
2225744
|
2344919
|
|
Япония
|
1377593
|
1857086
|
1952665
|
2113789
|
1985448
|
2091751
|
|
Канада
|
2013864
|
1990903
|
2314538
|
237656
|
861917
|
1782952
|
|
Индия
|
6807
|
17459
|
313071
|
976628
|
917331
|
966448
|
|
Германия
|
1113907
|
1230569
|
933731
|
890234
|
761328
|
802093
|
|
Перу
|
147201
|
80762
|
509509
|
792731
|
744600
|
784469
|
|
Болгария
|
172083
|
251242
|
514875
|
681205
|
639845
|
674104
|
|
Филиппины
|
130640
|
274710
|
294407
|
506505
|
475752
|
501225
|
|
Испания
|
326394
|
475923
|
349960
|
431979
|
416514
|
438816
|
|
Польша
|
124492
|
45213
|
280831
|
411757
|
386586
|
407285
|
|
Мексика
|
742157
|
535824
|
385798
|
390743
|
367019
|
386671
|
|
Швеция
|
567375
|
634337
|
539493
|
390586
|
366871
|
386515
|
|
Италия
|
385204
|
212348
|
402582
|
386333
|
362876
|
382306
|
|
Китай
|
4276
|
4243
|
3853
|
382418
|
359199
|
378432
|
|
Бельгия
|
416035
|
403947
|
375091
|
326346
|
306531
|
522944
|
|
США
|
350139
|
248490
|
336577
|
285256
|
267927
|
282272
|
|
Нидерланды
|
207657
|
221426
|
196068
|
226541
|
212786
|
224180
|
|
Прочие
|
1453332
|
1013816
|
1044554
|
1088533
|
1133197
|
1192874
|
|
Итог
|
11305611
|
11428760
|
12874717
|
15027573
|
12791470
|
14351262
|
Ключевыми импортерами серной кислоты являются США, Чили и Китай.
Импортируемая серная кислота применяется для производства агрохимической
продукции.
Таблица 2 - Импорт серной кислоты странами мира [2] В тоннах
|
Год
|
2005
|
2006
|
2007
|
2008
|
2009
|
2010
|
|
Страна
|
|
|
США
|
2660066
|
2427172
|
2603028
|
5163181
|
2892043
|
2996446
|
|
Чили
|
522870
|
621744
|
1381281
|
2389048
|
2357373
|
2442474
|
|
Китай
|
1956030
|
2158390
|
1959169
|
1606684
|
1585382
|
1642614
|
|
Турция
|
207646
|
316778
|
379520
|
365867
|
511802
|
530278
|
|
Индия
|
40537
|
250249
|
415778
|
409818
|
404385
|
418983
|
|
Австралия
|
402324
|
421450
|
545075
|
655468
|
392901
|
407085
|
|
Бельгия
|
657575
|
469281
|
468035
|
353973
|
349280
|
361889
|
|
Бразилия
|
477621
|
478131
|
428660
|
508284
|
336813
|
348971
|
|
Филиппины
|
81606
|
259073
|
266775
|
339458
|
334958
|
347050
|
|
Нидерланды
|
265197
|
219948
|
206953
|
320506
|
316256
|
527673
|
|
Франция
|
213934
|
306634
|
288892
|
354840
|
311953
|
32531
|
|
Намибия
|
186904
|
169100
|
259709
|
306673
|
302607
|
313531
|
|
Азиатские страны
|
191084
|
174578
|
204256
|
223769
|
220802
|
228773
|
|
Таиланд
|
43315
|
109002
|
94758
|
206823
|
204081
|
211448
|
|
Германия
|
173571
|
164359
|
200629
|
187405
|
184920
|
191596
|
|
Великобритания
|
393775
|
313748
|
415252
|
400656
|
179574
|
186056
|
|
Португалия
|
165683
|
105512
|
90149
|
133871
|
132096
|
136864
|
|
Венесуэла
|
52410
|
80669
|
44699
|
108278
|
106843
|
110700
|
|
Канада
|
92086
|
77348
|
101955
|
84157
|
104719
|
108499
|
|
Норвегия
|
138007
|
166941
|
168163
|
157043
|
104135
|
107834
|
|
Аргентина
|
20568
|
43371
|
64461
|
102151
|
100797
|
104436
|
|
Марокко
|
112870
|
104056
|
72660
|
97833
|
96536
|
100021
|
|
Прочие
|
1761660
|
1859742
|
1443342
|
1459383
|
1334902
|
|
Итог
|
10847336
|
11297311
|
12103264
|
15935169
|
12818643
|
13281396
|
Из данных United Nations Statistics Division можно сделать вывод о том, что самые
низкие цены на серную кислоту наблюдаются в регионах Дальнего Востока и
Восточной Европы. Цены в Южной Азии Океании выше на 30 - 40%, в Канаде на 80 -
90%.
Таблица 3 - Экспортные цены на серную кислоту( долл. США\ тонна) без НДС
[2]
|
Год
|
2005
|
2006
|
2007
|
2008
|
2009
|
2010
|
|
Страна
|
|
|
|
|
|
|
|
Республика Корея
|
29, 51
|
21,36
|
23,43
|
66,49
|
65,40
|
70,20
|
|
Япония
|
33, 93
|
36,51
|
25,74
|
75,70
|
74,80
|
75,10
|
|
Канада
|
44,09
|
44,19
|
47,97
|
105,57
|
153,31
|
130,24
|
|
Индия
|
124,10
|
124,68
|
101,47
|
172,41
|
103,80
|
107, 95
|
|
Германия
|
43,41
|
35,21
|
52, 35
|
102,61
|
89,72
|
94,26
|
|
Перу
|
30,21
|
34,39
|
43,81
|
85, 10
|
80, 40
|
83,20
|
|
Болгария
|
26,48
|
19,60
|
25,92
|
66,63
|
64,39
|
66,97
|
|
Филиппины
|
11,07
|
20,28
|
40,99
|
94,26
|
90,51
|
94,13
|
Таблица 4 - Импортные цены на серную кислоту (долл. США/ тонна) без НДС
[2]
|
Год
|
2005
|
2006
|
2007
|
2008
|
2009
|
2010
|
|
Страна
|
|
|
|
|
|
|
|
США
|
43,89
|
44,03
|
48,42
|
100,22
|
60,50
|
64,60
|
|
Чили
|
57,01
|
57,44
|
77,64
|
193,64
|
113,84
|
120,05
|
|
Китай
|
32,53
|
21,43
|
31,16
|
96,46
|
55,82
|
57,62
|
|
Турция
|
38,07
|
29,90
|
36,35
|
67,79
|
15,20
|
16,00
|
|
Индия
|
43,35
|
56,07
|
57,91
|
188,23
|
110,72
|
120, 30
|
|
Австралия
|
46,34
|
38,68
|
35,54
|
124,56
|
52,98
|
56,85
|
|
Бельгия
|
47,02
|
37,64
|
56,92
|
140,47
|
84,43
|
88,56
|
1.
Аналитический обзор
1.1 Физические и химические свойства серной кислоты
Таблица 5 -
Физические и химические свойства серной кислоты [3]
|
Серная кислота
|
О | OH-S-OH || O
|
|
Общие
|
Систематическое
наименование
|
Серная кислота
|
|
Химическая формула
|
H2SO4
|
|
Относительная молекулярная
масса
|
98,082 а.е.м.
|
|
Молярная масса
|
98,082 г/моль
|
|
Физические свойства
|
Состояние
|
Жидкость
|
|
Плотность
|
1,8356 г/см3
|
|
Термические свойства
|
Температура плавления
|
- 10,380С
|
|
Температура кипения
|
279,60С
|
|
Температура воспламенения
|
Не воспламеняется
|
|
Удельная теплота плавления
|
10,73 Дж/кг
|
|
Химические свойства
|
рКа
|
-3
|
|
Растворимость в воде
|
Смешивается г/100 мл
|
|
Оптические свойства
|
Показатель преломления
|
1, 397
|
|
Структура
|
Дипольный момент
|
2,72 D
|
|
Классификация
|
Рег. номер CAS
|
7664 - 93 - 9
|
|
Рег. номер EC
|
231 - 639 - 5
|
|
Рег. номер RTECS
|
WS 5600000
|
|
Токсикология
|
ЛД50
|
510 м2 /кг
|
|
Токсичность
|
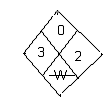
|
Серная кислота H2SO4 - сильная двухосновная кислота,
отвечающая высшей степени окисления серы (+6). При обычных условиях
концентрированная серная кислота - тяжелая маслянистая жидкость без цвета и
запаха. В технике серной кислоты называют ее смеси как с водой, так и с серным
ангидридом SO3. Если молярное отношение SO3 : H2O 1, то это водный раствор серной кислоты. Если SO3 : H2O 1, то это раствор SO3 в серной кислоте (олеум).
Серная кислота, при 18оС рКа = -2,8; Кг
= 1,2• 102; рКа = 1, 92 - очень сильная кислота. Длина
связей в молекуле S = O 0,143 нм, S-OH 0,154 нм, угол HOSOH 104о, OSO119о. Серная кислота
кипит, образуя азеотропную смесь (98,3% H2SO4 и 1,7% H2О с температурой кипения 338,8оС).
Серная кислота, отвечающая 100% содержанию H2SO4
имеет состав: H2SO4 - 99,5%, HSO4 - 0,18%, H3SO4 - 0,14%, H3O+ - 0,09%, H2S2O7 - 0,04%, HS2O7 - 0,05%. Смешивается с водой и SO3 во всех соотношениях. В водных
растворах серная кислота практически полностью диссоциирует на H+,HSO4 - и SO2 -,образуют
гидраты H2SO4 × n H2O, где
n = 1,2,3,4 и 6,5.
Растворы серного ангидрида SO3
в серной кислоте
называются олеумом, они образуют два соединения H2SO4
•SO3 и H2SO4 •2 SO3. Олеум содержит такие пиросерные кислоты, получающиеся по
реакциям:
H2SO4 + SO3 → H2S2O7;2SO4
+ 2 SO3 → H2S3O10..
Температура кипения водных растворов серной кислоты повышаются с ростом
ее концентрации и достигает максимума при содержании 98,3% H2SO4.
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных
растворов серной кислоты общее давление пара на растворами понижается и при
содержании 98,3% H2SO4 достигает минимума. С увеличением
концентрации SO3 в олеуме, общее давление пара над ним
повышается. Давление пара над водными растворами серной кислоты и олеума можно
вычислить по формуле:
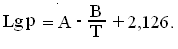
Плотность 100% серной кислоты можно определить по уравнению:
d =
1,8517 - 1,1 • 10-3 t + 2
• 10-3 t2.
Серная кислота - довольно сильный окислитель, особенно при нагревании и в
концентрированном виде. Серная кислота окисляет HI и частично HBr до
свободных галогенов, углерод до CO2, S до SO2,окисляет многие металлы (Cu, Hg и др). При этом
серная кислота восстанавливается до SO2,а
наиболее сильными восстановителями - до S и H2S.
Концентрированная H2SO4 частично восстанавливается до Н2,из-за
чего не может изменится до сушки. Разбавленная H2SO4
взаимодействует со
всеми металлами, находящимися в электрохимическом ряду напряжений левее
водорода с его выделением. Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние
- сульфаты и кислые гидросульфаты, а также эфиры. 9
.2 Сырьевые источники для сернокислотного производства
Исходными
веществами для промышленного производства серной кислоты являются сернистый
газ, кислород и вода. Из этих исходных веществ сернистый газ является
промышленным полупродуктом сернистых металлов и сжиганием самородной серы. Из
природных сернистых металлов специально для сернокислотного производства
используют пирит, или серный колчедан, состоящий главным образом из
двусернистого железа FeS2. Пирит
специально добывают для этой цели, или получают попутно при добыче природных
сернистых соединений цветных металлов. Последние в процессе производства
обжигают, при этом в качестве побочного продукта получается также сернистый
газ, который может быть использован для производства серной кислоты.
Помимо самородной серы и сернистых металлов ( железа, меди, цинка, свинца
и д.р.), сера в природе встречается также в виде сернокислых ( кальция, бария,
магния, натрия, железа и д.р.).
Сера содержится в нефти и каменном угле. Общее содержание серы в земной
коре составляет 0,1 %.
В качестве сырья для сернокислотного производства могут быть использованы
некоторые промышленные отходы, например кислые гудроны, травильные растворы,
фосфогипс.
1.2.1 Самородные серные руды
Залежи самородных серных руд встречаются в трех видах:
осадочные месторождения;
вулканические месторождения;
залежи в шляпах соляных куполов.
Многие самородные серные руды могут быть непосредственно подвержены
обжигу с получением сернистого газа для производства серной кислоты. Для этой
цели пригодны руды с содержанием серы порядка 20% и выше.
1.2.2 Серный колчедан
Основным сырьем для сернокислотного производства до сих пор служит серный
колчедан, главной составной частью которого является двусернистое железо FeS2, содержащее 53,46% S и 46,54% Fe.
Двусернистое железо существует в двух кристаллических видоизменениях:
пирит, кристаллизующий в кубической системе (плотность 4,95 - 5,0 г/см3);
марказит, кристаллизующий в ромбической системе (плотность 4,55 г/см3).
Известны следующие виды серного колчедана:
рядовой серный колчедан, добываемый специально или попутно при добыче
медистых сернистых руд; 10
флотационный колчедан, получаемый как отход при флотационном обогащении
содержащих медь сернистых руд;
углистый колчедан, получаемый в виде отхода при добыче и обогащении
ископаемых углей.
В рядовом серном колчедане содержится от 25 до 52% S и от 35 до 44% Fe. Основные примеси и колчедану:
сернистые соединения меди, цинка, свинца, мышьяка, никеля, кобальта,
селена, теллура;
углекислые и сернокислые соли кальция, магния;
тальк, кварц;
в незначительных количествах золото и серебро.
Цвет колчедана - зеленовато-серый.
На сернокислотные заводы рядовой колчедан поступает в виде кусков или в
виде мелочи.
Серный колчедан - самый распространенный из сернистых соединений
материал: он встречается во всех зонах земной коры.
Флотационный колчедан получают при выплавке меди из бедных медью
сернистых руд, содержащих от 3 до 8% меди.
Метод флотации основан на различном отношении к смачиванию водой
различных минералов. При флотации создаются такие условия, что частицы минералов,
не смачивающихся водой, прилипает к пузырькам воздуха и поднимаются вверх, а
частицы минералов, смачивающихся водой, оседают на дно сосуда.
Обогащенная часть руды называется концентратом, а остальная часть руды -
флотационными хвостами или флотационным колчеданом. Флотационный колчедан
выходит с обогатительной фабрики очень влажным, до 80% и для использования в
качестве сырья для производства сернистого газа должен быть предварительно
подвергнут фильтрации и сушке.
Флотационные пиритные хвосты содержат 32 - 40% серы. Если флотационный
колчедан подвергнуть вторичной флотации для отделения пирита от пустой породы,
то содержание серы в полученном пиритом концентрате можно повысить до 46 - 50%.
Сера в том или ином количестве содержится во всех ископаемых углях. Она
присутствует в них в виде серосодержащих органических соединений,
сернокислотных молей и пирита.
При добыче угля углистый колчедан в виде желваков может быть отобран
вручную. После околотки он содержит до 40% серы и 12- 18% угля. В результате
ручной отборки углистого колчедана и механического обогащения угля получаются
угольный концентрат, первичные отходы углеобогащения и углистый колчедан в
количествах, указанных в таблице 7.
Таблица 6 - Содержание серы в ископаемых углях % [1]
|
Наименьшее
|
Наибольшее
|
Среднее
|
|
Общее содержание серы
|
0,44
|
10,83
|
2,29
|
|
В виде пирита
|
0,20
|
2,61
|
1,00
|
|
В виде сернокислых солей
|
0,01
|
0,32
|
0,05
|
|
В виде органических
соединений
|
0,23
|
7,9
|
1,27
|
Таблица 7 - Распределение серы при обогащении угля [1]
|
Выход, %
|
Содержание, %
|
Переход серы в % от общего
содержания в породе
|
|
|
S
|
C
|
|
|
Угольный концентрат
|
87,10
|
2,54
|
89,36
|
76,3 - 69,5
|
|
Первичные отходы
углеобогащения
|
12,5 - 12,8
|
7,25
|
30
|
27,8 - 29,2
|
|
Углистый колчедан
|
0,1 - 0,4
|
40,0
|
12 - 15
|
1,26 - 4,87
|
.2.3 Сернокислые соли
В природе встречаются залежи сернокислых солей различных металлов.
Особенно многочисленны залежи гипса - водного сернокислого кальция:
Ca SO4 × 2H2O
Сернокислый кальций встречается также в виде :
безводной соли - ангидрида Ca SO4;
безводной соли - тенардита Na2SO4;
десятиводной соли - мирабилита Na2SO4
× 10H2O.
Значительны также залежи тяжелого шпата (сернокислого бария), кизерита
(сернокислого магния), алунита (сернокислого алюминия в виде квасцов),
купоросного сланца (сернокислого железа).
Наряду с природным гипсом для производства серной кислоты может быть
использован также фосфогипс, который представляет собой отход производства
концентрированных фосфорных удобрений.
Работы по использованию гипса для сернокислого производства ведутся в
следующих направлениях:
разложения с получением сернистого газа;
восстановление до сернистого кальция, вытеснение сероводорода и
дальнейшая переработка последнего на серную кислоту и серу;
переработка в другую сернокислую соль, технически более важную.
1.2.4 Промышленные отходы, содержащие серу
В обжиговых печах степень выгорания серы может колебаться от 25 до 75%.
Получаемый при этом газ по составу не отличается от газа, получаемого при
обжиге колчедана, и может быть непосредственно использован для производства
серной кислоты.
При сжигании угля в топках котельных установок сера, содержащаяся в угле
в виде пирита и органических серосодержащих соединений, превращается в
сернистый газ, который вместе с отходящим газом котельных установок
выбрасывается в трубу.
При коксовании угля около 50% всей содержащейся в угле серы переходит в
коксовый газ. При этом основная часть серы, перешедшей в газ (до 95%) находится
в нем в виде сероводорода. В коксовом газе содержится в виде сероводорода 5 -25
г/м3 серы. Кроме сероводорода, в газе
находятся органические соединения серы, тиофен, меркантаны.
Серная кислота, применяемая для очистки нефтепродуктов, переходит в
отброс производства нефтеперегонных заводов - кислые гудроны.
По составу кислые гудроны - весьма сложная смесь серной кислоты,
различных органических сульфосоединений и др. Содержание серной кислоты в
гудронах колеблется от 20 до 50%.
При термическом разложении кислых гудронов образуется двуокись серы,
вода, кокс и углеводороды. Разложение проводится во вращающихся печах.
Полученный сернистый газ с успехом может быть направлен в сернокислотную
установку для переработки в серную кислоту.
В металлообрабатывающей промышленности и машиностроении при давлении
металла получаются в качестве отхода травильные растворы содержащие 2 -4 %
свободной H2SO4 и до 25% FeSO4. Подобные
же отходы получаются при производстве титановых белил.
Из тривиального раствора, путем его охлаждения холодильным раствором,
выделяют все сернокислое железо в виде FeSO4×7H2O. Получаемый железный купорос может быть использован для получения
серной кислоты.
1.3 Методы производства серной кислоты
В настоящее время производство серной кислоты осуществляется в основном
двумя методами:
нитрозным;
контактным.
Исходных веществ для производства серной кислоты по обоим методам
является сернистый газ, который специально для этой цели получают сжиганием
серы или обжигом сернистых металлов.
Переработки сернистого газа в сернистую кислоту заключается в окислении
двуокиси серы и присоединении воды:
SO2 + 1|2 O2 + H2O = H2SO4.
Однако двуокись серы непосредственно с кислородом не реагирует, в
следствии чего для переработки ее в серную кислоту и применяют специальные
методы.
1.3.1 Нитрозный метод
По нитрозному методу окисление сернистого газа осуществляют при помощи
окислов азота. При этом высшие окислы азота (двуокись азота NO2,трехокись азота NO3) восстанавливаются до окиси азота NO. Окись азота затем вновь окисляется до высших окислов
непосредственно кислородом. Таким образом, окислы азота в производстве серной
кислоты играют роль передатчика кислорода.
Нитрозный процесс получения серной кислоты технически оформлен в виде
двух способов:
камерного;
башенного.
1.3.1.1 Камерный способ получения серной кислоты
Принципиальная схема производства серной кислоты камерным способом
изображена на рисунке 3.
В башне 1 навстречу сернистому газу, полученному обжигом сырья, течет по
насадке окислов азота в серной кислоте. В этом растворе, называемом нитрозой,
содержание различных окислов азота (NO, NO2, NO3) таково, что в общем их состав
соответствует N2O3. При действии на нитрозу горячего сернистого газа
(температура входящего газа 280 - 4000С,а выходящего - 1200С)
из нее выделяются окислы азота, которые вместе с двуокисью серы и кислородом
поступают в камеры 2. В камерах происходит окисление двуокиси серы и, в
следствии присутствия паров воды, образование серной кислоты:
SO2 + NO2 + H2O = H2SO4
+ NO;
NO + O2 = 2NO2. 14
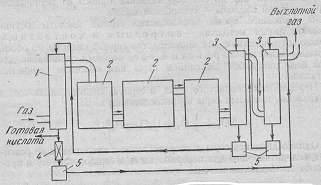
Рисунок 3 - Схема производства серной кислоты камерным способом [1]
-денитрационная башня; 2 -камеры; 3- поглотительные башни; 4-холодильник;
-сборники кислоты.
К моменту выхода газа из последней камеры 2 заканчивается окисление
двуокиси серы и окислы азота опять достигают степени окисления, в среднем
соответствующей N2O3. из камер 2 газ поступает в поглотительные башни 3,
где содержащиеся в нем окислы азота поглощаются серной кислотой. Образующиеся в
поглотительных башнях 3 нитроза подается на орошение башни 1, из которой
вытекает нагретая кислота, освобожденная от окислов азота. Часть ее отбирают в
качестве готового продукта, а часть через холодильник 4 подают на орошение
поглотительных башен 3. Процесс окисления двуокиси серы, происходящей в
основном в камерах, начинается уже в башне 1.
1.3.1.2 Башенный способ получения серной кислоты
Принципиальная схема производства серной кислоты башенным способом
изображена на рисунке 4.
В башенных системах сернистый газ, полученный обжигом колчедана,
последовательно проходит через ряд башен.
Первые башни 1, 2 орошается нитрозой, содержащий до 6% N2O3,в них происходит окисление двуокиси серы окисями азота,
находящимися в нитрозе. Часть окислов азота выделяется из нитрозы в газовую
фазу.
В последних башнях 4, 5 окислы азота поглощаются нитрозой. Окислы азота
лучше всего поглощаются серной кислотой в виде эквимолекулярной смеси NO + NO2.. Так как при выходе из башни, в которой заканчивается
окисление двуокиси серы, в газе обычно содержится больше NO, чем NO2, то в новых системах газ перед поступлением в поглотительные
башни 4, 5 проходит через окислительную башню 3, в которой окислы азота доводятся
до степени окисления, соответствующей N2O3.
Вытекающая из первых башен 1,2 называемых продукционными,
нитроза с пониженным содержанием окислов азота подается на орошение последних
поглотительных башен 4, 5.
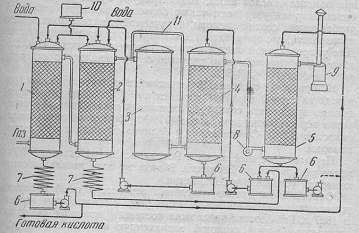
Рисунок 4 - Схема производства серной кислоты башенным способом [1]
,2-продукционные башни; 3-окислительная башня; 4,5-поглотительные башни;
6-циркуляционные сборники нитроза; 7-холодильники; 8-вентилятор; 9-циклон;
10-бак для азотной кислоты;11-обводной газопровод.
Нитроза, вытекающая из поглотительных башен 4, 5, подается на орошение
продукционных башен 1,2.
Первую продукционную башню орошают таким количеством нитрозы, чтобы
вытекающая кислота содержала не больше окислов азота, чем предусмотрено
стандартом не выпускаемый продукт, так как из этой башни отбирается продукция
системы.
При помощи окислов азота получают кислоту с содержанием 65 и 76% H2SO4. Кислота такой концентрации находит лишь ограниченное
применение. Поэтому серную кислоту, получаемую при помощи окислов азота,
концентрируют путем упарки. Однако путем упарки можно получить серную кислоту с
содержанием не более 98% H2SO4.
1.3.2 Контактный метод
По контактному методу окисление двуокиси серы осуществляют на поверхности
твердого катализатора. Образующаяся трехокись серы непосредственно соединятся с
водой, превращаясь в серную кислоту. Принципиальная схема производства серной
кислоты по контактному методу изображена на рисунке 5.

Рисунок 5 - Схема производства серной кислоты контактным методом [1]
-промывная башня; 2-электрофильтр; 3-сушильная башня; 4-теплообменник; 5-контактный
аппарат; 6-холодильник; 7, 8-поглотительные башни; 9-сборники; 10-холодильники для кислоты.
Сернистый газ из печей, прошедший через сухие электрофильтры, поступает
для окончательной очистки от пыли в промывную башню 1.
Для освобождения от соединений мышьяка и сернокислотного тумана газ
проходит через мокрый электрофильтр 2. При этом газ увлажняется. Для
освобождения от влаги газ осушается концентрированной серной кислотой в
сушильной башне 3. Очищенный сухой газ, подогретый в теплообменнике 4 за счет
тепла газов, идущих из контактного аппарата 5, поступает в контактный аппарат
5, заполненный контактной массой (катализатором), где SO2 окисляется в SO3. Газ, идущий из контактного аппарата
5, пройдя теплообменник 4 и холодильник 6, проходит далее через две
поглотительные башни 7,8, где трехокись серы поглощается серной кислотой. В
башне 7 образуется олеум, а в башне 8 - 98% кислота H2SO4. Для сохранения постоянства
концентрации кислоты, орошающей поглотительные башни 7,8 и сушильную башню 3, в
башни 7 и 3 добавляется часть кислот из башни 8, а в башню 8 добавляется часть
кислоты из башни 3. Если влаги, поступающей с газом, недостаточно для
образования продукционной кислоты, в систему добавляют воду. В зависимости от
того, какой концентрации желают получить готовую кислоту, продукцию отбирают из
сушильной башни 3 или из поглотительных башен 7,8.
Таким образом, основными стадиями контактного процесса являются:
специальная очистка газа;
осушка газа;
контактное окисление двуокиси серы;
поглощение трехокиси серы.
2.
Технологическая схема получения серной кислоты контактным методом на колчедане
На рисунке 6 изображена технологическая схема получения серной кислоты
контактным методом на колчедане.
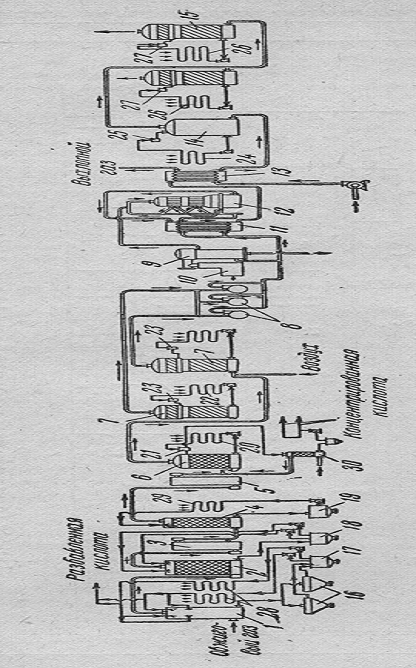
Рисунок 6 -Технологическая схема получения серной кислоты контактным
методом на колчедане [1] 19
1,2-промывные
башни; 3,5-мокрые электрофильтры; 4 -увлажнительная башня; 6,7-сушильные башни;
8-компрессоры; 9-пусковой подогреватель; 10-топка пускового подогревателя;
11-теплообменник; 12-контактный аппарат;
-холодильник
трехокиси серы; 14-олеумная поглотительная башня;
-поглотительная
башня для безводной серной кислоты; 16-отстойники для кислоты;
17,18,19-сборники кислоты; 20,22,24,26,28,29-холодильники для кислоты;
21,23,25,27-напорные баки; 30-башня для выдувания двуокиси серы.
Обжиговый газ, после очистки в сухих электрофильтрах, последовательно
проходит две промывные башни 1,2, а затем через первые два мокрых
электрофильтра 3, увлажнительную башню 4 и вторые два электрофильтра 5.
Очищенный увлажненный газ последовательно проходит через две сушильные башни
6,7 и компрессором 8 подается в контактный узел.
Подогретый в теплообменнике 11, за счет тепла газа, идущего из
контактного аппарата 12, газ поступает в контактный аппарат и возвращается из
него через теплообменник 11.
Во время пуска подогрев газа осуществляется в подогревателе 9 за счет
тепла топочного газа, получаемого в топке 10.
После теплообменника 11 газ дополнительно охлаждается в воздушном
холодильнике 13 и проходит две поглотительные башни: 14 - для олеума, 15 - для
безводной серной кислоты, в которых трехокись серы поглощаются орошающей
кислотой. В соответствии с растворимостью сернистого газа в серной кислоте, в
сушильной башне поглощается кислотой некоторое количество двуокиси серы. Для
освобождения сушильной кислоты двуокиси серы кислота из первой сушильной башни
пропускается через небольшую башню 30, в которой она продувается воздухом.
Воздух вместе с выделенной из кислоты двуокисью серы направляют в трубопровод,
подводящий газ к первой сушильной башне.
3. Технологические расчеты оборудования
.1 Технологический расчет печи обжига колчедана
.1.1 Исходные данные:
- Производительность по пириту, т/сутки……………………………..350
Состав пирита, % мас.:
SiO2………………………………………………………...……….……..7
Al2O3……………………………………………………………………....1
Состав окислителя (воздуха), % мас.:
O2 ………………………………………………………… … ……….20,5
N2……………………………………………………………… ……..79,5
Избыток воздуха составляет, % от стехиометрии…………………….20
Степень реагирования пирита,%…………………………………….....98
- Температура поступающих в печь продуктов, оС…………………….23
- Температура отходящих из печи продуктов, оС……………………..830
Хладоагент для отвоза избыточного тепла(воздух):
TH, оС……………………………………………………………………..23
TH, оС………………………………………………………… ……….120
Пылеунос с твердого продукта, % мас. …………………………. ….14
Тепловые потери, % от выделяющихся по реакции (I)………………...3
Теплоемкость шлака, С шлака,кДж/(кг·К)……………….………..,….0,71
Теплоемкость воздуха, Свозд, кДж/(кг·К)…………………………,…….1
Теплоемкость пирита, Спирита, кДж/(кг·К)……………………………0,52
Теплоемкость двуокиси серы, Сso2,кДж/(кг·К)……………………....0,75
Атомная масса:
- Fe…………………………….………………………… …………...55,849
- S……………………….………………………………… ………... 32,064
O…………………………………………………………
………….15,999
производительность по колчедану, т/сут……… ……….………….350
температура в печи, Т оС………………………………………………830
степень выгорания серы, η %…………………………………………..98
- время пребывания газа в печи, с …… ……………………………..….8
скорость газа в печи, W
м/с…………………………………………….1
концентрация SO2 в газе СSO2, %……………………………………..15
содержание серы в колчедане Cs ,%………………………………….92
3.1.2 Материальный баланс обжига колчедана
Процесс горения колчедана складывается из стадий:
термическое разложение FeS2:
FeS2 = 2FeS + S2;
горения серы:
S2 + 2O2 = 2SO2;
окисления FeS2, которое суммарно может быть
окислено уравнениями:
4FeS2 + 7O2 = 2Fe2O3 + 4SO2
или 3FeS + 5O2 =
Fe3O4 + 3SO2.
Окончательное горение колчедана представляют общими уравнениями:
при образовании окиси железа:
4FeS2 + 11O2 = 2Fe2O3
+ 8SO2 + 3372кДж;
при образовании закись - окись железа:
3FeS2 + 8O2 = Fe3O4
+ 6SO2 + 243,8 кДж.
Определим секундный расход пирита и содержание примесей в нём
G = 350×1000/24×3600 = 4,051кг/с;
G(SiO2) = %×SiO2/100×G
= 7/100×4,051 = 0,283кг/с;
G(Al2O3)
= %× Al2O3/100×G
= 1/100×4,051 = 0,040кг/с.
Определим массу прореагировавшего пирита
G(FeS2) = G×%FeS2/100×0,98
= 4,051×92/100×0,98 = 3,652кг/с.
Определим массу непрореагировавшего пирита
Gнепрореаг.(FeS2) = G×G(FeS2)×G(SiO2)×G(Al2O3)
=
4,051×3,652×0,283×0,040;
Gнепрореаг.(FeS2) = 0,076кг/с.
Оценим количество реагентов в уравнении
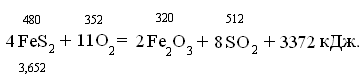
4FeS2 = 4 (55,849 +
2×32,064)= 480;
11О2 = 11 (15,999×2) = 352;
Fe2O3 = 2
(2×55,849 + 3×15,999) = 320;
8SO2 = 8 (32,064 + 2×15,999) =
512.
Определим количество кислорода
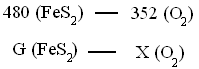
Отсюда,
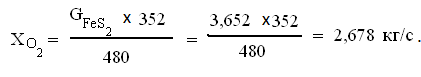 22
22
С учетом избытка кислорода получаем
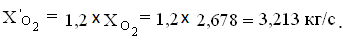
Отсюда избыток кислорода
Xизб.О2=3,213-2,678=0,535кг/с.
Определим количество воздуха подаваемого в аппарат
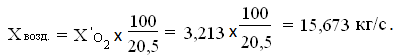
Определим
количество азота N2 в
подаваемом воздухе
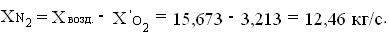
Определим
количество непрореагируемого кислорода
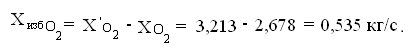
Определим количество окиси железа
480 (FeS2) - 320 (Fe2O3)(FeS2)
- X(Fe2O3)
Отсюда,
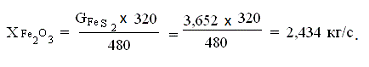
Определим
количество двуокиси серы
480 (FeS2) - 512 (SO2)(FeS2)
- X (SO2)
Отсюда,
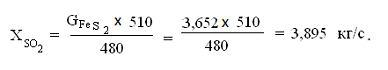
Определим
остаток пирита
ост. пирит =Xпирит
- ХFe2O3 = 4,051-2,434 = 1,617 кг/с.
Определим
остаток кислорода и азота
Х
N2, O2 = Хвозд. - ХSO2 = 15,673-3,895 = 11,778
кг/с.
Таблица 8 -
Материальный баланс обжига колчедана
|
Статьи
|
|
Приход
|
кг/с
|
%
|
Расход
|
кг/с
|
%
|
|
Пирит: FeS2
SiO2 Al2O3 FeS2 (непрореаг) Воздух: О2 (20%) N2 O2
(избыток)
|
4,051 3,652 0,283 0,040
0,076 15,673 3,213 12,46 0,535
|
100 90,15 6,98 0,98 1,87
100 20,5 79,49 3,41
|
Огарок: Fe2O3
и другое Газы + пыль: SO2
N 2 ; О 2
|
2,434 1,617 3,895
11,778
|
60,08 39,92 24,85
75,15
|
|
Всего
|
19,724
|
100
|
Всего
|
19,724
|
100
|
3.1.3 Тепловой баланс обжига колчедана
Рассчитаем приход теплоты.
Теплота поступает с пиритом:
Qпирит = Gпирит × Спирит
× tпирит ,
тогда,
Qпирит
= 4,051×0,52×23 = 48,45кВт.
Теплота поступает с воздухом:
Qвоздух = Gвоздух × С воздух
× tн.воздух ,
тогда,
Qвоздух
=
15,673×1×23 = 360,48кВт.
Теплота поступает за счет горения колчедана:
Qгорен.колч.= Gпирит.
×3372/320 ,
тогда,
Qгорен.колч=3,652×3372/320
= 26кВт.
Общий приход теплоты:
Qобщий
приход = Qпирит + Qвоздух+ Qгорен.колч,
тогда,
Qобщий
приход =
48,45+360,48+26=434,93кВт.
Рассчитаем расход теплоты [1].
Теплота уходит с огарком (14% огарка уходит из кипящего слоя с газами и
86% остается в остатке).
Qогарка = GFe2O3×Сшлак×tпрод.×14/100
+ GFe2O3×Сшлак×tпрод.×86/100,
тогда,
Qогарка
=
2,434×0,71×830×14/100+2,434×0,71×830×86/100, 24
Qогарка=201+1234=1435кВт.
Теплота уходит с обжиговым газом:
QSO2=GSO2×CSO2×tпрод.,
тогда,
QSO2=3,895×0,75×830=2424,63кВт.
Рассчитаем тепловые потери:
Qпотери= (Qогарка+ QSO2)×3/100,
тогда,
Qпотери=(1435+2424,63)×3/100=115,63кВт.
Общий расход теплоты:
Qобщ.расход= Qогарок+ QSO2+ Qпотери,
тогда,
Qобщ.расход=1430+2424,63+115,63=3970,26кВт.
Теплота используемая для испарения воды и получения пара:
Qпар= Qобщий приход - Qобщ.расход = 6136,53-3970,26 = 2166,27кВт.
Таблица 9 - Тепловой баланс обжига колчедана
|
Статьи
|
|
Приход
|
кВт
|
%
|
Расход
|
кВт
|
%
|
|
Пирит Воздух Тепловой
эффект
|
48,45 360,48 5727,6
|
0,78 5,87 93,33
|
Огарок Обжиговый газ
Тепловые потери Теплота образования пара
|
1430 2424,63 115,63 2166,27
|
23,30 39,51 1,88 35,30
|
|
Всего
|
6136,53
|
100
|
Всего
|
6136,53
|
100
|
3.1.4 Расчет печи для обжига колчедана в кипящем слое
Интенсивность печи кипящего слоя можно определить из выражения [3]:
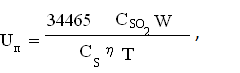
Тогда,
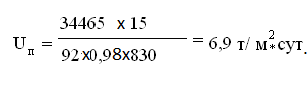
Объемную интенсивность печи кипящего слоя определяем по формуле:
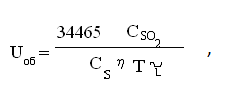
Тогда,

Площадь пода печи [3]:
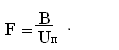
Тогда,

Диаметр
пода печи
D = 1,13 хF =
1,13 х51 = 8м.
Принимаем
площадь форкамеры для загрузки колчедана 3 м2. Общая площадь пода
печи Fобщ = 51+3
= 54 м2.
Внутренний
объем печи [3]:
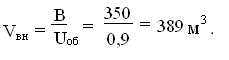
Высота
печи цилиндрической формы [3]:
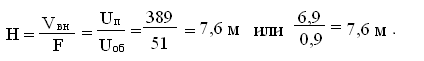
Полный
расход воздуха на обжиг [3]:
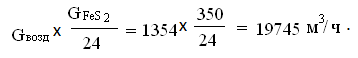
Объем
обжигового газа на 1 т колчедана[3]:
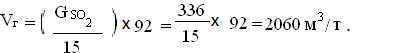
Расход
за 1 час составит [3]:
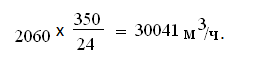
Скорость
газа в печи в рабочих условиях [3]:

Определим
число и размер дутьевых устройств. Число дутьевых грибков на 1 м2
беспровальной части решетки принимаем 30. Тогда всего грибков должно быть [3]:
N = 30×F = 30×51 = 1530 шт.
Расход
воздуха на провальную часть дутьевой решетки (в форкамере для загрузки
колчедана) принимаем 20% о общего количества [3]:
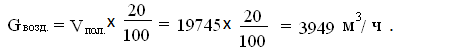
Расход
воздуха на один грибок равен [3]:
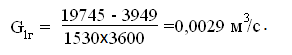
Площадь
сечения центрального канала грибка вычисляем, принимая скорость воздуха в нем
12 м/с [3]:

Диаметр канала равен [3]:
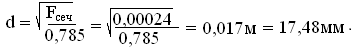
Принимаем
d=18мм.
Под
шляпкой грибка просверливают 4 отверстия,при скорости воздуха в них Wвозд
= 10 м/с. Диаметр одного отверстия
[3]:
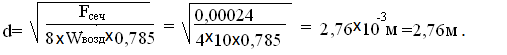
Принимаем
d=3мм.
Провальную часть решетки вынимают из труб. В них просверливают отверстия,
сквозь которые поступает воздух. Общая площадь отверстий должна быть равна [3]:
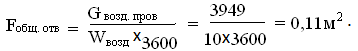
Количество отверстий [3]:
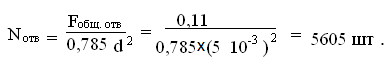
3.2
Технологический расчет котла - утилизатора
.2.1
Исходные данные:
-
температура поступающей газовой смеси Тн, 0С…………… ………820
температура
отходящей газовой смеси Тк, 0С……………… ……….420
хладогент
вода:
начальная
температура tн, 0С…………………………………
………..18
конечная
температура tк, 0С…………………………………
………..290
тепловые
потери % от поступающего тепла,……………… …………..3
теплоемкость
газовой смеси, Сг.с., кДж/(кг·К)………….… …….…0,85
теплоемкость
воды, Своды, кДж/(кг·К)……………………..… …….4,186
теплота
парообразования воды, rводы,
кДж/кг……………………….2258
количество
газа, т/сут………………………………………………….336
3.2.2
Расчет котла - утилизатора
.2.2.1
Тепловой расчет
Рассчитаем
среднюю температуру в котле - утилизаторе [4]:
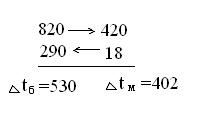
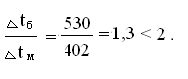
Тогда,
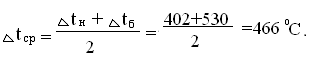
Массовый
расход газа из таблицы 8 составляет:
Gгаз=3,895кг/с.
Количество
передаваемой теплоты с учетом тепловых потерь 31% [3]:
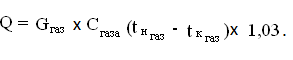
Тогда,
Q = 3,8× 0,85 × 1000×
(820 -
420) ×1,03 = 1330760 Вт
Определим
коэффициент теплопередачи[4]:

где,
αг = 85 -
коэффициент теплоотдачи для горячего теплоносителя, Вт/м2 ·К;
αх = 3500 -
коэффициент теплоотдачи холодного теплоносителя Вт/м2·К;
rст = 2558 - термическое сопротивление стенки м2·К/Вт.
Тогда,
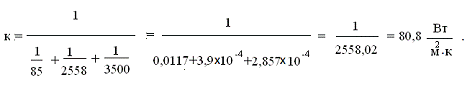
3.2.2.2
Тепловой расчет
Уравнение
теплопередачи [4]:
Q = K·F·∆tср.
Отсюда
площадь поверхности теплопередачи:

Принимаем
F = 35м2
Конструктивно
для площади теплопередачи F = 35м2 принимаем
dтрубок = 57 мм, длина трубчатки Lмр = 4000мм.
Тогда
количество трубок определяем из формулы: F = ·d·e·Z,
где Z - число трубок.
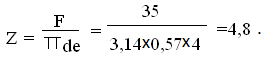
Принимаем
Z = 5 шт. 31
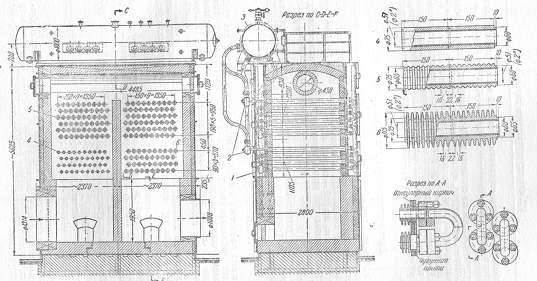
Рисунок
8 - Котел-утилизатор [2]
-коллектор
для подачи воды; 2-коллектор для выхода паро-водяной эмульсии; 3-паросборник;
4-трубы с гладкой облицовкой; 5-трубы с волнистой облицовкой; 6-трубы с
ребристой облицовкой.
3.3
Технологический расчет контактного аппарата
3.3.1 Исходные данные:
- степень окисления SO2, % мас. ……………………………..…….….97,6
избыток окислителя воздуха, % мас. ……………………...………...30
начальная температура газов, 0С…………………………………….430
конечная температура газов, 0С…………………………………...…450
хладоагент воздух:
температура воздуха начальная, tn 0С ………………………………...20
температура воздуха конечная,tк 0С………………………………...430
Состав воздуха, % мас.:
кислород, О2…………………………………………………………..20,5
азот, N2………………………………………………………….……..79,5
теплоемкость газовой смеси, кДж/ (кг·К)………………………….0,85
теплоемкость воды, кДж/ (кг·К)…………………………………...4,186
основная реакция:
3.3.2 Расчет контактного аппарата
Реакция окисления SO2 + 0,5O2 = SO3 + 95кДж/моль идет с уменьшением
реакционной смеси и с выделением теплоты.
Для окисления SO2 в SO3 в промышленных условиях применяют ванадиевые контактные
массы, содержащие V2O5 в качестве активного начала, пиросульфат металла к (Na)S2O7 в качестве активатора и носитель,
состоящий из алюминосиликатов, аморфной кремниевой кислоты и других инертных
примесей.
Мольные массы:
S = 32
SO2 = 32+16*2 = 64
O = 16
0,5O2 = 0,5*16*2 = 16
SO3 = 32+16*3 = 80

Из материального баланса обжига колчедана мы определим количество
двуокиси серы:
SO2 = 3,895 кг/с.
Количество сернистого ангидрида SO3
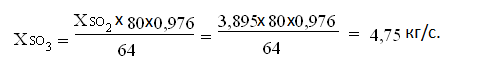
Расход
кислорода на окисление SO2

Останется в
газе
SO2
= 3,895×0,02 = 0,08 кг/с.
Из материального баланса обжига колчедана мы определим оставшиеся
количество кислорода
Mост. = 3,213-2,672 = 0,535кг/с.
Отсюда требуемое количество О2:
mo2
= 1,166-0,535 = 0,631кг/с.
Производительность
контактного аппарата 410т/ч [3]:
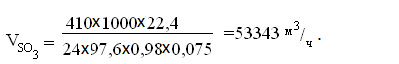
Теплоемкость
Сгаз. смеси = 0,85 кДж/(кг·К) = 4,186 кДж/м2К;
Увеличение
температуры газа - 213 0С.
Тепловая нагрузка теплообменника :
Q = V
× Cгаз. смеси( tк - tн)
= 53343× 4,186(450 - 430) = 4465876 кДж/ч.
Рассчитаем среднюю температуру в контактном аппарате [4]:
tН
газ = 430 ∆ tК газ = 450
tН
вод = 20 ∆ tК вод = 430
∆tб = 410 ∆tм = 20

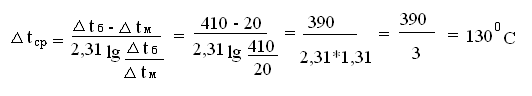
К
= 40 кДж/м2чК- коэффициент теплопередачи для системы газ - газ.
Необходимая
поверхность теплообмена
F=Q/k tcр.,
tcр.,
Тогда
F=4465876/40×130=858м2.
Конструктивно
для площади F=858м2 принимаем диаметр трубы dтр.=57мм, длина трубчатки L=4000мм.
Тогда
количество трубок определим по формуле
F=π·d·l·z,
где
z - число труб.
Тогда,
Z=F/π×d×l=858/3,14×0,57×4=120шт.
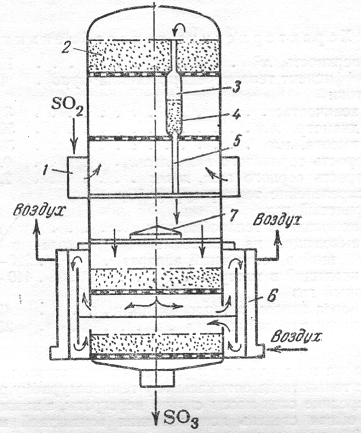
Рисунок
9-Контактный трубчатый аппарат [2]
-кольцевая
камера; 2-верхний слой контактной массы; 3- верхний охладительный пояс труб;
4-второй слой контактной массы; 5-нижний охладительный пояс; 6-рубашка для
воздушного охлаждения; 7-завихритель.
4. Техника
безопасности
Серная кислота пожаро - и взрывоопасна. При соприкосновении с водой
происходит бурная реакция с большим выделением тепла, паров и газов.
Кислота токсична. По степени воздействия на организм человека относится к
веществам второго класса опасности по ГСТ 12.1.007 - 76.
Предельно допустимая концентрация паров в воздухе рабочий зоны
производственных помещений 1мг/м3.
Работающие с кислотой люди должны быть обеспечены специальной одеждой и
обувью, а так же средствами индивидуальной защиты [10].
Заключение
В производстве H2SO4 соблюдены основные направления развития химической
промышленности:
технология малоотходная - переход сырья в целевой продукт достигает
99,9%;
энергосберегающее, так как процесс обеспечивает свое энергосбережение.
Эта химическая технология обладает рядом функций:
рациональное использование сырья и энергии;
масштабность и дешевизна.
Поскольку процесс непрерывен, он обладает рядом достоинств:
большое количество продукта с 1 -го объема аппарата;
высокая интенсивность процесса;
исключение потерь тепла из-за термодинамичности - нагрев-охлаждение;
легкость автоматизации технологического процесса.
Такой процесс учитывает основные принципы химической технологии:
наибольшая интенсивность процесса;
наилучшее использование сырья;
наибольшее использование сырья.
Литература
1.
К.М. Малинин, Н.Л. Аркин, Г.К. Боресков, М.Г. Слинько. Технология серной
кислоты. Государственное научно - техническое издательство химической
литературы. Москва, Ленинград, 1950г., 571 стр.
.
Справочник сернокислотника. Государственное научно - техническое издательство
химической литературы. Москва, Ленинград, 1952г. 570 стр.3
3. Расчеты по технологии неорганических веществ. Учебное
пособие для вузов. Изд. 2- е. перераб. Под редакцией проф. М.Е. Позина. Л.,
«Химия» 1977г. 496 стр., 48рис., 4табл., список литературы 33 ссылки.
. К.Ф.Павлов, П.Г.Романков, А.А.Носков. Примеры и задачи
процессов и аппаратов химической технологии. Ленинград: Химия, 1981г., 560стр.
5. www.vikipedia.ru
<http://www.vikipedia.ru/>
. Химик.ru -
Большая советская энциклопедия.
. www.Market Publishers.com
. www.newchemistry.ru
. Еврозийский химический
рынок. Международный деловой журнал.
. Объединенная химическая
компания "Щекиноазот".