Построение кривой титрования по методам окислительно-восстановительных реакций и нейтрализации
Федеральное Агентство Образования
АСТРАХАНСКИЙ ГОСУДАРСТВЕННЫЙ
УНИВЕРСИТЕТ
Курсовая работа
по аналитической химии на тему:
"Построение кривой титрования по
методам окислительно-восстановительных реакций и нейтрализации
Астрахань-2011 год
Оглавление
1. Введение
2.Сущность и понятия титраметрического анализа
2.1 Окислительно-восстановительное титрование
2.2 Условия проведения реакций окислительно-восстановительного
титрования
2.3 Виды окислительно-восстановительного титрования
2.4 Индикаторы метода
3. Пермангонатометрия
3.1 Сущность метода
3.2 Условия проведения
3.3 Индикаторы
4. Расчет точек кривой титрования, потенциалов, построение кривой
титрования
4.1 Окислительно-восстановительное титрование 0,3 М HBr - 0,1М KMnO4
4.2 Расчет точек кривой титрования, потенциалов
4.3 Построение кривой титрования
4.4 Подборка индикатора. Расчет индикаторных ошибок титрования
4.5 Вывод
5. Кислотно-основное титрование. Основные понятия
5.1 Индикаторы
5.2 Классификация индикаторов
5.3 Окраска индикаторов
5.4 Интервал перехода индикаторов
5.5 Исследование индикаторов
5.6 Выбор индикатора
5.7 Влияние растворителей
5.8 Влияние температуры
5.9 Индикаторная ошибка
5.10 Типы индикаторных ошибок
6. Кислотно-основное титрование 0,1 M KCN - 0,3 M H2SO4
6.1 Расчет точек кривой титрования
6.2 Построение кривой титрования
6.3 Подборка индикатора. Расчет индикаторных ошибок титрования
7. Вывод
8. Список литературы
1. Введение
Одним из самых старых и даже в настоящее время
распространенных методов химического анализа является титраметрический анализ.
Свое применение находят множество видов титраметрического анализа, такие как
кислотно-основное, окислительно-восстановительное, осадительное,
комплексонометрическое, титрование неводных растворов, физико-инструментальные
методы титрования. Используя результаты титрования, можно без труда определить
различные вещества.
Для проведения анализа нужно знать некоторые понятия и
закономерности в том числе и конечную точку титрования. Для ее определения
часто используются индикаторы. Для подбора индикатора необходимо, сделав
теоретические расчеты, построить кривую титрования, определить скачок
титрования и рассчитать индикаторные ошибки титрования.
Поэтому целью данной работы является выбор индикатора и
построение кривой титрования. Задачами работы являются расчет точек титрования,
выявление области скачка титрования, вычисление точки эквивалентности,
вычисление индикаторных ошибок титрования.
титрование окислительный восстановительный реакция
2.Сущность
и понятия титраметрического анализа
) Титраметрический, или объемный метод, анализ - метод
количественного анализа, основанный на измерении объема (или массы) реагента,
затраченного на реакцию с определяемым веществом. Другими словами,
титраметрический анализ - это анализ, основанный на титровании.
Титрование - процесс определение вещества постепенным
прибавлением небольших количеств титранта, при котором каким-либо способом
обеспечивается обнаружение точки, когда определяемое вещество полностью
прореагировало.
Титрант - раствор, содержащий активный реагент Т, с помощью
которого проводят титрование.
Аликвотная доля (аликвота) - это точно известная часть
анализируемого раствора, взятая на анализ.
Точка эквивалентности (Т. Э.) - такая точка титрования, в
котором количество прибавленного титранта Т эквивалентно количеству титруемого
вещества.
Конечная точка титрования (КТТ) - точка титрования, в
которой некоторое свойство раствора оказывает резкое и заметное изменение. КТТ
чаще всего не совпадает с точкой эквивалентности.
Интервал перехода индикатора - область концентрации
ионов H+, Men+, или других ионов, в пределах которых глаз
способен обнаружить изменение в оттенке, интенсивности в окраске, флуоресценции
или другого способа визуального индикатора, вызванного изменением соотношения
двух соответствующих форм индикатора.
Степень оттитрованности (f) - отношение объема V (T) добавленного титранта к
объему V
(TЭ) титранта,
соответствующему точке эквивалентности:
f=V (T) /V (TЭ).
Кривая титрования - графическое
изображение зависимости изменения концентрации С (х) определяемого вещества х
или некоторого связанного с ним свойства системы (раствора) от объема V (T) прибавленного титранта
Т. Величина С (х) в ходе титрования изменяется на несколько порядков, поэтому
кривая титрования часто строится в координатах lgС (х) - V (T).
Различают линейные, логарифмические, дифференциальные,
билогарифмические кривые титрования.
Классификация методов титраметрического анализа.
1. Кислотно - основное титрование - основано на реакции
переноса протонов от одной реагирующей единицы к другой в растворе. Различат
ацидиметрию и алкалиметрию.
. Окислительно-восстановтельное титрование - сопровождается
переходом 1 или большого числа электронов от иона - донора или молекулы
(восстановителя) к акцептору (окислителю).
. Осадительное титрование - титруемое вещество при
взаимодействии с титрантом выделяется из раствора в виде осадка.
. Комплексонометрическое титрование - титрование вещества
раствором такого соединения, которое образует с титруемым веществом слабодиссоциирующий
растворимый комплекс.
2.1
Окислительно-восстановительное титрование
Классификация редокс-методов
Известно несколько десятков различных методов 0В титрования.
Обычно их классифицируют следующим образом.
Классификация по характеру титранта. В этом случае методы ОВ
титрования подразделяют на две группы:
оксидиметрия - методы определения восстановителей с
применением титранта-окислителя;
редууктометрия - методы определения окислителей с применением
титранта-восстановителя.
Классификация по природе реагента, взаимодействующего с
определяемым веществом. Ниже после названия соответствующего метода в скобках
указано основное действующее вещество этого метода: броматометрия (KBrO3), бромометрия (Br2), дихроматометрия (K2Cr2O7), иодатометрия (KIO3), иодометрия (I2), нитритометрия (NaNO2), пермангонатометрия (KMnO4), цериметрия (Ce (SO4) 2)),
титанометрия (Ti3+), ванадатометрия (NH4VO3) и др. Реже применяются некоторые другие методы
0В титрования, такие, аскорбинометрия (аскорбиновая кислота).
2.2
Условия проведения реакций окислительно-восстановительного титрования
Условия, применяемые в методах
окислительно-восстановительного титрования должны отвечать ряду требований,
важнейшими из которых являются следующие:
Реакции должны протекать практически до конца.
Реакция должна протекать стехиометрически, побочные эффекты должны
быть исключены.
Конечная точка титрования должна определятся точно и
однозначно либо с индикатором или нет.
2.3
Виды окислительно-восстановительного титрования
1) Прямое окислительно-восстановительное титрование проводят
тогда, когда окислительно-восстановительная реакция удовлетворяет основным
требованиям к реакциям этого вида титрования. Определяемое вещество
непосредственно взаимодействует с титрантом.
) Обратное окислительно-восстановительное титрование проводят
тогда, когда применение прямого титрования нецелесообразно по тем или иным
причинам. К аликвоте анализируемого раствора, содержащего определяемый
компонент х, прибавляют точно известное избыточное количество вещества А.
Выдерживают раствор некоторое время для обеспечения полноты реакции между х и
А. Непрореагирующий избыток вещества А оттитровывают стандартным раствором
титранта Т.
) Заместительное окислительно-восстановительное титрование
применяют для определения веществ как вступающих, так и не вступающих в
окислительно-восстановительные реакции. К аликвоте анализируемого раствора,
содержащего определяемый компонент, прибавляют избыточное количество реагента.
Выделившееся вещество оттитровывают определенным титрантом.
2.4
Индикаторы метода
В титрометрическом физическом методе определяют КТТ
индикаторным методом. При этом индикатор может играть роль либо реагента,
участвующего в окислительно-восстановительной реакции, либо являться
специальным вводимым индикатором. В соответствии с этим индикаторы в
окислительно-восстановительном титровании можно классифицировать следующим
образом:
). Индикатор - реагент, участвующий в
окислительно-восстановительной реакции (пермангонатометрия)
). Индикатор - вещество, вступающий в непосредственное
взаимодействие с окислителем или восстановителем (участвующими в
окислительно-восстановительной реакции) с образованием различных соединений
(крахмал).
). Индикатор - вещество, которое при определенном потенциале
раствора окисляется или восстанавливается с изменением окраски
(окислительно-восстановительные индикаторы).
Окислительно-восстановительные индикаторы бывают обратимыми и
необратимыми. Обратимые индикаторы меняют окраску обратимо при потенциале
раствора в точке эквивалентности или вблизи ее и при этом не разрушаются.
Необратимые индикаторы изменяют окраску при достижении определенного значения
потенциала в точке эквивалентности или вблизи ее и при этом необратимо
разрушаются. Пример - метиловый оранжевый, метиловый красный, нейтральный
красный.
3.
Пермангонатометрия
3.1
Сущность метода
Пермангонатометрический метод анализа основан на реакции
перманганата калия с восстановителями, преимущественно в кислой среде по схеме:
MnO4 - +8H+ +5e↔Mn2++4H2O,
f=1/2=1/5.
В анализе некоторых органических соединений используется
восстановление в сильно щелочной среде по уравнению:
MnO4 - +e↔ MnO42-, f=1
Стандартный 0В потенциал редокс-пары МnО4/ Мn2+ имеет довольно высокое
значение и при комнатной температуре равен 1,51 В. Поэтому кислым раствором
перманганата калия можно оттитровать целый ряд восстановителей, причем
большинство таких 0В реакций протекает с высокой скоростью. С ростом
концентрации ионов водорода в растворе реальный потенциал рассматриваемой
редокс-пары возрастает и эффективность перманганат-иона как окислителя
повышается.
Е = Е° + (0,059/5) 1g ([МnО4-,] [}H+] 5/[Мn2+])
Поскольку в 0В полуреакции участвуют 5 электронов, то
молярная масса эквивалента перманганата калия как окислителя в кислой среде
равна
М (1/5КМnО4) = М (КМ04) /5 = 31,608 г/моль,
В нейтральной среде перманганат-ион восстанавливается до
диоксида марганца МnО2:
МnО4-, + Зе + 2Н20 = МnО2 + 40Н-
Стандартный 0В потенциал редокс-пары МnО4-|
МnО2,
сравнительно невелик и при комнатной температуре равен Д° = 0,60 В, поэтому
нейтральной среде эффективность перманганата калия как окислителя значительно
ниже, чем в сильнокислых растворах. Кроме того, образующийся в результате 0В
реакции бурый осадок диоксида марганца затрудняет фиксацию КТТ, обладает
развитой поверхностью и может адсорбировать определяемое вещество, что
увеличивает ошибку анализа. Поэтому как титрант-окислитель перманганат калия в
нейтральной среде практически не применяется.
В сильнощелочных средах перманганат-ион восстанавливается до
манганат-иона МпО42-:
МnО4-+е=МnО42-
Образующийся манганат-ион обладает зеленой окраской умеренной
интенсивности, окрашивает раствор в зеленый цвет, что затрудняет обнаружение
изменения окраски раствора и фиксацию КТТ.
Манганат-ион вступает в реакцию с водой:
МnО42 - + 2Н20 = 2Мn04 + МnО2 ↓
+40Н-
с образованием бурого осадка диоксида марганца и
перманганат-ион что искажает результаты анализа.
Стандартный 0В потенциал редокс-пары МnО4-|
МnО42 - невелик
при комнатной температуре равен Е° = 0,56 В, т.е. в щелочных средах перманганат
калия как окислитель менее эффективен, чем в кислых растворах. Кроме того,
щелочные растворы способны поглощать диоксид углерода из воздуха с образованием
гидроксокарбонатных соединений, что также затрудняет проведение количественного
анализа.
С учетом всех этих обстоятельств перманганат калия как
титрант-окислитель в щелочных средах практически не применяется.
Таким образом, на основе вышеизложенного можно сделать вывод
о том, что перманганатометрическое титрование целесообразно проводить в
сильнокислых средах.
3.2
Условия проведения
При проведении перманганатометрического титрования необходимо
соблюдать, по крайней мере, следующие основные условия.
) Влияние рН среды. Перманганатометрическое титрование
проводят в сильно кислой среде при концентрации ионов водорода [НзО+]
=1-2 моль/л. Кислая среда создается введением серной кислоты. Азотную кислоту
применять нельзя, так как она сама является сильным окислителем и может
окислять определяемое вещество. Хлороводородную кислоту в перманганатометрии
также не используют, так как хлорид-ионы окисляются перманганат-ионами до хлора
по схеме:
Cl - +2МnО4 - +16Н+ =5С12
+2Мn2+ +8Н20
При этом часть титранта расходуется на окисление
хлорид-ионов, что вызывает перерасход титранта и увеличивает ошибку анализа. В
обычных условиях эта реакция идет медленно, однако ускоряется в присутствии
соединений железа.
В сернокислой среде указанные побочные процессы отсутствуют,
поэтому перманганатометрическое титрование ведут в сернокислой среде.
) Влияние температуры. Чаще всего перманганатометрическое
определение проводят при комнатной температуре. Исключением является реакция
перманганат-иона с щавелевой кислотой и оксалатами, которую проводят при
нагревании титруемого раствора.
) Фиксация конечной точки титрования. При
перманганатометрическом титровании обычно не применяют посторонний индикатор,
так как сам титрант - раствор перманганата калия - обладает интенсивной
малиново-фиолетовой окраской. Прибавление одной избыточной капли титранта в ТЭ
приводит к окрашиванию титруемого раствора в розовый цвет. Так, чтобы придать
отчетливую окраску 100 мл воды достаточно прибавить всего 0,2 мл раствора
перманганата калия с молярной концентрацией эквивалента 0,1 моль/л. Окраска
раствора в КТТ неустойчива, раствор постепенно обесцвечивается. Это происходит
вследствие того, что избыточные перманганат-ионы, придающие раствору розовую
окраску, взаимодействуют с образовавшимися катионами марганца (2) Мn2+:
МnО4-+ЗМn2++Н20=5МnО2↓+4Н+
Хотя повышенная кислотность раствора способствует смещению
равновесия влево, однако константа равновесия этой реакции велика и составляет
~1047. Поэтому реакция протекает даже в кислой среде. Правда,
скорость данной реакции в обычных условиях мала, поэтому окраска раствора в КТТ
ослабляется медленно, в течение одной-двух минут. Тем не менее, указанное
обстоятельство необходимо иметь в виду во избежание перетитровывания раствора.
В некоторых (редких) случаях перманганатометрическое
титрование ведут очень разбавленным раствором титранта. В такой ситуации для
более четкого фиксирования КТТ в титруемый раствор вводят редокс-индикатор, например
ферроин или N-фенилантраниловую
кислоту.
) Ход титрования. Обычно в перманганатометрии к раствору
определяемого вещества медленно, по каплям прибавляют раствор титранта, для
того чтобы в растворе не было локального избытка окислителя - перманганат-иона
и не протекали бы побочные процессы.
Для титрования применяют бюретки со стеклянными кранами;
использование резиновых трубок исключается, так как резина взаимодействует с
перманганатом калия.
3.3
Индикаторы
В пермангонатометрии часто обходятся без применения
специального индикатора, так как перманганат имеет интенсивную окраску, и
избыточная капля реагента легко обнаруживается по собственной окраске.
Титрование раствора до бледно-розового окрашивания, не исчезающего в течение 30
секунд, - обычный способ фиксирования точки эквивалентности в методе. При
титровании с разбавленными растворами применяют резонс-индикаторы, такие как
дифениламинсульфокислота или ферроин.
4.
Расчет точек кривой титрования, потенциалов, построение кривой титрования
4.1
Окислительно-восстановительное титрование 0,3 М HBr - 0,1М KMnO4
16HBr + 2KMnO4=2KBr+2MnBr2+5Br2+8H2O+7+5ё→Mn2+ окислитель
Br--2ё→Br20 восстановитель
Концентрация HBr =0.3 M, концентрация KMnO4=0.1 M.
Сн (HBr) = См/ fэкв-ти = 0.3/1 = 0.3
Сн (KMnO4) = См/ fэкв-ти = 0.1*5 = 0.5
φ0 (MnO4-/ Mn2+) =1.51 В, φ0 (Br-/ Br20) =1.09 В
Пусть объем раствора KMnO4 будет равен 10мл.
С (HBr) *V (HBr) = С (KMnO4) *V (KMnO4)
V (KMnO4) = С (HBr) *V (HBr) / С (KMnO4) = 0.3*10/0,5 = 6 мл.
4.2
Расчет точек кривой титрования, потенциалов
До точки эквивалентности считаем по титруемому веществу:
φ= φ0+0.059/n*lg ([HBr-] 2/
([Br2-])
1.1% добавили от необходимого объема
6 мл - 100%, Х мл - 1%
Х=0,06 (мл) - добавленный объем KMnO4
Найдем Сн (KMnO4) прореагировавшего с
учетом разбавления:
Сн (KMnO4) = Сн (KMnO4) нач. *Vдоб/Vобщ. = 0.06*0.5/ (10+0.06)
=0.002982
По закону эквивалентов:
Сн (Br-) прореаг. = Сн (MnO4-) прореаг=0.002982
Найдем Сисх. (Br-) с учетом разбавления:
Сисх. (Br-) = Сн (Br-) *Vнач. (Br-) /Vобщ. = 0.3*10/ (10+0.06)
=0.2982
Найдем оставшуюся
С (Br-): Соств. =Снач. - Спрореаг.
= 0.2982 - 0.002982= 0.2952
φ= 1.09 + 0.059/1*lg (0.0029822/
0.2982) = 0.8900 B
.25% добавили от необходимого объема
мл - 100%, Х мл - 25%
Х=1.5 (мл) - добавленный объем KMnO4
Найдем Сн (KMnO4) прореагировавшего с
учетом разбавления:
По закону эквивалентов:
Сн (Br-) прореаг. = Сн (KMnO4) прореаг =
0.06521
Найдем Сисх (Br-) с учетом разбавления:
Сисх. (Br-) = Сн (Br-) *Vнач. (Br-) /Vобщ. = 0.02*10/ (10+1.5) =
0.26083
Найдем оставшуюся С (Br-):
Соств. = Снач. - Спрореаг. =
0.26083 - 0.06521= 0.19559
φ= 1.09 + 0.059/1*lg (0.065212/0.26083)
= 0.8911 B
.50% добавили от необходимого объема
6 мл - 100%
Х мл - 50%
Х=3 (мл) - добавленный объем KMnO4
Найдем Сн (KMnO4) прореагировавшего с
учетом разбавления:
Сн (KMnO4) = Сн (KMnO4) нач. *Vдоб/Vобщ. = 3*0.5/ (10+3) = 0.1153
По закону эквивалентов:
Сн (Br-) прореаг. = Сн (KMnO4) прореаг=0.1153
Найдем Сисх. (Br-) с учетом разбавления:
Сисх. (Br-) = Сн (Br-) *Vнач. (Br-) /Vобщ. = 0.3*10/ (10+3) = 0.2307
Найдем оставшуюся
С (Br-): Соств. = Снач. - Спрореаг
= 0.2307
.1153= 0.1154
φ= 1.09 +0.059/1*lg (0.11532/0.2307)
= 9788 B
.99.9% добавили от необходимого объема
6 мл - 100%
Х мл - 99.9%
Х = 5.994 (мл) - добавленный объем KMnO4
Найдем Сн (KMnO4) прореагировавшего с
учетом разбавления:
Сн (KMnO4) = Сн (KMnO4) нач. *Vдоб/Vобщ. = 5.994 *0.15/ (10+5.994)
= 0.1873
По закону эквивалентов:
Сн (Br-) прореаг. = Сн (KMnO4) прореаг=
0.1873
Найдем Сисх. (Br-) с учетом разбавления:
Сисх. (Br-) = Сн (Br-) *Vнач. (Br-) /Vобщ. = 0.3*10/ (10+5.994)
=0.1875
Найдем оставшуюся
С (Br-): Соств. =Снач. - Спрореаг.
= 0.1875-0.1873= 0.0002
φ= 1.09+0.059/*lg (0.18732/0.1875)
= 1.00416 B
.100% добавили от необходимого объема. Точка
эквивалентности
. φ= (φок*nок+ φвос*nвос) / (nок+ nвос) = (1.51*5+1.09*1) /
(1+5) = 1,44
. lgKp= (φок - φвос) *n/0.059= (1.51-1,09) *6/0.059 = 2.7966
Kp=102.7966, Kp=1/ [HBr-] 2* [MnO4-] 6
Пусть [MnO4] = х моль/литр, тогда [HBr-] =х. [HBr-] с учетом разбавления
равна:
[HBr--] = Снач. *Vнач. /Vобщ. =0.06*10/14 = 0.042857
(общая концентрация.)
Тогда [HBr-], оставшегося в растворе равна (0.007-х).
С (KMnO4) = Сн (KMnO4) нач. *Vдоб/Vобщ. = 0.15*4/14 = 0.007
Уточним концентрацию [Mn2+] в точке эквивалентности
с учетом разбавления:
[Mn2+] = 0.007-х
Константа равновесия с учетом следующих соотношений принимает
вид:
101.72=1/x8
10101.72= x-8
√10101.72=х-8
х=7*10-16.53 - равновесная концентрация [MnO4-]
φ=
1.53+0.058/5*lg ([MnO4-] 2/ ([Mn2+])
= 1.53+0.059/5*lg ([7*10-16.53] / ([0.007]) =1.36
6.110% добавили от необходимого объема, раствор
перетитрован
6 мл - 100%
Х мл - 10%
Х=0.6 (мл) - избыточный объем KMnO4
φ= φ 0+0.059/1*lg ([MnO4-] 2/ ([Mn2+])
Найдем избыточную См (KMnO4) с учетом разбавления:
См. (KMnO4) изб. = См (KMnO4) нач. *Vдоб/Vобщ. =0.6*0.5/ (10.06) =0.0036
Сколько молей Mn2+ получили, столько в растворе и осталось:
[Mn2+] оств. = Снач. *Vдоб/Vобщ. = 0.15*3.3/ (10.06)
=0.0363
φ= 1.53+0.059/5*lg ([0.0036] / ([0.0363])
=1.51
4.3
Построение кривой титрования
Таблица1. Точки для построения кривой титрования по методу
ОВР
|
Процент
титрования
|
Потенциал, В
|
|
1% добавили от
необходимого объема
|
0.8900
|
|
25% добавили от
необходимого объема
|
0.8911
|
|
50% добавили от
необходимого объема
|
0.9788
|
|
99.9% добавили
от необходимого объема
|
|
100% добавили
от необходимого объема
|
1.36
|
|
110% добавили
от необходимого объема
|
1.51
|
График
1. Кривая титрования 0,3 М HBr - 0,1М KMnO4
4.4 Подборка индикатора. Расчет индикаторных ошибок титрования
1. Пусть φ (2,2-дипиридин) =1.33<φ в точке эквивалентности, равного 1.36. Следовательно раствор HBr недотитрован.
φ= φ 0+0.059/2*lg ([HBr] 2/ ([Br-])
Пусть [HBr)] = (100-х) 2, а [Br-)] =х.
.33=0.94+0.058/2*lg ( (100-х) 2/х)
.058/2*lg ( (100-х) 2/х) =0.39
lg ( (100-х) 2/х) =13.44
(100-х) 2/х=1013,448
(100-х) 2=1013.44**х
-200х=1013.44**х2
х=3.56*10-12%
. Пусть φind=1.4<φ в точке эквивалентности, равного1.36. Следовательно раствор HBr перетитрован раствором KMnO4.
.4= 1.53+0.058/5*lg ([MnO4-] / ([Mn2+])
Пусть [MnO4-] =х, тогда [Mn2+] =100
.4= 1.53+0.058/5*lg ([х] / ([100])
.66= 0.0116*lg ([х] / [100])
х/100=3.16*10-13
х=3.16*10-15%
4.5
Вывод
С помощью расчетов точек кривой титрования по методу ОВР
кривой 0,3 М HBr - 0,1М KMnO4, вычислили скачок титрования, равный от 0.99
(99.9%) до 1.51 (110%). Так как скачок небольшой, построили кривую титрования.
С помощью расчета индикаторных ошибок, подобрали оптимальные индикаторы. С
индикатором 2,2-дипиридином индикаторная ошибка составила большая индикаторная
ошибка. Со вторым индикатором ошибка составила 3.16*10-15%.
Следовательно, титровать раствор HBr раствором KMnO4 можно со вторым
индикатором.
5.
Кислотно-основное титрование. Основные понятия
Кислотно-основное титрование - это метод определения
кислот, оснований, солей, основанный без реакции взаимодействия между кислотой
и основанием.
В общем виде можно записать:
НА + В = А - + НВ+
В водных растворах - это реакция нейтрализации:
Н30+ + ОН =2Н2О
Поэтому метод кислотно-основного титрования также называют
методом нейтрализации
Реагент обычно применяют в виде раствора точно известной
концентрации. Такой раствор называют типрованным, титрантом или
рабочим раствором. Рабочий раствор постепенно прибавляют к раствору
определяемого вещества до тех пор, пока не будет достигнуто эквивалентное
отношение реагирующих вещества. Измеряют объём рабочего раствора,
израсходованного на титрование, и вычисляют количество определяемого вещества.
При титровании весьма важно определить точку эквивалентности, т е момент
титрования, когда достигнуто эквивалентное отношение реагирующих компонентов -
определяемого вещества и реагента.
Рассмотрим случай, когда b молей вещества X реагирует
с а молями реагента R, т.е. реакция протекает в соответствии с уравнением:
bX+aR↔XbRa
В любой момент титрования концентрация X представляет собой
некоторую конечную величину, отличную от нуля, т.к. продукт реакции XR способен в той или иной
степени, в результате протекания обратной реакции, давать снова исходный
вещества X и R
в точке эквивалентности концентрации реагирующих веществ становятся
эквивалентными. Для записанной выше реакции это означает, что
a [X] =B [P].
Точку эквивалентности определяют экспериментально посредством
индикаторов.
При использовании любого способа определения точки
эквивалентности необходимо иметь чёткое представление об изменении концентрации
реагирующих веществ в процессе титрования. Это изменение обычно выражают кривой
титрования. Кривая титрования - графическое отражение зависимости концентрации
определяемого вещества от количества прибавленного реагента. Обычно, кривая
титрования передаёт зависимость логарифма концентрации определяемого вещества.
взятого с обратным знаком (-lgX), от объёма прибавленного рабочего раствора
известной концентрации.
5.1
Индикаторы
Существую различные методы установления точки
эквивалентности. Их можно разделить на 2 группы:
первая группа - индикаторные методы вторая группа -
физико-химические методы. Ко второй группе относятся потенциометрический метод,
амперометрический метод, метод радиоактивных индикаторов и др.
Индикатор - это вещество, которое претерпевает химическое
превращение, сопровождающееся внешним эффектом, при концентрациях реагента или
определяемого вещества. характерных для точки эквивалентности.
Индикатор - это вещество, которое проявляет видимое
изменение в точке эквивалентности или вблизи неё.
Индикатор - вещество в присутствии, которого в растворе
становятся видимым конец титрования. Как видно, можно давать различные
определения понятию индикатор. Из приведенных выше наиболее подходящим является
определение 2, которое отражает факт изменения индикатора не только в точке
эквивалентности, но и вблизи нее, а также является наиболее кратким.
Видимый эффект может состоять в изменении, возникновении или
исчезновении окраски, образовании или растворении малорастворимого соединения и
лр Существенно при этом, чтобы внесший эффект проявлялся только при такой
концентрации определяемого вещества X или реагента R, которая соответствует
точке эквивалентности т.е. индикатор должен реагировать с реагентом или с
определяемым веществом только при такой концентрации одного из них, какая
создаётся в точке эквивалентности.
Момент титрования, когда наблюдается внешний эффект реакции
между индикатором и рабочим раствором реагента R (или определяемым
веществом X) называют конечной точкой титрования. Расхождение между
конечной точкой титрования и точкой эквивалентности, т е неравенство рRэкв и рТ (или рХэкв и рТ)
является одной из причин возникновения погрешности титрования.
5.2
Классификация индикаторов
В основе классификации индикаторов могут быть различные
признаки. По технике применения различают внутренние и внешние
индикаторы.
Внутренние индикаторы - вещества, которые
вводят непосредственно в титруемый раствор. Конечную точку титрования
устанавливают по изменению цвета индикатора, по появлению или исчезновению
осадка или по какому-либо другому внешнему эффекту реакции. Внутренние
индикаторы широко распространены. Внешние индикаторы применяют в случаях, когда
использование внутренних индикаторов невозможно. Например, ионы никеля можно
титровать раствором диметилглиоксима Однако красный цвет осадка
диметилглиоксимата никеля мешает наблюдению эффекта реакции, вызванного
прибавлением индикатора. Поэтому в процессе титрования время от времени
отбирают каплю раствора, переносят её на часовое стекло и прибавляют реагент
(тот же диметилглиоксим) на ионы никеля. Титрование ведут до отрицательной
реакции на определяемый ион. Применение внешних индикаторов требует затраты
дополнительного времени и высокой квалификации аналитика.
По обратимости внешнего эффекта реакции различают
обратимые и необратимы индикаторы. Обратимые индикаторы - это
соединения, способные существовать в двух (или более) формах, причём переход
одной формы в другую обратим. К этому типу принадлежит большинство известных
индикаторов. Так, обратимые окрашенные индикаторы легко изменяют окраску в
зависимости от избытка или недостатка введённого реагента или определяемого
вещества. Примером может служить метиловый оранжевый для которого переход
красной формы индикатора в жёлтую и наоборот может происходить много раз в
зависимости от изменения концентрации ионов водорода. Обратимые индикаторы удобны
тем, что при случайном введении слишком большого количества рабочего раствора
определение всё же можно провести правильно. Для этого к перетитрованному
раствору следует добавить ещё некоторое количество определяемого вещества (при
этом восстанавливается первоначальная окраска индикатора) и осторожно
дотировать раствор.
Необратимые индикаторы - это соединения,
которые разрушаются при введении избытка реагента и цвет которых не
восстанавливается от дополнительного прибавления анализируемого раствора. Тот
же метиловый оранжевый может быть примером необратимого индикатора в реакциях
окисления-восстановления. Трёхвалентную сурьму титруют раствором бромата калия
с метиловым оранжевым. До тех пор, пока в растворе нет избытка окислителя,
индикатор окрашен в красный цвет. После точки эквивалентности некоторое
количество раствора бромата калия приводят к окислению индикатора, вследствие
чего раствор обесцвечивается. Естественно, что после прибавления раствора
трёхвалентной сурьмы окраска не восстановится, так как весь индикатор разрушен.
Необратимые индикаторы менее удобны и применяются редко.
Индикаторы различают по типу химической реакции, в которой их
применяют. Например, кислотно-основные индикаторы, индикаторы осадительного
титрования и т.д. для титрования мутных и окрашенных растворов применяют
люминесцентные и хемолюминесцентные индикаторы. Использование люминесцентных
индикаторов основано на применении веществ, которые при освещении у. ф. лучами
изменяют характер свечения в зависимости от изменения свойств среды (рН среды,
окислительно-восстановительного потенциала и т. д). Поэтому люминесцентные
индикаторы применяют в методах кислотно-основного титрования,
комплексообразования и окисления-восстановления.
В зависимости от химического строения индикатора, можно выделить
следующие группы
. Азоиндикаторы.
. Нитроиндикаторы.
. Фталеины.
. Сульфофталенны и др.
Существует несколько теорий строения кислотно-основных
индикаторов. Наиболее известными являются:
ионная теория (теория Оствальда)
хромофорная теория
ионно-хромофорная
теория резонанса
5.3
Окраска индикаторов
Все цветные индикаторы, имеющие практическое значение,
являются слабыми органическими соединениями. Они ведут себя как слабые кислоты
или как слабые основания (индикаторы-основания способны присоединять протон, а
индикаторы-кислоты способны отщеплять протон), цвет которых в
недиссоциированном состоянии отличается от цвета их ионов. Индикатор,
рассматриваемый как кислота, будет в водном растворе находиться в равновесии со
своими ионами по уравнению:
HInd ↔Н++Ind - (1)
Здесь HInd представляет собой кислотную форму, которая
имеет "кислотную окраску", a Ind - щелочную форму, обладающую "щелочной
окраской". Применяя закон действующих масс, имеем
[H+] [Ind-] / [HInd] =KHind (2)
или
[Ind-] / [HInd] = KHind/ [H+] (3)
цвет индикатора в растворе зависит от соотyощення [Ind-] / [HInd]. Если концентрация
ионов водорода будет равна KHind, то величина [Ind-] будет равна [HInd], т. е концентрации
кислой и основной форм индикатора будут равны. В этом случае говорят, что
превращение индикатора произошло наполовину. Из этого уравнения также следует,
что наблюдаемая при изменении [Н+] перемена света индикатора
происходит не резко, а постепенно. Для каждого значения [Н+] имеется
определённое отношение концентраций обеих форм индикатора в растворе. Поскольку
имеется определённое минимальное количество каждой из форм, которое глаз может
уловить в присутствии большого количества другой формы, мы наблюдаем изменение
цвета индикатора лишь в определённых границах концентраций ионов водорода Эти
границы не имеют теоретического значения: они лишь указывают, между какими
значениями [Н+] или рН на практике наблюдается изменение цвета
индикатора. Область между двумя крайними значениями рН, определяющими эти
границы называется интервалам превращения, областью перемены окраски
индикатора, интервалом перехода, интересном изменения окраски индикаторов.
5.4
Интервал перехода индикаторов
В точке перехода можно наблюдать изменение окраски
индикатора. Но в ней не происходит резкого изменения окраски индикатора, а
изменение идёт постепенно в некоторой области значений рН. Окраска зависит от
соотношения концентраций кислотной и основной форм, что определяется
концентрацией ионов водорода в растворе. При любой концентрации ионов
водорода присутствует все формы индикатора. От ряда условий зависит
минимальная концентрация каждой из двух форм, при которой можно наблюдать одну
окраску в присутствии другой. Здесь имеет значение интенсивность обеих окрасок,
освещение, зрительная способность аналитика и т.д. Вообще говоря, два цвета
можно различить при их совместном присутствии, если концентрация одной формы
индикатора составляет 10% концентрации другой формы. Следовательно, как видно
из уравнения (1,) в случае индикаторов-кислот можно обнаружить кислотную форму
в смеси с основной, если
[H+] =Ka [HInd] / [Ind-]
= Ka1/10 (4)
и наоборот, основную форму можно наблюдать в присутствии
кислотной формы, когда [H+] =Ka10
таким образом, интервал перехода индикаторов-кислот будет при
pH=pKInd±1 (5)
Естественно, что то же выражение относится к
индикатором-основаниям IndOH - ↔ОН - Ind+
[Ind+] / [IndOH] = KIndOH/Kw
[H+] =K’ [H+] (6)
Как можно заметить из выражения (5) интервал перехода
индикаторов составляет фактически две единицы рН. В этом интервале индикатор
имеет смешанную окраску кислотной и основной форм индикатора, которая
постепенно изменяется. Для индикаторов с контрастными окрасками интервал
перехода может быть даже меньше двух единиц рН. Интервал перехода не будет
симметричных относительно значений рН если одна из форм индикатора
воспринимается легче другой. Это очень часто наблюдается в случае двухцветных
индикаторов. В действительности на интервал перехода индикатора оказывают
влияния различные факторы, поэтому в таблицах принято давать не значения показателя
степени индикатора, а практически установленные и более характерные значения
интервалов перехода.
Таблица 2. Значенне рКInd некоторых
кислотно-основных индикаторов при µ=0
|
Индикатор
|
рКInd
|
|
Метиловый
оранжевый
|
3.46-0.014
|
|
Тимоловы синий
|
1.65
|
|
Метиловый
красный
|
5.00-0.006
|
|
n-Нитрофенол
|
7.15-0.011
|
|
Бромтиловый
синий
|
7.30
|
|
Крезоловый
красный
|
8.46
|
|
Тимоловый синий
|
9.20
|
5.5 Исследование индикаторов
Пригодность индикаторов можно оценить путём установления
интервала перехода и интенсивности окраски. Для этой цели получают 0.1% или
0,01% -ный раствор индикатора в соответствующем растворителе или, если надо
получить натриевую соль в растворе гидроксида натрия. Раствор индикатора должен
быть прозрачным и содержать минимум нерастворимых примесей.
а) определение интервала перехода проводят по
следующему способу [индикаторы.] Готовят серию буферных растворов
соответственно ожидаемому интервалу перехода в десяти пробирках одинакового
цвета и диаметра, при этом значение рН в первой пробирке должно быть на 0.4 ед.
рН ниже нижнего предела, а в последней - на 0.4 единицы рН выше верхнего
предела ожидаемого интервала перехода.
б) окраски индикатора измеряют спектрофотометрическим
путём определения удельной экстинкции в максимуме кривой поглощения. Кривые
поглощения снимают при нижнем и верхнем пределах значений рН, чтобы избежать
измерения смешанных цветов:
Elcm1%=A/cd,
где А - наблюдаемая экстинкция, с - концентрация (г/100 мл), d - толщина стоя кюветы.
Результаты, полученные для новых индикаторов, следует сопоставить с данными для
чистых препаратов.
Требования, предъявляемые к кислотно-основным индикаторам:
1.
Окраска
индикатора должна быть интенсивной и различаться в кислой и щелочной среде.
2.
Изменение
окраски индикатора должно быть быстрым, чётким и обратимым.
3.
Окраска
индикатора должна изменяться в узком интервале изменения рН раствора.
4.
Индикатор
должен быть чувствительным и менять свою окраску в присутствии минимального
избытка кислоты или щелочи
5.
Индикатор
должен быть стабильным, не разлагаться з водном растворе и на воздухе.
5.6
Выбор индикатора
Выбор того или иного индикатора для титрования следует
производить на основе кривой титрования определяемого вещества. В принципе,
следует брать такой индикатор, у которого интервал превращения включает то
значение рН, которое должен иметь титруемый раствор в точке эквивалентности.
Если скачок титрования очень большой, то можно воспользоваться многими
индикаторами. Возьмем, например титрование сильной кислоты сильным основанием:
рН в точке эквивалентности равен 7, следовательно, прежде всего мы можем взять
любой индикатор, изменяющий свой цвет вблизи этого значения рН. Но если мы
рассмотрим кривую титрования 0.01н. раствор сильной кислоты, то увидим, сто рН
меняется от 5 на расстоянии 0.1% от точки эквивалентности до 9 на расстоянии
0.1% за этой точкой. Следовательно, любой индикатор, имеющий интервал перехода
в пределах рН от 5 до 9 даст результат с ошибкой 0.1%. если титруется 0.1 н
раствор кислоты, то соответствующие границы рН расширяются от 4 до 10.
Однако совсем другая ситуация складывается при титровании
слабых кислот и оснований. В этом случае в точке эквивалентности рН не равен 7
а следовательно, кривые титрования не будут симметричны относительно линии
нейтральности в общем случае можно сказать, что слабые кислоты следует
титровать в присутствии индикаторов изменяющих свой цвет в слабощелочных
растворах, а слабые основании в присутствии индикаторов, изменяющих свой цвет в
слабокислых растворах.
Для получения точных и воспроизводимых результатов анализа
необходимо соблюдать определенные условия при титровании.
. Следует устанавливать титр стандартного раствора и
применять установленный для титрования раствор в присутствии одного и того же
индикатора
. Для титрования следует брать всегда одно и то же количество
индикатора и повторять титрование определяемого вещества несколько раз до тех
пор, пока не будут подучены три близко сходящиеся результата
. Как правило, берут 1-2 капли индикатора, не забывая о том,
что индикаторы, применяемые в методе нейтрализации, сами являются кислотами и
основаниями. На нейтрализацию их также расходуется некоторое количество
раствора. Кривая титрования в присутствии очень большого количества индикатора
может иметь следующий вид. (см рис 1)

Рис 1. Кривые титрования при добавлении
а) аномально большого количества индикатора
б) необходимого количества индикатора
. Всегда следует титровать до появления одного и того же оттенка
окраски раствора, используя для титрования по возможности одинаковые объёмы
титруемого раствора.
. Необходимо выбирать такой индикатор, который изменяет свой цвет
вблизи точки эквивалентности.
. Влияние экспериментальных условий на изменение окраски
индикаторов.
. На изменение окраски органических красителей, используемых в
качестве индикаторов, оказывают влияние следующие экспериментальные условия
концентрация раствора, растворённый диоксид углерода, присутствие посторонних
солей и растворителей, белковые вещества и другие коллоиды и температура.
5.7
Влияние растворителей
Различные растворители по-разному влияют на красители,
применяемые в качестве индикаторов: в зависимости от растворителя меняется
окраска и показатель степени индикатора. В водно-этанольных растворах изменения
не так значительны, в безводных спиртовых растворах они гораздо больше. Другие
растворители могут вызывать иные явления.
В аналитической практике часто водные растворы содержат
спирт. Спирт нарушает равновесие индикаторной системы, наблюдаемый эффект
зависит не только от индикатора, но и от кислотно-основной системы раствора.
Диссоциация слабых кислот и оснований изменяется в присутствии спирта из-за
уменьшения диэлектрической константы раствора. При добавлении спирта к
сильнокислым растворам окраска индикатора-кислоты смешается в сторону кислой
окраски. Это означает, что с увеличением концентрации спирта в растворе
константа ионизации индикатора понижается: следовательно индикаторы-кислоты
становятся более чувствительными к ионом водорода (согласно формуле 4)
[H+] =Ka [HInd] / [Ind-]
Это влияние значительно меньше в растворах слабых кислот, а в
буферных растворах вообще отсутствует.
Поведение индикаторов-оснований прямо противоположное: под
влиянием добавленного спирта к сильнокислым растворам окраска
индикатора-основания смешается в сторону окраски в щелочной среде. Это
изменение ещё существеннее в слабокислых растворах и наибольшее в буферных
растворах. Например, метиловый оранжевый приобретает переходную окраску 0.01 М
водного раствора уксусной кислоты, тогда как в присутствии 40% -ного спирта
окраска ярко-жёлтая
В присутствии спирта интенсивность окраски и оттенок
индикатора также различны. Например, фенолфталеин в водных растворах гидроксида
натрия имеет зеленый цвет, а по мере прибавления спирта бледнее и приобретает
фиолетовый оттенок. Понижается и интенсивность окраски. Кроме того, в спиртовой
среде изменяется чувствительность индикаторов. Индикаторы-кислоты становятся
более чувствительными к нонам водорода, чем индикаторы-основания, независимо от
их первоначальной чувствительности
5.8
Влияние температуры
Цвет многих индикаторов зависит от температуры. Шурль нашёл,
что нагретый до кипения раствор индикатора, чувствительного к основаниям,
изменяет свою окраску в более щелочной среде, а раствор чувствительного к
кислотам индикатора - в более кислой среде. Это указывает на смещение
интервалов перевода. Так, метиловый оранжевый, который чувствителен к
основаниям, меняет свою окраску в пределах рН 3.1-4.4 при комнатной
температуре, а при 100°С интервал рН становится 2.5-3.7 это связано с тем, что
как указывалось ранее, индикаторы-основания подчиняются следующему уравнению
[Ind+] / [IndOH] = KIndOH/Kw
[H+]
Так как Кw быстрее возрастает с повышением температуры, чем
КIndOH, то для одного и того же значения [Н+] уменьшается
отношение [Ind+] / [IndOH]. Другими словами, при повышении температуры индикатор
становится более чувствительным к ионам водорода.
Следует, однако, понимать, что если индикатор сохраняет при
высокой температуре свою чувствительность к нонам водорода, то по отношению к
гидроксид ионам он будет значительно менее чувствительным, а именно в 100 раз,
т.к. Кw, при 100о в 100 раз больше Кw, при 18о, и
следовательно при 100о той же концентрации [Н+]
соответствует в 100 раз большая концентрация [OН-]. При
рассуждениях этого рода также не следует забывать, что при 100о рН
нейтрального раствора (как в рОН) равен 6.1 при высоких температурах константы
ионизации слабых кислот и основании также повышаются.
5.9
Индикаторная ошибка
Изменение цвета индикатора происходит не абсолютно в точке
эквивалентности, а раньше или позже, поэтому аналитик допускает некоторую
ошибку, прекращая титрование раньше или позже требуемого момента. Такую ошибку
называют индикаторной ошибкой, значение ее может колебаться в самых широких
пределах в зависимости от того, насколько удачно выбрал индикатор.
Если индикатор выбран правильно, то индикаторную ошибку не
принимают во внимание, если же индикатор выбран не правильно, то индикаторная
ошибка превышает допустимые погрешности и может достигать очень большой
величины.
5.10
Типы индикаторных ошибок
К индикаторным ошибкам относят такие, которые вызываются
недотитрованием или перетитрованием исследуемого раствора. В методе
нейтрализации различают несколько типов индикаторных ошибок
а) Водородная ошибка титрования, вызываемая наличием в
титруемом растворе по окончании титрования избытка ионов водорода, остающихся в
результате недотитрования сильной кислоты сильной щелочью (обозначается Н+нед
- ошибка) или перетитрования сильного основания сильной кислотой (обозначается
Н+пер-ошибка)
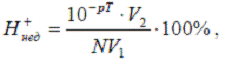
где V1 - объём в начале титрования. V2 - объём в конце
титрования.
б) Гидроксильная ошибка титрования, вызываемая наличием в
титруемом растворе по окончании титрования избытка гидроксид-ионов, остающихся
в растворе в результате недотитрования сильного основания сильной кислотой
(обозначается ОН - ошибка) или перетитрования сильной кислоты
сильной щёлочью (обозначается Н+ - ошибка)

где V1 - объём в начале титрования. V2 - объём в конце
титрования
в) Кислотная ошибка титрования, вызываемая присутствием в
титруемом растворе по окончании титрования нейтральных молекул недотитрованной
слабой кислоты
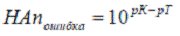
г) Щелочная ошибка титрования, вызываемая присутствием в
титруемом растворе по окончанию титрования нейтральных молекул недотитрованного
слабого основания
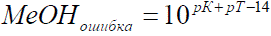
Фенолфталеин - один из наиболее широко используемых
индикаторов, особенно при титровании слабых кислот. Он не чувствителен к
повышению температуры, ошибка от присутствия белковых веществ незначительная.
Сн (KCN) = См/ fэкв-ти = 0.1
Сн (H2SO4) = См/ fэкв-ти = 0.3/ (1/2)
= 0.6
2KCN + H2SO4 = K2SO4 + 2HCN
Пусть объем раствора KCN будет равен 10мл.
С (KCN) *V (KCN) = С (H2SO4) *V (H2SO4)(H2SO4)
= С (KCN) *V
(KCN) / С (H2SO4)
= 10*0.1/0.6 = 1.667 мл.
6.1 Расчет точек кривой титрования
1.0% добавили от необходимого объема
В растворе находится только цианид натрия, который
гидрализуется, как
KCN + H2O = KOH + HCN
CN - + H2O = OH - + HCN
Цианидный ион и HCN в растворе образуют буферную смесь. Расчет pH производим по формуле
для буферной смеси:
[OH-] =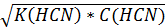
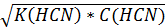 =√
=√
 ,1
,1
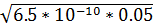 =0.000057
=0.000057
pH = 14 - pOH = 11.8337
До точки эквивалентности считаем по титруемому веществу:
2.10% добавили от необходимого объема
.667 мл - 100%
Х мл - 10%
Х=0.1667 (мл) - добавленный объем H2SO4
Получено HCN:
С (HCN) =С (H2SO4) = (Сн (H2SO4) *V (H2SO4)) / Vобщ= (0.6*0.1667) /10.1667 = = 0,009376
C (KCN) = (Сн (KCN) *V (KCN) - Сн (H2SO4) * Vдоб (H2SO4)) / Vобщ
c (KCN) = (0.051*10 - 0.6*0.1667) /10.1667
= 0.08852= pK + lg
 = 9.3 + lg (0.08852/0,009376) = 9.0676 = 14 - pOH = 9.0676
= 9.3 + lg (0.08852/0,009376) = 9.0676 = 14 - pOH = 9.0676
.50% добавили от необходимого объема
1.667 мл - 100%
Х мл - 50%
Х = 0.8335 (мл) - добавленный объем H2SO4
Получено HCN:
С (HCN) =С (H2SO4) = (Сн (H2SO4) *V (H2SO4)) / Vобщ= (0.6*0.8335) /10.8335 = = 0.04616
C (KCN) = (Сн (KCN) *V (KCN) - Сн (H2SO4) * Vдоб (H2SO4)) / Vобщ
c (KCN) = (0.1*10 - 0.6*0.8335) /10.8335 =
0.04614= pK + lg
 = 9.3 + lg (0.04614/0.04616) = 9.2997 = 9.2997
= 9.3 + lg (0.04614/0.04616) = 9.2997 = 9.2997
.75% добавили от необходимого объема
1.667 мл - 100%
Х мл - 75%
Х=1.25025 (мл) - добавленный объем H2SO4
Получено HCN:
С (HCN) =С (H2SO4) = (Сн (H2SO4) *V (H2SO4)) / Vобщ= (0.6*1.25025) /11.25025 = 0.06667
C (KCN) = (Сн (KCN) *V (KCN) - Сн (H2SO4) * Vдоб (H2SO4)) / Vобщ
c (KCN) = (0.1*10 - 0.6*1.25025) /11.25025
= 0.02220= pK + lg
 = 9.3 + lg (0.011104/0.033339) = 8.8224 = 8.8224
= 9.3 + lg (0.011104/0.033339) = 8.8224 = 8.8224
.99.9% добавили от необходимого объема
1.667 мл - 100%
Х мл - 99.9%
Х=1.6653 (мл) - добавленный объем H2SO4
Получено HCN:
С (HCN) =С (H2SO4) = (Сн (H2SO4) *V (H2SO4)) / Vобщ= (0.6*1.6653) /11.6653 = 0.08565
C (KCN) = (Сн (KCN) *V (KCN) - Сн (H2SO4) * Vдоб (H2SO4)) / Vобщ
c (KCN) = (0.1*10 - 0.6*1.6653) /11.6653 =
0.00007029= pK + lg
 = 9.3 + lg (0.0000351/0.042827) = 6.2142 = 6.2142
= 9.3 + lg (0.0000351/0.042827) = 6.2142 = 6.2142
.100% добавили от необходимого объема. Точка эквивалентности
Вещества прореагировали полностью, в растворе присутствует HCN, это слабая кислота. Рассчитываем pH:
[H+] = 
 =
=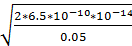
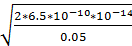 = 16.12*10-7
= 16.12*10-7
pH = 5,1245
После точки эквивалентности считаем по серной кислоте:
7.100.1% добавили от необходимого объема, раствор перетитрован
1.667 мл - 100%
Х мл - 100.1%
Х=1.668667 (мл) - добавленный объем H2SO4
[H+] = (Сн (H2SO4) * Vдоб (H2SO4) - Сн (KCN) *V (KCN)) / Vобщ
[H+] = (0.6*1.668667 - 0.1*10) /11.668667 = 0.00010285
pH = - lg [H+] = - lg0.00010285= 3.9877
.110% добавили от необходимого объема, раствор перетитрован
1.667 мл - 100%
Х мл - 100.1%
Х=1.8337 (мл) - добавленный объем H2SO4
[H+] = (Сн (H2SO4) * Vдоб (H2SO4) - Сн (KCN) *V (KCN)) / Vобщ
[H+] = (0.6*1.8337 - 0.1*10) /11.8337 = 0.008469
pH = - lg [H+] = - lg0.008469 = 2.07216
.200% добавили от необходимого объема, раствор перетитрован
1.667 мл - 100%
Х мл - 200%
Х=3.334 (мл) - добавленный объем H2SO4
[H+] = (Сн (H2SO4) * Vдоб (H2SO4) - Сн (KCN) *V (KCN)) / Vобщ
[H+] = (0.6*3.334 - 0.1*10) /13.334 = 0.07502
6.2
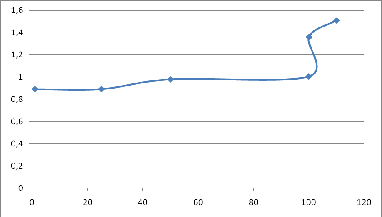
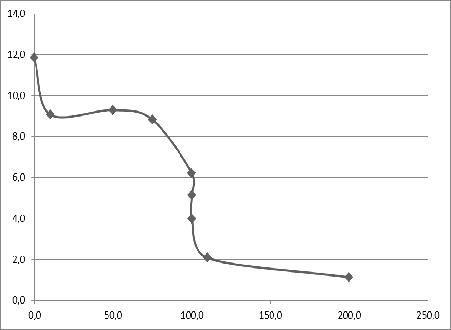
Построение кривой титрования
Таблица 2. Точки для построения кривой титрования по методу
"нейтрализации"
|
Процент титрования
|
pH
|
|
0% добавили от
необходимого объема
|
11,8337
|
|
10% добавили от
необходимого объема
|
9,0676
|
|
50% добавили от
необходимого объема
|
9,2997
|
|
75% добавили от
необходимого объема
|
8,8224
|
|
99.9% добавили
от необходимого объема
|
6,2142
|
|
100% добавили
от необходимого объема
|
7,1204
|
|
100.1% добавили
от необходимого объема
|
3,9877
|
|
110% добавили
от необходимого объема
|
2,0721
|
|
200% добавили
от необходимого объема
|
1,1248
|
График 1. Кривая титрования 0,1 M KCN - 0,3 M H2SO4
6.3
Подборка индикатора. Расчет индикаторных ошибок титрования
Таблица 4. Типы индикаторных погрешностей
|
Тип погрешности
|
Причина
погрешности
|
Расчетная
формула погрешности, %
|
|
Водородная
|
Избыток ионов Н+
вследствие недотитрования сильной кислоты или перетитрования основания
(сильного или слабого) сильной кислотой
|
∆H+
= (10-pT*V2*100) / (c*V1)
|
|
Гидроксильная
|
Избыток ионов
ОН - вследствие недотитрования сильного основания или перетитрования кислоты
(слабой или сильной) сильным основанием
|
∆ОН
- = (10-
(14-pT) *V2*100) / (c*V1)
|
|
Кислотная
|
Избыток молекул
слабой кислоты НА при её недотитровании
|
∆НА = (10pK-pT*100) / (1+10pK-pT)
|
|
Щелочная
|
Избыток молекул
слабого основания MOH при его недотитровании
|
∆МОН = = 10pK+pT-14*100
|
Тип погрешности. Причина погрешности. Расчетная формула
погрешности, %. Водородная. Избыток ионов Н+ вследствие недотитрования сильной
кислоты или перетитрования основания (сильного или слабого) сильной кислотой
∆H+ = (10-pT*V2*100) / (c*V1)
Гидроксильная. Избыток ионов ОН - вследствие недотитрования
сильного основания или перетитрования кислоты (слабой или сильной) сильным
основанием
∆ОН - = (10- (14-pT) *V2*100) / (c*V1)
Кислотная. Избыток молекул слабой кислоты НА при её
недотитровании
∆НА = (10pK-pT*100) / (1+10pK-pT)
Щелочная
Избыток молекул слабого основания MOH при его недотитровании
∆МОН = 10pK+pT-14*100
где V1 и V2 - объемы анализируемого раствора до и после титрования; с -
молярная концентрация эквивалента вещества анализируемого раствора; рК -
показатель константы диссоциации слабого электролита; рТ - показатель
титрования индикатора.
. Пусть pT розоловой кислоты = 7.1 больше pH в точке эквивалентности,
равного 7. Следовательно, раствор KCN недотитрован. Рассчитываем щелочную ошибку II-ого рода, вместо pK основания, берется pK сопряженной кислоты - pK (HCN) = 9,3: сопряженное pK = 14-9.3 = 4.7:
∆MОН = 10pK+pT-14*100
∆MОН =109,3+7,1-14*100 = 2.917*10-4 %
. Пусть pT бромтимолового синего = 6.8 меньше pH в точке
эквива-лентности, равного 7. Следовательно, раствор KCN перетитрован H2SO4. Рассчитываем водородную
ошибку (кислотную ошибку I-ого рода):
∆Н = (10-pT*V2*100) / (c*V1)
∆Н = (10-6.8* (10+1.667) *100) / (0.05*10) =
3.686*10-4 %
7.
Вывод
Роль титриметрического метода анализа не уменьшается и в наше
время. ОН является одним из самых простых. И удобных методов количественного
определения веществ. Основой данного метода является нахождение точки
эквивалентности анализируемого вещества и реагента. Ее можно определить как
физическими методами, так и с помощью индикаторов. Известно более десятка
кислотно-основных индикаторов с различными интервалами перехода, что позволяет
подобрать наиболее подходящий, для конкретной реакции. Постоянно изучаются
строение и свойства индикаторов, расширяются области их применения.
8.
Список литературы
1. Васильев
В.П. "Аналитическая химия: в двух книгах: Кн.1: Титриметрические и
гравиметрические методы анализа: Учеб. Для студ. ВУЗов, обучающихся по
химико-технологических спец. - 3-е издание, стереотип. - Москва: Дрофа, 2003год
- 368с.
2. Гильманшина
С.И. "Основы аналитической химии: курс лекций." Доп. УМО по
направлениям пед образования РФ в качестве учебного пособия для ВУЗов \ С.И. -
изд. СПб, Питер 2006год-224с. (Учебное пособие)
. Крешков
А.П. "Основы аналитической химии. Теоретические основы. Количественный
анализ. "том №1. Издательство №3 (перераб.). Учебное пособие для студентов
химико-технологических спец. ВУЗов. Москва, химия, 1970год.471с.
. Лурье
Ю.Ю. "Справочник по аналитической химии.5-е издание, переработ. и доп. -
Москва: химия, 1979год-480с
. Харитонов
Ю.Я. "Аналитическая химия.". кн.1. Общие теоретические основы.
Количественный анализ: Учеб. - Москва: Высшая школа. 2001год - 615с.
. Пилипенко
A. T. Пятницкий И.В. Аналитическая химия. т.2 М: Химия. 1990-480
с.
. Харитонов
Ю. А Аналитическая химия. Аналитика, т.2 М: Высшая школа. 2001 - 560 с.
. Дорохова
Е.Н. Прохорова Г.З. Задачи и вопросы по аналитической химии М" 1984 - 216
с.