Методы получения водорода
Реферат
«Методы
получения водорода»
Введение
Водород как технический продукт
широко используется во многих отраслях народного хозяйства - в технологических
процессах переработки нефти, производства аммиака, метанола, в металлургической
промышленности, во многих отраслях науки и техники.
Весьма перспективно использование
водорода в качестве горючего в транспортных средствах (авто- и авиатранспорт,
авиационно-космические объекты) ввиду его высокой теплоты сгорания и
значительной хладоемкости. Особый интерес представляет водород как аккумулятор
энергии - вторичный энергоноситель, который можно эффективно использовать,
например, на электростанциях для покрытия пиковых нагрузок. Кроме того,
применение водорода в качестве энергоносителя дает возможность передавать
энергию на большие расстояния с более высоким КПД, чем обеспечивают современные
системы.
При рассмотрении физико-химических
основ процессов получения водорода предпочтение было отдано наиболее
эффективным промышленным и, особенно перспективным (электрохимическим,
фотохимическим, термохимическим и др.). Также уделено внимание анализу
эффективности методов получения водорода из различного сырья с использованием
разных источников энергии.
1. Физические методы
извлечения водорода
Водород в значительных количествах
содержится во многих газовых смесях, например в коксовом газе, в газе,
получаемом при пиролизе бутадиена, в производстве дивинила.
Для извлечения водорода из
водородосодержащих газовых смесей используют физические методы выделения и
концентрирования водорода.
Низкотемпературная конденсация и
фракционирование. Этот процесс характеризуется высокой степенью извлечения
водорода из газовой смеси и благоприятными экономическими показателями. Обычно
при давлении 4,0 МПа для получения 93-94%-ного водорода необходима температура
115К. При концентрации водорода в исходном газе >40% степень его извлечения
может достигать 95%. Расход энергии на концентрирование Н2 от 70 до
90% составляет примерно 22 кВт·ч на 1000 м3 выделяемого водорода.
Адсорбционное выделение. Этот
процесс осуществляется при помощи молекулярных сит в циклически работающих
адсорберах. Его можно проводить под давлением 3,0-3,5 МПа со степенью
извлечения 80-85% Н2 в виде 90%-ного концентрата. По сравнению с
низкотемпературным методом выделения водорода для проведения этого процесса
требуется примерно на 20-25% меньше капитальных затрат и на 30-40%
эксплуатационных.
Адсорбционное выделение водорода при
помощи жидких растворителей. В ряде случаев метод пригоден для получения
чистого Н2. По этому методу может быть извлечено 80-80% водорода,
содержащегося в исходной газовой смеси, и достигнута его концентрация в целевом
продукте 99.9%. Расход энергии на извлечение составляет 68 кВт·ч на 1000 м3
Н2.
2. Современные методы
получения водорода
.1 Получение водорода
электролизом воды
Электролиз воды один из наиболее
известных и хорошо исследованных методов получения водорода. Он обеспечивает
получение чистого продукта (99,6-99,9% Н2) в одну технологическую
ступень. Экономика процесса в основном зависит от стоимости электроэнергии. В
производственных затратах на получение водорода стоимость электрической энергии
составляет примерно 85%.
Этот метод получил применение в ряде
стран, обладающих значительными ресурсами гидроэнергии. Наиболее крупные
электрохимические комплексы находятся в Канаде, Индии, Египте, Норвегии, но
созданы и работают более тысячи мелких установок во многих странах. Важен этот
метод и потому, что он является наиболее универсальным в отношении
использования первичных источников энергии. В связи с развитием атомной
энергетики возможен новый расцвет электролиза воды на базе дешевой энергии
атомных электростанций.
Электрохимический метод получения
водорода из воды обладает следующими положительными качествами:
) высокая чистота получаемого
водорода - до 99.9%;
) простота технологического
процесса, его непрерывность, возможность наиболее полной автоматизации,
отсутствие движущихся частей в электролитической ячейке;
) возможность получения
ценнейших побочных продуктов - тяжелой воды и кислорода;
) общедоступное сырье - вода;
) гибкость процесса и
возможность получения водорода непосредственно под давлением;
) физическое разделение
водорода и кислорода в самом процессе электролиза.
Если создать в водном растворе
электролита, куда погружены два электрода, постоянное электрическое напряжение,
которое превышает напряжение разложения воды, то в цепи появится ток и на аноде
начнет выделятся кислород, а на катоде - водород, в объемном отношении 1:2. При
этом будут происходить следующие реакции (в щелочной среде):


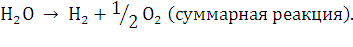
Удельная проводимость очищенной воды
незначительна: при 18°С она составляет (2-6)·10-6 Ом-1·м-1.
Поэтому электролизу подвергаю водные растворы сильных кислот или щелочей.
Другие электролиты обычно не используют, поскольку они сами разлагаются при
электролизе и дают нежелательные побочные продукты. Ввиду существенных
коррозионных проблем, возникающих при электролизе кислот, в настоящее время
почти все электролизеры используют водные растворы на основе гидроксидов калий
и натрия концентрацией 350-400 г./л. Растворы КОН имеют преимущества перед NaOH в силу больше
проводимости К+ против иона Na+. Равновесный состав пара над водным раствором КОН ниже, а это
означает, что в конечных продуктах электролиза Н2 и О2
содержится меньше водяного пара. Концентрация КОН соответствует оптимальным
значениям плотностей тока. Небольшие примеси к КОН не являются препятствием к
его использованию.
Рассмотрим механизм катодного
выделения водорода из щелочных растворов. На первой стадии происходит разряд
молекул воды с образованием адсорбированных на электроде атомов водорода:
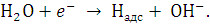
Далее происходи реакция так
называемой электрохимической десорбции (реакция Гейровского):
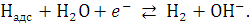
В сумме эти два процесса дают
катодную реакцию выделения водорода. На аноде вероятной первой стадией является
разряд гидроксил-ионов с образованием радикалов ОН:

Затем происходит цепочка процессов:

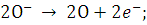
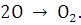
Содержащаяся в растворе щелочь, как
видно из приведенных уравнений, не участвует в разряде. А служит только для
переноса ионов.
Суммарный процесс разложения воды
электролизом является процессом, обратным горению водорода. Поэтому
теоретическая величина энергии, которая требуется на единицу количества
производимого водорода, равна теплоте сгорания водорода. Каждая молекула
водорода образуется при присоединении двух электронов к двум ионам водорода в
растворе, так что существует прямая связь между проходящим током и скоростью
производства водорода.
2.1.1 Электролиз воды с
использованием твердых высокополимерных электролитов
Чтобы работать при повышенных
плотностях тока и понизить омические потери, в современной электрохимической
технологии используют возможность нанесения электролита на мембраны-носители.
Эти мембраны можно сделать достаточно тонкими с тем, чтобы расстояние между
электродами были предельно малыми для повышения производительности установки.
Электролизеры такого типа позволяют работать при повышенных температурах и
давлениях. В качестве адсорбентов можно использовать полимеры типа тефлона. В
таких системах не используют никаких кислых или щелочных добавок.
Электролит представляет собой
пластину толщиной 0,25 - 0,5 мм. В таком электролите отсутствуют свободные
кислоты или основания; ионная проводимость обеспечивается лишь за счет
подвижности гидратированных ионов водорода. Эти ионы движутся через слой
электролита, переходят от одной сульфокислотной группы к другой. Вода на аноде
разлагается с образованием кислорода, ионов водорода и электронов. Ионы
водорода диффундируют через твердый полимерный электролит и попадают на катод.
Электроны проходят через внешний контур и достигают водородного электрода, глее
осуществляется рекомбинация водородных ионов и электронов с образованием
молекул водорода.
Схема электродных реакций на
полимерной мембране представлена на рис (2.1). Электроды не должны быть
стойкими против кислот или щелочей, так как электролит адсорбируется на
мембране. В качестве материала для катода можно использовать платиновую чернь,
а для анода - металлооксидный катализатор. Некоторые технические показатели
процесса: плотность тока 1,1 - 2,0 А/см2; напряжение 1,78 - 1,85 В;
потребление энергии 3,9 - 4,0 кВт·ч/м3 Н2; давление 0,2 -
6,0 МПа, температура 120°С.
Преимущества полимерных электролитов
проявляются в следующих особенностях:
) электролитическая ячейка
может работать при высоких перепадах давления и высоких давлениях генерирования
водорода;
) концентрация электролитов
постоянна и сам электролит находится в стационарном состоянии (отсутствует
циркуляция электролита), он остается неизменным в процессе эксплуатации;
) в системе отсутствуют
циркулирующие агенты (кислоты или щелочи), вызывающие коррозию технологического
оборудования;
) снижается расход
электроэнергии на электролиз;
) простота конструкции
электродов, которые представляют собой тонкие слои платиновой черни, нанесенные
с одной и другой стороны пластины полимерного электролита.

Рисунок 2.1 - Схемы электролиза
водяного пара
а - полимерная мембрана;
- катод; 2 - полимерная мембрана; 3
- анод;
реакция на катоде 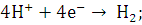 реакция на аноде
реакция на аноде 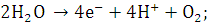
б - твердый катализатор;
- катод (Ni+10% ZrO2); 2 - анод (ABO3, где A - Sr, Ca, BA, Mg, B - Al, Ti);
катодная реакция 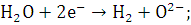 анодная реакция
анодная реакция  температура
электролиза 1100-1500 К
температура
электролиза 1100-1500 К
Разработка способов получения
водорода электролизом воды при высоких температурах с использованием твердых
полимерных электролитов направлена на достижение высокой эффективности процесса:
КПД ≥ 85% при сроке службы электролитических ячеек более 40 000 ч и всей
установки в целом более 20 лет. Высокотемпературный электролиз паров воды в
электролизерах с твердым электролитом позволяет получать водород при наиболее
низком расходе электроэнергии по сравнению со всеми существующими
электрохимическими способами получения водорода.
2.1.2 Получение водорода
в процессе парциального окисления углеводородов
Этот процесс представляет собой
технологическую комбинацию следующих основных химических реакций (тепловые
эффекты 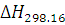 приведены в кДж/моль):
приведены в кДж/моль):
Всякий процесс парциального
окисления в качестве своей завершающей стадии включает процесс конверсии СО.
Значительным преимуществом процесса
парциального окисления является то, что этим процессом могут быть переработаны
любые газообразные и жидкие углеводороды, вплоть до мазута, со значительным
содержанием серы.
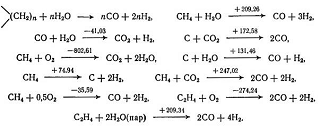
Переработка углеводородного сырья
протекает при температуре порядка 1600К и давлении 10 МПа по следующим основным
реакциям тепловые эффекты  приведены
в кДж/моль. Тепловые эффекты
приведены
в кДж/моль. Тепловые эффекты  даны
для температуры входящего сырья 420К и температуры конечных продуктов реакции
1530К.
даны
для температуры входящего сырья 420К и температуры конечных продуктов реакции
1530К.
Наряду с этими основными реакциями
следует учитывать протекание следующих процессов, связанных между собой
равновесными уравнениями. Тепловые эффекты для этих реакций даны при 1500 К (в
кДж/моль):
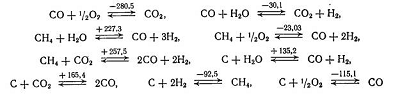
Чтобы избежать слишком высокой
температуры в реакторе, избыточное тепло поглощают вводимым паром. Часть
водяного пара используют для проведения эндотермических реакций, и в реакторе
при 1500К устанавливается равновесие приведенных выше реакций.
Следует отметить, что состав
получаемого газа не зависит от химической структуры исходного горючего
(природный газ, нафта, мазут), а зависит от соотношения в сырье исходных
элементов: С, Н, О, S. Для всех процессов парциального окисления должно соблюдаться
условие, которое заключается в том, что атомное отношение входящих в процесс
кислорода и углерода должно быть больше 1. Если это соотношение не соблюдено, в
процессе выделяются значительные количества сажи. Второе правило парциального
окисления углеводородов заключается в том, что из трех элементов: С, Н и S, которые могут вступить в реакцию с
ограниченным количеством кислорода, поступающего в процесс, он в первую очередь
связывается с углеродом, который превращается в оксид углерода, при этом
связанный водород углеводорода освобождается. Находящийся в процессе избыток кислорода
далее окисляет СО и Н2 до СО2 и Н2О, но
распределение кислорода на эти оба компонента регулируется условиями равновесия
водяного газа:  ,
которое устанавливается в газе с высокой скоростью.
,
которое устанавливается в газе с высокой скоростью.
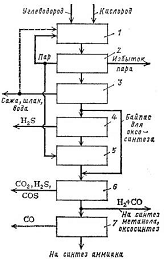
Рисунок 2.2 - Блок-схема установки
по парциальному окислению углеводородов
- установка высокотемпературной
конверсии (1570К); 2 - паровой котел (охлаждение с получением пара); 3 - блок
промывки, охлаждения и удаления твердых частиц; 4 - блок сероочистки; 5 -
установка конверсии СО; 6 - блок водной промывки; 7 - блок очистки от СО (метанирование,
медно-аммиачная очистка, промывка жидким азотом); байпас - для газов без серы
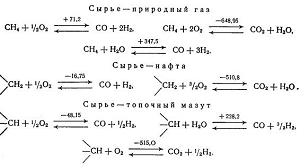
При паровом риформинге могут быть
использованы природный газ, пропан, жидкие углеводороды, газы рафинирования
нефти, нафта, бензины. Процессы Texaco и Shell дают возможность использовать в качестве исходного сырья также
сырую нефть и тяжелый мазут; наиболее широкими возможностями располагает
процесс Coppers-Totzek, в котором кроме указанных продуктов можно использовать
каменноугольные смолы, асфальты, лигнины, бурые угли, каменные угли, кокс.
2.2 Получение водорода в
процессе переработки угля и кокса
2.2.1 Коксование и
окисление кокса в расплаве
Коксованию могут быть подвергнуты
каменные угли, бурые угли, торф, каменноугольный пек, буроугольная и
каменноугольная смола. Газообразные продукты, получаемые при коксовании, наряду
с водородом содержат СО, СН4, СО2, N2, водяные пары, летучие газообразные углеводороды. Данные о
содержании водорода в газообразных продуктах коксования разного исходного сырья
представлены в табл. 2.1.
Таблица 2.1 - Содержание водорода в
газообразных продуктах коксования
|
Сырье
|
Н2, % (об.)
|
|
Бурый уголь
|
До 35
|
|
Каменный уголь
|
До 50
|
|
Торф
|
20
|
|
Смола торфяная
|
50
|
|
Смола буроугольная
|
До 80
|
|
Смола каменноугольная
|
До 80
|
Получение водорода при окислении
кокса в расплаве идет по реакции:

.2.2 Газификация кокса и
угля паром, паровоздушной и парокислородной смесью
Процесс представляет собой сложную
технологическую систему химических реакций, основные из которых представлены в
таблице 2.2.
Процессы газификации твердых горючих
в зависимости от состава дутья и конечного продукта газификации (смесь СО + Н2
или СН4) разделяются на процессы оксогазификации и гидрогазификации.
Возможен прямой подвод тепла (за счет сжигания части горючего кислородом
воздуха) или косвенный подвод тепла за счет перегретого дутья - пара, внешнего
обогрева реакционного объема газогенератора - газовым теплоносителем,
электрообогревом или внутренним подводом тепла за счет перегретого твердого
теплоносителя. В зависимости от этого процессы газификации разделяются на
автотермические и аллотермические.
Газификация угля может
осуществляться и как высокотемпературный процесс (температура в зоне
газификации (1900-2100 К), и как низкотемпературный процесс (1200-1250 К). В
случае высокотемпературного процесса зольную часть угля из газогенератора
обычно выводят в виде жидкого шлака, а конечным продуктом газификации является
смесь СО + Н2.
Таблица 2.2 - Тепловые эффекты (в
кДж/моль) химических реакций в технологической цепочке газификации кокса и угля
|
Реакции
|
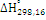
|
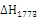
|
|
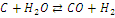
|
+131,46
|
+135,09
|
|

|
+77,46
|
-
|
|

|
- 86,25
|
- 92,36
|
|

|
-8,79
|
-
|
|

|
-206,00
|
-227,45
|
|
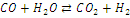
|
-41,16
|
-30,14
|
|
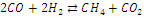
|
-247,00
|
-257,59
|
|

|
-165,38
|
-
|
|
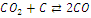
|
+160,00
|
+165,23
|
|
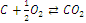
|
-123,10
|
-115,33
|
|

|
-406,12
|
-396,07
|
|

|
-299,77
|
-280,90
|
|
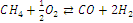
|
-
|
В случае низкотемпературного
процесса или среднетемпературного процесса (максимальная температура в зоне
газификации ниже температуры размягчения золы газифицируемого угля) золу из
газогенератора удаляют в сухом виде. Процесс газификации можно проводить при
обычном давлении и под давлением до 10 МПА. Процесс под давлением выгоден в том
случае, когда целевым продуктом процесса является метан, или в том случае,
когда стадия переработки полученного целевого газа протекает под давлением
(синтез аммиака, синтез метанола, процесс гидрогенизации).
В зависимости от фракционного
состава используемого горючего процессы газификации разделяются на три группы:
газификация крупнокускового горючего
в псевдопокоящемся слое;
газификация мелкозернистого горючего
в псевдоожиженном (кипящем) слое;
газификация пылевидного горючего в
потоке.
2.3 Термический и
термомагнитный методы получения водорода
.3.1 Термический метод
Разложение воды
Процесс термического разложения воды
можно описать следующими реакциями:

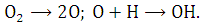
При реализации этого процесса возникают
проблемы:
) отделение Н2 от
О2;
) подбор материалов,
устойчивых при столь высоких температурах;
) подбор источников тепла
высокого потенциала;
) использование отходов
низко- и среднетемпературного тепла, образующегося в процессе.
Для предотвращения рекомбинации
продуктов реакции могут быть рассмотрены две возможности: использование
селективных мембран для удаления Н2 или О2, как только
они образуются, или быстрая закалка (охлаждение) газовой смеси.
Разложение жидких и
газообразных углеводородов
Процесс представляет собой
технологическую комбинацию следующих химических реакций (тепловой эффект  приведен в кДж/моль):
приведен в кДж/моль):


Метан разлагается на сажу и водород
при температуре 1400 К. Никелевый катализатор снижает температуру распада на до
920 - 1070 К. Процесс может быть осуществлен и в две ступени. В качестве
промежуточного продукта может быть получен ацетилен (тепловой эффект реакции
при 298 К в кДж/моль):
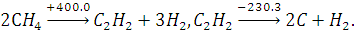
Тепло, необходимое для проведения
первой реакции, может быть получено в процессе электрокрекинга или парциального
окисления. Реакция разложения ацетилена протекает при 1070К очень быстро (со
взрывом).
Водород из ацетилена может быть
получен и другим методом (тепловой эффект реакции при 298 К в кДж/моль):

Эта реакция протекает при 670 К на
цинк оксидном катализаторе.
Термическое разложение метана и
углеводородов может быть проведено различными технологическими методами.
Например, углеводороды впрыскивают в расплавленное железо. Происходит распад
углеводорода с образованием свободного водорода и растворением углерода в
жидком металле. Выделившийся углерод выжигают из железа при продувке расплава
воздухом или кислородом. При выжигании углерода тепла получается больше, чем
требуется для разложения углеводорода. Избыток тепла используют для получения
пара.
Разложение метилового
спирта
Процесс может быть записан в
следующем виде (тепловой эффект реакции при 298 К в кДж/моль):
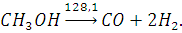
Катализатором процесса является
смешанный медно-никелевый или никелево-алюминиевый катализатор, нанесенный на
огнеупорный носитель. Состав получаемого газа после первой ступени процесса:
61% Н2, 31% СО и 2% СО2.
При избыточном давлении 2 МПА
процесс может быть проведен в одну ступень:  на медь-цинк-хромовом катализаторе при 530-570 К можно достигнуть
практически полной конверсии метанола до Н2 и СО2 при
значительной объемной скорости.
на медь-цинк-хромовом катализаторе при 530-570 К можно достигнуть
практически полной конверсии метанола до Н2 и СО2 при
значительной объемной скорости.
Для получения 1 м3 Н2
(чистота 99,5% (об.)) расходуется 0,505 кг жидкого метилового спирта и 0,32 кг
жидкого котельного горючего, в качестве побочного продукта образуется 63 кг СО2.
На 1 м3 Н2 расходуется 0,12 кВт·ч электроэнергии м 0,125
м3 охлаждающей воды.
Разложение сероводорода
При нагревании сероводород
разлагается по реакции:
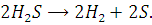
Термическое разложение
аммиака
При нагревании аммиак разлагается по
реакции:

Процесс протекает на никелевом или
железном катализаторе при 1170-1270 К. Из 1 т  получают смесь, содержащую 2110 м3 водорода и 685 м3
азота. Азот из процесса удаляют адсорбцией на активном угле, силикагеле или
методом глубокого охлаждения.
получают смесь, содержащую 2110 м3 водорода и 685 м3
азота. Азот из процесса удаляют адсорбцией на активном угле, силикагеле или
методом глубокого охлаждения.
2.3.2 Термомагнитный
метод
Молекулярный кислород является
парамагнетиком и, следовательно, притягивается магнитным полем. Так как вода и
водород парамагнетиками не являются, приложение магнитного поля к воде будет
вызывать «экстракцию» кислорода и поддерживать реакцию 
Показано, что смещение равновесия
химической реакции, включающей парамагнетик, очень незначительно при
использовании «обычного» магнитного поля, напряженностью 1 тесла (Т). В
настоящее время ведутся исследования магнитных полей, в которых возможен
практический сдвиг равновесия реакции разложения воды, и поиски системы, в
которой вода может быть подвергнута термомагнитному расщеплению на водород и
кислород.
В процессе термомагнитного
разложения воды энергия «экстрагируется» из магнитного поля. Когда кислород
покидает магнитное поле, магнитная энергия возвращается. Этот процесс должен
быть сбалансирован. Для обеспечения изотермического удаления кислорода и его
размагничивания необходима определенная тепловая энергия. На рис. 2.3 показана
схема термомагнитного разложения воды.

Рисунок 2.3 - Блок-схема
термомагнитного процесса разложения воды
Реактор, в котором проводят
расщепление воды, имеет вид кожухотрубчатого диффузора, изготовленного из
палладиевых трубок, через которые может диффундировать только водород, но не
кислород или вода. Реактор помещают между полюсами магнита. Пары воды при
относительно высоких температуре и давлении поступают в реактор из испарителя.
Водород отводится через стенки. Неразложившаяся вода, кислород и остаток водорода
удаляют через конец трубки. В случае необходимости использования катализатора
им можно набить трубку.
2.4 Получение водорода
методом фотолиза
.4.1 Электрохимический
фотолиз
Этот метод известен как
фотоэлектрохимическое разложение воды на полупроводниковых электродах, или как
метод Fuishima-Honda. В качестве электродов электрохимической ячейки используют
полупроводниковый монокристалл, например диоксид титана, и металлическую сетку
с платиновой чернью, которые в электролизере с водой разделены диафрагмой.
Прямой фотолиз воды требует
использование света с энергией квантов 6 эВ, которых практически нет в
солнечном спектре. Одним из методов многоступенчатого метода использования
света с меньшей энергией квантов является процесс фотоэлектрохимического разложения
воды. Фотоэлектрохимические устройства для преобразования солнечной энергии
делятся на две группы в зависимости от того, где именно происходит поглощение
света и, следовательно, первичный фотопроцесс: в растворе (это так называемые
фотогальванические фотоэлементы) или на электроде. Фотогальванические элементы
имеют КПД в несколько процентов, поэтому их практическое использование имеет
малую перспективу. Основным объектом исследования стали фотоэлектрохимические
элементы с полупроводниковыми электродами. Как показали исследования,
требования к совершенству кристаллической структуры полупроводника в случае
фотоэлектрохимических элементов менее жестки, чем в случае с твердотельными
полупроводниковыми преобразователями энергии (солнечными батареями), что и послужило
основной причиной широкого развития работ по фотоэлектрохимическим элементам с
электродами из полупроводников.
К фотоэлектрохимическим процессам
разложения воды можно отнести также и электрохимические реакции, протекающие
при облучении светом электрода (металлы, неорганические и органические
полупроводники), либо адсорбированных на поверхности электрода частиц.
Применение в качестве катализаторов
фотоэлектролитического разложения воды полупроводниковых соединений позволяет
увеличить термическую эффективность процесса. Механизм процесса заключается в
следующем. Квант света освобождает из кристаллической решетки
полупроводникового анода электрон, который во внешней цепи анода достигает
металлического катода и на его поверхности восстанавливает водородный ион.
Положительный носитель - дырка мигрирует на границу раздела фотоанода с
электролитом, встречается с ионом гидроксила и окисляет его до кислорода.
Процесс в целом состоит из двух
связанных частей: преобразования света в электрический ток (поток электронов) и
превращение электрического тока в химическую энергию водорода.
Как показано на рис. 2.4,
фотолитическая ячейка разделена мембраной на катодное и анодное пространство. В
них погружены два электрода: полупроводниковый металлический. На полупроводниковый
электрод падают кванты света, которые генерируют свободные электроны (е-).
Возле фотоанода, на котором разряжаются ионы гидроксила, раствор щелочной.
Возле катода, где разряжаются ионы водорода, раствор подкисленный. Разность в
рН двух электродов достаточна, чтобы между ними установилась дополнительная
концентрационная разность потенциалов, которая вместе с фотопотенциалом
фотоанода дает напряжение, достаточное для разложения воды.

Рисунок 2.4 - Блок-схема электрохимического
фотолиза воды
- платиновый электрод; 2 -
полупроводниковый фотоанод; 3 - мембрана; 4 - стекло
Электрохимические реакции,
протекающие в системе TiO2 (анод) - Pt (катод) при освещении,
могут быть записаны следующим образом:

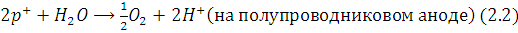

где, 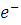 - свободные электроны;
- свободные электроны;  - частота световой волны;
- частота световой волны; 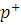 - позитроны (дырки);
- позитроны (дырки);  - энергия фотона.
- энергия фотона.
Когда анод (TiO2) и катод (Pt) опущены в общий раствор электролита, квантовый выход фотолиза
воды низок, так как потенциалы реакций (2.2) и (2.3) очень близки друг к другу.
Повысить эффективность такого процесса, т.е. повысить скорость выделения
водорода можно путем фиксации определенных рН в анодном и катодном
пространствах (высокого рН у анода и низкого - у катода).
Механизм процесса можно представить
в следующем виде. В результате воздействия излучения в кристалле TiO2 образуются электронно-дырочные пары. На поверхности кристалла
происходит процесс с выделением кислорода:
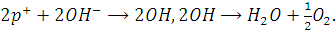
На катоде электроны реагируют с
ионами  , образуя молекулярный водород:
, образуя молекулярный водород:
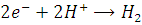 .
.
Эффективность такого процесса
фоторазложения воды достигает 10-14%. Из теоретических соображений следует, что
могут быть подобраны и другие, более эффективные полупроводники, способные
утилизировать почти 40% достигающей поверхности земли солнечной энергии и
обеспечивающие общую эффективность 28%.
Сегодня практически весь водород,
потребляемый промышленностью, производят путем конверсии природного газа или
путем переработки другого углеводородного сырья. Интересной представляется
возможность получения водорода из воды или при использовании в качестве
первичного источника энергии запасов угля.
В пользу водорода как универсального
энергоносителя говорят многие обстоятельства:
сырьем для получения водорода может
быть вода, а для получения искусственных углеводородов - еще и уголь,
углекислый газ или природные карбонаты, т. Е. запасы сырья практически
неограниченны;
при сжигании водорода или искусственных
топлив, полученных на его основе, образуется значительно меньше вредных веществ
и требуются меньшие затраты на мероприятия по охране окружающей среды, чем при
сжигании природных жидких и газообразных топлив;
водород широко используется в
современной химии, нефтехимии, а в меньших масштабах - в металлургии, при
металлообработке, в пищевой и других отраслях промышленности, и потребность в
нем непрерывно растет.
Список источников
информации
водород
физический термомагнитный электролиз
1 Д.Ю. Гамбурга, Н.Ф. Дубовкина. Водород. Свойства, получение,
хранение, транспортирование, применение. - М.: Химия, 1989. - 672 с.: ил.
Шпильрайн Э.Э. и др. Введение в водородную энергетику. - М.:
Энергоатомиздат, 1984. - 264 с.: ил.