Выбор конструкционного материала и способа защиты для изготовления и хранения раствора: H2SO4 - 60%
Государственное образовательное
учреждение
высшего профессионального образования
Тверской государственный технический
университет
Кафедра «Технология полимерных
материалов»
Курсовая работа
По курсу «Химическое сопротивление и
защита от коррозии»
Выбор конструкционного
материала и способа защиты для изготовления и хранения раствора: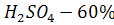

Выполнил: студент
группы МАХП - 0908
Матвеев Д.В.
Проверил: Комаров А.М.
Тверь 2010
Содержание
Введение
. Аналитический обзор
.1 Механизм коррозии металлов в кислотах
.2 Материалы, устойчивые в растворе Н2SO4
.3 Методы защиты от коррозии в растворе
. Выбор материала для изготовления емкости хранения
. Выбор метода защиты
. Коррозия в почвах
. Способы защиты от подземной коррозии
.1 Изоляционные покрытия трубопроводов
.2 Катодная защита трубопроводов
. Расчет катодной защиты трубопровода
Заключение
Список использованной литературы
Введение
В современном мире численность населения Земли быстро возрастает. В 1850
г. оно составляло 1,2 млрд. человек, к 1950 г. увеличилось до 2,5 млрд.
человек, а в 2011 г. - 7 млрд. человек. Соответственно растут и потребности
людей, причем не пропорционально росту их численности, а более высокими
темпами. Удовлетворить эти непрерывно умножающиеся потребности можно только за
счет развития производства. Так, если за последнюю четверть века население
планеты возросло в 1,6 раза, то объемы основных производств - в 2-5 раз.
Промышленность Российской Федерации имеет более 20000 предприятий с
разнообразными технологиями производства. Оборудование для них изготавливают на
основе сплавов черных и цветных металлов, а также из природных или
искусственных химически стойких материалов. Со временем оно стареет или
разрушается вследствие коррозии. Это приносит не только большие экономические
потери, но и приводит к глобальным экологическим катастрофам.
Экономический и экологический ущерб, наносимый нашей планете коррозией
металлических изделий, оборудования и конструкций, неисчислим. В Российской
Федерации ежегодные потери металлов из-за их коррозии составляют до 12% общей
массы металлофонда, что соответствует утрате до 30% ежегодно производимого
металла. Кроме столь огромных связанных с коррозией прямых потерь, существуют
еще большие косвенные потери. К ним относятся расходы, обусловленные потерей
мощности металлического оборудования, его вынужденными простоями из-за аварий,
а также расходы на ликвидацию последствий аварий, часто носящих характер
экологических катастроф. Как правило, металлическое изделие, пришедшее в
негодность вследствие коррозионных разрушений, отправляют на переплавку. В этом
случае общие потери будут включать безвозвратные потери металла, перешедшего в
продукты коррозии, стоимость изготовления металлических изделий и косвенные
потери. По статистическим данным безвозвратные потери составляют 8-12% от
первоначальной массы металла. Стоимость изготовления металлических конструкций
зачастую превосходит стоимость самого металла. К косвенным потерям относят
расходы, связанные с отказом в работе металлического оборудования, с его
простоями и ремонтом, связанные не в последнюю очередь с износом стыковых
соединений, выполненных с помощью незащищенных крепежных изделий. Суммарно в
большинстве стран потери от коррозии составляют 4-6% национального дохода.
Росту потерь от коррозии способствует постоянное интенсивное развитие
наиболее металлоемких отраслей промышленности, например, энергетики (тепловой и
атомной), транспорта (в том числе трубопроводного), металлургии, химической,
нефтяной и нефтехимической промышленности и др., а также ужесточение условий
эксплуатации металла, как в промышленности, так и в городском хозяйстве. Все
это указывает на исключительную важность проблемы борьбы с коррозией металлов,
а следовательно, и на большую значимость развития научно-технических работ в
данной области. Но главное, что определяет необходимость первоочередного
решения проблемы научного подхода к поиску оптимальных путей
противокоррозионной защиты металлов, связано с безвозвратностью затрат на
борьбу с коррозией металлических изделий и конструкций и невосполнимостью израсходованных
при этом земных ресурсов.
Химическая промышленность производит в настоящее время свыше 90 тысяч
наименований разнообразных химических продуктов. Но лишь 1/5 от этого
количества производится на основе всесторонних и действительно научных
разработок. Технология производства около 80% из них не оптимизирована.
Необходимо отметить, что создание самых совершенных машин и аппаратов не
гарантирует их от разрушений. Повышение надежности, экологической безопасности
технических систем предъявляет особо жесткие требования к качеству конструкций
и монтажа. В условиях несовершенства производства, нарушения технологий
эксплуатации, износа оборудования вероятность «отказов» и аварий возрастает.
Степень удовлетворенности страны основными средствами защиты
металлоконструкций существенно ниже необходимой. В частности, потребность в
лакокрасочных покрытиях и ингибиторах удовлетворяется на половину, а в защите
готового металлопроката, например, в трубах с покрытиями - менее чем на 30%.
Наибольшие потери от коррозии несут топливно-энергетический комплекс
(ТЭК), сельское хозяйство, химия и нефтехимия. Так, потери металла от коррозии
составляют: в ТЭК - 30%, химии и нефтехимии - 20%, сельском хозяйстве - 15%,
металлообработке - 5%.
Для нахождения путей практического решения тех или иных задач,
возникающих в результате коррозионного разрушения различных металлических
объектов, необходимо, в первую очередь, понимание законов такого разрушения,
т.е. теории коррозии металлов. Это требует рассмотрения общих вопросов, к
которым, кроме механизма коррозии металлов, следует отнести такие разделы, как:
диагностика конструкций и оборудования потенциально опасных производств и
объектов; оценка прочности и остаточного ресурса эксплуатируемых конструкций и
оборудования объектов повышенной опасности; разработка ресурсосберегающих
технологий сварки и смежных процессов для повышения надежности работы
конструкций; сертификация и нормирование, как основа обеспечения качества
оборудования; экологические и социально-экономические проблемы обеспечения
надежности эксплуатации потенциально опасных объектов./1/
1. Аналитический обзор
.1 Механизм коррозии металлов в кислотах
Механизм электрохимической коррозии. Коррозия металла в средах, имеющих
ионную проводимость, протекает через анодное окисление металла:

и
катодное восстановление окислителя (Ох)

Окислителями
при коррозии служат ионы  . Наиболее часто при коррозии в кислотах наблюдается
выделение водорода
. Наиболее часто при коррозии в кислотах наблюдается
выделение водорода 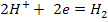
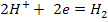
Коррозия
с участием ионов водорода называется коррозией с выделением водорода (коррозией
с водородной деполяризацией) (рис. 1).
Кроме
анодных и катодных реакций при электрохимической коррозии происходит движение
электронов в металле и ионов в электролите. Электролитами могут быть растворы
солей, кислот, оснований, морская вода, почвенная вода, вода атмосферы,
содержащая 
 ,
, 
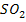 ,
, 
 и другие
газы.
и другие
газы.

Рис.
1. Схема коррозии стали в растворе  с
выделением водорода
с
выделением водорода
Химическая
энергия реакции окисления металла передается не в виде работы, а лишь в виде
теплоты. Схема электрохимической коррозии железа в контакте с углеродом
приведена на (рис. 1).
На
анодных участках происходит реакция окисления железа 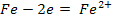
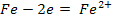 . На
катодных участках происходит восстановление водорода
. На
катодных участках происходит восстановление водорода
 .
.
Причинами
энергетической неоднородности поверхности металла и сплава могут быть
неоднородность сплава по химическому и фазовому составам, наличие примесей в
металле, пленок на его поверхности и др. На поверхности металла могут быть
участки, на которых катодные реакции протекают быстрее (катализируются), чем на
других участках. Поэтому катодный процесс в основном будет протекать на
участках, которые называются катодными. Наличие участков, на которых катодные
реакции протекают быстрее, увеличивает скорость коррозионного процесса. На
других участках будет протекать в основном растворение металла и поэтому они
называются анодными./1/
1.2
Материалы, устойчивые в растворе Н2SO4
Серная
кислота в диапазоне концентраций от 10 до 90%, как известно, особенно
коррозионно-активна. Специальные металлы, такие как титан, подвергаются быстрой
коррозии в серной кислоте при температурах ниже 100оC. Очень немногие
экзотические металлы (цирконий и тантал) могут применяться в серной кислоте
выше температуры кипения.
Тантал
(Та)
Элемент
V группы Периодической системы. Металл стального цвета с синеватым оттенком.
Тантал открыт в 1802 г. швед, химиком А. Г. Экбергом. Металлический тантал
впервые получил в 1903 г. немецкий химик В. фон Болтон. Тантал в соединениях
проявляет преимущественно степень окисления +5. Металлический тантал стоек в
большинстве агрессивных сред, в т.ч. в «царской водке». Взаимодействует с
 и
и 
 выше
50-100°С. /2/
выше
50-100°С. /2/
Цирконий
(Zr)
Элемент
IV группы Периодической системы. Серебристо-белый металл с характерным блеском.
Порошкообразный Zr был получен в 1824 г. шведским химиком И. Берцелиусом, а
пластичный - в 1925 г. нидерландскими химиками А. ван Аркелом и И. де Буром при
термической диссоциации иодидов Zr. Стоек в кипящей 
 при
концентрации до 70%./2/
при
концентрации до 70%./2/
Свинец
(Pb)
Элемент
IV группы Периодической системы. Тяжелый металл голубовато-серого цвета, очень
мягкий и пластичный (режется ножом). Стоек в растворе 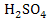
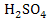 при
концентрации меньше 96% при комнатной температуре. Скорость коррозии в кипящих
растворах, содержащих менее 80%
при
концентрации меньше 96% при комнатной температуре. Скорость коррозии в кипящих
растворах, содержащих менее 80% 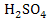
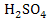 составляет
менее 2 мм/год; в кипящей 20%
составляет
менее 2 мм/год; в кипящей 20% 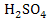
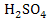 - 0,08
мм/год./2/
- 0,08
мм/год./2/
Хастеллой
Общее
название группы коррозионностойких Ni-сплавов систем Ni-Мо и Ni-Cr-Mo. Стойки в

 , но
склонны к межкристаллитной коррозии после нагрева при 600-850 °С. В России
производят хастеллой марок Н70МФ, ХН65МВ и др./2/
, но
склонны к межкристаллитной коррозии после нагрева при 600-850 °С. В России
производят хастеллой марок Н70МФ, ХН65МВ и др./2/
Полимербетон
(пластобетон)
Пластобетон
является одним из видов бетона, в котором в качестве связывающего вещества
применяются термореактивные смолы, такие как полиэфирные и эпоксидные с
отвердителями, а также термопластичные смолы. Технология полимербетона не
отличается существенно от приготовления обычных цементных бетонов. Примерный
состав полимербетона (% по массе): щебень гранитный 51, песок кварцевый 26,
кварцевая мука 11, фурфуролацетоновый мономер - ФАМ (продукт конденсации в
щелочной среде эквимолярных количество фурфурола и ацетона) 10,
бензолсульфокислота 2./6/
Резины гуммировочные
Сочетание резины и эбонита с различными физико-механическими свойствами и
химической стойкостью дает возможность подобрать для каждого аппарата в
зависимости от условий его эксплуатации наиболее долговечное покрытие,
состоящее из одного или нескольких сортов резины./6/
Полимерные материалы
Полимеры - неорганические и органические, аморфные и кристаллические
вещества, состоящие из «мономерных звеньев», соединённых в длинные
макромолекулы химическими или координационными связями.
Отличаются широкими возможностями регулирования состава, структуры и
свойств. Основные достоинства полимерных материалов: низкая стоимость,
сравнительная простота, высокая производительность, малая энергоемкость и
малоотходность методов получения и переработки, невысокая плотность, высокая
стойкость к агрессивным средам, атмосферным и радиационным воздействиям и
ударным нагрузкам, низкая теплопроводность, хорошие адгезионные свойства.
Недостатки полимерных материалов: низкая тепло- и термостойкость, большое
тепловое расширение, склонность к ползучести и релаксации напряжений; для
многих полимерных материалов - горючесть./6/
1.3 Методы защиты от коррозии в растворе
В зависимости от характера коррозии и условий ее протекания применяются
различные методы защиты. Выбор того или иного способа определяется его
эффективностью в данном конкретном случае, а также экономической
целесообразностью.
Перед нанесением защитного покрытия необходимо тщательно подготовить
поверхность защищаемого металла: очистить от загрязнений, обезжирить,
протравить, а перед нанесением лакокрасочных покрытий - подвергнуть изделие
оксидированию или фосфатированию, затем изделие промывают теплой или холодной
водой и сушат.
Металлические защитные покрытия по полярности относительно защищаемого
металла делятся на катодные и анодные. Катодные металлические покрытия
относительно металла основы имеют в данной агрессивной среде более
положительный электродный потенциал. Анодные металлические покрытия - более
отрицательный электродный потенциал.
Катодные покрытия защищают металл только механически, так как при
частичном разрушении покрытия оголенные участки поверхности металла начинают
разрушаться. Анодные покрытия защищают металл механически и электрохимически,
так как даже при частичном разрушении покрытия оголенные участки поверхности,
являясь катодами, не разрушаются.
Для определения полярности металла покрытия относительно металла основы
измеряют их электродные потенциалы в данной агрессивной среде с помощью
милливольтметра pН-340.
Металлические защитные покрытия наносят различными способами:
. Погружение изделия в расплавленный металл. Металлическое изделие
погружают в расплавленный металл (Zn, Sn, Pb или А1) и после извлечения из
расплава охлаждают. Недостатками этого метода являются: перерасход металла
из-за образования более толстых, чем это необходимо для защиты от коррозии,
слоев покрытия; неравномерность толщины покрытия и вредные условия труда.
. Напыление металла. Металлическую проволоку расплавляют в металлизаторе
и потоком инертного газа наносят на металлическое изделие. Недостатком данного
метода является пористость получаемого покрытия. Для устранения пористости и
увеличения его защитных свойств применяют пропитку пористого слоя напыленного
металла маслом и смазками или окраску лакокрасочными материалами. Наиболее
часто этим способом наносят алюминий.
. Плакирование - это горячая прокатка двух или трех металлических листов,
один из которых является защищаемым. Этим методом получают защитные слои из
нержавеющих сталей. Разновидностью плакирования является другой метод нанесения
металлов - наварка коррозионностойкой стали на углеродистые стали. Порошок
нержавеющей стали, смешанный с флюсом, наносят на защищаемую поверхность и
наваривают металл с помощью электродугового сварочного аппарата. Этот метод
используют для защиты фланцев трубопроводов от щелевой коррозии.
4. Гальванический способ. Нанесение металла (Сu, Zn, Pb, Sn, Ni, Cr и
др.) или сплава (Cu-Zr, Cu-Sn, Cu-Pb, Sn-Ni, Fe-Ni-Cr и др.) производят в
электролитических ваннах (электролизерах). Покрываемое изделие подвешивается на
катодной штанге или ином приспособлении для крепежа и погружается в
электролизер. На катоде происходит процесс электролитического осаждения
металла. Кроме того, одновременно возможен процесс восстановления водорода,
поэтому часть электрического тока расходуется на эту побочную реакцию./5/
Легирование
Имеется способ уменьшения коррозии металлов, который строго нельзя
отнести к защите. Этим способом является получение сплавов, которое называется
легирование. В настоящее время создано большое число нержавеющих сталей путем
присадок к железу никеля, хрома, кобальта и др. Такие стали, действительно, не
покрываются ржавчиной, но их поверхностная коррозия имеет место, хотя и с малой
скоростью. Оказалось, что при использовании легирующих добавок коррозионная
стойкость меняется скачкообразно. Установлено правило, названное правилом
Таммана, согласно которому резкое повышение устойчивости к коррозии железа
наблюдается при введении легирующей добавки в количестве 1/8 атомной доли, то
есть один атом легирующей добавки приходится на восемь атомов железа.
Считается, что при таком соотношении атомов происходит их упорядоченное
расположение в кристаллической решетке твердого раствора, что и затрудняет
коррозию.
Сопротивление нержавеющей стали к коррозии напрямую зависит от содержания
хрома: при его содержании 13% и выше сплавы являются нержавеющими в обычных
условиях и в слабоагрессивных средах, более 17% - коррозионностойкими и в более
агрессивных окислительных и других средах./1/
В
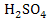
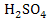 применяют
сложнолегированные сплавы с высоким содержанием Ni и присадками Mo, Cu, Si.
применяют
сложнолегированные сплавы с высоким содержанием Ni и присадками Mo, Cu, Si.
Электрохимическая
защита
В производственных условиях используют также электрохимический способ -
обработку изделий переменным током в растворе фосфата цинка при плотности тока
4 А/дм2 и напряжении 20 В и при температуре 60-700 С.
Фосфатные покрытия представляют собой сетку плотносцепленных с поверхностью
фосфатов металлов. Сами по себе фосфатные покрытия не обеспечивают надежной
коррозионной защиты. Преимущественно их используют как основу под окраску, обеспечивающую
хорошее сцепление краски с металлом. Кроме того, фосфатный слой уменьшает
коррозионные разрушения при образовании царапин или других дефектов./1/
Силикатные
покрытия
Для защиты металлов от коррозии используют стекловидные и фарфоровые
эмали, коэффициент теплового расширения которых должен быть близок к таковому
для покрываемых металлов. Эмалирование осуществляют нанесением на поверхность
изделий водной суспензии или сухим напудриванием. Вначале на очищенную
поверхность наносят грунтовочный слой и обжигают его в печи. Далее наносят слой
покровной эмали и обжиг повторяют. Наиболее распространены стекловидные эмали -
прозрачные или загашенные. Их компонентами являются SiO2 (основная масса), B2O3, Na2O, PbO. Кроме того, вводят вспомогательные
материалы: окислители органических примесей, оксиды, способствующие сцеплению
эмали с эмалируемой поверхностью, глушители, красители. Эмалирующий материал
получают сплавлением исходных компонентов, измельчением в порошок и добавлением
6-10% глины. Эмалевые покрытия в основном наносят на сталь, а также на чугун,
медь, латунь и алюминий.
Эмали обладают высокими защитными свойствами, которые обусловлены их
непроницаемостью для воды и воздуха (газов) даже при длительном контакте. Их
важным качеством является высокая стойкость при повышенных температурах. К
основным недостаткам эмалевых покрытий относят чувствительность к механическим
и термическим ударам. При длительной эксплуатации на поверхности эмалевых
покрытий может появиться сетка трещин, которая обеспечивает доступ влаги и
воздуха к металлу, вследствие чего и начинается коррозия./1/
Цементные
покрытия
Для защиты чугунных и стальных водяных труб от коррозии используют
цементные покрытия с добавлением в них жидкого стекла. Поскольку коэффициенты
теплового расширения портландцемента и стали близки, то он довольно широко
применяется для этих целей. Недостаток портландцементных покрытий тот же, что и
эмалевых, - высокая чувствительность к механическим ударам./1/
Покрытие
металлами
Широко распространенным способом защиты металлов от коррозии является
покрытие их слоем других металлов. Покрывающие металлы сами корродируют с малой
скоростью, так как покрываются плотной оксидной пленкой. Покрывающий слой
наносят различными методами:
·
горячее покрытие
- кратковременное погружение в ванну с расплавленным металлом;
·
гальваническое
покрытие - электроосаждение из водных растворов электролитов;
·
металлизация -
напыление;
·
диффузионное
покрытие - обработка порошками при повышенной температуре в специальном
барабане;
·
с помощью
газофазной реакции, например:
CrCl2 + 2Fe 1000 ‘ C 2FeCl3 + 3Cr (в расплаве с железом)
Имеются и другие методы нанесения металлических покрытий. Например,
разновидностью диффузионного способа является погружение изделий в расплав
хлорида кальция, в котором растворены наносимые металлы.
В производстве широко используется химическое нанесение металлических
покрытий на изделия. Процесс химического металлирования является каталитическим
или автокаталитическим, а катализатором является поверхность изделия. Используемый
раствор содержит соединение наносимого металла и восстановитель. Поскольку
катализатором является поверхность изделия, выделение металла и происходит
именно на ней, а не в объеме раствора. В настоящее время разработаны методы
химического покрытия металлических изделий никелем, кобальтом, железом,
палладием, платиной, медью, золотом, серебром, родием, рутением и некоторыми
сплавами на основе этих металлов. В качестве восстановителей используют
гипофосфит и боргидрид натрия, формальдегид, гидразин. Естественно, что
химическим никелированием можно наносить защитное покрытие не на любой металл.
Металлические покрытия делят на две группы:
·
коррозионностойкие;
·
протекторные.
Например, для покрытия сплавов на основе железа в первую группу входят
никель, серебро, медь, свинец, хром. Стоит отметить что для защиты металла в
кислой среде используют металлы именно первой группы, т.к. металлы, относящиеся
к группе протекторных относительно быстро растворяются. Вследствие чего не
обеспечивают требуемой защиты.
Металлические покрытия защищают железо от коррозии при сохранении
сплошности. При нарушении же покрывающего слоя коррозия изделия протекает даже
более интенсивно, чем без покрытия. Это объясняется работой гальванического
элемента железо-металл. Трещины и царапины заполняются влагой, в результате
чего образуются растворы, ионные процессы в которых облегчают протекание
электрохимического процесса (коррозии)./1/
Ингибиторы
Применение ингибиторов - один из самых эффективных способов борьбы с
коррозией металлов в различных агрессивных средах. Ингибиторы - это
вещества, способные в малых количествах замедлять протекание химических
процессов или останавливать их. Название ингибитор происходит от латинского
inhibere, что означает сдерживать, останавливать. Ещё по данным 1980 года,
число известных науке ингибиторов составило более пяти тысяч. Ингибиторы дают
народному хозяйству немалую экономию.
Ингибирующее воздействие на металлы, прежде всего на сталь, оказывает
целый ряд неорганических и органических веществ, которые часто добавляются в
среду, вызывающую коррозию. Ингибиторы имеют свойство создавать на поверхности
металла очень тонкую пленку, защищающую металл от коррозии.
Ингибиторы в соответствии с Х. Фишером можно сгруппировать следующим
образом.
) Экранирующие, то есть покрывающие поверхность металла тонкой
пленкой. Пленка образуется в результате поверхностной адсорбции. При
воздействии физических ингибиторов химических реакций не происходит
) Окислители (пассиваторы) типа хроматов, вызывающие образование на поверхности
металла плотно прилегающего защитного слоя окисей, которые замедляют протекание
анодного процесса. Эти слои не очень стойки и при определенных условиях могут
подвергаться восстановлению. Эффективность пассиваторов зависит от толщины
образующегося защитного слоя и его проводимости;
) Катодные - повышающие перенапряжение катодного процесса. Они замедляют
коррозию в растворах неокисляющих кислот. К таким ингибиторам относятся соли
или окислы мышьяка и висмута.
Эффективность действия ингибиторов зависит в основном от условий среды,
поэтому универсальных ингибиторов нет. Для их выбора требуется проведение
исследований и испытаний.
Наиболее часто применяются следующие ингибиторы: нитрит натрия,
добавляемый, например, к холодильным соляным растворам, фосфаты и силикаты
натрия, бихромат натрия, различные органические амины, сульфоокись бензила,
крахмал, танин и т. п. Поскольку ингибиторы со временем расходуются, они должны
добавляться в агрессивную среду периодически./4/ Количество ингибитора,
добавляемого в агрессивные среды, невелико. Например, нитрита натрия добавляют
в воду в количестве 0,01-0,05%.
Ингибиторы подбираются в зависимости от кислого или щелочного характера
среды. Например, часто применяемый в качестве ингибитора нитрит натрия может
использоваться в основном в щелочной среде и перестает быть эффективным даже в
слабокислых средах./1/
Применение противокоррозионных защитных покрытий
Для защиты оборудования и строительных конструкций от коррозии в
отечественной и зарубежной противокоррозионной технике применяется большой
ассортимент различных химически стойких материалов - листовые и пленочные
полимерные материалы, бипластмассы, стеклопластики, углеграфитовые,
керамические и другие неметаллические химически стойкие материалы.
В настоящее время расширяется применение полимерных материалов, благодаря
их ценным физико-химическим показателям, меньшему удельному весу и др.
Большой интерес для применения в противокоррозионной технике представляет
новый химически стойкий материал - шлакоситалл.
Значительные запасы и дешевизна исходного сырья - металлургических шлаков
- обусловливают экономическую эффективность производства и применения
шлакоситалла.
Шлакоситалл по физико-механическим показателям и химической стойкости не
уступает основным кислотоупорным материалам (керамике, каменному литью), широко
применяемым в противокоррозионной технике.
Среди многочисленных полимерных материалов, применяемых за рубежом в
противокоррозионной технике, значительное место занимают конструкционные
пластмассы, а также стеклопластики, получаемые на основе различных
синтетических смол и стекловолокнистых наполнителей.
В настоящее время химическая промышленность выпускает значительный
ассортимент материалов, обладающих высокой стойкостью к действию различных
агрессивных сред. Особое место среди этих материалов занимает полиэтилен. Он
инертен во многих кислотах, щелочах и растворителях, теплостоек до температуры
+ 7000 С и так далее.
Другими направлениями использования полиэтилена в качестве химически
стойкого материала являются порошкообразное напыление и дублирование
полиэтилена стеклотканью. Широкое применение полиэтиленовых покрытий
объясняется тем, что они, будучи одними из самых дешевых, образуют покрытия с
хорошими защитными свойствами. Покрытия легко наносятся на поверхность
различными способами, в том числе пневматическим и электростатическим
распылением.
Также в противокоррозионной технике особого внимания заслуживают
монолитные полы на основе синтетических смол. Высокая механическая прочность,
химическая стойкость, декоративный вид - все эти положительные качества делают
монолитные полы чрезвычайно перспективными.
Продукция лакокрасочной промышленности находит применение в различных
отраслях промышленности и строительства в качестве химически стойких покрытий.
Лакокрасочное пленочное покрытие, состоящее из последовательно наносимых на
поверхность слоев грунтовки, эмали и лака, применяют для противокоррозионной
защиты конструкций зданий и сооружений (ферм, ригелей, балок, колонн, стеновых
панелей), а также наружных и внутренних поверхностей емкостного
технологического оборудования, трубопроводов, газоходов, воздуховодов
вентиляционных систем, которые в процессе эксплуатации не подвергаются
механическим воздействиям твердых частиц, входящих в состав среды.
В последнее время большое внимание уделяется получению и применению
комбинированных покрытий, поскольку в ряде случаев использование традиционных
методов защиты является неэкономичным. В качестве комбинированных покрытий, как
правило, используется цинковое покрытие с последующей окраской. При этом
цинковое покрытие играет роль грунтовки.
Перспективно применение резин на основе бутилкаучука, которые отличаются
от резин на других основах повышенной химической стойкостью в кислотах и
щелочах, включая концентрированную азотную и серную кислоты. Высокая химическая
стойкость резин на основе бутилкаучука позволяет более широко применять их при
защите химической аппаратуры.
Данные способы находят широкое применение в промышленности в силу многих
своих преимуществ - уменьшения потерь материалов, увеличения толщины покрытия,
наносимого за один слой, уменьшения расхода растворителей, улучшение условий
производства окрасочных работ и т.д./3/
Грунтовки
и фосфатирование
Для большей надежности под лакокрасочный слой наносят грунтовки. Пигменты,
входящие в ее состав, также должны обладать ингибиторными свойствами. Проходя
через слой грунтовки, вода растворяет некоторое количество пигмента и
становится менее коррозионноактивной. Среди пигментов, рекомендуемых для
грунтов, наиболее эффективным признан свинцовый сурик Pb3O4.
Вместо грунтовки иногда проводят фосфатирование поверхности металла. Для
этого на чистую поверхность кистью или распылителем наносят растворы
ортофосфатов железа (III),
марганца (II) или цинка (II), содержащих и саму ортофосфорную кислоту H3PO4. В заводских условиях фосфатирование ведут при 99-970 С
в течение 30-90 минут. В образование фосфатного покрытия вносят вклад металл,
растворяющийся в фосфатирующейся смеси, и оставшиеся на его поверхности оксиды.
Для фосфатирования поверхности стальных изделий разработано несколько
различных препаратов. Большинство из них состоят из смеси фосфатов марганца и
железа. Возможно, наиболее распространенным препаратом является «мажеф» - смесь
дигидрофосфатов марганца Mn(H2PO4)2, железа Fe(H2PO4)2 и свободной фосфорной кислоты. Название
препарата состоит из первых букв компонентов смеси. По внешнему виду мажеф -
это мелкокристаллический порошок белого цвета с соотношением между марганцем и
железом от 10:1 до 15:1. Он состоит из 46-52% P2O5; не менее 14% Mn; 0,3-3% Fe. При фосфатировании мажефом стальное изделие помещается в
его раствор, нагретый примерно до ста градусов. В растворе происходит
растворение с поверхности железа с выделением водорода, а на поверхности
образуется плотный, прочный и малорастворимый в воде защитный слой фосфатов
марганца и железа серо-черного цвета. При достижении толщины слоя определенной
величины дальнейшее растворение железа прекращается. Пленка фосфатов защищает
поверхность изделия от атмосферных осадков, но мало эффективна от растворов
солей и даже слабых растворов кислот. Таким образом, фосфатная пленка может
служить лишь грунтом для последовательного нанесения органических защитных и
декоративных покрытий - лаков, красок, смол. Процесс фосфатирования длится
40-60 минут. Для его ускорения в раствор вводят 50-70 г/л нитрата цинка. В этом
случае время сокращается в 10-12 раз./1/
2. Выбор материала для изготовления емкости хранения
коррозия серная кислота сталь трубопровод
Данные:
Агрессивный
компонент: 

Концентрация
60%
Температура
40оС
Наличие
перемешивания +
Материалы,
рассмотренные в аналитическом обзоре стойки в данном растворе, но, к сожалению,
они не подходят для изготовления емкости хранения по некоторым причинам. К
примеру металлический тантал стоек в 
 если
температура раствора ниже 50оС, а цирконий в кипящей
если
температура раствора ниже 50оС, а цирконий в кипящей 
 при
концентрации до 70%, но данные материалы относительно дорогие и к тому же они
не используется в промышленности в чистом виде.
при
концентрации до 70%, но данные материалы относительно дорогие и к тому же они
не используется в промышленности в чистом виде.
Свинец
стоек в растворе 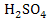
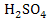 при
концентрации меньше 96% при комнатной температуре, но это тяжелый металл, очень
мягкий и пластичный (режется ножом) и его также не используют в чистом виде.
при
концентрации меньше 96% при комнатной температуре, но это тяжелый металл, очень
мягкий и пластичный (режется ножом) и его также не используют в чистом виде.
Различные
полимерные материалы на фоне рассмотренных металлов являются лучшими
материалами для изготовления емкости хранения. Основные их достоинства: низкая
стоимость, сравнительная простота, высокая производительность, малая
энергоемкость и малоотходность методов получения и переработки, невысокая
плотность, высокая стойкость к агрессивным средам, атмосферным и радиационным
воздействиям и ударным нагрузкам, низкая теплопроводность, хорошие адгезионные
свойства. Но в нашем случае для изготовления емкости объемом 10-20 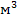
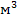 данные
материалы не совсем подходят, так как их главными недостатками являются:
большое тепловое расширение и склонность к ползучести, а это может привести к
деформации емкости.
данные
материалы не совсем подходят, так как их главными недостатками являются:
большое тепловое расширение и склонность к ползучести, а это может привести к
деформации емкости.
Поэтому
исходя из данного анализа, во избежание больших экономических затрат и для
большей надежности при хранении раствора 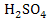
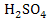 , емкость
для нее следует изготавливать из материалов рекомендуемых для изготовления
резервуаров:
, емкость
для нее следует изготавливать из материалов рекомендуемых для изготовления
резервуаров:
Сталь
09Г2С, Сталь09Г2ДТ, Сталь 30.
Исходя
из экономических и технологических требований, для изготовления резервуара
выбираем Сталь 30, так как она рекомендована ГОСТ 2184 - 77, и из
предоставленных она самая дешевая. /1/
Технические
характеристики Сталь 30:
Сталь
30 одна из самых распространенных конструкционных сталей, её широкое
применение и дешевизна позволяет легко изготовить резервуар при небольших
затратах. Работает в широком диапазоне температур, имеет высокие
технологические и конструкционные показатели.
Таблица 1. Химический состав
|
Химический элемент
|
%
|
|
Кремний (Si)
|
0.17-0.37
|
|
Медь (Cu), не более
|
0.25
|
|
Мышьяк (As), не более
|
0.08
|
|
Марганец (Mn)
|
0.50-0.80
|
|
Никель (Ni), не более
|
0.25
|
|
Фосфор (P), не более
|
0.035
|
|
Хром (Cr), не более
|
0.25
|
|
Сера (S), не более
|
0.04
|
Сталь
30 конструкционная сталь, не коррозионностойкая, поэтому для защиты емкости из
данного материала в растворе 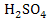
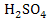 требуется
применить защитное покрытие.
требуется
применить защитное покрытие.
3. Выбор метода защиты
Для защиты от коррозии применяются различные методы защиты,
представленные в аналитическом обзоре, но некоторые из них не подходят в нашем
случае по ряду причин.
Например, покрытие поверхности металла лакокрасочным слоем не исключает
коррозию, а служит для нее преградой, а значит, лишь тормозит процесс коррозии.
Силикатные защитные покрытия (эмали) обладают высокими защитными
свойствами. Их важным качеством является высокая стойкость при повышенных
температурах, но основным недостатком эмалевых покрытий является чувствительность
к механическим и термическим ударам. При длительной эксплуатации на поверхности
эмалевых покрытий может появиться сетка трещин, которая обеспечивает доступ
агрессивной среды к металлу, вследствие чего и начинается коррозия. Таким же
недостатком обладают цементные покрытия.
Металлические коррозионностойкие покрытия защищают не коррозионностойкие
материалы при сохранении сплошности. При нарушении же покрывающего слоя
коррозия изделия протекает даже более интенсивно, чем без покрытия. К тому же
данный способ защиты является относительно дорогим.
В настоящее время химическая промышленность выпускает значительный
ассортимент материалов, обладающих высокой стойкостью к действию различных
агрессивных сред. Особое место среди этих материалов занимает полиэтилен. Он
инертен во многих кислотах, щелочах и растворителях, теплостоек до температуры
+ 7000 С.
Широкое
применение полиэтиленовых покрытий объясняется тем, что они, будучи одними из
самых дешевых, образуют покрытия с хорошими защитными свойствами. Покрытия
легко наносятся на поверхность различными способами, в том числе пневматическим
и электростатическим распылением. Поэтому емкость для хранения 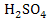
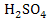 мы будем
покрывать полиэтиленом, в частности полиэтиленом низкого давления (ПНД).
мы будем
покрывать полиэтиленом, в частности полиэтиленом низкого давления (ПНД).
Данный
материал стоек в 60% -ном растворе 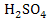
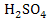 при
температуре 400 С.
при
температуре 400 С.
4.
Коррозия в почвах
Почвенная
коррозия - разрушение металла под воздействием агрессивной почвенной среды.
Этому виду коррозионного разрушения подвергаются металлы и конструкции,
находящиеся в почве, то есть различные подземные резервуары, трубопроводы,
сваи, кабеля и т. п.
Почва
и грунт представляют собой сложную природную среду, особенности которой надо
учитывать при рассмотрении протекающих в ней процессов коррозии.
Вода в грунте присутствует в виде связанной, капиллярной и
гравитационной. Связанная вода, входящая в состав гидратированных химических
соединений, не оказывает влияния на коррозию.
Высота подъема капиллярной влаги зависит от эффективного радиуса пор
грунта. Уровень грунтовых вод и пористость грунта определяют влажность, которая
влияет на скорость коррозии.
Гравитационная влага перемещается по грунту под действием силы тяжести и
также влияет на режим влажности почвы. Разные почвы по разному удерживают
влагу. Тяжелые, глинистые почвы удерживают влагу длительное время, песчаные
почвы - более проницаемы.
С увеличением влажности почвы ее коррозионная активность повышается до
тех пор. пока не достигнет некоторого критического уровня. В дальнейшем с
увеличением влажности ее активность падает. Это связывают с уменьшением доступа
кислорода, необходимого для осуществления катодной реакции.
Для каждого вида почвы существует свое значение критической влажности,
при которой коррозионные потери достигают максимума. Для глинистых почв это
значение лежит между 12 и 25%, для песчаных - между 10 и 20%.
При малой увлажненности почвы велики омические потери, что затрудняет
протекание электрохимических процессов. Значение рН для большинства почв
находится в границах рН - 6,0-7,5. Однако, встречаются также щелочные суглинки
и солончаки, имеющие значение рН = 7,5-9,5, и кислые, гумусовые и болотные
почвы с рН = 3,0-6,0. Такие почвы отличаются высокой агрессивностью.
Минерализация почвы может меняться в широких пределах - от 10 мг/л
до 300 мг/л, что тоже сказывается на скорости коррозии.
Минералогический и гранулометрический состав грунтов, так же как и
влажность, влияет на омическое сопротивление. Так, в сухом песчано-глинистом
грунте удельное сопротивление почвы составляет 240000 Ом-см, а во влажном
песчано-глинистом грунте - 900 Ом-см. Этот показатель также влияет на
агрессивность почвы. Ниже приведены данные, характеризующие взаимосвязь между
электросопротивлением и агрессивностью почвы (табл. 2)
Таблица 2. Зависимость коррозионной агрессивности грунта от
удельного сопротивления почвы
|
Удельное сопротивление,
Ом-см
|
<500
|
500-1000
|
1000-2000
|
2000-10000
|
>10000
|
|
Агрессивность грунта
|
Особо высокая
|
Высокая
|
Повышенная
|
Средняя
|
Низкая
|
Большое значение имеет воздухопроницаемость почв. Затруднение доступа
кислорода снижает скорость коррозии. По этой причине песчаные почвы часто более
агрессивны, чем глинистые. Если трубопровод пролегает последовательно в
глинистых и песчаных почвах, т.е. в условиях неравномерной аэрации, то
возникают микрогальванические коррозионные зоны: на глинистом участке -
анодная, на песчаном - катодная (рис. 2). Разрушение металла протекает на тех
участках, к которым затруднен доступ кислорода. Анодные и катодные участки
могут быть значительно удалены друг от друга. Расстояние между ними может
составлять несколько сотен метров.


Помимо равномерной коррозии подземные металлические сооружения подвержены
питтингу и коррозионному растрескиванию (КР). Питтинг возникает чаще всего на
нижней части трубопроводов, где имеется постоянный контакт с грунтом. КР
обнаруживают в катодно поляризованных трубопроводах в местах нарушения защитных
покрытий./4/
5. Способы защиты от подземной коррозии
Защита подземных трубопроводов от коррозии осуществляется как
изоляционным покрытием (пассивная защита), так и средствами электрохимической
защиты (активная защита).
5.1 Изоляционные покрытия трубопроводов
Изоляционные покрытия, применяемые на подземных магистральных
трубопроводах, должны удовлетворять следующим требованиям:
высокие диэлектрические свойства;
хорошая адгезия;
высокая механическая прочность и эластичность;
высокая биостойкость;
термостойкость;
простота конструкции покрытий;
недефицитность материалов;
Противокоррозионную защиту подземных трубопроводов осуществляют
покрытиями на основе:
полимерных материалов наносимых в заводских или базовых условиях;
материалов способных к термоусадке наносимых в базовых или трассовых
условиях
В период эксплуатации под воздействием различных факторов изоляционное
покрытие, а также при опуске и засыпке их грунтом возможны сквозные дефекты в
покрытиях. В период эксплуатации под воздействием различных факторов
изоляционное покрытие стареет, ранее образовавшиеся дефекты расширяются и
возникают новые. Скорость коррозии при этом в местах дефектов может достигать значительной
величины.
При наличии в изоляционном покрытии сквозных дефектов диаметром более 1
мм защищенность сооружения не будет равна 100%. Так как на стальных подземных
магистральных трубопроводах изоляционные покрытия всегда имеют сквозные
дефекты, возникшие в периоды строительства и эксплуатации, наряду с
изоляционными покрытиями при защите трубопроводов от коррозии применяются
средства электрохимзащиты./1/
5.2 Катодная защита трубопроводов
Электрохимическая защита от коррозии подземного трубопровода заключается
в катодной поляризации трубопровода, при степени поляризации МН равной - 0,85
mВ, скорость коррозии составляет 0,01 мм в год, что позволяет безаварийно
эксплуатировать МН в течении всего срока службы МН. Создание разности
потенциалов между трубопроводом и окружающим его грунтом осуществляется с
помощью внешнего источника тока (УКЗ) при подключении отрицательного полюса к
трубопроводу, а положительного полюса к заземлению (анод), расположенного в
стороне от трубопровода./1/
Область применения
Настоящий стандарт устанавливает общие требования к защите от коррозии
наружной поверхности подземных металлических сооружений (далее - сооружения):
трубопроводов и резервуаров (в том числе траншейного типа) из углеродистых и
низколегированных сталей, силовых кабелей напряжением до 10 кВ включительно;
кабелей связи и сигнализации в металлической оболочке, стальных конструкций
необслуживаемых усилительных (НУП) и регенерационных (НРП) пунктов линий связи,
а также требования к объектам, являющимся источниками блуждающих токов, в том
числе электрифицированному рельсовому транспорту, линиям передач постоянного
тока по системе "провод-земля", промышленным предприятиям,
потребляющим постоянный ток в технологических целях.
Стандарт не распространяется на следующие сооружения: кабели связи с
защитным покровом шлангового типа; железобетонные и чугунные сооружения;
коммуникации, прокладываемые в туннелях, зданиях и коллекторах; сваи, шпунты,
колонны и другие подобные металлические сооружения; магистральные трубопроводы,
транспортирующие природный газ, нефть, нефтепродукты, и отводы от них;
трубопроводы компрессорных, перекачивающих и насосных станций, нефтебаз и
головных сооружений нефтегазопромыслов; установки комплексной подготовки газа и
нефти; трубопроводы тепловых сетей с пенополиуретановой тепловой изоляцией и
трубой-оболочкой из жесткого полиэтилена (конструкция "труба в
трубе"), имеющие действующую систему оперативного дистанционного контроля
состояния изоляции трубопроводов; металлические сооружения, расположенные в
многолетнемерзлых грунтах.
Общие положения
1. Требования настоящего стандарта учитывают при проектировании,
строительстве, реконструкции, ремонте, эксплуатации подземных сооружений, а
также объектов, являющихся источниками блуждающих токов. Настоящий стандарт
является основанием для разработки нормативных документов (НД) по защите
конкретных видов подземных металлических сооружений и мероприятий по
ограничению блуждающих токов (токов утечки).
. Средства защиты от коррозии (материалы и конструкция покрытий, станции
катодной защиты, приборы контроля качества изоляционных покрытий и определения
опасности коррозии и эффективности противокоррозионной защиты) применяют только
соответствующие требованиям настоящего стандарта и имеющие сертификат
соответствия.
. При разработке проекта строительства сооружений одновременно
разрабатывают проект защиты их от коррозии.
Примечание - Для кабелей сигнализации, централизации и блокировки (СЦБ),
силовых и связи, применяемых на железной дороге, когда определить параметры электрохимической
защиты на стадии разработки проекта не представляется возможным, рабочие
чертежи электрохимической защиты допускается разрабатывать после прокладки
кабелей на основании данных по измерениям и пробным включениям защитных
устройств в сроки, установленные НД.
. Мероприятия по защите от коррозии строящихся, действующих и
реконструируемых сооружений предусматривают в проектах защиты в соответствии с
требованиями настоящего стандарта.
В проектах строительства и реконструкции сооружений, являющихся
источниками блуждающих токов, предусматривают мероприятия по ограничению токов
утечки.
. Все виды защиты от коррозии, предусмотренные проектом строительства,
принимают в эксплуатацию до сдачи в эксплуатацию сооружений. В процессе
строительства для подземных стальных газопроводов и резервуаров сжиженного газа
электрохимическую защиту вводят в действие в зонах опасного влияния блуждающих
токов не позднее одного месяца, а в остальных случаях - не позднее шести
месяцев после укладки сооружения в грунт; для сооружений связи - не позднее
шести месяцев после их укладки в грунт.
Не допускается ввод в эксплуатацию объектов, являющихся источниками
блуждающих токов, до проведения всех предусмотренных проектом мероприятий по
ограничению этих токов.
. Защиту сооружений от коррозии выполняют так, чтобы не ухудшить защиту
от электромагнитных влияний и ударов молнии.
. При эксплуатации сооружений систематически проводят контроль
эффективности противокоррозионной защиты и опасности коррозии, а также
регистрацию и анализ причин коррозионных повреждений.
. Работу по ремонту вышедших из строя установок электрохимической защиты
квалифицируют как аварийную.
. Сооружения оборудуют контрольно-измерительными пунктами (КИП).
Для контроля коррозионного состояния кабелей связи, проложенных в
кабельной канализации, используют смотровые устройства (колодцы)./7/
6. Расчет катодной защиты трубопровода
Данные:
Защитная
разность потенциалов 
 = 0,35
В,
= 0,35
В,
Толщина
стенки трубопровода (S) = 5 мм.,
Диаметр
трубопровода (D) = 400 мм.,
Сопротивление
изоляции (
 ) =
) = 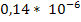
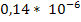 Ом*м.,
Ом*м.,
Удельное
сопротивление стали (
 ) = 0,18
мкОм*м.,
) = 0,18
мкОм*м.,
Длина
трубопровода (L) = 2000 км.,
Коэффициент
надежности (k) = 2,0
Расчет:
Плотность
защитного тока:
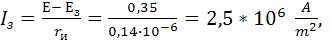
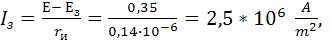
Минимальная
длина зоны покрытия:
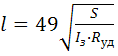
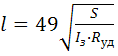 =
=
 =185,2
км,
=185,2
км,
Фактическая
длина:
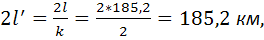
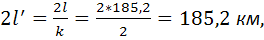
Требуемый ток одной станции:
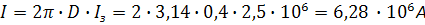
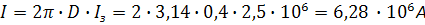 ,
,
Защитный
ток:


Количество
станций:


Заключение
В курсовой работе я рассмотрел сущность процесса коррозии металлов в 60%
серной кислоте при температуре 40 0С с перемешиванием. Провел
аналитический обзор механизма коррозии, коррозионностойких в данной среде
материалов, способов защиты некоррозионностойких материалов. Рассмотрел теорию
катодной защиты. Выбрал материал и способ его защиты для изготовления
резервуара объемом 10-20 м3 для хранения серной кислоты.
Материал: Сталь 30. Способ защиты: покрытие полимером ПНД
Был произведен расчет катодной защиты трубопровода длиной 2000 км.
Необходимое количество станций катодной защиты: 11
Список использованной литературы
1. Улиг
Г.Г., Реви Р.У. Коррозия и борьба с ней. - Л.: Химия, 1989.
2. И.А.
Кнуянц. Краткая химическая энциклопедия / Под ред. И.А. Кнуянц - М.: Советская
энциклопедия, 1961-1967.
. Никифоров
В.М. Технология металлов и конструкционные материалы. - М.: Высшая школа, 1980.
. Семенова
И.В., Флорианович Г.М., Хорошилов А.В. Коррозия и защита от коррозии /Под ред.
И.В. Семеновой. - М.: ФИЗМАТЛИТ, 2002
5. Клинов
И.Я. Коррозия химической аппаратуры и коррозионностойкие материалы - М.:
“Машиностроение”, 1967.
6. Техника
борьбы с коррозией: Пер. с пол. / Р. Юхневич, В. Богданович, Е. Валашковский и
др.; Под ред. А.М. Сухотина. - Л.: Химия. Ленингр. отд-ние, 1980.
7. ГОСТ
9.602-2005: Единая система защиты от коррозии и старения. Сооружения подземные.
Общие требования к защите от коррозии.
8. ГОСТ
2184 - 77. Сталь 30.