Анализ смеси фосфорной кислоты и дигидрофосфата натрия
ЛАБОРАТОРНАЯ
РАБОТА.
Анализ смеси
фосфорной кислоты и дигидрофосфата натрия.
Турнаева А.
Цель: рассчитать содержание
хлористоводородной и уксусной кислот при совместном присутствии методом
потенциометрического титрования.
Краткая теория: потенциометрические
методы основаны на измерении электродвижущих сил (ЭДС):
E = E1 - E2
где Е - электродвижущая сила; Е1
и Е2 - потенциалы электродов исследуемой цепи.
Потенциал электрода Е связан с
активностью и концентрацией веществ, участвующих в электродном процессе,
уравнением Нернста:


где Е?
- стандартный потенциал редокс-системы; R
- универсальная газовая постоянная; Т - абсолютная температура, К; F - постоянная Фарадея; n
- число электронов, принимающих участие в электродной реакции; аox, ared
- активности соответственно окисленной и восстановленной форм редокс-системы; [ox], [red] - их молярные
концентрации; 
 , - коэффициенты
активности.
, - коэффициенты
активности.
Потенциометрические
методы анализа подразделяются на прямую потенциометрию (ионометрию) и
потенциометрическое титрование.
Потенциометрическое
титрование основано на регистрации изменения потенциала индикаторного электрода
в процессе химической реакции между определяемым компонентом и титрантом.
Конечную точку титрования находят по скачку потенциала, отвечающему моменту
завершения реакции.
Методы
потенциометрического титрования классифицируют по:
1. по характеру протекающей
реакции (реакции кислотно-основного взаимодействия, реакции окисления -
восстановления, реакции осаждения и комплексообразования)
2. по способу изменения ЭДС
(компенсационные методы и методы титрования под током)
. по обработке результатов
К химическим реакциям, применяемым в
потенциометрическом титровании, предъявляют следующие требования:
. реакции должны протекать
строго количественно
2. равновесие основной
химической и индикаторной реакций должно устанавливаться быстро
. используемая реакция
требует подбора соответствующего электрода, реагирующего на изменение
концентрации определяемых или взаимодействующих с ним веществ
. в анализируемом растворе не
должны протекать побочные реакции
В отличие от прямой потенциометрии,
потенциометрическое титрование имеет ряд преимуществ:
§ позволяет
определить концентрацию проб с большой воспроизводимостью, особенно при высоких
концентрациях;
§ менее жесткие
требования к электроду в отношение стабильности, крутизны, и стандартного
потенциала;
§ титрованием можно
косвенно определять вещества, для которых отсутствуют ионоселективные
электроды;
§ позволяют измерить
концентрацию определяемого вещества в присутствии мешающих веществ;
§ результаты более
точны (чем при прямой потенциометрии)
Для нахождения конечной точки
титрования можно использовать несколько способов математической обработки
зависимости Е от объема добавленного титранта:
§ графический метод
нахождения точки перегиба интегральной кривой;
§ дифференциальный
метод
§ метод Грана
§ расчетный метод
Графический метод нахождения точки перегиба кривой. Результаты титрования
представляют в виде зависимости Е (рН) от объёма титранта V (интегральная кривая). Точка
перегиба на кривой отвечает конечной точке титрования (к. т. т). Для нахождения
точки перегиба проводят две параллельные касательные к пологим нижней и верхней
частям кривой. Расстояние между касательными делят пополам и проводя третью
прямую, параллельную касательным. Точка пересечения перпендикуляра, опущенного
из точки пересечения третьей прямой с графиком, на ось абсцисс дает объём
титранта, отвечающий к. т. т.
Дифференциальный метод. Более простым и точным способом нахождения к. т. т. является
графическое изображение зависимости величин первой производной от объёма
прибавленного титранта (дифференциальная кривая). В этом случае кривая имеет
пикообразную форму, максимум которой соответствует к. т. т. Перпендикуляр,
опущенный из точки пересечения двух восходящих ветвей кривой на ось абсцисс,
показывает объем титранта, затраченного на завершение реакции. Для более точного
нахождения к. т. т., особенно в случае несимметричности кривых титрования или
при малом скачке потенциала, следует воспользоваться второй производной. Для
нахождения к. т. т. по кривой зависимости второй производной от объёма
соединяют концы обеих ветвей кривой, которые находят по разные стороны оси
абсцисс. Точка пересечения полученной кривой с осью абсцисс дает объём
титранта, отвечающий к. т. т.
Метод Грана. Гран предложил простой и воспроизводимый способ нахождения к. т.
т. Экспериментальные данные преобразуют в функции, дающие линейную зависимость ∆V/∆E от объёма титранта. График
зависимости этих функций от объёма титранта представляет две пересекающиеся
прямые. Для каждого титрования рассчитывают две функции: одна пропорциональна
концентрации определяемого вещества и справедлива до точки эквивалентности,
другая - пропорциональна концентрации определяемого вещества и справедлива
после точки эквивалентности. До и после точки эквивалентности ∆V/∆E изменяется линейно с изменением
объёма. Поэтому экспериментальные данные выражаются в виде двух прямых линий,
которые пересекаются по оси объёма титранта, а тока пересечения соответствует
объёму в к. т. т.
Расчетный метод требует только экспериментальные данные. Объём соответствующий
точке эквивалентности лежит внутри интервала значений объёмов, где вторая
производная меняет знак.
Объём соответствующий достижению
точки эквивалентности равен
Vк.
т. т = V1
+ ∆V* ,
,
где V1 - объёма, соответствующий положительному значению  ,
V2 - объёма, соответствующий отрицательному значению
,
V2 - объёма, соответствующий отрицательному значению  ;
∆V = V2
- V1.
;
∆V = V2
- V1.
Для проведения
кислотно-основного титрования необходим индикаторный электрод, потенциал
которого реагирует на изменение концентрации ионов водорода.
В процессе
окислительно-восстановительного титрования обычно образуются растворимые
продукты, поэтому в качестве индикаторного можно использовать инертный
металлический электрод - платиновый.
Индикаторным электродом
при осадительном титровании галогенид - ионов раствором нитрата серебра служит
серебряный электрод.
Анализ смеси фосфорной
кислоты и дигидрофосфата натрия проводят титрованием стандартным раствором NaOH со стеклянным индикаторным электродом и хлорсеребряным электродом
сравнения. Метод основан на последовательной нейтрализации фосфорной кислоты по
двум ступеням диссоциации (два скачка потенциала на кривой титрования),
дигидрофосфат натрия нейтрализуется совместно с продуктом нейтрализации
фосфорной кbслоты по первой ступени (NaH PO):
H PO + NaOH→NaH PO
+ H O (1 скачок)
NaH PO + NaOH→Na HPO
+ H O (2 скачок)
NaH PO +NaOH→Na HPO
+ H O (2 скачок)
Приборы и реактивы:
1. Установка для
потенциометрического титрования.
2. Индикаторный электрод -
стеклянный.
. Электрод сравнения -
хлоридсеребряный.
4. NaOH, 0,1M, стандартный раствор.
. Анализируемый раствор:
смесь ≈0,01М растворов Н РО и NaH PO.
Ход работы:
Установка титра раствора щелочи.
Титр устанавливают
потенциометрическим титрованием 10 см3 0,1М раствора HCl. В стакан для
титрования вносим пипеткой 10 см3 0,1М раствора HCl, разбавляют водой до
объема 50 см3, опускают электроды, включают мешалку и проводят
ориентировочное титрование 0,1М раствора NaOH, прибавляя раствор
титранта порциями по 0,5 см3 и измеряя pH. Стоят график
зависимости pH от объема добавленного титранта и оценивают область скачка
титрования. Затем проводят точное титрование, приливая по 0,1 см3
щелочи в области скачка. Таким образом проводят 2 титрования.
Титрование контрольного раствора
смеси.
В стакан для титрования отбирают
аликвотную часть (10 см3) подготовленного контрольного раствора,
разбавляют 20-30 см3 воды, и опускают электроды и проводят
ориентировочное титрование, прибавляя раствор титранта по 0,5 см3.
При этом обнаруживают 2 скачка титрования: первый небольшой и второй более
четкий, соответствующий суммарному содержанию кислот. Затем проводят точное
титрование новой аликвотной порции в тех же условиях, прибавляя титрант вблизи
второго скачка по 0,1 см3, тем самым устанавливают объем раствора
реагента, соответствующий суммарному содержанию кислот V1.
Новую аликвотную часть контрольного
раствора помещают в стакан для титрования, добавляют 20-25 см3
ацетона, опускают электроды и проводят ориентировочное титрование, прибавляя
раствор титранта по 0,5 см3, наблюдая более резкое изменение pH в области первого
скачка. Затем выполняют точное титрование новой аликвотной части контрольного
раствора, прибавляя по 0,1 см3 титранта вблизи скачка pH, находя V2, соответствующий титрованию хлористоводородной кислоты.
Схема установки:

Рис 1. Установка для потенциометрического титрования.
Индикаторный электрод; 2 - электрод
сравнения; 3 - иономер; 4 - бюретка.
Результаты титрования:
потенциометрическое титрование
реактив смесь
Таблица 1.
Определение
титра раствора гидроксида натрия (1 точное титрование).
|
VT, см3
|
рН
|
∆рН
|
∆рН/∆V
|
∆2рН/∆V2
|
∆V/∆рН
|
|
0,00
|
2,02
|
|
|
|
|
|
0,50
|
2,08
|
0,06
|
0,12
|
|
8,33
|
|
1,00
|
2,13
|
0,05
|
0,1
|
-0,04
|
10,00
|
|
1,50
|
2,21
|
0,08
|
0,16
|
0,12
|
6,25
|
|
2,00
|
2,29
|
0,08
|
0,16
|
0
|
6,25
|
|
2,50
|
2,39
|
0,10
|
0,2
|
0,08
|
5,00
|
|
3,00
|
2,53
|
0,14
|
0,28
|
0,16
|
3,57
|
|
3,50
|
2,71
|
0,18
|
0,36
|
0,16
|
2,78
|
|
4,00
|
2,98
|
0,27
|
0,54
|
0,36
|
1,85
|
|
4,10
|
3,10
|
0,12
|
1,2
|
6,6
|
0,83
|
|
4, 20
|
3, 20
|
0,10
|
1
|
-2
|
1,00
|
|
4,30
|
3,33
|
0,13
|
1,3
|
3
|
0,77
|
|
4,40
|
3,51
|
0,18
|
1,8
|
5
|
0,56
|
|
4,50
|
4,09
|
0,58
|
5,8
|
40
|
0,17
|
|
4,60
|
6,56
|
2,47
|
24,7
|
189
|
0,04
|
|
4,70
|
8,86
|
2,30
|
23
|
-17
|
0,04
|
|
4,80
|
9,63
|
0,77
|
7,7
|
-153
|
0,13
|
|
4,90
|
10,06
|
0,43
|
4,3
|
-34
|
0,23
|
|
5,00
|
10,28
|
0,22
|
2,2
|
-21
|
0,45
|
|
5,50
|
10,71
|
0,43
|
0,86
|
-2,68
|
1,16
|
|
6,00
|
10,98
|
0,27
|
0,54
|
-0,64
|
1,85
|
|
6,50
|
11,12
|
0,14
|
0,28
|
-0,52
|
3,57
|
|
7,00
|
11,22
|
0,10
|
0,2
|
-0,16
|
5,00
|
|
7,50
|
11,28
|
0,06
|
0,12
|
-0,16
|
8,33
|
|
8,00
|
11,35
|
0,07
|
0,14
|
0,04
|
7,14
|
Таблица 2
Определение
титра раствора гидроксида натрия (2 точное титрование).
|
VT, см3
|
рН
|
∆рН
|
∆рН/∆V
|
∆2рН/∆V2
|
∆V/∆рН
|
|
0,00
|
2,03
|
|
|
|
|
|
0,50
|
2,09
|
0,06
|
0,12
|
|
8,33
|
|
1,00
|
2,15
|
0,06
|
0,12
|
0
|
8,33
|
|
1,50
|
2,22
|
0,07
|
0,14
|
0,04
|
7,14
|
|
2,00
|
2,31
|
0,09
|
0,18
|
0,08
|
5,56
|
|
2,50
|
2,41
|
0,10
|
0,2
|
0,04
|
5,00
|
|
3,00
|
2,54
|
0,13
|
0,26
|
0,12
|
3,85
|
|
3,50
|
2,72
|
0,18
|
0,36
|
0,2
|
2,78
|
|
4,00
|
3,00
|
0,28
|
0,56
|
0,4
|
1,79
|
|
4,10
|
3,08
|
0,08
|
0,8
|
2,4
|
1,25
|
|
4, 20
|
3,22
|
0,14
|
1,4
|
6
|
0,71
|
|
4,30
|
3,43
|
0,21
|
2,1
|
7
|
0,48
|
|
4,40
|
3,65
|
0,22
|
2,2
|
1
|
0,45
|
|
4,50
|
4,08
|
0,43
|
4,3
|
21
|
0,23
|
|
4,60
|
6,33
|
2,25
|
22,5
|
182
|
0,04
|
|
4,70
|
7,93
|
1,60
|
16
|
-65
|
0,06
|
|
4,80
|
9,43
|
1,50
|
15
|
-10
|
0,07
|
|
4,90
|
9,97
|
0,54
|
5,4
|
-96
|
0, 19
|
|
5,00
|
10,17
|
0, 20
|
2
|
-34
|
0,50
|
|
5,50
|
10,73
|
0,56
|
1,12
|
-1,76
|
0,89
|
|
6,00
|
10,98
|
0,25
|
0,5
|
-1,24
|
2,00
|
|
6,50
|
11,11
|
0,13
|
0,26
|
3,85
|
|
7,00
|
11,21
|
0,10
|
0,2
|
-0,12
|
5,00
|
|
7,50
|
11,30
|
0,09
|
0,18
|
-0,04
|
5,56
|
|
8,00
|
11,36
|
0,06
|
0,12
|
-0,12
|
8,33
|
Таблица 3
Определение титра
раствора гидроксида натрия (среднее значение).
|
VT, см3
|
рН
|
∆рН
|
∆рН/∆V
|
∆2рН/∆V2
|
∆V/∆рН
|
|
0,00
|
2,025
|
|
|
|
|
|
0,50
|
2,085
|
0,06
|
0,12
|
|
8,33
|
|
1,00
|
2,140
|
0,05
|
0,11
|
-0,02
|
9,09
|
|
1,50
|
2,215
|
0,08
|
0,15
|
0,08
|
6,67
|
|
2,00
|
2,300
|
0,09
|
0,17
|
0,04
|
5,88
|
|
2,50
|
2,400
|
0,10
|
0,2
|
0,06
|
5,00
|
|
3,00
|
2,535
|
0,14
|
0,27
|
0,14
|
3,70
|
|
3,50
|
2,715
|
0,18
|
0,36
|
0,18
|
2,78
|
|
4,00
|
2,990
|
0,28
|
0,55
|
0,38
|
1,82
|
|
4,10
|
3,090
|
0,10
|
1
|
4,5
|
1,00
|
|
4, 20
|
3,210
|
0,12
|
1,2
|
2
|
0,83
|
|
4,30
|
3,380
|
0,17
|
1,7
|
5
|
0,59
|
|
4,40
|
3,580
|
0, 20
|
2
|
3
|
0,50
|
|
4,50
|
4,085
|
0,51
|
5,05
|
30,5
|
0, 20
|
|
4,60
|
6,445
|
2,36
|
23,6
|
185,5
|
0,04
|
|
4,70
|
8,395
|
1,95
|
19,5
|
-41
|
0,05
|
|
4,80
|
9,530
|
1,14
|
11,35
|
-81,5
|
0,09
|
|
4,90
|
10,015
|
0,48
|
4,85
|
-65
|
0,21
|
|
5,00
|
10,225
|
0,21
|
2,1
|
-27,5
|
0,48
|
|
5,50
|
10,720
|
0,50
|
0,99
|
-2,22
|
1,01
|
|
6,00
|
10,980
|
0,26
|
0,52
|
-0,94
|
1,92
|
|
6,50
|
11,115
|
0,13
|
0,27
|
-0,5
|
3,70
|
|
7,00
|
11,215
|
0,10
|
0,2
|
-0,14
|
5,00
|
|
7,50
|
11,290
|
0,07
|
0,15
|
-0,1
|
6,67
|
|
8,00
|
11,355
|
0,07
|
0,13
|
-0,04
|
7,69
|
Таблица 4
Титрование
контрольного раствора смеси в воде (1 точное титрование)
|
VT, см3
|
рН
|
∆рН
|
∆рН/∆V
|
∆2рН/∆V2
|
∆V/∆рН
|
|
0,00
|
2,26
|
|
|
|
|
|
0,50
|
2,36
|
0,10
|
0, 20
|
|
5,00
|
|
1,00
|
2,49
|
0,13
|
0,26
|
0,06
|
3,85
|
|
1,50
|
2,69
|
0, 20
|
0,40
|
0,14
|
2,50
|
|
2,00
|
2,99
|
0,30
|
0,60
|
0, 20
|
1,67
|
|
2,50
|
3,41
|
0,42
|
0,84
|
0,24
|
1, 19
|
|
3,00
|
3,80
|
0,39
|
0,78
|
-0,06
|
1,28
|
|
3,50
|
4,04
|
0,24
|
0,48
|
-0,30
|
2,08
|
|
4,00
|
4,23
|
0, 19
|
0,38
|
-0,10
|
2,63
|
|
4,50
|
4,37
|
0,14
|
0,28
|
-0,10
|
3,57
|
|
5,00
|
4,52
|
0,15
|
0,30
|
0,02
|
3,33
|
|
5,50
|
4,65
|
0,13
|
0,26
|
-0,04
|
3,85
|
|
6,00
|
4,77
|
0,12
|
0,24
|
-0,02
|
4,17
|
|
6,50
|
4,90
|
0,13
|
0,26
|
0,02
|
3,85
|
|
7,00
|
5,04
|
0,14
|
0,28
|
0,02
|
3,57
|
|
7,50
|
5, 19
|
0,15
|
0,30
|
0,02
|
3,33
|
|
8,00
|
5,37
|
0,18
|
0,36
|
0,06
|
2,78
|
|
8,50
|
5,58
|
0,21
|
0,42
|
0,06
|
2,38
|
|
9,00
|
5,96
|
0,38
|
0,76
|
0,34
|
1,32
|
|
9,10
|
6,05
|
0,09
|
0,90
|
-2,90
|
1,11
|
|
9, 20
|
6,15
|
0,10
|
1,00
|
0,10
|
1,00
|
|
9,30
|
6,33
|
0,18
|
1,80
|
0,80
|
0,56
|
|
9,40
|
6,49
|
0,16
|
1,60
|
-0, 20
|
0,62
|
|
9,50
|
6,70
|
0,21
|
2,10
|
0,50
|
0,48
|
|
9,60
|
7,18
|
0,48
|
4,80
|
2,70
|
0,21
|
|
9,70
|
8,29
|
1,11
|
11,10
|
6,30
|
0,09
|
|
9,80
|
9,42
|
1,13
|
11,30
|
0, 20
|
0,09
|
|
9,90
|
9,66
|
0,24
|
2,40
|
-8,90
|
0,42
|
|
10,00
|
9,90
|
0,24
|
2,40
|
0,00
|
0,42
|
|
10,50
|
0,62
|
1,24
|
0,76
|
0,81
|
|
11,00
|
10,83
|
0,31
|
0,62
|
-0,62
|
1,61
|
|
11,50
|
11,02
|
0, 19
|
0,38
|
-0,24
|
2,63
|
|
12,00
|
11,13
|
0,11
|
0,22
|
-0,16
|
4,55
|
|
12,50
|
11,23
|
0,10
|
0, 20
|
-0,02
|
5,00
|
|
13,00
|
11,30
|
0,07
|
0,14
|
-0,06
|
7,14
|
|
13,50
|
11,36
|
0,06
|
0,12
|
-0,02
|
8,33
|
|
14,00
|
1,40
|
-9,96
|
-19,92
|
-20,04
|
-0,05
|
Таблица 5
Титрование
контрольного раствора смеси в воде (2 точное титрование)
|
VT, см3рН∆рН∆рН/∆V∆2рН/∆V2∆V/∆рН
|
|
|
|
|
|
|
0,00
|
2,28
|
|
|
|
|
|
0,50
|
2,39
|
0,11
|
0,22
|
|
4,55
|
|
1,00
|
2,52
|
0,13
|
0,26
|
0,04
|
3,85
|
|
1,50
|
2,71
|
0, 19
|
0,38
|
0,12
|
2,63
|
|
2,00
|
2,98
|
0,27
|
0,54
|
0,16
|
1,85
|
|
2,50
|
3,40
|
0,42
|
0,84
|
0,30
|
1, 19
|
|
3,00
|
3,80
|
0,40
|
0,80
|
-0,04
|
1,25
|
|
3,50
|
4,04
|
0,24
|
0,48
|
-0,32
|
2,08
|
|
4,00
|
4,24
|
0, 20
|
0,40
|
-0,08
|
2,50
|
|
4,50
|
4,39
|
0,15
|
0,30
|
-0,10
|
3,33
|
|
5,00
|
4,53
|
0,14
|
0,28
|
-0,02
|
3,57
|
|
5,50
|
4,66
|
0,13
|
0,26
|
-0,02
|
3,85
|
|
6,00
|
4,78
|
0,12
|
0,24
|
-0,02
|
4,17
|
|
6,50
|
4,92
|
0,14
|
0,28
|
0,04
|
3,57
|
|
7,00
|
5,05
|
0,13
|
0,26
|
-0,02
|
3,85
|
|
7,50
|
5, 20
|
0,15
|
0,30
|
0,04
|
3,33
|
|
8,00
|
5,38
|
0,18
|
0,36
|
0,06
|
2,78
|
|
8,50
|
5,62
|
0,24
|
0,48
|
0,12
|
2,08
|
|
9,00
|
5,95
|
0,33
|
0,66
|
0,18
|
1,52
|
|
9,10
|
6,10
|
0,15
|
1,50
|
-1,80
|
0,67
|
|
9, 20
|
6,22
|
0,12
|
1, 20
|
-0,30
|
0,83
|
|
9,30
|
6,40
|
0,18
|
1,80
|
0,60
|
0,56
|
|
9,40
|
6,61
|
0,21
|
2,10
|
0,30
|
0,48
|
|
9,50
|
6,80
|
0, 19
|
1,90
|
-0, 20
|
0,53
|
|
9,60
|
7,60
|
0,80
|
8,00
|
6,10
|
0,13
|
|
9,70
|
9,10
|
1,50
|
15,00
|
7,00
|
0,07
|
|
9,80
|
9,49
|
0,39
|
3,90
|
-11,10
|
0,26
|
|
9,90
|
9,72
|
0,23
|
2,30
|
-1,60
|
0,43
|
|
10,00
|
9,95
|
0,23
|
2,30
|
0,00
|
0,43
|
|
10,50
|
10,53
|
0,58
|
1,16
|
0,70
|
0,86
|
|
11,00
|
10,30
|
-0,23
|
-0,46
|
-1,62
|
-2,17
|
|
11,50
|
11,00
|
0,70
|
1,40
|
1,86
|
0,71
|
|
12,00
|
11,12
|
0,12
|
0,24
|
-1,16
|
4,17
|
|
12,50
|
11,21
|
0,09
|
0,18
|
-0,06
|
5,56
|
|
13,00
|
11,28
|
0,07
|
0,14
|
-0,04
|
7,14
|
|
13,50
|
11,34
|
0,06
|
0,12
|
-0,02
|
8,33
|
|
14,00
|
11,39
|
0,05
|
0,10
|
-0,02
|
10,00
|
Таблица 6
Титрование контрольного
раствора смеси в воде (среднее значение)
|
VT, см3
|
рН
|
∆рН
|
∆рН/∆V
|
∆2рН/∆V2
|
∆V/∆рН
|
|
0,00
|
2,270
|
|
|
|
|
|
0,50
|
2,375
|
0,11
|
0,21
|
|
4,76
|
|
1,00
|
2,505
|
0,13
|
0,26
|
0,05
|
3,85
|
|
1,50
|
2,700
|
0, 20
|
0,39
|
0,13
|
2,56
|
|
2,00
|
2,985
|
0,29
|
0,57
|
0,18
|
1,75
|
|
2,50
|
3,405
|
0,42
|
0,84
|
0,27
|
1, 19
|
|
3,00
|
3,800
|
0,40
|
0,79
|
-0,05
|
1,27
|
|
3,50
|
4,040
|
0,24
|
0,48
|
-0,31
|
2,08
|
|
4,00
|
4,235
|
0, 20
|
0,39
|
-0,09
|
2,56
|
|
4,50
|
4,380
|
0,15
|
0,29
|
-0,10
|
3,45
|
|
5,00
|
4,525
|
0,15
|
0,29
|
0,00
|
3,45
|
|
5,50
|
4,655
|
0,13
|
0,26
|
-0,03
|
3,85
|
|
6,00
|
4,775
|
0,12
|
0,24
|
-0,02
|
4,17
|
|
6,50
|
4,910
|
0,14
|
0,03
|
3,70
|
|
7,00
|
5,045
|
0,14
|
0,27
|
0,00
|
3,70
|
|
7,50
|
5, 195
|
0,15
|
0,30
|
0,03
|
3,33
|
|
8,00
|
5,375
|
0,18
|
0,36
|
0,06
|
2,78
|
|
8,50
|
5,600
|
0,23
|
0,45
|
0,09
|
2,22
|
|
9,00
|
5,955
|
0,36
|
0,71
|
0,26
|
1,41
|
|
9,10
|
6,075
|
0,12
|
1, 20
|
-2,35
|
0,83
|
|
9, 20
|
6,185
|
0,11
|
1,10
|
-0,10
|
0,91
|
|
9,30
|
6,365
|
0,18
|
1,80
|
0,70
|
0,56
|
|
9,40
|
6,550
|
0, 19
|
1,85
|
0,05
|
0,54
|
|
9,50
|
6,750
|
0, 20
|
2,00
|
0,15
|
0,50
|
|
9,60
|
7,390
|
0,64
|
6,40
|
4,40
|
0,16
|
|
9,70
|
8,695
|
1,31
|
13,05
|
6,65
|
0,08
|
|
9,80
|
9,455
|
0,76
|
7,60
|
-5,45
|
0,13
|
|
9,90
|
9,690
|
0,24
|
2,35
|
-5,25
|
0,43
|
|
10,00
|
9,925
|
0,23
|
2,35
|
0,00
|
0,43
|
|
10,50
|
10,525
|
0,60
|
1, 20
|
0,73
|
0,83
|
|
11,00
|
10,565
|
0,04
|
0,08
|
-1,12
|
12,50
|
|
11,50
|
11,010
|
0,44
|
0,89
|
0,81
|
1,12
|
|
12,00
|
11,125
|
0,12
|
0,23
|
-0,66
|
4,35
|
|
12,50
|
11,220
|
0,10
|
0, 19
|
-0,04
|
5,26
|
|
13,00
|
11,290
|
0,07
|
0,14
|
-0,05
|
7,14
|
|
13,50
|
11,350
|
0,06
|
0,12
|
-0,02
|
8,33
|
|
14,00
|
6,395
|
-4,96
|
-9,91
|
-10,03
|
-0,10
|
Таблица 7
Титрование
контрольного раствора смеси в водно-ацетоновой среде (1 точное титрование)
|
VT, см3
|
рН
|
∆рН
|
∆рН/∆V
|
∆2рН/∆V2
|
∆V/∆рН
|
|
0,00
|
1,72
|
|
|
|
|
|
0,50
|
1,85
|
0,13
|
0,26
|
|
3,85
|
|
1,00
|
2,02
|
0,17
|
0,34
|
0,08
|
2,94
|
|
1,50
|
2,23
|
0,21
|
0,42
|
0,08
|
2,38
|
|
1,60
|
2,30
|
0,07
|
0,70
|
-1,40
|
1,43
|
|
1,70
|
2,35
|
0,05
|
0,50
|
-0, 20
|
2,00
|
|
1,80
|
2,46
|
0,11
|
1,10
|
0,60
|
0,91
|
|
1,90
|
2,55
|
0,09
|
0,90
|
-0, 20
|
1,11
|
|
2,00
|
2,65
|
0,10
|
1,00
|
0,10
|
1,00
|
|
2,10
|
2,86
|
0,21
|
2,10
|
1,10
|
0,48
|
|
2, 20
|
3,00
|
0,14
|
1,40
|
-0,70
|
0,71
|
|
2,30
|
3,62
|
0,62
|
6, 20
|
4,80
|
0,16
|
|
2,40
|
5,05
|
1,43
|
14,30
|
8,10
|
0,07
|
|
2,50
|
5,51
|
0,46
|
4,60
|
-9,70
|
0,22
|
|
2,60
|
5,69
|
0,18
|
1,80
|
-2,80
|
0,56
|
|
2,70
|
5,90
|
0,21
|
2,10
|
0,30
|
0,48
|
|
2,80
|
6,00
|
0,10
|
1,00
|
-1,10
|
1,00
|
|
2,90
|
6,08
|
0,08
|
0,80
|
-0, 20
|
1,25
|
|
3,00
|
6,16
|
0,08
|
0,80
|
0,00
|
1,25
|
|
3,50
|
6,39
|
0,23
|
0,46
|
0,30
|
2,17
|
|
4,00
|
6,55
|
0,16
|
0,32
|
-0,14
|
3,13
|
|
4,50
|
6,68
|
0,13
|
0,26
|
-0,06
|
3,85
|
|
5,00
|
6,78
|
0,10
|
0, 20
|
-0,06
|
5,00
|
|
5,50
|
6,87
|
0,09
|
0,18
|
-0,02
|
5,56
|
|
6,00
|
6,96
|
0,09
|
0,18
|
0,00
|
5,56
|
Таблица 8
Титрование
контрольного раствора смеси в водно-ацетоновой среде (2 точное титрование)
|
VT, см3рН∆рН∆рН/∆V∆2рН/∆V2∆V/∆рН
|
|
|
|
|
|
|
0,00
|
1,72
|
|
|
|
|
|
0,50
|
1,87
|
0,15
|
0,30
|
|
3,33
|
|
1,00
|
2,02
|
0,15
|
0,30
|
0,00
|
3,33
|
|
1,50
|
2,25
|
0,23
|
0,46
|
0,16
|
2,17
|
|
1,60
|
2,31
|
0,06
|
0,60
|
-1,70
|
1,67
|
|
1,70
|
2,37
|
0,06
|
0,60
|
0,00
|
1,67
|
|
1,80
|
2,46
|
0,09
|
0,90
|
0,30
|
1,11
|
|
1,90
|
2,56
|
0,10
|
1,00
|
0,10
|
1,00
|
|
2,00
|
2,69
|
0,13
|
1,30
|
0,30
|
0,77
|
|
2,10
|
2,86
|
0,17
|
1,70
|
0,40
|
|
2, 20
|
3,09
|
0,23
|
2,30
|
0,60
|
0,43
|
|
2,30
|
3,83
|
0,74
|
7,40
|
5,10
|
0,14
|
|
2,40
|
5,13
|
1,30
|
13,00
|
5,60
|
0,08
|
|
2,50
|
5,54
|
0,41
|
4,10
|
-8,90
|
0,24
|
|
2,60
|
5,74
|
0, 20
|
2,00
|
-2,10
|
0,50
|
|
2,70
|
5,88
|
0,14
|
1,40
|
-0,60
|
0,71
|
|
2,80
|
6,00
|
0,12
|
1, 20
|
-0, 20
|
0,83
|
|
2,90
|
6,08
|
0,08
|
0,80
|
-0,40
|
1,25
|
|
3,00
|
6,15
|
0,07
|
0,70
|
-0,10
|
1,43
|
|
3,50
|
6,40
|
0,25
|
0,50
|
0,36
|
2,00
|
|
4,00
|
6,55
|
0,15
|
0,30
|
-0, 20
|
3,33
|
|
4,50
|
6,67
|
0,12
|
0,24
|
-0,06
|
4,17
|
|
5,00
|
6,77
|
0,10
|
0, 20
|
-0,04
|
5,00
|
|
5,50
|
6,86
|
0,09
|
0,18
|
-0,02
|
5,56
|
|
6,00
|
6,96
|
0,10
|
0, 20
|
0,02
|
5,00
|
Таблица 9
Титрование
контрольного раствора смеси в водно-ацетоновой среде (среднее значение)
|
VT, см3
|
рН
|
∆рН
|
∆рН/∆V
|
∆2рН/∆V2
|
∆V/∆рН
|
|
0,00
|
1,720
|
|
|
|
|
|
0,50
|
1,860
|
0,14
|
0,28
|
|
3,57
|
|
1,00
|
2,020
|
0,16
|
0,32
|
0,04
|
3,13
|
|
1,50
|
2,240
|
0,22
|
0,44
|
0,12
|
2,27
|
|
1,60
|
2,305
|
0,06
|
0,65
|
-1,55
|
1,54
|
|
1,70
|
2,360
|
0,06
|
0,55
|
-0,10
|
1,82
|
|
1,80
|
2,460
|
0,10
|
1,00
|
0,45
|
1,00
|
|
1,90
|
2,555
|
0,09
|
0,95
|
-0,05
|
1,05
|
|
2,00
|
2,670
|
0,12
|
1,15
|
0, 20
|
0,87
|
|
2,10
|
2,860
|
0, 19
|
1,90
|
0,75
|
0,53
|
|
2, 20
|
3,045
|
0, 19
|
1,85
|
-0,05
|
0,54
|
|
2,30
|
3,725
|
0,68
|
6,80
|
4,95
|
0,15
|
|
2,40
|
5,090
|
1,37
|
13,65
|
6,85
|
0,07
|
|
2,50
|
5,525
|
0,44
|
4,35
|
-9,30
|
0,23
|
|
2,60
|
5,715
|
0, 19
|
1,90
|
-2,45
|
0,53
|
|
2,70
|
5,890
|
0,18
|
1,75
|
-0,15
|
0,57
|
|
2,80
|
6,000
|
0,11
|
1,10
|
-0,65
|
0,91
|
|
2,90
|
6,080
|
0,08
|
0,80
|
-0,30
|
1,25
|
|
3,00
|
6,155
|
0,08
|
0,75
|
-0,05
|
1,33
|
|
3,50
|
6,395
|
0,24
|
0,48
|
0,33
|
2,08
|
|
4,00
|
6,550
|
0,16
|
0,31
|
-0,17
|
3,23
|
|
4,50
|
6,675
|
0,13
|
0,25
|
-0,06
|
4,00
|
|
5,00
|
6,775
|
0,10
|
0, 20
|
-0,05
|
5,00
|
|
5,50
|
6,865
|
0,09
|
0,18
|
-0,02
|
5,56
|
|
6,00
|
6,960
|
0,09
|
0, 19
|
0,01
|
5,26
|
Расчеты:
1. Определение титра NaOH.
V (NaOH) = 4,60 мл
2. Титрование смеси кислот в водной среде
V1 (NaOH) = 9,70мл
3. Титрование смеси кислот в водно-ацетоновой среде
V2 (NaOH) = 2,40 мл
Находим молярную концентрацию
эквивалента гидроксида натрия:


Находим содержание
соляной и уксусной кислот при совместном присутствии






Вывод: рассчитали
содержание хлористоводородной и уксусной кислот при совместном присутствии
методом потенциометрического титрования.

 ,
,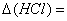 %;
%; 
 ,
, %
%