|
Приход
|
кг
|
%
|
Расход
|
кг
|
%
|
|
Глинозем
|
89,4
|
75,5
|
Алюминий
|
46,4
|
39,9
|
|
|
|
|
СО2
|
42,5
|
35,9
|
|
|
|
СО
|
18
|
15,2
|
|
Анодная масса
|
1,1
|
0,9
|
Потери:
|
|
|
|
|
|
Глинозем
|
1,8
|
1,5
|
|
|
|
Фтористые соли
|
1,1
|
0,9
|
|
Фтористые соли
|
27,9
|
23,6
|
Анодная масса
|
8,6
|
7,3
|
|
ИТОГО:
|
118,4
|
100
|
ИТОГО:
|
118,4
|
100
|
1.2 Конструктивный расчет
В задачу конструктивного расчета входит определение
основных размеров электролизера.
1.2.1 Анодное устройство электролизера
Площадь сечения анода Sа определяется по формуле:
,(15)
где I -
сила тока, А;
da- анодная плотность тока, А/см2
см2
Ширина анода Ва, см, для электролизёра С8БМ, принимаем 285 см.
Тогда длина анода La, см имеющего
прямоугольное сечение составит:
(16)
Расчёт штырей, с помощью которых ток подводится к телу анода,
осуществляется по силе тока и плотности тока в стальной части штыря принимаю
равной dш = 0,19 А/мм2.
Применяемые штыри имеют следующие размеры, мм:
общая длина - 2700
длина стальной части -1950
длина алюминиевой штанги - 1040
максимальный диаметр - 138
минимальный диаметр - 100
Площадь сечения всех штырей SО., мм2
определяются:
(17)
мм2
Штыри имеют форму усеченного конуса, поэтому расчёт ведём по среднему
диаметру.
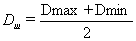 (18)
(18)
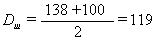 мм
мм
Площадь сечения одного штыря Sш, мм2 имеющего
круглое сечение составит:
(19)
мм2
где DШ - средний диаметр штыря, мм
Зная площадь сечения всех штырей и площадь сечения одного штыря можно
определить их количество, К:
(20)
Штыри на анодной раме располагаются в 4 ряда, поэтому принимаю их
количество 74 штуки.
1.2.2 Расчёт катодного устройства
Катодное устройство электролизёра предназначено для создания необходимых
условий для протекания процесса электролиза в криолитоглиноземном расплаве.
Катодное устройство состоит из стального сварного кожуха, теплоизоляционного
слоя и углеродистой футеровки, образующей шахту электролизёра.
Размеры шахты электролизёра
Внутренние размеры шахты электролизера рассчитывают исходя из длины анода
(формула 16) и принятых расстояний от анода до стенок боковой футеровки
(Рисунок 1). Для данного типа электролизёра установлено, что расстояние
от продольной стороны анода до футеровки, а = 65 см
от торца анода до футеровки, в = 55 см.
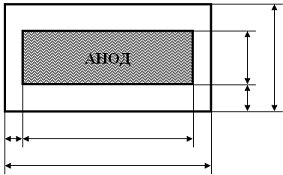
Рисунок 1 Схема анода и шахты электролизёра
Тогда длина Lш, см и ширина
Вш, см шахты определяются:
Lш =Lа + 2*в;(21)ш = 848 + 2 * 55 = 958 см
Вш = Ва + 2*а(22)
Вш = 285 + 2 * 65 = 415 см
Глубина шахты электролизёра С-8БМ равна 56,5 см.
Катодное устройство электролизёра имеет сборно-блочную подину, смонтированную
из коротких и длинных прошивных блоков вперевязку. Отечественная промышленность
выпускает катодные блоки высотой hб = 40 см , шириной bб = 50 см, и длиной l б от 110 до 400 см. При ширине шахты 415 см
применяют катодные блоки:
- короткие l кб = 160 см
длинные l дб = 220 см
Число секций в подине, Nс определяют исходя из длины шахты:
(23)
где bб - ширина подового блока;
с - ширина шва между блоками, 4 см.

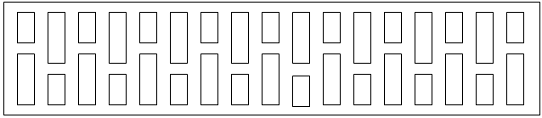
Рисунок 2 Схема подины электролизёра
Число катодных блоков Nб, равно:
Nб = Nс * 2 (24)б = 17* 2 =34
Подина данного электролизера монтируется из 34 катодных блоков, уложенных
по 17 штук в два ряда с перевязкой центрального шва.
Межблочные швы при монтаже подины набиваются подовой массой.
Для отвода тока от подины, в подовые блоки вставлены стальные катодные
стержни (блюмсы):
для блока 160 см длина блюмса 219 см;
для блока 220 см длина блюмса 279 см.
Ширина периферийных швов от подовых блоков до футеровки будет равна:
в торцах подины, bт,
т
= 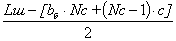 (25)
(25)
bт = 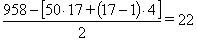 см
см
- по продольным сторонам, bп:
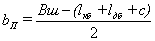
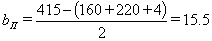 см
см
1.2.3 Размеры катодного кожуха
Внутренние размеры катодного кожуха определяются из рассчитанных ранее
размеров шахты электролизёра (формулы 21, 22) и толщины слоя теплоизоляционных
материалов.
Длина катодного кожуха Lк, см:
Lк =
Lш + 2 (Пу
+ 3,5),(27)
где: Lш - длина шахты, см;
Пу
- толщина угольной плиты,;
3,5 - толщина теплоизоляционной засыпки в торцах электролизёра, см.
Lк = 958 + 2 (20 + 3,5) = 1005
Ширина катодного кожуха Вк, см:
Вк = Вш +
2 (Пу + 5),(28)
где: Вщ - ширина шахты, см;
- толщина теплоизоляционной засыпки в продольных сторонах электролизёра,
см.
Вк = 415 + 2 (20+5) = 465
Футеровка днища катодного кожуха выполняется следующим образом (снизу -
вверх):
теплоизоляционная засыпка 3 см;
два ряда легковесного шамота или красного кирпича 2 6,5 см;
три ряда шамотного кирпича 3 6,5 см;
угольная подушка 3 см;
подовый блок 40 см.
Тогда высота катодного кожуха Нк, см будет:
Нк = 3 + 5* 6,5 + 3 + Нш + hб (29)
где: Нш - глубина шахты, см;
hб - высота подового блока, см.
Нк =3 + 5 * 6,5 + 3 + 56,5 +40 = 114см
Принимаем катодный кожух контрфорсного типа с днищем.
Число контрфорсов равно 20, по 10 с каждой продольной стороны. Стенки катодного
кожуха изготавливаются из листовой стали толщиной 10 мм, днище - 12мм.
Кожух снаружи укреплен поясами жесткости из
двутавровых балок или швеллеров.
1.3 Электрический баланс электролизёра
Электрический расчёт электролизера заключается в определении всех
составляющих падения напряжения на электролизёре, включая напряжение разложения
глинозёма и долю падения напряжения при анодных эффектах.
Среднее напряжение UСР.,В на электролизёре определяет общий
расход электроэнергии на производство алюминия и равно(В):
Uср = Ер + ∆Uа + ∆Uп + ∆Uаэ + ∆Uэл + ∆ Uо + ∆Uоо,(30)
где ЕР - напряжение разложении глинозема (или ЭДС поляризации)
1,5;
∆UА - падение напряжения в анодном устройстве,
∆UП - падение напряжения в подине,
∆UАЭ - доля увеличения напряжения при анодных эффектах,
∆UЭЛ - падение напряжения в электролите,
∆UО - падение напряжения в ошиновке электролизёра,
∆UОО - падение напряжения в общесерийной ошиновке.
1.3.1 Падение напряжения в анодном устройстве
Падение напряжения в анодном устройстве состоит из суммы падений
напряжения в ошиновке, контактах и теле анода. Для определения падения напряжения
в теле анода с верхним токоподводом пользуются уравнением, предложенным М.А.
Коробовым.
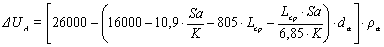 ,(31)
,(31)
где Sa - площадь анода,241539 см2;
К - количество токоподводящих штырей- 74
Lср -
среднее расстояние от подошвы анода до концов токоподводящих штырей, принимаем
в пределах 30 см.a - анодная плотность тока, 0,65 А/см2;
ρа -
удельное электросопротивление анода в интервале температур 750 -950 °С равно 8*10-3
Ом *см.
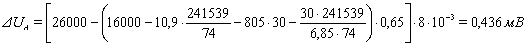
1.3.2 Падение напряжения в
подине
Падение напряжения в подине,
смонтированной из прошивных блоков, определяется по уравнению М.А. Коробова и
А.М. Цыплакова:
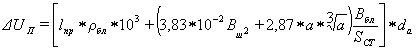 (32)
(32)
где lпр - приведенная длина пути тока- 28,4
см;
ρбл - удельное сопротивление прошивных
блоков принимаем 3,72 * 10-3 Ом *см.;
Вш - половина ширины шахты ванны 207,5, см;
Вбл - ширина катодного блока-54, см;
a - ширина настыли, равна расстоянию от продольной
стороны анода до боковой футеровки, 65 см;cт - площадь сечения
блюмса -377см2;a - анодная плотность тока-0,65 А/см2.
Приведенную длину пути тока
по блоку lпр, см
определяем по уравнению:
 (33)
(33)
где hбл - высота катодного блока;
hст - высота катодного стержня, 14,5 см;
Вст - ширина катодного стержня, 26 см
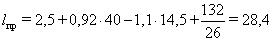 см
см
Ширина катодного блока с учетом набивного шва Вбл,см равна:
Вбл = bб + с,(34)
где bб - ширина подового блока;
с - ширина набивного шва между блоками.
Вбл = 50 + 4 = 54
Площадь сечения катодного стержня с учетом заделки равна:
Sст = hст * Вст
(35)ст = 14,5 * 26 = 377см2
Тогда падение напряжения в подине ∆UП, В составит (формула 32):
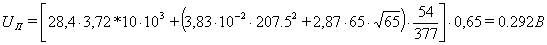
1.3.3 Доля падения напряжения от анодных эффектов
Величину падения напряжения от анодных эффектов ∆UАЭ, В определяем по формуле:
 (36)
(36)
где UАЭ - напряжение в момент анодного
эффекта, принимаем 30 В;- длительность анодного эффекта, принимаем 2 мин;
k -
частота анодного эффекта в сутки, принимаем 1;
- число минут в сутках.
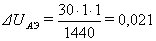 В
В
Падение напряжения в электролите, Uэл, В определяется по формуле Форсблома и Машовца:
 (37)
(37)
где I - сила тока, А; р - удельное
электросопротивление электролита, равно 0,53 Ом * см; l - междуполюсное расстояние, по
практическим данным принимаем 5,5 см; Sа -
площадь анода, см2; 2 (La + Вa) - периметр анода, см.
 В
В
1.3.4 Падение напряжения в ошиновке электролизёра
Падение напряжения в ошиновке электролизёра принимаем на основании
замеров на промышленных электролизерах: ∆UО = 0,3 В
Падение напряжения в общесерийной ошиновке
Падение напряжения в общесерийной ошиновке принимаем на основании
практических данных: ∆UОО = 0,016 В
Таблица 2 - Электрический баланс электролизера на силу тока 157 кА
|
Наименование участков
|
Ucp
|
Up
|
Uгр
|
|
Ер
|
1,5
|
1,5
|
1,5
|
|
UА
|
0,436
|
0,436
|
0,436
|
|
UП
|
0,292
|
0,292
|
0,292
|
|
UЭЛ
|
1,76
|
1,76
|
1,76
|
|
UАЭ
|
0,021
|
--
|
0,021
|
|
UО
|
0,3
|
0,3
|
0,3
|
|
UОО
|
0,016
|
--
|
--
|
|
Итого:
|
4,325
|
4,288
|
4,309
|
.4 Тепловой баланс электролизёра
Нормальная работа электролизёра возможна только при соблюдении теплового
равновесия, когда приход и расход тепла в единицу времени при установившемся
режиме электролиза становятся равными, т.е. Qпр = Qрасх
Приход тепла в электролизёр осуществляется от прохождения постоянного
электрического тока и от сгорания анодной массы
Тепловой баланс составляют применительно к определённой температуре:
окружающей среды или температуре протекания процесса. Обычно составляют баланс
при температуре 25С.
В этом случае уравнение теплового баланса можно представить в виде:
Qэл + Qан = QГ + Q Al + Qгаз + Qп,(38)
где Qэл - приход тепла от электроэнергии;
Qан -
приход тепла от сгорания анода;
QГ - расход тепла на разложение
глинозёма;
Q Al -
тепло, уносимое с вылитым металлом;
Qгаз - тепло, уносимое отходящими газами;
Qп -
потери тепла в окружающее пространство.
1.4.1 Расчет приход тепла
Приход тепла от прохождения электрического тока Qэл, кДж определяется по уравнению:
эл = 3600 * I * Uгр
* τ (39)
где 3600 - тепловой эквивалент 1 кВт*ч, кДж; I - сила тока, кА;
Uгр
- греющее
напряжение, В (из таблицы 2); τ
- время, часы.
эл = 3600 * 157 * 4,309 * 1 = 2435446.8 кДж
Приход тепла от сгорания угольного анода Qан, кДж определяется:
ан = Р1СО2 * ∆HTCO2 + Р1СО * HTCO (40)
где Р1СО2 и Р1СО - число
киломолей оксидов углерода; определяется по материальному балансу исходя из
формул (10 и 11);
∆НТСО2 и ∆НТСО
- тепловые эффекты реакций образования СО2 и СО из углерода и
кислорода при 25 ˚С (298 К):
∆H298СО2 = 394 070 кДж/кмоль
(41)
кмоль
(42)
Qан =
0.97* 394070 + 0,64∙* 110616=453042.1 кДж
1.4.2 Расход тепла
На разложение глинозема расходуется тепла QГ, кДж:
Г
= R1Г * ∆HTГ (43)
∆HTГ - тепловой эффект образования оксида алюминия при 25 ˚С
(298 К), равный 1676000 кДж/кмоль.
(44)
кмоль
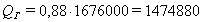 кДж
кДж
Потери тепла с выливаемым из ванны алюминием рассчитываются, исходя из
условия, что количество вылитого алюминия соответствует количеству
наработанного за то же время.
При температуре выливаемого алюминия 960 °С энтальпия алюминия ∆HT1Al составляет 43982 кДж/кмоль, а при 25
°С энтальпия алюминия ∆HT2Al равна 6716 кДж/кмоль. Отсюда потери тепла QAl, кДж с выливаемым алюминием
составят:
QAl = Р1Al * (∆HT1Al - ∆HT2Al) (45)
где Р1Al - количество наработанного алюминия, кмоль определяемое по формуле:
(46)
кмоль
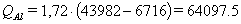 кДж
кДж
Унос тепла с газами при колокольной системе газоотсоса рассчитываем,
принимая, что разбавление газов за счет подсоса воздуха в систему отсутствует.
В этом случае ведем расчет на основные компоненты анодных газов - оксид и
диоксид углерода. Тогда унос тепла с газами Qгаз, кДж будет равен:
газ = Р1СО * ( HT1CO - HT2CO) + Р1СО2 * (HT1CO2 - HT2CO2), (47)
где Р1СО и Р1СО2 - количество
CO и CO2, кмоль
HT1CO -
энтальпия СО при температуре 550 °С, равна 24860 кДж/кмоль
HT2CO - энтальпия СО при температуре 25 °С, равна 8816 кДж/кмоль
HT1CO2 -
энтальпия СО2 при температуре 550 °С, равна 40488 кДж/кмоль
HT2CO2 -
энтальпия СО2 при температуре 25°С соответственно, 16446 кДж/кмоль
HT2CO2 -
энтальпия СО2 при температуре 25°С соответственно, 16446 кДж/кмоль
газ = 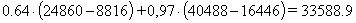 кДж
кДж
Потери тепла в окружающую среду определяются на основании законов
теплоотдачи конвекцией, излучением и теплопроводностью. Так как электролизер
представляет собой сложную систему, изготовленную из различных материалов, для
упрощения расчетов, потери тепла конструктивными элементами электролизёра QП,
кДж определяются по разности между приходом тепла и расходом по рассчитанным
статьям:
п = (Q эл + Qан) - (QГ + QAl + Qгаз) (48)
 кДж
кДж
Таблица 3 - Тепловой баланс электролизера на силу тока 157кА
|
Приход тепла
|
кДж
|
%
|
Расход тепла
|
кДж
|
%
|
|
От прохождения
электроэнергии
|
2435446,8
|
84,32
|
На разложение глинозёма
|
1474880
|
51,06
|
|
|
|
С вылитым металлом
|
64097,5
|
2,22
|
|
От сгорания угольного анода
|
453042,1
|
15,68
|
С отходящими газами
|
33588,9
|
1,16
|
|
|
|
Конструктивными элементами
и с поверхности электролизёра
|
1315922,5
|
45,56
|
|
ИТОГО
|
2888488,9
|
100
|
ИТОГО
|
2888488,9
|
100
|
.5 Расчёт цеха
В расчёт цеха входит определение числа рабочих электролизёров в серии,
число резервных электролизёров, общее число устанавливаемых электролизёров,
годовой выпуск алюминия-сырца одной серией и тремя сериями и удельный расход
электроэнергии.
Расчёт числа рабочих электролизёров определяется величиной среднего
напряжения на электролизёре и напряжением выпрямительных агрегатов, питающих
серию электролизёра. КПП обеспечивает серию
электролизёров, напряжением 850 В. Учитывается резерв напряжения 1% на
колебание во внешности сети, потери напряжения в шинопроводах и т.д.
Для подстанции на 850 В рабочее напряжение серии U, В составит:
U =
850 - (U1 + U2 + U3) (49)
U =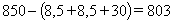 В
В
Число рабочих электролизеров N в серии составит:
, (50)
где U - напряжение серии U, В
UСР - среднее напряжение на
электролизере, В (из таблицы 2);
UАЭ- доля увеличения напряжения от
анодных эффектов, В (по формуле 36)
Для максимального использования возможностей преобразовательной
подстанции и обеспечения постоянства производительности серии, число
установленных в ней электролизеров NУ должно
быть больше, чем работающих, на число резервных электролизеров.
Количество резервных ванн NР рассчитывается исходя из
необходимости капитального ремонта электролизеров по формуле:
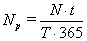 , (51)
, (51)
где N - число рабочих электролизёров в
серии; t - длительность простоя ванн в
ремонте, по практическим данным 6 дней; Т -
срок службы электролизёра, 4 года; 365 -
дней в году.

Принимаем 1 резервный электролизёр на серию, тогда в серии будет
установлено электролизеров Nу шт.:
у
= N + NР,(52)
где N - число установленных
электролизеров;
NР - число резервных электролизеров
у
= 187 +1 = 188
В 3 сериях будет 6 корпусов, в них установленных электролизёров, NУСТ:
УСТ = NУ * n(53)
NУСТ = 188 * 3 = 564
Годовая производительность серии Pс, т рассчитывается по формуле:
Pс = 0,335 * I * η * 8760 * N * 10-3 (54)
где 0,335 - электрохимический эквивалент, кг/(кА*ч);- сила
тока, кА;
η - выход по току, д. е.;
- часов в год;
N -
число работающих ванн в серии.
РС = 0,335 * 157000* 0,883 * 8760 * 187 = 76076,56 т
Годовая производительность цеха Рц, т будет:
Рц = Рс * n (55)
Рц = 76076,56 * 3 = 228229,68 т
Удельный расход электроэнергии W, кВт*ч/т рассчитывается по формуле:
 (56)
(56)
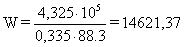 кВт*ч/т
кВт*ч/т
Выход по энергии г/кВт*ч
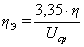 (57)
(57)
 г/(кВт*ч)
г/(кВт*ч)
2. Описательная часть
2.1 Поведение примесей при электролизе
В процессе электролиза содержание примесей относительно постоянно и
изменяется во времени на незначительную величину, как и содержание добавок к
электролиту. Введение различных добавок в промышленные электролиты необходимо
для снижения температуры его плавления и улучшения его других физико-химических
свойств. Отрицательным свойством всех добавок и примесей является значительное
снижение растворимости глинозема в электролите, что осложняет обслуживание
электролизеров.
Вместе с исходными материалами - глинозёмом, фтористыми солями, золой
анодов, а также вследствие разрушения отдельных элементов ванны в электролит
попадают примеси: Na2O, CaO, SiO2, TiO2, H2O,
соединения железа и другие.
Ведут они себя при электролизе по-разному. Одни из них вызывают
загрязнение получаемого металла, другие вступают в химическое взаимодействие с
криолитом. При этом изменяется состав электролита и образуются фтористые
газообразные соединения, что вызывает потери фтора и загрязнение атмосферы
цеха.
1) Na2O попадает в электролит с глинозёмом и фторсолями, в
результате электролит обогащается фтористым натрием и нарушается криолитовое отношение
2Na3AlF6+3Na2O=12NaF+Al2O3
2)CaO тоже попадает с глинозёмом и фторсолями, химически взаимодействует
с криолитом
2Na3AlF6+3CaO=6NaF+Al2O3+3CaF2
Появляется фтористый кальций. Так как он вводится специально для
улучшения свойств электролита, то небольшая примесь окисей кальция не считается
вредной
3) SiO2 попадает с глинозёмом, фторсолями и золой анода.
Действие:
а) металлотермически восстанавливается алюминием. Восстановленный кремний
переходит в жидкий алюминий и загрязняет его:
3SiO2+4Al=3Si +2Al2O3
б) образует карбид
Карбид кремния образовавшийся в результате реакций:
SiO2+Al4C3=2Al2O3+3SiC
или+C=SiC
откладывается на подине электролизёра, увеличивая её омическое
сопротивление.
в) химически взаимодействует с криолитом
3SiO2 + 4Na3AlF6 = ↑3SiF4 + 12NaF + 2Al2O3
Образовавшийся четырёхфтористый кремний обладает высокой упругостью паров
и улетучивается из ванны, вызывая потери фтора и обогащение электролита
фтористым натрием (увеличивается КО).
) TiO2 появляется в электролите с глинозёмом. Действие:
а) металлотермически восстанавливается алюминием
3TiO2+4Al=3Ti+2Al2O3
восстановленный титан загрязняет алюминий
б) химически взаимодействует с криолитом
TiO2+4Na3AlF6= ↑3TiF4+2Al2O3+12NaF
Образовавшийся четырёхфтористый титан улетучивается из ванны, вызывая
потери фтора и обогащение электролита фтористым натрием.
) H2O наиболее вредная примесь попадаетс глинозёмом и
фторсолями, поэтому их засыпают на корку, где они подсушиваются и
подогреваются. Действие:
а) химическое взаимодействие с криолитом. Электролит обогащается
фтористым натрием. Выделяется газообразный фтористый водород, который отравляет
атмосферу цеха и вызывает потери фтора.
2Na3AlF6 +3H2O = 6NaF+Al2O3
+ ↑6HF
б) электролитическое разложение. На катоде выделяется водород,
растворяется в катодном металле и загрязняет его
) Сульфаты (в виде сульфата натрия) попадают с глинозёмом и фторсолями,
химически взаимодействуя с криолитом в присутствии углерода. Влияние:
электролит обогащается фтористым натрием и выделяется вредный сернистый газ в атмосферу
Na2SO4+2Na3AlF6+3C=12NaF+3CO+
↑3SO2+Al2O3
7) Fe (в виде окислов Fe2O3, FeO) попадает в
электролит со всеми видами сырья, в результате растворения рабочего инструмента
и отдельных элементов ванны. Металлотермически восстанавливается алюминием и полностью
переходит в катодный алюминий, загрязняя его.
8) Cu, Zn попадают в электролит со всеми видами сырья при зачистке
контактов ошиновки ванны. Они более электроположительны, чем алюминий, поэтому
восстанавливаются алюминием и переходят в расплавленный металл, загрязняя его.
9) Окислы Р, V, Мn (P2O5, V2O5
и др) попадают с глинозёмом, и металлотермически восстанавливаются алюминием.
На восстановление этих многовалентных элементов расходуется электричество, что
снижает выход по току алюминия. Восстановленные ванадий и марганец переходят в
алюминий, загрязняя его. Восстановленный фосфор улетучивается из электролизера
в атмосферу корпуса.
Таким образом, практически все примеси, попадающие в электролит,
оказывают отрицательное влияние на процесс электролиза. Это заставляет
предъявлять очень высокие требования к чистоте исходных материалов и тщательно
соблюдать технологию, чтобы не допустить попадания примесей в электролит и
металл.
2.2 Атомно-эмиссионный спектральный анализ
Атомно-эмиссионным спектральным анализом называется метод определения
химического состава, основанный на изучении атомных спектров вещества,
возбуждаемых в горячих источниках света. Спектр-излучение, разложенное по
длинам волн, заключает в себе информацию о качественном и количественном составах
анализируемого объекта.
На металлургических предприятиях до 70% всех анализов проводят этим
методом. Такое широкое распространение атомно-эмиссионного анализа обусловлено
его универсальностью, возможностью определения многих элементов одновременно, высокой
чувствительностью. Современные варианты спектрального анализа имеют хорошие
метрологические характеристики. Этот метод позволяет определять до 80
элементов. При анализе расходуются очень малые количества вещества.
В качестве стандартного спектра чаще всего используют спектр железа,
имеющий характерные группы линий в разных областях длин волн. Спектр железа
является удобной шкалой длин волн в видимой и ультрафиолетовой областях
спектра. Для анализа алюминия небольшие содержания железа очень важны, так как
улучшают марку.
Определение длин волн спектральных линий при решении вопросов
качественного анализа ведется с помощью приборов, называемых спектрографами. В
большинстве спектрометрических методов концентрацию определяемого элемента
устанавливают путем сравнения интенсивности спектральных линий исследуемой
пробы и стандартных образцов с известным содержанием этого элемента.
С аналитической точки зрения очень важным является вопрос о влиянии
сопутствующих элементов на интенсивность аналитических линий определяемого
элемента.
2.3 Безопасность труда в ЦЗЛ
Создание здоровых и безопасных условий труда, его облегчение, является
главной задачей руководства завода. Вопросы охраны труда, охватывают ряд
правовых, организационных и технических задач. Все они направлены на улучшение
технико-экономические показатели алюминиевой промышленности, значительно
облегчить и обезопасить труд рабочих, что способствует значительному снижению
производственному травматизму и профзаболеваниям. Также большое внимание
уделяют мерам пожарной безопасности. Так как в алюминиевом производстве
основные технологические процессы сопровождаются горячими расплавами
электролита, алюминия и сплавов на его основе. По мимо этого на заводе много
различного оборудования работающего на повышенном напряжении. Хранятся и
используются горюче-смазочные материалы.
Общие требования пожарной безопасности в зданиях лабораторий ЦЗЛ
обязательна для исполнения всем персоналом лабораторий, прибывшими на
производственное обучение или практику учащимися и студентами, временными
работниками и работниками сторонних организаций, выполняющих по договору
подряда.
Каждый вновь принятый на предприятие работник, а также учащиеся и
студенты, прибывшие на производственное обучение или практику, обязаны пройти
вводный инструктаж по пожарной безопасности, первичный инструктаж по пожарной
безопасности на рабочем месте по "Инструкции о мерах пожарной безопасности
ИПБ 2-2002", "Инструкции о мерах пожарной безопасности ЦЗЛ".
Отметка о прохождении первичного инструктажа делается должностным лицом,
проводившим инструктаж, в личной карточке рабочего либо в "Журнале учета
инструктажей по пожарной безопасности" при проведении инструктажа с ИТР.
3. Организационно - экономическая часть
3.1 Организационная структура проектируемого цеха
Данный курсовой проект предусматривает расчёт оборудования электролизного
цеха, состоящего из трех серий. В результате расчета были получены следующие
данные. Для реализации проекта понадобится 564 электролизера с самообжигающимся
анодом и верхним токоподводом. Тогда в каждой серии разместится по 188
электролизёров. Рабочих электролизеров в этом цехе 561, число ванн, подлежащих
капитальному ремонту 3
При силе тока 157 кА и выходе по току 88,3 % выход алюминия- сырца на
одну ванну в сутки составляет 1,1136 тонн.
В трех сериях за год выпуск алюминия- сырца составляет 228229,68 тонн.
Среднее напряжение на один электролизёр с верхним токоподводом составляет 4,325
В. Удельный расход электроэнергии составляет 14621,37 кВт*ч /т.
.2 Расчет производственной программы
На основании расчётных данных производственная часть приведена таблице 4.
Таблица 4 Показатели цеха.
|
Показатели
|
Формула
|
Цифровое значение
|
|
Число установленных
электролизёров, шт.
|
NУСТ
|
564
|
|
Число ванн подлежащих
капитальному ремонту, шт.
|

|
141
|
|
Длительность простоя одной
ванны в капитальном ремонте, дней
|
t
|
6
|
|
Длительность планового
ремонта, дней
|
T
|
365
|
|
Число электролизёров в
ремонте, шт.
|

|
3
|
|
Число рабочих
электролизёров, шт.
|
N = NУ - Nр
|
561
|
|
Сила тока, А
|
I
|
157000
|
|
Выход по току, %
|
η
|
88,3
|
|
Выход на ванну, т/сутки
|
m
|
1113,6
|
|
Среднее напряжение, В
|
Uср
|
4,325
|
|
Удельный расход
электроэнергии, кВт*ч/т
|
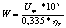
|
14621,37
|
|
Количество алюминия 3
серий, т/год
|
M = N*m*T
|
228229,68
|
Список использованных источников
. Троицкий И.А. Железнов В.А. 2-е издание, дополненное и
переработанное Металлургия алюминия. М.: Металлургия - 1984 .
. Минцис М.Я., Поляков П.В. Электрометаллургия алюминия. -
Новосибирск: Наука, 2001
. Сушков А.И., Троицкий И. А. Металлургия алюминия. - М.:
Металлургия - 1965.
. Янко Э.А. Производство алюминия в элекролизерах с верхним
токоподводом. - М.: Металлургия - 1976.
. Деев П.З. техника безопасности в производстве алюминия. -
М.: - Металлургия - 1978.
. Инструкция по охране труда для работающих в подразделениях
ОАО "КрАЗ", ИОТ №1-04, ОАО "КрАЗ", 2004.
. Инструкция о мерах пожарной безопасности ЦЗЛ.
. Технико-экономический вестник "Русского
алюминия", №12, сентябрь 1998
9. Сборник нормативных документов по ОТ и ТБ ОАО КрАЗ