Проводимость реакционных смесей WO3 и Al2O3 различной степени дисперсности
Реферат
Проведен анализ литературы по
получению наноразмерных порошков оксидов. Осуществлен синтез наноразмерного
оксида алюминия Al2O3. Полученные вещества
были аттестованы рентгенофазовым анализом.
Морфология использованных оксидов
исследована методами измерения удельной поверхности образцов, гранулометрии и
оптической микроскопии.
Также было проведено исследование
реакционной способности смесей оксидов в различной степени дисперсности,
методом измерения проводимости. Были исследованы смеси, состоящие из
реактивного оксида вольфрама и полученного оксида алюминия.
Введение
Современный технологический прогресс
тесно связан с получением новых твердых конструкционных материалов со
специфическими магнитными, электрическими, механическими, оптическими и др.
свойствами. Использование химии в решении задачи создания функциональных
материалов (электролитов, катализаторов, лазерных материалов,
сегнетоэлектриков, ферритов, конденсаторных материалов, люминофоров и др.) во
многом основано на тонком регулировании протекания твердофазных химических
реакций. Сильное влияние на их протекание оказывают т.н. размерные эффекты [1].
Современный уровень физических и химических методов получения новых
функциональных материалов допускает создание структур, размер которых становится
соизмеримым с масштабом того или иного явления или характерной длиной
какого-либо процесса переноса.
При получении и эксплуатации изделий
из разнообразных неорганических материалов важную роль играет межфазный перенос
заряда и массы по границам, поскольку большинство этих изделий представляют
собой системы с развитой внутренней поверхностью (керамика, поликристаллические
пленки, композиты). Тем не менее, процессы межфазного переноса остаются
малоизученной областью физикохимии поверхности. Существующие представления по
сути дела приспосабливают традиционную концепцию «объемного» переноса
посредством точечных дефектов к граничным условиям.
Естественно было ожидать, что данный
пробел в последнее время будет восполнен в результате интенсивных исследований наноразмерных
систем и материалов, выполненных с привлечением современных физических методов.
Особые строение и свойства малых атомных агрегаций представляют значительный
научный и прикладной интерес, так как они являются промежуточными между
изолированными атомами и массивным (объемным) твердым телом. Однако вопрос о
том, как быстро нарастает и на каком этапе объединения атомов завершается
формирование того или иного свойства массивного кристалла, до сих пор не решен.
Не вполне ясно, каковы вклады поверхностных (связанных с границами раздела) и
объемных (связанных с размером частиц) эффектов в свойства наноматериалов и как
они могут быть разделены. Длительное время исследования в этом направлении
проводились на изолированных кластерах, содержащих от двух атомов до нескольких
сотен, малых частиц с размером более 1 нм и ультрадисперсных порошках. Переход
от свойств изолированных наночастиц к свойствам массивных кристаллических
веществ оставался белым пятном, так как отсутствовало промежуточное звено -
компактное твердое тело с зернами нанометрового размера. Лишь после 1985 года,
когда были созданы методы получения компактных нанокристаллических веществ,
началось интенсивное заполнение отмеченного пробела в знаниях о твердом теле.
Однако большинство работ в данной
области посвящено структуре и строению наноматериалов, реорганизации
электронной подсистемы и поведению макродефектов; вопросы механизма межфазных
явлений переноса и реакций в них не рассмотрены, прекрасной иллюстрацией тому
служит недавняя обзорная работа [2].
С другой стороны, твердофазные
системы типа керамик и поликристаллов, особенно наноразмерные, во многом
аналогичны связнодисперсным (капиллярно-пористым) системам, традиционно
изучаемым коллоидной химией. Известно, что процессы переноса в них своеобразны
по внешним проявлениям; микромеханизм явлений исключительно сложен и во многом
определяется параметрами двойного электрического слоя, существующего на
межфазных границах. Важно, что двойной слой возникает и при контакте твердых
фаз, различающихся хотя бы величиной проводимости. В связи с этим,
«коллоидно-химические» представления о граничных транспортных процессах могли
бы быть, по крайней мере, полезными для систем «твердое| твердое» и «твердое
|газ».
Природа поверхностного
взаимодействия, состав и свойства возникающих систем, вероятно, зависят от
природы и энергетики химической связи в контактирующих фазах и безусловно
должны влиять на реакционную способность и механизм реакций с участием
нанопорошков оксидов. Этот аспект в литературе не рассмотрен и составил одну из
задач настоящей работы.
1.
Литературный обзор
1.1 Электрохимический
подход к изучению твердофазных реакций
Систематическая разработка
теоретических и экспериментальных аспектов концепции электрохимического подхода
к реакциям синтеза сложных ионных соединений и межфазным транспортным процессам
была начата с работ [3, 4]. Применение данного подхода к ряду «классических»
твердофазных реакций с участием ковалентно-ионных оксидов привело к
определенному прорыву, качественному скачку, поскольку был обнаружен ряд ранее
неизвестных эффектов. Полученные результаты сделали необходимым переосмысление
некоторых важных общепринятых представлений, поставили ряд вопросов, не имеющих
на сегодняшний день ответа. Прежде чем перейти к их обзору, вкратце напомним
узловые моменты данного подхода.
1.1.1 Основные идеи
Согласно определению,
электрохимические реакции характеризуются (а) пространственным
разделением исходных компонентов и (б) переносом и взаимодействием
заряженных частиц. Очевидно, что реакции между оксидами типа
AOm+BOn®ABOm+n (1)
также удовлетворяют критерию
электрохимического процесса. Поэтому, если (1) проводить в модельной
электрохимической ячейке
Pt½AOm½BOn½Pt, (2)
трансформирующуйся в ходе
взаимодействия в ячейку
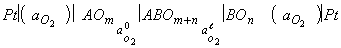 , (3)
, (3)
то появляется возможность
реализовать следующие принципиальные методики:
·
(а) исследовать отклик системы (1) на воздействие внешнего
электрического поля (тока);
·
(б) изучить «внутреннее» электрическое поле -
разность потенциалов, самопроизвольно генерируемую в ячейке (3) при протекании
реакции;
·
(в) исследовать свойства продукта, границ раздела и
параметров реакционной цепи in situ.
Ячейка (3) состоит из
двух оксидных электродов - PtЅAOm Ѕ
ABO m+n и PtЅBOnЅABOm+n,
роль электролита выполняет продукт реакции. Символ 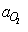 относится
к активности кислорода в окружающей газовой фазе,
относится
к активности кислорода в окружающей газовой фазе,  ,
,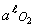 -
к границам «оксид / продукт».
-
к границам «оксид / продукт».
Если реакция (1)
реализуется, например, путем переноса компонентов оксида BOn к AOm и протекает в диффузионном режиме,
контролируемом переносом компонента «В», то скорость роста продукта
описывается выражением
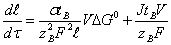 (4)
(4)
где l
- толщина продукта, t
- время, V - мольный объём продукта, DG°-энергия
Гиббса реакции (1), s
- проводимость продукта, tB - число переноса носителей лимитирующих скорость
реакции (1), J - плотность тока [4,5]. Позднее, аналогичное уравнение
(но учитывающее падение потенциала во всей ячейке (3), а не только в слое
продукта, как в нашем случае) было получено Шмальцридом [6]. На основе
соотношения (4) получены уравнения кинетики роста слоя продукта для различных
потенциально-токовых режимов [3-5, 7]:
- (а) при постоянном значении
разности потенциалов, U, приложенной к слою продукта (U = const ≠f
(t))
 , (5)
, (5)
или
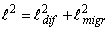 (6)
(6)
где 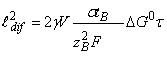 и
и
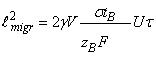 отражают
рост слоя за счёт доставки диффузанта под действием химического и
электрического полей, соответственно.
отражают
рост слоя за счёт доставки диффузанта под действием химического и
электрического полей, соответственно.
·
(б) при постоянстве плотности тока в реакционной цепи (J
= const)
 (7)
(7)
где
С1  ,
С2
,
С2 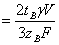 ,
С3 =
,
С3 = 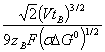 , (7’)
, (7’)
или
ℓ ≈ ℓdif
+ℓ migr, (8)
где С1-С3
- константы, определяемые свойствами продукта (проводимость, числа переноса,
плотность, молекулярная масса и др).
Для величины реакционной разности
потенциалов, спонтанно генерируемой в реакционной цепи, получено соотношение
[8]
 течения (9)
течения (9)
Как видно, значение Ur
определяется термодинамическими параметрами реакции, значениями 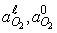 на
фазовых границах и транспортными свойствами продукта (величина и соотношение
чисел переноса), но не зависит от свойств исходных оксидов. Полярность Ur
зависит от доминирующего направления диффузии катионов и соотношения значений
на
фазовых границах и транспортными свойствами продукта (величина и соотношение
чисел переноса), но не зависит от свойств исходных оксидов. Полярность Ur
зависит от доминирующего направления диффузии катионов и соотношения значений 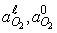 .
.
Важным, неклассическим,
элементом соотношения (8) является член Uтечения - потенциал
течения, генерируемый при спонтанном твердофазном растекании одного из исходных
оксидов по поверхности партнера или продукта реакции [9].
Обширный ряд различных реакций был
изучен с использованием нового подхода. Среди них синтез соединений на основе
оксидов алюминия [4], ванадия [9,10], висмута [10,11], ниобия [12], молибдена и
вольфрама [3-5].
Однако только для процессов синтеза
О2--твердого электролита Bi2WO6 [10], Na+
- электролита Na-b,b» - Al2O3 [4] и смешанного Li-e-проводника
LiNbO3 [8,12] экспериментальные данные удовлетворяли приведенным
соотношениям (4) - (8).
В то же время применение новой
методологии к реакциям образования сложных соединений, протекающих за счет
диффузии ковалентно-ионных оксидов MoO3, WO3, V2O5,
Nb2O5 и Bi2O3, характеризуемых
невысокой поверхностной энергией, позволило обнаружить следующие необычные
факты:
·
аномально сильное, не согласующееся с теорией ионного переноса,
влияние электрического поля - скорость этих взаимодействий может быть изменена
на три порядка при воздействии слабого электрического поля (E £ 10-1 В/см) или
слабого тока (J £10-3 А/см2) [4,6,7,11,16];
·
радикальное изменение химизма реакций - природы образующихся продуктов
- в указанных выше условиях [11,13];
·
немонотонный, экстремальный ход зависимости скорости реакции от
плотности тока или напряжения, подаваемого на реакционную ячейку
[4,5,9,10,13-15];
·
нефарадеевское поведение реакций в электрическом поле - при
синтезе PbMoO4 кажущийся выход по току достигает 10 000%, а ZnMoO4
- 4 000% [3-5];
·
изменение адгезионных свойств реакционных границ в электрическом
поле, что приводит к изменению места локализации продукта взаимодействия
[7,11,14];
·
существенное влияние пористости подложки и формирующегося на ней
продукта реакции на скорость реакции и на эффективность влияния электрического
поля [3,5];
·
самопроизвольное обогащение поверхности продукта реакции
диффузантом - концентрация Mo и W в поверхностном слое в 1,5 - 2 раза выше, чем
в объеме [4,7,15];
·
индуцированное полем втягивание (течение) WO3 на
внутреннюю поверхность керамики CaWO4 и других вольфраматов (в
направлении положительного электрода) с образованием двухфазного композита,
содержащего до 10 мол.% WO3 [6,16,17];
·
резкое влияние поля на синтез электронных проводников с высокой
проводимостью, формирующихся при реакции между MoO3 и V2O5
[9,13].
В данных экспериментах мы имеем дело
с новым типом твердофазных транспортных и реакционных процессов - электроповерхностными
явлениями, которые ранее наблюдались исключительно в связнодисперсных
(капиллярно-пористых) коллоидных системах типа «твердое / жидкость». Отметим,
что в данном случае термин «электроповерхностные явления» используется в
расширительном аспекте [18], включая явления как термодинамического, так и
кинетического плана.
1.1.2 Природа новых
движущих сил для систем с многозарядными катионами
Очевидно, что модель механизма
процесса должна учитывать как термодинамический, так и кинетический аспекты явления.
Возможен подход, согласно которому
аномальные реакционные и транспортные процессы следует рассматривать не как
обычную миграцию в поле, а как процессы, индуцированные электрическим полем
[19].
Модель твердофазной
электрокапиллярости постулирует основную
роль термодинамического аспекта электроповерхностных явлений. Базовые посылки
модели таковы.
(а) В результате процесса типа
А+В → АВ, (10)
на границе А½В образуется поверхностная фаза с доминирующей ионной
проводимостью, состав которой условно обозначен как АВ-s. Резкое различие
величины и характера проводимости АВ-s и А приводит к формированию на их
границе двойного электрического слоя (dl), одна обкладка которого находится в «АВ-s-электролите», другая -
в полупроводящем электроде (В).
a = - q dj (11)
где q - удельный поверхностный заряд, a
- удельная поверхностная энергия. Уравнение (11) может быть интерпретировано
следующим образом: упругая энергия заряжения границы переходит в поверхностную
химическую энергию. Тогда, рассматривая a как свободную
поверхностную энергию, можно записать (Р, Т = const):
a = Smis ni, (12)
где
mis = (∂a/∂ni)P,T,nj (13)
Здесь mis и ni - химический поверхностный потенциал и число
молей i-го компонента, соответственно. Из уравнений (12) и (13) следует, что
как межфазная энергия, так и химический потенциал поверхностного компонента могут
меняться при наложении разности электрических потенциалов.
Это может приводить к ряду важных следствий. Известно, что
движущая сила спонтанного втягивания В вглубь керамики А (которое
сопровождается одновременным образованием фазы АВ-s) может быть выражена как
[3,4,16,20]
DGs = a АВ-s + a
АВ-s/А - aА (14)
Если ak = f(j), то величины и соотношение межфазных энергий могут меняться,
приводя к увеличению химической движущей силы поверхностного переноса В. Таким
образом, увеличение DGs может приводить к стимулированному полем втягиванию
оксида.
Микроскопическая картина явления электрокапиллярности не всегда
очевидна даже в классической ситуации Hg-электрода, погруженного в раствор
индифферентного электролита. Если система электрод / электролит состоит из твердых
тел, то заметить и интерпретировать механизм эффекта изменения межфазной
энергии тем более трудно.
В данной модели течение нейтрального В вглубь керамики А, так же
как и аномальные явления, при синтезе молибдатов и вольфраматов в электрическом
поле, представляются процессами, индуцированными электрическим полем. Поэтому
анализ экспериментальных данных на подчинение закону Фарадея обнаруживает
нефарадеевское поведение процессов
Модель твердофазной электроосмотической миграции
постулирует основную роль кинетического аспекта электроповерхностных явлений. В
соответствии с этой моделью основной маршрут переноса В проходит по границе
типа «А½АВ-s».
Предполагается, что обкладка dl, расположенная в фазе АВ-s, состоит из
двух частей - плотной, с линейным падением потенциала (слой Гельмгольца) и
диффузной (слой Гуи). При наложении поля (пропускании тока), подвижные ионы
(комплексы), находящиеся в диффузной части двигаются к противоположно
заряженному электроду и форетически увлекают диффузант, перенося его вглубь
керамической подложки. В коллоидной химии данное электрохимическое явление
называют электроосмосом. Электроосмотическая миграция всегда имеет
нефарадеевский характер, поскольку каждая заряженная частица увлекает большое
число «молекул» диффузанта. По нашему мнению, именно этот механизм является
основным при осуществлении химических реакций с участием ковалентно-ионных
оксидов в электрическом поле.
Имеющихся на сегодня данных явно недостаточно для более детального
описания механизма и выбора реальных моделей. Однако ряд независимых
экспериментальных наблюдений подтверждает предполагаемую физическую картину
[19].
Так, если перенос диффузанта (WO3, MoO3, V2O5)
происходит вдоль заряженных границ и ускоряется в электрическом поле, то
спонтанное распространение WO3 или MoO3 (в ходе
реакционного или безреакционного процесса) в соответствии с принципом
взаимности Онзагера, должно сопровождаться генерацией разности потенциалов.
Действительно, при втягивании WO3 в CaWO4, так же как и в
ходе спонтанно протекающих реакций с участием WO3, MoO3,
V2O5, всегда фиксируется потенциал поверхностного
распространения Uтечения [8]. Cходные по картине явления
твердофазного распространения и кристаллизации высокотемпературных оксидов In2O3,
Ga2O3, Cr2O3 по монокристаллам Al2O3
и ZrO2(Y2O3) [21,22] подтверждают описанный
выше механизм и указывают на значительную распространенность указанных явлений.
Другой концептуально важный аспект - единство природы и физической
картины явлений, наблюдающихся на межфазных границах в конденсированных
системах любого типа, от классических коллоидов до твердофазных неметаллических
нанокомпозитов. Именно от приложения развиваемого подхода к системам последнего
типа мы ждем качественного скачка, как в понимании природы описанных явлений,
так и решении ряда перспективных прикладных задач.
Вероятно, использование представлений о явления Ребиндера,
самопроизвольного диспергирования и капиллярной сверхпроводимости в коллоидных
системах [18], как и признание образования поверхностных фаз, позволит дать
качественно верную картину генезиса явления композитной (дисперсоидной) ионной
проводимости, механизм которой на сегодня не имеет разумного физико-химического
толкования.
1.2 Свойства оксида
вольфрама (VI) и оксида индия и оксида алюминия
Оксид вольфрама (VI) имеет структуру ReO3. Для WO3 характерны чрезвычайно
сложные полиморфные превращения, в интервале от -50 до 900 оС у него
наблюдается не менее восьми фазовых переходов. Все модификации представляют
собой искажённые варианты кубической структуры ReO3: моноклинная(I) -40 C триклинная 17 С моноклинная
(II)
330 C ромбическая 740 С тетрагональная900
С кубическая.
Атом металла смещен из центра
октаэдра О6 и это приводит к разбросу в расстояниях W-O в интервале 1,7-2 A. Характерной чертой данных структур
является чередование длинных и коротких связей вдоль направления осей.
Практически не растворим в воде
(0,02 г./л) и минеральных кислотах (кроме плавиковой кислоты). При растворении
трёхокиси вольфрама в избытке растворов щелочей или карбонатов щелочных
металлов получают вольфраматы общей формулы Ме2WО4* nН2О [23].
Оксид вольфрама (VI) представляет собой
зеленоватые кристаллы с плотностью 7,3 г/см3 при 21°С; т. пл.
1470°С, т. кип. 1850°С. Заметно возгоняется выше 800°С.
Трехокись вольфрама - типичный
полупроводник n-типа с дефектной кислородной подрешеткой. При прокаливании оксида
вольфрама, он приобретает темно-зелёный цвет.
Оксид алюминия (глинозём) Al2O3 это бесцветные кристаллы; т. пл. 2044°С; т. кип. 3530°С.
Единственная стабильная до 2044°С кристаллическая модификация оксида алюминия-α-А12О3 (корунд):
решетка ромбоэдрическая; плотность 3,99 г./см3. Корунд может быть
получен искусственно в результате термического разложения ромбической
модификации А1ООН-диаспора или полиморфного перехода метастабильной формы γ-А12О3,
которые образуются при разложении кристаллических модификаций А1 (ОН)3-гиббсита
и байерита, и АlOОН-бемита. Оксид алюминия не растворим в воде, хорошо
растворим в расплавленном криолите. Амфотерен. Корунд на воздухе при обычных
условиях химически инертнен и негигроскопичен. Около 1000°С интенсивно
взаимодействует с щелочами и карбонатами щелочных металлов, давая алюминаты.
[24]
1.3 Размерные эффекты в
наноструктурированных системах
Особенности свойств нанодисперсных
материалов.
Известно, что физические и
химические свойства твердых веществ изменяются при уменьшении размера частиц,
подобные явления обычно классифицируют как размерные эффекты. Теоретическому и
экспериментальному исследованию размерных эффектов посвящено много работ,
имеется ряд обзоров по данной теме. [25,26]. К настоящему времени показано, что
размерный эффект является общей закономерностью, присущей твердым веществам,
предложены феноменологические модели, описывающие эффект на количественном или
полуколичественном уровне. Наиболее основательно этот эффект изучался в
металлах, в меньшей - в ионных кристаллах. Во многих веществах размерный эффект
начинает проявляться в области относительно больших размеров зерен: например,
коэффициенты диффузии. Проводимость и механические свойства зависят от размера
зерен, L, уже при L ~ 1000 - 10000 нм. При уменьшении L до 10 - 100 нм происходит
уменьшение температуры плавления, наблюдается изменение параметра
кристаллической решетки вещества. Наиболее ярко размерный эффект выражен в
нанодисперсных системах с характерным размером частиц порядка 1-10 нм. В этом
случае может произойти кардинальное изменение физических свойств, например,
вещество может перейти в высокотемпературную фазу или иное высокоэнергетическое
состояние, не реализующееся в данном соединении при обычных условиях.
В гетерогенных системах размерные
эффекты зависят от дополнительных факторов: химической природы компонентов
гетерогенной смеси, морфологии частиц, т.е. пространственного распределения
компонентов в композите, и межфазного поверхностного взаимодействия между
компонентами. В связи со сложностью учета этих факторов, до сих пор не
предложено удовлетворительного теоретического описания размерного эффекта в
композитах. Как и в чистых веществах, наиболее сильные изменения свойств наблюдаются
в нанокомпозитах - гетерогенных системах со средним размером частиц обеих фаз
менее 10-100 нм. В последние годы резко усилился интерес к изучению нелбычных
эффектов, наблюдающихся в наноразмерных системах. И это неудивительно, так как
процессы, протекающие в таких системах, лежат в основе будущих твердотельных
нанотехнологий.
Химические реакции в твердофазных
смесях до сих пор остаются наименее изученной областью химии твердого тела. Во
многом это связано с недостаточным учетом специфики мелких частиц, участвующих
или образующихся в химическом процессе. На стадии зародышеобразования
реакционная система может оказаться нанокомпозитом, в котором свойства
реагентов могут существенно отличаться от равновесных.
Размерные эффекты можно условно
разделить на два типа [27]:
) слабые (тривиальные по Майеру)
эффекты, когда при увеличении удельной поверхности (или уменьшении размера
частиц) физико-химические свойства вещества изменяются не сильно, а все
наблюдаемые изменения можно объяснить влиянием поверхностных эффектов на общие
свойства кристалла. Как правило, указанные эффекты наблюдаются в кристаллах
размерами более 5 - 10 нм.
) сильные (истинные по Майеру)
эффекты, когда наблюдается кардинальные изменения свойств вещества, которые
невозможно интерпретировать в рамках теории поверхностных явлений. Обычно такие
эффекты наблюдаются в очень малых частицах, размер которых не превышает 10 нм.
1.4 Твердофазные
взаимодействия с участием нанооксидов
Благодаря огромному влиянию и
интенсивному исследованию различных физических свойств в наноразмерных системах
существует большое количество информации по их реакционной способности и
транспортным свойствам. Большой интерес представляет выявление сущности
явления, связанного со специфическими свойствами неравновесного состояния
наноразмерного оксида в твердофазных реакциях, а именно размерный эффект. В
соответствии с идеями недавних работ [28] проявление «тривиального» размерного
эффекта (увеличение давления паров, уменьшение температуры плавления и др.)
может быть предсказано на основе классических термодинамических поверхностей
(уравнение Гиббса) или маленьких частиц (уравнение Томпсона-Кельвина) и связано
с увеличением специфической площади и фракционным объемом, занимаемым границами
зерен. Наоборот, сущность «истинного» размерного эффекта относится к изменению
локальных параметров одно- или многокомпонентной системы: изменение
доминирующего типа несущего заряда, поверхностные фазовые переходы,
стабилизация неравновесных структур через так называемое гетерофазное допирование.
В статье [29] изучено влияние
нанодисперсности оксидов Ni и Al на совместную реакционную способность с оксидами-партнерами,
имеющими различные свойства поверхности (поверхностная энергия, поверхностная и
внутренняя подвижность), используя различные экспериментальные условия. Особый
акцент сделан на различие между «тривиальным» и «истинным» размерным эффектом.
В работе использовались нанопорошки NiOn и Al2O3n, а также микроразмерные
оксиды NiOm, Al2O3m, MoO3m и Bi2O3m. Парные модельные отжиги были проведены для исследования скорости
образования продукта реакции на межфазной границе в системах: NiOn│ MoO3, NiOm│ MoO3. Образование молибдата
никеля по реакции
NiO + MoO3→ NiMoO4 (1.3)
является примером одностадийного
взаимодействия, которое протекает благодаря переносу компонентов MoO3 в объем субстрата NiO на поверхности которого образуется продукт NiMoO4. Перенос MoO3 осуществляется
посредством кооперативного механизма диффузии Mo-O [30].
Наноразмерные керамические образцы NiO и Al2O3 имеют проводимость по крайней мере на один порядок величины
меньше, чем микроразмерные керамические образцы. Это противоречит предыдущему
широко распространенному мнению о более высокой проводимости нанооксидов [31].
В недавней работе [32] было показано, что наноразмерность приводит к увеличению
проводимости для оксидов в очень редких случаях и иногда имеет противоположный
эффект. Результаты полученные в работе [29] согласуются с этим выводом и могут
быть рассмотрены, как дополнительное доказательство, что скорости переноса заряда
для нано- и микродисперсных систем могут быть совершенно различными.
Полученные результаты показали, что
проявление «нано-фактора» зависит от природы оксида-партнера, в частности, от
дисперсионной способности его твердого состояния, поверхностной подвижности,
температуры и типа эксперимента (спрессованная, отожженная керамика или
взаимодействие в порошковых смесях). Некоторые результаты могут получаться
благодаря «тривиальному» размерному эффекту, например, увеличение во
взаимодействии площади контакта в порошковых смесях NiOn,m + MoO3, NiOm,n + Al2O3m,n (если по крайней мере один из начальных оксидов является
наноразмерным) и низкие проводимости наноструктурных NiO и Al2O3. Тем не менее, некоторые данные не могут быть объяснены. Это
утверждение относится к стабилизации низкой температуры полиморфа α - Bi2O3
в контакте с Al2O3n благодаря действию сильной поверхностной силы. На границе α - Bi2O3│Al2O3 могут образовываться некоторые неавтономные фазы, как результат
химического сходства между Bi2O3 и Al2O3 и поверхностной подвижности Bi2O3. Пленка
этой фазы распространяется по поверхности α - Bi2O3 и зерен Al2O3. Распространяющаяся фаза, покрывающая поверхность зерен α - Bi2O3
замедляет скорость α→δ перехода Bi2O3 посредством расхода
поверхностно-активных центров, которые предоставляют место для образования ядер
α - Bi2O3
(в поверхностной области α - Bi2O3), или посредством значительного
увеличения энергии активации α→δ перехода. Наоборот, это справедливо для рассмотрения феномена
стабилизации низкотемпературного полиморфа как проявление «истинного»
размерного эффекта (изменение локальных параметров системы [28]). Внутренний
механизм стабилизации на данный момент [29] не понятен. Диспергирование NiO на Al2O3n может быть рассмотрено
как другой пример «истинного» размерного эффекта, результатом чего является
значительное изменение проводимости в NiO. Кроме того, наблюдаемая диффузионная проницаемость слоя NiMoO4 выросшая на поверхности наноразмерного NiO также может считаться
как проявление «истинного» размерного эффекта.
1.5 Экспериментальные
методы исследования твердофазных реакций
Реакции между твердыми веществами,
начинаясь с определенных температур, ведут к разрушению старых и образованию
новых кристаллических фаз. Они, как правило, сопровождаются определенными
тепловыми эффектами, а в ряде случаев - выделением газообразных продуктов
реакции, что приводит к уменьшению массы реакционной смеси. Поэтому, при
изучении твердофазных взаимодействий чаще всего используют методы термографии,
гравиметрии, а также любые методы количественного фазового анализа. Очевидно,
что точность фиксации температур начала взаимодействия и температурного
интервала, в котором при непрерывном разогреве реакционной смеси процесс,
начавшись, завершается полностью, определяется чувствительностью избранных
методов контроля. Особый интерес для выявления первых необратимых изменений в
реакционной смеси имеют структурно-чувствительные методы, реагирующие на
появление ничтожно малых количеств новой фазы. К ним, в частности, относится
метод измерения электропроводности твердых фаз в процессе их химического
взаимодействия, успешно применяющийся для исследования механизма твердофазного
взаимодействия.
Данный метод применим только в том
случае, когда проводимость исходных оксидов и продукта значительно отличаются
друг от друга. В таком случае проводимость смеси будет либо возрастать (если
проводимость продуктов выше, чем индивидуальных веществ), либо уменьшаться (при
обратном характере зависимости).
Например, используя этот метод,
можно наблюдать за изменением степени превращения в ходе взаимодействия оксида
кадмия и оксида вольфрама по реакции:
CdO + WO3 = CdWO4. (1.4)
Здесь исходные вещества CdO и WO3 имеют высокую проводимость - 10-1 Ом-1см-1,
а продукт - гораздо более низкую: 10-5 Ом-1см-1
при температуре 600ОС. По уменьшению электропроводности реакционной
смеси в ходе взаимодействия можно оценить количество образующегося продукта. На
подобных же системах с участием оксидов вольфрама и молибдена было показано
[33,34], что кинетика твердофазных реакций в смесях порошков в значительной
степени определяется гранулометрическим составом исходных реагентов.
Обратный случай - взаимодействие
низкопроводящих йодидов серебра, рубидия и калия с образованием
высокопроводящего твердого электролита по реакции:
AgI + KI + RbI = (K, Rb) Ag4I5 (1.5.)
В данной системе по мере
взаимодействия происходит повышение электропроводности реакционной смеси, что
можно использовать для определения степени превращения[35].
Сначала исследуют проводимость
индивидуальных оксидов, а затем проводимость порошковых смесей. При этом,
способ приготовления реакционной смеси имеет принципиальное значение: реагенты
следует смешать максимально гомогенно, не разрушая структуры их частиц и не
вызывая дополнительных механических напряжений и активаций поверхности. Иногда
исходную реакционную смесь подвергают прессованию, что в ряде случаев
интенсифицирует реакцию, но вместе с тем затрудняет интерпретацию кинетических
данных. Процесс можно вести в изотермических или политермических условиях [36,37].
О процессах, происходящих в
порошковых смесях при нагреве можно судить по характеру изменения проводимости.
При этом перегибы и пики на кривой нагрева обычно не воспроизводятся на кривых
охлаждения.
В настоящей работе исследование
взаимодействия оксидов Al и W проводили методами измерения проводимости, синхронного ТА,
микроскопии и РФА.
2. Постановка задачи
исследования
Таким образом, анализ литературных
данных показал, что изучение твердофазных реакций с участием
наноструктурированных оксидов представляет собой перспективную в прикладном и
теоретическом плане задачу.
Наиболее достоверные данные о
кинетике и механизме твердофазных реакций можно получить, используя комплекс
взаимодополняющих экспериментальных методов. Особый интерес для выявления первых
необратимых изменений в реакционной смеси имеют структурно-чувствительные
методы, реагируя на появление ничтожно малых количеств новой фазы. К ним, в
частности, относится метод измерения электропроводности брикетированных смесей
оксидов в процессе их химического взаимодействия, успешно применяющийся для
исследования механизма твердофазного взаимодействия [35].
Для исследования в настоящей работе
была выбрана система WО3 - Al2O3, т.к. она удовлетворяет
определенным условиям, а именно - в системе имеется только одно химическое
соединение - вольфрамат алюминия Al2(WO4)3 [38], к тому же, в литературе описаны достаточно
простые в аппаратном оформлении методы синтеза данных оксидов в наноразмерном
состоянии.
Исходя из выше изложенного, целью
данной работы явилось следующее:
Исследование реакционной способности
смесей оксидов WO3 и Al2O3 с различной степенью дисперсности методом измерения проводимости
порошковых смесей.
3. Методика эксперимента
3.1 Исходные материалы
В работе были использованы следующие
реактивы:
) оксид вольфрама(VI) WO3 марки ЧДА;
) оксиды алюминия Al2O3 различной степени дисперсности;
3.2 Подготовка образцов
для исследования
Порошковые смеси для проведения
исследований готовили путем смешивания навесок оксидов алюминия и вольфрама, рассчитанных
исходя из химической реакции между оксидами по схеме:
Al2O3 + 3WO3 = Al2(WO4)3
Перед исследованиями порошки оксидов
смешивали:
) в среде этанола при
охлаждении с использованием ультразвукового дезинтегратора ULTRASONIK PROCESSOR СРХ 750 (мощность
дезинтегратора 750 Вт, пульсирующий режим 10 сек/10 сек, амплитуда 40%, время
перемешивания 10 минут).
Порошки исходных веществ прессовали в
стальной пресс-форме на ручном гидравлическом прессе. Диаметр таблеток составил
10 мм. Отметим, что в системе WO3ô Al2O3, концентрация, выраженная в мольных процентах близка к
концентрации, выраженной в объемных процентах.
3.3 Рентгенофазовый
анализ
Рентгенофазовый анализ (РФА)
проводили с целью контроля фазового состава продуктов синтеза. Рентгенограммы
были получены на дифрактометре Bruker D8 Advance в CuKa излучении при напряжении в трубке на трубке 40 кВ и токе 40 мА.
Съемка производилась в интервале 2q =20-80º с шагом 0,05°θ и экспозицией 1 секунда на точку.
3.4
Дифференциально-термический анализ
Дифференциально - термический анализ
проводили на приборе NETZSCH STA 409 PC в интервале температур 40 - 600 0С и скоростью нагрева
10 град/мин.
3.5 Измерения удельной
поверхности образцов
Измерения произведены методом
низкотемпературной адсорбции азота с использованием прибора Tristar II 3020.
Относительная погрешность измерений
5 - 7%.
3.6 Измерение
электропроводности
Измерение электросопротивления брикетированных
смесей оксидов проводили двухконтактным методом с помощью моста переменного
тока RCL E7-22 на частоте 1,0 кГц в режимах нагревания и охлаждения в
интервале температур 100-600ОС. Скорость съемки температурной
зависимости не превышала 5о/мин.
Расчет общей электропроводности
проводили по формуле:
lgs общ = - lgR, (3.1)
где s - общая электропроводность, Ом-1; R - сопротивление
образца, Ом.
3.7 Измерение размерных
характеристик оксидов
Эффективный диаметр частиц оксидов
определяли методом дифракции лазерного луча на приборе SHIMADZU SALD-7101.
3.8 Микроскопический
метод анализа
Оптические микроскопические
исследования порошков оксидов проводили на микроскопе OLYMPUS CX 41 в отраженном свете
при увеличении в 100 и 500 раз.
4. Экспериментальные
данные и обсуждение результатов
4.1 Свойства оксидов
алюминия различной степени дисперсии
Нанооксид алюминия получали
прокаливанием псевдобемита при температуре 600оС в течение 2 часов,
микрооксид алюминия получали спеканием γ-модификации оксида алюминия при температуре 1300оС в
течение 10 часов. Температура синтеза оксида алюминия была выбрана в
соответствии с результатами исследования псевдобемита AlOOH методом ДСК.
Характеристика порошка оксида
алюминия приведены в таблице 1.
Таблица 1
|
Образец
|
Sуд,
м2/г
|
Dрасет.
|
Dэф
|
|
Al2O3
|
200
|
8 нм
|
5 мкм - 120
мкм
|
Sуд определяли методом
адсорбции азота.
Dрасчет. вычисляли по
следующей формуле:
Dрасчет. = 6/(ρ* Sуд), (4.1.)
где ρ
- плотность вещества, г/см3, Sуд - удельная поверхность вещества, м2/г.
Эффективный диаметр частиц (Dэф) определяли методом дифракции лазерного луча (рис. 4.1).
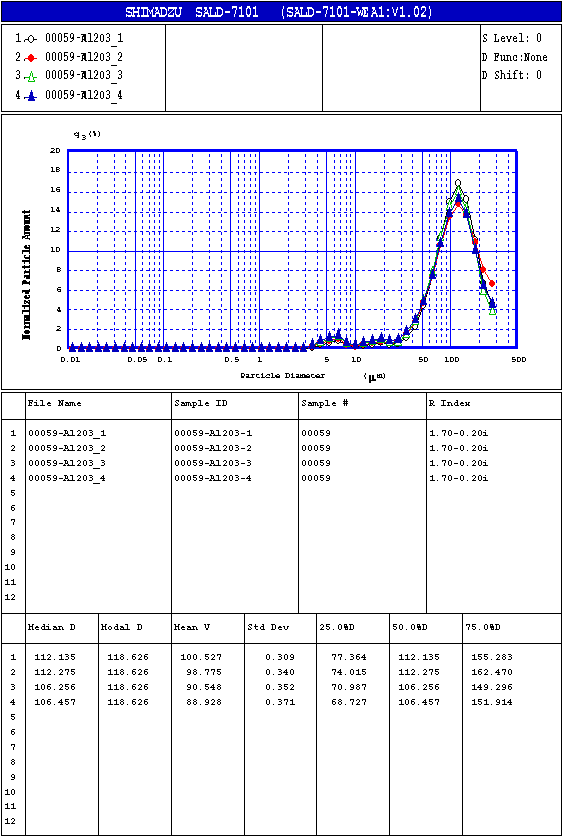
Рис. 4.1. Распределение частиц по
диаметрам
Так же был проведен РФА анализ
оксидов алюминия различной степени дисперсии и оксида вольфрама. Рентгенограммы
индивидуальных оксидов приведены на рис. 4.2. - 4.3; 4.9. На рис. 4.4
представлена модельная рентгенограмма Al2O3M, подтверждающая что после термической обработки Al2O3N действительно получился
Al2O3M Из рисунков следует, что рентгенограммы наноразмерного и
микроразмерного оксидов алюминия сильно отличаются, пики на рентгенограмме
наноразмерного оксида алюминия размыты, а интенсивность их уменьшена по
сравнению с пиками на рентгенограмме полученного из него микрокристаллического
оксида алюминия. Эти данные, а также результаты определения удельной
поверхности полученного нами оксида алюминия свидетельствуют о том, что оксид
алюминия получен в наноразмерном состоянии. Результаты оптических исследований
(рис. 4.5-4.8) и результаты определения размеров частиц методом лазерного
рассеяния показывают, что полученный оксид алюминия сильно агрегирован.
Проведенные микроскопические
исследования с помощью оптического микроскопа OLYMPUS CX 41 показали, что
микроразмерный оксид алюминия является кристаллическим, а нанооксид алюминия -
аморфным.
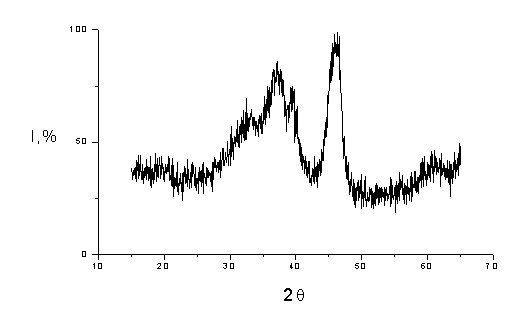
Рис. 4.2. Рентгенограмма
образца Al2O3N
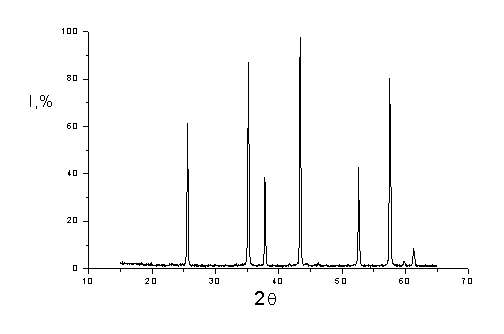
Рис. 4.3. Рентгенограмма
образца Al2O3M
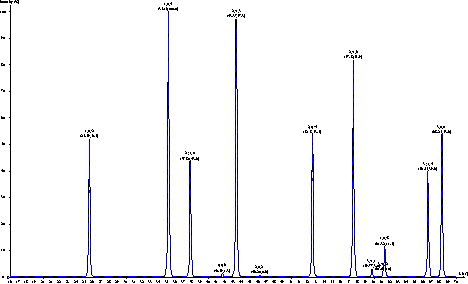
Рис. 4.4. Модельная
рентгенограмма α-Al2O3M
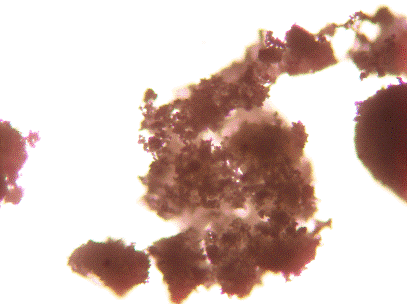
Рис. 4.5. Фотография с
микроскопа OLIMPUS (оптическое увеличение 100) зерен Al2О3M
Рис. 4.6. Фотография с
микроскопа OLIMPUS (оптическое увеличение 500) зерен Al2О3M

Рис. 4.7. Фотография с
микроскопа OLIMPUS (оптическое увеличение 100) зерен Al2O3 N
Рис. 4.8. Фотография с
микроскопа OLIMPUS (оптическое увеличение 500) зерен Al2O3 N
Рентгенограмма используемого в
работе оксида вольфрама приведена на рис. 4.8.
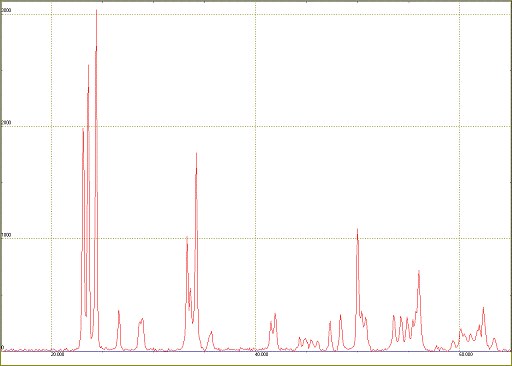
Рис. 4.9. Рентгенограмма образца WO3М
Таким образом для исследования
взаимодействия в порошковых смесях нами были выбраны следующие пары оксидов
приготовленных смешением:
1. на ультразвуке: WO3М - Al2O3М; WO3M
- Al2O3N;
2. механически на планетарной
мельнице: WO3М - Al2O3N; WO3M - Al2O3M.
4.2 Исследование
реакционной способности смесей оксидов
Для исследования
реакционной способности были проведены измерения электропроводности смешанных на ультразвуке и механически на планетарной мельнице оксидных смесей.
Для исследования
реакционной способности были проведены измерения электропроводности «сырых»
(спрессованных, но предварительно не спеченных) оксидных смесей. Также был
сделан ДСК анализ порошковых смесей.
Были сняты кривые изменения
электропроводности от температуры для неспеченных оксида вольфрама и оксида
алюминия в нано- и микроразмерном состоянии (рис. 4.10. - 4.12.).

Рис. 4.9. Температурная зависимость
проводимости Al2О3М

Рис. 4.10. Температурная
зависимость проводимости Al2O3N.
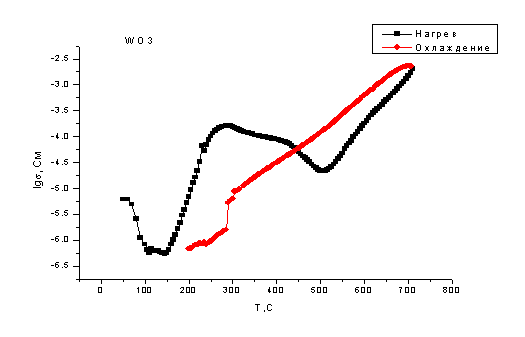
Рис. 4.11. Температурная
зависимость проводимости WO3М
в режиме нагрев-охлаждение
Из представленных
зависимостей видно, что при повышении температуры проводимость оксидов алюминия
различной степени дисперсности во всём исследованном интервале температур
(100-700оС) практически не меняется. Проводимость наноразмерного
оксида алюминия во всём исследованном интервале температур скакала, а
проводимость микроразмерного оксида алюминия при низких температурах также
изменялась скачкообразно, а при температурах более 550оС
стабилизировалась до величины порядка 10-6 См. и при дальнейшем
повышении температуры не менялась.
Затем была исследована
проводимость смесей оксида вольфрама с оксидами алюминия различной степени
дисперсности. Смеси готовили двумя способами, описанными в разделе 3.2.
На рис. 4.12. и 4.13.
показаны температурные зависимости проводимости смесей, где оксид алюминия
находится в микроразмерном состоянии.

Рис. 4.12. Температурная
зависимость смеси WО3М
- Al2O3M

Рис. 4.13. Температурная
зависимость смеси WО3M - Al2O3M.
(смесь на планетарной мельнице)
Из рисунков видно, что
общий вид зависимости проводимости смесей в режиме нагрева практически
совпадает с проводимостью оксида вольфрама: также имеется максимум при 300°С,
затем при нагреве до 550оС происходит уменьшение проводимости
примерно на половину десятичного порядка, после чего проводимость начинает
возрастать. Однако величина проводимости меньше на половину десятичного порядка
по сравнению с проводимостью чистого оксида вольфрама, что может быть связано с
появлением в системе низкопроводящего соединения вольфрамата алюминия.
Проведённый
рентгенофазовый анализ показал, что в смесях после проведения опытов
присутствует продукт вольфрамат алюминия и отмечены рефлексы оксида вольфрама и
оксида алюминия (рис. 4.14; 4.15).

Рис. 4.14.
Рентгенограмма смеси Al2O3M-WO3M
(смешение ультразвуком)
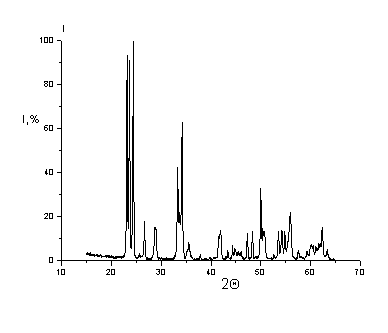
Рис. 4.15. Рентгенограмма
смеси Al2O3M-WO3M
(смешение на планетарной мельнице)
Зависимости
проводимостей этих же смесей от температуры при втором цикле нагрев-охлаждение
изображены на рисунках 4.16; 4.17 из которых видно, что обе кривые близки по
величине проводимости (на кривых нагревания отсутствует максимум характерный
для кривой нагревания первого цикла) и практически совпадают с кривой
охлаждения первого цикла. Отличие заключается в том, что на зависимостях
полученных при смешивании оксидов на мельнице имеются скачки подобные скачкам
на кривой проводимости чистого оксида вольфрама, но они смешены на 150-200 оС
в область более высокой температуры. Природа этих скачков пока не выяснена.
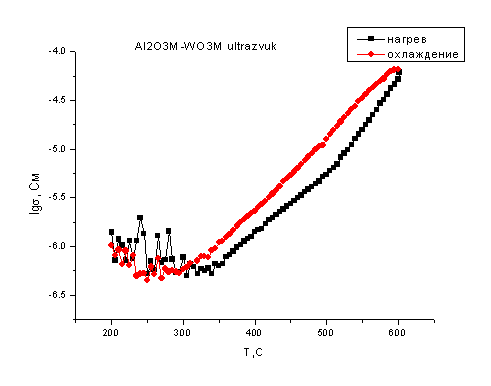
Рис. 4.16. Температурная
зависимость второго цикла (нагрев-охлаждение) смеси WО3М
- Al2O3M. (смесь на ультразвуке)
На рис. 4.18. и 4.19. показаны
температурные зависимости проводимости смесей, где оксид алюминия находится в
наноразмерном состоянии….
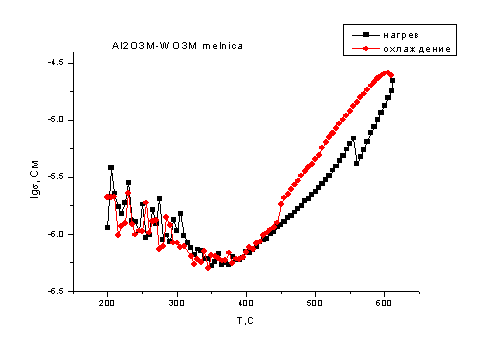
Рис. 4.17. Температурная
зависимость второго цикла (нагрев-охлаждение) смеси WО3М
- Al2O3M. (смесь на планетарной мельнице)
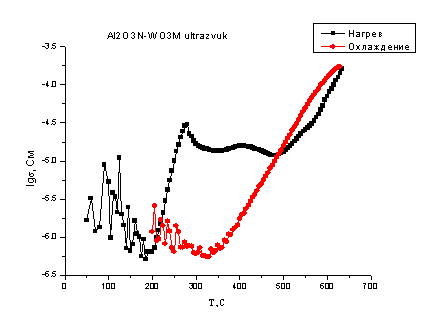
Рис. 4.18. Температурная
зависимость смеси WО3М
- Al2O3N. (смесь на ультразвуке)
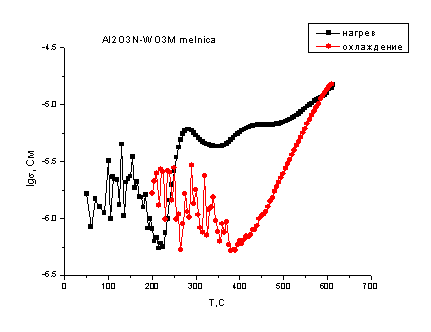
Рис. 4.19. Температурная
зависимость смеси WО3М
- Al2O3N. (смесь на планетарной мельнице)
Здесь так же видим, что
общий вид зависимостей сходен. Отличие от систем, где оксид алюминия находился
в микроразмерном состоянии заключается в том, что:
во-первых, на кривых
нагревания в области низких температур имеются скачки проводимости характерные
для оксида алюминия;
во-вторых, после
максимума при 300оС проводимость уменьшается незначительно, а в
случае мельничного помола исходных смесей начинает возрастать. При этом общая
величина проводимости ещё ниже, чем в смесях с микроразмерным оксидом алюминия,
что может быть объяснено тем, что в данных смесях взаимодействие произошло
глубже, продукта реакции образовалось больше, что привело к закономерному
снижению общей проводимости в системе. Результаты рентгенофазового анализа
отличаются от такового для систем с микроразмерным оксидом алюминия (рис. 4.20.
- 4.23). На полученных рентгенограммах отсутствуют рефлексы от оксида алюминия,
это связано с их малой интенсивностью. В этих же системах зависимости
проводимостей во втором цикле также совпадают с кривыми охлаждения в первом
цикле. (рис. 4.24 - .4.25)
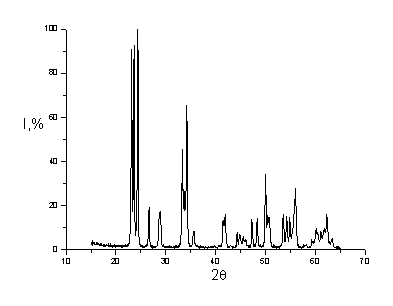
Рис. 4.20.
Рентгенограмма смеси Al2O3N-WO3M (смешение на планетарной мельнице)
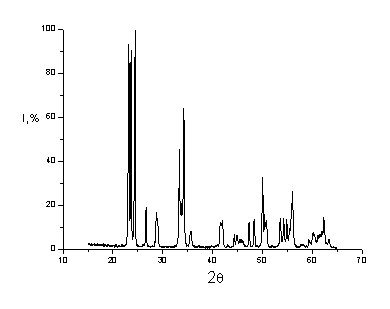
Рис. 4.21 Рентгенограмма
смеси Al2O3N-WO3M (смешение ультразвуком)
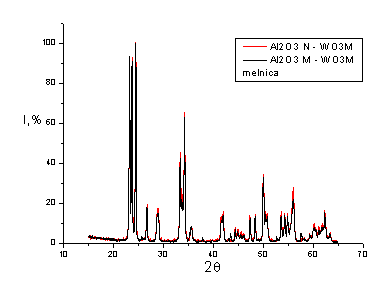
Рис. 4.22. Сдвоенная
рентгенограмма Al2O3N-WO3M и Al2O3M - WO3M (смешение на планетарной мельнице)

Рис. 4.23. Сдвоенная
рентгенограмма Al2O3N-WO3M и Al2O3M - WO3M (смешение ультразвуком)
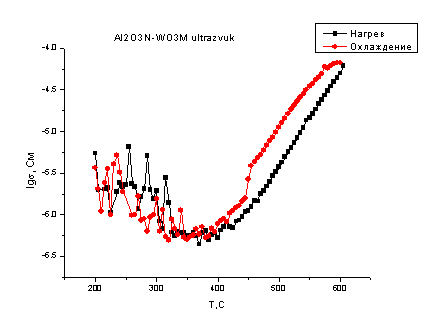
Рис. 4.24. Температурная
зависимость второго цикла (нагрев-охлаждение) смеси WО3М
- Al2O3N. (смесь на ультразвуке)

Рис. 4.25. Температурная
зависимость второго цикла (нагрев-охлаждение) смеси WО3М
- Al2O3N. (смесь на планетарной мельнице)
Выводы
электрохимический
наноструктурированный порошковый оксид
1. Для проведения исследований
по влиянию размеров частиц простых оксидов на их реакционную способность в
порошковых смесях был синтезирован оксид алюминия в наноразмерном состоянии.
Физико-химическими методами показано, что оксид алюминия получен в
полидисперсном агрегированном состоянии с размерами агрегатов до 120 мкм,
состоящих из более мелких частиц, удельная поверхность составила 200 м2/г.
2. РФА полученного оксида
алюминия подтверждает получение его в наноразмерном состоянии.
3. Изучены процессы
взаимодействия в системе WO3 - Al2O3(N, M) методами измерения проводимости порошковых смесей, РФА анализа.
Показано что:
· характер
взаимодействия в парах оксидах зависит от размеров частиц оксидов алюминия.
· РФА подтверждено
наличие в реакционных смесях после цикла нагрев-охлаждение как исходных
оксидов, так и продукта вольфрамата алюминия;
· показано, что
образование в системе низкопроводящего вольфрамата алюминия приводит к снижению
проводимости в смеси оксидов в интервале 300-600оС. Этот эффект
особенно проявляется в случае, когда оксид алюминия находиться в наноразмерном
состоянии;
· установлено, что
механическое перемешивание на планетарной мельнице, по-видимому, приводит к
дополнительной активации оксидов.
Литература
1. Н.Ф. Уваров, В.В. Болдырев. Размерные эффекты в химии гетерогенных
систем: - успехи химии, 70 (4) 2001, 307-329.
2. Нейман А.Я, Гусева А.Ф. Особенности твердофазного синтеза
молибдатов в электрическом поле // Журнал физической химии. 1986, т. 60, №11,
с. 2873
. Нейман А.Я, Гусева А.Ф. Электрохимический подход к механизмам
твердофазных реакций и межфазного массопереноса // Электрохимия. 1993 т. 29,
11, с. 1386
. Нейман А., Крылов А., Кузнецов В.А. Влияние
электрического поля на твердофазные реакции оксидов // Журнал физической химии.
1985, т. 59. №9, с. 236
. Нейман А.Я, Гусева А.Ф. Новые данные о механизме
массопереноса при твердофазных реакциях: 1. Реакции в электрическом поле //
Кинетика и катализ. 1994. т. 35, 1, C.1
. Нейман А., Барсанов С.Ю. Новые данные о механизме
массопереноса при твердофазных реакциях: 3. Взаимодействие оксидов ванадия и
молибдена // Кинетика и Катализ, 1999, т. 40, №1, с. 50
. Нейман А., Кирпищикова Т.А. Влияние электрического поля
на взаимодействие оксидов висмута и вольфрама // Электрохимия. 1996, т. 32, №4,
с. 511
8. Белкова Т., Костиков Ю. Нейман А. Реакции оксида висмута
с оксидами переходных металлов // Журнал неорганической химии, 1999, т. 44, N2,
202
. Нейман А, Запасская И., Шарафутдинов А. Механизм синтеза
ниобата лития // Журнал физической химии, 1990, т. 64, 10, с. 1943
. Нейман А, Белкова Т. Электрохимия твердофазных реакций:
реакции оксида висмута с оксидами алюминия и иттрия // Электрохимия, 1997, т.
33, №9, с. 1082
. Нейман А., Гусева А. Новые данные о механизме
массопереноса при твердофазных реакциях: 2. Поверхностный и электроповерхностный
аспекты // Кинетика и Катализ, 1999, т. 40, №1, с. 38
. Нейман А., Конышева Е. Электроповерхностный перенос
оксида вольфрама в керамику вольфрамата кальция // Электрохимия, 1998, т. 34,
№3, 272
. Фридрихсберг Д.А. // Курс коллоидной химии. Ленинград.
Химия. 1984. 368 С.
. Нейман А.Я. Электроповерхностные явления в твердофазных
системах: первые свидетельства // ЖФХ, в печати
15. Knozinger H., Taglauer E. Solid state spreading of oxides
- a new route to supported catalists fabrication // Catalysis, 10, 1 (1993)
. Neiman A., Utiumov V. Solid State Spreading and
Crystallisation of Refractory Oxides // Solid State Ionics, 1999, v. 119, p. 49
17. Нейман А, Утюмов В.Ю., Карпов С.Г., Костиков Ю.П., Шиятова
М.В Твердофазное растекание оксидов: система In2O3-Al2O3 // Поверхность, 2000, №3, с. 52-61
. Руководство по препаративной неорганической химии. // Под
ред. Брауэра Г.М.: Наука, 1956. 869 с.
. Рипан Р., Читяну И. неорганическая химия. М.: Мир,
1971.т. 1.
. И.Ю. Петров. Кластерыи малые частицы. М.: Наука, 1971.
. Ю.Ф, Комник. Физика металлических пленок. Размерные и
структурные эффекты. М.: Атомиздат, 1979.
. Н.Ф. Уваров, В.В. Болдырев. Размерные эффекты в химии
гетерогенных систем - успехи химии 70 (4) 2001, 307-329.
. Конюк И.Ф., Ващук В.В., Пацей В.Ф. Механизм реакций
твердофазного синтеза некоторых молибдатов и вольфраматов. Журн. Неорганические
материалы. 1975.Т.2. №2.С. 278-281.
. Гусева А.Ф., Нейман А.Я., Анимица И.Е. Твердофазные
реакции при получении и эксплуатации неорганических материалов. Екатеринбург.
2005.
. Третьяков Ю.Д. твердофазные реакции. М.:Химия. 1978.
. Кинетика и механизм твердофазных взаимодействий в
системах MeCO3 - Nb2O5 (Me-Sr, Ba), SrCO3-BaCO3-Nb2O5. Дипл. работа. УрГУ.
Свердловск, 1978.78 с.
28. Диаграммы состояния систем
тугоплавких оксидов: Справочник. Вып. 5. Двойные системы. Л.: Наука, 1988.