Определение влажности в процентном соотношении исследуемого пищевого сырья. Распределение электронов по орбиталям. Причины изменения свойств оксидов и гидроксидов марганца
Контрольная
работа по химии
№ 1
Определите, какова была влажность (в %)
исследуемого пищевого сырья, если при обработке 100 г сырья карбидом кальция
выделилось 1,12 л ацетилена.
Решение
Дано:
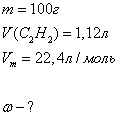
Запишем реакцию взаимодействия воды
с карбидом кальция:
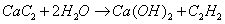
Найдем количество ацетилена:
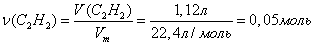
Согласно уравнения реакции можно
сделать вывод, что количество воды равно удвоенному количеству ацетилена:

Масса воды будет равна:
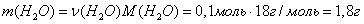
Влажность равна отношению массы воды
к массе образца пищевого продукта:

Влажность пищевого продукта
составляет 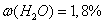 .
.
Ответ: 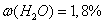 .
.
№2.
Пользуясь правилом Хунда,
распределите электроны по орбиталям, отвечающим высшему энергетическому
состоянию атомов хлора и кремния.
Решение
Для хлора: 

Как видно из записи электронных
формул данных элементов хлор имеет на внешнем р - электронном слое пять
электронов, и для завершения электронного слоя атому хлора надо только один
электрон. Поэтому хлор относят к активным неметаллам, он легко вступает в
химические реакции и притягивает электроны от менее электронегативных
элементов.

Рассмотрим химические свойства хлора.
Хлор может
иметь такие степени окисления
-1, 0, +1, +3, +5, +7. Это объясняется
возможностью последовательного возбуждения спаренных электронов в атомах Cl,
Br, I, At на d - подуровне, что
приводит к росту числа электронов, которые принимают участие в образовании
ковалентных связей до 3, 5 или 7. Хлор
относится к сильным окислителям, хотя и более слабый чем фтор.
Кремний имеет порядковый номер в периодической
системе 14. В периодической системе кремний расположен в четвертом периоде,
поэтому на внешнем энергетическом уровне у него будет четыре электрона.
Можно записать распределение электронов в атоме
кремния в виде:
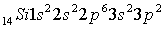
Запишем электронно-графические
формулы атома кремния. В нормальном состоянии для кремния можно записать:

А в возбужденном:

В нормальном состоянии атом кремния проявляет
валентность равную 2, а в возбужденном состоянии - валентность равную 4.
Валентность будет зависеть от числа неспаренных электронов в атоме. В атоме
кремния в возбужденном состоянии их четыре.
№ 3
На основании распределения электронов внешнего
энергетического уровня по квантовым ячейкам в основном и возбужденном
состояниях определите возможные степени окисления атомов указанных элементов:
фосфора, брома.
Решение
Рассмотрим атом фосфора. Он расположен в 5
периоде и на его внешнем энергетическом уровне расположено 5 электронов.
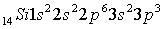
Запишем строение его энергетических
уровней в нормальном и возбужденном состоянии:

Поэтому в нормальном состоянии атом фосфора
может проявлять степень окисления равную +3 (Р2О3).
А в возбужденном:

В нормальном состоянии атом фосфора проявляет
валентность равную 3, а в возбужденном состоянии - валентность равную 5.
степень окисления фосфора: +3 и +5.
Рассмотрим свойства брома.
Его
электронная формула:

Как видно из записи электронной
формулы бром имеет на внешнем р - электронном слое пять электронов, и для завершения
электронного слоя атому брома надо только один электрон. Поэтому бром относят к
активным неметаллам, он легко вступает в химические реакции и притягивает
электроны от менее электронегативных элементов.
В нормальном состоянии атом брома
проявляет степень окисления - 1.:

Далее возможны возбужденные состояния:

Возможна приведенная ниже конфигурация, в
которой есть четыре неспаренных электрона (степень окисления +4):

Возможна приведенная ниже конфигурация, в
которой есть семь неспаренных электрона (степень окисления +7):

Бром может проявлять степени
окисления
-1, 0, +1, +3, +5, +7. Это объясняется
возможностью последовательного возбуждения спаренных электронов в атоме брома
на 4d
-
подуровне, что приводит к
росту числа электронов, которые принимают участие в образовании ковалентных
связей до 3, 5 или 7.
№ 4
Как и почему изменяются кислотно-основные
свойства оксидов и гидроксидов марганца с изменением его степени окисления в
ряду: Mn(II)→ Mn(IV) → Mn(VI) → Mn(VII).
Решение
Составим формулы оксидов и гидроксидов марганца
с указанными в условии степенями окисления.
Марганец имеет четыре оксида MnO, Mn2O3, MnO2, Mn2O7. Как
известно из курса химии по кислотно-основным свойствам оксиды марганца
разделяют на: MnO, Mn2O3 - основные
оксиды, MnO2 - амфотерен,
а высший оксид Mn2O7 является
ангидридом марганцовой кислоты. Гидроксиды марганца имеют формулы 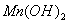 ,
, 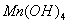 ,
, 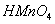 .
.
Амфотерными свойствами владеет
Mn(OH)4. При действии щелочей на растворы солен марганца (II) выпадает
белый осадок гидроксид марганца Мп(ОН)2. Осадок легко растворяется в
кислотах. На воздухе он быстро темнеет, окисляясь в бурый гидроксид марганца(IV) Мп(ОН)4.
Оксид марганца, или закись марганца, МпО получается в виде зеленого порошка при
восстановлении других оксидов марганца водородом.
Наиболее стойким соединением
марганца является темно-бурый диоксид марганца МпО2; он легко
образуется как при окислении низших, так и при восстановлении высших соединений
марганца. Как уже указывалось, МпО2 - амфотерный оксид; однако и
кислотные, и основные свойства выражены у него очень слабо.
Поэтому можно сделать вывод, что в ряду оксидов
марганца основные свойства слабеют, а нарастают кислотные свойства. Это можно
объяснить изменением степени окисления марганца в этих соединениях. В основных
соединениях степень окисления марганца невысока (+2), а в кислотах степень
окисления марганца более высока (+6, +7). Увеличение степени окисления приводит
к возрастанию кислотных свойств. Высокая степень окисления (+6, +7) более
характерна для неметаллов, например хлора, серы и т.п. поэтому при высоких
степенях окисления более проявляются кислотные свойства.
№ 5
Составьте молекулярные, молекулярно-ионные и
сокращенные ионные уравнения реакций между веществами:
А) нитратом свинца и хроматом калия,
Б) гидроксидом алюминия и гидроксидом калия.
В) гидроксохлоридом кобальта (ІІ) и соляной
кислотой.
Запишем уравнения реакций между указанными ниже
веществами.
А) нитратом свинца и хроматом калия

Б) гидроксидом алюминия и
гидроксидом калия.

В) гидроксохлоридом кобальта (ІІ) и
соляной кислотой.
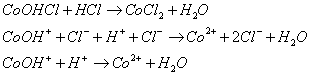
Уравнения реакций записаны в
молекулярном и ионном видах.
№ 6
Напишите реакцию образования
комплексного соединения и константу его нестойкости.
Образование хлорида диамминсеребра
(І) за счет растворения осадка хлорида серебра в NH4OH.
Решение
Запишем сначала реакцию получения
комплексного соединения хлорида диамминсеребра (І) за счет растворения осадка
хлорида серебра в NH4OH.
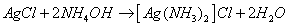
В результате взаимодействия мы
получим комплексное соединение серебра  .
.
В водных растворах комплексное
соединение будет диссоциировать согласно уравнения реакции:

Комплексный катион может
разлагаться, эту меру разложения и характеризирует константа нестойкости
комплексного соединения:
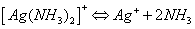
Константа нестойкости равна:

Уравнение для константы нестойкости
комплекса записано.
№ 7
К двум литрам воды прибавили 1 л 40%
раствора гидроксида натрия (плотность 1,43 г/мл). Рассчитайте процентную
концентрацию полученного раствора.
Решение
Дано:
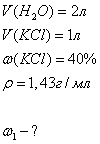
Для решения задания мы используем
формулу:
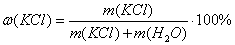
Вычислим сначала массу 1 литра
раствора хлорида калия:

Далее вычислим массу соли хлорида
калия в указанном растворе:
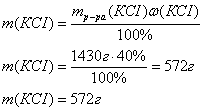
Тогда используя формулу вычислим
процентную концентрация раствора полученного при смешивании 1 литра
первоначального раствора и 2 литров воды.
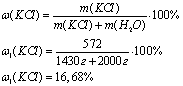
Ответ: 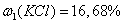 .
.
№ 8
Вычислите степень диссоциации в 0,1
н растворе цианистоводородной кислоты. 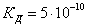 .
.
Решение
Дано:

Согласно условия задачи нам
необходимо вычислить значение степени диссоциации в 0,1 н растворе
цианистоводородной кислоты. цианистоводородная кислота относится к группе
слабых кислот, она в малой мере диссоциирует на ионы в водных растворах. Эта
кислота относится к одноосновным кислотам. Запишем уравнение диссоциации
кислоты в растворе:
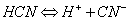
Степень диссоциации можно вычислить
при помощи формулы:

Поскольку степень диссоциации
незначительна, то:
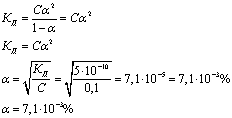
Ответ: 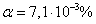 .
.
№ 9
В какой цвет будет окрашена
лакмусовая бумажка в водных растворах цианида калия, хлорида аммония, сульфата
лития, нитрата натрия? Составьте молекулярные и ионно-молекулярные уравнения
реакций.
Решение
Рассмотрим процессы гидролиза солей
в растворах. Найдем значение РН растворов солей.
Цианид калия образован слабой
кислотой и сильным основанием.
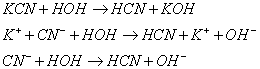
В результате гидролиза образуются
ионы  и среда
будет щелочной. Лакмусовая бумага будет иметь синий цвет.
и среда
будет щелочной. Лакмусовая бумага будет иметь синий цвет.
Рассмотрим гидролиз хлорида аммония.
Он образован сильной кислотой и слабым основанием.
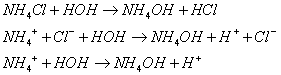
В результате гидролиза образуются
ионы  , поэтому
среда будет кислой и лакмус будет окрашен в красный цвет.
, поэтому
среда будет кислой и лакмус будет окрашен в красный цвет.
Сульфат лития образован сильной
кислотой и сильным основанием, литий принадлежит к щелочным металлам, поэтому
гидролиз такой соли не протекает, РН равно 7, среда нейтральная. В нейтральной
среде лакмус будет бесцветен.
Нитрат натрия образован сильной
кислотой и сильным основанием, поэтому соль не гидролизируется и РН среды равно
7, лакмус бесцветен.
№ 10
Вычислить объем воды, необходимый
для растворения при 25ºС 1 грамма
сульфата бария (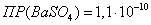 ).
).
Решение
Дано:
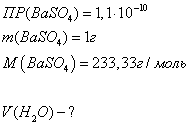
В водных растворах сульфат бария
диссоциирует на ионы согласно уравнения реакции:

Тогда концентрация ионов бария в
растворе равна:
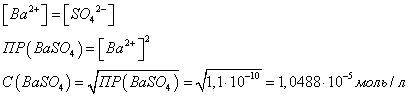
Тогда в 1 литре воды мы можем
растворить 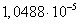 моль
сульфата бария. Вычислим массу сульфата бария, который растворим в 1 литре
воды.
моль
сульфата бария. Вычислим массу сульфата бария, который растворим в 1 литре
воды.
Тогда объем воды будет равен
отношению:

Ответ: 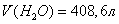
№ 11
Рассчитайте сколько граммов
гидрокарбоната кальция содержится 1 м3 мягкой воды, если ее
временная жесткость по Са2+ равна 1,5 ммоль/л?
Решение
Дано:
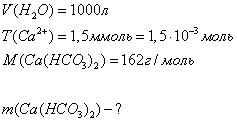
Согласно условия задания нам дано
временную жесткость воды, которая равна 1,5 ммоль/л. Тогда мы можем вычислить
количество гидрокарбоната кальция, который находится в 1000 литров воды.

Вычислим массу гидрокарбоната в
воде:

Масса гидрокарбоната кальция в 1 м3
воды составила 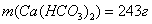 .
.
Ответ: 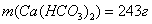 .
.
№ 12
При 100ºС некоторая
реакция заканчивается за 1 мин. Рассчитайте, через какое время закончится эта
реакция при температуре 60ºС, если
температурный коэффициент скорости реакции равен 2.
Решение
Дано:
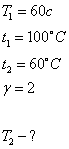
Вычислим значение времени Т2.
для этого мы сначала вычислим насколько уменьшится скорость химического
процесса при уменьшении температуры от 100ºС до 60ºС.
Используем уравнение Вант-Гоффа:

Поэтому скорость химического
процесса уменьшилась в 16 раз. Тогда можно сделать вывод, что время протекания
процесса увеличиться также в 16 раз. Тогда реакция будет продолжаться не 1
минуту, а в 16 раз больше:
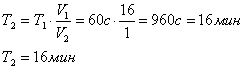
Ответ: 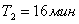
№ 13
Расставьте коэффициенты в
окислительно-восстановительных процессах на основании составления
электронно-ионного баланса:
В реакции между растворами иодида
калия и пероксидом водорода в сернокислой среде, используемой при определении
активных окислительных ферментов.
Решение
Расставьте коэффициенты в
окислительно-восстановительных процессах на основании составления
электронно-ионного баланса. Запишем уравнение реакции между растворами иодида
калия и пероксидом водорода в сернокислой среде. Также запишем продукты данного
процесса.

Рассмотрим полученное уравнение
реакции и запишем его в ионном виде:
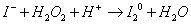
Запишем ионные полуреакции:
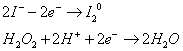
Суммируем полуреакции:

Запишем реакцию в молекулярном виде
и уравняем ее:
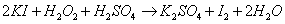
Уравнение реакции
окислительно-восстановительного процесса уравнено.
№ 13
Расставьте коэффициенты в
окислительно-восстановительных процессах на основании составления электронного
баланса:
В реакции между сульфидом свинца
(ІІ) и пероксидом водорода, используемой для осветления картин за счет
образования сульфата свинца (ІІ) белого цвета.
Решение
Запишем уравнение реакции между
сульфидом свинца (ІІ) и пероксидом водорода, в результате которой образуется
сульфат свинца.
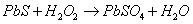
Проставим степени окисления
элементов у уравнении:

Составим уравнения электронного
баланса:
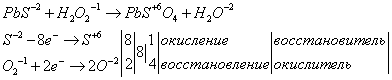
Уравняем уравнение окислительного
процесса:
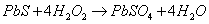
Уравнение уравнено при помощи метода
электронного баланса.
хлор кремний гидроксид молекулярный
№ 14
В каких растворах восстановительная способность
цинка выражена более сильно, если:
А) 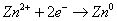 Е = - 0,76В,
Е = - 0,76В,
Б) 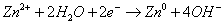 Е = - 1,26В.
Е = - 1,26В.
Решение
В условии задания нам дано значения
потенциалов восстановления цинка в растворе. Восстановительная способность
цинка будет зависеть от потенциала восстановления, чем потенциал менее
негативный, тем большей будет восстановительная способность цинка, тем проще и
легче восстановить его из раствора. Поэтому восстановительная способность будет
большей в случае реакции 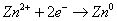 , потенциал
которой Е = -0,76В. в случае реакции
, потенциал
которой Е = -0,76В. в случае реакции 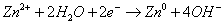 , потенциал которой Е = - 1,26В,
восстановительная способность будет меньшей.
, потенциал которой Е = - 1,26В,
восстановительная способность будет меньшей.
№ 15
Исходя из положения металлов в ряду
напряжений металлов и растворимости продуктов их взаимодействия с указанными
ниже реагентами, определите в каком из приведенных реагентов: воде, уксусной,
азотной, серной кислотах (различной концентрации), гидроксиде калия -
происходит растворение меди в стандартных условиях. Ответ подтвердите
соответствующими уравнениями реакций.
Решение
Медь расположена в ряду напряжений
металлов после водорода, поэтому она не вытесняет водород из кислот. Медь
относится к малоактивным металлам, она не будет реагировать с водой. Уксусная
кислота, которая относится к малоактивным кислотам не будет реагировать с
медью, водород не вытесняется. Гидроксид калия также не реагирует с медью.
Из всего списка веществ в реакцию в
медью будет вступать только серная кислота и азотная кислота.
Медь не реагирует с разбавленной
серной кислотой. Только если в растворе серной кислоты присутствует кислород,
то тогда возможна химическая реакция:

Возможна реакция концентрированной
серной кислоты и меди с образованием оксида серы 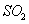 .
.

Медь реагирует как с
концентрированной, так и с разбавленной азотной кислотами.
Рассмотрим отношение меди к
концентрированной азотной кислоте.
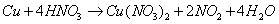
С разбавленной азотной кислотой
протекает реакция:
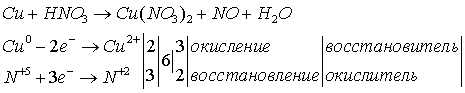

Уравнения взаимодействия меди с
кислотами записаны.
Список использованной литературы
1. Артеменко
А. И., Тикунова И. В., Ануфриев Е. К. Практикум по органической химии. - М.:
Высшая школа, 1991. - 175 с.
. Глинка
Н. Л. Общая химия. - Л.: Химия, 1988. - 702 с.
. Крешков
А. П., Ярославцев А. А. Курс аналитической химии. - М.: Химия, 1964. - 430 с.
. Полеес
М. Э. Аналитическая химия. - М.: Медицина, 1981. - 286 с.
. Рабинович
В. А., Хавин З. Я. Краткий химический справочник. - Л.: Химия, 1978. - 331 с.
. Химия:
Справочное издание/ под ред. В. Шретер, К.-Х, Лаутеншлегер, Х. Бибрак и др.:
Пер. с нем. - М.: Химия, 1989.- 648 с.
. Щукарев
С. А. Неорганическая химия. - М.: Высшая школа, 1970. - 437 с.