Окислительно-восстановительная реакция
Рязановский
сельскохозяйственный техникум
РЕФЕРАТ
на
тему: "Окислительно-восстановительная реакция"
Выполнила:
Абидова С.В., гр. 21 Т
Проверил Валеев Р.В.
Рязаново,
2011 г.
Оглавление
Введение
. Окисление. Понятие и виды
. Восстановление. Понятие и виды
. Окислительно-восстановительные реакции
Заключение
Введение
Окислительно-восстановительные реакции, химические реакции,
сопровождающиеся изменением окислительных чисел
<#"534698.files/image001.gif"> = Zn2+
Восстановлением называется присоединение электронов атомом,
молекулой или ионом:
Cl2 + 2 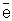 = 2Cl-
= 2Cl-
Окислителями называется нейтральный атом, молекула или ион,
принимающие электроны (во втором примере молекула хлора Cl2),
восстановителями - нейтральный атом, молекула или ион, отдающие электроны (в
первом примере - атом Zn). Окисление и восстановление - взаимосвязанные
процессы, которые всегда протекают одновременно. Когда одно вещество
окисляется, то другое восстанавливается, и наоборот. Так, приведённые выше
частные реакции окисления и восстановления составляют единый процесс О.-в.:
Zn + Cl2 = ZnCl2.
Здесь Zn окисляется до Zn2+, а Cl2 восстанавливается
до 2Cl-.
В химии окислительно-восстановительные реакции принадлежат к числу
наиболее распространённых. Например, на них, как правило, основано получение
простых веществ (металлов и неметаллов)
CuO + H2 =Cu + H2O,
КВг + Cl2 = Br2 + 2KCl
1. Окисление. Понятие и виды
Окисление - это химическая реакция присоединения кислорода
или отнятия водорода. Для ионных процессов общепринята более расширенная
формулировка: окисление - есть увеличение положительной валентности (заряда)
или уменьшение отрицательной валентности (заряда) иона, напр.
Fe"-*Fe*" при окислении солей закиси железа в соли окиси или
S"_>.S0-в переходе от H2S к свободной сере.
Окисление - означает потерю электронов. Из условия общей электронейтральности
необходимо, чтобы при этом присутствовало вещество, присоединяющее электронной
тем увеличивающее свою отрицательную валентность; оно называется окислителем;
само оно при этом восстановляется. Так процессы окисления и
восстановления тесно связаны и должны протекать совместно. Пример:
SnCl2+2FeCl3 = SnCl4+2FeCl2, или (в
ионной форме) Sn"+2Fe'" = Sn"" + 2Fe". В этой реакции
ион олова окисляется, ион железа восстановляется; ион железа - окислитель, ион
олова - восстановитель. Баланс зарядов. Отсюда следует, что должен соблюдаться
строгий баланс числа принятых и отданных зарядов. Это дает простой способ
находить стехиометрические коэффициенты при реагирующих молекулах, если
известны исходные и конечные продукты. Пусть имеем реакцию окисления
двухвалентного марганца в виде Mn(N03)2 в семивалентный в
виде НМп04 посредством Рb02, которая при этом восстановляется в
Pb(N03)2 в присутствии азотной кислоты.
Окислительный эквивалент. Окислительный эквивалент п есть
число отрицательных зарядов, принимаемых окислителем. Реакции
окисления-восстановления применяются между прочим в объемном анализе. В
нормальной оксидиметрической системе принимается за единицу концентрации число
граммов, равное молекулярному весу, деленному на окислительный эквивалент, в 1 л
раствора. Окислительный эквивалент может изменяться в зависимости от
условий среды. Сила окислительного действия. Равные концентрации окислителей
разной химической природы действуют неодинаково, будучи способны окислять одно
вещество и являясь недостаточными для окисления другого. Далее вещество, будучи
окислителем, для одного вещества в одной реакции, может явиться восстановителем
для другого, более сильного окислителя в другой реакции, например: S02
+ 3H2 = H2S + 2H20; 2S02 + + 02=2S03-
Мерой силы окислительного действия является окислительный потенциал. Если
построить элемент с раствором окислителя у одного химически инертного электрода
и восстановителя - у другого, растворы соединить жидким проводником, а
электроды - проволокой, то по проволоке потечет ток.
Скорость окисления не всегда соответствует силе
окислительного действия. Сопряженное окисление образованием промежуточных
продуктов с более высоким окислительным потенциалом во многих случаях
объясняется то, что окисляющее вещество (актор), действуя на легко окисляемое
вещество (индуктор), вызывает одновременное окисление третьего вещества
(акцептор), которое само по себе не окисляется или окисляется с трудом под
действием актора (сопряженные реакции). От катализа этот случай
отличается тем, что с прекращением окисления индуктора прекращается окисление
акцептора. В типичных сопряженных реакциях он выражается небольшим целым
числом. Сопряженные реакции окисления помимо образования нестойкой формы могут
быть вызваны также образованием комплексных соединений индуктора с актором или
с акцептором, вообще тогда, когда один процесс идет за счет энергии другого, а
также при образовании комплексных или нерастворимых соединений, удаляющих
продукты из сферы реакции. При окислении кислородом фосфора, скипидара и
некоторых других веществ, образуется озон. Здесь выделенной при окислении
энергии оказывается достаточно, чтобы провести процесс 02^03,
требующий затраты энергии.
Из случаев медленного окисления наиболее важна автооксидация
(Traube, ср. также "активированный кислород" Schonbein'a), механизм
которой стоит в близкой связи с сопряженным окислителем. Под автооксидацией
понимают окисление тел газообразным кислородом, которое происходит само собой,
без всяких дополнительных воздействий. Согласно общепринятой теперь теории Баха
и Энглера (Engler) процесс окисления протекает в 2 стадиях: в первом
присоединяется целая молекула кислорода и образуется перекись (с характерной
группой А она обладает более сильным окислительным действием, чем молекула
кислорода), и поэтому может окислить молекулу какого-нибудь другого вещества
(сопряженная реакция) или того же самого, которое взято для окисления.
Имея в виду, что вся живая природа постоянно находится в
соприкосновении с таким сильным окислителем, как свободный кислород, можно
удивляться ее устойчивости в этом отношении и точной регулировке окисления
(дыхания). Это объясняется действием мощных сопротивлений, именно наличием
катализаторов-замедлителей (antioxy-genes no Moureu). Применение таких
замедлителей имеет большое практическое значение: 1%-ная прибавка спирта к хлороформу
применяется для предохранения его от быстрого загрязнения вредными продуктами,
прибавка 0,1% фенола к акролеину позволила готовить это нестойкое вещество в
больших количествах. Таких примеров известно много, напр.: Вещество Замедлитель
Na2S03 Бензиловый, бутиловый спирты, глицерин, бензойный
альдегид SnCl2 Маннит, крезолы, анилин Бензойный аль- Гидрохинон
дегид Щавелевая к-та Хингидрон, резорцин Адреналин, ал- Сернистая кислота
калоиды Парафин Сера (при нов. t°) Жиры и масла Фенолы, танин, салигенин, ацетилтиомочевина
и др. Шелк Соли олова, роданаты Каучук Фенолы для замедляющего действия имеются
следующие законности: замедление растет с концентрацией замедлителя (рис. 1).
Замедлители-вещества, сами способные к окислению. В некоторых случаях вещества
из замедлителей становятся ускорителями: иод-замедлитель для окислителя
бензойного альдегида, ускоритель для стирола. Ускорители как правило изменяют
скорость реакции не очень значительно (maximum в несколько раз), тогда как
замедлители могут практически совсем подавить реакцию, продолжается 2Н2
+ С (аморфн.) + С (аморфн.) S + 2Р + Mg + Соответственно хотя это действие
повидимому не бесконечно долгое время. Экспериментально показано, что
автооксидация тесно связана с полимеризацией и конденсацией (осмоление).
Катализаторы у них общие.
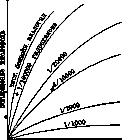
Рисунок 1
Реакции автооксидации сопровождаются свечением и
светочувствительны. Определения, произведенные Бекстремом (Backstrom) для
автооксидации бензойного альдегида, дали длину цепи в десятки тысяч молекул для
первого стадия (А+02) и значительно более короткие во втором (А[02]+А).
Роль замедлителей окисления сводится к обрыву цепей в первом стадии, т. к. цепи
очень длинны, то для этого достаточно прибавления очень малого количества
отрицательного катализатора. Горение происходит при быстром кислении,
сопровождаемом пламенем. Многие вещества, окисляясь, выделяют очень много
тепла. В этих случаях скорость реакции горения зависит от разогревания всей
массы горящего газа. Существует и так называемое холодное пламя, при низких
давлениях, при разбавлении индифферентным газом. Общая t° горящей смеси при
этом очень мала, но энергия отдельных молекул конечно остается очень высокой.
Здесь скорость реакции зависит исключительно от распространения цепей.
Процесс окисления можно описать следующим образом: Чтобы
уголь загорелся, его нужно нагреть. Выделяющаяся при реакции теплота, нагревая
смесь, сможет снова доставить энергию активации. Т. к. с повышением температуры
число активных молекул I очень быстро возрастает, то скорость реакции также
быстро возрастает, обычно при нагревании на 10° в 2 раза. При повышении t° О.
от 200° до 200° скорость реакции увеличивается в 10 раз. Реакции горения суть
цепные реакции. Каждый первичный акт реакции молекулы с кислородом является
началом энергетической цепочки: образовавшаяся молекула в первый момент своего
появления несет очень большую энергию; столкнувшись с молекулой исходного
вещества, она передает ей свою энергию, эта вторая молекула становится
активной, реагирует, процесс повторяется далее и идет цепью. Т. е. число
активных молекул значительно увеличивается сравнительно с первоначальным. Длина
цепей достигает величин порядка 104-10е. Если в своем
продвижении такая цепь встретит молекулы, которые, поглощая энергию, не
реагируют дальше, напр. молекулы постороннего вещества (стенки сосуда), то цепь
обрывается. Т. е. скорость горения зависит от диаметра сосуда. В капиллярах
горение не идет, так как цепи слишком быстро обрываются и газ не успевает
разогреваться. На этом основано действие предохранительной лампы для углекопов,
применение водяных бань с предохранительными металлическими сетками в
лаборатории и т. д. При
низких t° скорость реакции мала, и выделяемое тепло уводится стенками сосуда
(медленное Окисление). С повышением t° скорость реакции увеличивается быстро,
отвод тепла-медленно. При температуре, когда теплоприход уже не компенсируется
теплоотводом, получается лавинообразное увеличение скорости и как следствие -
взрыв, горение. Это и есть t° воспламенения. Температуры воспламенения в смесях
с воздухом при атмосферном давлении: СО, СН4-650°, Н2-5
50°, С2Н2-450°, CSa-350°, РН3-100°.
Зависимость от давления. Когда скорость горения зависит от разогревания всей
массы газа, t° воспламенения зависит от давления. Скорость реакции по закону
действия масс пропорциональна давлениям реагирующих газов и кислорода, а
теплоприход пропорционален скорости реакции. Пусть давление и скорость реакции
малы и теплоприходов зависимости от t° выражается кривой 3, а
теплоотвод-наклонной прямой (рис. 2). Если реакция окисления началась при tp
T0, то теплоприход
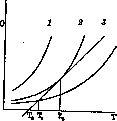
Рисунок 2.
больше теплоотвода и смесь разогревается до ТХг где
эти величины сравняются. Дальше разогревание не произойдет, т. к. теплоприход,
уже меньше возможного теплоотвода (прямая выше кривой 3). Т. е. взрыва
нет. При большем давлении достигается условие (кривая 2), что прямая
касается кривой в точке Т2, выше нее теплоотвод остается
меньше теплоприхода, а скорость реакции чрезвычайно быстро увеличивается -
происходит взрыв. Если давление еще выше (кривая 1), теплоотдача всегда
меньше теплоприхода и быстро наступает взрыв. Т. е. существует низший предел
воспламеняемости, зависящий от давления. Из этих критических давлений можно
вычислить энергию активации. Понижение t° воспламенения при сжатии, т. е.
воспламенение сжатием, использовано в моторе Дизеля. Впрыскивая бензин в
воздух, сжатый до 50 атмосфер, вызывают его моментальное воспламенение; t° газа
повышается при этом до 1 000°.
Существуют пределы воспламенения в зависимости от состава
смеси. Горение в смесях с воздухом происходит лишь при содержании: На-от
10% до 70% Н„ СО - от 16% до 75% СО, светильн. газа-от 8% до 25% газа. Когда
одного компонента слишком много, горение не может распространяться, так как
выделяющаяся при реакции между молекулами энергия растрачивается без
распространения цепей. Аналогичное разбавляющее действие производит прибавление
негорючего газа. Интересно далее существование верхнего предела давления для
горения смесей, выше которого они не загораются.
2. Восстановление. Понятие и виды
Восстановление - Алхимики принимали, что металлы
<#"534698.files/image001.gif"> = Zn2+
Восстановлением называется присоединение электронов атомом,
молекулой или ионом:
Cl2 + 2 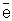 = 2Cl-
= 2Cl-
Окислителями называется нейтральный атом, молекула или ион,
принимающие электроны (во втором примере молекула хлора Cl2),
восстановителями - нейтральный атом, молекула или ион, отдающие электроны (в
первом примере - атом Zn). Окисление и восстановление - взаимосвязанные
процессы, которые всегда протекают одновременно. Когда одно вещество
окисляется, то другое восстанавливается, и наоборот. Так, приведённые выше
частные реакции окисления и восстановления составляют единый процесс О.-в.:
Zn + Cl2 = ZnCl2
Здесь Zn окисляется до Zn2+, а Cl2
восстанавливается до 2Cl-.
В химии окислительно-восстановительные реакции принадлежат к числу
наиболее распространённых. Например, на них, как правило, основано получение
простых веществ (металлов и неметаллов)
CuO + H2 =Cu + H2O,
КВг + Cl2 = Br2 + 2KCl
В основе технического производства таких важнейших химических
продуктов, как аммиак <#"534698.files/image001.gif"> = 1/2Cl2 (окисление аниона Cl-), на катоде
Н+ + 1 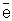 =1/2Н2 (восстановление катиона Н+).
Коррозия
<#"534698.files/image001.gif"> = S°), положительно заряженные ионы
металлов в низшей степени окисления (
=1/2Н2 (восстановление катиона Н+).
Коррозия
<#"534698.files/image001.gif"> = S°), положительно заряженные ионы
металлов в низшей степени окисления (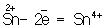 ), сложные ионы и молекулы, содержащие атомы в промежуточной
степени окисления (
), сложные ионы и молекулы, содержащие атомы в промежуточной
степени окисления ( 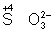 ,
, 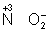 ). В промышленности и технике широко
используются такие восстановители, как углерод и окись углерода (восстановление
металлов из окислов)
). В промышленности и технике широко
используются такие восстановители, как углерод и окись углерода (восстановление
металлов из окислов)
ZnO + С= Zn + СО, FeO +СО = Fe + СО2
сульфит натрия Na2SO3 и гидросульфит натрия
NaHSO3 - в фотографии и красильном деле, металлический натрий и
свободный водород - для получения чистых металлов
4 + 4Na = Ti + 4NaCI,2 +2Н2 = Ge + 2H2O
Окислителями могут быть нейтральные атомы неметаллов (в
особенности галогенов и кислорода), положительно заряженные ионы металлов в
высшей степени окисления (Sn4+ + 2 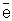 = Sn2+), сложные ионы и
молекулы, содержащие атомы элементов в более высокой степени окисления (
= Sn2+), сложные ионы и
молекулы, содержащие атомы элементов в более высокой степени окисления ( 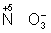 ,
, 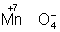 ,
, 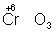 ). Промышленное значение как окислители
имеют: кислород (особенно в металлургии), озон, хромовая и двухромовая кислоты
и их соли, азотная кислота, перекись водорода, перманганат калия, хлорная
известь и др. Самый сильный окислитель - электрический ток (окисление
происходит на аноде).
). Промышленное значение как окислители
имеют: кислород (особенно в металлургии), озон, хромовая и двухромовая кислоты
и их соли, азотная кислота, перекись водорода, перманганат калия, хлорная
известь и др. Самый сильный окислитель - электрический ток (окисление
происходит на аноде).
Для подбора коэффициентов в уравнениях реакций О.-в. служит общее
правило: число электронов, отданных восстановителем, должно равняться числу
электронов, принятых окислителем. Применяют обычно два метода подбора
коэффициентов: метод электронного баланса и электронно-ионный метод.
В методе электронного баланса подсчёт числа принятых и отданных
электронов производят на основании значений степеней окисления элементов до и
после реакции. Например,
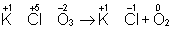
Таким образом, 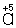 является окислителем, а
является окислителем, а 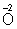 - восстановителем. Составляют частные реакции окисления и
восстановления:
- восстановителем. Составляют частные реакции окисления и
восстановления:
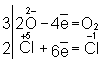
В соответствии с приведённым выше правилом числа отданных и
принятых электронов уравнивают. Полученные величины подставляют в исходное уравнение:
2KClO3 = 2KCl + 3O2
В электронно-ионном методе схему реакции записывают в соответствии
с общими правилами составления ионных реакций, т. е. сильные электролиты
записывают в виде ионов, а неэлектролиты, слабые электролиты, газы и осадки - в
виде молекул. Не изменяющиеся в результате реакции ионы в такую схему не
входят. Например,
KMnO4 + KI + H2SO4 ® K2SO4
+ I2+ MnSO4 + H2O,
в ионном виде:
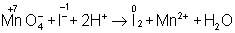
Рассчитав степени окисления, определяют окислитель и
восстановитель и составляют частные реакции окисления и восстановления:
2I- - 2 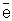 = I2,
= I2,
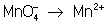
Во втором уравнении, перед тем как записать переход электронов,
необходимо составить "материальный" баланс, т.к. в левой части
уравнения есть атомы О, а в правой их нет. Избыточные атомы О связываются в
молекулы воды ионами Н+, присутствующими в сфере реакции (кислая
среда):
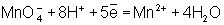
Далее, как и в первом методе, находят коэффициенты-множители к
частным уравнениям для достижения электронного баланса (в приведённом примере 5
и 2 соответственно).
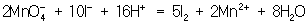 .
.
Полученные коэффициенты подставляют в исходное уравнение:
KMnO4 + 10KI + 8H2SO4
= 6K2SO4 + 5I2 + 2MnSO4 + 8H2O.
Аналогично составляют и уравнения реакций О.-в. в щелочной среде
(вместо ионов Н+ в частных уравнениях фигурируют ионы OH-).
Т. о., в уравнивании реакций по второму методу учитывают характер реакционной
среды (кислая или щелочная либо нейтральная), которая сильно влияет и на направление
реакции О.-в. и на продукты, получаемые в результате реакции. Например,
равновесие окислительно-восстановительной реакции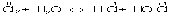 в кислой среде смещено влево, а в щелочной - вправо. Сильный
окислитель ион
в кислой среде смещено влево, а в щелочной - вправо. Сильный
окислитель ион 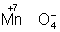 в кислой среде восстанавливается до иона
Mn2+, в щелочной среде - до иона
в кислой среде восстанавливается до иона
Mn2+, в щелочной среде - до иона 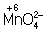 , в нейтральной - до молекулы
, в нейтральной - до молекулы 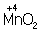 .
.
Заключение
Все химические реакции можно разделить на два типа. К первому
из них относятся реакции, протекающие без изменения степени окисления атомов,
входящих в состав реагирующих веществ.
Например:
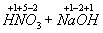 =
= 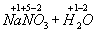
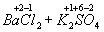 =
= 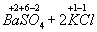
Как видно, степень окисления каждого из атомов до и после реакции
осталась без изменения.
Ко второму типу относятся реакции, идущие с изменением степени
окисления атомов реагирующих веществ.
Например:
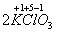 =
= 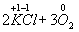
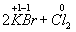 =
= 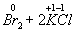
Здесь в первой реакции атомы хлора и кислорода, а во второй -
атомы брома и хлора изменяют степень окисления. Реакции, протекающие с
изменением степени окисления атомов, входящих в состав реагирующих веществ,
называются окислительно-восстановительными. Изменение степени окисления связано
с оттягиванием или перемещением электронов.
Окислительно-восстановительные реакции - самые распространенные и
играют большую роль в природе и технике.
Рассмотрим основные положения теории
окислительно-восстановительных реакций.
. Окислением называется процесс отдачи электронов атомом,
молекулой или ионом. Например:
- 3e- = Al3+ Fe2+
- e- = Fe3+2 - 2e- = 2H+
2Cl- - 2e- = Cl2
окисление восстановление металл
восстановление
При окислении степень окисления повышается.
. Восстановлением называется процесс присоединения электронов
атомом, молекулой или ионом.
Например:
+ 2е-
= S2-
Сl2 + 2е- = 2Сl- Fe3+ +
e- = Fe2+
При восстановлении степень окисления понижается.
. Атомы, молекулы или ионы, отдающие электроны называются
восстановителями. Во время реакции они окисляются.
Атомы, молекулы или ионы, присоединяющие электроны, называются
окислителями. Во время реакции они восстанавливаются.
Так как атомы, молекулы и ионы входят в состав определенных
веществ, то и эти вещества соответственно называются восстановителями или
окислителями.
4. Окисление всегда сопровождается восстановлением, и наоборот,
восстановление всегда связано с окислением, что можно выразить уравнениями:
Восстановитель - е- 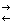 Окислитель
Окислитель
Окислитель + е- 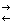 Восстановитель
Восстановитель
Поэтому окислительно-восстановительные реакции представляют собой
единство двух противоположных процессов - окисления и восстановления.
Число электронов, отдаваемых восстановителем, равно числу
электронов, присоединяемых окислителем.
При этом, независимо от того, переходят ли электроны с одного
атома на другой полностью или же лишь частично оттягиваются к одному из атомов,
условно говорят только об отдаче и присоединении электронов.
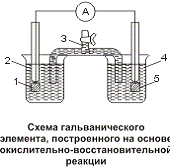
Процессы окисления и восстановления можно физически отделить друг
от друга и осуществить перенос электронов по внешней электрической цепи. Пусть
в стакан 2налит раствор иодида калия КI , а в стакан 4- раствор хлорида железа
(III) FeСl3.
Растворы соединены между собой так называемым
"электролитическим ключом" 3 - U-образной трубкой,
заполненной раствором хлорида калия КCl, обеспечивающим ионную проводимость. В
растворы опущены платиновые электроды 1 и 5. Если замкнуть цепь,включив в нее
чувствительный амперметр, то по отклонению стрелки можно будет наблюдать
прохождение электрического тока и его направление. Электроны перемещаются от
электрода с раствором иодида калия к электроду с раствором хлорида железа
(III), т.е. от восстановителя - ионов I- - к окислителю - ионам Fe3+.
При этом ионы I- окисляются до молекул иода I2, а ионы Fе3+
восстанавливаются до ионов железа (II) Fe2+. Через некоторое время
продукты реакций можно обнаружить характерными реакциями: иод - раствором
крахмала, а ионы Fe2+ - раствором гексациано-(II) феррата калия
(красной кровяной соли) К3[Fе(СN)6].
Приведенная на рисунке схема представляет собой гальванический
элемент, построенный на основе окислительно-восстановительной реакции. Он
состоит из двух полуэлементов: в первом протекает процесс окисления
восстановителя:
2I- - 2e- = I2
а во втором - процесс восстановления окислителя:
Fe3+ + е- = Fe2+
Поскольку эти процессы протекают одновременно, то, умножив
последнее уравнение на коэффициент 2 (для уравнивания числа отданных и
присоединенных электронов) и суммируя почленно приведенные уравнения,
получим уравнение реакции:
I- + 2Fe3+ = I2
+ 2Fe2+
или
KI + 2FeCl3 = I2 +
2FeCl2 + 2KCl
Всякая окислительно-восстановительная реакция может служить источником
электрического тока, если она протекает в гальваническом элементе.
Важнейшие восстановители и окислители
|
Восстановители
|
Окислители
|
|
Металлы,
водород, уголь Оксид углерода (II) CO Сероводород H2S, оксид серы
(IV) SO2,
сернистая кислота H2SO3
и ее соли Иодоводородная кислота HI,
бромоводородная кислотаHBr, соляная
кислота HCl Хлорид олова (II) SnCl2, сульфат железа (II) FeSO4, сульфат марганца (II) MnSO4, сульфат хрома (III)Cr2(SO4)3 Азотистая кислота HNO2, аммиак NH3, гидразин N2H4, оксид азота (II) NO Фосфористая кислота H3PO3
Альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза Катод при
электролизе
|
Галогены
Перманганат калия KMnO4, манганат калия K2MnO4, оксид марганца (IV) MnO2
Дихромат калия K2Cr2O7, хромат калия K2CrO4 Азотная кислота HNO3 Кислород O2, озон О3, пероксид водорода
Н2О2 Серная кислота H2SO4 (конц.), селеновая кислотаH2SeO4
Оксид меди (II) CuO, оксид серебра (I) Ag2O, оксид свинца (IV) PbO2 Ионы благородных металлов (Ag+, Au3+ и др.) Хлорид железа (III) FeCl3 Гипохлориты, хлораты и перхлораты Царская водка, смесь
концентрированной азотной и плавиковой кислот Анод при электролизе
|