Изучение процесса и отработка технологии гидролиза растительных отходов с целью получения спиртов
Изучение процесса и отработка
технологии гидролиза растительных отходов с целью получения спиртов
Содержание
Введение
1. Литературный обзор. Методы получения целевого продукта
1.2 Анализ основной реакции
2. Обсуждение результатов
2.1 Механизм реакции
.2 Кинетическая модель реакции
.3 Обсуждение полученных результатов и выводы
3. Экспериментальная часть.
3.1 Свойства исходных соединений
.2 Синтез глюкозы
4. Инженерные расчеты
4.1 Выбор типа реактора
.2 Расчет материального баланса
.3 Расчет теплового баланса
.4 Операторная схема процесса
Выводы
Библиографический список
Введение
Биоэтанол может быть произведён из широкого разнообразия
целлюлозосодержащего сырья, включая сельскохозяйственные отходы. Целлюлозная
биомасса состоит из целлюлозы, гемицеллюлозы и лигнина, с небольшим количеством
белков, липидов и минеральных веществ. Приблизительно 60 - 65% сухих веществ
целлюлозной биомассы представлены в качестве целлюлозы и гемицеллюлозы.
Целлюлоза представляет собой высокополимерный углевод, состоящий из глюкозидных
остатков C6H10O5. Целлюлоза является одним из
самых распространенных природных органических веществ Земли [1].
Получение биоэтанола из растительных отходов актуально на сегодняшний
день, так как биоэтанол является заменителем традиционных источников горючего.
Биоэтанол - экологически чистое топливо по сравнению с другими видами топлива
(это касается как технологии его получения, так и сжигания его при работе
транспортных установок), при этом происходит максимально полное использование биоресурсов
региона.
Основой технологии производства биоэтанола из растительного сырья
является гидролиз целлюлозы, в результате которого происходит эффективное
разделение сложных полимерных структур целлюлозы на растворимые формы простых
углеводов, пригодных для дальнейшего сбраживания. Основным продуктом гидролиза
целлюлозосодержащего сырья является глюкоза.
Среди многочисленных способов проведения гидролиза выделяют основные -
кислотный и ферментативный гидролиз. Ферментативный гидролиз в настоящее время
представляется более перспективным. Преимуществами ферментативного гидролиза
являются:
лучшие выходы целевого продукта (моносахаридов);
мягкие условия проведения процесса (низкие температуры, атмосферное
давление);
данный способ перспективен с точки зрения создания самостоятельных
малоотходных технологий;
снижение экологической опасности различных производств, перерабатывающих
растительное сырьё и образующих большое количество отходов [2].
Целью данной работы является отработка методики получения биоэтанола из
растительных отходов. Для достижения поставленной цели необходимо решить
следующие задачи:
изучение механизма трансформации целлюлозы в растворимые формы простых
углеводов;
установление факторов, влияющих на гидролиз целлюлозы, определение
оптимальных условий для протекания процесса;
выделение местных штаммов микроорганизмов, позволяющих провести гидролиз
наиболее эффективно;
исследование состава полученного субстрата после гидролиза.
1 Литературный обзор
.1 Методы получения целевого продукта
.1.1 Получение глюкозы альдольной конденсацией
Синтез глюкозы из формальдегида в присутствии гидроксида кальция впервые
был произведён А.М. Бутлеровым в 1861 году.
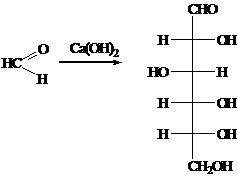
1.1.2 Получение глюкозы неполным окислением многоатомных спиртов

1.1.3
Получение глюкозы гидролизом цианогенных гликозидов
Одна
из группа растительных О-гликозидов - цианогенные гликозиды (содержатся в
семенах некоторых растений), агликоновый компонент которых образован из α-циангидринов. Их особенностью является способность
выделять глюкозу при ферментативном гидролизе, которому они подвергаются
чрезвычайно легко.

.1.4 Получение глюкозы гидролизом крахмала
Ферментативный гидролиз крахмала
Получение D-глюкозы из крахмала с помощью ферментативного гидролиза.
Ферментативный гидролиз крахмала и крахмалоподобных полисахаридов происходит
под действием амилаз. α-Амилаза превращает крахмал в декстрины (олигосахариды,
содержащие 6-10 остатков D-глюкозы)
и небольшое количество мальтозы. Эта стадия гидролиза идет быстро и фиксируется
резким падением вязкости раствора. Декстрины далее медленно гидролизуются при
участии фермента β-амилазы с образованием мальтозы. Под действием
фермента мальтазы происходит гидролиз мальтозы до глюкозы.

Кислотный гидролиз крахмала

.1.5
Получение глюкозы ферментативным расщеплением синигрина
Синигрин
- простейший представитель группы гликозидов, которые расщепляются ферментом
мирозином, специфичным для данного класса соединении. Синигрин в виде калиевой
соли содержится в семенах черной горчицы и в хрене. Под действием мирозина он
расщепляется на D-глюкозу, горчичное масло или аллилизотиоцианат и
бисульфат калия.
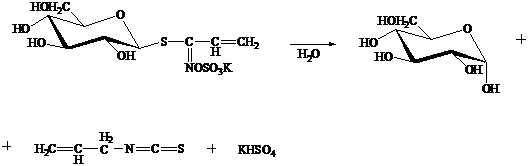
.1.6
Получение глюкозы гидролизом мальтозы
Мальтоза
- солодовый сахар
<#"530855.files/image007.gif">
.1.7
Получение глюкозы кислотным гидролизом сахарозы
В
результате гидролиза сахарозы (тростникового сахара) образуются глюкоза и
фруктоза.
.1.8 Получение глюкозы гидролизом целлюлозы
Гидролиз разбавленной кислотой
Производится при температуре 120-190 0С и давлении выше
атмосферного.
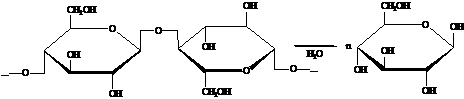
Гидролиз
концентрированной кислотой
Производится
при температуре 55-65 0С и атмосферном давлении.
Ферментативный
гидролиз
Производится
при температуре 40-60 0С и атмосферном давлении.
.2
Анализ основной реакции
1.2.1 Физические свойства реагентов и продуктов реакции
Таблица 1
Физические свойства реагентов и продуктов реакции
|
Вещество
|
Фазовое состояние
|
Плотность, г/см3
|
ТКИП. ТПЛ.,°С
|
Растворимость
|
Примечание
|
|
(С6Н10О5)n целлюлоза
|
Белый волокнистый материал
|
1,52 - 1,54
|
--
|
Не растворима в воде и органических растворителях,
растворима в водных растворах комплексных солей некоторых поливалентных
металлов с NH3 или аминами.
|
Полимерные цепи целлюлозы упакованы в длинные пучки, или
волокна, длина волокон до 50 мм.
|
|
С6Н12О6 глюкоза α-D-глюкопираноза β-D-глюкопираноза
|
Кристаллы белого цвета
|
1,54
|
146 148-150
|
Растворимость в 100 мл Н2О - 82 г при 25 0С,
154 г при 15 0С.
|
Моносахарид сладкого вкуса
|
|
Н2О вода
|
жидкость
|
1,33
|
100 0
|
-
|
|
1.2.2 Электронная структура реагентов и продуктов
реакции
Электронная структура целлюлозы
Целлюлоза представляет собой линейный гетероцепной
стереорегулярный гомополимер, имеющий большое число ОН-групп, образующих
водородную связь. Поэтому целлюлоза является одним из достаточно жестких
полимеров, характеризующихся высокой степенью асимметрии макромолекул. Для нее
характерны значительное внутри- и межмолекулярное взаимодействие и высокий
потенциальный барьер вращения. Однако молекулы целлюлозы не являются абсолютно
жесткими, они способны принимать различные конформации.
Конформационные превращения макромолекул обусловлены
внутренним вращением глюкопиранозных звеньев вокруг гликозидных связей. Эти
конформационные превращения придают цепям целлюлозы гибкость. При нагревании и
(или) пластифицировании целлюлозы ее цепи приобретают сегментальную
подвижность. Особенно сильно гибкость проявляется в растворах. В твердом
состоянии цепи целлюлозы имеют вытянутую форму, а в растворах образуют клубки, свободно
протекаемые растворителем.
Кроме гибкости цепей за счет глюкозидных связей между глюкозными
единицами у целлюлозы возможны конформационные превращения и в самих глюкозных
звеньях. Глюкопиранозные звенья могут принимать форму “кресла” или “ванны”.
Для пиранозного цикла возможно существование двух
конформаций типа кресла (К1 и 1К) и шести конформаций типа ванны, но не все они
равноценны энергетически. Напряжение меньше в циклах типа кресла, поэтому эти
конформации предпочтительнее, а конформации типа ванны менее предпочтительны,
за исключением особых случаев (переход молекулы в процессе реакции в
возбужденное состояние с менее выгодной энергетически конформацией).

а)
б)
Рисунок
1 - а) конформация “кресло”, б) конформация “ванна”
В
естественном состоянии в природных волокнах звенья глюкозы в молекулах
целлюлозы не являются плоскими, а принимают наиболее устойчивую для
глюкопиранозного цикла конформацию K1.
В
целлюлозе между макромолекулами действуют два вида взаимодействий: силы
Ван-дер-Ваальса и водородные связи. Силы Ван-дер-Ваальса в отличие от валентных
сил относят к дальнодействующим. Большое число гидроксильных групп в целлюлозе
обусловливает высокую суммарную энергию водородных связей. Водородные связи
между ОН-группами образуются при сближении их атомов кислорода на расстояние
0,25...0,28 нм. Энергия Н-связи у целлюлозы составляет в среднем около 28
кДж/моль. Эта энергия зависит от расстояния между ОН-группами. При расстояниях
около 0,27...0,28 нм образуются “слабые” связи, при расстояниях порядка 0,25 нм
- “сильные”. Существование различающихся по прочности межмолекулярных Н-связей
объясняет особенности набухания и растворения целлюлозы - слабое набухание в
воде, более сильное в щелочах и возможность неограниченного набухания
(растворения) в комплексных основаниях и других растворителях целлюлозы.
Гидроксильные
группы целлюлозы образуют водородные внутримолекулярные и межмолекулярные
связи. Внутримолекулярные Н-связи образуются в пределах одной цепи между
соседними глюкопиранозными звеньями. Эти связи придают жесткость цепям
целлюлозы. Межмолекулярные Н-связи образуются между цепями и относятся к силам
межмолекулярного взаимодействия. В образовании Н-связей, относящихся к
донорно-акцепторным связям, кроме ОН-групп могут принимать участие в качестве
доноров электронной пары атомы кислорода пиранозного цикла и гликозидной связи.
Водородные связи в целлюлозе имеют очень важное значение.
Они определяют физическую структуру целлюлозы (форму макромолекул, фазовые и
релаксационные состояния, надмолекулярную структуру) и оказывают влияние на все
свойства целлюлозы - физические, физико-химические и химические (химическую
реакционную способность).
У целлюлозы в твердом состоянии возникают регулярная
система Н-связей и вследствие этого кристаллическая решетка, образуются
микрофибриллы, фибриллы, ламеллы и клеточная стенка в целом
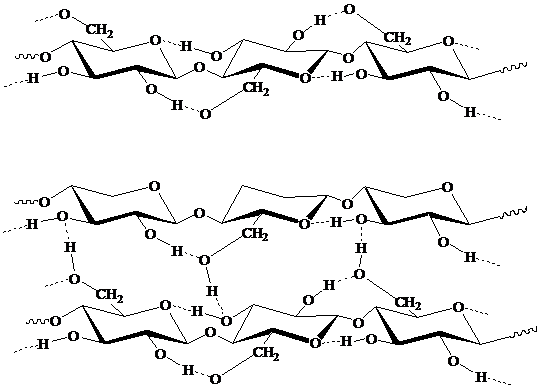
б)
Рисунок
2 - а) внутримолекулярные, б) межмолекулярные водородные связи в целлюлозе
Из-за
высокой энергии когезии, обусловленной Н-связями и превышающей прочность
ковалентных связей в макромолекулах, у целлюлозы невозможно плавление и при
нагревании происходит деструкция. Высокая энергия когезии затрудняет подбор
растворителей. Выделенную из древесины целлюлозу растворяют лишь немногие
растворители, которые способны преодолевать энергию ее межмолекулярного
взаимодействия. Образование Н-связей между цепями целлюлозы и молекулами воды
имеет важное значение при поглощении целлюлозой и древесиной гигроскопической
влаги. Высокая энергия Н-связей, особенно в кристаллических участках, понижает
химическую реакционную способность целлюлозы, оказывая решающее влияние на
скорость диффузии реагентов в целлюлозное волокно. Механические свойства
технической целлюлозы и бумажного листа определяются межволоконными связями,
возникающими в частности в результате образования Н-связей между
макромолекулами целлюлозы на поверхностях фибрилл и волокон.
Надмолекулярная
структура целлюлозы является одним из самых сложных и противоречивых вопросов в
химии древесины. Основными элементами надмолекулярной структуры целлюлозы
считают микрофибриллы, которые могут быть собраны в более крупные агрегаты -
фибриллы. Существуют две основные теории строения целлюлозы:
теория
кристаллического строения, которую в свою очередь можно условно подразделить на
теорию аморфно-кристаллического строения, рассматривающую целлюлозу как
двухфазную систему, и теорию кристаллического строения, рассматривающую
целлюлозу как однофазную систему (одна кристаллическая фаза с дефектами
кристаллической решетки).
теория
аморфного строения.
Большинство
исследователей придерживается теории кристаллического строения целлюлозы.
Модель
элементарной кристаллической ячейки целлюлозы. Кристаллическая решетка
целлюлозы состоит из элементарных кристаллических ячеек. На основании
рентгенографических данных было установлено, что элементарная ячейка Целлюлозы
является моноклинной. С помощью рентгеноструктурного анализа были определены
параметры ячейки: а=8,2·10-8см (8,2 Е); b = 10,3·10-8
см (10,3 Е); с = 7,9·10-8 см (7,9 Е) и β = 83°. Каждая элементарная ячейка целлюлозы вмещает в
свой объем четыре глюкозных звена. Пространственную модель элементарной кристаллической
ячейки целлюлозы в настоящее время не считается окончательной.
Для
целлюлозы характерен полиморфизм. Целлюлоза имеет несколько кристаллических
модификаций. Кристаллическую модификацию природной целлюлозы называют
целлюлозой I. Из других кристаллических модификаций наибольшее
значение имеет целлюлоза II (гидратцеллюлоза), которая получается при обработке
целлюлозы I 16 - 18%-ным раствором NaOH
(мерсеризация) с последующей отмывкой щелочи водой или при осаждении целлюлозы
из раствора, т. е. при получении регенерированной целлюлозы.
Элементарная
ячейка целлюлозы II имеет следующие параметры: а = 8,1·10-8 см
(8,1 Е); b = 10,3·10-8 см (10,3 Е); с = 9,2·10-8
см (9,2 Е) и β = 63°. По сравнению с целлюлозой I
цепи повернуты и центральные цепи несколько смещены. В результате происходит
перераспределение и некоторое ослабление водородных связей.
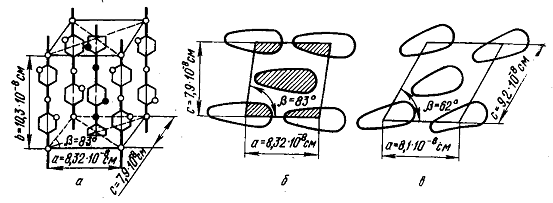
Рисунок
3 - Элементарная кристаллическая ячейка целлюлозы: а) - модель элементарной
кристаллической ячейки целлюлозы I; б) - проекция на плоскости ас модели ячейки
целлюлозы I; в) - проекция на плоскости ас модели ячейки
целлюлозы II
Электронная структура глюкозы
Внутримолекулярное замыкание цикла в циклическую
полуацетальную структуру связано с возникновением нового хирального центра,
аномерного атома углерода. Из одной энантиомерной оксоформы вследствие этого
могут образоваться две хиральные диастереомерные циклические полуацетальные
формы - аномеры. Эти стереоизомеры обозначают как α- и β-формы. В фишеровских проекциях в D-ряду гликозидный гидроксил α-формы располагают справа, а в β-форме - слева.
Диастереомерные циклические полуацетали могут через
промежуточное образование оксоформы превращаться друг в друга:
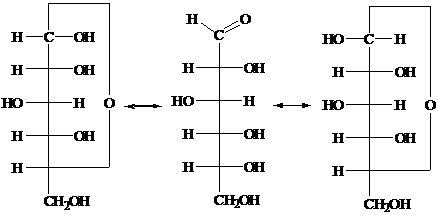
На основании эпимеризации такого рода может быть дано
объяснение явлению мутаротации. D-(+)-Глюкоза
кристаллизуется из воды в виде α-D-(+)-глюкозы (α-D-(+)-глюкопиранозы) c [α]D20 = +111°, из пиридина она
кристаллизуется в виде β-D-(+)-глюкозы (β-D-(+)-глюкопиранозы) с [α]D20 = + 19,2°. В водном растворе
устанавливается равновесие, при котором имеется 36% α-D-(+)-глюкозы и 64% β-D-(+)-глюкозы, что дает для удельного
вращения раствора усредненное значение [α]D20 = + 52,5°.
В водных растворах глюкоза существует в виде
таутомерной смеси открытой и циклической форм (кольчато-цепная таутомерия). При
растворении любого из индивидуальных аномеров происходит его превращение в
другой аномер вплоть до достижения равновесного состояния, после чего
соотношение таутомеров остается постоянным.
По сравнению с проекционными формулами лучшее
представление о конфигурации полуацетальных циклических форм моносахаридов
можно дать с помощью перспективных циклических формул по Хеворту.
Гидроксильные группы при атомах С1 и С2
α-D-глюкопиранозы находятся в цис-положении,
в β-D-глюкопиранозе те же ОН-группы
расположены в транс-положении. Циклические формулы по Хеворту находят широкое
применение, хотя они и недостаточно точно передают истинное пространственное
строение молекул.

Наиболее энергетически выгодной конформацией является конформация кресла.
α-D-глюкопираноза и β-D-глюкопираноза преимущественно должны
существовать в следующих конформациях:
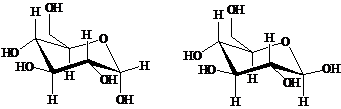
α-D-глюкопираноза β-D-глюкопираноза
Возможно существование двух конформаций типа кресла
(К1и1К), которые энергетически неравноценны. D-Глюкопираноза обычно существует в конформации К1, в которой
группы ОН экваториальны (лежат в плоскости кольца), а не в конформации 1К, в
которой группы ОН аксиальны (перпендикулярны плоскости кольца).
а)
б)
в)
Рисунок
4 - а), в) конформация К1, б) конформация 1К
Конформация
К1 с экваториальным расположением гидроксильных групп энергетически более
выгодна, в этой конформации гидроксилы оказываются более реакционноспособными,
например по отношению к реакциям этерификации, и легче образуют глюкозидные
связи.
На
устойчивость конформации моносахаридов сильное влияние оказывает так называемый
Δ2-эффект,
обусловленный присутствием в цикле атома кислорода. Δ2-Эффект
проявляется в том случае, если гидроксил при С2 расположен
аксиально, а заместитель при С1 - экваториально. При этом
кислородные атомы гидроксилов при С1 и С2 и кислород
цикла оказываются пространственно сближенными, что приводит к сильному
отталкиванию одноименно заряженных атомов, вследствие чего конформация
оказывается очень неустойчивой.
Второй эффект, связанный с влиянием кислорода в цикле, заключается в
большей устойчивости производных по С1 у α-аномера, несмотря на то, что в нем
гидроксил занимает аксиальное положение, а в β-аномере - экваториальное. Этот
эффект, называемый “аномерным”, обусловлен взаимодействием диполя связи С-X (в частном случае С-О) и суммарного
диполя неподеленной пары электронов атома кислорода и электронов цикла.
Величина аномерного эффекта зависит от полярности связи С-X. Если заместитель X экваториален, то угол между диполями
мал и отталкивание сильнее, при аксиальном заместителе угол значительно больше
и взаимодействие слабее:

Электронная структура воды
Молекула воды имеет угловое строение. Угол ÐН-О-Н =104,50.. Связь О-Н
в молекуле воды является полярной, на атоме кислорода существует частично
отрицательный заряд d─, на
атоме водорода частично положительный заряд d+ . В целом молекула воды является диполем.
δ- δ+
O −− H
δ+ |
H
.2.3 Химические свойства реагентов и продуктов реакции
Химические свойства целлюлозы
) Нитрование целлюлозы смесью концентрированных серной и азотной кислот.

2) Взаимодействие с металлическим натрием.
В результате реакции образуется алкоголят целлюлозы.

)
Реакция этерификации
При
метилировании диметилсульфатом в присутствии щёлочи всегда образуются
трёхзамещённые продукты.

)
Ацетилирование целлюлозы.
Триацетат
целлюлозы получают ацетилированием целлюлозы уксусным ангидридом в кислой
среде.

)
Гидролиз целлюлозы.
Гидролиз
проводится концентрированными либо разбавленными кислотами, либо под действием
ферментов, реакция ведётся при повышенной температуре (45 - 95 0С).
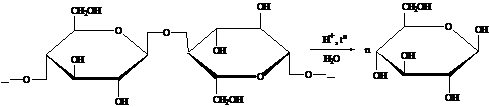
)
Целлюлоза хорошо растворяется в щёлочи в присутствии сероуглерода, образуя
ксантогенаты.

7) При действии различных окислителей на целлюлозу принципиально возможно
протекание реакций окисления ОН-групп элементарного звена, описываемых
следующими схемами:
а) Окисление первичных гидроксильных групп элементарного звена до
альдегидных групп:

б)
Окисление первичных гидроксильных групп до карбоксильных:

в)
Окисление первичных гидроксильных групп элементарного звена у С2 или
у С3, или у С2 и С3 одновременно до кетогрупп:

г)
Одновременное окисление двух вторичных гидроксильных групп элементарного звена
до альдегидных, сопровождающееся разрывом пиранозного цикла:

д)
При комбинированном действии окислителей может произойти дальнейшее окисление
альдегидных групп до карбоксильных:

В большинстве случаев при действии различных
окислителей на целлюлозу происходит одновременное окисление как первичных, так
и вторичных гидроксильных групп с образованием в различном соотношении
альдегидных, кето- и карбоксильных групп, находящихся у различных атомов
углерода элементарного звена макромолекулы (так называемое неизбирательное
окисление целлюлозы). Соотношение карбонильных и карбоксильных групп в
продуктах окисления целлюлозы зависит от условий проведения процесса, в
частности от рН среды.
Вместе с тем, имеется ряд окислителей, применение
которых дает возможность осуществить окисление ОН-групп, расположенных у
определенных углеродных атомов элементарного звена, с образованием продуктов
окисления, содержащих, в основном, кроме гидроксильных групп один тип
функциональных групп (избирательное окисление).
Избирательное окисление целлюлозы может быть
осуществлено по двум основным схемам:
при действии на целлюлозу двуокиси азота происходит
преимущественное окисление первичных гидроксильных групп до карбоксильных.
- при действии на целлюлозу водных растворов йодной кислоты и ее солей
или растворов, тетраацетата свинца в неводных растворителях происходит
одновременное окисление обеих вторичных гидроксильных групп до альдегидных,
сопровождающееся разрывом пиранозного цикла элементарного звена макромолекулы
целлюлозы.
) Взаимодействие с альдегидами.
Образование ацеталей формальдегида может протекать в двух направлениях:
а) внутримолекулярная реакция:

б)
межмолекулярная реакция с образованием сшитого полимера:

Химические свойства глюкозы
1) Реакции по гидроксильной группе.
а) Алкилирование. Результат взаимодействия
зависит от природы алкилирующего агента и условий реакции. Метанол в
присутствии сухого НСl
метилирует только полуацетальный или полукетальный гидроксил, образуя смесь α- и β-метилглюкопиранозидов. Алкилирование
остальных гидроксильных групп удается осуществить только действием сильных
алкилирующих средств, например, диметилсульфата (СН3)2SO4 и щелочи.
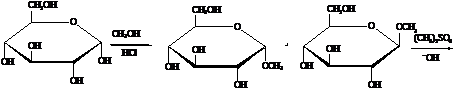
α-D-глюкопираноза
метил-α-D-глюкопиранозид
метил-β-D-глюкопиранозид
метил-2,3,4,5-тетраметил-α-D-глюкопиранозид
б)
Ацилирование. Глюкоза легко этерифицируется с образованием сложных
эфиров. Ацилирование обычно осуществляют избытком уксусного ангидрида в
присутствии кислотных (H2SО4, ZnCl2) или основных (CH3COONa)
катализаторов. Соотношение между α- и β-аномерными пентаацетатами можно регулировать, меняя
условия реакции.
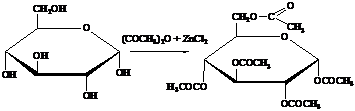
При повышенных температурах в результате
взаимопревращений α- и β-ацетатов образуется смесь, состоящая
на 90% из α- и на 10% из β-аномеров. При 0 °С образуется в основном
β-аномер.
2) Реакции по карбонильной группе.
а) В результате взаимодействия D-глюкозы с избытком фенилгидразина сначала образуется фенилгидразон,
который дегидрируется второй молекулой фенилгидразина, превращающейся при этом
в аммиак и анилин с формированием второй карбонильной группы. Последующая
реакция третьей молекулы фенилгидразина приводит к бис-фенилгидразону, или
озазону.

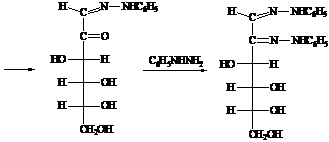
б)
Реакции глюкозы с гидроксиламином. Оксимы глюкозы в растворах образуют
таутомерные циклические α- и β- формы.

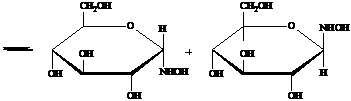
На
этой реакции основан один из способов укорочения цепи глюкозы:

Дегидратация
оксима при действии уксусного ангидрида сопровождается одновременным
ацилированием всех гидроксигрупп. В результате последующей переэтерификации с
образованием метилацетата и одновременного отщепления HCN образуется
альдоза с углеродной цепью, укороченной по сравнению с исходной на один атом
углерода, - D-арабиноза.
)
Дегидратация глюкозы.
Происходит
при действии минеральных кислот и приводит к производному фурана -
4-гидроксиметилфурфуролу, который, теряя молекулу муравьиной кислоты,
превращается в левулиновую (4-оксопентановую) кислоту.

) Реакции окисления.
Окисление глюкозы можно осуществить различными по силе
окислителями, которые, соответственно этому, дают разные продукты окисления.
Глюкоза окисляется до гликоновой кислоты в мягких
условиях такими слабыми окислителями, как:
а) бромная вода Вr2/Н2О
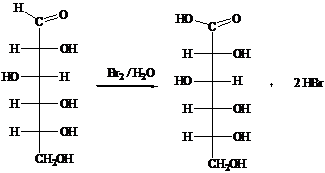
б)
реактив Толленса (реакция “серебряного зеркала”):
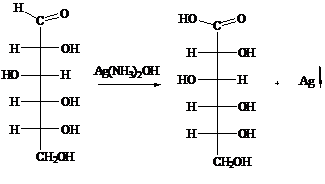
в) раствор Фелинга: CuSО4
+ NaOH + KOOC-CHOHCHOHCOONа.
В результате реакции выпадает красный осадок оксида меди.

Сильные
окислители, например, концентрированная HNO3, окисляют оба концевых атома углерода глюкозы с
образованием сахарных (гликаровых) двухосновных кислот:

В щелочной среде окисление обычно идет с разрывом С-С
связи и образованием продуктов окисления с меньшей длиной углеродной цепи.
Расщепление глюкозы осуществляют также действием периодат-иона IO-4 или тетраацетата свинца (СНзСОО)4Рb - специфических реагентов на α-гликольную группировку.
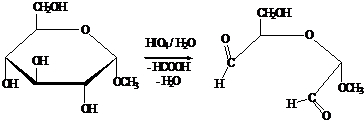
Анализ
продуктов окисления позволяет установить строение моносахаридов.
В
результате расщепления D-глюкозы образуются иные продукты реакции:
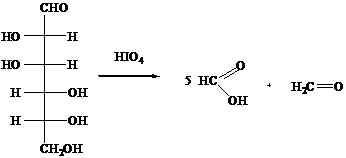
5) Реакции восстановления
Восстановление глюкозы амальгамой натрия в
разбавленной H2SO4, NaBH4 в воде или каталитически водородом
над Ni, Pt, Pd идет легко, с
образованием многоатомных спиртов. Глюкоза при восстановлении дает D-сорбит.
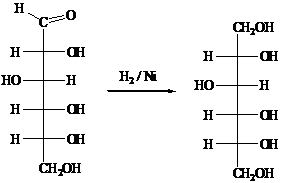
)
Брожение моносахаридов
Отличительным
свойством моносахаридов является их способность вступать в анаэробное (без
доступа кислорода) расщепление под влиянием микроорганизмов или выделенных из
них ферментов. Такие процессы называются брожением.
Характер
продуктов брожения зависит от типа микроорганизма, условий, при которых оно
осуществляется (рН, наличие или отсутствие кислорода, природа субстрата и т.
д.).
а)
Спиртовое брожение - это расщепление глюкозы в анаэробных условиях
смесью ферментов - зимазой, которую выделяют дрожжевые грибки.

В результате анаэробного ферментативного расщепления
глюкоза превращается в пировиноградную кислоту, которая декарбоксилируется
пируватдекарбоксилазой. Образующийся уксусный альдегид восстанавливается до
этанола восстановленным никотинамидадениндинуклеотидом (НАД·Н), входящим в
состав фермента алкогольдегидрогеназы.
б) Уксуснокислое брожение. Если брожение
осуществляется в присутствии кислорода, то в качестве основного продукта
получают уксусную кислоту. В атмосфере воздуха возникающий в процессе брожения
спирт окисляется кислородом при катализе алкогольоксидазой, выделяемой
уксуснокислыми бактериями (Acetobacter).
СН3СН2ОН → СН3СООН
+ Н2О2
в) Молочнокислое брожение. При ферментативном
брожении под действием Lactobacillus delbruckii
пировиноградная кислота восстанавливается до молочной кислоты с помощью НАД·Н.
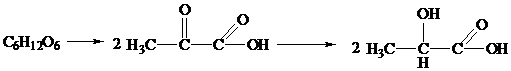
г)
Лимоннокислое брожение глюкозы можно осуществить под действием Aspergillus niger, Citromyces pfefferianus, Citromyces graber.
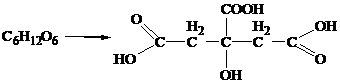
Химические свойства воды
Вода - одно из наиболее реакционноспособных соединений. Проявление
окислительно-восстановительных свойств возможно при взаимодействии воды с
активными восстановителями или окислителями:
вода окислитель:
Na + Н2О = 2NaOH + Н2
вода восстановитель:
F2 + 2 Н2О = 4HF + O2
внутремолекулярный окислительно-восстановительный процесс (при 1000 0С):
Н2О = 2Н2 + O2
Кислотно-восстановительные свойства воды проявляются в следующих процессах:
самоионизация (характерна для жидкой воды):
Н2О + Н2О = Н3О+ + ОН-
- вода является амфотерным электролитом:
Н3 + Н+ОН- = NН4+
+ ОН-
NаCN + Н+ОН- = NaOH
+ Н+СN
. Реакции гидратации:
гидратация оксидов:
2О
+ Н2О = Н2SО4
NaO + Н2О = 2 NaOH
образование кристаллогидратов:
CuSО4
+Н2О = CuSО4
·Н2О
. Реакции гидролиза:
гидролиз солей
2CО3
+ Н2О = NaHCО3 + NaОН
FеСl3 + Н2О = FеОНСl2 + НСl2S3
+ 6Н2О = 2Al(OH)3 + 2 Н2S
гидролиз карбидов металлов:
4С3
+ 12Н2О = 4Al(OH)3 + 3 СН4
гидролиз сложных эфиров (при воздействии температуры и водоотнимающего
средства):
СН3СООС2Н5 + Н2О → СН3СООН
+ С2Н5ОН
гидролиз полисахаридов (при воздействии температуры и водоотнимающего
средства):
(С6Н10О5 ) n + Н2О
→ n С6Н10О6
гидролиз белка до аминокислот:
NН2
−СН2 − CО−NH−CH(CH3) COOH + Н2О →
→ NН2 −СН2 −
CОOH + NН2
−CH(CH3) COOH
гидролиз целлюлоза микроорганизм биоэтанол
2. Обсуждение результатов
.1 Механизм реакции
Наличие в макромолекуле целлюлозы гликозидных связей
между элементарными звеньями является причиной сравнительно низкой устойчивости
целлюлозы к действию водных и спиртовых растворов кислот, а также воды при
высокой температуре. Хотя при высоких температурах гидролиз целлюлозы может
быть осуществлен действием воды и в отсутствие кислот, однако скорость распада
гликозидных связей целлюлозы в этих условиях очень мала. Для повышения скорости
реакции гидролиз целлюлозы проводят в присутствии минеральных кислот
(разбавленных или концентрированных), а также ферментов [25].
Механизмы
кислотного и ферментативного гидролиза идентичны друг другу. Это происходит по
причине того, что в состав ферментов входят коферменты, необходимые для
осуществления каталитического действия ферментов. Никотинамидадениндинуклеотид
(НАД) и его восстановленная форма НАДН - кофермент <#"530855.files/image053.gif">
б) оксониевый ион медленно диссоциирует с образованием гликозил-катиона
(наиболее медленная стадия гидролиза):

в)
гликозил-катион реагирует с водой:
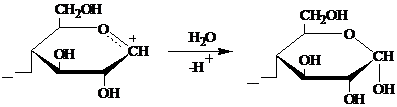
При
разрыве всех гликозидных связей в макромолекуле целлюлозы (т. е. при её полном
гидролизе) образуется глюкоза [1]:
.2
Кинетическая модель реакции
Реакция
взаимодействия целлюлозы с водой под действием ферментов является реакцией
второго порядка. Скорость ее будет определяться как произведение константы
скорости реакции на концентрацию целлюлозы и концентрацию воды:
υr = K·Сц·Св
Сц
- концентрация целлюлозы; Св - концентрация воды; К - константа
скорости химической реакции.
2.3 Обсуждение полученных результатов и выводы
Переработка растительного целлюлозосодержащего сырья имеет целый ряд
особенностей по сравнению с давно известными процессами гидролиза крахмала,
основные из них:
предварительная обработка растительной массы, в том числе активирующая
обработка;
культивирование микроорганизмов и получение ферментных препаратов;
собственно биохимические трансформации исходного сырья в целевой продукт
(глюкозу или др. гексозы).
Предварительная обработка растительного сырья может осуществляться
несколькими методами:
физическими воздействиями (механической дезинтеграцией и др.);
термическими и гидротермическими воздействиями, в том числе методами
“парового взрыва”;
химической обработкой (кислотной, щелочной, окислительной, воздействием
органических растворителей и др.);
биологическим воздействием лигнинразрушающих микроорганизмов и др. [26]
Важнейшей задачей указанных методов обработки является либо активация
растительной биомассы, либо микробиологическое удаление лигнинового компонента
с применением микроорганизмов, образующих лигнинолитические ферменты,
разрушающие лигнин. Во многих случаях используется комбинация различных
методов. [27]
В наших экспериментах предобработка проводилась путем механического
измельчения.
Выбор штаммов микроорганизмов во многом определяет эффективность
биохимических процессов. Важнейшими для исходных трансформаций целлюлозы в
гексозы (глюкозы) являются микроорганизмы, образующие целлюлолитические
ферменты.
Выбор ферментобразующих микроорганизмов для дальнейшей трансформации
глюкозы (и других моносахаридов) определяется видом целевого продукта.
Подробные данные о промышленно применяемых микроорганизмах, видах продуцируемых
ими ферментов, получении иммобилизованных на носителе ферментах взяты из
соответствующей литературы [28, 29, 30].
Мы остановились на штаммах микроскопических грибков родов Trichoderma и Aspergillum, а также бактериях рода Clostridium. Бактерии рода Clostridium были представлены двумя видами -
мезофильным видом Cl. Omelianskii и термофильным видом Cl. Thermocellum, культивированные на синтетической
питательной среде Имшенецкого.
Микробиологическая деградация растительных материалов производится в
аэробных или анаэробных условиях, периодическими и непрерывными методами с
применением различных технологий и аппаратурных решений.
В лаборатории используется периодический метод культивирования в
анаэробных условиях (для бактерий рода Clostridium) и факультативно аэробных условиях
для грибков родов Trichoderma и Aspergillum.
Для крупнотоннажных производств целесообразно применение непрерывных
процессов и соответствующего аппаратурного оформления, что имеет немало
преимуществ, но и вызывает ряд трудностей. Поэтому выбор конкретной
технологической схемы должен определяться, исходя из вида используемого
растительного сырья, вида микроорганизмов и многих других факторов. При этом
большое значение имеет оптимизация питательной среды, содержащей источники
углерода, азота, а также фосфора, серы, ионов щелочных и щелочноземельных
металлов, микроэлементов и других минеральных веществ. Условия культивирования
микроорганизмов, в том числе рН среды, концентрация компонентов, температура
играют важную роль в обеспечении максимальной производительности, минимизации
побочных реакций и обеспечении максимального выхода целевого продукта. [31]
Процессы получения органических соединений на основе растительного сырья
и их дальнейшей трансформации в некоторые виды мономеров и полимеров методами
биохимической технологии имеют перед указанными выше химическими методами целый
ряд преимуществ.
Биохимические процессы получения волокнообразующих мономеров и полимеров
наименее энергоемки, позволяют получать заданные продукты с высокими выходами,
экологически менее вредны по сравнению с традиционными химическими технологиями
(отходы производства обычно легко ассимилируются в окружающей среде). Причина
этого - в избирательности действия микроорганизмов, малых величинах энергий
активации протекающих реакций и невысоких температурах их проведения [32].
Был проведен эксперимент по сравнению эффективности кислотного и
ферментативного гидролиза при получения гексоз (глюкозы) из
целлюлозосодержащего сырья. Были проведены исследования следующего целлюлозного
сырья: древесина тополя, трава (смесь разнообразных трав), высшая водная
растительность (макрофиты). Результаты занесены в таблицы 2, 3, 4. Был проведен
ряд экспериментов. Степень конверсии растительного сырья в моносахариды
определялась через разные промежутки времени после начала гидролиза: через 3
ч., 24 ч., 48 ч., 72 ч. Дальнейшее проведение гидролиза не имеет смысла, так
как максимальное время гидролиза, указанное по литературным данным, варьирует
от 72 до 80 часов максимум.
Кислотный гидролиз рассматривался только концентрированными кислотами,
так как гидролиз разбавленными кислотами должен проводиться при высоком
давлении, которое в условия лаборатории, в которой проводился эксперимент,
невозможно достичь.
Таблица 2
Сравнение скорости и эффективности разных видов гидролиза для извлечения
моносахаридов из биомассы древесины тополя
|
Время гидролиза, час
|
Конверсия целлюлозы, %
|
|
Кислотный гидролиз
|
Ферментативный гидролиз
|
|
H2SO4
|
HCl
|
Aspergillum
|
Trichoderma
|
Clostridium
|
|
3
|
15
|
13
|
12
|
18
|
19
|
|
24
|
26
|
28
|
24
|
25
|
35
|
|
48
|
39
|
42
|
50
|
49
|
46
|
|
72
|
45
|
49
|
54
|
51
|
49
Рисунок 5 - Зависимость конверсии целлюлозы биомассы древесины тополя от
времени и разных видов гидролиза
Таблица 3
Сравнение скорости и эффективности разных видов гидролиза для извлечения
моносахаридов из биомассы высшей водной растительности (пресноводная)
|
Время гидролиза, час
|
Конверсия целлюлозы, %
|
|
Кислотный гидролиз
|
Ферментативный гидролиз
|
|
H2SO4
|
HCl
|
Aspergillum
|
Trichoderma
|
Clostridium
|
|
3
|
29
|
27
|
20
|
23
|
24
|
|
24
|
39
|
42
|
44
|
50
|
39
|
|
48
|
45
|
46
|
48
|
56
|
45
|
|
72
|
47
|
50
|
55
|
60
|
51
|
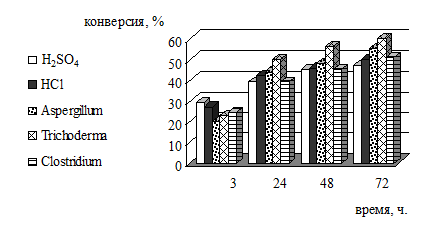
Рисунок 6 - Зависимость конверсии целлюлозы биомассы высшей водной
растительности от времени и разных видов гидролиза
Таблица 4
Сравнение скорости и эффективности разных видов гидролиза для извлечения
моносахаридов из биомассы травы
|
Время гидролиза, час
|
Конверсия целлюлозы, %
|
|
Кислотный гидролиз
|
Ферментативный гидролиз
|
|
H2SO4
|
HCl
|
Aspergillum
|
Trichoderma
|
Clostridium
|
|
3
|
16
|
16
|
24
|
20
|
18
|
|
24
|
28
|
30
|
48
|
44
|
30
|
|
48
|
39
|
41
|
54
|
52
|
45
|
|
72
|
46
|
48
|
57
|
54
|
54
|
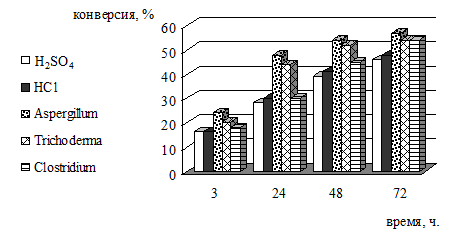
Рисунок 7 - Зависимость конверсии целлюлозы биомассы травы от времени и
разных видов гидролиза
Проанализировав полученные результаты можно отметить более высокий
процент конверсии полисахаридов в моносахариды в процессе ферментативного
гидролиза. Большая эффективность гидролиза получена при конверсии биомассы
высшей водной растительности. Это можно объяснить тем, что в состав клеток
высшей водной растительности входят, помимо целлюлозы и гемицеллюлоз, довольно
высокий процент крахмала, есть инулин, а также имеются глюкоза и фруктоза.
Поэтому в гидролизате обнаруживается больший процент моносахаридов. Сравнивая
штаммы микроорганизмов, можно отметить что для древесины и травы наиболее
эффективным оказался Aspergillum, для макрофитов - Trichoderma.
Из рассмотренных микроорганизмов наименьшую эффективность показали
бактерии рода Clostridium. Но даже этот наименее эффективный
организм гидролизует целлюлозу лучше, чем кислота.
Незначительная разница в эффективности гидролиза древесины (меньшая
конверсия) и травы объясняется мешающим действием лигнина, содержащемся в
древесине, т.к. предварительная делигнификация не проводилась.
Ферментативный гидролиз наиболее эффективно протекает в первые сутки (на
сырье, прошедшем предпоготовку), затем скорость его снижается, скорее всего, в
силу ингибирования процесса продуктом реакции.
Количество целлюлозы и сопутствующих сахаров в сырье брали по
литературным источникам [33, 34].
Определение углеводов (моносахаридов) проводилось по результатам
качественной реакции аммиачного раствора оксида серебра на глюкозу (реакция
“серебряного зеркала”) по количеству выделившегося осадка серебра
гравиметрическим методом. Методика проведения реакции соответствует
литературным данным [35].
Сравнительный анализ ферментативного и кислотного гидролиза (по условиям
проведения и выходу гексоз) приведён в Таблице 5. Данные для кислотного
гидролиза разбавленными кислотами взяты из литературных источников [27, 35].
Таблица 5
Сравнение кислотного и ферментативного гидролиза
|
Показатели
|
Гидролиз разбавленной кислотой
|
Гидролиз концентрированной кислотой
|
Ферментатив-ный
гидролиз
|
|
Температура, oC
|
120 - 190
|
55 - 65
|
40 - 60
|
|
Давление
|
Выше атмосферного
|
Атмосферное
|
Атмосферное
|
|
Получаемые продукты
|
Гексозы (глюкоза и др.), пентозы, фурфурол,
гидроксиметилфур-фурол и др.
|
Гексозы (глюкоза и др.), пентозы, фурфурол,
гидроксиметилфурфу-рол и др.
|
Гексозы (глюкоза и др.), пентозы
|
|
Выход гексоз, %
|
45 - 50
|
45 - 50
|
85 - 95
|
Сравнительно низкий выход глюкозы, полученный в данной работе при
проведении экспериментов, объясняется тем, что используемые для проведения
ферментативного гидролиза микроорганизмы были выращены в условиях лаборатории.
Таблица 6
Сравнение ферментативного гидролиза высокоэффективными промышленными
штаммами (1), и штаммами, полученными в лаборатории ВПИ (2)
|
Культура, используемая в качестве источника полисахаридов
|
Конверсия целлюлозы, %
|
|
Aspergillum
|
Trichoderma
|
Clostridium
|
|
1
|
2
|
1
|
2
|
1
|
2
|
|
древесина тополя
|
86
|
54
|
80
|
51
|
82
|
49
|
|
высшая водная растительность
|
-
|
55
|
-
|
60
|
-
|
51
|
|
биомасса травы
|
87
|
57
|
84
|
54
|
84
|
54
|
3. Экспериментальная часть
.1 Свойства исходных соединений
Глюкоза синтезируется из целлюлозы по стандартной методике. Свойства
глюкозы соответствуют литературным данным [2, 8].
.2 Синтез глюкозы
Перед проведение ферментативного гидролиза целлюлозы необходимо провести
культивирование микроорганизмов, под действием которых будет происходить
реакция гидролиза, а также провести подготовку исходного сырья путём её
механического измельчения.
Определение глюкозы
Реакция "серебряного зеркала" - это реакция восстановления
серебра в аммиачном растворе оксида серебра (реактив Толленса). В водном
растворе аммиака оксид серебра образует комплексное соединение - гидроксид
диамин серебра [Ag(NH3)2]OH
Ag2O + 4 NH4OH => 2 [Ag(NH3)2]OH
+ Н2O
при действии которого на альдегид происходит
окислительно-восстановительная реакция с образованием соли аммония:
R-CH=O + 2 [Ag(NH3)2]OH => RCOONH4
+ 2 Ag +3 NH3 + H2O
Серебряное зеркало образуется в том случае, если восстанавливающееся
серебро осаждается на гладких стенках сосуда из не слишком концентрированных
растворов. Малейшие загрязнения мешают восстанавливающемуся серебру
прикрепиться к стеклу и заставляют его выделяться в виде рыхлого осадка.
Кетоны окисляются значительно труднее, чем альдегиды, поэтому кетоны не
дают реакции "серебряного зеркала", поэтому реакция "серебряного
зеркала", может использоваться как качественная реакция на альдегиды. Так,
реакцию "серебряного зеркала", можно использовать как отличительную
между глюкозой и фруктозой. Глюкоза относится к альдозам (содержит альдегидную
группу в открытой форме), а фруктоза - к кетозам (содержащие кетогруппу в
открытой форме). Поэтому глюкоза дает реакцию "серебряного зеркала",
а фруктоза - нет.
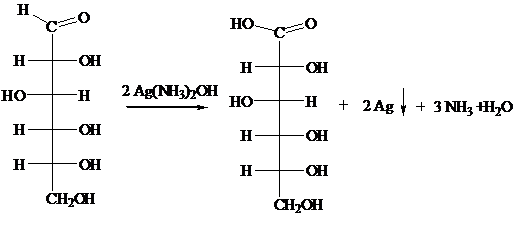
Используя
реактив Толленса проведём окисление раствора глюкозы, полученного в 11 разных
опытах в зависимости от времени протекания гидролиза. Определим массу выпавшего
осадка серебра, находящуюся в прямой зависимости от концентрации глюкозы в
растворе.
|
№ опыта
|
Время гидролиза, ч.
|
Масса серебра, выпавшего в осадок, г
|
|
1
|
12
|
0,0011
|
|
2
|
14
|
0,0024
|
|
3
|
16
|
0,0040
|
|
4
|
18
|
0,0058
|
|
5
|
20
|
0,0081
|
|
6
|
22
|
0,0174
|
|
7
|
24
|
0,0179
|
|
8
|
26
|
0,0189
|
|
9
|
28
|
0,0196
|
|
10
|
30
|
0,0207
|
|
11
|
32
|
0,0218
|
Наибольшая масса выпавшего в осадок серебра наблюдается при максимальном
времени проведения глюкозы, что связано с образованием максимального количества
молекул глюкозы в результате ферментативного гидролиза.
Проведём окисление реактивом Толленса раствора глюкозы, полученного в
результате проведения ферментативного гидролиза различного сырья (опыты 1-5),
время проведения гидролиза для всех опытов 22 часа. Определим массу выпавшего в
осадок серебра.
|
№ опыта
|
Время гидролиза, ч.
|
Масса серебра, выпавшего в осадок, г
|
|
1
|
22
|
0,0174
|
|
2
|
22
|
0,0132
|
|
3
|
22
|
0,0191
|
|
4
|
22
|
0,0186
|
|
5
|
22
|
0,0159
|
Из результатов опыта видно, что наибольшая масса серебра выпадает в
осадок при проведении опыта №3, соответствующего измельчённой листве тополя.
Следовательно, гидролиз данного вида сырья является наиболее эффективным с
точки зрения выхода глюкозы.
.2.1 Методика культивирования микроорганизма Clostridium
В анаэробных условиях процесс разложения клетчатки идет за счет
мезофильных и термофильных бактерий рода Clostridium.
Cl.omelianskii имеет вид длинных палочковидных
клеток (4-8 мкм), в старых культурах длина 10-15 мкм, расположены одиночно или
соединены в нити. Споры шаровидные, формируются на конце клетки, клетка
принимает форму барабанной палочки. Выделяется из почвы и воды. Оптимальная
температура роста 25-30°С.
Из термофильных форм особо активно разрушает клетчатку Cl.thermocellum. Он представлен прямыми или слегка
изогнутыми палочками с округлой спорой на конце клетки. Оптимальная температура
роста 55-60°С [24].
1) Материалы
и оборудование.
Ножницы, спиртовка, пинцет, предметные стекла, микробиологическая петля,
микроскоп, пробирка. Компоненты среды Имшенецкого, водные растворы фуксина и
генцианвиолета.
) Ход работы.
Для получения накопительной культуры анаэробных клетчаткоразрушающих
бактерий используется питательная среда Имшенецкого.
Таблица 7
Состав среды Имшенецкого
|
Компоненты среды
|
г/л дистиллированной воды
|
|
NaNH4HPО4
|
1,0
|
|
K2HPО4
|
0,5
|
|
NaСl
|
0,1
|
|
пептон
|
5,0
|
|
KH2PО4
|
0,5
|
|
MgSО4
|
0,4
|
|
СаСО3
|
2,0
|
Также добавляется MnSO4 или FeSO4 - 1 капля 1%-ного раствора.
рН среды должен составлять 7,0 - 7,4.
а) Питательную среду разливают высоким слоем в большие пробирки и в
каждую пробирку нарезают 2-3 полоски фильтровальной бумаги длиной 6-8 см,
шириной 0,5 см.
б) Пробирку с питательной средой стерилизуют в автоклаве при давлении 1
атм 20 мин.
в) Пробирку помещают в термостат при температуре 30-35°С для выделения
мезофильных форм, остальные пробирки выдерживают в термостате при 60-65°С для
накопления термофильных клетчаткоразрушающих бактерий.
При 60°С через 3-4 суток в пробирках бурно начинается процесс разрушения
клетчатки, жидкость пенится, выделяются газы. Полоски фильтровальной бумаги
желтеют, ослизняются, постепенно превращаясь в аморфную массу, и оседают на
дно. Брожение заканчивается на 8-10-е сутки. При температуре 30-35°С клетчатка разрушается
медленнее и заканчивается через 2-3 недели.
Разрушенные массы клетчатки подвергают микроскопическому анализу.
Микробиологической петлей разрушенную клетчатку переносят на предметное стекло
в каплю жидкости из пробирки и делают мазок.
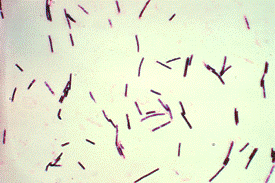
Рисунок 8 - Бактерии рода Clostridium
Мазок окрашивают фуксином или генцианвиолетом и микроскопируют, пользуясь
объективом МИ-90. Идентифицируют полученные микроорганизмы [29].
.2.2 Методика культивирования микроорганизмов рода Aspergillus
В факультативно аэробных условиях деструкция целлюлозы идет под действием
ферментных комплексов различных микроорганизмов, в том числе разнообразных
штаммов грибов рода Аspergillus. Грибы рода Аspergillus
способны синтезировать различные ферменты целлюлазного комплекса: эндо-1,4-β-глюконазу, эндо-1,4-β-D-глюканцеллобиогидролазу, эндо-1,4-β-4-глюкозидазу, целлобиазу (β-глюкозидазу). Целлобиаза
катализируект гидролиз целлобиозы и других низкомолекулярных
целлоолигосахаридов до глюкозы. Для выращивания грибов рода Аspergillus подходят разнообразные субстраты
(зерновые продукты, древесные отходы, хлебная мякина, хлопок и др). Подходят
для культивирования и синтетические питательные среды, в том числе
синтетическая питательная среда Чапека, на которой выращиваются и другие
плесневые грибы. Засев питательной среды производился спорами, собранными на
разлагающейся древесине в природных условиях [24].
1) Материалы
и оборудование.
Чашки Петри, шпатели, кюветы объемом 0,5 л, термостат.
Компоненты среды Чапека, почва, микрокристаллическая целлюлоза,
измельченная древесина.
2) Ход работы
- Подготавливают синтетическую среду Чапека
Таблица 8
Состав среды Чапека
|
Компоненты средыг/л дистиллированной воды
|
|
|
K2HPО4
|
1,0
|
|
NaNO3
|
3,0
|
|
KCl
|
0,5
|
|
MgSO4·7H2O
|
0,5
|
|
FeSO4·7H2O
|
0,01
|
|
С12Н22О11(сахароза)
|
30,0
|
|
H2O.
|
1 литр
|
- Измельчают древесину до состояния мелкой стружки, увлажняют раствором
солей и сахаров; объем увлажняющей жидкости составлял 200-400 мл на 1 кг
древесины.
- Древесину заражают собранными предварительно спорами Аspergillus.
Древесину пропаривают в течение 12 часов на водяной бане при температуре
700С (для уничтожения спор различных грибов. При этом имеющиеся
споры Аspergillus способны выдерживать такую
температуру, то есть являются термофильными организмами).
Кюветы с засеянным субстратом помещают в термошкаф, где проводится
культвирование гриба в течение 7-10 суток при температуре 450С.
Содержание среды в кюветах-250 г.
Контролируется рост колоний через сутки, затем через 3-е суток и через 5
суток.
Перемешивание осуществляется вручную - шпателем.
Через 7-10 суток культуру полученного гриба можно помещать в
гидролизуемый субстрат. Готовность штамма-деструктора определяется визуально:
плесень должна изменить цвет с белого на окрашенный. Разные виды гриба Аspergillus дают различное окрашивание:
лимонно-желтое, зеленоватое, зеленовато-голубое, черное [31].
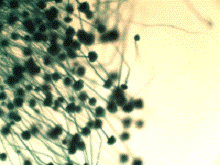 <#"530855.files/image063.gif"> <#"530855.files/image063.gif">
а) б)
Рисунок 9 - Грибок Аspergillus а) 200-кратное увеличение; б) 800-кратное увеличение
.2.3 Методика культивирования микроорганизма Trichoderma
В факультативно аэробных условиях деструкция целлюлозы идет под действием
ферментных комплексов различных микроорганизмов, в том числе разнообразных
штаммов микромицетов. Грибы рода Trichoderma способны синтезировать мощный комплекс гидролитических ферментов,
расщепляющих не только нерастворимые полисахариды - пектин, целлюлозу и
гемицеллюлозы, но и лигнин. Чаще других из природных субстратов высеваются
грибы видов Триходерма зеленая (Trichoderma viride) и триходерма
древесная (Т. lignorum). Триходерму зеленую используют для
приготовления препаратов: триходермин 1, 2 и 3. Эти препараты изготовляют на
основе массового (производственного) размножения этого гриба, с использованием
разных растительных отходов и других субстратов (хлебного мякиша, соломенной
резки, отходов зерна и хлебных злаков, перегретого торфа). При культивировании
в глубинных условиях с использованием растворимых субстратов (глюкоза,
фруктоза, лактоза) образуется рыхлый разветвленный мицелий со слабой
пеллетизацией. [36]

Рисунок 10-
Грибок рода Trichoderma
Материалы и
оборудование.
Чашки Петри, шпатели, кюветы объемом 0,5 л, термостат.
Компоненты среды Чапека, почва, микрокристаллическая целлюлоза, лактоза,
измельченная древесина.
Ход работы.
Получение продуцента целлюлазного комплекса ферментов - микромицета
Trichoderma проводят в два этапа: отбор штаммов-деструкторов; твердофазное культивирование.
1) Отбор штаммов-деструкторов
Отбор целлюлолитических штаммов мицеллиальных грибов оcуществляли на
модифицированной среде Чапека c микрокристаллической целлюлозой (целлюлозы 5%
от массы субстрата). Оценка роста производилась визуально.
Таблица 9
Состав среды Чапека
|
Компоненты средыг/л дистиллированной воды
|
|
|
K2HPО4
|
1,0
|
|
NaNO3
|
3,0
|
|
KCl
|
0,5
|
|
MgSO4·7H2O
|
0,5
|
|
FeSO4·7H2O
|
0,01
|
|
С12Н22О11 (лактоза)
|
30,0
|
|
H2O
|
1 литр
|
Обычно в среду Чапека добавляют сахарозу (30 г на литр). В
модифицированной среде вместо сахарозы добавлена лактоза (в том же количестве),
так как при добавлении лактозы стимулируется выработка именно ферментов
целлюлазного комплекса (на среде с сахарозой - ксилоназного).
Добавляют молочной кислоты из расчета 0,4 мл на 100 мл среды (для подавления
посторонней бактериальной микрофлоры), тщательно перемешивают и разливают в
чашки Петри. Среду заражают небольшим комочком почвы.
Чашки Петри помещают в термостат при температуре 420С (для
интенсификации развития гриба). Через 3 суток производят подсчет выросших
колоний по культурально-морфологическим признакам и характерной пигментации
среды.
Триходерма зеленая (Trichoderma viride) и триходерма древесная (Т.
lignorum) появляются на Чапек-агаре вначале в виде бесцветного мицелия, который
быстро разрастается и с возрастом приобретает зеленый цвет. Колонии этих грибов
бывают различных оттенков, от лимонно-желто-зеленого цвета до темно-зеленого
[37].

Рисунок 11 - Микромицет Trichoderma, выращенный в чашке Петри
) Твердофазное культивирование
Культивирование мицелиальных грибов в твердой фазе проводили в кюветах
емкостью 0,5 л. Содержание среды в кюветах - 250 г. Перемешивание осуществляли
вручную - шпателем.
Культивирование мицеллиальных грибов проводилось на специально
разработанных средах, представляющих собой измельченную древесину, увлажненную
раствором солей и сахаров (как для среды Чапека). Объем увлажняющей жидкости
составлял 200-400 мл на 1 кг древесины.
Посевной материал для кювет выращивали на чашках Петри. Чашки Петри
засевали суспензией спор, полученной путем смыва увлажняющей жидкостью с газона
7-суточной культуры на среде Чапека. Во всех случаях посевной материал вносился
в количестве 10% от объема ферментационной среды [38].
После культивирования микроорганизмов был проведён эксперимент по
сравнению эффективности кислотного и ферментативного гидролиза при получения
гексоз (глюкозы) из целлюлозосодержащего сырья. Были проведены исследования
следующего целлюлозного сырья: древесина тополя, трава (смесь разнообразных
трав), высшая водная растительность (макрофиты). Степень конверсии
растительного сырья в моносахариды определялась через разные промежутки времени
после начала гидролиза: через 3 ч., 24 ч., 48 ч., 72 ч.
Определение углеводов (моносахаридов) проводилось по результатам
качественной реакции аммиачного раствора оксида серебра на глюкозу (реакция
“серебряного зеркала”) по количеству выделившегося осадка серебра
гравиметрическим методом. Методика проведения реакции соответствует
литературным данным [35].
4. Инженерные расчёты
.1 Выбор типа реактора
По фазовому состоянию реагентов реакция ферментативного гидролиза
целлюлозы является гетерогенной, т.к. в водной среде происходит набухание
целлюлозы.
Для проведения данной реакции необходимо использовать реакторы с
перемешивающими устройствами.
Существует несколько видов перемешивающих устройств - механические
мешалки, пневматические мешалки, перемешивание на полках и перемешивание со
шнеком.
Тип мешалки определяется вязкостью реакционной среды. Для жидкостей с
незначительной вязкостью применяются реакторы с пропеллерными мешалками, а
также реакторы с пневматическими мешалками, т.е. с перемешиванием за счёт
барботажа воздуха или пара через реакционную массу. При повышении вязкости
реакционной среды применяют реакторы с якорными мешалками.
Нами выбрана лопастная мешалка, т.к. вязкость реакционной массы не
высока.
По гидродинамическому режиму выбранный нами реактор относится к реакторам
идеального смешения. Т.е. потоки всех реагентов мгновенно и равномерно
перемешиваются во всем реакционном объеме.
Реактор периодического действия. Все отдельные стадии процесса протекают
последовательно в разное время. Характер изменения концентрации реагирующих
веществ одинаков во всех точках реакционного объема, но различен во времени для
одной и той же точки объема. [39]
Процесс
проведения реакции 12-32 ч, нагрева смеси 30 мин., охлаждения смеси 30 мин.;
техническое обслуживание реактора 2 ч.
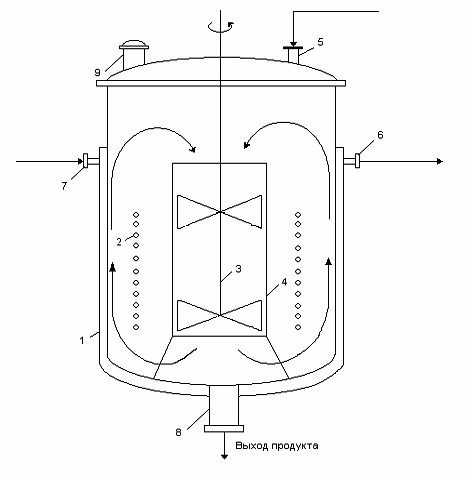

Рисунок 12 - Реактор периодического действия для получения раствора
глюкозы:
- рубашка; 2 - змеевик; 3 - мешалка; 4 - стакан (диффузор); 5 - штуцер
для ввода продуктов; 6,7 - штуцеры для входа и выхода теплоносителя; 8 - штуцер
для вывода продукта реакции; 9 - штуцер для сброса газов.
.2 Расчёт материального баланса
Общее
выражение для материального баланса процесса имеет вид:
∑Gприх. = ∑Gрасх. + ∑Gпотр.
где ∑Gприх. - мольный поток, приходящий в
реактор;
∑Gрасх. - мольный поток, уходящий из
реактора;
∑Gпотр.. - потери принимаем 0,02 %
Основная реакция:
С6Н10О5 + Н2О = С6Н12О6
А В С
Таблица 10
Данные материального баланса
|
Технологи-ческий выход продукта, f, %
|
Массовое соотношение исходных реагентов А:В
|
Производительность реактора П, моль
|
Степень превращения, Ха, %
|
Селек-тивность основной реакции, Ф, %
|
Состав исходного реагента, А, %масс
|
Состав исходного реагента, В %масс
|
|
|
|
|
|
Целлю лоза
|
крахмал
|
ксилан
|
Н2О
|
|
90
|
1:3
|
96
|
100
|
98
|
1
|
1
|
100
|
Материальный баланс составляется с учетом технико-экономических
показателей процесса (степень превращения, селективность, выход), соотношения
исходных реагентов, чистоты сырья.
.2.1 Расчет
приходной части баланса
1. Рассчитаем производительность с учетом технологического выхода:
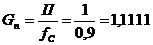 моль/мин. моль/мин.
Т.
к. целлюлоза в реакционной массе находится в недостатке, то требуемый расход
смеси рассчитываем по ней:
.
Количество целлюлозы, необходимое для получения 1,1111 моль/мин продукта.
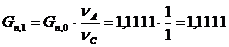 моль/мин. моль/мин.
.
Пересчитаем количество целлюлозы с учетом селективности процесса:
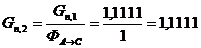 моль/мин. моль/мин.
. Определяем количество целлюлозы с учетом степени превращения:
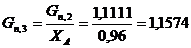 моль/мин. моль/мин.
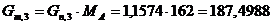 г/мин. г/мин.
.
Определим количество непрореагировавшей целлюлозы
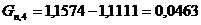 моль/мин. моль/мин.
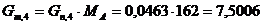 г/мин. г/мин.
. Определим количество целлюлозы с учетом её состава:
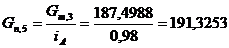 г/мин. г/мин.
.
Количество примесей, поступивших с целлюлозой:
iкрахмал(I)= iксилан(II)=iприм.
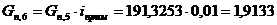 г/мин. г/мин.
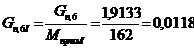 моль/мин. моль/мин.
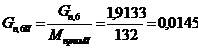 моль/мин. моль/мин.
.
Определим количество воды, поступающей в реактор, с учетом массового
соотношения:
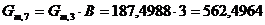 г/мин. г/мин.
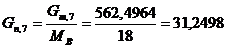 моль/мин. моль/мин.
.
Определим количество воды, пошедшее на основную реакцию:
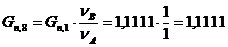 моль/мин. моль/мин.
10. Количество непрореагировавшей воды:
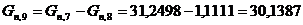 моль/мин. моль/мин.
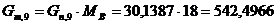 г/мин. г/мин.
4.2.2
Расчет расходной части баланса
Определим
количество целевого продукта, образующееся в основной реакции:
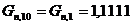 моль/мин. моль/мин.
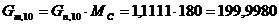 г/моль г/моль
Результаты
расчета сведем в таблицу.
Таблица 11
Результаты расчета материального баланса
|
Приход
|
Расход
|
|
Вещество
|
моль/мин.
|
%,мольн.
|
г/мин.
|
%,масс.
|
Вещество
|
моль/мин.
|
%мольн
|
г/мин.
|
%масс.
|
|
С6Н10О5 (целю-лоза)
|
1,1111
|
3,43
|
187,4988
|
24,87
|
С6Н12О6
|
1,1111
|
3,55
|
199,9980
|
26,53
|
|
Н2О
|
31,2498
|
96,49
|
562,4964
|
74,63
|
С6Н10О5 (целю-лоза)
непрореаг.
|
0,0463
|
0,15
|
7,5006
|
1,00
|
|
С6Н10О5 (крахмал)
|
0,0118
|
0,035
|
1,9131
|
0,25
|
Н2О непрореаг.
|
30,1387
|
96,22
|
542,4966
|
71,97
|
|
С5Н8О4
|
0,0145
|
0,045
|
1,9131
|
0,25
|
С6Н10О5 (крахмал)
|
0,0118
|
0,034
|
1,9131
|
0,25
|
|
Итого
|
32,3872
|
100
|
753,8214
|
100
|
С5Н8О4
|
0,0145
|
0,046
|
1,9131
|
0,25
|
|
|
|
|
|
|
Итого
|
31,3224
|
100
|
753,8214
|
100
|
Вывод:
таким образом, в результате составления материального баланса,
рассчитанного с учетом технологических критериев и состава сырья,
соответствующему закону действия масс (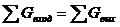 ),
установлено, что для получения единицы продукции (1моль/мин.) глюкозы требуется
взять 187,5 г целлюлозы и 562,5 мл Н2О. Показатели данного процесса
имеют высокие значения, а именно степень превращения составляет 96 %, это
говорит о том, что большая часть исходного вещества вступила в реакцию.
Селективность, равная 100 % показывает, что прореагировавшее сырье полностью
пошло на получение целевого продукта. Все выше перечисленные факторы
обеспечивают выход продукта, равный 90 %. ),
установлено, что для получения единицы продукции (1моль/мин.) глюкозы требуется
взять 187,5 г целлюлозы и 562,5 мл Н2О. Показатели данного процесса
имеют высокие значения, а именно степень превращения составляет 96 %, это
говорит о том, что большая часть исходного вещества вступила в реакцию.
Селективность, равная 100 % показывает, что прореагировавшее сырье полностью
пошло на получение целевого продукта. Все выше перечисленные факторы
обеспечивают выход продукта, равный 90 %.
4.3 Расчет
теплового баланса
В основе теплового баланса (энергетического) лежит закон сохранения
энергии:
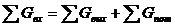
Составим
тепловой баланс стадии синтеза, используя данные для теплового баланса и данные
рассчитанного материального баланса, определим тепловую нагрузку на реактор.
Таблица 12
Данные теплового баланса
|
Температура исходных реагентов, К
|
293
|
|
Температура продуктов реакции, К
|
308
|
|
Тепловые потери от прихода тепла, %
|
2
|
4.3.1
Подготовка исходных данных
Рассчитаем эмпирическими методами теплоту образования и теплоемкость
участников реакции.
Целлюлоза (С5Н10О5):
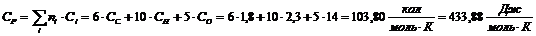
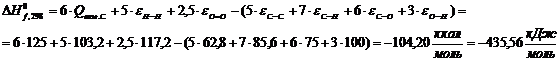
Вода
(Н2О):

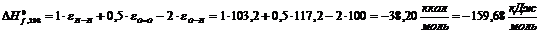
Глюкоза
(С6Н12О6):
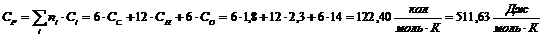
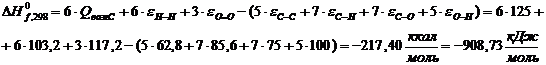
Крахмал
(С5Н10О5):
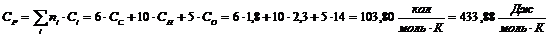
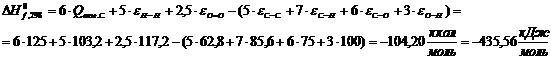
Ксилан
(C5H8О4):
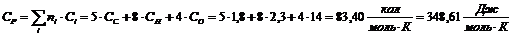
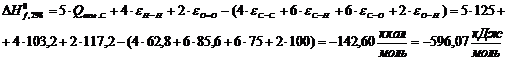
Полученные
данные внесем в таблицу.
Таблица 13
Термодинамические свойства веществ
|
Вещество
|
ΔH0298, кДж/моль
|
C0p, Дж/(моль·К)
|
|
Целлюлоза С5Н10О5
|
-435,56
|
433,88
|
|
Н2О
|
-159,68
|
77,75
|
|
Глюкоза С6Н12О6
|
-908,73
|
511,63
|
|
Крахмал С5Н10О5
|
-435,56
|
433,88
|
|
Ксилан C5H8О4
|
-596,07
|
348,61
|
Для данного периодического процесса температурная нагрузка на реактор
будет выглядеть следующим образом:
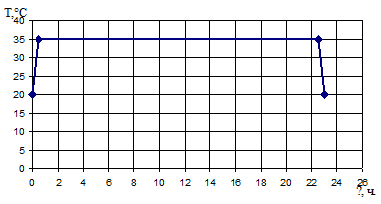
Рисунок 13 - Температурные нагрузки процесса синтеза глюкозы
.3.2. Расчет
тепловой нагрузки стадии нагрева реакционной смеси
Приход:
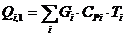
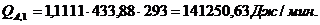
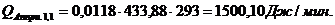
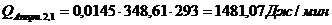
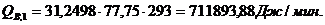
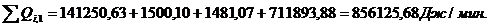
Расход:
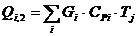
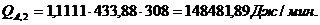
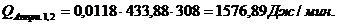
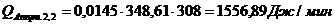
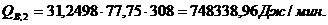
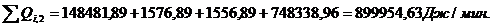
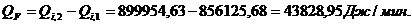
Таблица 14
Результаты расчёта теплового баланса стадии нагрева реакционной смеси
|
Приход
|
Расход
|
|
Тепловые потери
|
Дж/мин.
|
%
|
Тепловые потери
|
Дж/мин.
|
%
|
|
∑Qi,1
|
856125,68
|
95,13
|
∑Qi,2
|
899954,63
|
100
|
|
QF
|
43828,95
|
4,87
|
|
|
|
|
Итого
|
899954,63
|
100
|
Итого
|
899954,63
|
100
|
.3.3 Расчет
тепловой нагрузки стадии проведения реакции
Приход:
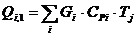
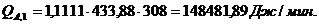
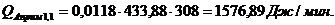


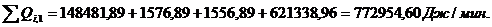
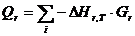
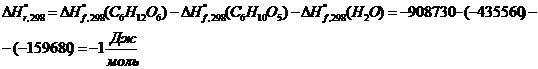
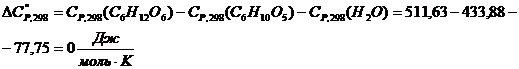
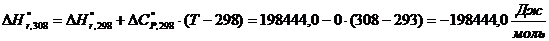
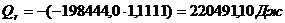
Расход:
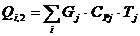
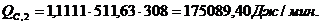


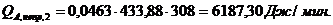
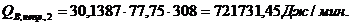
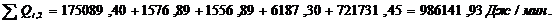
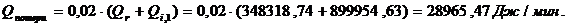
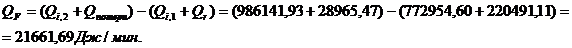
QF>0,
следовательно, реакция является экзотермической, то есть необходимо подводить
тепло к реактору.
Таблица 15
Результаты расчёта теплового баланса стадии проведения реакции
|
Приход
|
Расход
|
|
Тепловые потери
|
Дж/мин.
|
%
|
Тепловые потери
|
Дж/мин.
|
%
|
|
∑Qi,1
|
772954,60
|
76,15
|
∑Qi,2
|
986141,93
|
97,15
|
|
Qr
|
220491,11
|
21,72
|
Qпотери
|
28965,47
|
2,85
|
|
QF
|
21661,69
|
2,13
|
|
|
|
|
Итого
|
1015107,40
|
100
|
Итого
|
1015107,40
|
100
|
4.3.4 Расчет
тепловой нагрузки стадии охлаждения отработанной смеси
Приход:
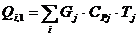
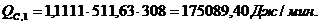
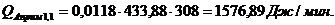

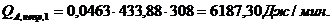
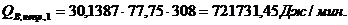
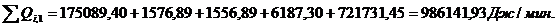
Расход:
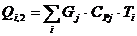
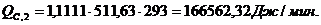
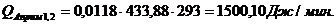
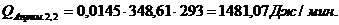
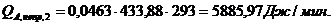
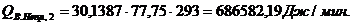
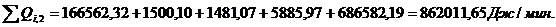
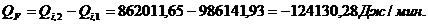
Таблица 16
Результаты
расчёта теплового баланса стадии охлаждения отработанной смеси
|
Приход
|
Расход
|
|
Тепловые потери
|
Дж/мин.
|
%
|
Тепловые потери
|
Дж/мин.
|
%
|
|
∑Qi,1
|
986141,93
|
100
|
∑Qi,2
|
862011,65
|
87,41
|
|
|
|
QF
|
124130,28
|
12,59
|
|
Итого
|
986141,93
|
100
|
Итого
|
986141,93
|
100
|
.3.5 Определение площади теплообмена реактора
Из трех рассчитанных ранее значений тепловой нагрузки выбираем
наибольшую. Рассчитаем тепловую нагрузку для стадии проведения реакции.
Нагрев осуществляется на воздушной бане с температурой 120 0С.
Согласно литературным данным для нагрева паром коэффициент теплопередачи
изменяется в пределах 120 - 640 Вт/(м2∙К). Принимаем
коэффициент теплопередачи 120 Вт/(м2∙К).
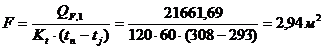
.3.6 Расчет объема реактора
В реакторе идеального смешения периодического действия (РИС-П) исходная
смесь загружается в реактор, где происходит мгновенное выравнивание всех
параметров вследствие интенсивного перемешивания.
Объем реактора РИС-П рассчитывается по формуле:
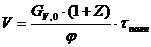 , ,
где Gv,o - объемный расход реакционной массы;
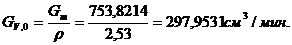
τполн.= τ+τвспом. -
время нахождения реагентов в реакторе, ч (τ - время реакции, τвспом. - время вспомогательных процессов);
z - коэффициент
запаса мощности 0,15;
φ - 0,7 - коэффициент заполнения.
Рассчитываем
объём реактора:
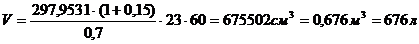
Вывод: расчёт теплового баланса показал, что реакция является
экзотермической и для её протекания необходимо подводить тепло в количестве
21661,69 Дж (2,13 %) к реактору, обладающему площадью теплообменной поверхности
2,94 м2.
.4 Операторная схема процесса
I.
Стадия подготовки.
На данной стадии происходит измельчение растительного сырья в
измельчителе (1). При работе измельчителя сырье попадает в измельчающую камеру,
в которой находятся два вращающихся металлических ножа. Проходя сквозь них
сырье измельчается до размера частиц 3-5 мм. При этом недостаточно измельчённое
сырьё отправляется на повторное измельчение.
Измельчённое растительное сырьё смешивается в смесителе (2) с
предварительно соединёнными в смесителе (3) водой и ферментами.
II.
Стадия синтеза
Полученная смесь, состоящая из измельчённого растительного сырья, воды и
ферментов, поступает в реактор (4) с мешалкой, где происходит ферментативный
гидролиз целлюлозы в течение 12-32 часов при температуре 30 - 40 ˚С.
III.
Стадия выделения.
Реакционная масса поступает в сепаратор (5), где путём фильтрования через
решётки происходит отделение непрореагировавшей целлюлозы, которая возвращается
на стадию смешения с ферментами и водой в смеситель (2).
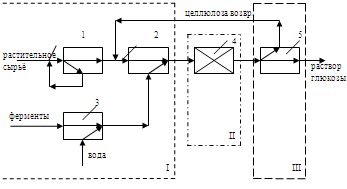
Рисунок 14 - Операторная схема получения раствора глюкозы, где I - стадия подготовки; II - стадия синтеза; III - стадия выделения; 1 -
измельчитель; 2,3 - смесители; 4 - реактор; 5 - сепаратор.
Выводы
. Гидролиз целлюлозы до глюкозы является важнейшей
стадией процесса получения спиртов из растительных отходов.
. Анализ результатов проведённых экспериментов
позволяет сделать вывод о том, что наиболее эффективным методом получения
глюкозы из растительных отходов является ферментативный гидролиз.
Ферментативный гидролиз перспективен с точки зрения создания самостоятельных
малоотходных технологий, даёт лучшие выходы целевого продукта (90 %),
проводится в мягких условиях (низкие температуры, атмосферное давление).
. Сравнив эффективность проведения гидролиза тремя
разными штаммами микроорганизмов можно сделать вывод о том, что для древесины и
травы наиболее эффективным оказался Aspergillum, для водорослей - Trichoderma. Из рассмотренных микроорганизмов наименьшую эффективность
показали бактерии рода Clostridium, но даже этот микроорганизм гидролизует целлюлозу лучше, чем кислоты.
. Наибольшая скорость гидролиза и самый высокий
процент конверсии полисахаридов в моносахариды получены в результате проведения
ферментативного гидролиза биомассы высшей водной растительности, следовательно
пресноводные водоросли являются достаточно перспективным сырьём для получения
глюкозы.
5. Расчёт материального баланса показал, что для получения единицы продукции
глюкозы требуется взять 187,5 г целлюлозы и 562,5 мл воды.
6. Расчёт теплового баланса показал, что реакция является экзотермической
и для её протекания необходимо подводить тепло в количестве 21661,69 Дж (2,13
%) к реактору, обладающему площадью теплообменной поверхности 2,94 м2.
Для проведения процесса выбран реактор идеального смешения периодического
действия, объёмом 676 л.
8. Предложена операторная схема процесса получения глюкозы гидролизом
целлюлозосодержащего сырья.
Библиографический список
1. Роговин,
З.А. Химия целлюлозы. - М.: Химия, 1972. - 520 с.
. Лобанок,
А.Г. Микробный синтез на основе целлюлозы: белок и другие ценные продукты /
А.Г. Лобанок, В.Г. Бабицкая, Ж.Н. Богдановская - М.: Наука и техника, 1988. -
261 с.
. Племенков,
В.В. Введение в химию природных соединений. - Казань: Химия, 2001. - 376 с.
. Ким, А.М.
Органическая химия: учебное пособие. - 3-е изд., перераб. и доп. - Новосибирск:
Сибирское университетское издательство, 2002. - 971 с.
. Физер, Л.
Органическая химия: углубленный курс. - М.: Химия, 1986. - 782 с.
. Грандберг,
И.И. Органическая химия: учеб. для студ. вузов, обучающихся по агроном. спец. -
4-е изд., перераб. и доп. - М.: Дрофа, 2001. - 672 с.
.
Сорочинская, Е.И. Биоорганическая химия: учебное пособие. - СПб.: Изд-во
Санкт-Петербургского университета, 1998. - 148 с.
. Краткий
справочник по химии. // Под. ред. Уреленко О.Д. - Киев: Наукова думка, 1974 -
991с.
.
Энциклопедия полимеров./ Под. ред. Кабанова. − М.: Советская
энциклопедия, 1974, Том 2-3.
. Никитин,
В.М. Химия древесины и целлюлозы / В.М. Никитин, А.В. Оболенская, В.П. Щеголев.
- 3-е изд., перераб. и доп. - М.: Лесная промышленность, 2002. - 368 с.
. Азаров,
В.И. Химия древесины и синтетических полимеров / В. И. Азаров, А.В. Буров, А.В.
Оболенская. - СПб.: СПбЛТА, 1999. - 628 с.
. Рабинович,
М.Л. Теоретические основы биотехнологии древесных композитов. Древесина и
разрушающие её грибы. В 2-х ч. Ч. 1 / М. Л. Рабинович, А.В. Болобова, В.И.
Кондращенко - М.: Наука, 2001. - 264 с.
. Современные
представления о строении целлюлоз / Л.А. Алешина [и др.] // Химия растительного
сырья. - 2001. - № 1. - С. 5 - 36.
. Аким, Э.Л.
Реакционная способность и физическое состояние целлюлозы / Аким, Э.Л. // Химия
древесины. - 1984. - №4. - с. 3 - 17.
. Байклз, Н.
Целлюлоза и её производные. В 2-х ч. Ч. 2 / Н. Байклз, Л. Сегал - М.: Мир,
1974. - 510 с.
. Кочева, Л.
С. Структурная организация и свойства лигнина и целлюлозы травянистых растений
семейства злаковых: автореф. дис. канд. хим. наук: 05.21.03 / Кочева Людмила
Сергеевна. - Архангельск, 2008. - 42 с.
. Гауптман,
З. Органическая химия / З. Гауптман, Ю. Грефе, Х. Ремане. - 2-е изд., перераб.
и доп. - М.: Химия, 1999. - 832 с.
.
Преображенский, Н.А. Химия биологически активных природных соединений / Н.А.
Преображенский, Р.П. Евстигнеева. - 3-е изд., перераб. и доп. - М.: Химия,
2000. - 456 с.
. Егоров,
А.С. Химия. - М.: Феникс, 1996. - 736 с.
. Березов,
Т.Т. Биоорганическая химия: учебник. - 3-е изд., перераб. и доп. - М.:
Медицина, 1998. - 704 с.
. Эриньш,
П.П. Строение и свойства древесины как многокомпонентной полимерной системы /
Эриньш, П.П. // Химия древесины. - 1977. - №1 - с. 8 - 25.
. Овчинников,
Ю.А. Биоорганическая химия. - М.: Просвещение, 1987. - 815 с.
. Инженерная
энзимология / И.В. Березин [и др.] - М.: Высшая школа, 1987 - 143 с.
. Синицын,
А.П. Биоконверсия лигноцеллюлозных материалов / А.П. Синицын, А.В. Гусаков,
В.М. Черноглазов - М.: МГУ, 1995. - 224 с.
26. Сухарькова,
В.А. Совершенствование процесса гидролиза древесины / Сухарькова, В.А.,
Антонов, Г.А. // Химия древесины. - 2002. - №3 - с. 14 - 28.
27. Биомасса
как источник энергии: Пер. с англ. / Под ред. С. Соуфера, О. Заборски. - М.:
Мир, 1985. - 368 с.
. Биотехнология.
Принципы и применение: Пер. с англ. / Под ред. И. Хиггинса, Д. Беста, Д.
Джонса. - М.: Мир, 1988. - 480 с.
. Егоров,
А.П. Практикум по микробиологии. - М.: Наука, 1996. - 448 с.
. Айбазов,
О.А Ферментативный способ обработки пшеничной соломы. - М.: Россельхозиздат,
1984. - 327 с.
. Грачева,
И.М. Технология микробных белковых препаратов, аминокислот и биоэнергия / И.М.
Грачева, Л.А. Иванова, В.М. Кантере - М.: Колос, 1992.
. Беккер,
М.Е. Введение в биотехнологию. - М.: Химия, 1994. - 239 с.
. C 13K
1/02А. Способ получения глюкозы из целлюлозосодержащего сырья / В. С. Орлова,
Н. Н. Филатов, Р. Г. Шаимов. - № 006944; заявлено 31.07.2003 ; опубл.
19.02.2004, Бюл. № 3. - 2 с.
. Кузнецов,
Б.Н. Каталитическая химия растительной биомассы / Кузнецов, Б.Н. // Соросовский
образовательный журнал. - 1996. - № 12. - с. 47-55.
. Оболенская,
А.В., Ельницкая З.П., Леонович А.А. Лабораторные работы по химии древесины и
целлюлозы / А. В. Оболенская, З. П. Ельницкая, А.А. Леонович - М.: Экология,
1991.-320 с.
. Степанова
Л.М., Саловарова В.Т., Королёва Т.С. // Использование Trichoderma
longibrachiatum для биотехнологической переработки пшеничной соломы: Тезисы
докладов. В сб.: Интродукция микроорганизмов в окружающую среду. - Москва,
1994. - с. 99-100.
. Фрунзе, А.А.
Рекомендации по применению гриба “Триходерма-лигнорум-19” для ферментативной
обработки пшеничной соломы. - М.: Россельхозиздат, 1987. - 251 с.
.
Культивирование гриба Р. Trichoderma на растительном сырье / Е. В. Скворцов [и др.] // Химия и компьютерное
моделирование. Бутлеровские сообщения. - Казань, 2002. - № 7. - С. 57-59
. Методы
расчета процессов и аппаратов химической технологии (примеры и задачи): Учеб.
пособие для вузов./ П.Г. Романков, В.Ф. Фролов, О.М. Флисюк, М.И. Курочкина -
СПб: Химия, 1993. - 496 с.
Похожие работы на - Изучение процесса и отработка технологии гидролиза растительных отходов с целью получения спиртов
|