Строение металлов
Контрольная
работа
по
дисциплине: "Материаловедение"
по
теме: "Строение металлов"
Содержание
Введение
1. Строение металла
Заключение
Литература
Введение
Металлы - простые вещества, обладающие в обычных
условиях характерными свойствами: высокой электро - и теплопроводностью,
отрицательным температурным коэффициентом электропроводности, способностью
хорошо отражать электромагнитные волны (блеск и непрозрачность), высокой
прочностью и пластичностью.
Свойства металлов могут значительно измениться
при очень высоких давлениях. Многие металлы в зависимости от температуры и
давления могут существовать в виде нескольких кристаллических модификаций.
Подобными металлическими свойствами обладают
более 80 химических элементов и множество металлических сплавов. Число
металлических сплавов, применяемых в технике, исчисляется тысячами и постоянно
возрастает в соответствии с возникающими новыми и разнообразными требованиями,
предъявляемыми многими отраслями промышленности.
Свойства металлов обусловлены их кристаллическим
строением и наличием в их кристаллической решетке многочисленных не связанных с
атомными ядрами подвижных электронов проводимости.
Металлические сплавы по свойствам имеют много
общего с металлами, поэтому их нередко относят к металлам.
Металлы (сплавы) в промышленности разделяют на
две основные группы: черные и цветные металлы.
Черные металлы - сплав железа с углеродом, в
котором могут содержаться в большем или меньшем количестве и другие химические
элементы. Кобальт, никель, а также близкий к ним по свойствам марганец нередко
относят к черным металлам. Черные металлы получили наибольшее распространение,
что обусловлено относительно высоким содержанием железа в земной коре, его
низкой стоимостью, высокими механическими и технологическими свойствами.
Цветные металлы по свойствам подразделяют на
следующие группы:
0легкие
(Be, Mg,
Al, Ti),
обладающие сравнительно малой плотностью - до 5000 кг/м3;
1тугоплавкие
(Ti, Сг, Zr,
Nb, Mo,
W, V
и др.) с температурой плавления выше, чем у железа (1539°С);
2благородные
(Ph, Pd,
Ag, Os,
Pt, Аи и др.),
обладающие химическойинертностью:
3урановые
(U, Th,
Pa) - актиноиды,
используемые в атомной технике;
4редкоземельные
металлы (РЗМ), лантаноиды (Се, Рг, Nd,
Sm и др.) и сходные с
ними иттрий и скандий, применяемые как присадки к различным сплавам;
5щелочноземельные
металлы (Li, Na,
К), используемые в качестве теплоносителей в ядерных реакторах.
Классификация металлических сплавов по
химическому составу, основанная на указании главного компонента сплава (железо,
медь, алюминий и др.), имеет традиционный характер, и получила наибольшее
распространение.
Макро-, микро- и атомную структуру металлов и
сплавов изучает металлография.
Макроструктура - это строение металла, видимое
невооруженным глазом или с помощью лупы в изломе или на протравленном шлифе.
Микроструктура строения металла, наблюдаемое под оптическим или электронным
микроскопами, позволяющими увеличить рассматриваемый участок от десяти раз до
сотен тысяч раз.
Атомная структура металлов - это
пространственное расположение атомов в кристаллической решетке. Этот вид
структуры исследуется с помощью рентгено- графического структурного анализа.
1. Строение металла
Все металлы имеют кристаллическое строение.
Располагаясь тем или иным способом, атомы образуют элементарную ячейку
пространственной кристаллической решетки. Тип ячейки зависит от химической
природы и состояния металла. Кристаллическое состояние, прежде всего,
характеризуется определенным, закономерным расположением атомов в пространстве.
Это обусловливает то, что в кристалле каждый атом имеет одно и то же количество
ближайших атомов - соседей, расположенных на одинаковом от него расстоянии. В
процессе кристаллизации положительно заряженные ионы, располагаясь
последовательно в виде элементарных кристаллических решеток, образуют кристаллы
в виде зерен или дендритов. Все металлы и сплавы имеют кристаллическое
строение. Образующиеся кристаллы растут, кристаллизуются из жидкого расплава
сначала свободно, не мешают один другому, потом они сталкиваются и рост
кристаллов продолжается только в тех направлениях, где есть свободный доступ
жидкого металла. В результате первоначальная геометрически правильная форма
кристаллов нарушается. После затвердевания зерна и дендриты имеют неправильную,
геометрически искаженную форму.

Рисунок 1. Схема кристаллизации: а - в виде
зерен; б - в виде дендритов.
Стремление атомов (ионов) металла расположиться,
возможно, ближе друг к другу, плотнее, приводит к тому, что число встречающихся
комбинаций взаимного расположения атомов металла в кристаллах невелико.
Существует ряд схем и способов описания
вариантов взаимного расположения атомов в кристалле. Взаимное расположение
атомов в одной из плоскостей показано на схеме размещения атомов (рисунок 2) .
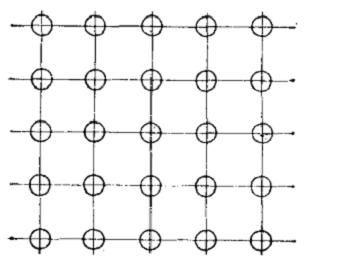
Рисунок 2. Элементарная кристаллическая ячейка
(простая кубическая).
Воображаемые линии, проведенные через центры
атомов, образуют решетку, в узлах которой располагаются атомы (положительно заряженные
ионы); это так называемая кристаллографическая плоскость. Многократное
повторение кристаллографических плоскостей, расположенных параллельно,
воспроизводит пространственную кристаллическую решетку, узлы которой являются
местом расположения атомов (ионов). Расстояния между центрами соседних атомов
измеряются ангстремами (1 А= 1 • 10-8 см) или в килоисках - kX
(1kX = 1,00202 А).
Взаимное расположение атомов в пространстве и величину между атомных расстояний
определяют рентгеноструктурным анализом. Расположение атомов в кристалле весьма
удобно изображать в виде пространственных схем, в виде так называемых
элементарных кристаллических ячеек. Под элементарной кристаллической ячейкой
подразумевается наименьший комплекс атомов, который при многократном повторении
в пространстве позволяет воспроизвести пространственную кристаллическую
решетку. Простейшим типом кристаллической ячейки является кубическая решетка. В
простой кубической решетке атомы расположены (упакованы) недостаточно плотно.
Стремление атомов металла занять места, наиболее близкие друг к другу, приводит
к образованию решеток других типов: кубической объемноцентрированной (рисунок
3, а), кубической гранецентрированной (рисунок 3, б) и гексагональной
плотноупакованной (рисунок 3, в).

Рисунок 3. Элементарные кристаллические ячейки:
а - кубическая объемноцентрированная; б - кубическая гранецентрированная; в -
гексагональная плотноупакованная.
металл теплопроводность
электромагнитный температурный
Кружки, отображающие атомы, располагаются в
центре куба и по его вершинам (куб объемноцентрированный), или в центрах граней
и по вершинам куба (куб гранецентрированный), или в виде шестигранника, внутрь
которого наполовину вставлен также шестигранник, три атома верхней плоскости
которого находятся внутри шестигранной призмы (гексагональная решетка).
Метод изображения кристаллической решетки,
приведенный на рисунке 3, является условным (как в любой другой). Может быть,
более правильно изображение атомов в кристаллической решетке в виде
соприкасающихся шаров (левые схемы на рисунке 3). Однако такое изображение
кристаллической решетки не всегда удобно, чем принятое (правые схемы на рисунке
3).
Размеры кристаллической решетки характеризуются
параметрами, или периодами решетки. Кубическую решетку определяет один параметр
- длина ребра куба а (рисунок 3, а, б). Параметры имеют величины порядка
атомных размеров и измеряются в ангстремах.
Так например, параметр решетки хрома, имеющего
структуру объемноцентрированного куба, равен 2,878 А, а параметр решетки
алюминия, имеющего структуру гранецентрированного куба, 4,041 А.
Параметр решетки - чрезвычайно важная
характеристика. Современные методы рентгеновского исследования позволяют
измерить параметр с точностью до четвертого или даже пятого знака после
запятой, т. е. одной десятитысячной - одной стотысячной доли ангстрема.
Из рассмотрения схем кристаллических решеток
(рисунок 3), если считать, что атомы являются как бы упругими, касающимися друг
друга шарами, вытекает, что параметр решетки а и атомный диаметр d
связаны простыми геометрическими соотношениями.
Для объемноцентрированного куба
=
а √3 / 2.
Для
гранецентрированного куба
=
а √2 / 3.
Принимая
для атома форму шара, можно подсчитать, что в кубической объемноцентрированной
решетке атомы занимают 68% объема, а в кубической гранецентрированной (как и в
гексагональной плотноупакованной) 74%, т.е. во втором случае атомы
располагаются более плотно, более компактно.
Для
металлов распространена гексагональная решетка (рисунок 3, в).
Если
слои атомов касаются друг друга, т. е. три атома, изображенные внутри решетки
(рисунок 3, в), касаются атомов, расположенных на верхней и нижней плоскостях,
то имеем так называемую гексагональную плотноупакованную решетку.
Размеры
гексагональной плотноупакованной решетки характеризуются постоянным значением
с/а=1,633. При иных значениях с/а получается неплотлоупакованная гексагональная
решетка.
Кубическая
гранецентрированная и гексагональная решетки представляют самый плотный способ
укладки шаров одного диаметра.
Некоторые
металлы имеют тетрагональную решетку (рисунок 4); она характеризуется тем, что
ребро с не равно ребру а. Отношение этих параметров характеризует так
называемую степень тетрагональности. При с/а = 1 получается кубическая решетка.
В зависимости от пространственного расположения атомов тетрагональная решетка
(как и кубическая) может быть простой, объемноцентрированной и
гранецентрированной.

Рисунок
4. Тетрагональная решетка
Существенное
значение для свойств данного металла или сплава имеет число атомов, находящихся
во взаимном контакте. Это определяется числом атомов, равноотстоящих на
ближайшем расстоянии от любого атома.
Число
атомов, находящихся на наиболее близком и равном расстоянии от данного атома,
называется координационным числом. Так, например, атом в простой кубической
решетке имеет шесть ближайших равноотстоящих соседей, т. е. координационное
число этой решетки равно 6.
Центральный
атом в объемноцентрированной решетке имеет восемь ближайших равноотстоящих
соседей, т. е. координационное число этой решетки равно 8. Координационное
число для гранецентрированной решетки равно 12. В случае гексагональной
плотноупакованной решетки координационное число равно 12, а в случае с/а ≠
1,633 каждый атом имеет шесть атомов на одном расстоянии и шесть на другом
(координационное число 6).
Для
краткого обозначения кристаллической решетки с указанием в этом обозначении
типа кристаллической решетки и координационного числа была принята одна из
следующих систем (таблица 1).
Таблица
1
|
Решетка
|
Обозначение
|
Координационное
число
|
|
Простая
кубическая
|
к
|
К6
|
|
Кубическая
объемно-центрированная
|
о.
ц. к.
|
|
Кубическая
гранецентрированная
|
г.
ц. к.
|
К12
|
|
Гексагональная
плотноупакованная 1
|
г.
п. у.
|
Г12
|
|
Гексагональная
2
|
г
|
Г6
|
1
с/а=1,633
2
с/а ≠ 1,633
Каждый металл обладает определенной
кристаллической решеткой.
Существенной характеристикой кристаллической
структуры является число атомов, приходящихся на элементарную ячейку.
В о. ц. к. решетке атомы, находящиеся в вершине,
принадлежат восьми элементарным ячейкам. Следовательно, каждый атом вносит в
данную элементарную ячейку только одну восьмую часть своего объема. Центральный
атом полностью принадлежит данной элементарной ячейке. Следовательно, на одну
элементарную ячейку приходятся 1/8 • 8+1=2 атома.
В гранецентрированном кубе на одну элементарную
ячейку приходятся четыре атома (1/8 × 8 атом
от числа расположенных в вершинах куба + 1/2 × 6=3 атома
из числа центрирующих грани).
Типично металлические элементы, расположенные в
левой части таблицы Д. И. Менделеева, кристаллизуются в плотной упаковке, т. е.
в простые кристаллические ячейки с большим координационным числом. Типично
металлическими решетками являются, как указывалось, решетки о. ц. к., г. ц. к.
и г. п. у. Действительно, почти все металлы, начиная от цинка, кадмия и ртути и
левее имеют в большинстве случаев простые решетки.
Для неметаллических элементов характерно малое
значение координационного числа (К4 и меньше). Неметаллы обладают меньшей
плотностью и меньшим удельным весом, чем металлы.
Заключение
Металлы - простые вещества, обладающие
свободными, не связанными с определенными атомами электронами, которые способны
перемещаться по всему объему тела. Эта особенность состояния металлического
вещества определяет собой свойства металлов.
Атомы металлов легко отдают внешние (валентные)
электроны, превращаясь при этом в положительно заряженные ноны. Отданные
атомами свободные электроны непрерывно хаотически, т. е. беспорядочно,
перемещаются по всему объему металла. Такие свободные электроны часто называют
электронным газом. Положительно заряженные ионы при столкновении со свободными
электронами на некоторое время могут превращаться в нейтральные атомы.
Таким образом, металлы состоят из упорядоченно
расположенных в пространстве положительно заряженных ионов, перемещающихся
среди них электронов и небольшого количества нейтральных атомов. Металлами
являются алюминий, железо, медь, никель, хром и т.д.
Сплавы представляют собой системы, состоящие из
двух или нескольких металлов или металлов и неметаллов. Сплавы обладают всеми
характерными свойствами металлов. Например, сталь и чугун - сплавы железа с
углеродом, кремнием, марганцем, фосфором и серой; бронза - сплав меди с оловом
или другими элементами; латунь - сплав меди с цинком и другими элементами.
В промышленности широко применяют сплавы,
получаемые сплавлением составляющих с последующей кристаллизацией из жидкого
состояния, значительно меньше - сплавы, получаемые спеканием.
В процессе кристаллизации из расплавленного
(жидкого) состояния металла или сплава положительно заряженные ионы и
нейтральные атомы группируются в строго определенной последовательности,
образуя кристаллические решетки - правильное упорядоченное расположение атомов
в элементарной ячейке. Кристаллические решетки у металлов и сплавов могут быть
различных типов: объемно-концентрированные кубические (о. ц. к.),
гранецентрированные кубические (г. ц. к.), гексагональные плотноупакованные (г.
п. у.). Объемно-концентрированную кубическую решетку образуют железо, медь,
алюминий, свинец и др.; гексагональную плотноупакованную- цинк, магний, кобальт
и др.
Для характеристики кристаллической решетки
необходимо знать периоды решетки - расстояние а и с между центрами атомов или
ионов, находящихся в узлах решетки. Период решетки измеряется в ангстремах
(1А=10-8 см).
В процессе кристаллизации положительно
заряженные ионы, располагаясь последовательно в виде элементарных
кристаллических решеток, образуют кристаллы в виде зерен или дендритов. Все
металлы и сплавы имеют кристаллическое строение. Образующиеся кристаллы растут,
кристаллизуются из жидкого расплава сначала свободно, не мешают один другому,
потом они сталкиваются и рост кристаллов продолжается только в тех
направлениях, где есть свободный доступ жидкого металла. В результате
первоначальная геометрически правильная форма кристаллов нарушается. После
затвердевания зерна и дендриты имеют неправильную, геометрически искаженную
форму.
При нагревании поглощаемое металлами тепло
расходуется на колебательные движения атомов и вследствие этого на тепловое
расширение металла. При плавлении объем
металлов увеличивается на 3-4%. С повышением температуры колебательные движения
атомов или ионов возрастают, кристаллические зерна распадаются и сплав, проходя
через твердо-жидкое состояние, превращается в расплав.
Переход в жидкое состояние не приводит к полному
уничтожению кристаллической структуры. В расплаве металлов и сплавов всегда
находятся мельчайшие участки, в которых сохраняется первоначальное,
наследственное строение металла, близкое к кристаллическому. Кроме того, всегда
присутствуют тугоплавкие частицы (остатки футеровки печи, примеси других
элементов), которые могут образовывать дополнительные центры кристаллизации и
вызывать начало кристаллизации. На искусственном создании центров
кристаллизации в расплаве с одновременным изменением его скорости охлаждения
основано управление кристаллизации сплава с целью получения заданной структуры
сплава в твердом состоянии.
Литература
1. Гуляев А.П. Металловедение.-
5-е изд., перераб. и доп. - М.: Издательство "металлургия", 1977.
2. Материаловедение для
слесарей-сантехников, слесарей-монтажников, машинистов строительных машин:
Учебник для сред. проф.-тех. училищ /Ю.Г.Виноградов, К.С.Орлов, Л.А.Попова. -
М.: Высш. школа , 2-е изд., 1989.
. Материаловедение. Лекция 5.
З.О.
. Мойзберг Р.К.
Материаловедение, 1991.
. Ханапетов М.В. Сварка и
резка металлов. - 3-е изд., перераб. и доп. - М.: Стройиздат, 1988.