Концентрирование экстрактов лекарственных растений методом нанофильтрации
ДИПЛОМНАЯ РАБОТА
НА ТЕМУ:
Концентрирование экстрактов
лекарственных растений методом нанофильтрации
Введение
Уже на самых ранних стадиях развития человечества растения были не только
источником питания людей, они помогали человеку избавиться от
болезней.Влекарственных травах содержится минимум одно вещество, обладающее
лечебными свойствами. Сейчас известно несколько групп активных веществ
растений: алкалоиды, гликозиды, дубильные вещества, сапонины, флавоноиды,
различные органические кислоты, витамины, жирные и эфирные масла, микроэлементы
и др.Наличием этих веществ обусловлен терапевтический эффект лекарственных
растений.
Основные способы применения сырья лекарственных растений: производство
лекарственных средств для внутреннего и наружного применения.Из лекарственных
растений на фармацевтических заводах и фабриках, в аптеках готовят лечебные
препараты в различных лекарственных формах.
Внутрь
применяют водные извлечения: настой
<#"527401.files/image001.gif"> 4) малотранспортабельны
|
Густой (до 25% влаги)
|
1) используют как связывающие и формообразующие вещества
при изготовлении пилюль в условиях аптеки 2) можно использовать как
корригенты в составах сиропов 3) полупродукты настоек, таблеток
|
1) неудобство использования 2) подсыхают в сухом воздухе 3)
во влажном воздухе отсыревают, плесневеют 4) требуют герметичной упаковки
|
|
Сухой (до 5% влаги)
|
1) удобны в применении 2) имеют минимальную массу
|
1) высокая гигроскопичность
|
Авторы [3] называют сухие экстракты самым рациональным типом экстрактов.
1.2
Способы получения экстрактов
Рассмотрим технологию приготовления лекарственных препаратов из
растительного сырья.
Помимо основных требований к конструкции и материалам аппаратов [3]
описывает все основные технологические линии производства лекарств.
Описать процесс получения готовой продукции (сухого экстракта) можно
следующими этапами:
) Измельчение исходного сырья (дробление, резание, размол и др.)
2) Получение вытяжки (перколяция, реперколяция, циркуляционное
экстрагирование и др.)
) Очистка вытяжки
) Сгущение (концентрирование) вытяжки
) Сушка
В качестве способов измельчения авторы [3,4] рассматривают
дробление на различных аппаратах, некоторые конструкции которых представлены на
рисунке .1.1.
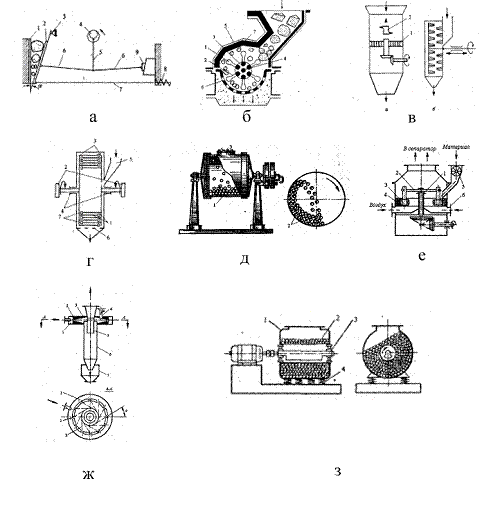
Рисунок 1.2.1 Аппараты для измельчения. а - щековая дробилка, б -
молотковая дробилка, в - дисковые дробилки с одним (а) и двумя (б) дисками, г -
дезинтегратор, д - шаровая мельница, е - кольцевая маятниковая мельница, ж -
струйная мельница, з - вибрационная мельница
Из измельченного сырья выжимку получают экстрагированием. В
производстве сухих и густых экстрактов для получения извлечений из сырья
используют различные способы:
) Ремацерацию и ее варианты (экстрагент делится на части и сырье
последовательно в них настаивается, вытяжка сливается)
2) Перколяцию (процеживание экстрагента через растительный материал)
- рис. 1.1.2
) Реперколяцию (повторное процеживание вытяжки через сырье) -
рис.1.1.3
) Циркуляционное экстрагирование - рис. 1.1.4
) Противоточное экстрагирование в батарее перколяторов с
циркуляционным перемешиванием
) Непрерывное противоточное экстрагирование с перемещением сырья и
экстрагента и др.
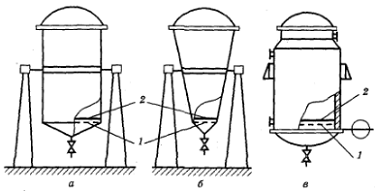
Рисунок 1.2.2 Перколяторы-экстракторы; а - цилиндрический, б -
конический, в - цилиндрический с рубашкой

Рисунок 1.2.3 Схема реперколяции в батарее перколяторов с циркуляционным
перемешиванием
Очистку вытяжек, если не имеет места инактивация БАВ проводят кипятением. При
этом сворачиваются и отслаиваются белки. Иногда применяют адсорбенты. Часто
применяют способ удаления балластных веществ путем осаждения их спиртом.
Существует также метод замены экстрагента (для хлороформных вытяжек).
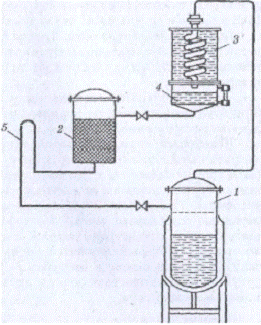
Рисунок 1.2.4 Схема циркуляционного аппарата
Предложенные в [3] способы сгущения выжимки рассмотрим в пункте
1.3.
Если вытяжка достаточно жидкая, ее сушку можно проводить в
распылительных сушилках, барабанных вакуум-сушилках или сублимационных
сушилках.
Для более густой (концентрированной) вытяжки используют вакуум-сушильные
шкафы.
Согласно [3], порошки, гранулы и сборы выпускаются в банках из
стеклопластмассы, пластмассовых банках, а также в пакетах из полимерных
материалов.
Сухие экстракты, отличающиеся большой гигроскопичностью необходимо
хранить в мелкоемких широкогорлых банках, герметически укупоренных, емкостью не
более 100 г. При необходимости хранят в прохладном, защищенном от света месте.
.3 Области
применения экстрактов
Основная область применения экстрактов лекарственных растений, в
частности, экстракта грецкого ореха, - медицина.
Экстракт грецкого ореха содержит большое количество биологически активных
веществ - гидроюглон, легко окисляющийся в юглон, флавоноиды (гипероизид,
3-арабинозид кверцетина, 3-арабинозид кемпферола), альдегиды, эфирные масла,
алкалоиды, витамины С, РР, каротин, фенолкарбоновые кислоты, дубильные
вещества, кумарины, флавоноиды, антоцианы, хиноны и высокие ароматические
углеводороды.
Экстракт грецкого ореха обладает противовоспалительным, глистогонным,
умеренно сахароснижающим, ранозаживляющим и эпителизирующим, бактерицидным,
противосклеротическим, тонизирующим, легким слабительным и вяжущим свойствами;
нормализует углеводный обмен; хорошо зарекомендовало себя при лечении
лимфатических узлов; регулирует функциональную деятельность желудочно-кишечного
тракта [5].
Экстракт осины - природный источник салициловой кислоты и ее производных,
антибактериальное, вяжущее, противоревматическое средство [5].
Известно, что главный компонент исследуемых экстрактов - юглон - обладает
антиоксидантным, противоопухолевым, антисептическим, общеукрепляющим действием
[5].
Юглон используют в лечении инфицированных ран, длительно незаживающих
язв, термических ожогов. Часто юглон применяют для лечения дерматомикозов,
хронических экзем и псориаза. Многие работы свидетельствуют о том, что юглон
является важным элементом лечения онкологических заболеваний [6,7].
В статье [8] рассматривается регулирование афлатоксина, вырабатываемого
грибами Aspergillus flavus и Aspergillus parasiticus. Этот токсин может вызывать
серьезные заболевания печени, в том числе и рак. Юглон ограничивает рост грибов
и выработку афлатоксина, что может говорить об противогрибковом действии
юглона.
Препараты, которые предполагается приготовить из полученного после
концентрирования экстракта: Юглон-П и Югло-осин.
ЮГЛОН-П: антиоксидантное, адаптогенное, противоопухолевое,
противопаразитарное, антисептическое, иммуномодулирующее, общеукрепляющее.
ЮГЛОСИН: Обладает противопаразитарным, противовоспалительным,
бактерицидным, спазмолитическим, иммуномодулирующим, желчегонным действиями.
.4 Методы
концентрирования экстрактов
Вакуумное выпаривание
Самым распространенным на сегодняшний день методом концентрирования
растительных экстрактов является вакуумное выпаривание.
Данный метод приводится в качестве основного в [3]. В этом источнике
дается описание процесса вакуумного выпаривания, а также аппараты для
реализации этого метода.
При выпаривании под вакуумом можно проводить процесс при более низких
температурах, что очень важно для веществ, склонных к разложению.
Часто для экономии греющего пара используют многокорпусные выпарные
установки [4] (рисунок 1.4.1).
Очищенные вытяжки упаривают под вакуумом при температуре 50-60оС
до требуемой консистенции. Аппаратура, используемая для упаривания вытяжек в
фармацевтическом производстве, имеет свои особенности. Это объясняется наличием
в вытяжке биологически активных веществ, которые могут осаждаться на стенках
выпарных аппаратов при упаривании и терять свою активность из-за высокой
температуры стенок.
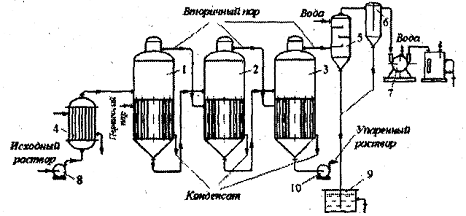
Рисунок 1.4.1 Многокорпусная прямоточная вакуум-выпарная установка. 1,2,3
- выпарные аппараты, 4 - подогреватель исходной смеси, 5 - барометрический
конденсатор, 6 - ловушка, 7 - вакуум-насос, 8 - насос, 9 - барометрический
ящик, 10 - центробежный насос
Поэтому аппараты, в которых нет циркуляции упариваемой вытяжки,
применяются в фармацевтическом производстве крайне редко. Наибольшее применение
нашли такие конструкции, как прямоточный роторный (рисунок 1.4.2), циркуляционный
вакуум-выпарной (рисунок 1.4.3) и пенный испаритель (рисунок 1.4.4) [3].
Вариант использования роторно-вакуумного пленочного испарителя рассмотрен в
статье [9]. Предметом исследования авторов является хвойный лечебный экстракт.
Цель работы [9] заключается в исследовании физико-химических показателей
(плотность и вязкость) и тепло-физических характеристик (коэффициенты
теплопроводности, температуропроводности и теплоемкости) хвойноголечебного
экстракта, необходимых для проведения процесса концентрирования хвойного
лечебного экстракта в роторно-вакуумном испарителе.
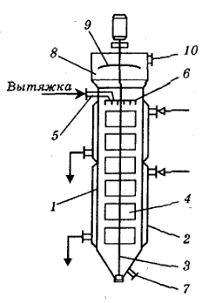
Рисунок 1.4.2 Роторный прямоточный аппарат:
- корпус, 2 - рубашка, 3 - вал, 4 - скребки, 5 - штуцер для ввода
вытяжки, 6 - распределительное кольцо, 7 - штуцер, через который выводится
сгущенная вытяжка, 8 - сепарационная камера, 9 - каплеотбойник, 10 - патрубок
для отвода вторичного пара
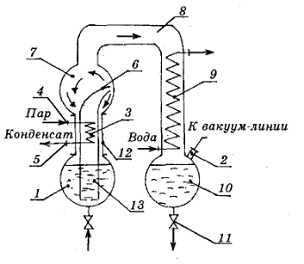
Рисунок 1.4.3 Схема циркуляционного вакуум-выпарного аппарата фирмы
"Симакс":
- колба-приемник, 2 - штуцер для подачи вытяжки, 3 - калорифер, 4 -
патрубок для подачи греющего пара, 5 - патрубок для отвода конденсата, 6 -
хобот, 7 - колба-расширитель, 8 - широкая труба для отвода паров, 9 -
холодильник-конденсатор, 10 - колба-приемник, 11 - штуцер для отвода паров
экстрагента, 12 - царга, 13 - циркуляционная труба
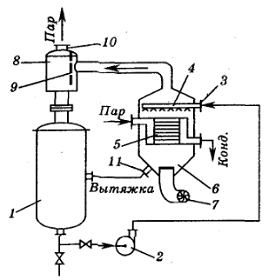
Рисунок 1.4.4 Схема пенного испарителя:
1 - рабочая емкость, 2 - насос, 3 - патрубок для подачи вытяжки, 4 -
распределительное устройство, 5 - трубки испарительной камеры, 6 -
испарительная камера, 7 - вентилятор, 8 - сепаратор, 9 - перегородка, 10 -
патрубок для вывода воздуха, обогащенного влагой, 11 - патрубок для подачи
капель вытяжки в рабочую емкость
Нанофильтрация
Несмотря на широкое использование выпаривания в фармацевтическом и
пищевом производстве, в последние десять лет активно изучают мембранные методы
концентрирования различных растительных препаратов, в том числе нанофильтрацию.
Так одна из ранних статей, относящаяся к 2004 году, [10] посвящена
изучению процесса нанофильтрации экстракта кофе, а также сравнительной
экономической оценке нанофильтрации и обратного осмоса для проведения
концентрирования. Основная проблема, с которой сталкиваются исследователи -
необходимость найти способ концентрирования экстракта кофе без потери качества
и по приемлемой цене. В качестве возможного метода получения растворимого кофе
авторы [10] рассматривают распылительную сушку, оборудование для которой
является дорогостоящим, а также высокими могут оказаться эксплуатационные
затраты. Поэтому предварительной стадией перед распылительной сушкой еще в
восьмидесятые годы прошлого века предлагалось установить обратный осмос,
призванный сократить затраты.
Другой метод - сублимационная сушка. Но затраты на этот способ еще выше,
в том числе и капитальные затраты.
Таким образом авторы [10] приходят к необходимости использования
мембранного разделения, так как этот метод является щадящим, приводит к
невысоким потерям и может быть интегрирован с другими методами разделения и
реакторами. С помощью мембран можно разработать более чистые технологические
процессы (рисунок 2.4.5)

Рисунок 1.4.5 Чистая технология производства растворимого кофе
Авторы [10] изучают возможность заменить обратный осмос нанофильтрацией
дабы уменьшить затраты процесса. В [10] предлагается осуществление схемы с
рециклом пермеата (рисунок 1.4.5), что уменьшает потери ценных компонентов.
Исследователи проводили эксперименты на мембране NF-45 (DowFilmtec). Характеристики процесса: площадь
мембраны - 0,047 м2, максимальное давление - 30 бар, максимальная
величина рециркуляционного потока - 1000 л/ч.
Первоначально исследовались производительности по чистой воде и кофейному
экстракту при различных давлениях, температурах и значениях рециркуляционного
потока. Вторым шагом было концентрирование 8 литров экстракта при 42оС
при 700 л/ч рециркуляционого потока и давлении 20 бар. С каждым литром
выходившего фильтрата сливали по 200 мл концентрата и фильтрата. Определялось
содержание сухого вещества высушиванием в сушильном шкафу.
Влияние рециркуляционного потока определялось при 24оС при
различных давлениях (рисунок 1.4.6).
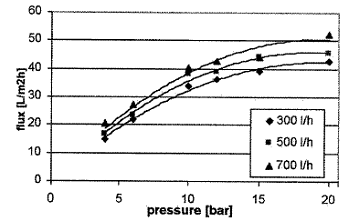
Рисунок 1.4.6 Диаграмма давление-производительность кофейного экстракта
при 24оС и различных величинах рециркуляционного потока
С повышением давления и рециркуляционного потока производительность
фильтрата возрастала.
Результаты изучения влияния температуры можно видеть на рисунке 1.4.7
Наибольшей производительности можно добиться при повышенной температуре:
42оС.
Таким образом в качестве рабочих параметров выбрали давление 20 бар,
температуру 42оС и рециркуляционный поток 700 л/ч.
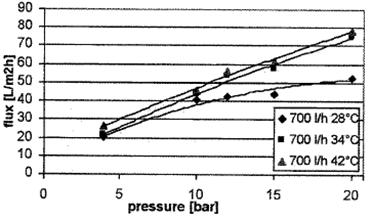
Рисунок 1.4.7 Диаграмма давление-производительность кофейного экстракта
при рециркуляционном потоке 700 л/ч и разных температурах
Для математического описания производительности кофейного экстракта
использовалась осмотическая модель:
 (2.4.1)
(2.4.1)
Производительность по чистой воде:
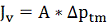 (2.4.2)
(2.4.2)
Разность осмотических давлений:
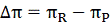 (2.4.3)
(2.4.3)
Разность осмотических давлений зависит от температуры и концентрации.
Температура во время измерений была постоянна, концентрация фильтрата была
практически равна нулю, поэтому разность осмотических давлений зависит только
от концентрации концентрата. Эмпирическая формула (уравнение Раушенбаха) была
использована, чтоб рассчитать осмотическое давление:
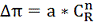 (2.4.4)
(2.4.4)
Подставляя это уравнение в уравнение (2.4.1) получим:
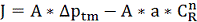 (2.4.5)
(2.4.5)
Из уравнений (2.4.5) и (2.4.2) имеем:
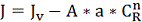 (2.4.6)
(2.4.6)
Логарифмируя это уравнение получим:
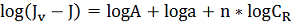 (2.4.7)
(2.4.7)
С помощью построения графика (рисунок 2.4.8) из угла наклона кривой и
отрезка, отсекаемого на оси авторы [10]находят параметры уравнения Раушенбаха: a = 5,772; n = 0,223
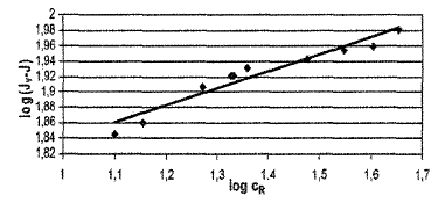
Рисунок 1.4.8 Графическое отображение уравнения (1.4.7)
Влияние концентрации на производительность можно видеть на рисунке 1.4.9.
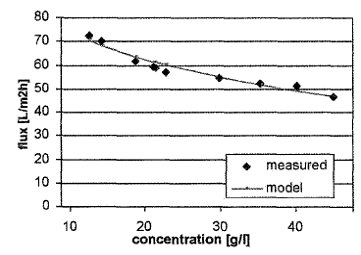
Рисунок 1.4.9 Измеренные и модельные значения производительности в
зависимости от концентрации
После проведения экспериментов было определено содержание основного
компонента - кофеина - в исходном экстракте, концентрате и фильтрате. Они
оказались равными 1,49 г/л, 5,51 г/л и 0,323 г/л соответственно.
На основе литературных данных и собственных расчетов авторы [10] сравнили
стоимость обратного осмоса и нанофильтрации при работе завода 5 дней в неделю с
перерывом на обслуживание установки на 3 дня в месяц. Расчитанная
производительность для нанофильтрации составила 2,678 м3/м2*сутки
и 0,5557 м3/м2*сутки для обратного осмоса. Инвестиционные
(капитальные), эксплуатационные и общие затраты отображены в таблице 1.4.1
Таблица 1.4.1
Сравнение затрат на нанофильтрацию и обратный осмос
|
Нанофильтрация (NF-45)
|
Обратный осмос (HR-30)
|
|
Поверхность мембраны, м2
|
20
|
94
|
|
Капитальные затраты в год, €(руб)/год
|
180 (6813)
|
850 (32172,5)
|
|
Капитальные затраты на м3, €(руб)/м3
|
0,022 (0,84)
|
0,104 (3,94)
|
|
Эксплуатационные затраты, €(руб)/м3
|
0,048 (1,82)
|
0,087 (3,29)
|
|
Итого, €(руб)/м3
|
0,070 (2,66)
|
0,191 (7,23)
|
В результате было авторами [10] было определено, что нанофильтрацию можно
использовать вместо обратного осмоса. Общее задерживание (селективность)
твердых частиц(сухого остатка) составило 98,75%.
В статье [11] авторы соглашаются, что наиболее популярным методом
концентрирования экстрактов является выпаривание. Однако они подчеркивают ряд
недостатков выпаривания: высокие затраты, загрязнение окружающей среды,
снижение активности важнейших компонентов экстракта и низкая чистота.
Аналогичного мнения придерживаются и авторы статьи [12].
По мнению исследователей [11] нанофильтрация привлекательна невысоким
давлением, различной селективностью по одно- и двухвалентным ионам, высокой
стойкостью к микроорганизмам, невысокой стоимостью и малым износом. Именно по
этим причинам нанофильтрация широко применяется в пищевой промышленности,
очистке сточных вод, подготовке питьевой воды, для разделения, очистки и
концентрирования в фармацевтической области и экологии.
Таким образом в работе [11] задачей исследователей является попытка
замены вакуумного выпаривания экстракта Гинкго билоба новым методом -
нанофильтрацией.
В эксперименте [11] использовались три мембраны с поверхностью 0,004 м2.
Характеристики мембран можно увидеть в таблице 2.4.2
Таблица 1.4.2
Характеристики мембран G, K, L
|
G
|
K
|
L
|
|
Максимальное давление, кПа
|
4000
|
3500
|
3500
|
|
рН
|
2,0-11,0
|
2,0-11,0
|
2,0-11,0
|
|
Отсечка по молекулярной массе
|
До 100
|
Около 250
|
Около 250
|
|
Производительность по воде л/м2*ч
|
20,5
|
34
|
47,2
|
Все измерения проводились при температуре 35-40оС. Схема
процесса изображена на рисунке 1.4.10
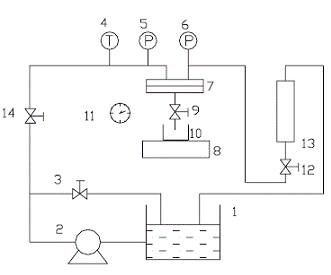
Рисунок 1.4.10 Схема нанофильтрационного процесса: 1 - емкость питания, 2
- насос, 3,9,12,14 - регулирующие вентили, 4 - цифровой термометр, 5,6 -
манометры, 7- мембранная ячейка, 8 - электрические весы, 10 - мерный стакан, 11
-секундомер, 13 - ротаметр
Исследователи [11] измеряли производительность мембран и концентрацию
пермеата при различных рабочих условиях. Концентрация активного компонента в
пермеате определялась жидкостной хроматографией высокого давления. Результаты
отображены в таблице 1.4.3
Таблица 1.4.3
Производительность пермеата и селективность. Давление 1,2 МПа,
рециркулирующий поток 60 л/ч, концентрация 8,46%
|
G
|
K
|
L
|
|
Производительность пермеата, л/м2*ч
|
5.9
|
6.8
|
9.5
|
|
Концентрация пермеата (%)
|
0,9
|
1,5
|
2,4
|
|
Селективность суммарная по флавонам (%)99,57
|
99,57
|
99,06
|
98,44
|
Не слишком высокая разница в селективности, но значительная разница в производительности
позволяет авторам статьи [11] отбросить мембрану G и продолжать дальнейшие
исследования с мембранами K и L. При изучении влияния давления были получены
зависимости похожие с полученными в [10]. При росте давления до некоторого
значения производительность резко растет, потом рост значительно снижается
(рисунок 1.4.11)

Рисунок 1.4.11 Диаграмма производительность пермеата-рабочее давление
(исходная концентрация экстракта 8,46%, рециркулирующий поток 60 л/ч)
При величине давления 1-1,5 МПа отчетливо проявляется влияние
концентрационной поляризации. Рост производительности с ростом давления
способствует увеличению концентрации у поверхности мембраны. Это вызывает
концентрационную поляризацию и адсорбцию на поверхности мембраны. В работе [11]
сопротивление мембраны, концентрационной и гелевой поляризации, а также общее
сопротивление определялись теоремой Дарси:
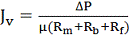 (2.4.8)
(2.4.8)
Где  - разность давлений по обе стороны мембраны, μ
- вязкость пермеата,
- разность давлений по обе стороны мембраны, μ
- вязкость пермеата,  - сопротивление мембраны,
- сопротивление мембраны, - сопротивление концентрационной
поляризации,
- сопротивление концентрационной
поляризации, 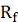 - сопротивление гелевой поляризации
- сопротивление гелевой поляризации
Как можно увидеть на рисунке 2.4.12 сопротивление мембраны и
концентрационной поляризации значимы по сравнению с гелевой поляризацией.
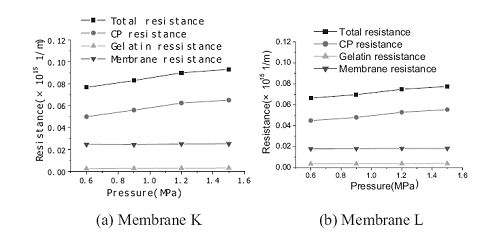
Рисунок 1.4.12 Диаграмма сопротивление - давление (исходная концентрация
экстракта 8,46%, рециркулирующий поток 60 л/ч) а - мембрана K, b - мембрана L
Авторы [11] сравнивают общее сопротивление двух мембран и отмечают, что
сопротивление мембраны K больше, чем мембраны L. Следовательно при одинаковой
движущей силе производительность по пермеату мембраны L будет больше, чем
мембраны K.
Концентрация пермеата понижается с увеличением давления и выходит на
постоянное значение (рисунок 1.4.13)
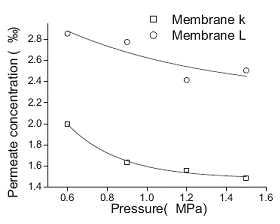
Рисунок 1.4.13 Зависимость концентрации пермеата от давления (исходная
концентрация экстракта 8,46%, рециркулирующий поток 60 л/ч)
Согласно авторам [11]концентрация пермеата падает с увеличением давления,
так как несмотря на увеличение проницания растворенных веществ, увеличивается и
проницание растворителя, причем проницание растворителя в диапазоне рабочих
давлений оказывается больше, чем растворенного вещества.
Таблицы 1.4.4 и 1.4.5 результируют общую селективность по флавонам двух
мембран. Изменение селективности незначительно. Все величины селективности
свыше 99%.
Таблица 1.4.4
Конечное количество флавонов в пермеате в зависимости от давления для
мембраны К (исходная концентрация экстракта 8,46%, рециркулирующий поток 60
л/ч)
|
Давление, МПа
|
0,6
|
0,9
|
1,2
|
1,5
|
|
Концентрация пермеата %
|
2,0
|
1,64
|
1,56
|
1,48
|
|
Общая селективность по флавонам %
|
99,46
|
99,43
|
99,06
|
99,40
|
Таблица 1.4.5
Конечное количество флавонов в пермеате в зависимости от давления для
мембраны L(исходная концентрация экстракта 8,46%, рециркулирующий поток 60 л/ч)
|
Давление, МПа
|
0,6
|
0,9
|
1,2
|
1,5
|
|
Концентрация пермеата %
|
2,85
|
2,77
|
2,50
|
2,41
|
|
Общая селективность по флавонам %
|
99,18
|
99,88
|
99,82
|
99,79
|
Результаты показывают, что рабочее давление должно быть в пределах
1,2-1,5 МПа.
При изучении авторами [11] влияния рециркулирующего потока был получен
следующий результат: при повышении рециркулирующего потока возрастала
производительность, но постепенно ее возрастание становилось все менее заметным
(рисунок 1.4.14).
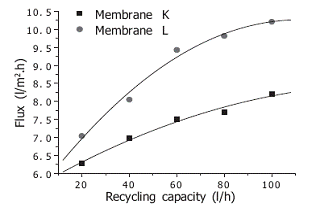
Рисунок 1.4.14 Зависимость производительности пермеата от
рециркулирующего потока (исходная концентрация экстракта 8,31%, давление 1,2
МПа)
Авторы статьи [11] находят следующее объяснение:из рисунка 1.4.15 видно,
что тангенциальная сила разрежает концентрацию у поверхности мембраны и
уменьшает слой концентрационной поляризации. Когда слой концентрационной
поляризации достигает своего предела, производительность остается постоянной.

Рисунок 1.4.15 Диаграмма сопротивление - рециркулирующий поток (исходная
концентрация экстракта 8,31%, давление 1,2 МПа) а - мембрана K, b - мембрана L
Рисунок 1.4.16 показывает, что концентрация пермеата падает с повышением
рециркулирующего потока, но в конце приобретает постоянное значение. Вместе с
повышением рециркулирующего потока падает концентрация у поверхности мембраны,
что уменьшает проницаемость растворенного вещества.
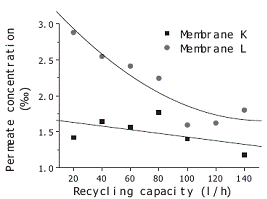
Рисунок 1.4.16 Зависимость концентрации пермеата от рециркулирующего
потока (исходная концентрация экстракта 8,31%, давление 1,2 МПа)
Таблицы 1.4.6 и 1.4.7 показывают, что селективность выше 99% во всех
случаях. Оптимальным значением рециркулирующего потока выбирается 100-140 л/ч.
Таблица 1.4.6
Конечное количество флавонов в пермеате в зависимости от рециркулирующего
потока для мембраны К(исходная концентрация экстракта 8,31%, давление1,2МПа)
|
Рециркулирующий поток, л/ч
|
20
|
40
|
60
|
80
|
100
|
140
|
|
Концентрация пермеата %
|
1,42
|
1,64
|
1,5
|
1,77
|
1,4
|
1,17
|
|
Общая селективность по флавонам %
|
99,69
|
99,82
|
99,06
|
99,67
|
99,90
|
99,87
|
Таблица 1.4 7
Конечное количество флавонов в пермеате в зависимости от рециркулирующего
потока для мембраны L(исходная концентрация экстракта 8,31%, давление1,2МПа)
|
Рециркулирующий поток, л/ч
|
20
|
40
|
60
|
80
|
100
|
120
|
140
|
|
Концентрация пермеата %
|
2,88
|
2,55
|
2,41
|
2,24
|
1,59
|
1,62
|
1,80
|
|
Общая селективность по флавонам %
|
99,34
|
99,49
|
99,82
|
99,80
|
99,72
|
99,62
|
99,77
|
Также исследователями [11] было изучено влияние исходной концентрации
экстракта на производительность и концентрацию пермеата. На практике эта
концентрация постоянно меняется, так как процесс непрерывен. И это делает еще
более важным исследование этой зависимости.
Все три мембраны использовали в этом опыте. Концентрации исходного
экстракта были 8,4, 5,4, 4,3, 3,3,2,8, 0,95 %
Из рисунка 1.4.17 можем заключить, что производительность пермеата падает
с повышением концентрации экстракта. Одна из причин то, что эффективное
давление, приложенное к мембране, ослабляется осмотическим давлением, которое
увеличивается с увеличением концентрации.

Рисунок 1.4.17 Зависимость производительности пермеата от исходной
концентрации экстракта (давление 1,2 МПа, рециркулирующий поток 60 л/ч)
Плюс к тому, как результат увеличения концентрации, увеличивается общее
сопротивление и вязкость раствора. Когда концентрация ниже 8,4% сопротивления
мембраны и концентрационной поляризации значимо больше гелевой поляризации, а
следовательно падение производительности не такое большое. Тогда как при
приближении исходной концентрации к концентрации гелеобразования, полное сопротивление
будет резко усиливаться, и производительность пермеата быстро упадет. Поэтому
стоит удерживать концентрацию в пределах концентрации гелеобразования.
Рисунок 1.4.17 показывает, что концентрация пермеата резко возрастает с
увеличением исходной концентрации. Авторы [11] объясняют это тем, что
увеличение концентрации в исходном растворе повышает проницаемость
растворенного вещества за счет увеличения концентрации у поверхности мембраны,
кроме того влияет уменьшение производительности.
Таблицы 1.4.8 (а), 1.4.8 (б) и 1.4.8 (в) показывают, что селективность
выше 99% во всех случаях.
Таким образом авторы [11] делают основные выводы о пределах проведения
процесса концентрирования экстракта Гинкго билоба.

Рисунок 1.4.17 Зависимость концентрации пермеата от исходной концентрации
экстракта (давление 1,2 МПа, рециркулирующий поток 60 л/ч)
Таблица
1.4.8(а)
Конечное количество флавонов в пермеате в зависимости от исходной
концентрации экстракта для мембраны G (давление 1,2МПа, рециркулирующий поток 60 л/ч)
|
Исходная концентрация экстракта, %
|
8,46
|
4,27
|
3,63
|
2,84
|
2,28
|
0,95
|
|
Концентрация пермеата %
|
0,88
|
0,87
|
0,54
|
0,63
|
0,39
|
0,34
|
|
Общая селективность по флавонам %
|
99,58
|
100,00
|
99,86
|
100,00
|
99,95
|
99,95
|
Таблица 1.4.8
(б)
Конечное количество флавонов в пермеате в зависимости от исходной
концентрации экстракта для мембраны K (давление 1,2МПа, рециркулирующий поток
60 л/ч)
|
Исходная концентрация экстракта, %8,465,344,273,272,840,95
|
|
|
|
|
|
|
|
Концентрация пермеата %
|
1,56
|
1,01
|
0,90
|
0,61
|
0,52
|
0,28
|
|
Общая селективность по флавонам %
|
99,06
|
99,76
|
100,00
|
99,92
|
100,00
|
100,00
|
Исследования мембранных процессов для концентрирования растительных
препаратов были также проведены в статье [12], где объектом исследования
служила облепиха крушинная. Основная область применения сока этого растения -
пищевая промышленность. Изготовление растворимого чая, джемов или каких-либо
других продуктов, обладающих благотворным действием на организм, так как
облепиха крушинная может лечить некоторые болезни.
Таблица 1.4.8
(в)
Конечное количество флавонов в пермеате в зависимости от исходной
концентрации экстракта для мембраны L (давление 1,2МПа, рециркулирующий поток 60 л/ч)
|
Исходная концентрация экстракта, %
|
8,13
|
5,37
|
4,23
|
3,63
|
2,84
|
0,95
|
2,41
|
0,98
|
0,85
|
0,98
|
0,82
|
0,37
|
|
Общая селективность по флавонам %
|
99,82
|
100,00
|
99,88
|
99,93
|
99,94
|
99,98
|
Основная цель авторов [12] изучить концентрирование сока облепихи
крушинной различными методами мембранного разделения.
Использовался сок облепихи крушинной с частицами кожицы и мякотью ягод.
Сок был лишь стерилизован, но не подвергался предварительной очистке.
Предполагалось в одном случае провести предварительную очистку микрофильтрацией
(MF) и сконцентрировать очищенный сок обратным осмосом (RO1), в других двух
случаях концентрировать неочищенный сок нанофильтрацией (NF) или обратным осмосом (RO2).
Для микрофильтрации использовались керамические мембраны Millipore при
давлении 0,7 - 3,2 бар. Очищенный сок концентрировали обратным осмосом на
рулонном модуле Millipore при трансмембранном давлении 9-30 бар. Необработанный
сок концентрировали в одном случае на плоской листовой нанофильтрационной
мембране Trisep с давлением 9-32 бар, а в другом случае на плоской
обратноосмотической мембране Filmtec DOW при 22-48 бар. Во всех случаях
температура проведения процессов была примерно 30оС. Схема процесса
показана на рисунке 1.4.18.
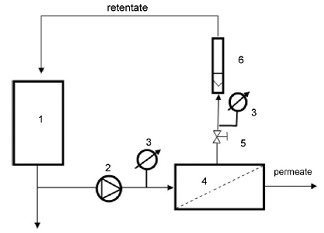
Рисунок 1.4.18 Схема проведения процессов. 1 - емкость, 2 - насос, 3 -
манометры, 4 - мембрана, 5 - вентиль, 6 - ротаметр
Характеристики мембран, использованных в эксперименте, даны в таблице
1.4.9.
Таблица 1.4.9
Характеристики мембран
|
процесс
|
Тип мембраны/ материал
|
Изготовитель
|
Поверхность мембраны, м2
|
Максимальная производительность, л/ч
|
Максимальное давление, бар
|
|
MF
|
Керамическая/Al2О3
|
Millipore
|
0,125
|
500
|
6
|
|
RO1
|
Рулон/полиамид
|
Millipore
|
0,3
|
250
|
40
|
|
NF
|
Лист/полиамид
|
Trisep
|
0,036
|
800
|
40
|
|
RO2
|
Лист/полиамид
|
Filmtec DOW
|
0,072
|
800
|
70
|
В каждом эксперименте использовалось по 8 литров раствора. После
микрофильтрации осталось 5 литров пермеата. После обратного осмоса 1 было слито
1,8 литров пермеата из 3 литров (объем емкости). После нанофильтрации из 8
литров было слито 2,6 литров пермеата. С обратного осмоса 2 было получено 3
литра пермеата. Приложенное давление: 3 бар (MF), 30 бар (RO1), 30 бар (NF), 48 бар (RO2).
Измеряли антиоксидантную активность (через аскорбиновую кислоту) и
количество сухого остатка в соке. Антиоксидантную активность измеряли
спектрофотометром при длине волны 593 нм, количество сухого остатка измеряли
рефрактометром.
Измерение производительности по воде было проведено до и после
эксперимента.
Результаты измерения производительности при различных давлениях для
микрофильтрации приведены на рисунке 1.4.19. Результаты измерения изменения
производительности во времени для микрофильтрации изображены на рисунке 1.4.20.
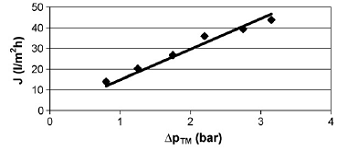
Рисунок 1.4.19 Производительность по соку облепихи крушинной (MF, рециркулирующий поток - 500 л/ч, 30оС)
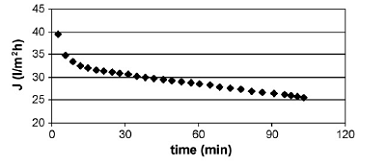
Рисунок 1.4.20 Изменение производительности по соку во времени(MF, рециркулирующий поток - 500 л/ч,
давление - 3 бар, 30оС)
До проведения эксперимента производительность по воде была 12 000 л/м2*ч.
После проведения эксперимента она стала составлять лишь 118 л/м2*ч
при трансмембранном давлении 3,5 бар.
Рисунок 1.4.21 показывает зависимость производительности от давления для
обратного осмоса 1 при различных величинах рециркулирующего потока.
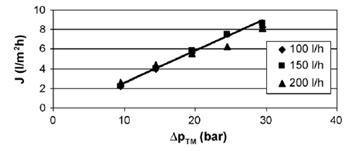
Рисунок 1.4.21 Производительность очищенного сока облепихи крушинной при
различных величинах рециркулирующего потока (RO1, 30оС)
Как видно, величина рециркулирующего потока в данном случае практически
не влияет на производительность.
На рисунке 1.4.22 отображены результаты измерений концентрации, а также
производительности в процессе концентрирования обратным осмосом 1.
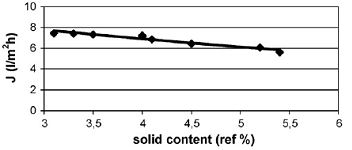
Рисунок 1.4.22 Концентрирование очищенного сока облепихи крушинной (RO1, рециркуляционный поток - 150 л/ч,
давление 30 бар, 30оС)
Как видно, концентрация достигла 5,5%. Это не было пределом, однако
исходный раствор был исчерпан и продолжать далее авторы [12] не имели
возможности. Для обратного осмоса загрязнение мембраны было незначительным и
мембрана легко промывалась. Мембрана восстанавливала исходные значения
производительностей по воде.
Зависимость производительности от давления для нанофильтрации при
различных значениях рециркулирующего потока можно увидеть на рисунке 1.4.23.
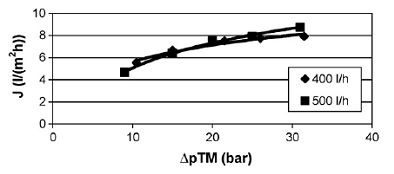
Рисунок 1.4.23 Производительность по соку обл.круш.(неочищ.) при
различных значениях рециркулирующего потока (NF, 30оС)
Аналогично с результатами [11] производительность возрастает с повышением
давления и рециркулирующего потока.

Рисунок 1.4.24 Концентрирование неочищенного сока облепихи крушинной (NF, рециркуляционный поток - 500 л/ч,
давление 30 бар, 30оС)
Авторы [12]отмечают, что при том, что концентрация концентрата возрасла
от 4 до 15% (рисунок 1.4.24), концентрация пермеата была практически равна
нулю.
Производительность нанофильтрационной мембраны по воде сократилась втрое
после после проведения опыта. Несмотря на то, что промыть мембрану было сложно,
дважды промытая, она была восстановлена.
На рисунке 1.4.25 отображена зависимость производительности от давления
при различных значениях рециркулирующего потока для обратного осмоса без
предочистки.

Рисунок 1.4.25 Производительность по соку обл.круш.(неочищ.) при
различных значениях рециркулирующего потока (RO2, 30оС)
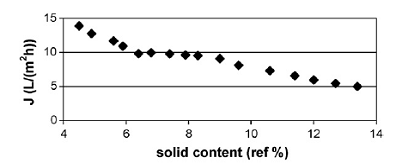
Рисунок 1.4.26 Концентрирование неочищенного сока облепихи крушинной
(RO2, рециркуляционный поток - 500 л/ч, давление 48 бар, 30оС)
Концентрация концентрата возрасла от 4,5 до 13,4% (рисунок 1.4.26).
Мембрана загрязнилась вдвое больше, чем при нанофильтрации. Мембрана была
восстановлена только при вдвое длительной промывке, чем остальные мембраны.
Результаты оценки антиоксидантной активности полученных продуктов
отображены на рисунке 1.4.27.
Из этих результатов можно понять, что наибольшей эффективностью является
метод MF-RO1. Практически одинаковой эффективностью, не намного меньше MF-RO1,
обладают NF и RO2.
Как отмечают исследователи [12], отсюда видно, что наибольшее количество
витамина С содержится именно в мякоти, потому что наибольшее его содержание
обнаруживается в концентратах, полученных способами, не включающими предочистку
(NF, RO2, MF).
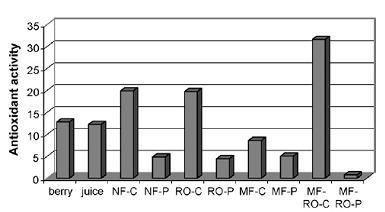
Рисунок 1.4.27 Антиоксидантная активность облепихи крушинной: ягод, сока,
концентратов и пермеатов
Оценка содержания витамина С отображена на рисунке 2.4.28.
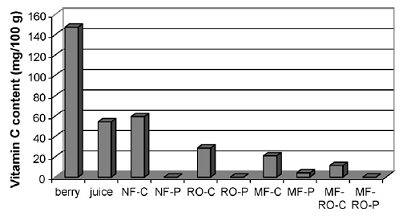
Рисунок 1.4.28 Содержание витамина С: в ягодах, соке, концентратах и
пермеатах
Таким образом, авторы [12] делают вывод о применимости мембранных методов
для концентрирования сока облепихи крушинной.
За последний год было опубликовано несколько исследовательских работ,
посвященных концентрированию растительных экстрактов мембранными методами.
В статье [13] авторы изучают экстракцию пектина из красной смородины и
дальнейшее концентрирование раствора пектина нанофильтрацией и обратным
осмосом. Использовались плоская мембрана для обратного осмоса и рулонный модуль
для нанофильтрации. Изучались влияние давления и перекрестного потока на
производительность и концентрацию. Степень концентрирования определялась как
отношение объемов исходного потокак концентрату.
В таблице 1.4.10 отражены характеристики мембран, использованных в
процессе исследования.
Таблица
1.4.10
Характеристики мембран
|
RO1
|
RO2
|
NF1
|
NF2
|
|
Тип мембраны
|
Лист ACM2
|
Лист SG
|
Рулон
|
Лист DL
|
|
Материал
|
полиамид
|
Композит.
|
полиамид
|
Композит.
|
|
Поверхность,м2
|
0,18
|
0,0156
|
0,3
|
0,0156
|
|
Давление максимальное, бар
|
70
|
70
|
40
|
40
|
|
рН
|
2-11
|
2-11
|
2-11
|
2-11
|
|
Селективность по NaCl(%)
|
99,9
|
98,5
|
-
|
-
|
|
Селективность по CaCl2/MgSO4(%)
|
-
|
-
|
94
|
96
|
Содержание воды и pH в исходном растворе красной смородины были 74,7% и
6,18 соответственно. Организация потока - противоток. Электропроводность и
содержание твердых веществ в пермеате определялись кондуктометром Consort C535
и рефрактометром. Содержание пектина измерялось фотометрически при 520 нм и
приводилось к галактуроновой кислоте.
Как и в статьях [10] и [11]авторы получают похожую зависимость
производительности от давления (рисунок 1.4.29) и делают выводы, аналогичные
выводам в [11].
Оптимальным рабочим давлением принимается 3 МПа.
Во времени производительность пермеата падала, приобретая постоянный
характер (рисунок 1.4.30). Выводы исследователей аналогичны [11].
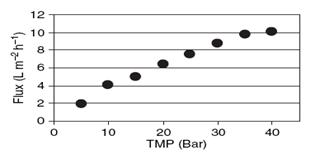
Рисунок 1.4.29 Зависимость производительности NF1 от давления,
перекрестный поток: 200 л/ч
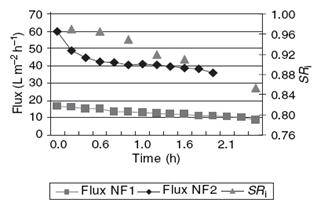
Рисунок 1.4.30 Сравнение величин производительности для разных
нанофильтрационных мембран с течением времени (давление 3МПа, температура 20оС,
поперечный поток 200 л/ч)
Степень концентрирования была 3,6 и 11 для NF1 и NF2 соответственно.
Общее количество твердого вещества составляло 8.8 и 6,3oBrix.
Первоначальное значение было 0,9oBrix.
Зависимости для обратного осмоса отражены на рисунке 1.4.31. Как видно,
зависимости производительности от давления и рециркулирующего потока абсолютно
аналогичны статьям, рассмотренным ранее.
Оптимальными параметрами для проведения концентрирования выжимки обратным
осмосом были приняты давление 3 МПа, рециркулирующий поток 500 л/ч. Как можно
видеть на рисунке 1.4.32, между производительностями для различных мембран
большая разница. Хотя обе мембраны листовые, они сделаны из разных материалов и
имели различную селективность по NaCl.
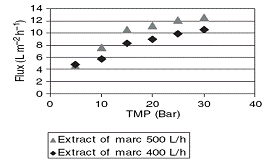
Рисунок 1.4.31 Зависимость производительности от давления при различных
значениях рециркулирующего потока.
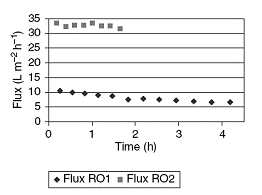
Рисунок 1.4.32 Концентрирование выжимки красной смородины во времени
(давление 30бар, температура 30оС, поперечный поток: 500 л/ч)
Для RO2 было получено значение производительности в 3 раза больше из-за
меньшего полного сопротивления. Содержание твердого вещества в пермеате было
практически равно нулю. Концентрация же в концентрате возросла от 0,9 до 4,2 oBrix
для RO1 и до 6,7 oBrix для RO2. Степень концентрирования была 3 и 16
для RO1 и RO2 соответственно (таблица 1.4.11).
Одной из задач исследования было рассмотрение индивидуального
сопротивления и влияние его на полное сопротивление. Индивидуальное
сопротивление: сопротивление мембраны, сопротивление внешнего загрязнения
(концентрационная поляризация), сопротивление гелевой поляризации.
Таблица
1.4.11
Характеристики концентрирования для различных мембран
|
селективность
|
Степень концентрирования
|
oBrix
|
|
RO1
|
0.96
|
3
|
4.2
|
|
RO2
|
0.96
|
16.5
|
6.7
|
|
NF1
|
0.85
|
3.6
|
8.8
|
|
NF2
|
0.62
|
11
|
6.3
|
Сопротивление мембраны было вычислено из измерений производительности по
воде до и после работы с выжимкой (рисунок 1.4.33)
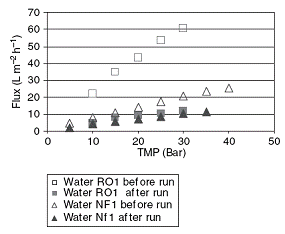
Рисунок 1.4.33 Производительности по воде чистой и загрязненной мембран в
зависимости от давления
Из рисунка 1.4.34 ясно, что мембранное сопротивление и внешнее
загрязнение мембраны наиболее важны по сравнению с гелевой поляризацией для
RO1, RO2, NF1. В экспериментах для NF2 тенденция такова: соотношение
между мембранным сопротивлением, сопротивлением концентрационной и гелевой
поляризаций - 44%, 22% и 34% соответственно. Эта разница обусловлена величиной 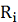 - селективности. Селективность ионов
была меньше для NF2, что было причиной малой концентрационной поляризации и
относительно небольшой гелевой поляризации, а также более высокой
производительности.
- селективности. Селективность ионов
была меньше для NF2, что было причиной малой концентрационной поляризации и
относительно небольшой гелевой поляризации, а также более высокой
производительности.
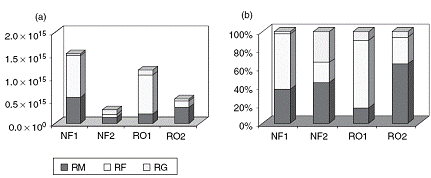
Рисунок 1.4.34 Индивидуальное сопротивление в абсолютных величинах(a) и
процентах(b)
Авторы [13] делают вывод о возможности проведения концентрирования
выжимки красной смородины нанофильтрацией и обратным осмосом, так как
достигается достаточная чистота пермеата. Также авторы отмечают, что при
незначительной разнице в концентрациях, достигаемых NF1 и NF2 эти мембраны дают
большую разницу в производительности, что делает более выгодной NF2. Для
обратного осмоса RO2 значительно лучше как по концентрации концентрата, так и
по производительности.
Статья [14] содержит исследование процессов концентрирования
антиоксидантов, содержащихся в очищенной виноградной мезге, методами ультра- и нанофильтрации.
Таблица
1.4.12
Характеристики мембран
|
Мембрана
|
материал
|
Производитель
|
Pmax, бар
|
Tmax,оС
|
Отсечка по молекуляной массе
|
Производительность по воде, л/м2*ч
|
|
Nanomax95
|
PA/PS
|
Millipore
|
41
|
50
|
250
|
85
|
|
Nanomax 50
|
PA/PS
|
Millipore
|
41
|
50
|
350
|
50
|
|
DL2540
|
TF
|
Osmonics
|
40
|
50
|
150-300
|
95
|
|
GE2540
|
TF
|
Osmonics
|
40
|
50
|
1000
|
-
|
Для всех мембран были оценены зависимости производительности от времени и
давления, а также зависимости селективности от давления.
Чтобы избежать сильного загрязнения мембраны, мезга сначала
центрифугировалась.
На рисунке 1.4.35 отображена зависимость производительности от времени
при различных давлениях. Наибольшее снижение производительности из-за
концентрационной поляризации и загрязнения наблюдалось для керамической
мембраны Inside Ceram и Nanomax 95. Для DL2540 и GE2540 не наблюдалось
изменения, за исключением более низких давлений.
На рисунке 1.4.36 показана зависимость производительности от давления.
Линейная зависимость отмечалась для Nanomax 95и GE2540. Для Inside Ceram и
DL2540 производительность росла линейно только при низких давлениях. В
экспериментах с Nanomax 50 производительность выходила на постоянное значение
при величине давления порядка 7 бар.
Как можно видеть из рисунка 1.4.35, отсечка по молекулярной массе не
имеет значения для производительности, однако ключевую роль несет материал
мембраны. Наибольшая производительность была достигнута с Nanomax 95 (меньший
размер пор), тогда как производительности для GE2540 (отсечка 1000 Да) были
меньше, чем для DL2540, Nanomax 95 и Nanomax 50 (отсечка 150-350 Да). Это
видимое противоречие, как отмечают авторы [14], было найдено ранее при изучении
мембранных процессов разделения растворов, полученных из биомассы, и вероятно
обязано формированию во время процесса очень маленьких частиц (размера тех же
порядков, что и мембранные каналы ультрафильтрационной мембраны), которые
забиваясь в мембранных каналах увеличивали сопротивление потоку. В
нанофильтрации частички будут оставаться вне каналов, не засоряя их, в
результате чего сопротивление потоку будет меньше.
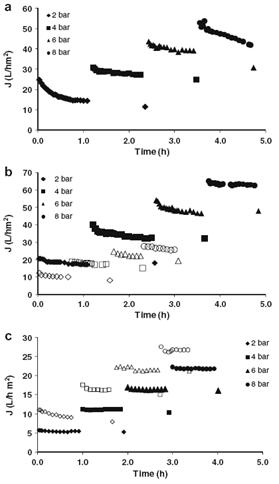
Рисунок 1.4.35 Зависимость производительности от времени: (a)Inside Ceram; (b)Nanomax 50 (бел.), Nanomax 95 (черн.); (c) - DL2540 (бел.) и GE2540 (черн.).
Скорость подачи питания 2 м/с для ультрафильтрационных мембран, 3 м/с для
нанофильтрационных мембран. Температура 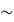 20оС
20оС
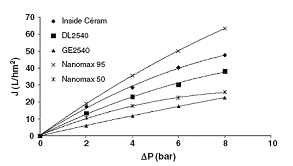
Рисунок 1.4.36 Влияние давления на производительность при скорости подачи
питания 2-3 м/с при 20оС, при полной рециркуляции
Рисунок 1.4.37 показывает влияние давления на селективность мембран. Для
каждой мембраны селективность имела свою зависимость от давления.
Возрастание селективности по твердым веществам и фенольным смолам
наблюдалось для керамической мембраны, почти постоянные величины определялись
для Nanomax 95 и понижение селективности было характерно для DL2540 и GE2540.
Керамическая мембрана обеспечивала наивысшее задерживание по твердым веществам
и фенольным смолам, кроме случая с низким рабочим давлением. Как и ожидалось,
антиоксидантная активность эквивалентная тролоксу в концентратах следует тем же
тенденциям, что и фенольные смолы, что подтверждает пропорциональность данных
параметров.
Эта пропорциональность не обнаружилась бы если фракции или компоненты,
которые исследуются, стали бы прооксидантами в рассматриваемых пределах
концентрации. Более низкое давление приводит к более высокой селективности
антиоксидантов для всех мембран, кроме керамической, которая не показала
зависимости антиоксидантной активности концентрата от давления.
Влияние степени концентрирования на производительность можно увидеть на
рисунке 1.4.38. Видно, что производительность уменьшается с увеличением степени
концентрирования. Такой эффект был прогрессивным для мембран Millipore,
асимптотическим для InsideCeram и DL2540 и почти отсутствовал для
мембраны GE2540, у которой была самая низкая производительность.
Лучше всего сконцентрировали исходный раствор мембраны GE2540 и Inside
Ceram, показав степень концентрирования около 6,5. С мембранами Millipore
степень концентрирования достигалась величины между 5,5 и 6,5.
лекарственный концентрат
нанофильтрация выпаривание
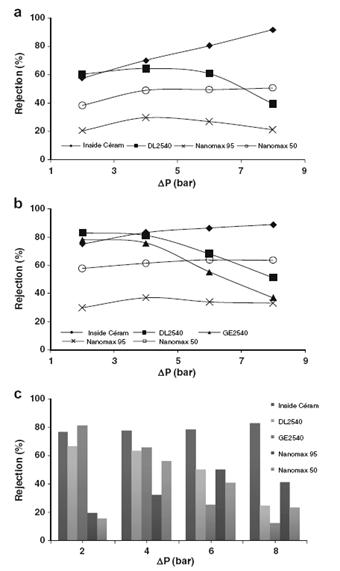
Рисунок 1.4.37 Селективность по (a) - всем твердым веществам (b) - всем фенольным смолам (c) - антиоксидантной активности эквивалентной тролоксу в
режиме полной рециркуляции

Рисунок 1.4.38 Влияние степени концентрирования на производительность
Тем не менее, при этом не достигалось устойчивой производительности. В
этих экспериментах достигались сравнительно высокие величины производительности
в конце опыта, что показывает, что вероятно с обеими мембранами можно было бы
работать дальше, достигая постоянной производительности.
Наблюдаемая селективность 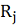 по общим фенольным смолам и сахарам была рассчитана для
экспериментов при давлении, предварительно установленном для достижения степени
концентрирования 5,5 - 6,5 (рисунок 1.4.39).
по общим фенольным смолам и сахарам была рассчитана для
экспериментов при давлении, предварительно установленном для достижения степени
концентрирования 5,5 - 6,5 (рисунок 1.4.39).

Рисунок 1.4.39 Селективность по общим фенольным смолам (a) и общим сахарам (b)
Работая в режиме концентрирования различные отрезки времени, в которые
объем концентрата изменяется от 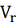 до
до 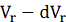 , а объем перемеата
, а объем перемеата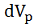 , численно равный объему
, численно равный объему 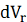 , проникает через мембрану, и
рассматривая концентрации пермеата и концентрата как
, проникает через мембрану, и
рассматривая концентрации пермеата и концентрата как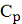 и
и 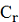 соответственно, материальный баланс
может быть выражен как:
соответственно, материальный баланс
может быть выражен как:
 (2.4.9)
(2.4.9)
С другой стороны, 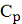 может быть выражена как функция концентрации
может быть выражена как функция концентрации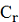 через уравнение (2.4.10):
через уравнение (2.4.10):
 (2.4.10)
(2.4.10)
Принимая, что селективность независима от концентрации концентрата,
получаем:
 (2.4.11)
(2.4.11)
Где 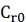 и
и 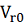 концентрация и объем питания, а
концентрация и объем питания, а 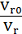 - степень концентрирования. Как
говорилось раньше, предполагается, что
- степень концентрирования. Как
говорилось раньше, предполагается, что 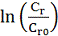 будет линейно зависеть от
будет линейно зависеть от 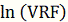 , а селективность соответственно
будет углом наклона кривой.
, а селективность соответственно
будет углом наклона кривой.
Химический состав концентратов, полученных на разных мембранах при
степени концентрирования 5,5 - 6,5 отражен в таблице 2.4.13. Как видно, общее
содержание фенольных смол возросло от 3 до 6 раз.
Таблица
1.4.13
Характеристика концентратов, полученных на исследуемых мембранах
|
Мембрана
|
Общие твердые вещества, г/100г
|
Общие фенольные смолы, мг GAE/мл
|
Общие сахара, мг/мл
|
TAEC, моль тролокса
|
DPPHEC50, г экстракта/мл
|
DPPH EC50, г GAE/мл
|
|
Исходное число
|
0.222
|
0.173
|
0.27
|
3.42
|
|
0.112
|
|
Nanomax 95
|
1.410 0.019 0.019
|
1.090 0.0002 0.0002
|
2.09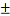 0.02 0.02
|
19.6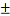 0.173 0.173
|
1.14
|
0.155
|
|
Nanomax 50
|
0.990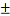 0.011 0.011
|
0.842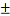 0.003 0.003
|
1.19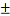 0.019 0.019
|
22.5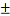 0.074 0.074
|
1.37
|
0.198
|
|
DL2540
|
0.698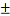 0.009 0.009
|
0.940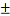 0.002 0.002
|
0.89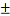 0.009 0.009
|
18.0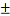 0.450 0.450
|
1.52
|
0.103
|
|
GE2540
|
0.659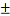 0.019 0.019
|
0.615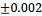
|
0.45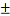 0.004 0.004
|
12.1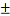 0.750 0.750
|
1.96
|
0.127
|
|
Inside Ceram
|
0.786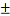 0.020 0.020
|
0.867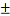 0.006 0.006
|
1.35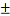 0.040 0.040
|
19.6 0.173 0.173
|
0.88
|
0.100
|
Загрязнение всех мембран, кроме керамической, привело к незначительному
понижению производительности после нескольких циклов промывки. Керамическая
мембрана после регенерации полностью восстановила свои свойства.
Российские ученые также применяли нанофильтрацию для концентрирования
растительного сырья. В работе [15] автор рассматривала процесс концентрирования
экстрактов шалфея лекарственного методом нанофильтрации.
Автор [15]отдает предпочтение мембранной технологии, так как она
позволяет концентрировать растительные экстракты в условиях низких температур,
что обеспечивает максимальное сохранение исходных свойств природных
компонентов. Для концентрирования водных экстрактов S. officinalis был
использован метод нанофильтрации с использованием мембран с минимальным
размером пор 5-10 A (0,5-1 нм) (установка ROCS-5, Россия). В [15] было
исследовано влияние величины давления на степень концентрирования экстракта S.
officinalis, полученного методом батарейного экстрагирования. Для этой цели
определяли массу, плотность и массовую долю растворимых сухих веществ в
оставшемся концентрате в зависимости от прилагаемого давления 4,7; 5,2 и 5,3
кг/см2 (таблица 2.4.14)
Таблица
1.4.14
Влияние величины прилагаемого давления на степень концентрирования
экстракта корней S. officinalis при нанофильтрации
|
Давление, кг/см2
|
Масса, г
|
Плотность, кг/м3
|
Массовая доля растворимых сухих веществ. %
|
|
Исходный экстракт
|
|
1350
|
1032
|
9,0
|
|
Фильтрат1
|
4,689
|
250
|
999
|
0
|
|
Концентрат1
|
4,689
|
1100
|
1038
|
10,0
|
|
Фильтрат2
|
5,199
|
1120
|
998
|
0
|
|
Концентрат2
|
5,199
|
230
|
1100
|
26,0
|
|
Фильтрат3
|
5,301
|
1230
|
998
|
0
|
|
Концентрат3
|
5,301
|
120
|
1219
|
50,0
|
Установлено, что концентрирование при давлении 5,2 кг/см2 в
течение 62 мин приводит к получению концентрата с массовой долей растворимых
сухих веществ 26%, в то время, как увеличение давления до 5,3 кг/см2
при той же продолжительности процесса позволяет сконцентрировать экстракт до
массовой доли растворимых сухих веществ почти 50%.
Однако, концентрированные экстракты корней S. officinalis имели высокую
плотность и вязкость, причем значительное увеличение этих параметров
наблюдалось при содержании массовой доли растворимых сухих веществ -30%. В
связи с этим, концентрирование экстрактов свыше 30% нецелесообразно из-за
технологических проблем, возникающих в промышленных условиях при использовании
высоковязких растворов.
Как отметила автор [15], концентрирование с помощью метода нанофильтрации
позволило полностью сохранить функциональные свойства экстрактов, в отличие от
концентратов, полученных методом упаривания. Так, концентрат, полученный
методом упаривания, имел более низкие показатели пенообразующей способности и
эмульгирующей емкости (способности связывать масло) по сравнению с концентратом,
полученным методом нанофильтрации, или свежеприготовленным экстрактом корней,
при сохранении параметров устойчивости эмульсии на прежнем уровне (таблица
1.4.15). Для сравнения функциональных свойств концентраты разбавляли до
массовой доли растворимых сухих веществ 5%.
Таблица
1.4.15
Сравнительная характеристика функциональных свойств экстрактов S.
officinalis, концентрированных различными методами
|
Экстракт 5%
|
Пс, %
|
ТИ, мл
|
Эс
|
Уэ, %
|
|
Свежеприготовленный
|
500
|
100
|
138
|
17,3
|
100
|
|
Методом нанофильтрации
|
500
|
100
|
138
|
17,3
|
100
|
|
Методом выпаривания
|
380
|
97,4
|
112
|
14,0
|
100
|
Автор [15] делает вывод, что Результаты исследований свидетельствуют о
принципиальной возможности использования нанофильтрации для концентрирования
разбавленных экстрактов S. оfficinalis, с целью максимального сохранения их
исходных функциональных свойств.
Изучению процесса концентрирования экстракта прополиса нанофильтрацией
посвящена статья [16]. Основными компонентами, селективность по которым
определялась в статье, были флавоны, флавонолы, флаваноны и дигидрофлаваноны.
Как один из методов концентрирования экстракта авторы рассматривают
лиофилизацию, отмечая, что ее основными недостатками по сравнению с
нанофильтрацией являются высокие затраты энергии и необходимость долгого выдерживания
экстракта при температуре порядка 70оС.
Характеристики мембран, использованных в исследовании отображены в
таблице 1.4.16
Таблица
1.4.16
Характеристика мембран
|
Мембрана
|
StarmemTM 122
|
DURAMEMTM 200
|
|
Материал
|
Полиимид
|
Модифицированный полиимид
|
|
Тип мембраны
|
Листовая плоская
|
Листовая плоская
|
|
Максимальное давление
|
60 бар
|
60 бар
|
|
Максимальная температура
|
50оС
|
50оС
|
|
Производительность по толуолу при 55 бар
|
30 л/м2ч
|
-
|
|
Отсечка по молекулярной массе
|
220 Да
|
200 Да
|
|
Устойчивость к растворителям
|
Спирты, алканы, ароматические соединения, эфиры, кетоны
|
Спирты, алканы, ароматические соединения, эфиры, кетоны
|
Экспериментальная установка работает в режиме тупиковой фильтрации. Схема
установки представлена на рисунке 1.4.40.

Рисунок 1.4.40 Экспериментальная установка: 1 - регулятор давления, 2 -
магнитная мешалка, 3 - нанофильтрационная ячейка METcell, 4 - мерный цилиндр
Давление нагнеталось сжатым азотом чистотой 99,996%. Частота перемешивания
поддерживалась постоянной - 350 оборотов в минуту, чтобы уменьшить величину
концентрационной поляризации.
Распределение частиц экстракта прополиса (пиноцембрин и галангин) по
размеру дано на рисунке 1.4.41. Как видно, размеры колеблются в пределах от 10
до 80 микрометров. 90% - 15-52 микрометра. Размер агломератов составлял порядка
344 микрометров.
Результаты измерения концентрации в исходном растворе флавонов,
флавонолов, флаванонов и дигидрофлаванонов, а также фенольных веществ,
экстрагированных из прополиса, даны в таблице 1.4.17
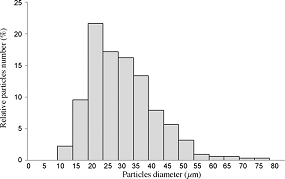
Рисунок 1.4.41 Распределение частиц пиноцембрина-галангина (2:1) по
размеру
Таблица
1.4.17
Количественный анализ экстрактов прополиса, полученных нанофильтрацией
|
Мембрана
|
Приложенное давление, бар
|
Компонент
|
Сf, мг/мл
|
Сp, мг/мл
|
R, %
|
Сr, мг/мл
|
|
StarmemTM 122
|
30
|
Флавоны и флавонолы
|
2.99
|
0.284
|
90
|
9.29
|
|
|
|
Флаваноны и дигидрофлаваноны
|
5.12
|
0.596
|
88
|
15.7
|
|
|
|
Общие фенолы
|
19.9
|
2.41
|
88
|
60.6
|
|
|
50
|
Флавоны и флавонолы
|
2.99
|
0.245
|
92
|
9.38
|
|
|
|
Флаваноны и дигидрофлаваноны
|
5.12
|
0.552
|
89
|
15.8
|
|
|
|
Общие фенолы
|
19.9
|
2.20
|
89
|
61.1
|
|
DURAMEMTM 200
|
30
|
Флавоны и флавонолы
|
2.99
|
0.070
|
97
|
9.79
|
|
|
Флаваноны и дигидрофлаваноны
|
5.12
|
0.248
|
95
|
16.5
|
|
|
Общие фенолы
|
19.9
|
1.02
|
95
|
63.8
|
|
50
|
Флавоны и флавонолы
|
2.99
|
0.089
|
97
|
9.75
|
|
|
Флаваноны и дигидрофлаваноны
|
5.12
|
0.228
|
95
|
16.5
|
|
|
Общие фенолы
|
19.9
|
1.16
|
95
|
65.8
|
В таблице 1.4.17 величины концетрации в исходном растворе и пермеате
измерены спектрофотометрией. Концентрация концентрата вычислена из
материального баланса.
Таблица
1.4.18
Производительность и коэффициент проницаемости через мембрану, уменьшение
толщины активного слоя после нанофильтрации
|
Мембрана
|
Приложенное давление, бар
|
Jp, л/м2ч
|
Толщина активного слоя до нано-фильтрации, мкм
|
Толщина активного слоя после нано-фильтрации, мкм
|
Коэффициент проницаемости, *106, л/м*ч*бар
|
|
StarmemTM 122
|
30
|
1,70
|
38
|
26
|
1,5
|
|
|
50
|
2,05
|
|
|
1,1
|
|
DURAMEMTM 200
|
30
|
2,66
|
72
|
70
|
6,2
|
|
50
|
4,05
|
|
|
5,7
|
Обе использованные в исследовании [16] мембраны показали очень хорошую
селективность. Лишь около 11% флавоноидов и 12% всех фенольных компонентов
прошли через активный мембраны StarmemTM 122.Для мембраны DURAMEMTM 200 эти величины еще меньше: 3% и 5% соответственно.
Это может быть объяснено как минимум тремя причинами:
) Молекулярная отсечка мембраны DURAMEMTM 200 на 20 Да меньше. Таким образом органические
компоненты с молекулярной массой от 200 до 220 Да будут задержаны только DURAMEMTM 200.
2) DURAMEMTM 200 в отличие от StarmemTM 122 изготовлена из модифицированного
полиимида (перекрестно-плетеного). Соответственно, механизм транспорта
органических веществ через активный слой мембран будет различен благодаря
взаимодействию мембрана-растворитель.
) Сравнивая результаты из таблиц 1.4.17 и 1.4.18, как и
микроснимки поперечного сечения мембран до и после нанофильтрации (рисунки
1.4.42 и 1.4.43), кажется вполне вероятным, что DURAMEMTM 200 (рисунок 1.4.43) более
устойчива, чем StarmemTM 122 (рисунок 2.4.42). После нанофильтрации на StarmemTM 122 обнаруживается более чем 30%
снижение толщины актиного слоя мембраны, чего не наблюдается со второй
мембраной. Это тоже может влиять на селективность.

Рисунок1.4.42 Микроснимки поперечного сечения мембраны Starmem 122 после
обраюотки жидким азотом: (а) - до нанофильтрации, (b) - после нанофильтрации

Рисунок 1.4.43 Микроснимки поперечного сечения мембраныDuramem 200 после
обраюотки жидким азотом: (а) - до нанофильтрации, (b) - после нанофильтрации
Кроме того, результаты из таблицы 1.4.17 показывают, что с увеличением
давления от 30 до 50 бар селективность StarmemTM 122 возрастает
незначительно. Совмещенный эффект повышения давления и уменьшения толщины
активного слоя могут изменять величину отсечки по молекулярной массе.
То что с увеличением давления мембрана Duramem устойчива, влияет на
возрастание производительности с давлением. Проницаемость, как фидно из таблицы
2.4.18 остается постоянной в случае DURAMEMTM 200, тогда как для StarmemTM 122 с
увеличением давления уменьшается.
На микроснимках поверхности мембран до и после нанофильтрации (рисунок
1.4.44 и 1.4.45) хорошо видно, что гладкая поверхность покрывается
загрязнением, что влияет на срок использования мембраны и делает необходимым
принятие мер для предотвращения образования слоя гелевой поляризации.
Авторы [16] приходят к выводу, что для медицинских и фармакологических
целей вероятно подойдет использование режима перекрестного потока (cross-flow).

Рисунок 1.4.44 Микроснимки поверхности мембраны Starmem 122 после обработки жидким азотом: (а) - до
нанофильтрации, (b) - после нанофильтрации

Рисунок 1.4.45 Микроснимки поверхности мембраны Duramem 200 после обработки жидким азотом: (а) - до
нанофильтрации, (b) - после нанофильтрации
Выводы
На основании изученной литературы можно сделать следующие выводы о целях
и задачах, ставимых в данной исследовательской работе:
) На основании эксперимента выбрать метод мембранного разделения, который
будет наиболее эффективен для концентрирования объекта.
2) Получить массив экспериментальных данных для оценки влияния
различных параметров на характеристики процесса разделения.
) Проанализировать полученные зависимости и сделать
соответствующие выводы о протекании процесса.
) Обозначить и обосновать пределы проведения процесса, оптимальные
величины исследованных параметров.
) Сделать вывод о применимости нанофильтрации для концентрирования
объекта.
2.
Методическая часть
.1 Выбор
мембраны
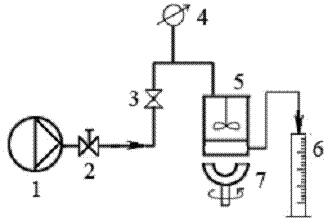
Рисунок 2.1.1 Схема процесса концентрирования экстрактов. 1 -
компрессор,2 - редуктор,3 - регулирующий вентиль, 4 - манометр, 5 - мембранная
ячейка, 6 - мерный цилиндр на 10 мл, 7 - магнитная мешалка
Таблица 2.1.1
Характеристики мембран
|
Мембрана
|
Произво-дитель
|
Материал
|
Рабочее давление, МПа
|
Селективность по 0,2% MgSO4/0,5% NaCl
|
Отсечка по молекулярной массе, 97%
|
Производительность по чистой воде, л/м2*ч*ат
|
Диапа-зон рабочих рН
|
|
УПМ-10
|
Владипор
|
Полисульфонамид
|
0,1
|
--
|
64500
|
15
|
2-12
|
|
УПМ-30
|
Владипор
|
Полисульфонамид
|
0,1
|
--
|
64500
|
60
|
2-12
|
|
УФМ-50
|
Владипор
|
Фторопласт
|
0,1
|
--
|
64500
|
250
|
2-8
|
|
ОПМН-К
|
Владипор
|
Полиамид
|
1,6
|
98.5/--
|
--
|
6,25
|
2-12
|
|
ОПМН-КМ
|
Владипор
|
полиамид
|
1,6
|
98.5/--
|
--
|
6,25
|
2-12
|
|
МГА-70
|
Владипор
|
Ацетатцеллюлозы
|
5,0
|
--/70
|
--
|
1,84
|
3-8
|
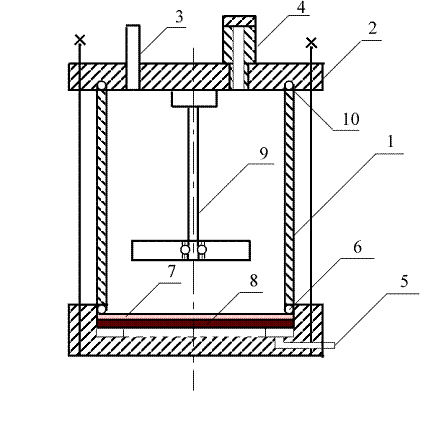
Рисунок 2.1.1 Мембранная ячейка. 1 - корпус, 2 - крышка, 3 - трубка для
подачи воздуха под давлением, 4 - клапан регулирования давления, 5 - трубка для
вывода пермеата, 6, 10 - уплотнительные кольца, 7 - мембрана, 8 - дренаж, 9 -
магнитная мешалка
Для проведения эксперимента были взяты пять мембран: ультрафильтрационные
- УПМ-10, УПМ-30, УФМ-50; и нанофильтрационные - ОПМН-К, ОПМН-КМ.
Перед проведением эксперимента экстракты были очищены от взвешенных
частиц микрофильтрацией на мембранах с размером пор 5 мкм.
Перед проведением эксперимента необходимо смочить мембрану
дистиллированной водой.
) Предохранительный клапан (позиция 4 на рисунке 2.1.2) отвинчивается
2) В отверстие для предохранительного клапана вливается жидкость,
исследование которой необходимо провести.
) Предохранительный клапан возвращается на место.
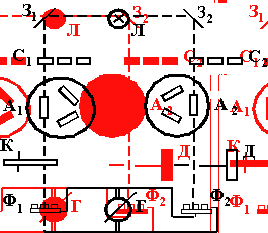
) Включается магнитная мешалка (рисунок 2.1.1), регулируется число
оборотов.
) Через трубку (позиция 3 на рисунке 2.1.2) компрессором (рисунок
2.1.1) подается воздух. Вентилем (рисунок 2.1.1) регулируют давление. Отмечают
давление, показываемое манометром (рисунок 2.1.1).
) Через трубку (позиция 5 на рисунке 2.1.2) сливают образец
пермеата в мерный цилиндр (рисунок 3.1.1).
) Предохранительным клапаном сбрасывают давление.
) Жидкость сливают, ячейку тщательно промывают дистиллированной
водой.
Каждый образец пермеата исследуется на ФЭК:
) В правый световой пучок помещают кювету с исследуемым раствором, в
левый - кювету с растворителем.
2) Направляют пучок света через кювету с растворителем.
3) Устанавливают показания гальванометра на 0.
4) Направляют пучок света через кювету с исследуемым раствором.
5) Фиксируют показания прибора.
6) После проведения опыта кюветы промывают дистиллированной водой.
2.2
Методика проведения исследования процесса концентрирования экстрактов

Рисунок 2.2.1 Схема процесса концентрирования: 1 - емкость с исходным
экстрактом, 2 - насос, 3 - нанофильтрационный аппарат, 4- манометр, 5 -
ротаметр, 12 - регулирующий вентиль, 6-11 - вентиль запорный, 13 - емкость для
регенерации
Величина давления ограничена возможностями насоса и составляет 7 ати.В
качестве модуля в экспериментальной установке выбираем нанофильтрационныйрулонный
модуль с элементом DesalHL1812T
) Исходный раствор насосом (рисунок 2.2.1) подается из емкости (рисунок
2.2.1) в мембранный аппарат (рисунок 2.2.1) с нанофильтрационным модулем.
Вентилем 12 (рисунок 2.2.1) регулируют давление. Давление фиксируют на манометре
(рисунок 2.2.1). Вентили 7,9,11 закрыты.
2) Расход пермеата измеряется ротаметром (рисунок 2.2.1).Каждые
полчаса измеряют производительность и берут образцы пермеата.
) Концентрат возвращают в исходную емкость.
) Во время регенерации перекрываются вентили 6,8,10. Вентили
7,9,11 открыты, реагент подается из емкости 13.
.3
Методика проведения измерений концентрации пермеата на приборе Specord
Для оценки относительной концентрации пермеата был использован прибор
Specord UV-VIS. Методика работы с этим прибором описана далее:
1. Установить и подключить мультиметр к спектрографу. Для этого два
черных штекера закрепленных с тыльной стороны спектрографа подключить в гнезда
на нижней части мультиметра COM и V/Ω (рис. 2.3.1 поз. 5).
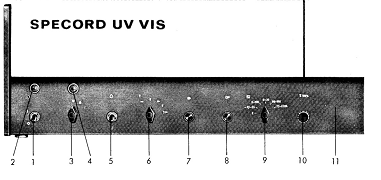
Рисунок 2.3.1 Рабочая панель прибора SpecordUV-VIS
2. Соединить ПК с мультиметром при помощи специального кабеля. Для
этого пятиигольчатый конец кабеля подключить к порту мультиметра RS232C (рис.2.3.1 поз. 4). Другой конец кабеля соединить с
универсальным последовательным COM-портом
ПК.
3. Включить ПК и запустить программу для записи показаний прибора.
(Данное программное обеспечение прилагается к мультиметру, либо может быть
найдено через интернет-ресурсы)
. Открыть файл для обработки данных в MicrosoftExcel “Отчет_Specord.xls”
. Включить мультиметр (рис.2.3.1 поз.1)
. С помощью переключателя (рис.2.3.1 поз.6) установить режим
измерения Ω (рис.2.3.1 поз.2)
. С помощью кнопки выбора диапазона измерений (рис.3.3.1 поз.3)
выбрать режим, при котором на экране, индикация будет соответствовать виду: 000
а единицы измерений: кΩ
8. Включить вилку прибора Specord в сеть ~220 В.
9. Поместить в кюветное отделение кюветы с фоновым раствором.
10. Включить тумблер (рис.2.3.1 поз.1) в положение «I». При этом должна загореться лампа
(рис.2.3.1 поз.2), свидетельствующая о подаче напряжения на схемы прибора.
11. Если необходимо проводить измерения в видимом диапазоне спектра
400-750 нм - включить тумблер (рис.2.3.1 поз.5).
. Если необходимо проводить измерения в ультрафиолетовом диапазоне
- повернуть переключатель (рис.2.3.1 поз.3) в среднее положение и подождать
пять-десять секунд, затем повернуть переключатель в положение «I». Сигнальная лампа (рис.2.3.1 поз.4)
свидетельствует об успешном зажигании дейтериевой лампы. Если лампа не
загорелась - повторить этот пункт методики с начала. При этом необходимо
использовать кюветы, изготовленные из кварца - 2 из их стенок имеют матовую
поверхность.
13. Выставить необходимое волновое число при помощи переключателя
(рис.2.3.1 поз.6). В положении «►» происходит быстрая прокрутка спектра
от больших волновых чисел к меньшим. Если необходимо передвинуть начальную
точку измерения в обратную сторону - повернуть переключатель (рис.2.3.1 поз.6)
в положение «ξ◄». Откорректировать волновое число поворотом верхней дальней
шестеренки на правом торце прибора. Нажимая на кнопку, расположенную рядом с
планшетом самописца, передвинуть планшет так, чтобы начальная точка измерений
была на левом краю координатной бумаги. Отпустить кнопку и пошевелить планшет
до его жесткой фиксации. Занести начальное значение волнового числа в ячейку n0,
см-1
14. Зафиксировать линию полного
поглощения. Для этого перекрыть ход лучей прибора непрозрачным предметом.
Закрыть кюветное отделение. Занести показания мультиметра в ячейку MSExcel: 0% пропускания, кОм
15. Отмасштабировать ординату - для этого перевести переключатель
режимов (рис.2.3.1 поз.9) в положение «0-100». Вращая ручку реостата (рис.2.3.1
поз.10), установить желаемое положение линии 100%-го пропускания, но не более:
950кΩ по показанию (мультиметра). Занести показания мультиметра в ячейку MSExcel: 100%пропускания, кОм
. Заполнить ближнюю кювету исследуемым образцом.
. Закрыть кюветное отделение. В расчетном модуле “Отчет_Specord.xls” внести маркировку образца в соответствующую ячейку,
в программе нажать на кнопку старт, одновременно повернув переключатель на
спектрографе (рис.3.3.1 поз.6) в положение «ξ◄», при этом начнется регистрация
показаний.
. Сняв желаемую часть спектра, в программе нажать на кнопку стоп,
а на спектрографе вернуть переключатель (рис.3.3.1 поз.6) в положение «0». Для
удобства обработки результатов, можно занести в таблицу отчета диапазон
порядковых номеров измерений из программы в соответствующую ячейку отчета N1-N2 для
этого образца.
. При необходимости, повторить действия по регистрации спектра
другого образца, повторив пункты 17-19 настоящей методики, предварительно
выставив начальное волновое число по пункту 14. НЕОБХОДИМО УСТАНАВЛИВАТЬ ОДНО И
ТО ЖЕ ВОЛНОВОЕ ЧИСЛО В КАЖДОЙ СЕРИИ ИЗМЕРЕНИЙ, что связано с обработкой данных.
. При длительных простоях (10-15 мин) ОБЯЗАТЕЛЬНО ВЫКЛЮЧИТЬ ЛАМПЫ
ПРИБОРА И МУЛЬТИМЕТР.
. После окончания экспериментальной части, в окне ПО мультиметра
нажать иконку X, при этом
происходит экспорт данных в формат CSV. В диалоге сохранения введите желаемое имя файла.
. Открыть экпортированные данные и программу расчета «Отчет_Specord». Если файл с экспортированными
данными автоматически не распределил их по колонкам, то проделать следующие
шаги :
- выделить весь столбец данных (А) с экспортированными данными;
открыть на панели управления вкладку «Данные», выбрать формат данных «с
разделителем», нажать «Далее»;
в качестве разделителя выбрать «запятая», нажать кнопку «Далее»
. После разбивки данных по столбцам, выделить столбцы А-Е, скопировать и
вставить их в те же самые столбцы расчетного модуля «Отчет_Specord».
25. Согласно времени проведения измерений из столбца Е (или согласно
записанным диапазонам точек измерения) данные из столбца С со значениями
сопротивления скопировать в соответствующие образцам столбцы таблицы (I, M, O, Q, S, U, W) предварительно очистив их от старых
значений.
26. Выровнять диапазоны значений поглощения соразмерно диапазону
сопротивления для каждого образца, протянув или удалив лишнее в столбце
поглощений.
. В результате на графике расчетного модуля появятся кривые
пропускания образцов. Точное положение минимума пропускания можно установить
либо по координатной сетке, либо наведя курсор на минимум линии пропускания,
при этом рядом с ним высветится ближайшее значение длины волны из расчетной
таблицы. По соответствующей этой длине волны строке таблицы можно посмотреть
значения пропускания.
Примечания:
1) При необходимости - выставить желаемый диапазон измерений
светопропускания поворотом переключателя режимов (рис. 2 поз. 9). При этом
поменять значения границ измерений в отчете, изменив значения ячеек нижняя,
%верхняя, %
2) Пример определения волнового числа.
Слева от индексного штриха «0» нониуса находится деление для волнового
числа 40.2∙103 см-1 = 40 200 см-1 . Цену
расстояния между этим делением шкалы и неподвижным индексом можно определить,
найдя тот штрих нониуса, который точнее всего совпадает с одним из делений
шкалы волновых чисел. В случае данного примера это относится к штриху «1,2» нониуса,
соответствующему приращению на 120 см-1. Итого, текущее значение
волнового числа составляет 40 320 см-1.
Пересчет в длину волны производится по формуле :
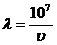
где λ- длина волны излучения, нм.; υ - волновое число, см-1.
) Таблица соответствия волновых чисел длинам волн находится на листе
«Таблица соответствия» файла-отчета.
3.
Экспериментальная часть
.1
Характеристики мембран. Выбор мембраны
Таблица 3.1.1
Данные о производительности мембран в зависимости от давления
|
мембрана
|
ΔP,ат
|
 ,мл ,мл
|
τ, с
|
Jv(H2O), л/м2*ч
|
|
УПМ-10
|
3,25
|
5
|
269
|
24,48
|
|
|
2,10
|
5
|
396
|
16,63
|
|
|
1,80
|
3
|
272
|
14,53
|
|
УПМ-30
|
3,40
|
5
|
61
|
107,93
|
|
|
1,95
|
5
|
110
|
59,85
|
|
|
1,45
|
5
|
140
|
47,03
|
|
УФМ-50
|
3,35
|
5
|
8
|
822,97
|
|
|
2,00
|
14
|
420,27
|
|
|
1,20
|
5
|
21
|
313,51
|
|
ОПМН-К
|
3,35
|
5
|
420
|
15,68
|
|
|
2,00
|
5
|
730
|
9,02
|
|
|
1,55
|
3
|
530
|
7,45
|
|
ОПМН-КМ
|
3,35
|
5
|
305
|
21,59
|
|
|
1,95
|
5
|
630
|
10,45
|
|
|
1,50
|
5
|
823
|
8,00
|
Таблица 3.1.2
Производительность исследуемых мембран по экстракту при ΔР = 3,35ат
|
мембрана
|
 ,мл ,мл
|
τ, с
|
Jv, л/м2*ч
|
|
УПМ-10
|
3
|
510
|
7,75
|
|
УПМ-30
|
5
|
234
|
28,14
|
|
УФМ-50
|
5
|
255
|
25,82
|
|
ОПМН-К
|
3
|
3040
|
1,30
|
|
ОПМН-КМ
|
3
|
5595
|
0,706
|
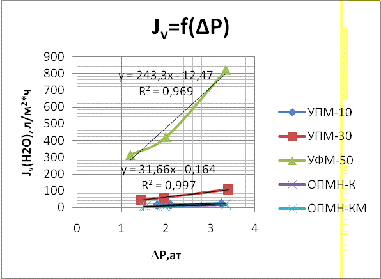
а)

б)
Рисунок
4.1.4 Производительность мембран (л/м2*ч) по дистиллированой воде в
зависимости от давления (ат), а - УПМ-10,УПМ-30, УФМ-50, ОПМН-К, ОПМН-КМ; б
(укрупненный масштаб) - УПМ-10, ОПМН-К, ОПМН-КМ
Таблица 3.1.3
Измерения оптической плотности на ФЭК при λ=670 для разбавлений исходного экстракта
Юглон-П в 4, 6, 8, 10, 12, 15, 20, 50 и 100 раз
|
разбавл
|
4
|
|
разбавл
|
6
|
|
T
|
13
|
13
|
13
|
|
T
|
21,5
|
21,5
|
21,5
|
|
D
|
0,9
|
0,9
|
0,9
|
|
D
|
0,58
|
0,58
|
0,58
|
|
|
разбавл
|
8
|
|
разбавл
|
10
|
|
T
|
36,5
|
36,5
|
36,5
|
|
T
|
45
|
45
|
45
|
|
D
|
0,445
|
0,445
|
0,445
|
|
D
|
0,35
|
0,35
|
0,35
|
|
|
разбавл
|
12
|
|
разбавл
|
15
|
|
T
|
51
|
51
|
51
|
|
T
|
61
|
61
|
61
|
|
D
|
0,03
|
0,03
|
0,03
|
|
D
|
0,22
|
0,22
|
0,22
|
|
|
разбавл
|
20
|
|
разбавл
|
50
|
|
T
|
66
|
66
|
66
|
|
T
|
82,5
|
82,5
|
82,5
|
|
D
|
0,185
|
0,185
|
0,185
|
|
D
|
0,085
|
0,085
|
0,085
|
|
|
разбавл
|
100
|
|
|
T
|
90
|
90
|
90
|
|
|
D
|
0,045
|
0,045
|
0,045
|
|
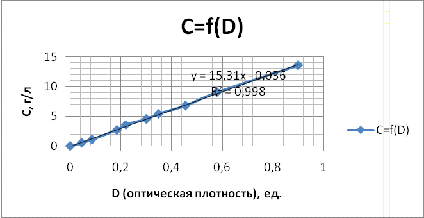
Рисунок
3.1.5 Калибровочная кривая для определениия концентрации сухого вещества (г/л)
в пермеате Юглона-П
Таблица 3.1.4
Концентрация пермеата
|
мембрана
|
|
C, г/л
|
|
УПМ-10
|
0,85
|
12,8
|
|
УПМ-30
|
0,65
|
10,2
|
|
УФМ-50
|
0,7
|
10,8
|
|
ОПМН-К
|
0,01
|
0,2
|
|
ОПМН-КМ
|
0,042
|
0,4
|
3.2
Зависимость производительности по экстракту от давления и от времени
В качестве модуля в экспериментальной установке выбираем
нанофильтрационный рулонный модуль с мембраной Desal HL1812T
Таблица 3.2.1
Зависимость производительности по воде от давления
|
ΔР, ат
|
Jv, л/м2*ч(до проведения
опыта)
|
ΔР, ат
|
Jv, л/м2*ч(после
проведения опыта)
|
|
2,4
|
18,90
|
2,1
|
12,90
|
|
3,2
|
25,02
|
4,1
|
23,63
|
|
6,2
|
44,78
|
6,0
|
32,73
|
Таблица 3.2.2
Зависимость производительности по экстракту Юглон-П от давления
|
ΔР, ат
|
Jv, л/м2*ч
|
|
4,0
|
0,47
|
|
5,0
|
1,23
|
|
6,5
|
2,17
|
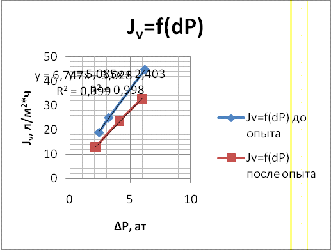
Рисунок 3.2.1 Зависимость удельной производительности (л/м2ч)
по воде от давления (ат)
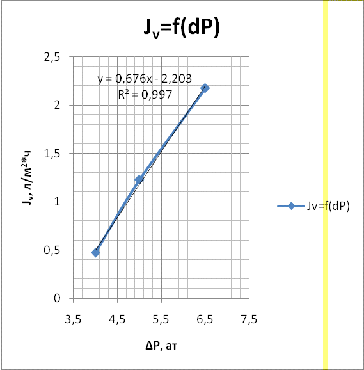
Рисунок 3.2.2Зависимость удельной производительности (л/м2ч)
по экстракту Юглон-П от давления (ат)
Таблица 3.2.3
Зависимость производительности по экстракту Югло-осин от давления
|
ΔР, ат
|
Jv, л/м2*ч
|
|
4,0
|
3,03
|
|
5,4
|
4,73
|
|
6,5
|
5,79
|
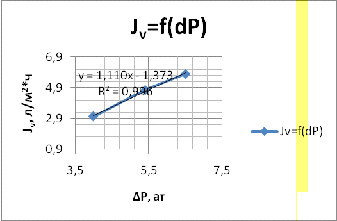
Рисунок 3.2.3 Зависимость производительности по экстракту Югло-осин(л/м2ч)от
давления (ат)
Таблица 3.2.3
Зависимость производительности по экстракту Юглон-П от времени при ΔР = 7 ат
|
τ, мин
|
Q, л/ ч
|
|
0
|
5,14
|
|
28
|
3,91
|
|
58
|
3,13
|
|
88
|
2,35
|
|
118
|
1,90
|

Рисунок
3.6.3 Зависимость производительности (л/м2ч) по экстракту Юглон-П от
времени (мин) при ΔР = 7 ат
Таблица 3.2.4
Зависимость производительности по экстракту Югло-осин от времени при ΔР = 7 ат
|
τ, мин
|
Q, л/ ч
|
|
0
|
5,48
|
|
10
|
4,99
|
|
29
|
4,32
|
|
43
|
3,71
|
|
62
|
3,05
|
|
102
|
1,84
|
|
218
|
0,43
|
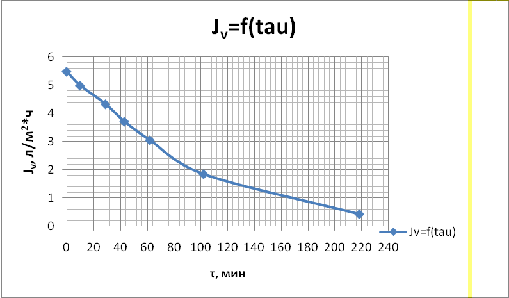
Рисунок
3.7.4 Зависимость производительности (л/м2ч)по экстракту Югло-осин
от времени (мин) при ΔР = 7 ат
3.3
Зависимость производительности от относительной концентрации
Под относительной концентрацией понимаем отношение концентрации
концентрата к исходной концентрации:
Содержание сухих веществ в концентрате определялось по материальному
балансу через концентрацию пермеата, которая в свою очередь была определена на
приборе Specord UV VIS.
По высотам пиков (светопропускание) в программном обеспечении Specord для
растворов известной концентрации построены калибровочные графики.
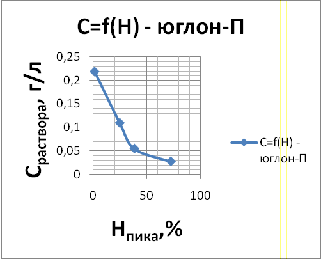
Рисунок 3.3.1 Калибровочный график пересчета высоты пика (%) в концентрацию
пермеата Юглона-П (г/л)

Рисунок 3.3.2 Калибровочный график пересчета высоты пика (%) в
концентрацию пермеата Югло-осина (г/л)
Отсюда:
Таблица 3.3.1
Соответствие концентраций пермеата Юглон-П высотам пиков
|
Hпика, %
|
49,153
|
44,972
|
23,616
|
7,119
|
|
Сперм, г/л
|
0,065
|
0,075
|
0,13
|
0,19
|
Таблица 3.3.2
Соответствие концентраций пермеата Югло-осин высотам пиков
|
Hпика, %
|
17,319
|
16,963
|
16,607
|
15,777
|
14,591
|
|
Сперм, г/л
|
0,24
|
0,25
|
0,27
|
0,29
|
0,31
|
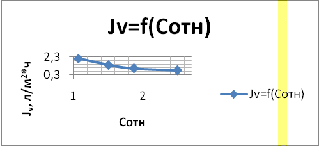
Рисунок 3.3.1 Зависимость производительности по экстракту Юглон-П (л/м2ч)от
относительной концентрации, ΔР = 7 ат
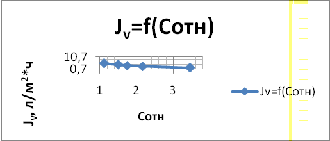
Рисунок 3.3.2 Зависимость производительности по экстракту Югло-осин(л/м2ч)от
относительной концентрации,ΔР = 7 ат
3.4
Зависимость содержания сухого вещества в перемеате от степени концентрирования

Рисунок 3.4.1 Зависимость концентрации пермеата Юглона-П (г/л) от степени
концентрирования, ΔР = 7 ат
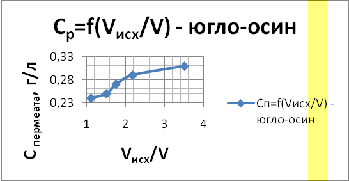
Рисунок 3.4.2 Зависимость концентрации пермеата Югло-осина (г/л) от
степени концентрирования, ΔР = 7 ат
3.5
Обсуждение результатов эксперимента
) Несмотря на высокую производительность ультрафильтрационных мембран,
они показывают относительно невысокое качество разделения. Поэтому для
концентрирования экстрактов предпочтительнее выбор нанофильтрационных мембран.
2) Использование обратного осмоса требует организации высокого
давления, поэтому в данной работе изучено не было. Однако литературные
источники [10] показывают, что для концентрирования растительных экстрактов
нанофильтрация предпочтительнее обратного осмоса по экономическим соображениям.
) Линейная зависимость удельной производительности по экстракту от
давления позволяет сделать вывод о том, что использование насоса с большим
напором даст возможность добиться довольно высоких производительностей. Однако,
исходя из данных, полученных в литературе [10,11,13], можно сделать вывод о
том, что при повышении давления производительность будет расти лишь до
некоторого оптимального значения давления, а далее приобретать постоянный характер.
) Значительное падение производительность во времени и с ростом
концентрации экстракта означает необходимость частого проведения регенерации
мембраны, а также определяет концентрационные пределы проведения процесса,
равные 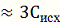 для Юглона-П и
для Юглона-П и  для Югло-осина. Такие выводы
подтверждаются источниками [10-14]. Однако при повышении давления возможно
изменение концентрационных пределов. Необходимы дополнительные исследования.
для Югло-осина. Такие выводы
подтверждаются источниками [10-14]. Однако при повышении давления возможно
изменение концентрационных пределов. Необходимы дополнительные исследования.
) Увеличение содержания сухого вещества в пермеате с повышением
степени концентрирования также задает пределы проведения процесса. Если в
случае экстракта Югло-осин увеличениеконцентрации пермеата не так значительно,
то в случае с Юглоном-П концентрация пермеата возросла в 3 раза при степени
концентрирования 2,5. В статье [14] нарастание степени концентрирования также
приводит к понижению производительности, что еще раз обосновывает выбор
концентрационных пределов проведения данного процесса, упомянутых в пункте 3.
Чтобы выявить тенденцию возрастания концентрации пермеата с увеличением
степени концентрирования, возможно, недостаточно существующей выборки
экспериментальных данных, что делает необходимыми дополнительные исследования
данного процесса.
4. Расчет
экономической эффективности процесса
Проведем расчет экономической эффективности метода концентрирования
растительного экстракта нанофильтрацией в сравнении с вакуумным выпариванием.
) Вакуумное выпаривание:
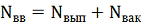 (5.1)
(5.1)
Где 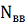 - общая мощность установки вакуумного выпаривания, Вт;
- общая мощность установки вакуумного выпаривания, Вт; 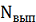 - мощность выпарной установки, Вт;
- мощность выпарной установки, Вт;  - мощность процесса вакуумирования,
Вт
- мощность процесса вакуумирования,
Вт
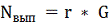 (5.2)
(5.2)
Где r - удельная теплота парообразования воды, Дж/м3; G - массовый расходвлаги, кг/с
r =
2382,5кДж/кг при Р = 0,126 ат, tкип = 50оС
 (5.3)
(5.3)
Где Q - объемный расход экстракта, м3/с,
ΔP
- разность давлений,
создаваемая вакуум-насосом.
Р =1- 0,126=0,874 ат = 85739,4Па
Расход принимаем равным 1 л/ч = 2,78 м3/с
м3/с
Упаривание на вакуум-выпарной установке ведем от исходных 5,4% до 75%
сухого вещества.
Тогда материальный баланс:
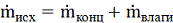 (5.4.1)
(5.4.1)
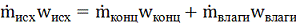 (5.4.2)
(5.4.2)
Принимая концентрацию в паре равной 0, получим:
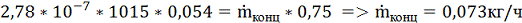
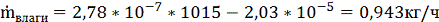
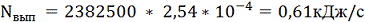
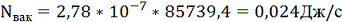
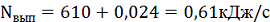 =>0,61 кВт*ч
=>0,61 кВт*ч
Так как с 1л/ч раствора приготовить можно 0,073кг концентрата и выпарить
0,943 кг влаги. Тогда на м3 упаренной влаги получим:
,61/(0,943/988)=639 кВт*ч/м3 влаги
Стоимость кВт*ч энергии в Москве - 3,31 руб.
*3,31 = 2115 руб/м3 влаги
2) 
Где Q - объемный расход концентрата экстракта, м3/с, p -
разность давлений, создаваемая насосом.
Производительность насоса: 18 л/ч при давлении 6 ат. Тогда мощность
насоса:
Следовательно при удельной производительности 1 л/ч получим:

С коэффициентом запаса 2 получим, что при стоимости кВт*ч энергии 3,31
руб:
*3,31*2=19,86 руб/м3
Сконцентрированный нанофильтрацией экстракт имеет массовую концентрацию  17% сухого вещества. Плотность
раствора станет 1,0353 кг/м3.Тогда сопряженный процесс вакуумного
выпаривания будет иметь следующую стоимость:
17% сухого вещества. Плотность
раствора станет 1,0353 кг/м3.Тогда сопряженный процесс вакуумного
выпаривания будет иметь следующую стоимость:
Соотношение удаленной влаги нанофильтрацией и выпариванием составит
1:4,42. Тогда и затраты будут распределяться аналогичным образом. Из м3
удаленной влаги 185 л будет удалено нанофильтрацией, а оставшиеся 815 л
вакуумным выпариванием.
,86*0,185+2115*0,815=1727,4 руб/м3
Выводы
В результате проделанной работы был изучен процесс жидкостного
концентрирования экстрактов лекарственных растений методом нанофильтрации.
Были оценены параметры проведения процесса, а также определены пределы, в
которых можно осуществлять процесс.
Концентрационные пределы проведения процесса составили 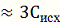 для Юглона-П и
для Юглона-П и  для Югло-осина. Выявлена
необходимость проведения опытов с насосом большего напора для выбора
оптимального рабочего давления.
для Югло-осина. Выявлена
необходимость проведения опытов с насосом большего напора для выбора
оптимального рабочего давления.
Предложен метод концентрирования экстрактов лекарственных растений на
основе совмещения нанофильтрации с традиционным вакуумным выпариванием.
В результате совмещенного процесса достигается:
) Необходимое качество целевого продукта, содержание влаги в котором
составляет 25%
2) Сокращение энергетических затрат в 1,2 раза
По результатам проведенной работы получены исходные данные для проектирования
промышленной установки концентрирования экстрактов лекарственных растений на
основе совмещения нанофильтрации и вакуумного выпаривания
5. Приложение
по экономической части
.1 Технико-экономическое обоснование
Уже на самых ранних стадиях развития человечества растения были не только
источником питания людей, они помогали человеку избавиться от болезней.
В лекарственных травах содержится минимум одно вещество, обладающее
лечебными свойствами. Сейчас известно несколько групп активных веществ растений:
алкалоиды, гликозиды, дубильные вещества, сапонины, флавоноиды, различные
органические кислоты, витамины, жирные и эфирные масла, микроэлементы и др.[17]
Основные способы применения сырья лекарственных растений: производство
лекарственных средств для внутреннего и наружного применения.
Из лекарственных растений на фармацевтических заводах и фабриках, в
аптеках готовят различные лечебные препараты и лекарственные формы.
Внутрь
применяют водные извлечения: настой <#"527401.files/image126.gif">(1)
Где
Pi - количество израсходованного i-го
материального ресурса;
Цi
- планово-заготовительная цена i-го вида материальных ресурсов (руб/ед);
i- 1, 2, … n -
виды ресурсов.
В
работе используются растворы, поставляемые заводом, поэтому в материальных
затратах учитываем только затраты на пилотную установку.
Пилотная
установка для концентрирования экстракта грецкого ореха включает в себя
следующее оборудование. Оборудование закупается у фирм изготовителей.
Таблица 2
Расходы на закупку оборудования.
|
Наименование технологического оборудования
|
Количество, шт
|
Цена, руб. (вкл. НДС)
|
Стоимость, руб.
|
|
Шланги силиконовые
|
5м
|
100
|
100
|
|
Насос центробежный
|
1
|
3000
|
3000
|
|
Мембранная ячейка: Корпус Мембрана нанофильтрационная
|
1 1
|
142 1750
|
142 1750
|
|
ИТОГО, руб:
|
4992
|
.2.2 Расчёт энергетических затрат
В составе энергетических затрат учитываются затраты на электроэнергию,
пар, воду, холод, сжатый воздух и т.п., непосредственно израсходованные на
технологические цели на выполнение научно-исследовательской работы.
Затраты на электроэнергию
Затраты на электроэнергию составят:
 (2)
(2)
Где
Мi - паспортная мощность электрооборудования (кВт);
К
- коэффициент использования мощности, К=0,8-0,9;
Тi
- время работы электрооборудования (ч);
Ц
- цена за 1 кВт·ч (руб/кВт·ч);
Рi
- расход электроэнергии на i-том виде оборудования (кВт·ч).
Т.к.
работа проводилась в лаборатории кафедры Мембранной технологии РХТУ им. Д.И.
Менделеева, цена 1 кВт·ч составляет 2 руб 47 коп.
Таблица 3
|
Наименование оборудования
|
Число ед. оборудования
|
Номинальная мощность ед. оборудования, кВт
|
Суммарная потребляемая мощность, кВТ
|
Коэф. Использования мощность
|
Время работы оборудования, ч.
|
Цена, ру/кВтч
|
Сумма затрат, руб
|
|
Насос центробежный
|
1
|
0,2
|
0,2
|
0,8
|
200
|
3,31
|
105,92
|
|
ИТОГО, руб:
|
105,92
|
Затраты на воду
Т.к. работа проводилась в лаборатории кафедры Мембранной технологии РХТУ
им. Д.И. Менделеева, цена за потребление и отведение воды принята согласно
тарифам, установленным для РХТУ им. Д.И. Менделеева.
Таблица 4
|
Вид ресурса
|
Израсходованное количество, м3
|
Цена, руб/м3
|
Сумма, руб
|
|
Вода холодная, потребление
|
5
|
19,85
|
99,25
|
|
Вода холодная, отведение
|
5
|
14,40
|
72
|
|
ИТОГО, руб:
|
171,25
|
5.2.3 Затраты на аренду помещения
Т.к. работа проводилась в лаборатории кафедры Мембранной технологии РХТУ
им. Д.И. Менделеева, аренда помещения в затратах не учитывается.
5.2.4 Расчет затрат на заработную плату
Заработная плата состоит из заработной платы исполнителя (студента) ЗПЛИ,
заработной платы консультантов ЗПЛКОН, заработной платы
руководителей дипломной работы (ЗПЛрук).
Заработная плата исполнителя:
ЗПЛи = См · n (3)
См - месячная стипендия: 1350 руб.
n-
количество месяцев выполнения дипломной работы: 4 месяцев.
ЗПЛИ=1350 · 4 =5400 руб.
Заработная плата руководителя:
Заработная плата руководителя определяется из почасовой ставки, которая
составляет (по данным РХТУ):
руб. в час для ассистента, ст. преподавателя;
руб. в час для кандидата наук;
руб. в час для доктора наук.
Общая продолжительность консультаций 24,5 часа:
ЗПЛрук=24,5·Т (5)
Т - часовая оплата труда руководителя
ЗПЛрук=24,5 · 400 = 9800 руб.
Заработная плата консультантов:
ЗПЛКОН=0.5·Т (5)
Т - часовая оплата труда консультантов:
ЗПЛкон,общ=400·0,5+300·0,5+150·0,5+150·0,5=500 руб.
Начисления на заработную плату.
Начисления на заработную плату составляют 26% от суммарной заработной
платы:
Ссс = (ЗПЛрук + ЗПЛкон) · 0,26 = (500 +
9800) = 2678 руб
Общий фонд заработной платы:
Собщ = ЗПЛИ + ЗПЛкон + ЗПЛрук=
5400 + 500 + 9800 + 2678 = 18378 руб.
5.2.5 Затраты на посуду
Таблица 5
|
Наименование
|
количество
|
Цена за единицу, руб.
|
Сумма, руб.
|
|
Колба мерная 25 мл
|
2
|
38
|
76
|
|
Колба мерная 50 мл
|
1
|
41
|
41
|
|
Колба мерная 250 мл
|
2
|
52
|
104
|
|
Колба мерная 500 мл
|
1
|
59
|
118
|
|
Мерный цилиндр 100 мл
|
1
|
320
|
320
|
|
Колба коническая 250 мл
|
4
|
80
|
320
|
|
Колба коническая 500 мл
|
2
|
95
|
190
|
|
ИТОГО, руб:
|
1169
|
5.5.2 Амортизационные отчисления:
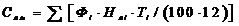 (6)
(6)
Где:
Ф - стоимость приборов, применяемых в исследовании, руб.;
На
- годовая норма амортизационных отчислений, %;
Т
- время работы приборов и оборудования в течение срока выполнения дипломной
работы, месс.
Так
как стоимость оборудования меньше 20 тыс. рублей, то амортизацию не
рассчитываем.
5.2.7
Затраты, связанные с использованием вычислительной техники
Свт
= Т Ц
Где
Т - время использования вычислительной техники, ч;
Ц
- цена за 1 час машинного времени;
Поскольку
в ходе выполнения дипломной работы вычислительная техника не применялась, то
затраты, связанные с использованием вычислительной техники равны 0.
Свт
= 0 руб.
.2.8
Услуги сторонних организаций
В
данной работе затрат на услуги сторонних организаций нет.
.2.9
Накладные расходы
Накладные
расходы принимаются в размере 15% от суммы заработной платы с начислениями:
Сн = 18378 · 0,15 = 2756,70 руб.
.3 Смета затрат на проведение дипломной
научно-исследовательской работы
Таблица 7
|
Наименование статей затрат
|
Сумма, руб.
|
%
|
|
Затраты на покупку оборудования
|
4992
|
18,10
|
|
Энергетические затраты: На электроэнергию На воду
|
277,17
|
1,00
|
|
105,92
|
0,38
|
|
171,25
|
0,62
|
|
Заработная плата: Исполнителя Руководителя консультантов
|
15700
|
56,94
|
|
5400
|
19,59
|
|
9800
|
35,154
|
|
500
|
1,81
|
|
Начисления на заработную плату
|
2678
|
9,72
|
|
Затраты на посуду
|
1169
|
4,24
|
|
Накладные расходы
|
2756,7
|
10,00
|
|
ИТОГО, руб
|
27907,46
|
100
|
Заключение
Проведенный расчет показывает, что большую часть затрат на
исследовательскую работу составляют затраты на оплату труда, а значит работа
является трудоемкой. Однако, существенны и затраты на покупку оборудования,
т.е. работа относительно фондоёмка. Энергетические затраты невысоки, таким
образом, эксплуатационные затраты на установку малы.
6.
Приложение по охране окружающей среды
Сегодня человечество переживает фазу осмысления опасности бурного
неконтролируемого роста промышленного производства, приводящего к истощению
природных ресурсов и загрязнению окружающей среды.
6.1 Экологическое обоснование темы работы и предполагаемых
технологических решений
Россия осталась практически единственным на планете регионом с
огромнейшими запасами экологически чистого растительного сырья и питьевой воды.
Производство лекарственных средств и экологически чистых продуктов из дикого и выращенного
в регионах России сырья является перспективным направлением.
Переработка растительного сырья представляется перспективной для пищевой
и фармацевтической промышленности. Как, собственно, и разработка новых
технологий и технологического оборудования для этих отраслей.
Основным требованием к препаратам из растительного сырья при их
разработке является обеспечение высокой эффективности и биологической
доступности. Для этого необходимо извлечь биологически активные вещества из
клеток сырья и обеспечить их поступление в организм человека.
Технологии экстрагирования из лекарственных растений, позволяющие
выделить биологически активные вещества, целенаправленно, в максимальном
количестве и сохранением их высокой природной активности, являются основополагающими
в производстве экстрактов.
Работа с экологически чистым природным сырьем является безопасной и
приносит огромную пользу, ведь обогащение витаминными комплексами и
биологически активными добавками благотворно сказывается на здоровье людей.
Цель работы.
Исследование эффективности и экологической безопасности метода
нанофильтрации для концентрирования растительных экстрактов.
6.2 Краткая характеристика процесса
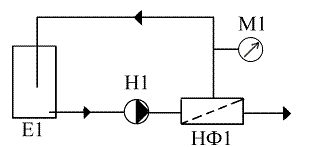
Из емкости с исходным раствором Е1 насосом Н1 перекачивается растительный
экстракт, содержащий юглон. Раствор проходит через мембранный аппарат с
нанофильтрационной мембраной НФ1, разделяя поток на концентрат и пермеат.
Концентрат циркулирует, обогащаясь основным компонентом - юглоном, пермеат
сбрасывается в канализацию.
6.3 Токсикологическая характеристика сырья, реагентов,
промежуточных и конечных продуктов
В процессе проведения НИР использовались следующие вещества:
Вода
Под свойствами воды понимают совокупность биохимических,
органолептических, физико-химических, физических, химических и других свойств
воды. Многие свойства воды аномальны, это вызвано особенностями строения
молекулы воды. Вода является наиболее важным и распространенным веществом, в
природе не существует чистой воды, в ней обязательно содержатся какие-либо
примеси, чистая вода не имеет вкуса и запаха, прозрачна, её получают в процессе
перегонки, после этого она называется дистиллированная.
Среди всех жидкостей вода имеет самое высокое поверхностное натяжение.
Дистиллированная вода не проводит электрический ток, так как она слабый
электролит и диссоциирует в малой степени.
По массе в состав воды входит 88,81%кислорода и 11,19%водорода, а
наибольшую плотность вода имеет при 0°С (1г/см3)
Физические свойства воды:
· Температура кипения - 100°С;
· Температура кристаллизации - 0°С;
· Плотность при 20°С - 0,9982 г/см3
· Молекулярная масса - 18
· Теплоемкость - 4,1868 кДж/кг
В работе использовалась водопроводная вода (ГОСТ 2874-82).
Исходный раствор -экстракт грецкого ореха и персика, а также экстракт
грецкого ореха и осины. Точный состав экстракта не установлен. Однако известно,
что все компоненты растительного происхождения, соответственно для
сравнительного расчета токсикологической активности используем как
характеристику ХПК теоретическое основных компонентов.
Концентрат - вышеупомянутые экстракты, обогащенные юглоном и обедненные
солями (NaCl, KCl).
Пермеат - солевой раствор, содержащий NaCl, KCl
Химическое потребление кислорода (ХПК) - количество кислорода,
потребляемое при химическом окислении содержащихся в воде органических и
неорганических веществ под действием различных окислителей.
Расчитаем ХПК теоретическое для основных компонентов экстрактов: юглона,
дубильных веществ, флавоноидов, витаминов, органических кислот, сахаров.Реакции
горения будут выглядеть следующим образом:
Юглон:
С10Н6О3+10О2 = 10СО2+3Н2О
Дубильные вещества: эллагогендубильная и эллаговая кислоты
C14H10O10 + 23О2 = 28СО2+10Н2О
C14H6O8+ 23О2 = 28СО2+6Н2О
Флавоноиды: эпикатехин, эпигаллокатехин, изофлавон,
C15H10O6 + 29О2 = 30СО2+10Н2О15H14O7
+ 15О2 = 15СО2+7Н2О
C15H10O2 + 33О2 = 30СО2+10Н2О
Витамины: С, А, Е, В2, В5, В6
С6Н8О6+ 5О2 = 6СО2+4Н2О
С20Н30О + 27О2 = 20СО2+15Н2О
С29Н50О2+ 81О2 = 58СО2+50Н2О17H20N4O6+
19О2 = 17СО2+10Н2О+2N2
4C9H17NO5+ 43О2 = 36СО2+34Н2О+2N2
C7H11NO3+ 33О2 = 28СО2+22Н2О+4N2
Органические кислоты: яблочная, бензойная
С4Н6О5 + 3О2 = 4СО2+3Н2О
C7H6O2
+ 15О2
= 14СО2+6Н2О
Рассчитаем ХПК теоретическое в мг О2 на один мг вещества:
1) 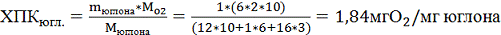
2) 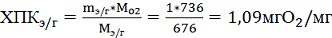
3) 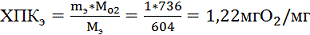
4) 
5) 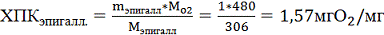
6) 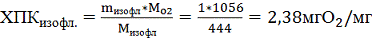
7) 
8) 
9) 
10) 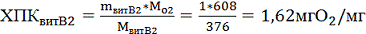
11) 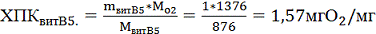
12) 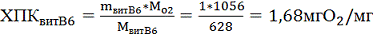
13) 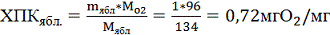
14) 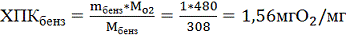
Сведем результаты в таблицу в порядке уменьшения величины ХПК:
|
Вещество
|
ХПКтеор, мгО2/мг вещества
|
|
Витамин А
|
3,02
|
|
Витамин Е
|
3,01
|
|
Изофлавон
|
2,38
|
|
Юглон
|
1,84
|
|
Витамин В6
|
1,68
|
|
Эпикатехин
|
1,62
|
|
Витамин В2
|
1,62
|
|
Эпигаллокатехин
|
1,57
|
|
Витамин В5
|
1,57
|
|
Бензойная кислота
|
1,56
|
|
Эллаговая кислота
|
1,22
|
|
Эллагогендубильная кислота
|
1,09
|
|
Витамин С
|
0,91
|
|
Яблочная кислота
|
0,72
|
Таким образом, можно оценить, какое из веществ в составе экстракта более
токсично с экологической точки зрения.
Хлорид натрия
По степени воздействия на организм согласно ГОСТ 12.1.007 - 76 ССБТ
относится к веществам 3-го класса опасности. При повышенной концентрации в
организме может вызвать отёки.
Хлорид калия
Калий хлористый не горюч, пожаро- и взрывобезопасен, по степени
воздействия на организм согласно ГОСТ 4568-95относится к веществам 3-го класса
опасности. Пылевидные частицы, попадая на кожные раны, ухудшают их заживление.
На неповрежденную кожу калий хлористый вредного действия не оказывает. Не
образует токсичных соединений в воздушной среде.
ПДКв ионов в воде водных рыбохозяйственных объектов составляет:
· ПДКврСl- = 300 мг/л
· ПДКврNa+ = 120 мг/л
· ПДКврK+ = 50 мг/л
.4 Охрана атмосферного воздуха от загрязнения
При проведении работы вредные газы, пары не образуются.
6.5 Охрана водоёмов от загрязнения сточными водами
При проведении НИР сточные воды не образуются, организуется замкнутая
система водооборота.
6.6 Экологически безопасное обращение с отходами
В ходе работы твердые отходы не образуются.
.7 Экономическая оценка природоохранных мероприятий
Все используемые в работе экстракты безопасны для окружающей среды, так
как являются объектами природного происхождения.
Заключение
В результате данной дипломной работы была исследована возможность
концентрирования растительных экстрактов методом нанофильтрации.
Результаты работы могут быть использованы конструкторскими предприятиями
для усовершенствования разрабатываемых ими установок, что поможет им выпускать
более качественную продукцию.
7.
Приложение по охране труда
Основная задача охраны труда - создание здоровых и безопасных условий
труда.
Пилотная установка, на которой производятся исследования, находится в
лаборатории кафедры мембранной технологии РХТУ им. Д.И. Менделеева.
При работе необходимо предусматривать соответствующие меры по охране
труда, технике безопасности и производственной санитарии.
При проведении экспериментов на пилотной установке исследуется экстракт
грецкого ореха, персика и осины. Компоненты, входящие в экстракт: юглон,
дубильные вещества, флавоноиды, органические кислоты, витамины.
В установку входит центробежный насос. Существует возможность
возникновения короткого замыкания и, как следствие возгорания. Кроме того,
поражения работника электрическим током. Механические травмы при неправильной
работе с насосом.
Таким образом, при проведении экспериментов следует особое внимание
обращать особое внимание на следующее: электро и пожаробезопасность.
Расчет выполнен по методическим указаниям [18].
7.1 Физико-химические, пожаровзрывоопасные и токсические
свойства веществ, входящих в состав экстракта, используемого в работе
[19,20,21]
Юглон
Юглон (5-гидрокси-1,4-нафтохинон) в кристаллическом виде -
желто-оранжевое вещество, впервые выделено немецкими химиками Фогелем и
Райшауэром в 1856 году из зеленой кожуры грецкого ореха. Он также обнаружен в
листьях, корнях и стеблях орехового дерева. Ммол = 174 г/моль, Tпл
= 153-154оС, Tкип - возгоняется, Qсг - 23870 кДж/кг
5-Гидрокси-1,4-нафтохинон
легко растворяется в СНСl3, разбавленных растворах щелочей <#"527401.files/image144.gif">
Где:
S0 -
площадь световых проёмов, м2;
S = А·В = 18,75
м2 - площадь пола помещения;
η0 = 9,6 -
световая характеристика окна, зависящая от отношения длины помещения к глубине
и отношения глубины помещения к возвышению верхнего края окна.
КЗД
= 1 - коэффициент, учитывающий затемнение окон противостоящими зданиями.
КЗ
- коэффициент запаса, учитывающий загрязнение светопропускающего материала
светового проёма. Для лабораторий не учитывается.
r1 = 1,4 - коэффициент, учитывающий отраженный свет
(расстояние от рабочей поверхности до верха окна 2 м., установка находится
примерно посередине лаборатории, поэтому отношение l/B =
0,5).
τ0 - общий
коэффициент светопропускания светового проема.
В
соответствии с [9] выбираем значения:
τ1 -
коэффициент, учитывающий потери света в светопропускающем материале, для
двойного оконного листового стекла = 0,8.
τ2 -
коэффициент, учитывающий потери света в переплётах светопроема, для деревянных
двойных раздельных = 0,65.
τ3 -
коэффициент, учитывающий потери света в несущих конструкциях ( при боковом
освещении τ3 =1)
τ4 -
коэффициент, учитывающий потери света в солнцезащитных устройствах. При их
отсутствии = 1.
Определяем
периметр τ0 = τ1 · τ2 ·τ3 ·τ4 = 0,8 ·
0,65 · 1 · 1 = 0,52
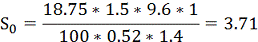
Количество
необходимых световых проёмов:
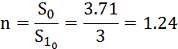
Где
S10 - площадь одного светового проёма.
Таким
образом, для обеспечения нормированного значения КЕО необходимо два оконных
проёма.Однако фактическая площадь световых проёмов - 3 м2, а значит,
необходимо дополнительное (искусственное) освещение.
Искусственное
освещение
В
лаборатории применяется комбинированное освещение - общее и местное.
Источниками искусственного освещения служат люминесцентные лампы дневного света
ЛД-30.
В
помещениях высотой до 6 м рекомендуется применять люминесцентные лампы,
основным достоинством которых является высокая светоотдача (до 75 лм/Вт), срок
службы до 10000ч, хорошая цветопередача, низкая температура [26].
Рассчитаем
необходимое число ламп.
)
Определение коэффициента запаса:
Коэффициент
запаса k учитывает запыленность помещения, снижение светового потока ламп в
процессе эксплуатации. Согласно СНиП 23-05-95 принимается = 1,5
)
Определение коэффициента минимальной освещенности:
Коэффициент
минимальной освещенности Z характеризует неравномерность освещения. Он является
функцией многих переменных. Для стандартных светильников равен 1,1-1,2
)
Определение коэффициента использования светового потока
Коэффициент
использования светового потока η зависит
от типа светильника, показателя типа помещения, освещенности и т.д. Для ламп
данного типа η
= 0,55
4)
Световой поток одной лампы для люминесцентных ламп мощностью 30Вт равен: F=1800лм.
Нормальная
освещенность для работ со зрительным разрядом IV (размер
объекта различения, минимальный - 0,5-1.0, фон светлый) составляет 300 лк
(согласно [26]).
В
один светильник вставляется 2 лампы.
Таким
образом необходимое количество светильников:

Т.е.
необходимо 5 светильников. В лаборатории установлено 4 светильника с лампами
ЛД-30, что не соответствует предъявляемым нормам.
Шум
Установки,
создающие уровень шума, превышающий предельно допустимый (75 Дб) [27], в
лаборатории отсутствуют.
Таблица 1
Спектр, соответствующий ПС-75
|
Среднегеометрические частоты октавных полос, Гц
|
63
|
125
|
250
|
500
|
1000
|
2000
|
4000
|
8000
|
|
Уровень шума, Дб
|
94
|
87
|
82
|
78
|
75
|
73
|
71
|
70
|
Водоснабжение и канализация
Вода, подаваемая в лабораторию - хозяйственно-питьевая по назначению.
В канализацию сбрасывается только вода с небольшими количествами
загрязняющих веществ ввиду их малой токсичности. Для слива вредных, густых или
едких веществ, а так же осадков, предназначены специальные керамические
емкости, содержимое которых в последствии нейтрализуется.
В лаборатории имеется центральное отопление, которое обеспечивает
температуру не ниже 16оС в холодный период года [28].
7.3 Техника безопасности
Электробезопасность
Т.к. в пилотной установке значительную роль играет электричество,
электробезопасности следует уделять наибольшее внимание.
Электробезопасность - это система организационных и технических
мероприятий и средств, обеспечивающих защиту от опасного воздействия электрического
тока. Лаборатория - это помещение с повышенной опасностью поражения людей
электрическим током, поэтому ей присвоен II класс по опасности поражения
электрическим током. Работающий человек может прикоснуться к металлическому
корпусу с одной стороны и соединенной с землей металлической конструкцией
здания, технологическим аппаратом, механизмом - с другой. Используемый ток -
напряжение 220В, частота 50Гц. Все подходы для отключения тока должны быть
легкодоступны, а для защиты от поражения применятся заземление приборов на
общий контур сопротивлением R=40
Ом [29].
Электрооборудование в соответствии с ПУЭ выбирают с учетом класса
взрывоопасной зоны и свойств взрывоопасной смеси. Для зоны класса В-1б
используются установки без взрывозащиты.
Пожарная профилактика. Категорирование производственных
помещений по пожаровзрывоопасности
Дипломная работа проводится в лаборатории, которая по степени
пожаровзрывоопасности относится к категории В - пожароопасная [30].
По ПУЭ лаборатория относится к помещениям класса В-1б, в них при
нормальной эксплуатации взрывоопасные смеси горючих газов и паров ЛВЖ с
воздухом не образуются, а возможны только аварии и неисправности. Эти помещения
характеризуются следующими особенностями: горючие газы и ЛВЖ находятся в небольших
количествах только для однодневного применения, их недостаточно для образования
взрывоопасной смеси в объеме, превышающем 5% от общего объема помещения. Работы
с ними ведутся без применения открытого огня.
Число этажей для зданий данной категории не более 8. Площадь этажа между
противопожарными стенами не ограничена. Расстояние от дальнего рабочего места
до выхода не более 40м [31], в лаборатории-9 м.
Степень огнестойкости здания - II[31].
Список
литературы
1. <http://www.xumuk.ru/encyklopedia/2/3054.html> (статья «Оксинафтохиноны»)
2. R.
W. Hanson, Characterization of Juglone,Plymouth Polytechnic Devon, United
Kingdom/ Journal of Chemical Education, 1976, 53 (6), p 400
3. Чуешов
В.И. и др. Промышленная технология лекарств: [Учебник. В 2-х т. Том 2/В.И.
Чуешов, О.И. Зайцев, С.Т. Шебанова, М.Ю. Чернов]: Под редакцией В.И. Чуешова. -
Х.:МТК-Книга; Издательство НФАУ, 2002. - 716с.
4. Чуешов
В.И. и др. Промышленная технология лекарств: [Учебник. В 2-х т. Том 1/В.И.
Чуешов, О.И. Зайцев, С.Т. Шебанова, М.Ю. Чернов]: Под редакцией В.И. Чуешова. -
Х.:МТК-Книга; Издательство НФАУ, 2002. - 560с.
5. <http://ecstract.ru>
6. <http://healing-nature.ru/stati/3130/>
7. <http://www.niopik.ru/reports/O27>
8. Regulation
of Aflatoxin Production by Naphthoquinones of Walnut (Juglans regia). Noreen
Mahoney, Russell J. Molyneux, and Bruce C. Campbell. Western Regional Research
Center, Agricultural Research Service, U.S. Department of Agriculture/ J.
Agric. Food Chem. 2000, 48, 4418-4421
9. Г.А.
Хантургаев, С.М. Репях, Л.Е. Полякова, Б.В. Бадмацыренов. Экспериментальное
определение параметров хвойного лечебного экстракта, необходимых для
оптимизации процесса концентрирования в роторно-вакуумном пленочном испарителе.
Химия растительного сырья. 1998. №2. С. 95-99
10. Application
of nanofiltration for coffee extract concentration, Ivetta Vincze, Gyula
Vatai*Faculty of Food Science, Department of Food Engineering, Budapest
University of Economic Sciences andPublic Administration (Szent Istv6n
University)/ Desalination 162 (2004) 287-294
11. The
Ginkgo biloba extract concentrated by nanofiltration, Li Xu*, Shiyong Wang
School of Chemical Engineering and Technology, Tianjin University /
Desalination 184 (2005) 305-313
. Concentration
of sea buckthorn (Hippophae rhamnoides L.)juice with membrane separation,
Ivetta Vincze, Eva Banyai-Stefanovits, Gyula Vatai Corvinus University of
Budapest, Faculty of Food Science, Department of Food Engineering,Corvinus
University of Budapest, Faculty of Food Science, Department of Applied
Chemistry/Separation and Purification Technology 57 (2007) 455-460
. Concentration
of marc extracts by membrane techniques, C. Hodur, Sz. Kertesz, S. Beszedes,
Zs. Laszlo, G. Szabo. Department of Technical and Process Engineering, Faculty
of Engineering, University of Szeged;PhD School of Environmental Sciences,
University of Szeged / Desalination 241 (2009) 265-271
. Ultra-
and nanofiltration of aqueous extracts from distilled fermented grape pomace.
Beatriz Diaz-Reinoso, Andres Moure, Herminia Dominguez, Juan Carlos Parajo.
Department of Chemical Engineering, University of Vigo (Campus Ourense) /
Journal of Food Engineering 91 (2009) 587-593
15. Научное
обоснование технологий функциональных продуктов питания с использованием
растительных сапонинов. Юдина Татьяна Павловна. Автореферат диссертации на
соискание ученой степени д.т.н. от 20.04.2009
16. Extraction
of biologically active compounds from propolis and concentration ofextract by
nanofiltration. Bartosz Tylkowski, Boryana Trusheva, Vassya Bankova, Marta
Giamberini, Georgi Peev, Agnessa Nikolova. University of Chemical Technology
and Metallurgy, Department of Chemical Engineering; Institute of Organic
Chemistry with Centre of Phytochemistry, Bulgarian Academy of Sciences;
University Rovira i Virgili, Department of Chemical Engineering / Journal of
Membrane Science 348 (2010) 124-130
17. <http://ru.wikipedia.org/wiki/Лекарственные>растения
18. Методические указания
по разделу «Охрана труда» в дипломных проектах и работах / под редакцией
Маринина Л.К.: РХТУ им Д.И.Менделеева. М., 2009. 102 с.
19. www.wikipedia.ru
. Беспамятнов Г.П.,
Кротов Ю.А. Предельно допустимые концентрации веществ в окружающей среде. Л.:
Химия, 1985.
. Лазарев Н.В. Левина
Э.Н. Вредные вещества в промышленности. Справочник для химиков, инженеров и
врачей. Том 3. Неорганические и элементорганические соединения. Химия. 1977 г.
. СП 2.2.1.1312-03 -
Гигиенические требования к проектированию вновь строящихся и реконструируемых
промышленных предприятий.
. ГОСТ 12.1.005-88
(2001 - переиздание) ССБТ. Общие санитарно-гигиенические требования к воздуху
рабочей зоны.
. СанПиН 2.2.4.548-96.
Гигиенические требования к микроклимату производственных помещений.
. СНиП 41-01-2003.
Отопление, вентиляция и кондиционирование.
. СНиП 23-05-95.
Естественное и искусственное освещение.
. СНиП 23-03-2003.
Защита от шума.
. СНиП II-32-74.
Канализация, наружные сети и сооружения. М.: Стройиздат, 1976.
. ПУЭ. Правила
устройства электроустановок, 7е издание, Промышленная безопасность 2007. -
552с.
. НПБ 105-03.
Категорирование помещений и зданий по пожаровзрывобезопасности.
. СНиП 31-03-2001.
Производственные здания.