Физическая химия
1. Предмет и задачи химии. Место химии среди естественных наук
Химия - наука о строении, свойствах веществ, их превращениях и
сопровождающих явлениях. В зависимости от атомарной природы изучаемого
вещества, типов химических связей между атомами различают неорганическую,
органическую и элементоорганическую химии. Объектом неорганической химии
являются все химические элементы и их соединения, другие вещества на их основе.
Органическая химия изучает свойства обширного класса соединений, образованных
посредством химических связей углерода с углеродом. Химия является
общетеоретической дисциплиной. Она призвана дать студентам современное научное
представление о веществе как одном из видов движущейся материи, о путях,
механизмах и способах превращения одних веществ в другие. Знание основных
химических законов, владение техникой химических расчетов, понимание
возможностей, предоставляемых химией с помощью других специалистов, работающих
в отдельных и узких ее областях, значительно ускоряют получение нужного результата
в различных сферах инженерной и научной деятельности.
Предмет, задачи, значение предмета химия
Химия изучает свойства, состав, строение и процессы превращения веществ.
впервые определения химии как науки дал м. в. ломоносов: «химическая наука
рассматривает свойства и изменения тел... должна исследовать состав тел,
объяснить причину того, что с веществами при химическом превращениях
происходит» . задачи определённые ломоносовым очень близки к современным.
Химия тесно связана с физикой. «и эти две науки, - писал ломоносов,- так
соединены между собой, что одна без другой в совершенстве быть не могут». химия
также соприкасается также и с другими естественными науками из задач химии
вытекает её значение. «широко распростирает химия руки свои в дела человеческие.
куда не посмотрим , куда не оглянемся - везде перед очами нашими успехи её
применения», - указывал ломоносов ещё в 1751г. в настоящие время невозможно
представить себе жизнь без химии. современная химия приникла во все области
народного хозяйства . химическая промышленность выпускает продукты, которые
являются предметом потребления человека: синтетический каучук, пластические
массы, искусственное волокно, искусственное топливо, красители, лекарственные
вещества и многое другое. в сельском хозяйстве широко применяются минеральные
удобрения и химические средства защиты растений.
Атомно-молекулярное учение помогает составить правильное понимание о
природе веществ и их превращениях. оно лежит в основе всех законов химии.
Ломоносов создал стройное атомно-молекулярное учение и впервые применил
его в химии. основные положения атомно-молекулярного учения м.в. ломоносова
изложены в работе «элементы математической химии»(1741г.) сущность
атомо-молекулярного учения сводиться к следующему:
. все вещества состоят из «корпускул» (так ломоносов называл молекулы).
между которыми имеются промежутки.
. молекулы находятся в непрерывном движении.
. молекулы состоят из «элементов» (так ломоносов называл атомы).атомы,
как и молекулы находятся в непрерывном движении.
. атомы характеризуются определенной массой и размерами.
. молекулы простых веществ из одинаковых атомов, а молекулы сложных - из
различных атомов.
Через 67 лет после ломоносова атомистическое учение в химии применил
английский ученый дальтон. в своей основе учение дальтона повторяет учение
ломоносова. вместе с тем оно развивает его дальше, поскольку дальтон впервые
попытался установить атомные веса известных тогда элементов. однако дальтон
отрицал существование молекул у простых веществ, что по сравнению с учением ломоносова
является шагом назад. по дальтону, простые вещества состоят только из атомов, и
лишь сложные веществами - из «сложных атомов» (молекул).
Атомно-молекулярное учение в химии окончательно утвердилось лишь в
середине xix в. на международном съезде химиков в карлсруе в 1986 г. были
приняты определения молекулы и атома.
Молекула - это наименьшая частица данного вещества, обладающая его
химическими свойствами. химические свойства молекулы её составм и химическим
строением.
Атом - наименьшая частица, входящая в состав простых и сложных веществ.
химические свойства атома определяются его строением . атом - это
электронетральная частица , состоящего из положительно заряженного ядра и
одного или нескольких электронов.
По современным представлениям из молекул состоят лишь вещества
молекулярного строения (многие неметаллы , вода, органические соединения с
неионными связями).вещества немолекулярного строения состоят не из молекул, а
из других химических частиц, химически связанные друг с другом (алмаз, кремний,
соли).у веществ молекулярного строения химическая связь между молекулами
слабая, поэтому они имеют сравнительно низкие температуры плавления и кипения.
у веществ немолекулярного строения химическая связь между частицами весьма
прочная, поэтому эти вещества имеют высокие температура плавления и кипения.
. Простые и сложные вещества
Среди чистых веществ принято различать простые (состоящие из одного
химического элемента) и сложные (образованы несколькими химическими элементами)
вещества.
Простые вещества следует отличать от понятий «атом» и «химический
элемент».
Химический элемент - это вид атомов с определённым положительным зарядом
ядра. Все химические элементы указаны в Периодической системе элементов Д. И.
Менделеева; каждому элементу отвечает свой порядковый (атомный) номер в
Периодической системе. Значение порядкового номера элемента и значение заряда
ядра атома того же элемента совпадают, то есть химический элемент - это
совокупность атомов с одинаковым порядковым номером.
Простые вещества представляют собой формы существования химических
элементов в свободном виде; каждому элементу соответствует, как правило,
несколько простых веществ (аллотропных форм), которые могут различаться по
составу, например атомный кислород O, кислород O2 и озон O3,
или по кристаллической решетке, например алмаз и графит для элемента углерод C.
Очевидно, что простые вещества могут быть одно- и многоатомными.
Сложные вещества иначе называются химическими соединениями. Этот термин
означает, что вещества могут быть получены с помощью химических реакций
соединения из простых веществ (химического синтеза) или разделены на элементы в
свободном виде (простые вещества) с помощью химических реакций разложения
(химического анализа).
Простые вещества представляют собой конечные формы химического разложения
сложных веществ. Сложные вещества, образующиеся из простых веществ, не
сохраняют химические свойства составляющих веществ.
Суммируя всё сказанное выше, можно записать

Где
E - простые вещества (элементы в свободном виде),- сложные вещества (химические
соединения),- синтез,- анализ.
В
настоящее время понятия «синтез» и «анализ» химических веществ используются в
более широком смысле. К синтезу относят любой химический процесс, который
приводит к получению необходимого вещества и при этом существует возможность
его выделения из реакционной смеси. Анализом считается любой химический
процесс, позволяющий определить качественный и количественный состав вещества
или смеси веществ, то есть установить, из каких элементов составлено данное
вещество и каково содержание каждого элемента в этом веществе. Соответственно
различают качественный и количественный анализ - две составные части одной из химических
наук - аналитической химии.
Органические
вещества в своем составе наряду с другими элементами всегда содержат углерод.
Изучение соединений углерода - их строения, химических превращений - и
составляет предмет органической химии.
Вещества
органические и неорганические.
Наряду
с углеродом в состав органических веществ чаще всего входят водород, кислород и
азот, сравнительно реже - сера, фосфор, галогены и другие элементы. Известно
несколько миллионов органических соединений, неорганических же веществ значительно
меньше. Из всех химических элементов только углерод образует такое большое
число органических соединений.
С
органическими веществами мы встречаемся на каждом шагу. Они содержатся во всех
растительных и животных организмах, входят в состав нашей пищи, служат
материалом для изготовления одежды, образуют различные виды топлива,
используются нами в качестве лекарств, красителей, средств защиты урожая и т.
д.
Резкой
грани между органическими и неорганическими веществами не существует. Оксиды
углерода, угольная кислота, ее соли и некоторые другие вещества по наличию в
них углерода должны считаться органическими, но по свойствам они близки к
неорганическим соединениям подобного типа и изучаются обычно в неорганической
химии.
С
органическими веществами человек знаком с давних времен. Наши далекие предки
применяли природные красители для окраски тканей, использовали в качестве
продуктов питания растительные масла, животные жиры, тростниковый сахар,
получали уксус брожением спиртовых жидкостей.
В
настоящее время синтезированы многие органические вещества, не только имеющиеся
в природе, но и не встречающиеся в ней: многочисленные пластмассы, различные
виды каучуков, всевозможные красители, взрывчатые вещества, лекарственные
препараты.
Синтетически
полученных веществ сейчас известно даже больше, чем найденных в природе, и
число их быстро растет. Осуществляются синтезы самых сложных органических
веществ - белков.
Название
науки «органическая химия», утратив первоначальный смысл, приобрело в связи с
этим более широкое толкование.
Можно
сказать, что такое название получило и новое подтверждение, так как ведущей
познавательной задачей современной органической химии является глубокое
изучение процессов, происходящих в клетках организмов на молекулярном уровне,
выяснение тех тонких механизмов, которые составляют материальную основу явлений
жизни.
Изучение
химии органических веществ, таким образом, расширяет наши знания о природе.
Неорганическое
вещество это химическое вещество, химическое соединение, которое не является
органическим, то есть оно не содержит углерода. Неорганические соединения не
имеют характерного для органических углеродного скелета. К числу неорганических
соединений принадлежат соединения всех элементов, за исключением большинства
соединений углерода, являющихся объектом изучения органической химии
<#"526429.files/image002.gif">
где
R - универсальная газовая постоянная, а NA - постоянная Авогадро.
Измеряется энтропия в Дж/(моль.К).
Физический
смысл: энтропия является мерой неупорядоченности состояния системы. Энтропия
системы увеличивается во всех процессах, когда возрастает неупорядоченность
(нагревание, растворение, испарение, реакции разложения и т.п.) и уменьшается в
процессах, идущих с увеличением упорядоченности (охлаждение, кристаллизация,
сжатие и т.п.).
Энтропия
является функцией состояния, но в отличие от большинства других
термодинамических функций возможно экспериментальное определение абсолютного
значения энтропии вещества. Эта возможность основана на постулате М.Планка,
согласно которому «при абсолютном нуле энтропия идеального кристалла равна
нулю» (третий закон термодинамики).
.
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или
термодинамический потенциал в узком смысле) - это величина, показывающая
изменение энергии в ходе химической реакции и дающая таким образом ответ на
принципиальную возможность протекания химической реакции; это термодинамический
потенциал <#"526429.files/image003.gif">
Энергию
Гиббса можно понимать как полную химическую
<#"526429.files/image003.gif">
где
U - внутренняя энергия
<#"526429.files/image004.gif">
Для
системы с переменным числом частиц этот дифференциал записывается так
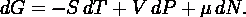
Здесь
μ - химический потенциал
<#"526429.files/image006.gif">
Величина
стандартного изменения изобарно-изотермического потенциала в ходе химической
любой реакции ΔG°298 есть мера химического сродства
исходных веществ. Основываясь на уравнении (I.75), можно оценить вклад
энтальпийного и энтропийного факторов в величину ΔG и сделать некоторые обобщающие заключения о
возможности самопроизвольного протекания химических процессов, основываясь на
знаке величин ΔН и ΔS.
.
Экзотермические реакции; ΔH < 0.
а)
Если ΔS > 0, то ΔG всегда отрицательно; экзотермические реакции, сопровождающиеся
увеличением энтропии, всегда протекают самопроизвольно.
б)
Если ΔS < 0, реакция будет идти самопроизвольно при ΔН > TΔS (низкие температуры).
.
Эндотермические реакции; ΔH > 0.
а)
Если ΔS > 0, процесс будет самопроизвольным при ΔН < TΔS (высокие температуры).
б)
Если ΔS < 0, то ΔG всегда положительно; самопроизвольное протекание эндотермических
реакций, сопровождающихся уменьшением энтропии, невозможно.
.
Скорость химической реакции
Химические
реакции протекают с различными скоростями. Некоторые из них полностью
заканчиваются за малые доли секунды, другие осуществляются за минуты, часы,
дни; известны реакции, требующие для своего протекания несколько лет,
десятилетий и еще более длительных отрезков времени. Кроме того, одна и та же
реакция может в одних условиях, например, при повышенных температурах,
протекать быстро, а в других, - например, при охлаждении, - медленно; при этом
различие в скорости одной и той же реакции может быть очень большим.
Знание
скоростей химических реакций имеет очень большое научное и практическое
значение. Например, в химической промышленности при производстве того или иного
вещества от скорости реакции зависят размеры и производительность аппаратуры,
количество вырабатываемого продукта.
Различают
гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из
одной фазы, гетерогенной- система, состоящая из нескольких фаз. Фазой
называется часть системы, отделенная от других ее частей поверхностью раздела,
при переходе через которую свойства изменяются скачком.
Гомогенные
реакции протекают в однородной среде (например, в газовой фазе или жидком
растворе). Гетерогенные реакции протекают в неоднородной среде - между
веществами, которые находятся в разных фазах (твердой и жидкой, газовой и
жидкой и т.д.). Таким образом, гомогенные реакции происходят равномерно во всем
объеме, заполненном реагентами; гетерогенные - только на некоторых пограничных
поверхностях - на границе раздела фаз.
Скорость
химической реакции υ определяется изменением количества реагирующего
вещества за единицу времени в единице реакционного пространства. В гомогенной
системе реакционным пространством служит объем сосуда, в котором протекает
взаимодействие. Так как отношение количества вещества к единице объема
выражается концентрацией С, то скорость гомогенной реакции равна изменению
концентрации исходных веществ или продуктов реакции во времени. Концентрация С
выражается обычно в моль/л, а время τ - в минутах или секундах; поэтому размерность скорости реакции моль/л .
мин или моль/л . с. При химическом взаимодействии концентрация
каждого из исходных веществ уменьшается во времени (С2<С1;
ΔС<0), а концентрация каждого из продуктов реакции
возрастает (С2>C1; ΔC>0).
Факторы,
влияющие на скорость химической реакции
Для
гомогенных, гетерогенных реакций:
)
концентрация реагирующих веществ;
)
температура;
)
катализатор;
)
ингибитор.
Только
для гетерогенных:
)
скорость подвода реагирующих веществ к поверхности раздела фаз;
Главный
фактор - природа реагирующих веществ - характер связи между атомами в молекулах
реагентов.
)
Скорость реакции зависит от природы реагирующих веществ.
скоростью,
например хлор быстрее йода

)
Для веществ в растворенном состоянии и газов скорость реакции зависит от
концентрации реагирующих веществ.
)
Для веществ в твердом состоянии скорость реакции прямо пропорциональна
поверхности реагирующих веществ.
Чем
сильнее измельчено твердое вещество, тем больше его поверхность. Уголь в виде
больших кусков сгорает в печи медленнее, чем измельченный

)
При повышении температуры на каждые 10°С скорость большинства реакций
увеличивается в 2-4 раза.
Железо
при обычной температуре реагирует с хлором очень медленно, при высокой же
температуре протекает бурная реакция (железо горит в хлоре)

)
Скорость реакции зависит от присутствия некоторых веществ (катализаторов и
ингибиторов).
. Закон действия масс
Закон действия масс открыт опытным путем К.М. Гульдбергом и П. Вааге в
1867 г. Он гласит: При постоянной температуре скорость химической реакции
пропорциональна произведению концентраций реагирующих веществ, причем каждая
концентрации входит в произведение в степени, равной коэффициенту, стоящему
перед формулой вещества в уравнении реакции.
Уравнение химической реакции в общем виде можно представить так:
аА + вВ ↔ сС + dD
Тогда скорость реакции можно выразить уравнением:
= k*[A]a *[B]b
Все химические реакции можно разделить на обратимые и необратимые
реакции. Необратимые реакции протекают до конца - до полного израсходования
одного из реагирующих веществ. Обратимые реакции протекают не до конца: ни одно
из реагирующих веществ не расходуется полностью. Когда скорости прямой и
обратной реакции становятся одинаковыми, наступает химическое равновесие.
Количественной характеристикой химического равновесия служит константа
химического равновесия.
Согласно закону действия масс, скорости прямой V1 и обратнойV2 реакции
выражаются уравнениями:
V1= k1*[A]a *[B]b= k2*[C]c *[D]d
При равновесии V1 = V2 , значит, k1*[A]a *[B]b= k2*[C]c *[D]d
Отношение констант скорости прямой и обратной реакций есть величина
постоянная. Она и называется константой химического равновесия
К = k1 / k2 K = (k2*[C]c *[D]d )/k1*[A]a *[B]b
Кинетическим уравнением химической реакции называют математическую
формулу, связывающую скорость реакции с концентрациями веществ. Это уравнение
может быть установлено исключительно экспериментальным путём.
В зависимости от механизма все химические реакции классифицируют на
простые (элементарные) и сложные. Простыми называются реакции, протекающие в
одну стадию за счёт одновременного столкновения молекул, записанных в левой
части уравнения. В простой реакции могут участвовать одна, две или, что встречается
крайне редко, три молекулы. Поэтому простые реакции классифицируют на
мономолекулярные, бимолекулярные и тримолекулярные реакции. Так как с точки
зрения теории вероятности одновременное столкновение четырёх и более молекул
маловероятно, реакции более высокой, чем три, молекулярности не встречаются.
Для простых реакций кинетические уравнения относительно просты. Например, для
реакции H2 + I2 = 2 HI кинетическое уравнение имеет вид
 = k ∙
C(I2) ∙ C(H2)
= k ∙
C(I2) ∙ C(H2)
Сложные
реакции протекают в несколько стадий, причём все стадии связаны между собой.
Поэтому кинетические уравнения сложных реакций более громоздки, чем простых
реакций.
Например,
для сложной реакции H2 + Br2 = 2 HBr известно
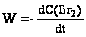 =
=  .
.
Сложность
кинетического уравнения напрямую связана со сложностью механизма реакции.
Основным
законом химической кинетики является постулат, вытекающий из большого числа
экспериментальных данных и выражающий зависимость скорости реакции от
концентрации. Этот закон называют законом действующих масс. Он утверждает, что
скорость химической реакции в каждый момент времени пропорциональна
концентрациям реагирующих веществ, возведённым в некоторые степени.
.
Со скоростью химических реакций связаны представления о превращении веществ
Учение
о скоростях и механизмах химических реакций называется химической кинетикой.
Под
скоростью химической реакции понимают изменение концентрации одного из
реагирующих веществ в единицу времени при неизменном объеме системы.
При
этом безразлично, о каком из участвующих в реакции веществе идет речь: все они
связаны между собой уравнением реакции, и по изменению концентрации одного из
веществ можно судить о соответствующих изменениях концентраций всех остальных.
Обычно концентрацию выражают в моль/л, а время - в секундах или минутах. Если,
например, исходная концентрация одного из реагирующих веществ составляла 1
моль/л, а через 4 с от начала реакции она стала 0,6 моль/л, то средняя скорость
реакции будет равна (1 - 0,6)/4 = 0,1 моль/(л∙с).
Рассмотрим
в общем виде скорость реакции, протекающей по уравнению
А
+ В = С + D (I)
По
мере расходования вещества А скорость реакции уменьшается

Отсюда
следует, что скорость реакции может быть определена лишь для некоторого
промежутка времени. Так как концентрация вещества А в момент времени t1
измеряется величиной с1, а в момент t2 - величиной c2,
то за промежуток времени ∆t = t2 - t1 изменение концентрации вещества составит ∆с = с2
- с1, откуда определится средняя скорость реакции (  )
)

Знак
минус ставится потому, что, несмотря на убывание концентрации вещества А и,
следовательно, на отрицательное значение разности с2 - с1,
скорость реакции может быть только положительной величиной. Можно также следить
за изменением концентрации одного из продуктов реакции - веществ С или D; она в
ходе реакции будет возрастать, и потому в правой части уравнения нужно ставить
знак плюс.
Поскольку
скорость реакции все время изменяется, то в химической кинетике рассматривают
только истинную скорость реакции v, т.е. скорость в данный момент времени.
Влияние природы веществ на скорость химических реакций очень велико. Например,
процесс превращения гранита в глину, тек называемое выветривание горных пород,
протекает на протяжении тысячелетий. Природа бутылочного или оконного стекла,
полиэтилена и других веществ, созданных человеком, такова, что эти вещества
практически не разлагаются или разлагаются чрезвычайно медленно. Вот и
приходится человеку находить способы их утилизации, например сжигать. И как
мудро распорядилась эволюция, когда предусмотрела для человека и большинства
животных в качестве транспортирующего кислород вещества гемоглобин крови,
который уже при комнатной температуре способен соединяться с кислородом воздуха
со значительной скоростью, а следовательно, и быстро доставлять его из легких в
тканях.
Сильное
изменение скорости реакции с изменением температуры объясняет теория активации.
Согласно этой теории в химическое взаимодействие вступают только активные
молекулы (частицы), обладающие энергией, достаточной для осуществления данной
реакции. Неактивные частицы можно сделать активными, если сообщить им необходимую
дополнительную энергию, - этот процесс называется активацией. Один из способов
активации - увеличение температуры: при повышении температуры число активных
частиц сильно возрастает, благодаря чему резко увеличивается скорость.
Энергия,
которую надо сообщить молекулам (частицам) реагирующих веществ, чтобы
превратить их в активные, называется энергией активации.
Ее
определяют опытным путем, обозначают буквой Еa и обычно выражают в
кДж/моль. Так, например, для соединения водорода и иода (Н2 + I2 = 2НI) Еа = 167,4 кДж/моль, а для распада
иодоводорода (2НI = Н2 + I2) Еа = 186,2 кДж/моль.
Энергия
активации Еa зависит
от природы реагирующих веществ и служит характеристикой каждой реакции. Эти
представления поясняются рисунком

На
примере реакции в общем виде А2 + В2 = 2АВ. Ось ординат
характеризует потенциальную энергию системы, ось абсцисс - ход реакции:
исходное состояние → переходное состояние → конечное состояние.
Чтобы реагирующие вещества А2 и В2 образовали продукт
реакции АВ, они должны преодолеть энергетический барьер С. На это затрачивается
энергия активации Еа, на значение которой возрастает энергия
системы. При этом в ходе реакции из частиц реагирующих веществ образуется
промежуточная неустойчивая группировка, называемая переходным состоянием или
активированным комплексом (в точке С), последующий распад которого приводит к
образованию конечного продукта АВ. Механизм реакции можно изобразить схемой
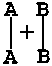



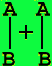
исходные реагенты (начальное состояние системы) активированный комплекс
(переходное состояние) продукты реакции (конечное состояние системы)
Если при распаде активированного комплекса выделяется больше энергии, чем
это необходимо для активации частиц, то реакция экзотермическая. Примером
эндотермической реакции служит обратный процесс - образование из вещества АВ
веществ А2 и В2: 2АВ = А2 + В2. В
этом случае процесс протекает также через образование активированного комплекса
А2В2, однако энергия активации больше, чем для прямого
процесса: Еа = Еа + ∆H (∆H - тепловой эффект реакции). Для протекания
эндотермических реакций требуется подвод энергии извне.
Как видно из рисунка

Разность
энергий конечного состояния системы (Hкон) и начального (Hнач) равна тепловому
эффекту реакции:
∆H = Hкон - Hнач.
Скорость
реакции непосредственно зависит от значения энергии активации: если оно мало,
то за определенное время протекания реакции энергетический барьер преодолеет
большое число частиц и скорость реакции будет высокой, но если энергия
активации велика, то реакция идет медленно.
При
взаимодействии ионов энергия активации очень мала и ионные реакции протекают с
очень большой скоростью (практически мгновенно).
Уравне́ние Арре́ниуса устанавливает зависимость константы скорости химической реакции
<#"526429.files/image021.gif">от температуры
<#"526429.files/image022.gif">.
Согласно
простой модели столкновений химическая реакция между двумя исходными веществами
может происходить только в результате столкновения молекул
<#"526429.files/image023.gif">), чтобы этот барьер преодолеть. Из распределения
Больцмана <#"526429.files/image024.gif">, пропорционально

В
результате скорость химической реакции представляется уравнением, которое было
получено шведским химиком Сванте Аррениусом
<#"526429.files/image026.gif">
Здесь
 характеризует частоту столкновений реагирующих
молекул,
характеризует частоту столкновений реагирующих
молекул,  универсальная газовая постоянная
<#"526429.files/image027.gif">зависит
от температуры, но эта зависимость достаточно медленная
универсальная газовая постоянная
<#"526429.files/image027.gif">зависит
от температуры, но эта зависимость достаточно медленная

Оценки
этого параметра показывают, что изменение температуры в диапазоне от 200 °C до
300 °C приводит к изменению частоты столкновений A на 10 %.
В
рамках теории активированного комплекса получаются другие зависимости  от температуры, но во всех случаях более слабые, чем
экспонента.
от температуры, но во всех случаях более слабые, чем
экспонента.
Уравнение
Аррениуса стало одним из основных уравнений химической кинетики, а энергия
активации - важной количественной характеристикой реакционной способности
веществ.
.
Зависимость скорости реакции от температуры определяют в соответствии с так называемым
«правилом Вант-Гоффа», которое в 19 в. сформулировал голландский химик Якоб
Вант-Гофф
<#"526429.files/image030.gif"> 4 раза.
Математически это означает, что скорость реакции зависит от температуры
степенным образом

Правило
Вант-Гоффа: при повышении Т на  скорость
хим. реакции увеличивается в 2-4 раза. Математически это правило можно
записать:
скорость
хим. реакции увеличивается в 2-4 раза. Математически это правило можно
записать:  ,
, 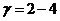 ,
, 
 - температурный коэффициент хим. реакции. Правило
Вант-Гоффа является приближённым и его обычно используют для приблизительно
оценки скорости при изменении температуры. Более точным является уравнение
Аррениуса, по которому
- температурный коэффициент хим. реакции. Правило
Вант-Гоффа является приближённым и его обычно используют для приблизительно
оценки скорости при изменении температуры. Более точным является уравнение
Аррениуса, по которому
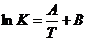
Они
могут быть вычислены по значению констант скорости при 2-х различных Т. При  :
:  (1). При
(1). При
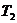 :
:  (2).
Вычитая из (1) (2) получаем
(2).
Вычитая из (1) (2) получаем  . Отсюда
можно выразить А. Зная А, по уравнению (1) или (2) вычисляют В.
. Отсюда
можно выразить А. Зная А, по уравнению (1) или (2) вычисляют В.
.
КАТАЛИЗ - процесс, заключающийся в изменении скорости химических реакций в
присутствии веществ, называемых катализаторами
Катализаторы
- вещества, изменяющие скорость химической реакции, которые могут участвовать в
реакции, входить в состав промежуточных продуктов, но не входят в состав
конечных продуктов реакции и после окончания реакции остаются неизменными.
Каталитические
реакции - реакции, протекающие в присутствии катализаторов. Понятие о катализе
и катализаторах
Увеличить
скорость реакции можно с помощью катализаторов. Применять катализаторы
выгоднее, чем повышать температуру, тем более, что ее повышение далеко не
всегда возможно.
Катализаторами
называются вещества, изменяющие скорость химической реакции, но сохраняющие при
этом свои свойства и состав. Сам катализатор в реакциях не расходуется и в
конечные продукты не входит.
Одни
катализаторы ускоряют реакцию - положительный катализ, или просто катализ,
другие - замедляют - отрицательный катализ. Примером положительного катализа
может служить получение серной кислоты, окислением аммиака в азотную кислоту с
помощью платинового катализатора и др.
Примером
отрицательного катализа является замедление взаимодействия раствора сульфита
натрия с кислородом воздуха в присутствии этилового спирта или уменьшение
скорости разложения пероксида водорода в присутствии небольших количеств серной
кислоты и др. Отрицательный катализ часто называют ингибированием, а
отрицательные катализаторы, снижающие скорость реакции - ингибиторами (механизм
действия последних отличен от действия катализаторов).
Химические
реакции, протекающие при участии катализаторов, называются каталитическими.
Различают два вида катализа - гомогенный (однородный) и гетерогенный
(неоднородный) катализ.
При
гомогенном катализе реагирующие вещества и катализатор образуют однофазную
систему - газовую или жидкую, между катализатором и реагирующими веществами
отсутствует поверхность раздела. Например, каталитическое разложение пероксида
водорода в присутствии раствора солей (жидкая фаза). Для гомогенного катализа
установлено, что скорость химической реакции пропорциональна концентрации
катализатора.
При
гетерогенном катализе реагирующие вещества и катализатор образуют систему из
разных фаз. В этом случае между катализатором и реагирующими веществами
существует поверхность раздела. Обычно катализатор - твердое вещество, а
реагирующие вещества - газы или жидкость. Примером может служит окисление
аммиака (газообразная фаза) в присутствии платины (твердая фаза). Все реакции при
гетерогенном катализе протекают на поверхности катализатора. Поэтому активность
твердого катализатора зависит и от свойств его поверхности (размера,
химического состава, строения и состояния). На поверхности катализатора имеются
активные центры, реагирующие вещества адсорбируются на них, происходит
деформация молекул, ослабевают связи между атомами и молекулы становятся
активными.
Механизм
действия катализаторов обычно объясняют образованием промежуточных соединений с
одним из реагирующих веществ. Рассмотрим схему действия катализатора на
следующем примере:
Основной
химический процесс:
А
+ В = АВ; SO2 + 1/2O2 = SO3
Образование
промежуточного соединения одного из исходных веществ с катализатором:
К
+ А = КА; NO + 1/2O2 = NO2 (катализатор)
Взаимодействие
промежуточного соединения со вторым исходным веществом и освобождение
катализатора:
КА
+ В = АВ + К; NO2 + SO2 = SO3 + NO
(катализатор)
Катализатор
разбивает ход химической реакции на несколько стадий. Соответственно у каждой
стадии имеется свой энергетический барьер. В сумме он составляет энергию
активации (Еа). За счет снижения энергетических барьеров по стадиям
реакции протекают с большими скоростями.
Некоторые
вещества снижают или полностью уничтожают активность твердого катализатора.
Такие вещества называются каталитическими ядами. В качестве примера можно
привести соединения мышьяка, ртути, свинца, цианистые соединения, к которым
особенно чувствительны платиновые катализаторы
Однако
имеются и такие вещества, которые усиливают действие катализаторов, хотя сами
катализаторами не являются. Эти вещества называются промоторами (промотирование
платиновых катализаторов добавками железа, алюминия и др.).
Следует
особо отметить, что действие катализаторов избирательно, поэтому из одного и
того же вещества можно получить разные продукты.
Особую
роль играют биологические катализаторы - ферменты.
При
их участии протекают сложные химические процессы в растительных и животных
организмах.
.
Понятие обратимого и необратимого процесса
Научно
целесообразным представляется установить разграничение динамических процессов
на эволюционные (иначе неповторимые, или необратимые) и волнообразные
(повторимые, или обратимые). Под эволюционными, или необратимыми, процессами мы
понимаем те изменения, которые при отсутствии резких посторонних
пертурбационных воздействий протекают в определенном и в одном и том же
направлении. Как например, можно указать на постоянную тенденцию роста
населения, увеличение общего объема производства и др.
Замечу,
что, называя некоторые динамические процессы эволюционными, неповторимыми или
необратимыми, а другие обратимыми, я совершенно не имею здесь в виду известного
противопоставления идиографической и номографической точек зрения. Все
построения находятся в плоскости общей теории и не имеют ничего общего с
идиографией. Идиографическая точка зрения исключает возможность установления
закономерностей. Но когда говорится об эволюционном, или неповторимом,
процессе, то не отрицается возможности установления общей закономерности этого
процесса. Процесс этот неповторяем лишь в том смысле, что он, имея определенное
направление, не может иметь двух или более звеньев, стоящих на одном и том же
уровне или находящихся в одном и том же состоянии. Но это не значит, что не
может быть найдена формула, выражающая закон перехода его от одного звена к
другому. Примером такой формулы могла бы служить известная формула
развертывающегося ряда 1, 2, 4, 8, ..., 2n или какая-либо другая. Это не значит
также, что процесс этот, сам по себе неповторимый в данном месте и времени, не
может с номографической точки зрения повториться в другом месте или в другое
время.
Под
волнообразными (повторимыми, или обратимыми) процессами понимаются те процессы
изменений, которые в каждый данный момент имеют свое направление и, следовательно,
постоянно меняют его, при которых явление, находясь в данный момент в данном
состоянии и затем меняя его, рано или поздно может вновь вернуться к исходному
состоянию. Примером таких процессов могут служить процессы изменения товарных
цен, процента, на капитал, процента безработных и т. д. Действительно,
указанные элементы экономической жизни могут изменяться в различных
направлениях. Если рассматривать их изменения как непрерывные, то процесс этих
изменений можно изобразить в виде кривой, направление которой в различные
моменты будет различно. Рассматривая такую кривую, легко видеть, что,
отправляясь от точки, стоящей на определенной высоте, через некоторое время она
может пройти через точку, стоящую на той же высоте.
Правда,
это будет не та же точка в строгом смысле слова: вторая точка, стоящая на том
же уровне, что и первая, будет, однако, отвечать другому моменту времени и,
конечно, другой комбинации общих экономических условий в производстве,
распределении, спросе, предложении и т. д. Для того чтобы вторая точка в полном
смысле совпала с первой, необходимо было бы, чтобы все процессы изменений
экономической действительности были обратимы, чтобы они все могли так же
развиваться вперед, как и развертываться назад,- иначе говоря, чтобы к ним была
неприложима категория времени. Совершенно очевидно, что такой абсолютной
обратимости в экономической жизни нет, что в ней есть по крайней мере некоторые
заведомо необратимые процессы. И поскольку все процессы ее взаимно связаны
между собой, поскольку надо брать каждый отдельный процесс по связи с другими,
и в том числе необратимыми, постольку в каждый новый момент времени том или
ином отношении будет новая комбинацию условий, постольку надо признать, что все
процессы экономической жизни необратимы. Но в таком случае необходимо было бы
на тех же основаниях признать, что необратимы и все процессы изменений природы.
Однако предыдущие замечания позволяют отвергнуть лишь мысль об абсолютной и
всеобщей обратимости. Действительно, как бы то ни было, нельзя отрицать существенного
различия между теми процессами, при которых явления без вмешательства
пертурбационных факторов, хотя бы и в другой момент времени и при иных общих
условиях, могут оказаться на прежнем уровне, и теми процессами, при которых
явления не могут оказаться на том же уровне.
Если
первую серию процессов надо брать как таковую, отвлекаясь от второй серии
процессов, то первая серия их может быть названа обратимыми процессами. Говоря
об отвлечении от второй серии, не утверждается, что в действительности те и другие
процессы протекают раздельно и независимо. Признается лишь их принципиальное
различие и подчеркивается разделение в порядке научного анализа. Чтобы
подчеркнуть эту мысль, было бы правильно поэтому говорить не об абсолютно, а об
относительно обратимых процессах в экономической жизни. Итак, в относительном
смысле мы можем говорить об обратимых процессах изменений элементов
экономической жизни.
Идеи
необратимых и обратимых процессов, так же как и идеи статики и динамики,
принадлежат, в сущности говоря, естествознанию в узком смысле слова, физике и
химии , идеи эти имеют в них очень большое значение.
ХИМИЧЕСКОЕ
РАВНОВЕСИЕ - состояние химической системы, при котором возможны реакции, идущие
с равными скоростями в противоположных направлениях. При химическом равновесии
концентрации реагентов, температура и другие параметры системы не изменяются со
временем.
Необратимые
и обратимые реакции. Если слить растворы кислоты и щелочи, образуется соль и
вода, например,
HCl
+ NaOH = NaCl + H2O
и
если вещества были взяты в нужных пропорциях, раствор имеет нейтральную реакцию
и в нем не остается даже следов соляной кислоты и гидроксида натрия. Если
попытаться провести реакцию в растворе между образовавшимися веществами -
хлоридом натрия и водой, то никаких изменений не обнаружится. В подобных
случаях говорят, что реакция кислоты со щелочью необратима, т.е. обратная
реакция не идет. Практически необратимы при комнатной температуре очень многие
реакции, например,
+
Cl2 = 2HCl, 2H2 + O2 = 2H2O и др.
Многие
реакции обратимы уже в обычных условиях, это означает, что в заметной степени
протекает обратная реакция. Например, если попытаться нейтрализовать щелочью
водный раствор очень слабой хлорноватистой кислоты, то окажется, что реакция
нейтрализации до конца не идет и раствор имеет сильнощелочную среду. Это
означает, что реакция HClO + NaOH NaClO + H2O обратима, т.е. продукты этой
реакции, реагируя друг с другом, частично переходят в исходные соединения. В
результате раствор имеет щелочную реакцию. Обратима реакция образования сложных
эфиров (обратная реакция называется омылением): RCOOH + R"OH RCOOR" +
H2O, многие другие процессы.
Как
и многие другие понятия в химии, понятие обратимости во многом условно. Обычно
необратимой считают реакцию, после завершения которой концентрации исходных
веществ настолько малы, что их не удается обнаружить (конечно, это зависит от
чувствительности методов анализа). При изменении внешних условий (прежде всего
температуры и давления) необратимая реакция может стать обратимой и наоборот.
Так, при атмосферном давлении и температурах ниже 1000° С реакцию 2Н2 + О2 =
2Н2О еще можно считать необратимой, тогда как при температуре 2500° С и выше
вода диссоциирует на водород и кислород примерно на 4%, а при температуре 3000°
С - уже на 20%.
В
конце 19 в. немецкий физикохимик Макс Боденштейн (1871-1942) детально изучил
процессы образования и термической диссоциации иодоводорода
+
I2 2HI
Изменяя
температуру, он мог добиться преимущественного протекания только прямой или
только обратной реакции, но в общем случае обе реакции шли одновременно в
противоположных направлениях. Подобных примеров множество. Один из самых
известных - реакция синтеза аммиака 3H2 + N2 2NH3; обратимы и многие другие
реакции, например, окисление диоксида серы 2SO2 + O2 2SO3, реакции органических
кислот со спиртами и т.д.
Скорость
реакции и равновесие. Пусть есть обратимая реакция A + B C + D. Если
предположить, что прямая и обратная реакция проходят в одну стадию, то скорости
этих реакций будут прямо пропорциональны концентрациям реагентов: скорость
прямой реакции v1 = k1[A][B], скорость обратной реакции v2 = k2[C][D]
(квадратными скобками обозначены молярные концентрации реагентов). Видно, что
по мере протекания прямой реакции концентрации исходных веществ А и В
снижаются, соответственно, уменьшается и скорость прямой реакции. Скорость же
обратной реакции, которая в начальный момент равна нулю (нет продуктов C и D),
постепенно увеличивается. Рано или поздно наступит момент, когда скорости
прямой и обратной реакций сравняются. После этого концентрации всех веществ -
А, В, С и D не изменяются со временем. Это значит, что реакция достигла
положения равновесия, а неизменяющиеся со временем концентрации веществ
называются равновесными. Но, в отличие от механического равновесия, при котором
всякое движение прекращается, при химическом равновесии обе реакции - и прямая,
и обратная - продолжают идти, однако их скорости равны и поэтому кажется, что
никаких изменений в системе не происходит.
Доказать
протекание прямой и обратной реакций после достижения равновесия можно
множеством способов. Например, если в смесь водорода, азота и аммиака,
находящуюся в положении равновесия, ввести немного изотопа водорода - дейтерия
D2, то чувствительный анализ сразу обнаружит присутствие атомов дейтерия в
молекулах аммиака. И наоборот, если ввести в систему немного дейтерированного
аммиака NH2D, то дейтерий тут же появится в исходных веществах в виде молекул
HD и D2. Другой эффектный опыт был проведен на химическом факультете МГУ.
Серебряную пластинку поместили в раствор нитрата серебра, при этом никаких
изменений не наблюдалось. Затем в раствор ввели ничтожное количество ионов
радиоактивного серебра, после чего серебряная пластинка стала радиоактивной.
Эту радиоактивность не могло «смыть» ни споласкивание пластинки водой, ни
промывание ее соляной кислотой. Только травление азотной кислотой или
механическая обработка поверхности мелкой наждачной бумагой сделало ее
неактивной. Объяснить этот эксперимент можно единственным образом: между
металлом и раствором непрерывно происходит обмен атомами серебра, т.е. в
системе идет обратимая реакция
(тв)
- е- = Ag+
Поэтому
добавление радиоактивных ионов Ag+ к раствору приводило к их «внедрению» в
пластинку в виде электронейтральных, но по-прежнему радиоактивных атомов.
Таким
образом, равновесными бывают не только химические реакции между газами или
растворами, но и процессы растворения металлов, осадков.
Например,
твердое вещество быстрее всего растворяется, если его поместить в чистый
растворитель, когда система далека от равновесия, в данном случае - от
насыщенного раствора. Постепенно скорость растворения снижается, и одновременно
увеличивается скорость обратного процесса - перехода вещества из раствора в
кристаллический осадок. Когда раствор становится насыщенным, система достигает
состояния равновесия, при этом скорости растворения и кристаллизации равны, а
масса осадка со временем не меняется.
Константа
равновесия. Важнейший параметр, характеризующий обратимую химическую реакцию -
константа равновесия К. Если записать для рассмотренной обратимой реакции A + D
C + D условие равенства скоростей прямой и обратной реакции в состоянии
равновесия -
[A]равн[B]равн
= k2[C]равн[D]равн,
откуда
[C]равн[D]равн/[A]равн[B]равн = k1/k2 = К
К
называется константой равновесия химической реакции.
Итак,
при равновесии отношение концентрации продуктов реакции к произведению
концентрации реагентов постоянно, если постоянна температура (константы
скорости k1 и k2 и, следовательно, константа равновесия К зависят от
температуры, но не зависят от концентрации реагентов). Если в реакции участвуют
несколько молекул исходных веществ и образуется несколько молекул продукта (или
продуктов), концентрации веществ в выражении для константы равновесия
возводятся в степени, соответствующие их стехиометрическим коэффициентам. Так
для реакции 3H2 + N2 2NH3 выражение для константы равновесия записывается в
виде K = [NH3]2 равн/[H2]3равн[N2]равн. Описанный способ вывода константы
равновесия, основанный на скоростях прямой и обратной реакций, в общем случае
использовать нельзя, так как для сложных реакций зависимость скорости от
концентрации обычно не выражается простым уравнением или вообще неизвестна. Тем
не менее, в термодинамике доказывается, что конечная формула для константы
равновесия оказывается верной.
Для газообразных соединений вместо концентраций при записи константы равновесия
можно использовать давление; очевидно, численное значение константы при этом
может измениться, если число газообразных молекул в правой и левой частях
уравнения не одинаковы.
Графики,
показывающие, как система приближается к равновесию (такие графики называются
кинетическими кривыми), приведены на рисунках.
Расчётные
методы определения константы равновесия реакции обычно сводятся к вычислению
тем или иным способом стандартного изменения энергии Гиббса в ходе реакции (ΔG0), а затем использованию формулы

При
этом следует помнить, что энергия Гиббса - функция состояния
<#"526429.files/image046.gif">
В
подавляющем большинстве случаев константы скоростей прямой и обратной реакций
не равны. Константа равновесия - постоянная при данной температуре величина и
определяет соотношение между равновесными концентрациями продуктов реакции и
исходных веществ, возведенных в степени их стехиометрических коэффициентов.
Например,
для процесса N2 + 3H2 ↔ 2NH3

Квадратной
скобкой обозначена концентрация каждого вещества в момент равновесия, так
называемая равновесная концентрация.
Константа
равновесия зависит от природы реагирующих веществ и температуры. Катализатор не
влияет на состояние равновесия. Присутствие катализатора в системе лишь
изменяет время его достижения. В состоянии равновесия система может находиться
до тех пор, пока не изменится хотя бы одно из внешних воздействий: температура,
концентрация одного из реагентов, давление (для газов). Изменения, происходящие
в равновесной системе в результате внешних воздействий, определяются принципом
подвижного равновесия (принцип Ле-Шателье): внешнее воздействие на систему,
находящуюся в состоянии равновесия, приводит к смещению этого равновесия в
направлении, при котором эффект произведенного воздействия ослабляется.
На
смещение равновесия оказывает влияние:
)
изменение температуры: эндотермический процесс ускоряется в большей степени при
повышении температуры и, наоборот, при понижении температуры ускоряется
экзотермический процесс;
)
изменение давления (для реакций, протекающих в газовой фазе): при повышении
давления равновесие реакции смещается в направлении образования веществ,
занимающих меньший объем, и, наоборот, понижение давления способствует
процессу, сопровождающемуся увеличением объема. Если реакция протекает без
изменения объема, то изменение давления в системе не оказывает влияние на
химическое равновесие.
)
изменение концентрации: увеличение концентрации исходных веществ приводит к
увеличению скорости прямой реакции, при этом протекающий в системе процесс
завершится, когда скорости прямой и обратной реакций станут равны и установится
новое равновесие.
Уменьшение
концентрации одного из продуктов реакции (вывод из системы) приводит к смещению
равновесия в сторону его образования.
Критерием
принципиальной осуществимости реакций является неравенство ΔGp, T < 0. Но это неравенство не является еще полной
гарантией фактического течения процесса в данных условиях, не является
достаточным для оценки кинетических возможностей реакции. Так, ΔGо298, H2O(г)
= - 228,59 кДж/моль, а ΔGо298, AlI3(к)
= -313;8 кДж/моль и, следовательно, при Т = 298 К и р = 1,013 • 105
Па возможны реакции, идущие по уравнениям:
Н2(г)
+ ½О2(г) = Н2О
Однако
эти реакции при стандартных условиях идут только в присутствии катализатора
(платины для первой и воды для второй). Катализатор как бы снимает кинетический
"тормоз", и тогда проявляется термодинамическая природа вещества,
Скорость химических реакций зависит от многих факторов, основные из которых -
концентрация (давление) реагентов, температура и действие катализатора. Эти же факторы
определяют и достижение равновесия в реагирующей системе.
.
Модель атома Томсона
Первую
модель атома в 1903 г. предложил Джозеф Джон Томсон (1856 1940), создав ее
вскоре после открытия им же в 1895 - 1897 гг. электрона. Длительность времени
открытия электрона определяется продолжительностью проведения большой серии
многосложных экспериментов, которые он вместе со своими сотрудниками проводил в
Кавендишской лаборатории, которую с 1884 г. он же и возглавлял.
Представление
об электроне, как мельчайшей заряженной частице созрело не сразу. Известно, что
в экспериментах электроны предстают делокализованными, т.е. как бы размазанными
по всему объему пространства атома. Кроме того, почти сразу же стало понятно,
что масса электрона является переменной величиной; опыт Кауфмана, проведенный
несколькими годами позже, подтвердил то, о чем Томсон только смутно
догадывался. Позже он выведет формулу для массы электрона, движущегося со
скоростью, сопоставимой со скоростью света, которая количественно давала те же результаты,
что и релятивистская формула. У него же в экспериментах пока получалось так,
что величина массы тесно была связана с зарядом.
При
измерении величины заряда Томсон колебался, какую величину от измеренной
необходимо отнести на счет массы, а какую на счет заряда. Поэтому Томсон не
особенно торопился с выводами о существовании объекта, форму которого он себе
плохо представлял. В 1897 г. он мог уверенно говорить лишь о том, что отношение
электрического заряда к массе для частиц, которые образуют катодные лучи,
намного больше, чем для ионов водорода. Если предположить, что заряды их по
абсолютной величине равны, то, рассудил Томсон, масса катодных частиц должна
быть намного меньше массы атомов водорода. Когда представление об электроне у
него более или менее сложилось, он предложил модель «пудинга с изюмом».
Согласно этой модели, отрицательные электроны, образуя правильные конфигурации,
«плавают» в эфирной среде, заряженной положительно. О существовании
положительного ядра атома он тогда ничего не подозревал; ядро было открыто
несколько лет спустя.
Атом
Резерфорда.
Эрнест
Резерфорд родился 30 августа 1871 года в семье новозеландского фермера. Окончив
школу в Хавелоке, где в это время жила его семья, он получил стипендию для
продолжения образования в колледже провинции Нельсон, куда поступил в 1887
году. Через два года он сдал экзамен в Кентерберийский колледж - филиал
Новозеландского университета в Крайчестере. Резерфорд окончил колледж в 1893
году с отличием и получил степень магистра по физике и математике. В это время
Резерфорд занялся изучением магнитного действия электромагнитных волн. В 1894
году в «Известиях философского института Новой Зеландии» появилась его первая
печатная работа «Намагничивание железа высокочастотными разрядами». В 1895 году
оказалась вакантной стипендия для получения научного образования, первый
кандидат на эту стипендию отказался по семейным обстоятельствам, вторым
кандидатом был Резерфорд. Приехав в Англию, Резерфорд получил приглашение Дж.
Дж. Томсона работать в Кембридже в лаборатории Кавендиша. Так начался научный
путь Резерфорда.
Резерфорд,
продолжая свою работу над магнитным детектором, вместе с тем заинтересовался
исследованиями Томсона по электропроводимости газов. В 1896 году появляется
совместная работа Томсона и Резерфорда «О прохождении электричества через газы,
подвергнутые действию лучей Рентгена». В 1897 году выходит в свет
заключительная статья Резерфорда «Магнитный детектор электрических волн и
некоторые его применения». После этого он полностью сосредоточивает свои силы
на исследовании нового разряда. В том же, 1897 году появляется его новая работа
«Об электризации газов, подверженных действию рентгеновских лучей, и о
поглощении рентгеновского излучения газами и парами». Вероятно, Резерфорд и
Томсон вообще были одними из первых ученых, проявивших интерес к рентгеновским
лучам и считавших открытие Рентгена исключительно важным и многообещающим.
В
воскресенье 1 марта 1896 года Анри Беккерель обнаружил, что уран непрерывно
испускает проникающее излучение неизвестной природы, которая оказалась
совершенно отличной от природы рентгеновских лучей. Тем самым он обнаружил
существование радиоактивности, начавшее новую эпоху в истории науки и
человечества.
Сообщение
об открытии Беккерелем радиоактивности произвело большой эффект в Кавендишской
лаборатории, и Резерфорд решил немедленно заняться изучением этих загадочных
лучей. Сначала ему казалось, что существует какая-то связь между урановыми и
рентгеновскими лучами. Излучение урановых препаратов, как и рентгеновские лучи,
производило ионизацию воздуха. Такое сходство в воздействии излучений на
окружающую среду привело Резерфорда к мысли об опытном сравнении рентгеновских
и беккерелевых лучей, что могло дать наиболее достоверные и точные сведения об
их физических свойствах. Результатом этого явилась большая статья «Излучение
урана и созданная им электропроводность».
Опыты
продолжались почти год. Они показали, что сходства между двумя исследовавшимися
излучениями, несмотря на их одинаковое ионизирующее действие, нет. Резерфорд
также смог убедиться также в том, что предположение Беккереля о сходстве
урановых лучей со световыми ошибочно. Излучение урана вопреки заявлению
Беккереля (правда, не подкрепленному опытами) не обнаружило свойств,
характерных для света. Оно не подчинялось законам световой оптики: отражению,
преломлению и поляризации.
В
результате этих работ Резерфорда были открыты a-частицы. Резерфорд поместил
радиоактивный источник в магнитное поле и получил три вида излучений,
испускаемых ураном: a-, b-частицы и g-лучи.
Уже
при проведении этих опытов Резерфорд предвидел, что a-частицы помогут
исследовать структуру атома в качестве мощных инструментов для проникновения в
атом.
В
сентябре 1898 года Резерфорд был приглашен в университет Мак-Гила в Монреале
(Канада) в качестве профессора кафедры теоретической физики. В Монреале он
пробыл до 1907 года. Здесь он сделал фундаментальные открытия: им была открыта
эманация теория и разгадана природа так называемой «индуцированной
радиоактивности»; совместно с Содди он открыл радиоактивный распад и его закон.
Здесь им была написана книга «Радиоактивность». В Монреале он начал тщательные
исследования природы a-частиц, закончившееся уже в Манчестере полной разгадкой
их природы. Здесь же он начал свои исследования по происхождению a-частиц через
вещество.
Огромный
размах научной работы Резерфорда в Монреале принес ему славу первоклассного
исследователя. Им было опубликовано как лично, так и совместно с другими
учеными 66 статей, не считая книги «Радиоактивность». Он получает приглашение
занять кафедру в Манчестере. 24 мая 1907 года Резерфорд вернулся в Европу.
Начался новый период в его жизни.
Атом
Бора.
Идеи
о непримиримости законов классической механики и электродинамики во всей их
полноте к исследованию внутреннего строения атома высказывались и до Бора.
Мысли о необходимости учета квантового характера излучения были также не
новыми. Тем не менее именно Нильс Бор заслуженно считается пионером квантовой
теории атома. Имена его предшественников на этом пути - Никольсона, Штарка,
Бьеррума и других, на которых Бор не устает ссылаться в своих первых статьях,
сейчас мало кому известны. Это можно объяснить тем, что упомянутые авторы
достигали только частных результатов, не объединенных в сколько-нибудь стройную
систему, которая могла бы служить программой целого круга исследований и
допускала бы количественную проверку на опыте.
Нильс
Бор родился 7 октября 1885 года в семье профессора физиологии Копенгагенского
университета Христиана Бора. В 1903 году Бор поступил в Копенгагенский
университет. Еще в студенческие годы Бор выполнил конкурсную работу по
поверхностному натяжению. Работа была удостоена золотой медали Датской Академии
наук. В 1909 году, спустя два года после окончания Бором университета, эта
работа - «Определение поверхностного натяжения воды методом колебания струи» -
была опубликована в трудах Лондонского Королевского общества.
Весной
1911 года состоялась защита докторской диссертации Бора на тему «Анализ
электронной теории металла», в сентябре того же года Бор приехал на стажировку
в Кембридж к Дж.Дж. Томсону. Томсон в это время занимался анализом
положительных лучей. Им был разработан метод точного анализа - метод парабол, с
помощью которого он впервые обнаружил у неона существование двух разновидностей
атомов: с атомным весом 20 и 22. Продолжая эти исследования уже после войны,
ученик Томсона Астон открыл изотопы многих стабильных элементов. Исследования
самого Томсона были обобщены им в монографии «Лучи положительного электричества
и их применение к химическому анализу», вышедшей в 1913 году. Томсон поручил и
Бору провести эксперимент с положительными лучами. Бор собрал вакуумную
установку, однако дело дальше не пошло, и он начал готовить к изданию свою
докторскую диссертацию. Томсон отнесся без внимания к работе Бора и не прочитал
ее.
В
том же, 1911 году, когда Бор приехал в Кембридж, сотрудник Томсона Чарльз Томас
Рис Вильсон (1869-1959) изобрел замечательный прибор, известный ныне под
названием «камера Вильсона». Этот прибор позволяет видеть частицу по
оставляемому ею туманному следу. Резерфорд, приехавший на традиционный
ежегодный обед в Кембридж, в своей речи с энтузиазмом отозвался о приборе
Вильсона и полученных первых результатах. Бор, который впервые увидел
Резерфорда на этом обеде, вспоминал, «что наибольшее восхищение у Резерфорда,
как это он подчеркивал в своей речи, вызвала настойчивость, с которой Вильсон
[в то время они уже были связаны тесной дружбой в Кавендишской лаборатории]
продолжал свои исследования по образованию тумана с все более и более
усовершенствованными аппаратами». Великий исследователь ядра ясно видел
возможности, открываемые камерой Вильсона в изучении ядерных процессов. Позднее
в том же Кембридже ученик и сотрудник Резерфорда Блэккет (1897-1974) получил
вильсоновскую фотографию расщепления ядра азота a-частицей, первой ядерной
реакции, открытой Резерфордом.
Встреча
с Резерфордом произвела на Бора огромное впечатление. Вскоре по своим личным
делам он побывал в Манчестере, и ему удалось встретиться и побеседовать с
Резерфордом. «Во время беседы, в которой Резерфорд с подлинным энтузиазмом
говорил о многих новых перспективах развития физики, он любезно согласился на
мою просьбу о том, чтобы присоединиться к группе, работающей в его лаборатории,
после того как ранней весной 1912 года я должен был закончить свои занятия в
Кембридже; там я был сильно увлечен оригинальными идеями Дж.Дж. Томсона,
касающимися электронного строения атомов».
В
апреле 1912 года Бор приехал в Манчестер. История позаботилась о том, чтобы
создатель квантовой модели атома поработал сперва с автором первой модели
атома, а затем приехал к автору планетарной модели, чтобы на основе этой модели
создать теорию атома Резерфорда-Бора. Знаменитая статья Бора, в которой были
заключены основы этой теории, начиналась с указания на модели Резерфорда и Томсона
и обсуждения их особенностей и различий. Интересно следующее замечание Бора:
«Принципиальная разница между моделями атома, предложенными Томсоном и
Резерфордом, заключается в том обстоятельстве, что силы, действующие на
электрон в атоме Томсона, допускают определенные конфигурации и движение
элементов, при которых система находится в устойчивом равновесии: такие
конфигурации, очевидно, не существуют во второй модели атома. Природу этой
разницы можно, по-видимому, сделать предельно ясной, если заметить, что среди
величин, характеризующих первый атом, фигурирует некоторая величина - радиус
положительной сферы размерности длины и того же порядка, что и линейные размеры
атома, в то время как среди величин, характеризующих второй атом, - зарядов и
масс элементов положительного ядра - такой длины не только не имеется, но она
не может быть определена только с помощью этих последних величин». Иными
словами в модели Дж.Дж. Томсона определенность пространственных размеров атома
вытекает из жесткой количественной определенности элементарного свойства
положительно заряженной части атома, что было естественным с точки зрения
классического понимания категории структуры. В модели же Резерфорда
определенность размеров атома требовала количественной определенности элементарного
отношения (расстояние между ядром и самым удаленным электроном), в то время как
классическое понимание категории структуры устанавливало только качественную
определенность элементарных отношений.
. Классификация элементарных частиц
Унитарная симметрия. Классификация лептонов пока не представляет проблем,
большое же число адронов, известных уже в начале 50-х гг., явилось основанием
для поиска закономерностей в распределении масс и квантовых чисел барионов и
мезонов, которые могли бы составить основу их классификации. Выделение
изотопических мультиплетов адронов было первым шагом на этом пути. С
математической точки зрения группировка адронов в изотопические мультиплеты
отражает наличие у них симметрии, связанной с группой вращения (см. Группа),
более формально, с группой SU (2) - группой унитарных преобразований в
комплексном двумерном пространстве.
Предполагается, что эти преобразования действуют в некотором
специфическом внутреннем пространстве - "изотопическом пространстве",
отличном от обычного. Существование изотопического пространства проявляется
только в наблюдаемых свойствах симметрии. На математическом языке изотопические
мультиплеты суть неприводимые представления группы симметрии SU (2).
Концепция симметрии как фактора, определяющего существование различных
групп и семейств Э. ч., в современной теории является доминирующей при
классификации адронов и других Э. ч. Предполагается, что внутренние квантовые
числа Э. ч., позволяющие выделять те или иные группы частиц, связаны со
специальными типами симметрий, возникающими за счёт свободы преобразований в
особых "внутренних" пространствах. Отсюда и происходит название
"внутренние квантовые числа".
Внимательное рассмотрение показывает, что странные и обычные адроны в
совокупности образуют более широкие объединения частиц с близкими свойствами,
чем изотопические мультиплеты. Они называются супермультиплетами. Число частиц,
входящих в наблюдаемые супермультиплеты, равно 8 и 10. С точки зрения симметрий
возникновение супермультиплетов истолковывается как проявление существования у
адронов группы симметрии более широкой, чем группа SU (2), а именно: SU (3) -
группы унитарных преобразований в трёхмерном комплексном пространстве (М.
Гелл-Ман и независимо Ю. Нееман, 1961). Соответствующая симметрия получила назв.
унитарной симметрии. Группа SU (3)имеет, в частности, неприводимые
представления с числом компонент 8 и 10, отвечающие наблюдаемым
супермультиплетам: октету и декуплету. Примерами могут служить следующие группы
частиц с одинаковыми значениями J P:
Общими для всех частиц в супермультиплете являются значения двух величин,
которые по математической природе близки к изотопическому спину и поэтому часто
называются унитарным спином.
Для октета значения связанных с этими величинами квантовых чисел равны
(1, 1), для декуплета - (3, 0).
Унитарная симметрия менее точная, чем изотопическая симметрия. В
соответствии с этим различие в массах частиц, входящих в октеты и декуплеты,
довольно значительно. По этой же причине разбиение адронов на супермультиплеты
сравнительно просто осуществляется для Э. ч. не очень высоких масс. При больших
массах, когда имеется много различных частиц с близкими массами, это разбиение
осуществляется менее надёжно. Однако в свойствах Э. ч. имеется много
разнообразных проявлений унитарной симметрии.
Включение в систематику Э. ч. очарованных адронов позволяет говорить о
сверхсупермультиплетах и о существовании ещё более широкой симметрии, связанной
с унитарной группой SU (4). Примеры до конца заполненных сверхсупермультиплетов
пока отсутствуют. SU (4)-симметрия нарушена ещё сильнее, чем SU (3)-симметрия,
и её проявления выражены слабее.
Обнаружение у адронов свойств симметрии, связанных с унитарными группами,
и закономерностей разбиения на мультиплеты, отвечающих строго определённым
представлениям указанных групп, явилось основой для вывода о существовании у
адронов особых структурных элементов - кварков.
Кварковая модель адронов. Развитие работ по классификации адронов с
первых своих шагов сопровождалось попытками выделить среди них частицы более
фундаментальные, чем остальные, которые могли бы стать основой для построения
всех адронов. Начало этой линии исследования было положено Э. Ферми и Ян
Чжэнь-нином (1949), которые предположили, что такими фундаментальными частицами
являются нуклон (N) и антинуклон ( ), a p-мезоны есть их связанные
состояния ( ). При дальнейшем развитии этой идеи в число
фундаментальных частиц были включены также странные барионы (М. А. Марков,
1955; японский физик С. Саката, 1956; Л. Б. Окунь, 1957). Модели, построенные
на этой основе, хорошо описывали мезонные мультиплеты, но не давали правильного
описания мультиплетов барионов.
Важнейший элемент данных моделей - использование для
"построения" адронов небольшого числа фермионов - органически вошёл в
модель, которая наиболее успешно решает задачу описания всех адронов, -
кварковую модель (австрийский физик Г. Цвейг и независимо М. Гелл-Ман, 1964).
В первоначальном варианте в основу модели было положено предположение,
что все известные адроны построены из трёх типов частиц спина 1/2,
названных р-, n-, l-кварками, не принадлежащих к числу наблюдавшихся адронов и
обладающих весьма необычными свойствами. Название "кварки"
заимствовано из романа Дж. Джойса (см. Кварки). Современный вариант модели
предполагает существование как минимум четырёх типов кварков. Четвёртый кварк
необходим для описания очарованных адронов.
Идея кварков подсказана унитарной симметрией. Математическая структура
унитарных групп открывает возможность описания всех представлений группы SU (n)
(и, следовательно, всех мультиплетов адронов) на основе самого простого
представления группы, содержащего n компонент. В случае группы SU (3)таких
компонент три. Необходимо только допустить наличие частиц, связанных с этим
простейшим представлением. Эти частицы и есть кварки. Кварковый состав мезонов
и барионов был выведен из того факта, что супермультиплеты мезонов содержат,
как правило, 8 частиц, а барионов - 8 и 10 частиц. Эта закономерность легко
воспроизводится, если предположить, что мезоны составлены из кварка q и антикварка
- символически: , а барионы из трёх кварков - символически: В = (qqq). В силу
свойств группы SU (3) 9 мезонов разбиваются на супермультиплеты из 1 и 8
частиц, а 27 барионов - на супермультиплеты, содержащие 1, 10 и дважды по 8
частиц, что и объясняет наблюдаемую выделенность октетов и декуплетов.
Добавление к схеме четвёртого кварка (и, если окажется необходимым, новых
дополнительных кварков) осуществляется при сохранении основного предположения
кварковой модели о строении адронов
В = (qqq)
Все экспериментальные данные хорошо соответствуют приведённому кварковому
составу адронов. Имеются, видимо, лишь небольшие отклонения от этой структуры,
которые не влияют существенным образом на свойства адронов.
Указанная структура адронов и математические свойства кварков, как
объектов, связанных с определённым (простейшим) представлением группы SU (4),
приводят к след. квантовым числам кварков (табл. 2).
Обращают внимание необычные - дробные - значения электрического заряда Q,
а также В, S и Y, не встречающиеся ни у одной из наблюдавшихся Э. ч. С индексом
a у каждого типа кварка qi (i = 1, 2, 3, 4) связана особая
характеристика кварков - "цвет", которой нет у изученных адронов.
Индекс a принимает значения 1, 2, 3, т, е. каждый тип кварка qi представлен
тремя разновидностями qia (Н. Н. Боголюбов с
сотрудниками, 1965; американские физики И. Намбу и М. Хан, 1965; японский физик
И. Миямото, 1965). Квантовые числа каждого типа кварка не меняются при
изменении "цвета" и поэтому табл. 2 относится к кваркам любого
"цвета".
Всё многообразие адронов возникает за счёт различных сочетаний р-, п-, g-
и с-кварков, образующих связанные состояния. Обычным адронам соответствуют
связанные состояния, построенные только из р- и n-кварков [для мезонов с
возможным участием комбинаций и ]. Наличие в связанном состоянии наряду с р- и
n-кварками одного g- или с-кварка означает, что соответствующий адрон странный
(S = -1) или очарованный (Ch = + 1). В состав бариона может входить два и три g
-кварка (соответственно с-кварка), т. е. возможны дважды и трижды странные
(очарованные) барионы. Допустимы также сочетания различного числа g- и
с-кварков (особенно в барионах), которые соответствуют "гибридным"
формам адронов ("странно-очарованным"). Очевидно, что чем больше g- или
с-кварков содержит адрон, тем он тяжелее.
Если сравнивать основные (не возбуждённые) состояния адронов, именно
такая картина и наблюдается (см. табл. 1, а также табл. 3 и 5).
Поскольку спин кварков равен 1/2, приведённая выше
кварковая структура адронов имеет своим следствием целочисленный спин у мезонов
и полуцелый - у барионов, в полном соответствии с экспериментом. При этом в
состояниях, отвечающих орбитальному моменту l = 0, в частности в основных
состояниях, значения спина мезонов должны равняться 0 или 1 (для антипараллельной
ґ¯ и параллельной ґґ
ориентации спинов кварков), а спина барионов - 1/2 или 3/2
(для спиновых конфигураций ¯ґґ и ґґґ). С учётом того,
что внутренняя чётность системы кварк-антикварк отрицательна, значения JP
для мезонов при l = 0 равны 0- и 1-, для барионов - 1/2+
и 3/2+. Именно эти значения JP
наблюдаются у адронов, имеющих наименьшую массу при заданных значениях I и Y
(см. табл. 1).
Поскольку индексы i, k, l в структурных формулах пробегают значения 1, 2,
3, 4, число мезонов Mik с заданным спином должно быть равно 16. Для
барионов Bikl максимально возможное число состояний при заданном
спине (64) не реализуется, т. к. в силу принципа Паули при данном полном спине
разрешены только такие трёхкварковые состояния, которые обладают вполне
определённой симметрией относительно перестановок индексов i, k, 1, а именно:
полностью симметричные для спина 3/2 и смешанной
симметрии для спина 1/2. Это условие при l = 0 отбирает
20 барионных состояний для спина 3/2 и 20 - для спина 1/2.
Более подробное рассмотрение показывает, что значение кваркового состава
и свойств симметрии кварковой системы даёт возможность определить все основные
квантовые числа адрона (J, Р, В, Q, I, Y, Ch), за исключением массы;
определение массы требует знания динамики взаимодействия кварков и массы
кварков, которое пока отсутствует.
Правильно передавая специфику адронов с наименьшими массами и спинами при
заданных значениях Y и Ch, кварковая модель естественным образом объясняет
также общее большое число адронов и преобладание среди них резонансов.
Многочисленность адронов - отражение их сложного строения и возможности
существования различных возбуждённых состояний кварковых систем. Не исключено,
что число таких возбуждённых состояний неограниченно велико. Все возбуждённые
состояния кварковых систем неустойчивы относительно быстрых переходов за счёт
сильных взаимодействий в нижележащие состояния. Они и образуют основную часть
резонансов. Небольшую долю резонансов составляют также кварковые системы с
параллельной ориентацией спинов (за исключением W-). Кварковые
конфигурации с антипараллельной ориентацией спинов, относящиеся к осн.
состояниям, образуют квазистабильные адроны и стабильный протон.
Возбуждения кварковых систем происходят как за счёт изменения
вращательного движения кварков (орбитальные возбуждения), так и за счёт
изменения их пространств. расположения (радиальные возбуждения). В первом
случае рост массы системы сопровождается изменением суммарного спина J и
чётности Р системы, во втором случае увеличение массы происходит без изменения
JP. Например, мезоны с JP = 2+ являются первым
орбитальным возбуждением (l = 1) мезонов с JP = 1-.
Соответствие 2+ мезонов и 1-мезонов одинаковых кварковых
структур хорошо прослеживается на примере многих пар частиц:
Мезоны r' и y' - примеры радиальных возбуждений r- и y-мезонов
соответственно (см.
Орбитальные и радиальные возбуждения порождают последовательности
резонансов, отвечающие одной и той же исходной кварковой структуре. Отсутствие
надёжных сведений о взаимодействии кварков не позволяет пока производить
количественные расчеты спектров возбуждений и делать какие-либо заключения о
возможном числе таких возбуждённых состояний. При формулировке кварковой модели
кварки рассматривались как гипотетические структурные элементы, открывающие
возможность очень удобного описания адронов. В дальнейшем были проведены
эксперименты, которые позволяют говорить о кварках как о реальных материальных
образованиях внутри адронов. Первыми были эксперименты по рассеянию электронов
нуклонами на очень большие углы. Эти эксперименты (1968), напоминающие
классические опыты Резерфорда по рассеянию a-частиц на атомах, выявили наличие
внутри нуклона точечных заряженных образований. Сравнение данных этих
экспериментов с аналогичными данными по рассеянию нейтрино на нуклонах (1973-75)
позволило сделать заключение о средней величине квадрата электрического заряда
этих точечных образований. Результат оказался удивительно близким к величине 1/2[(2/3
e)2+(1/3e)2]. Изучение
процесса рождения адронов при аннигиляции электрона и позитрона, который
предположительно идёт через последовательность процессов: ® адроны, указало на
наличие двух групп адронов, генетически связанных с каждым из образующихся
кварков, и позволило определить спин кварков. Он оказался равным 1/2. Общее
число рожденных в этом процессе адронов свидетельствует также о том, что в
промежуточном состоянии возникают кварки трёх разновидностей, т. е. кварки
трёхцветны.
Т. о., квантовые числа кварков, введённые на основании теоретических
соображений, получили подтверждение в ряде экспериментов. Кварки постепенно
приобретают статус новых Э. ч. Если дальнейшие исследования подтвердят это
заключение, то кварки являются серьёзными претендентами на роль истинно Э. ч.
для адронной формы материи. До длин ~ 10-15 см кварки выступают как
точечные бесструктурные образования. Число известных видов кварков невелико. В
дальнейшем оно может, конечно, измениться: нельзя поручиться за то, что при
более высоких энергиях не будут обнаружены адроны с новыми квантовыми числами,
обязанные своим существованием новым типам кварков. Обнаружение Y -мезонов
подтверждает эту точку зрения. Но вполне возможно, что увеличение числа кварков
будет небольшим, что общие принципы накладывают ограничения на полное число
кварков, хотя эти ограничения пока неизвестны. Бесструктурность кварков также,
возможно, отражает лишь достигнутый уровень исследования этих материальных
образований. Однако ряд специфических особенностей кварков даёт некоторые
основания предполагать, что кварки являются частицами, замыкающими цепь структурных
составляющих материи.
От всех других Э. ч. кварки отличаются тем, что в свободном состоянии они
пока не наблюдались, хотя имеются свидетельства их существования в связанном
состоянии. Одной из причин ненаблюдения кварков может быть их очень большая
масса, что препятствует их рождению при энергиях современных ускорителей. Не
исключено, однако, что кварки принципиально, в силу специфики их
взаимодействия, не могут находиться в свободном состоянии.
Существуют доводы теоретического и экспериментального характера в пользу
того, что силы, действующие между кварками, не ослабляются с расстоянием. Это
означает, что для отделения кварков друг от друга требуется бесконечно большая
энергия, или, иначе, возникновение кварков в свободном состоянии невозможно.
Невозможность выделить кварки в свободном состоянии делает их совершенно новым
типом структурных единиц вещества. Неясно, например, можно ли ставить вопрос о
составных частях кварков, если сами кварки нельзя наблюдать в свободном
состоянии. Возможно, что в этих условиях части кварков физически вообще не
проявляются и поэтому кварки выступают как последняя ступень дробления адронной
материи.
Атом - наименьшая химически неделимая часть химического элемента,
являющаяся носителем его свойств. Атом состоит из атомного ядра и электронов.
Ядро атома состоит из положительно заряженных протонов и незаряженных
нейтронов. Если число протонов в ядре совпадает с числом электронов, то атом в
целом оказывается электрически нейтральным. В противном случае он обладает некоторым
положительным или отрицательным зарядом и называется ионом. Атомы
классифицируются по количеству протонов и нейтронов в ядре: количество протонов
определяет принадлежность атома некоторому химическому элементу, а число
нейтронов - изотопу этого элемента.
Атомы различного вида в разных количествах, связанные межатомными
связями, образуют молекулы.
.
Двойственная природа электрона
Подтвержденная экспериментально в 1927 г. двойственная природа электрона,
обладающего свойствами не только частицы, но и волны, побудила ученых к
созданию новой теории строения атома, учитывающей оба этих свойства.
Современная теория строения атома опирается на квантовую механику.
Двойственность свойств электрона проявляется в том, что он, с одной
стороны, обладает свойствами частицы (имеет определенную массу покоя), а с
другой - его движение напоминает волну и может быть описано определенной
амплитудой, длиной волны, частотой колебаний и др. Поэтому нельзя говорить о
какой-либо определенной траектории движения электрона - можно лишь судить о той
или иной степени вероятности его нахождения в данной точке пространства.
Следовательно, под электронной орбитой следует понимать не определенную
линию перемещения электрона, а некоторую часть пространства вокруг ядра, в
пределах которого вероятность пребывания электрона наибольшая. Иными словами
электронная орбита не характеризует последовательность перемещения электрона от
точки к точке, а определяется вероятностью нахождения электрона на определенном
расстоянии от ядра.
Уравнением де Бройля. Это было волновое уравнение
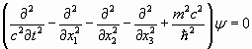
Де
Бройль предложил это уравнение просто потому, что он заметил интересную связь
между его решением и релятивистским движением частицы. Если обозначить через  три компоненты импульса, а
три компоненты импульса, а 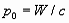 , то
, то  соответствует
соответствует
 .При такой связи между волнами и импульсом частицы
получалась релятивистская теория. Де Бройль постулировал, что волны связаны с
движением частицы. Он сделал это до того, как Гейзенберг сформулировал свою
квантовую механику. Это было в 1924 г.”
.При такой связи между волнами и импульсом частицы
получалась релятивистская теория. Де Бройль постулировал, что волны связаны с
движением частицы. Он сделал это до того, как Гейзенберг сформулировал свою
квантовую механику. Это было в 1924 г.”
Оказывается
волны были изначально постулированы , другие решения не рассматривались вообще.
Я
читал статью де Бройля, но не воспринял волны серьезно. Я считал, что эти волны
были всего лишь математическим курьезом, не имеющим никакого физического
смысла. И тут я был неправ. А Шрёдингер действительно отнесся к волнам
серьезно…Он попытался догадаться о правильном способе изменения уравнения (2)
де Бройля, учитывающем требования теории относительности. И ему удалось
придумать такое уравнение

Это
уравнение сводится к предыдущему уравнению (2), если электромагнитные
потенциалы Αμ положить равными нулю. Насколько мне известно,
получение этого уравнения из уравнения де Бройля было всего лишь результатом
догадки Шрёдингера.
Когда
Шрёдингер получил это уравнение, первое, что он сделал, конечно, было
применение его к задаче об электроне в атоме водорода. Он вычислил уровни
энергии водорода и получил неверный результат. Причина, из-за которой он пришел
к неверному ответу, заключалась в том, что его уравнение не учитывало спина
электрона.
Шрёдингер
ничего не знал об этом. Он обнаружил, что его волновое уравнение приводило к
результатам, не согласующимся с опытом, и был очень разочарован этим. На
некоторое время он даже оставил работу.
Однако
несколькими месяцами позже он вновь вернулся к ней и тут заметил, что если бы
он поубавил свои претензии и просто записал свое уравнение в нерелятивистской
форме, то, применив его к конкретным задачам, он пришел бы к результатам,
совпадающим с наблюдаемыми всюду, кроме тонкой структуры водородного спектра,
которая зависит от релятивистских поправок. В отсутствие магнитного поля
уравнение Шрёдингера в нерелятивистском приближении записывается следующим
образом.

При
использовании уравнения в такой нерелятивистской форме получались результаты,
согласующиеся с данными об энергетическом спектре водорода. Помимо дискретного
спектра, описывающего спектр линий водорода, получался и непрерывный спектр,
соответствующий рассеянию электрона на ядре атома водорода.
Я
помню, что когда я впервые услышал об этих двух квантовых теориях, я
почувствовал заметное раздражение. Если у нас есть одна хорошая теория, то в
действительности это все, чего мы хотим. Но тут было что-то слишком много,
изобилие богатства. Однако вскоре Шрёдингер показал , что эти две теории на
самом деле эквивалентны.”
Итак
Шредингер на основании волнового уравнения де Бройля (не будем менять
терминологию Дирака ) из стремления получить верные результаты получил свое
уравне- ние , и назвал его волновым , а как бы вы его назвали на его месте . И
тут начинается весьма интересная ситуация.
Ведь
на самом деле уравнение Шредингера не волновое. Решение уравнения де Бройля
можно написать в виде

И
это действительно будет волна.
Но
проблема заключается в том что свободное уравнение Шредингера , без величины
eA0 /c

не
допускает такого решения. Его решением является

только
комплексная величина , чувствуете разницу. В уравнении Шредингера мы
принципиально не можем опустить мнимую часть и потому оно не волновое.
Уравнение Шредингера это уравнение только комплексного переменного , по
видимому оно вообще не имеет действительных решений . Так что квантовая
механика нечто отличное от волновой теории .
В
результате работы Шрёдингера появилось новое понятие, волновая функция ψ, которая существенно помогла при физической
интерпретации теории. Было обнаружено, что если вы возьмете ψ и правильно нормируете ее, то | ψ |2 даст вам вероятность нахождения частицы
в пространстве.
Но
функцию (6) лишь условно можно назвать волновой.
Идея
введения некоммутативности послужила ключом к построению новой механики,
избавившей нас от той неудовлетворенности, которую мы ощущали все предыдущие
годы.
В
итоге за этим последовал период огромной активности физиков-теоретиков.
Огромная активность сопровождалась огромным возбуждением. Было так много работы
по развитию новых идей и осознанию того, как уравнения старой механики
переходят в новую теорию. Новые результаты получались очень легко, и при этом
была большая убежденность в том, что мы действительно куда-то продвигаемся.
Можно было развивать общие основы новой теории, а также применять ее к
конкретным задачам и разрабатывать ее уравнения.”
В
итоге на коренное различие между волновой и квантовой теориями никто не обратил
внимания .
А
Дирака ожидал заслуженный триумф . Вот как он описывает его историю .
“Мне
удалось развить общую теорию преобразований, и это доставило мне большое
удовлетворение. Я считаю, что из всех работ, которые я сделал за свою жизнь,
именно эта работа принесла мне наибольшее удовлетворение…Но у этой теории была
и одна плохая особенность. Она состояла в том ,что теория была
нерелятивистской... Таким образом, перед нами встала проблема такой модификации
теории, которая бы сделала теорию, релятивистской…Согласно Эйнштейну теория
должна быть полностью симметрична по отношению ко времени и трем
пространственным координатам. Но вы , видите , что здесь нет такой симметрии. В
уравнении (1) стоит  без соответствующих
без соответствующих  .
В уравнении Шрёдингера (4) есть
.
В уравнении Шрёдингера (4) есть , но нет
соответствующих операторов дифференцирования по пространственным координатам.
Таким образом, перед нами встала проблема такой модификации теории, которая бы
сделала теорию , релятивистской…
, но нет
соответствующих операторов дифференцирования по пространственным координатам.
Таким образом, перед нами встала проблема такой модификации теории, которая бы
сделала теорию , релятивистской…
Большинство
физиков пыталось решить эту проблему путем возвращения к уравнению (3),
обобщенному уравнению де Бройля. Это - релятивистское уравнение. Впервые оно
было предложено Шрёдингером, но он не опубликовал его, потому что вытекающие из
этого уравнения результаты не согласовались с данными эксперимента о спектре
водорода. Независимо оно было переоткрыто Клейном и Гордоном, они и
опубликовали его. Их не смутило расхождение с опытом. Так это уравнение стало известно
теперь как уравнение Клейна - Гордона. Конечно, его следовало бы назвать
уравнением Шрёдингера, но у Шрёдингера не хватило мужества опубликовать его…
Большинство
физиков было удовлетворено таким приложением уравнения Клейна - Гордона. Они
говорили, что здесь мы уже имеем дело с хорошей релятивистской квантовой
теорией. Но меня такое состояние дел совершенно не удовлетворяло, потому что не
удавалось применить к этому уравнению теорию преобразований...
Таким
образом, я должен был беспокоиться о проблеме создания релятивистской теории,
которая была бы линейной по оператору  .
Линейность по
.
Линейность по  была абсолютно необходима для меня; я просто не мог
представить себе, что можно отказаться от теории преобразований. Видите ли,
используя теорию преобразований, вы можете вычислить также вероятность того,
что частица обладает заданным импульсом. Вы не смогли бы сделать это, исходя из
уравнения Клейна - Гордона...
была абсолютно необходима для меня; я просто не мог
представить себе, что можно отказаться от теории преобразований. Видите ли,
используя теорию преобразований, вы можете вычислить также вероятность того,
что частица обладает заданным импульсом. Вы не смогли бы сделать это, исходя из
уравнения Клейна - Гордона...
Это
привело меня к уравнению

содержащему
матрицы а, которые представляют собой четыре-на-четыре матрицы. Они подчиняются
определенным алгебраическим соотношениям, в результате чего квадрат выписанного
выше оператора в точности равен  .”
.”
По
существу Дирак извлек матричным способом квадратный корень из уравнения
Клейна-Гордона . И это величайшая заслуга Дирака , несмотря на его собственную
ее недооценку . Вы спросите зачем было переписывать его статью здесь. В ней по
видимому весьма объективно описана история становления квантовой механики .
Но
история становления квантовой механики , как впрочем любая история , содержит и
историю ее ошибок . Выше было показано что уравнение Шредингера вовсе не
является волновым , хотя и было выведено из волнового уравнения де Бройля
(здесь и далее мы будем придерживаться терминологии Дирака , мы считаем что он
имеет на это право ).
Волновое
уравнение вообще может иметь не волновое решение. Например волновое уравнение
записанное в наиболее общем виде

имеет
решение называемое волной при условии что оно разлагается в интеграл Фурье на
плоские волны вида

Но
волновое уравнение имеет решение