Биологические свойства онкогенных вирусов, влияющие на развитие злокачественных новообразований
Курсовая
работа
Тема
«Биологические свойства
онкогенных вирусов, влияющие на развитие злокачественных новообразований»
Введение
Основателем вирусной онкологии
следует считать Пэйтона Рауса, который в 1911 г. описал куриную саркому,
перевиваемую от птицы к птице с помощью бесклеточных фильтратов. Вирус получил
название вируса саркомы Рауса. К середине XX в. было обнаружено
значительное число вирусов, вызывающих опухоли у человека и животных, в
частности, были открыты вирусы сарком и лейкозов мышей, кошек, обезьян,
крупного рогатого скота. Позже проведенными исследованиями было доказано, что
практически у всех представителей животного мира имеются опухоли вирусного
происхождения. Большой вклад в изучение вирусного канцерогенеза внесли и отечественные
ученые. Среди них следует назвать таких выдающихся исследователей, как Л.А.
Зильбер, Г.Я. Свет-Молдавский, Н.П. Мазуренко, Б.А. Лапин, А.Д. Альтшейн, И.Н.
Крюкова, В.Н. Степина, А.М. Дядькова, Л.С. Яковлева и многие другие. [6]
Хорошо известно, что возникновение
примерно 15-20% новообразований человека имеют вирусное происхождение. Среди
наиболее часто встречающихся таких вирусом индуцированных опухолей можно
назвать рак печени, рак шейки матки, рак носоглотки, лимфому Беркитта, лимфому
Ходжкина и многие другие. В настоящее время экспертами Международного Агентства
по Изучению Рака (МАИР) следующие вирусы рассматриваются в качестве онкогенных
для человека:
¨ вирусы гепатита В и С (Hepatitis B virus и Hepatitis C virus, HBV/ HCV), вызывающие рак
печени;
¨ определенные типы (16 и
18) папаломавирусов человека (Human papillomavirus, HPV) - являющихся этиологическим агентом рака шейки матки и некоторых
опухолей аногенитальной сферы;
¨ вирус Эпштейна-Барр (Epstein-Barr virus, EBV), принимающий участие в
возникновении целого ряда злокачественных новообразований;
¨ недавно открытый
герпесвирус человека 8-го типа (Human herpesvirus type 8, HHV-8), игращий важную роль в возникновении
саркомы Капоши, первичной выпотной лимфомы, болезни Кастельмана и некоторых
других патологических состояний;
¨ вирус Т-клеточного
лейкоза человека (Human T-cell leukemia virus, HTLV-1), являющийся
этиологическим агентом Т-клеточного лейкоза взрослых, а также тропического
спастического парапареза и ряда других неонкологических заболеваний;
¨ вирус иммунодефицита человека (Human
immunodeficiency virus, HIV) - не обладающего трансформирующими генами, но
создающего необходимые условия (иммунодефицит) для возникновения рака. [7]
Очень часто онкогенным вирусам, в
том числе и человека, приписывают свойства вирусов инфекционных. Причиной тому,
по-видимому, являются достаточно хорошая информированность населения на бытовом
уровне об инфекционных вирусах и вызываемых ими заболеваниях, и практически
полная неосведомленность об онкогенных вирусах и их свойствах. Действительно,
если внедрение инфекционного вируса в организм животного или человека влечет за
собой возникновение соответствующего заболевания, то, следуя логике обывателя,
заражение онкогенным вирусом должно привести к возникновению соответствующей
опухоли.
У многих представителей животного
мира такая взаимосвязь действительно довольно часто наблюдается. Так, вирусы
лейкоза кур, мышей, крупного рогатого скота вызывают соответствующие лейкозы;
вирус папилломы кролика - папиллому у кроликов и т.д. Однако взаимоотношения
между онкогенными вирусами и представителями животного мира гораздо сложнее и
многообразнее. Оказалось, что некоторые вирусы, считавшиеся онкогенными только
для одного вида животных, способны вызывать опухоли у разных представителей
млекопитающих (например, куриный вирус саркомы Рауса вызывает также опухоли у
крыс, мышей, кроликов, змей и т.д.). В почках зеленой мартышки обнаружен вирус
(SV-40),
непатогенный для этого вида обезьян, но высокоонкогенный для некоторых видов
млекопитающих, в частности, хомяков. Не менее сложной оказалась ситуация и с
онкогенными вирусами человека: часть из них может персистировать в организме
инфицированного лица всю жизнь, не вызывая у него новообразования и какой-либо
другой патологии. Некоторые вирусы являются убиквитарными для человека, т.е.
чрезвычайно широко распространены в человеческой популяции, благополучно с ним
сожительствуя. После заражения человека онкогенным вирусом опухолевый процесс
все же может возникнуть, но только при сочетанном действии дополнительных
факторов и наличии определенных условий, что происходит достаточно редко. [6]
Одно из чрезвычайно важных отличий
инфекционного вируса от онкогенного заключается в том, что генетический
материал опухолеродных вирусов, как правило, внедряется функционально и
физически в геном клетки, нарушая ее нормальную жизнедеятельность и превращая
ее в конечном итоге в злокачественную. При этом инфицированная клетка не
гибнет, она усиленно размножается и дополнительного внедрения вируса уже не
требуется. Инфекционный же вирус, проникая в клетку, заставляет все ее ресурсы
работать на себя, что крайне редко происходит с онкогенным вирусом. В этом
случае процесс заканчивается созреванием вирусного потомства и гибелью клетки.
Другое важное отличие онкогенных от
инфекционных вирусов состоит в том, что в геноме большинства ДНК- и
РНК-содержащих онкогенных вирусов были найдены гены, названные онкогенами,
которые кодируют белок, ответственный за превращение нормальной клетки в
опухолевую, причем попадание в организм животного вируса, содержащего онкоген
(примером могут служить саркоматозные вирусы птиц и других животных), приводит
к быстрому возникновению опухоли. У животного, зараженного вирусом, не
содержащим онкогена (примером могут служить лейкозные вирусы мышей), латентный
период возникновения новообразования может занять большую часть их жизни. Это
происходит потому, что злокачественная трансформация клетки наступает только в
случае внедрения вирусного генома в клеточный в непосредственной близости к
гену или группе генов, ответственных за регуляцию роста и дифференцировки
клетки, нарушая нормальную функцию этих генов.
Следует отличать однако опухоли,
индуцированные вирусами, от опухолей, в которых вирус присутствует в качестве
«пассажира». У опухолей, вирусного происхождения заражение клеток предшествует
появлению опухоли и вирусные маркеры в организме возникают еще до формирования
опухоли, в то время как в опухолях невирусного происхождения клетки опухоли
могут быть заражены вирусом уже после ее появления. Опухоль вирусного
происхождения возникает из одной - единственной зараженной вирусом клетки, а
для самой опухоли характерна моноклональность и интеграция вируса в одни и те
же места генома опухолевой клетки. Обнаружена также корреляция между высокой
заболеваемостью определенным типом рака и высокой инфицированностью населения
определенным типом вируса. Для индуцированных вирусом опухолей характерно
снижение заболеваемости определенным типом рака после вакцинации против
соответствующего вируса и / или проведения других профилактических мер.
Было доказано, что когда-то
(по-видимому, миллионы лет тому назад) регуляторные гены клетки были захвачены
этими вирусами и уже в составе вирусного генома превратились в онкогены. Это
открытие оказалось чрезвычайно важным для понимания механизма возникновения
опухоли, т. к. стала очевидной возможность превращения нормальных клеточных
генов в онкогены под воздействием спонтанных или вызванных какими-либо
факторами генетических мутаций и без участия вирусов. И действительно, такие клеточные
онкогены, не имеющие никакого родства с вирусными онкогенами, были
обнаружены во многих опухолях невирусного происхождения человека и животных.
[15]
Вирус наряду с химическими
канцерогенами и лучевой энергией, следует рассматривать в качестве одного из
возможных канцерогенных факторов, способных индуцировать опухоль.
Таким образом, опухоли могут иметь
вирусную и невирусную природу. Роль вирусов в возникновении ряда опухолей
животных доказана уже давно. Особенно высок процент опухолей вирусного
происхождения у короткоживущих животных (грызунов, кур), в то время как у
приматов и человека большая часть новообразований, по-видимому, не связана с
вирусами.
1.
Классификация ретровирусов
ретровирус
онкогенный эпидемиология лимфотропный
В 1970 г. Д. Балтимор и Х.М. Темин
открыли механизм передачи информации от вирусной РНК к ДНК, т.е. наоборот тому,
что имеет место в клетках высших организмов. [11] Такой процесс получил
название обратной транскрипции, а фермент, его осуществляющий, был назван обратной
транскриптазой или ревертазой.
Ретровирусы - обширное семейство вирусов (Retroviridae), заражающих
преимущественно позвоночных. Это РНК-содержащие вирусы, обладающие уникальным
механизмом репродукции.
В состав ретровирусов входит фермент
обратная транскриптаза, которая обеспечивает синтез ДНК на матрице вирусной РНК
внутри клетки - хозяина. Открытие обратной транскрипции (отсюда название
ретровирусы) опровергло центральную догму молекулярной биологии, утверждавшую,
что перенос генетической информации возможен только в направлении от ДНК к РНК
и затем к белку.
Изучение ретровирусов изменило
представления не только о направлении потока генетической информации, но и об
этиологии некоторых злокачественных новообразований, а также об онкогенах, как
о нормальных генах клетки-хозяина, измененных вирусным геномом. Онкогены:
определение (с-onc) - это активированные вследствие мутаций или по другим
причинам клеточные протоонкогены продукты которых стимулирует одну из стадий
раковой прогрессии клетки, действуя доминантным образом. или гены онкогенных
вирусов, вызывающие малегнизацию (Малигнизация - лат. malignus, гибельный -
приобретение клетками свойств злокачественной опухоли) клеток и образование
раковых опухолей. [13]
Царство: Вирусы
Группа: РНК-содержащие вирусы
Семейство: Retroviridae
Семейство Retroviridae (табл. 1) включает три
подсемейства:
Oncovirinae (онковирусы), важнейший представитель которого - T-лимфотропный вирус человека типа 1;
Lentivirinae (лентивирусы), к которому относится ВИЧ;
Spumavirinae (спумавирусы, или пенящие вирусы).
Таблица 1. Классификация
ретровирусов (семейство Retroviridae) [11]
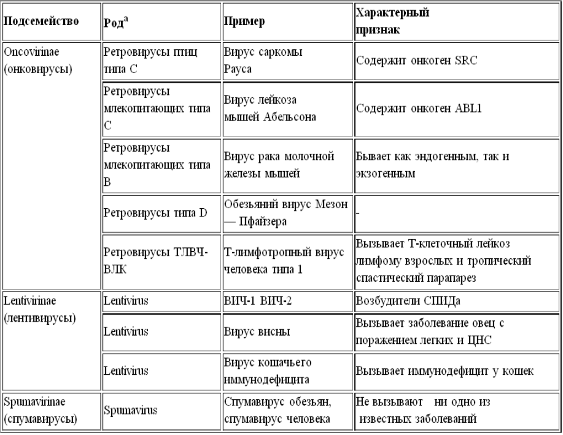
ТЛВЧ - Т-лимфотропный вирус
человека; ВЛК - вирус лейкоза коров.
А первоначально на основании
морфологических особенностей, обнаруженных при электронной микроскопии (размер,
расположение сердцевины, отпочковывание), выделяли четыре рода онковирусов (А -
D), однако позднее в основу классификации легли различия в строении геномов.
Онкогенные вирусы человека. К
настоящему времени известно несколько вирусов, которые ответственны за
возникновение около 15% всех опухолей человека. У животных многие
злокачественные новообразования имеют вирусную этиологию. Значительная часть
онкогенных вирусов принадлежит к семейству ретровирусов, геном которых
представлен одноцепочечной РНК.подсемейство вирусов (лентивирусы). ВИЧ-1 и
ВИЧ-2 - единственные патогенные для человека представители подсемейства
Lentivirinae. Говоря о медленном течении лентивирусных (lente - медленно)
инфекций, их обычно сравнивают с острыми вирусными инфекциями (например, с
гриппом), но не с инфекциями, вызываемыми другими ретровирусами. В то же время
клиническая картина острой лихорадочной фазы ВИЧ-инфекции напоминает проявления
многих классических острых инфекций. Геномы всех лентивирусов, и особенно ВИЧ-1
и ВИЧ-2, превосходят по размеру геномы других патогенных ретровирусов.
Spumavirinae (спумавирусы, или пенящие вирусы) - название происходит от лат. spuma - губка, поскольку
характерной особенностью этих вирусов является образование синцитиев в
зараженных клетках. По морфологии и химическому составу вирусы сходны с другими
членами семейства, но не обладают онкогенностью. Нет группоспецифического
антигена. Вирусы поражают многие виды млекопитающих, включая человека. Естественная
инфекция протекает без симптомов и патологических изменений. Вирусы удается
демаскировать при культивировании зараженных тканей in vitro. К подсемейству
относятся синцитиальные вирусы человека, обезьян, коров, кошек, хомяков и
других животных. [3]
Основным представителем онкогенных
ретровирусов является Т-лимфотропный вирус человека.
2.
Ретровирусы как носители и активаторы онкогенов
Вирусы, вызывающие рак, называются
онкогенными. Среди онкогенных вирусов есть вирусы, наследственной молекулой которых
является РНК (их называют ретровирусами). Было установлено, что и в этом случае
на вирусной РНК с помощью особого фермента ревертазы синтезируется ДНК, которая
встраивается в хромосому хозяина. Таким образом вирусы, встроившиеся в
хромосому, могут приводить к превращению здоровой клетки в раковую. Для
возникновения рака существенен не весь геном вируса, а лишь один из его генов.
Такой ген, вызывающий рак, назвали онкогеном.
.1 Ретровирусы
высокоонкогенные
Высокоонкогенные ретровирусы
получили свое название благодаря способности трансформировать культивируемые
клетки в течение нескольких дней и индуцировать опухоли у инфецированных
животных с коротким латентным периодом в течение 2-3 недель. За злокачественную
трансформацию отвечают входящие в состав вирусного генома онкогенные
последовательности.
Обнаружены трансдуцирующих вирусов,
геномы которых приобрели клеточные последовательности. На рис. 1 показан геном
одного из таких вирусов. Часть вирусной последовательности - в данном случае
ген env - замещена геном v-onc. Образовавшийся вирус дефектен по репликации и не способен
поддерживать самостоятельно инфекционный цикл. Такой вирус может сохраняться
вместе с вирусом-помощником, который восполняет утраченные вирусные функции.

Рис. 1. у дефектных в отношении
репликации трансформирующих вирусов часть вирусной последовательности замещена
последовательностью клетки. Длина замещенной последовательности характерна для
каждого вируса
Онкогены РНК-содержащих вирусов (v-onc) не являются
вирусспецифическими генами и ведут свое происхождение от ядерной ДНК
клеток-хозяев, а именно: от клеточных протоонкогенов.
Захват клеточных последовательностей
осуществляется в результате рекомбинационно-интеграционных процессов,
происходящих между клеточным и вирусным геномами. В этих процессах участвует
кодируемый вирусом фермент обратная транскриптаза, которая синтезирует
ДНК-копии вирусной РНК.
Таким образом, вирусные онкогенные
последовательности являются чужеродным генетическим материалом, не участвуют в
процессах размножения вируса и, более того, в подавляющем большинстве случаев
делают вирус дефектным по репликации за счет замещения онкогеном части
необходимых вирусных генов.
Большинство высокоонкогенных
ретровирусов можно считать лабораторными конструкциями, поскольку они были
получены в ходе пассирования родительских ретровирусов в опухолевых клетках. В
нелабораторных условиях эти вирусы быстро исчезают или теряют онкогены.
Однако вирусы лейкоза кошек, которые
трансдуцировали клеточные протоонкогены, служат примером онковирусов,
встречающихся в природных популяциях.
В настоящее время выделено
значительное количество независимых изолятов высокоонкогенных ретровирусов.
Молекулярно-биологическими методами были идентифицировано более 20 различающихся
по структуре онкогенов.
С помощью гибридизации нуклеиновых
кислот эукариотических клеток с ретровирусными зондами практически для всех
известных v-onc были найдены гомологичные клеточные последовательности (c-onc). Таким образом, этим
способом было выявлено наибольшее число с-onc (более 20), в том числе
с-Ha-ras 1 - по гомологии с
онкогеном штамма Харви вируса мышиной саркомы Ha-MSV и c-myc - по гомологии с
онкогеном ретровируса птиц МС29. [10]
Онкогенный потенциал v-onc, также как и c-onc, может определяться как
качественными, так и количественными изменениями. Наряду с повышенным уровнем
экспрессии v-onc за счет сильных вирусных промоторов во многих случаях в них
наблюдается много структурных изменений, происходящих в ходе захвата клеточного
гена, а также в ходе пассирования вируса. Однако встречаются и единичные
точковые замены.
.2 Ретровирусы
низкоонкогеные
Помимо высокоонкогенных
ретровирусов, практически не встречающихся в природных популяциях, существует
группа низкоонкогенных ретровирусов. Причем большинство вирус-индуцированных
опухолей животных в природе возникают под действием данных вирусов.
Свое название низкоонкогенные
ретровирусы получили благодаря ряду принципиальных отличий от высокоонкогенных
вирусов. Они не несут трансформирующих генов, не вызывают злокачественной
трансформации при размножении клеток в культуре и способны индуцировать опухоли
у части инфецированных животных лишь после длительного латентного периода от 4
до 12 месяцев.
.3 Механизм онкогенного
действия
Механизм онкогенного действия
низкоонкогенных ретровирусов также существенно отличается от действия
высокоонкогенных ретровирусов. В данном случае злокачественная трансформация
является следствием так называемого инсерционного мутагенеза. При этом если
встройка провирусной ДНК происходит внутри или вблизи клеточного протоонкогена,
она превращает его в онкоген.
Поскольку известно, что инсерция
ретровирусов происходит нелокусоспецифично, т.е. в любые точки клеточного
генома, то очевидно, такое попадание в локус c-onc должно быть редким
событием. Эта редкая и единственная трансформированная клетка, имея селективные
преимущества перед нормальными клетками, должна образовать опухоль клонального
происхождения только после достаточно длительного периода размножения, что и
наблюдается в действительности. [14]
3.
Строение онкогенных ретровирусов
Вирионы имеют диаметр 70-130 нм и
состоят из липидсодержащей внешней оболочки, окружающей нуклеокапсид в форме
икосаэдра с плотной сердцевиной. В сердцевине содержатся две идентичные молекулы
одноцепочечной РНК (то есть геном диплоидный) длиной 8000-10000 нуклеотидов
каждая, тРНК. Вирусный конверт сформирован клеточным двойным слоем липида в
который белки, закодированные огибающая область вирусного генома вставлена. Они
состоят из трансмембранного (ТМ) и поверхность (SU) компоненты,
соединенные дисульфидными мостиками. Внутренние негликозилированнае структурные
белки закодированы областью gag вирусного генома. Они - матричный белок (МА),
белок капсулы вируса (CA), и нуслеокапсидный белок (NC). Предложенная
двадцатигранная структура капсулы ретровируса определенно не установлена.
Главные продукты кодирующей политика области - обратная транскриптаза (RT) и integrase (IN). Протеаза (PR)
получена из прогена между gag и pol. [2]
Вирионы имеют 6 структурных белков,
из них 4 внутренних (капсидных) негликолизированных и 2 гликопротеина оболочки.
Капсидные белки несут группоспецифические межвидовые антигены и являются
основой для разделения вирусов на роды и подроды. Гликопротеиды являются
типоспецифическими антигенами, участвуют в реакции нейтрализации. [8] Геном
ретровирусов представлен однонитчатой РНК с молекулярной массой 7 мегадалътон и
состоит из двух копий, каждая из которых является полноценным геномом и
содержит одинаковую генетическую информацию, однако неизвестно, обе ли они
функциональны. Нуклеиновая кислота онковирусов имеет гомологию с клеточной ДНК
своего вида хозяина. Вирионная РНК неинфекционна. Вирусная РНК транскрибируется
в ковалентно связанную двунитчатую ДНК, которая интегрируется с клеточной ДНК в
виде ДНК-провируса. Провирус, экстрагированный из клетки, обладает
инфекционностью.
Ретровирус раздваивает функции
своего генетического материала:
. инфекционную функцию, т.е.
функцию самораспространения, выполняет вирусная РНК,
. функцию экспрессии вирусных
генов и синтеза молекул РНК, которые затем перенесут генетическую информацию в
другие клетки, выполняет вирусная ДНК.
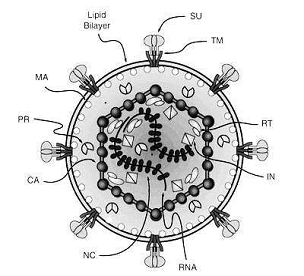
Рис. 2. Схематическое поперечное
сечение через частицу Т-лимфотропного вируса человека. [2]
Вирусная РНК (рис. 3):
содержит так называемые короткие
концевые повторы, STR, short terminal repeats,
Содержит на 5'-конце характерный для
информационных РНК кэп сайт (5'-конец молекулы РНК прежде всего кэпируется,
т.е. достраивается с образованием особой структуры, ответственной за
последующее связывание молекулы мРНК с рибосомой), а на 3' - конце поли - (А)
хвост (В ходе созревания РНК процессу сплайсинга предшествует процесс
полиаденилирования - присоединение последовательности poly(A) к 3'-концу РНК
сразу после транскрибции).
Содержит специальный участок,
сигнализирующий, что данная РНК может быть упакована во внутрь вирусных белков,
чтобы в результате образовалась вирусная частица, вирион. Это сигнал упаковки y, пси. Расположен этот сайт: между
двумя сплайс - сайтами. Благодаря этому может упаковываться только
полноразмерная вирусная РНК, а сплайсированная, в которой y отсутствует, остается
неупакованной. [13]

Рис. 3. (A) Геном вируса лейкоза
птиц. Генетическая карта ALV содержит четыре главных кодирующих области, gag,
pro, pol, и env. Различные рамки считывания обозначены вертикальным смещением
кодирующей области. pro ген закодирован в рамке считывания gag. Предельные
некодирующие последовательности включают два прямых повторения (R), U5 (5′unique),
и U3 (3′unique) последовательность. (B) сложный ретровиральный геном.
Генетическая карта HTLV содержит, помимо главных кодирующих областей,
информации для двух регулирующих белков, Tax и Rex, закодированного в областях
(боксах), к которым присоединяется соединение РНК. В этом случае, gag, pro и
pol является всеми в различных рамках считывания. [2]
Геном ретровирусов содержит как
кодирующие, так и некодирующие нуклеотидные последовательности. Многие
некодирующие последовательности представляют собой специфические участки
связывания регуляторных факторов.
Концевые участки ДНК-генома
ретровирусов отличаются от концевых участков РНК-генома. На обоих концах
ДНК-генома имеются идентичные последовательности, названные длинными концевыми
повторами (LTR), которые выполняют регуляторные функции: содержат промоторы,
участвуют в интеграции провируса в клеточный геном и полиаденилировании
вирусной РНК. Участок связывания праймера, необходимого для инициации обратной
транскрипции, и последовательности, ответственные за сборку вирусов, находятся
вне длинных концевых повторов. Кодирующие участки генома содержат структурные
гены gag, pol и env. В результате транскрипции генов gag и pol образуется единая
молекула мРНК, которая в большинстве случаев транслируется в полипротеин Gag. Однако часть молекул
мРНК в результате сдвига рамки считывания дает большой полипротеин Gag-Pol. [8]
При расщеплении полипротеина Gag образуются от трех до
пяти капсидных белков.
Полипротеин Pol состоит из трех белков:
обратной транскриптазы, интегразы и протеазы. Обратная транскриптаза
обеспечивает образование на матрице вирусной РНК двухцепочечной ДНК, которая
затем встраивается в клеточный геном при участии интегразы. Протеаза расщепляет
полипротеин Gag-Pol на отдельные белки.
Ген env кодирует гликопротеиды
внешней оболочки: один из белков обеспечивает адсорбцию вируса на мембранных
рецепторах клетки и определяет тропность вируса; другой небольшой
трансмембранный белок удерживает комплекс гликопротеидов во внешней оболочке.
В геноме Т-лимфотропных вирусов
человека между геном env и З'-длинным концевым повтором расположена нуклеотидная
последовательность, кодирующая по меньшей мере два разных белка. Белок Tax с молекулярной массой
40000 сам не взаимодействует с ДНК, но запускает синтез клеточных факторов,
стимулирующих транскрипцию клеточных генов. Tax (HTLV-1) белок, кодируемый
областью pX вирусного генома, вызывает активацию ряда генов (включая гены,
стимулирующие пролиферацию клетки), взаимодействуя с фактором транскрипции,
связывающиеся с цАМФ-чувствительными регуляторными элементами. Белок Tax -
единственный вирусный белок, обычно присутствующий в опухолевых клетках,
трансформированных in vivo, однако даже этот белок далеко не всегда
обнаруживается у больных с T-клеточным лейкозом-лимфомой взрослых. [17]
Белок Rex с молекулярной массой
27000 регулирует транскрипцию вирусных генов. Образование обоих белков
обеспечивается альтернативным сплайсингом, в результате которого из одного
транскрипта образуются две зрелые мРНК на основе различных, хотя и
перекрывающихся экзонов. [12]
.
Цикл развития онкогенных ретровирусов
Цикл развития ретровирусов состоит
из двух этапов.
На первом этапе вирусы адсорбируются
на специфических мембранных рецепторах клетки и проникают в цитоплазму, где при
участии обратной транскриптазы на матрице вирусной РНК образуется
двухцепочечная ДНК - провирус (рис. 4). Затем провирус переходит в ядро,
встраивается в геном клетки-хозяина и сохраняется в таком состоянии в течение
длительного времени. Хотя некоторые ретровирусы животных встраиваются только в
один определенный участок генома во всех зараженных клетках, четыре
ретровируса, патогенных для человека (Т-лимфотропный вирус человека типа 1,
Т-лимфотропный вирус человека типа 2, ВИЧ-1 и ВИЧ-2), встраиваются в клеточную
ДНК случайным образом.

Рис. 4. Схема обратной транскрипции
ретровирусов - образование ДНК по матрице одноцепочечной РНК. [3]
Первый этап репродукции полностью
осуществляется вирусными белками и нуклеиновыми кислотами. Провирусы
встраиваются в клеточный геном во время периода S клеточного цикла, поэтому
ретровирусы (кроме лентивирусов) не способны заражать непролиферирующие клетки.
По информационному содержанию
ДНК-вариант генома ретровируса отличается от РНК-варианта только тем, что ДНК
содержит не короткие концевые повторы, а длинные концевые повторы, LTR. LTR, long terminal
repeats. Последовательности LTR включают в себя последовательности STR.
Возникновение LTR очень важно для экспрессии вирусных генов. Они содержат
вирусные регуляторные транскрипционные элементы: промотор, энхансер, и другие.
Например, некоторые вирусы содержат элементы, определяющие зависимость вирусной
транскрипции от наличия определенных гормонов. LTR и являются теми
регуляторными сигналами, которые вирус использует для эксплуатации клеточной
транскрипционной машины в своих целях. [13]
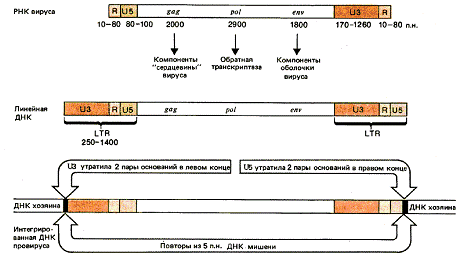
Рис. 5. Ретровирусные РНК кончаются
прямыми повторами (R), а свободные линейные ДНК-последовательностями LTR; концы провирусов
представляют собой LTR-последовательности, укороченные на два основания. [4]
На втором этапе происходит синтез и
процессинг вирусных геномов, мРНК и белков при участии структур клетки-хозяина,
что тоже во многом контролируется продуктами вирусных генов. В дальнейшем
происходит сборка вирусов и выход их из клетки путем отпочковывания; при этом белки
клеточной мембраны нередко включаются в состав внешней оболочки вирусов.
Рекомбинация происходит с высокой частотой во время инфекционного цикла
ретровируса; по-видимому, в ней используются промежуточные продукты ДНК или
дополнительные реакции переноса цепи (рис. 6).

Рис. 6. Дефектные в отношении
репликации вирусы могут возникать благодаря интеграции и делеции вирусного
генома, в результате чего образуются слившиеся вирусно-клеточные транскрипты,
которые упаковываются вместе с нормальным РНК-геномом. [14]
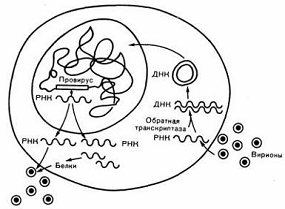
Рис. 7. Жизненный цикл ретровируса.
[2]
Особенности трансляции
РНК ретровирусов
Находясь в составе геномной ДНК,
вирусные гены транскрибируются под контролем LTR. Продуктом транскрипции
является полноразмерная вирусная РНК. Она должна транслироваться. И здесь
вирусу необходимо решить такую проблему: нужно синтезировать много белков, а
РНК одна. И в клетках эукариот РНК моноцистронны, т.е. предназначены для
синтеза только одного белка. Синтез белка при этом начинается с ближайшего к
кэп-сайту инициирующего кодона (не всегда, но в подавляющем большинстве
случаев).
Если просмотреть открытую рамку
считывания от этого ближайшего инициирующего кодона, то мы увидим, что если бы
вирус пользовался традиционными способами экспрессии, то он смог бы
синтезировать только полипептид GAG. А дальше идет стоп - кодон. Как быть с POL и ENV? Кроме того, эти
полипептиды очень длинны, а в вирусе содержатся гораздо более короткие.
Проблема решается несколькими способами.
Во-первых, с помощью сплайсинга эта
одна РНК превращается в упрощенном варианте еще в одну, более короткую. При
этом последовательности, кодирующие ENV полипептид, оказываются рядом с инициирующим кодоном, ближайшим к
кэп-сайту, и начинают транслироваться.
Во-вторых, разными для разных
ретровирусов способами они ухитряются обойти стоп - кодон после открытой рамки
считывания GAG и синтезировать сплавленный полипетид GAG-POL, который содержит
последовательности обоих групп белков.
В-третьих, полученные длинные
полипептиды подвергаются процессингу и разрезаются на множество белков, которые
и функционируют либо в роли регуляторных, как, например, обратная
транскриптаза, либо в роли структурных, как, например, белки оболочки зрелых
вирусов. [3]
Иными словами, ретровирусы
используют гибкую тоталитарную систему для весьма тонкой регуляции синтеза
большого разнообразия белков под контролем одного промотора. Они дают урок, как
множественны пути молекулярного обеспечения жизни.
5.
T-лимфотропные вирусы человека
Т-лимфотропный вирус человека (англ.
Human T-lymphotropic virus, HTLV) - это серотип в виде Т-лимфотропного вируса
обезьян, вызывающий у людей такие злокачественные новообразования лимфоидной и
кроветворной тканей, как Т-клеточный лейкоз и тропический спастический
парапарез.
Т-лимфотропный вирус человека типа 1
(HTLV-I) выделен в 1980 г. из опухолевых
клеток больного, заболевание которого вначале расценили как грибовидный микоз.
Позже стало ясно, что это другая форма лимфомы, впервые выявленная в Японии и
названная Т-клеточным лейкозом-лимфомой взрослых. [16]
По данным серологических
исследований, Т-лимфотропный вирус человека типа 1 вызывает два тяжелых
заболевания: Т-клеточный лейкоз-лимфому взрослых и тропический спастический
парапарез (другое название - миелопатия, вызванная Т-лимфотропным вирусом
человека типа 1).
Т-лимфотропный вирус человека типа 2
выделен в 1982 г. от больного с необычной формой волосатоклеточного лейкоза,
поражавшего Т-лимфоциты. Ранние эпидемиологические исследования не выявили
связи Т-лимфотропного вируса человека типа 2 с каким-либо заболеванием, но в
дальнейшем такая связь была установлена, особенно среди инъекционных
наркоманов. [16]
Здесь рассмотрен только
Т-лимфотропный вирус человека типа 1. Молекулярная биология Т-лимфотропного
вируса человека типа 2 во многом сходна.
Клеточный рецептор для
Т-лимфотропного вируса человека типа 1 пока не найден, но его ген картирован на
хромосоме 17. [1] Обычно вирус поражает только Т-лимфоциты, но иногда - и
другие клетки, например В-лимфоциты. Чаще всего развивается носительство
провируса, беспорядочно встроенного в различные участки ДНК лимфоцитов CD4.
Т-лимфотропный вирус человека типа 1
не содержит онкогенов и не обладает сродством к какому-либо определенному
участку клеточного генома. Его трансформирующие свойства связывают с белком Tax. Инфицирование in vitro
штаммом HTLV-I культуры Т-клеток человека подтверждает способность вызывать
рост независимо от экзогенных факторов роста Т-клеток. Вместо этого они меняют
поведение клетки-хозяина уникально взаимодействующими вирусными регуляторными
белками. В большинстве зараженных клеток вирусные гены не экспрессируются.
Белок Tax - единственный вирусный белок, обычно присутствующий в опухолевых
клетках, трансформированных in vivo, однако даже этот белок далеко не всегда обнаруживается у больных
с Т-клеточным лейкозом - лимфомой взрослых. Однако в клетках,
трансформированных in vitro, происходит активная транскрипция вирусной РНК и формирование
новых вирусов. Большинство трансформированных клеточных линий - результат
заражения нормальных Т-лимфоцитов in vitro. [9] Получение клеточных линий из опухолевых клеток больных
Т-клеточным лейкозом - лимфомой взрослых связано со значительными трудностями.
Хотя белок Tax непосредственно не
связывается с ДНК, он вызывает экспрессию генов, кодирующих факторы
транскрипции, цитокины, мембранные белки и рецепторы. Белок Tax активирует гены, обычно
контролируемые факторами транскрипции семейства ATF/CREB. Пока не ясно, каким
образом изменение уровня экспрессии клеточных генов приводит к трансформации
клетки. Предполагается, что важную роль в клеточной трансформации играет
аутокринная регуляция цитокинами по принципу положительной обратной связи. При
инфицировании HTLV-I или HTLV-II небольшая часть Т-клеток становится
«бессмертной», теряя потребность в экзогенном интерлейкине-2 для поддержания
роста. [17]
Поскольку белок Tax присутствует в
опухолевых клетках не постоянно, можно предположить, что этот белок необходим
для запуска трансформации, которая в дальнейшем развивается без его участия.
Как показали эпидемиологические исследования, трансформация клеток, зараженных
Т-лимфотропным вирусом человека типа 1, происходит редко; возможно, для нее
необходимо сочетание нескольких разных генетических нарушений. У больных
Т-клеточным лейкозом - лимфомой взрослых не найдено специфических хромосомных
аномалий, однако в отдельных случаях выявляют мутации гена ТР53 и транслокации,
затрагивающие гены антигенраспознающих рецепторов Т-лимфоцитов на хромосоме 14.
[9] Согласно исследованиям, белок Tax способен подавлять активность некоторых ферментов репарации ДНК,
вызывая накопление мутаций. Однако молекулярный механизм трансформирующего
действия Т-лимфотропного вируса человека типа 1 окончательно не выяснен.
5.1 Эпидемиология
Т-лимфотропного вируса человека
Т-лимфотропный вирус человека типа 1
передается от матери к ребенку (особенно через молоко), при половых контактах
(чаще от мужчины к женщине), а также при переливании инфицированной крови и
использовании инфицированных игл. Чаще всего заражение происходит в
перинатальном периоде. В отличие от ВИЧ, который может передаваться с
бесклеточным материалом, Т-лимфотропный вирус человека типа 1 менее заразен, и
для его передачи обычно необходим контакт между клетками. [5]
Т-лимфотропный вирус человека типа 1
широко распространен в юго-западной части Японии и на острове Окинава, где
заражено более 1 млн человек. Антитела к вирусу присутствуют в сыворотке у 35%
жителей Окинавы, у 10% жителей японского острова Кюсю и менее чем у 1% проживающих
в неэндемических районах Японии. Несмотря на высокий риск заражения, здесь
выявляют только 500 случаев Т-клеточного лейкоза-лимфомы взрослых ежегодно.
Очаги инфекции обнаружены и в других
странах Востока (например, на Тайване), в странах Карибского бассейна, включая
северо-восточную часть Южной Америки, в Центральной Африке, Италии, Израиле, в
Арктике, в юго - восточной части США. [8]
Хотя ранние эпидемиологические
исследования выявили растущее число носителей антител к Т-лимфотропному вирусу
человека типа 1 среди инъекционных наркоманов, применение более специфичных
методов серодиагностики показало, что в подавляющем большинстве случаев
инфекция у инъекционных наркоманов обусловлена Т-лимфотропным вирусом человека
типа 2.
Т-клеточный лейкоз - лимфома
взрослых редко возникает у лиц, инфицированных при переливании компонентов
крови; в то же время около 20% больных тропическим спастическим парапарезом
заражаются через кровь.
Развитие прогрессирующей
спастической или атаксической миелопатии у носителей антител к Т-лимфотропному
вирусу человека типа 1, вероятно, обусловлено прямым воздействием вируса на
нервную систему; похожее заболевание может быть вызвано ВИЧ или Т-лимфотропным
вирусом человека типа 2. Изредка у больных с тропическим спастическим парапарезом
антитела к вирусу отсутствуют в сыворотке, но обнаруживаются в СМЖ. [5]
У носителей Т-лимфотропного вируса
человека типа 1 вероятность заболеть в течение жизни Т-клеточным
лейкозом-лимфомой взрослых составляет 2-5%, такой же риск развития тропического
спастического парапареза. Эти заболевания встречаются только там, где
распространен Т-лимфотропный вирус человека типа 1, причем у 95% больных в
сыворотке присутствуют антитела к этому вирусу. [15]
Т-клеточный лейкоз-лимфома взрослых
развивается через 20-30 лет после заражения. В половине случаев тропического
спастического парапареза продолжительность латентного периода составляет около
3 лет; этот период может быть короче (в одном случае заболевание развилось
через 4 мес после переливания инфицированной крови), но может достигать и 20-30
лет.
В эндемических районах с заражением
Т-лимфотропным вирусом человека типа 1 связывают развитие ряда воспалительных и
аутоиммунных заболеваний, в том числе увеита (воспаление сосудистой оболочки
глаза, которая в норме содержит мало Т- и В-лимфоцитов), дерматита
(собирательное обозначение воспалительных поражений кожи), интерстициальной
пневмонии (характеризуется диффузной лимфоцитарной и плазмоцитарной
инфильтрацией интерстициальной ткани легких), ревматоидного артрита (системное
воспалительное заболевание соединительной ткани с преимущественным поражением
суставов) и полимиозита (аутоиммунное заболевание, характеризующееся диффузным
воспалением мышц). Однако доказать такую связь пока не удается.
.2 T-клеточная лейкемия
(лейкоз) взрослых (ATL)
Это заболевание обусловлено
Т-лимфотропным вирусом человека типа 1 - представителем семейства ретровирусов.
Опухоль проявляется генерализованным
увеличением лимфоузлов, гепатоспленомегалией (характеризуеся отсутствием
активности липопротеидлипазы и тяжелой гипертриглицеридемией), поражением кожи,
остеолизом (рассасывание участка костной ткани без замещения ее какой-либо
другой тканью). Характерны гиперкальциемия (увеличение содержание кальция в
сыворотке крови выше нормы), повышение активности лактатдегидрогеназы в
сыворотке. Опухолевые клетки полиморфны, экспрессируют CD4. Поражение кожи бывает
представлено папулами, бляшками, опухолевидными образованиями, изъязвлениями.
Инфильтрация костного мозга незначительна, анемия и тромбоцитопения
нехарактерны.
Опухоль неуклонно прогрессирует,
лечение малоэффективно.
Полихимиотерапия позволяет 50-70%
больных достичь полной ремиссии, однако у половины из них ремиссия длится менее
12 мес. [1]
Из-за глубокого иммунодефицита очень
высока частота вторичных инфекций, многие из которых обусловлены
условно-патогенными микроорганизмами.
Описана также хроническая форма
заболевания - с поражением кожи, но без гепатоспленомегалии и увеличения
лимфоузлов. Характерен умеренный лимфоцитоз (увеличение числа лимфоцитов в
единице объема крови), доля опухолевых клеток в крови невелика.
Продолжительность жизни таких больных может достигать нескольких лет - пока
болезнь не перейдет в острую форму.
Выделяют четыре формы Т-клеточного
лейкоза-лимфомы взрослых: острую, лимфоматозную, хроническую и тлеющую. [1] При
любой форме заболевания опухоль развивается за счет моноклональной пролиферации
лимфоцитов CD4. Во всех таких клетках провирус встроен в ДНК одинаково и
обнаруживается уникальная перестройка генов, кодирующих антигенраспознающие
рецепторы Т-лимфоцитов.
Острая форма встречается в 60%
случаев; заболевание характеризуется коротким продромальным периодом (от
появления первых симптомов до постановки диагноза проходит около 2 нед) и
бурным течением (продолжительность жизни - 6 мес). Клинические проявления:
быстро прогрессирующие поражение кожи и поражение легких, гиперкальциемия и
лимфоцитоз. [1] Появляются атипичные лимфоциты с дольчатыми ядрами или
атипичные лимфоциты с ядрами в виде раздвоенного копыта. В ДНК опухолевых
клеток встроен провирус. Уровень CD25 в сыворотке служит опухолевым маркером. Анемия и
тромбоцитопения наблюдаются редко. Поражения кожи иногда трудно отличить от
сыпи при грибовидном микозе. Часто возникающие очаги лизиса костной ткани
обычно содержат не опухолевые клетки, а остеокласты (разрушают костный
матрикс). Поражение костного мозга в большинстве случаев носит очаговый
характер, хотя при цитологическом исследовании обнаруживают бластные клетки.
Заболевание сопровождается
иммунодефицитом, на фоне которого возникают оппортунистические инфекции,
аналогичные тем, что встречаются при СПИДе. Патогенез иммунодефицита не
установлен. Изменения на рентгенограмме грудной клетки в половине случаев
обусловлены лейкозной инфильтрацией легких, а остальное приходится на
пневмонии, вызванные условно-патогенными возбудителями (Pneumocystis carinii и другими грибами).
Желудочно-кишечные нарушения практически всегда связаны с оппортунистической
инфекцией. В отличие от других лимфом, поражающих ЦНС, при Т-клеточном
лейкозе-лимфоме взрослых содержание белка в СМЖ может оставаться в норме.
Диагноз подтверждает присутствие в СМЖ опухолевых клеток.
Лимфоматозная форма развивается у
20% больных. По клинической картине и течению данная форма напоминает острую,
но отличается малым количеством атипичных лимфоцитов в крови и выраженным
увеличением лимфоузлов.
При хронической форме ЦНС, кости и
ЖКТ обычно не поражаются, а концентрация кальция и активность ЛДГ в сыворотке
остаются нормальными. Обычно продолжительность жизни больных - 2 года. Иногда
хроническая форма переходит в острую.
Тлеющая форма встречается не более
чем у 5% больных. ДНК моноклональных опухолевых клеток содержит встроенный
провирус; доля атипичных лимфоцитов в крови - менее 5%; гиперкальциемия,
лимфаденопатия и гепатоспленомегалия, а также изменения со стороны ЦНС, костей
и ЖКТ отсутствуют, но легкие и кожа могут поражаться. Обычно продолжительность
жизни больных - 5 лет и более. [16]
5.3 Тропический
спастическмй парапарез
Тропический спастическмй парапарез -
ретровирусное заболевание, вызываемое T-лимфоцитарным вирусом человека 1-го типа. Характеризуется
прогрессирующим поражением спинного мозга.
Это заболевание, называемое также
миелопатией (общее название невоспалительных, обычно протекающих хронически
поражений спинного мозга), вызванной Т-лимфотропным вирусом человека типа 1,
проявляется медленно прогрессирующим нижним спастическим (возникающий во время
спазмов или напоминающий по своему проявлению спазм) парапарезом (легкая
степень паралича, поражающего обе ноги), часто в сочетании с нейрогенной
дисфункцией мочевого пузыря. Типичный возраст начала - 20 - 40 лет, гораздо
чаще болеют женщины. Заболевание несколько напоминает рассеянный склероз
(хроническое прогрессирующее заболевание человека, характеризующееся развитием
очагов распада миелина в центральной и периферической нервной системе).
Клинические проявления: слабость или
спастичность мышц одной или обеих ног, боль в спине и недержание мочи.
Нарушения чувствительности обычно не выражены, но может развиться нейропатия
(заболевание периферических нервов, обычно вызывающее ослабление и потерю
чувствительности пораженного участка тела). Обычно заболевание начинается
незаметно и принимает форму медленно и неуклонно прогрессирующей миелопатии
грудного отдела спинного мозга; через 10 лет после постановки диагноза треть
больных прикованы к постели, а половина не могут ходить без поддержки. [16] При
неврологическом обследовании выявляют спастический парапарез или параплегию
(отсутствие произвольных движений в обеих руках или обеих ногах) с
гиперрефлексией (усиление рефлексов), клонус стопы (беспорядочные движения) и
патологические разгибательные рефлексы.
На МРТ (магнитно-резонансная
тамография) видны изменения в белом веществе и в паравентрикулярных областях
головного мозга, а также в спинном мозге. Оболочки и вещество спинного мозга
содержат воспалительные инфильтраты; разрушается миелин.
При тропическом спастическом
парапарезе репродукция вируса происходит более интенсивно и иммунный ответ у
больных выражен сильнее, чем при Т-клеточном лейкозе-лимфоме взрослых. Антитела
к вирусу, по-видимому, вырабатываются в СМЖ и присутствуют в сыворотке, где их
титр обычно ниже. Предполагают, что при тропическом спастическом парапарезе
происходит аутоиммунное разрушение нервных клеток Т-лимфоцитами, которые
специфичны к вирусным белкам, таким, как белок Tax и белок Env.
В 5-20% случаев выявляются
нарушения: повышение сухожильных рефлексов в руках, признаки поражения лобных
долей, черепных нервов (нейропатия зрительного нерва, нейросенсорная
тугоухость, нистагм (непроизвольные ритмические судорожные движения глазного
яблока), диплопия (двоение в глазах), нейропатия лицевого нерва), мозжечка
(тремор, дисметрия).
У 25-60% больных наблюдается
небольшой лимфоцитоз (до 50 в мкл), чаще умеренно повышен уровень белка. [9]
ПЦР позволяют обнаружить в СМЖ и лимфоцитах крови вирусную РНК. Вирус может
быть выделен из крови и СМЖ.
Лечения нет. В части случаев
помогают преднизолон или другие глюкокортикоиды внутрь. Определенные надежды
связаны с зидовудином - он препятствует репликации вируса и тем самым уменьшает
его прямое повреждающее действие на клетки.
5.4 T-лимфотропный вирус
человека типа 2
Пути передачи - как у
Т-лимфотропного вируса человека типа 1. Т-лимфотропный вирус человека типа 2
реже передается половым путем.
Сходство в строении Т-лимфотропных
вирусов человека типа 1 и 2 до недавнего времени препятствовало созданию
высокоспецифичных серологических методов, поэтому при эпидемиологических
исследованиях нередко эти вирусы не разделяли. Обследование больших групп
инъекционных наркоманов с применением высокоспецифичных серологических методов
показало, что в подавляющем большинстве случаев они заражены Т-лимфотропным
вирусом человека типа 2.
Т-лимфотропный вирус человека типа 2
был более распространен на юго-западе и центральном западе США, а
Т-лимфотропный вирус человека типа 1 - на северо-востоке США. Около 3%
обследуемых были заражены вирусами обоих типов. [1]
Поскольку среди инфицированных
Т-лимфотропным вирусом человека типа 2 значительно преобладают женщины, сделан
вывод, что этот вирус легче передается от мужчин к женщинам, чем от женщин к
мужчинам.
Хотя Т-лимфотропный вирус человека
типа 2 был выделен у одного больного с Т-клеточным вариантом волосатоклеточного
лейкоза, его этиологическую связь с каким-либо заболеванием доказать не
удалось. Однако по некоторым данным, Т-лимфотропный вирус человека типа 2 может
играть роль в развитии ряда заболеваний нервной системы, крови и кожи. Эти
факты требуют проверки, особенно с учетом нечеткого различения Т-лимфотропных
вирусов человека типа 1 и 2 в ранних исследованиях.
.5 Профилактика T-лимфотропного вируса
человека
Принципы профилактики заражения
Т-лимфотропным вирусом человека типа 1 очевидны: в эндемических районах следует
отказаться от кормления детей грудью; все доноры должны проходить обследование
на носительство антител к Т-лимфотропному вирусу человека типа 1; для
предупреждения половой передачи вируса необходимо использовать презервативы;
для инъекций следует применять только одноразовые иглы. Добросовестное
следование этим принципам должно существенно ограничить распространение
инфекции.
Заключение
Онкогенные вирусы человека обладают
рядом общих биологических свойств, а именно:
1) вирусы лишь инициируют
патологический процесс, усиливая пролиферацию и генетическую нестабильность
инфицированных ими клеток;
) у инфицированных онкогенными
вирусами лиц возникновение опухоли, как правило, событие нечастое: один случай
новообразования возникает среди сотен, иногда тысяч инфицированных;
) после инфицирования до
возникновения опухоли имеет место продолжительный латентный период, длящийся
годами, иногда десятилетиями;
) у большинства инфицированных лиц
возникновение опухоли не является обязательным, но они могут составить группу
риска, с более высокой возможностью ее возникновения;
) для злокачественной
трансформации инфицированных клеток необходимы дополнительные факторы и
условия, приводящие к селекции наиболее агрессивного опухолевого клона.
Ретровирусы пронизывают жизнь многих
существующих на земле видов от дрожжей и дрозофилы, до приматов и человека. Это
вирусы, которые, как и другие вирусы, для собственного размножения используют
сложную молекулярную и надмолекулярную систему жизнеобеспечения клетки,
заставляя ее подчиняться своим регуляторным сигналам. Но это и необычные
вирусы, поскольку они подстраивают свой жизненный цикл под жизненный цикл
клетки-хозяина, превращая свою генетическую молекулу - РНК в ДНК и стабильно
встраивая эту ДНК в геном клетки.
Изучение ретровирусов изменило
представления не только о направлении потока генетической информации, но и об
этиологии некоторых злокачественных новообразований, а также об онкогенах, как
о нормальных генах клетки-хозяина, измененных вирусным геномом.
Уникальные особенности ретровирусов
побудили к поиску возможностей их использования в качестве переносчиков генов в
клетки определенного типа (генотерапии). Цель генотерапии - исправление генных
дефектов либо придание клеткам новых полезных свойств (например, введение в
опухолевые клетки гена тимидинкиназы сообщает им чувствительность к
ганцикловиру). Одно из возражений против такого подхода - риск того, что
способный к репродукции ретровирус-переносчик вызовет репродукцию и эндогенных
ретровирусов, последствия которой непредсказуемы. Активация эндогенных
ретровирусов представляется вполне реальной: обнаружение на поверхности опухолевых
клеток белков эндогенных ретровирусов свидетельствует, что клеточная
трансформация вызывает активацию обычно не экспрессирующихся вирусных генов.
Заболевания, вызванные
Т-лимфотропным вирусом человека типа 1, встречаются редко, но они неизлечимы.
Т-клеточный лейкоз-лимфома взрослых обладает высокой чувствительностью к
полихимиотерапии, применяемой для лечения других лимфом; однако на фоне лечения
возникают оппортунистические инфекции, и в большинстве случаев заболевание
рецидивирует через 4-10 мес после ремиссии. [15] Назначение интерферона альфа в
комбинации с зидовудином дает больший процент ремиссий, оказывает меньше
побочных эффектов по сравнению со стандартной химиотерапией и может увеличивать
продолжительность жизни больных.
Поскольку четкая связь между
прогрессированием заболевания и репродукцией вируса отсутствует, эффективность
зидовудина (аналог тимидина, подавляющий синтез ДНК), по-видимому, связана с
его цитотоксическим, а не противовирусным действием. Обнадеживающие результаты
получены в экспериментах по применению антител к рецепторам ИЛ-2, меченных 90Y, но широкого распространения этот
метод не получил.
При тропическом спастическом
парапарезе противовоспалительная терапия глюкокортикоидами позволяет добиться
некоторого улучшения. Антиретровирусные препараты неэффективны. Лечение при
данном заболевании обязательно включает физиотерапию и реабилитационные
мероприятия.
Таким образом за время, прошедшее
после открытия Пэйтоном Раусом онкогенного вируса, вызывающего саркому у кур,
сделан огромный прогресс в наших знаниях о биологии и механизмах вирусного
канцерогенеза для большинства открытых в настоящее время онкогенных вирусов
человека. Остается однако много вопросов, на которые до сих пор не получены
ответы, связанные, например, с биологией взаимоотношений между онкогенным
вирусом и инфицированным им хозяином, спектром типов клеток, естественно
инфицированных этими вирусами in vivo, защитными механизмами, позволяющими вирусу персистировать в
организме, несмотря на его иммунологическую защиту, и др. Важной задачей
исследований остается разработка эффективных вакцин или других средств иммунной
интервенции против вирус-ассоциированных опухолей, успешное решение которой
внесет важный вклад в борьбу за здоровье человечества.
Список литературы
1. Franchini G: Molecular mechanisms of human T-cell
leukemia/lymphotropic virus type I infection // Blood, 1995, Vol. 86, Р. 3619-3639.
. Retroviruses / edited by John M. Coffin, Stephen H.
Hughes, Harold E. Varmus. CSHL Press, 1997. 843 с.
. Альштейн А.Д. Семейство Retroviridae // Общая и частная
вирусология, 1982. Т. 2. C. 240-289.
. Быковский А.Ф. Онкогенные вирусы (атлас) // Быковский
А.Ф., Клицунова Н.В., Миллер Г.Г., Мартыненко В.Б., Горохова Л.В. - М.:
Медицина, 1983, 224 с.
. Внутренние болезни по Тинсли Р. Харрисону. Книга 3.
Инфекционные болезни // Э. Фаучи, Ю. Браунвальд, К. Иссельбахер, Дж. Уилсон,
Дж. Мартин, Д. Каспер, С. Хаузер, Д. Лонго / Пер. с англ. под общей ред. Н.Н.
Алипова, Е.Р. Тимофеевой. М.: Практика, 2005. 605 с.
. Гурцевич В.Э. Онкогенные вирусы человека: от латентного
вирусоносительства к канцерогенезу // Вопросы онкологии. 2005 г. №1. С. 8-12.
. Гурцевич В.Э. Вирусы, онкогенные для человека //
Информационный бюллетень. 2006. №1 (3). С. 8-12.
. Гурцевич В.Э. Молекулярно-биологический и филогенетический
анализ вариантов Т - лимфотропного ретровируса человека первого типа (HTLV-1) // Гурцевич В.Э.,
Афанасьева Т.А., Галецкий С.А., Павлиш О.А., Сенюта Н.Б., Степина В.Н., Сусова
О.Ю., Сырцев А.В., Яковлева Л.С. / Информационный бюллетень РФФИ. 1994. Т. 2.
№4. С. 86-89.
. Гурцевич В.Э., Сенюта Н.Б. HTLV-1 как канцерогенный
фактор и инструмент изучения миграционной истории // Вопросы Вирусологии, 1998,
№2, С. 62-66.
. ДеМартини Д.К. Онкогенез ретровирусов на модели рака
легких овец // Российский ветеринарный журнал. 2005. №1. С. 9-11.
. Кочарова Н.П. Классификация ретровирусов и характеристика
вируса лейкоза крупного рогатого скота // Ветеринария. 2001, №4, С. 10-20.
. Л.Н. Нефедова, А.И. Ким Эволюция от ретротранспозонов к
ретровирусам: источник и происхождение гена env // Журнал общей
биологии, Том 68, 2007. №6. С. 459-463.
. Лапин Б.А. Различия последовательностей ДНК в геноме
ретровирусов семейства HTLV-1/STLV-1 у разных представителей отряда приматов и
возможная связь структуры вирусного генома с онкогенными свойствами вируса //
Лапин Б.А., Агрба В.З., Чикобава М.Г., Яковлева Л.А. / Информационный бюллетень
РФФИ. 1997. Т. 5. №4. С. 63-69.
. Лапин Б.А. Анализ взаимосвязи между структурой
Т-лимфотропного ретровируса STLV-1 и его онкогенностью на модели
злокачественной лимфомы бурых макаков // Информационный бюллетень РФФИ. 1995.
Т. 3. №4. С. 478-483.
. Поль Нейман. Онкогены и неопластические заболевания. //
Внутренние болезни. Книга 2/ Е. Браунвальд и др. М.: Медицина, 1993. - Глава
59. - С. 187 - 199.
. Роберт К. Галло, Антони С. Фаучи. Т-лимфотропные вирусы
человека. // Внутренние болезни. Книга 8/ Е. Браунвальд и др. М.: Медицина,
1993. - Глава 293. - С. 7-14.
. Сусова О.Ю., Гурцевич В.Э. Область РХ HTLV-1 в жизненном цикле
вируса и канцерогенезе // Молекулярная Биология, 2003, Т.37, №3, С. 1-12.