Биохимия спорта
Контрольная
работа № 1
Биохимия
спорта
1. Общая
характеристика и роль макроэргических соединений в обмене веществ. Укажите
известные Вам макроэргические вещества
Главными материальными носителями свободной
энергии в органических веществах являются химические связи между атомами,
поэтому при преобразовании химических связей в молекуле уровень свободной
энергии соединения изменяется. Если изменение уровня свободной энергии
соединения при возникновении или распаде химической связи составляет около 12,5
кДж/моль преобразуемого вещества, то такая связь по своему энергетическому
уровню считается нормальной. Именно такую размерность имеет изменение уровня
свободной энергии при преобразовании большинства связей в органических
соединениях. Однако при новообразовании и распаде некоторых связей уровень
свободной энергии в молекулах ряда органических соединений изменяется в гораздо
большей степени и составляет 25-50 кДж/моль и более. Такие соединения
называются макроэргическими соединениями, а связи, при преобразовании которых
наступают столь крупные изменения в энергетическом балансе вещества, ‒
макроэргическими связями. Последние в отличие от обычных связей обозначают
значком “~”.
Макроэргические связи представлены
преимущественно сложноэфирными, в том числе и тиоэфирными, ангидридными и
фосфоамидными связями. Однако наиболее интересно, что почти все известные
соединения с макроэргическими связями содержат атомы Р и S, по месту которых в
молекуле эти связи локализованы.
Именно та энергия, которая высвобождается при
разрыве макроэргических связей, поглощается при синтезе органических соединений
с более высоким уровнем свободной энергии, чем исходные. В то же время запасы
макроэргических веществ в организме постоянно пополняются путем аккумулирования
энергии, выделяющейся при понижении энергетического уровня распадающихся
соединений.
Таким образом, макроэргические вещества
выполняют функцию и доноров, и акцепторов энергии в обмене веществ; они служат
как аккумуляторами, так и проводниками энергии в биохимических процессах. Кроме
того, им свойственна роль трансформаторов энергии, так как они способны
преобразовывать стационарную форму энергии химической связи в мобильную, т.е. в
энергию возбужденного состояния молекулы. Последний вид энергии и служит непосредственным
источником реакционной способности молекул; преобразуясь снова в стационарную
форму энергии химической связи, он энергетически обеспечивает видоизменение
веществ, их преобразование, т.е. их обмен в организме.
К макроэргическим соединениям относятся, главным
образом, аденозинтрифосфорная кислота (АТФ) и вещества, способные образовывать
АТФ в ферментативных реакциях переноса преимущественно фосфатных групп, а также
нуклеозидтри- (или ди)-фосфорные кислоты, пирофосфорная и полифосфорная
кислоты, креатинфосфорная, фосфопировиноградная, дифосфоглицериновая кислоты,
ацетил- и сукцинилкоферменты А, аминоацильные производные адениловой и
рибонуклеиновых кислот и другие.
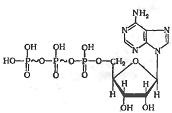
Аденозинтрифосфорная кислота (АТФ)
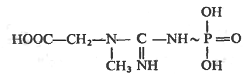
Креатинфосфат

Ацетилкоэнзим А
Энергия, которая выделяется при распаде
макроэргических соединений и за счет которой может быть совершена та или иная
работа, используется не только для химического синтеза. Она может служить в
организме для теплообразования, свечения, накопления электричества, выполнения
механической работы и т. п. При этом химическая энергия преобразуется в
тепловую, лучистую, электрическую, механическую и пр. Принципиально важно то,
что преобразование химической энергии в другие ее виды протекает в организме
при обязательном участии соединений с макроэргическими связями, в частности
АТФ. В молекуле АТФ происходит трансформация стабильной энергии макроэргических
межфосфатных химических связей в подвижную энергию возбуждения электронов
пуриновой части молекулы; это и есть, вероятно, первый этап преобразования
энергии в организме. Именно поэтому АТФ занимает центральное место в
энергетическом обмене живой материи.
Как видно из рис. 1, АТФ играет выдающуюся роль
как при запасании, так и при расходовании энергии, т.е. является ключевым
веществом в энергетическом обмене организма. Известно много реакций, при
посредстве которых АТФ возникает из других макроэргических соединений, и
наоборот, есть много процессов, приводящих к синтезу макроэргических соединений
при участии АТФ. Такие, например, макроэргические соединения, как
креатинфосфат, фосфоенолпировиноградная кислота и 1,3-дифосфоглицериновая
кислота, при взаимодействии с АДФ образуют АТФ с выделением креатина,
пировиноградной кислоты и 3-фосфоглицериновой кислоты. Эти и подобные им
соединения принято обозначать как АТФ-генерирующие вещества. Перечисленные
реакции обратимы, и при известных условиях равновесие может быть смещено в
сторону распада АТФ.
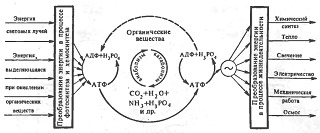
Рис. 1. Превращения энергии в живой природе
Обмен энергии в процессе жизнедеятельности не
исчерпывается превращением химической энергии в другие виды ее и наоборот (рис.
1); он носит более широкий характер. Так, в палочках и колбочках сетчатки глаза
световая энергия превращается в электрическую; в специфических структурах
внутреннего уха звуковая и гидродинамическая энергия переходит в электрическую
и т.п.
Трансформация одного вида энергии в другой
осуществляется в организмах в морфологически разнообразных элементах ‒
хлоропластах, мышцах, рецепторных аппаратах тканей и органов, сетчатке глаза,
люминесцентных органах и т. п. Однако всем этим разнообразным элементам
свойственны некоторые общие черты строения. Они отличаются наличием двухслойных
мембран с высоким содержанием липопротеинов в них и присутствием структурного
белка, связывающего в упорядоченные образования достаточно унифицированные
элементарные частицы. Последние включают в свой состав молекулы определенного
строения, которые, собственно, и осуществляют процесс трансформации энергии.
При этом энергия одного вида поглощается молекулой-преобразователем и
превращается в энергию другого вида. Простейшим примером механизма
внутримолекулярного превращения энергии молекулой-преобразователем служит
переход стационарной энергии химических связей трифосфатной группировки
молекулы АТФ в подвижную энергию возбуждения электронов ее пуриновой части.
Более сложным примером являются конформационные изменения белковых молекул в
процессе преобразования одного вида энергии в другой (например, мышечное
сокращение).
Обмен веществ и энергии представляет единый,
неразрывный процесс, где видоизменение вещества всегда сопровождается
выделением или поглощением свободной энергии и где выделившаяся или
поглотившаяся в том или ином количестве энергия обеспечивает распад или синтез
химических связей, т.е. по существу видоизменение самих веществ.
. Белки мышечной
ткани, их строение и функции
Среди белков мышечной ткани выделяют три
основные группы: саркоплазматические белки, на долю которых приходится около 35
%, миофибриллярные белки, составляющие около 45 %, и белки стромы, количество
которых достигает 20 %.
Саркоплазматические белки растворимы в воде и
слабых солевых растворах. Основную массу их составляют белки-ферменты,
локализованные главным образом в митохондриях и катализирующие процессы
окислительного фосфорилирования, а также многие ферменты гликолиза, азотистого
и липидного обменов, находящиеся в саркоплазме. К этой группе относится также
белок миоглобин, который связывает кислород с большим сродством, чем
гемоглобин, и депонирует молекулярный кислород в мышцах. В последнее время
открыта группа саркоплазматических белков парвальбуминов, которые способны
связывать ионы кальция, однако их физиологическая роль остается невыясненной.
Миофибриллярные белки включают сократительные
белки миозин, актин и актомиозин, а также регуляторные белки тропомиозин,
тропонин, α- и β-актинины.
Миофибриллярные белки обеспечивают сократительную функцию мышц.
Миозин является одним из основных сократительных
белков мышц, составляющий около 55 % общего количества мышечных белков. Из него
состоят толстые нити (филаменты) миофибрилл. Молекулярная масса этого белка -
около 470 000. В молекуле миозина различают длинную фибриллярную часть и
глобулярные структуры (головки). Фибриллярная часть молекулы миозина имеет
двуспиральную структуру (рис. 2).
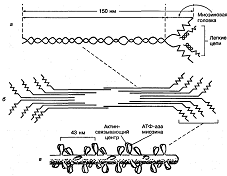
Рис. 2. Схема
строения молекулы миозина (а), миозинового пучка (б) и миозиновой толстой нити
(в)
В составе молекулы выделяют шесть субъединиц:
две тяжелые полипептидные цепи (молекулярная масса 200 000) и четыре легкие
цепи (молекулярная масса 1500-2700), расположенные в глобулярной части.
Основной функцией фибриллярной части молекулы миозина является способность
образовывать хорошо упорядоченные пучки миозиновых филаментов или толстые
протофибриллы. На головках молекулы миозина расположены активный центр АТФ-азы
и актинсвязывающий центр, поэтому они обеспечивают гидролиз АТФ и
взаимодействие с актиновыми филаментами.
Молекула миозина содержит значительное
количество глутаминовой аминокислоты и имеет большой отрицательный заряд, что
усиливает связывание свободных ионов Са2+ и Мg2+. В присутствии ионов Са2+
повышается АТФ-азная активность миозина и скорость гидролиза АТФ согласно
уравнению
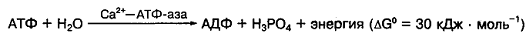
Химическая энергия АТФ, освобождающаяся в ходе
данной ферментативной реакции, используется для изменения конформации белка
миозина и генерации напряжения между толстыми и тонкими нитями миозина в
сокращающейся мышце. Посредством ионов Мg2+ миозин способен присоединять
молекулы АТФ и АДФ, а также взаимодействовать с молекулами актина, находящимися
в составе тонких нитей миофибрилл.
Актин - второй сократительный белок мышц,
который составляет основу тонких нитей (рис. 3). Известны две его формы -
глобулярный G-актин и фибриллярный F-актин. Глобулярный актин - это
шарообразный белок с молекулярной массой 42 000. На его долю приходится около
25 % общей массы мышечного белка. В присутствии Мg2+ актин подвергается
нековалентной полимеризации с образованием нерастворимого филамента в виде
спирали, получившего название F-актин. Обе формы актина не обладают
ферментативной активностью. Каждая молекула G-актина способна связывать один
ион Са2+, который играет важную роль в инициировании сокращения. Кроме того,
молекула G-актина прочно связывает одну молекулу АТФ или АДФ. Связывание АТФ
G-актином обычно сопровождается его полимеризацией с образованием F-актина и
одновременным расщеплением АТФ до АДФ и фосфата. АДФ остается связанной с
фибриллярным актином. Процесс полимеризации актина можно описать следующим
уравнением:
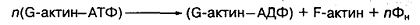
актин активирует АТФ-азу миозина, что создает
движущую силу процессу сокращения. Актин способен взаимодействовать с миозином,
образуя актомиозиновый комплекс. Молярное соотношение актина и миозина в
актомиозиновом комплексе - примерно 1:1. Нить F-актина может связывать большое
число молекул миозина. Существенным свойством актомиозинового комплекса
является диссоциация его в присутствии АТФ и Мg2+.
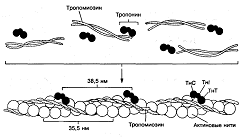
Рис. 3. Схема
строения актиновой, или тонкой нити
В состав тонких нитей наряду с актином входят и
другие минорные белки - тропомиозин, тропонины, актинины.
Тропомиозин (Тм) - это структурный белок
актиновой нити, представляющий собой вытянутую в виде тяжа молекулу. Две его
полипептидные цепи как бы обвивают актиновые нити. На концах каждой молекулы
тропомиозина расположены белки тропониновой системы, наличие которой характерно
только для поперечно-полосатых мышц.
Тропонин (Тн) является регуляторным белком
актиновой нити. Он состоит из трех субъединиц - ТнТ, ТнI и ТнС. Тропонин Т(ТнТ)
обеспечивает связывание этих белков с тропомиозином. Тропонин I (ТнI) блокирует
(ингибирует) взаимодействие актина с миозином. Тропонин С (ТнС) - это
Са2+-связывающий белок, структура и функции которого подобны широко
распространенному в природе белку кальмодулину. Тропонин С, как и кальмодулин,
связывает четыре иона Са2+ на молекулу белка и имеет молекулярную массу 17 000.
В присутствии Са2+ изменяется конформация тропонина С, что приводит к изменению
положения Тн по отношению к актину, в результате чего открывается центр
взаимодействия актина с миозином.
Таким образом, тонкий филамент миофибриллы
поперечно-полосатой мышцы состоит из F-актина, тропомиозина и трех тропониновых
компонентов - ТнС, ТнI и ТнТ. Кроме этих белков, в мышечном сокращении
участвует белок актинин. Обнаруживается он в зоне Z-линии, к которой крепятся
концы F-актиновых молекул тонких нитей миофибрилл. Белки мышечной стромы в
скелетной мышце представлены в основном коллагеном и эластином, которые входят
в состав сарколеммы и Z-линий миофибрилл. Эти белки обладают эластичностью,
большой упругостью, что имеет существенное значение для процесса сокращения и
расслабления мышцы.
. Аэробная
работоспособность, ее биохимические факторы
Аэробный механизм ресинтеза АТФ в обычных
условиях обеспечивает около 90 % общего количества АТФ, ресинтезируемой в организме.
Ферментные системы аэробного обмена расположены в основном в митохондриях мышц.
Механизм аэробного окисления питательных веществ носит название «окислительное
фосфорилирование.
В качестве субстратов аэробного окисления
используются глюкоза, высшие жирные кислоты, отдельные аминокислоты, кетоновые
тела, молочная кислота и другие недоокисленные продукты метаболизма. Все эти
вещества постепенно превращаются в единое вещество - ацетил-КоА, который далее
окисляется в цикле лимонной кислоты до конечных продуктов СО2 и Н2О с участием
многочисленных окислительных ферментов и вдыхаемого кислорода, доставляемого к
тканям гемоглобином эритроцитов крови, а в скелетных мышцах - с участием
кислорода, накапливаемого белком миоглобина. Энергия окисления накапливается в
восстановленной форме переносчиков водорода НАДН2 и ФАДН2, которые передают
высокоэнергетические электроны по дыхательной цепи на вдыхаемый кислород, а
протоны водорода создают на мембране митохондрий протонный градиент, который
является движущей силой для генерирования АТФ в процессе окислительного
фосфорилирования. Когда разница протонного градиента достигает определенной
величины (200 мВ), протоны движутся через мембрану митохондрий и
взаимодействуют с кислородом с образованием Н2О.
При потреблении одинакового количества кислорода
объем выполненной работы будет большим в том случае, если энергетическим
субстратом будут углеводы, а не жиры. Углеводы являются более эффективным
"топливом" по сравнению с жирами, так как на их окисление требуется
на 12 % меньше кислорода в расчете на молекулу синтезированной АТФ. Поэтому в
условиях недопоступления кислорода при физических нагрузках энергообразование
происходит в первую очередь за счет окисления углеводов.
Поскольку запасы углеводов в организме
ограничены, ограничена и возможность их использования в видах спорта, требующих
проявления общей выносливости. После исчерпания запасов углеводов к
энергообеспечению работы подключаются жиры, запасы которых позволяют выполнять
очень длительную работу. Так, в марафонском беге за счет использования
мышечного гликогена работа мышц продолжается в течение 80 мин. Часть АТФ может
быть получена за счет мобилизации гликогена печени. Следовательно, за счет
углеводов можно обеспечить энергией 75 % марафонской дистанции. Остальное
количество энергии образуется за счет окисления жирных кислот. Учитывая, что
жирные кислоты содержат большое количество энергии, весьма важно развивать
способность организма спортсмена к более ранней их мобилизации для
энергообеспечения работы. Для этого рекомендуется периодически использовать в
тренировке аэробные нагрузки - бег на сверхдлинные дистанции (по 30-40 км и
более).
В качестве субстрата окисления могут
использоваться и белки-, которые распадаются на аминокислоты, способные
превращаться в глюкоз или другие метаболиты аэробного процесса окисления.
Однако вклад белков в образование энергии при мышечной деятельности составляет
всего 5-10%.
Максимальная мощность аэробного механизма
наименьшая и составляет 1,2 кДж∙кг-1∙мин-1 и в равной степени
зависит от скорости поступлениия и скорости утилизации О2 в клетках. Мощность
аэробного энергообразования оценивается по величине максимального потребления
кислорода (МПК), достигнутого при выполнении мышечной работы. У спортсменов эта
величина составляет в среднем 5,5-6 л∙мин-1, а у неспортсменов ‒
2,5-3,5 л∙мин-1. Поскольку она отражает скорость потребления О2 в
работающих мышцах, а на скелетные мышцы приходится большая часть активной массы
тела, то в целях сравнения аэробных способностей разных людей величины МПК
обычно выражают в расчете на 1 кг массы тела. У молодых людей, не занимающихся
спортом, МПК составляет 40-45 мл∙кг-1∙мин-1 (800-1000 Дж∙кг-1∙мин-1),
у спортсменов, занимающихся видами спорта на выносливость, ‒ 80-90 мл∙кг-1∙мин-1
(1600-1800 Дж∙кг-1∙мин-1).
Максимальная мощность аэробного процесса
достигается на 2-3-й минуте неинтенсивной работы у спортсменов и на 4-5-й
минуте ‒ у неспортсменов и может поддерживаться до 15-30-й минуты. В
более длительных упражнениях она постепенно уменьшается. При марафонском беге
средний уровень аэробной энергопродукции составляет 80-85 % максимальной
аэробной мощности.
Наиболее интенсивно протекают процессы аэробного
энергообразования в медленносокращающихся мышечных волокнах. Следовательно, чем
выше процентное содержание таких волокон в мышцах, несущих основную нагрузку
при выполнении упражнения, тем больше максимальная аэробная мощность у
спортсменов и тем выше физическая работоспособность при продолжительной работе.
Метаболическая емкость аэробного механизма
практически безгранична, поскольку имеются большие запасы энергетических
источников, дающих большое количество ресинтезируемой АТФ. Так, при окислении 1
молекулы глюкозы в аэробных условиях образуется 38 молекул АТФ, тогда как в
анаэробных - только 2 АТФ:
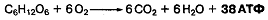
При окислении высших жирных кислот, например
пальмитиновой, образуется еще больше энергии:

Эффективность энергообразования этого механизма
также высокая и составляет около 50 %. Определяется она по порогу анаэробного
обмена (ПАНО): у нетренированных людей ПАНО наступает при потреблении кислорода
примерно 50 % от уровня VO2max, а у высокотренированных на выносливость - при
80-90 % МПК. Увеличение показателя ПАНО под влиянием специальной тренировки
связано с повышением (адаптацией) возможностей кислородтранспортной системы, а
также ферментативных, регуляторных и других систем.
Аэробный механизм энергообразования является
основным при длительной работе большой и умеренной мощности: беге на дистанции
5000 и 10 000 м, марафонском беге на 25 000 м, велогонках, плавании на 800 и
1500 м, беге на коньках на 5000 и 10 000 м. Он является биохимической основой
общей выносливости.
4. Дайте
характеристику ведущего механизма энергообеспечения при работе максимальной
мощности (длительность ее - 15 сек., химическая сущность, энергетические
субстраты, продукты распада, показатели, биологическая роль)
Максимальную мощность и эффективность
образования АТФ имеет креатинфосфокиназный механизм, который является
алактатным анаэробным механизмом ресинтеза АТФ и включает использование
имеющейся в мышцах АТФ и быстрый ее ресинтез за счет высокоэнергетического
фосфогенного вещества - креатинфосфата, концентрация которого в мышцах в 3-4
раза выше по сравнению с АТФ.
Креатинфосфат локализован непосредственно на
сократительных нитях миофибрилл и способен быстро вступать в реакцию перефосфорилирования
с участием фермента креатинфосфокиназы (КФК) согласно уравнению
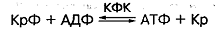
В скелетных мышцах человека КФК обладает высокой
активностью, а КрФ и АДФ проявляют высокое химическое сродство друг к другу,
что приводит к усилению этой реакции в самом начале мышечной работы, когда
начинает расщепляться АТФ и накапливаться АДФ.
Максимальная мощность креатинфосфокиназной
реакции развивается уже на 0,5-0,7-й секунде интенсивной работы, что
свидетельствует о большой скорости развертывания, и поддерживается в течение
10-15 с у нетренированных, а у высокотренированных спринтеров может
удерживаться 25-30 с.
Креатинфосфокиназный механизм первым включается
в процесс ресинтеза АТФ в начале интенсивной мышечной работы и протекает с
максимальной скоростью до тех пор, пока не исчерпаются запасы КрФ в мышцах. Эта
реакция выполняет роль своеобразного "энергетического буфера", так
как обеспечивает поддержание постоянства содержания АТФ в мышцах при резком ее
использовании или избыточном накоплении АТФ в период отдыха. В последнем случае
интенсивно протекает реакция перефосфорилирования между АТФ и свободным
креатином, т.е. увеличивается скорость обратной креатинфосфокиназной реакции.
Максимальная мощность креатинфосфокиназной
реакции составляет 3,8 кДж∙кг-1∙мин-1, что значительно выше
мощности анаэробного гликолиза (в 1,5-2 раза) и аэробного процесса (в 3-4
раза). Общие запасы фосфогенов у нетренированных испытуемых обеспечивают
образование энергии в количестве около 420 Дж∙кг-11 мышечной ткани, а у
тренированных ‒ в 2 раза больше. Скорость расщепления КрФ в работающих
мышцах находится в прямой зависимости от интенсивности выполняемого упражнения
либо величины мышечного напряжения, а также активности фермента КФК.
Метаболическая емкость этого механизма невелика,
так как запасы КрФ в мышцах превышают содержание АТФ всего в 3 раза (табл. 1).
Следовательно, поддержание уровня АТФ за счет креатинфосфата ограничено его
запасами, которые уже на 5-й секунде уменьшаются на 1/3, а на 15-й секунде ‒
наполовину. После этого скорость креатинфосфокиназной реакции уменьшается, а в
ресинтез АТФ вовлекается гликолитический и окислительный механизмы.
Таблица 1 Запасы
АТФ и КрФ в скелетных мышцах человека (в расчете на среднюю массу тела 70 кг)
|
Метаболиты
|
Концентрация
в мышцах, ммоль∙кг-1 мышц
|
Общее
содержание в организме, ммоль
|
Количество
выделенной энергии, кДж∙кг-1
|
4-6
|
120-180
|
0,17-0,25
|
|
КрФ
|
15-16
|
450-510
|
0,63-0,71
|
|
Общие
запасы фосфогенов (АТФ + КрФ)
|
19-23
|
570-690
|
0,80-0,96
|
Эффективность креатинфосфокиназной реакции очень
высокая (76 %), так как реакция протекает непосредственно между двумя
веществами на миофибриллах. Запасы КрФ зависят от содержания креатина в
организме. Введение креатина в виде пищевых добавок приводит к увеличению
запасов креатинфосфата в мышцах (от 84 до 91 ммоль∙кг-1 сухой мышечной
ткани), а также к повышению физической работоспособности.
Содержание креатинфосфата в скелетных мышцах
увеличивается в процессе адаптации организма к скоростным и силовым физическим
нагрузкам в 1,5-2 раза, что влияет на емкость креатинфосфокиназного механизма
энергообеспечения мышечной деятельности.
Креатинфосфокиназный путь ресинтеза АТФ играет
решающую роль в энергообеспечении кратковременной работы максимальной
интенсивности в течение 15-30 с, например бег на 100 м, плавание на короткие
дистанции, прыжки, метания, тяжелоатлетические упражнения и т.п. Он
обеспечивает возможность быстрого перехода от покоя к работе, внезапных
изменений темпа по ходу ее выполнения, а также финишного ускорения. Функционирует
креатинфосфокиназная система преимущественно в быстросокращающихся мышечных
волокнах, поэтому составляет биохимическую основу скорости и локальной мышечной
силы (выносливости).
. Норма сахара в
крови. Как изменяется уровень глюкозы при выполнении работы различного
характера (бег 100 м, 800 м и 30 000 м)?
Концентрация глюкозы в крови взрослого человека
в норме поддерживается в пределах 4,4-6,0 ммоль∙л-1, или 80-120 мг% (в
100 мл крови) несмотря на значительные изменения ее потребления и поступления в
течение дня. Постоянный уровень глюкозы в крови регулируется прежде всего
печенью, которая может поглощать или выделять глюкозу в кровь в зависимости от
ее концентрации в крови и в ответ на воздействие гормонов. Повышение глюкозы в
крови после приема углеводной пищи активирует ферментативный процесс синтеза
гликогена в печени, а понижение ее уровня усиливает распад гликогена в печени
до глюкозы с последующим выделением ее в кровь.
Важную роль в регуляции постоянного содержания
глюкозы в крови играют гормоны, главным образом инсулин и глюкагон, проявляющие
взаимопротивоположное действие. Инсулин усиленно секретируется поджелудочной
железой при повышении глюкозы в крови после приема пищи и стимулирует
поступление глюкозы в скелетные мышцы, печень и жировую ткань, что активирует
синтез гликогена или жира (в жировой ткани). Глюкагон усиленно выделяется при
снижении глюкозы в крови и запускает процесс расщепления (мобилизации)
гликогена в печени, выделение глюкозы в кровь. При уменьшении концентрации
глюкозы в крови скелетные мышцы и печень в качестве источника энергии начинают
использовать жирные кислоты. Это также вносит свой вклад в поддержание
определенной концентрации глюкозы в крови.
При значительном поступлении углеводов с пищей
или интенсивном распаде гликогена в печени уровень глюкозы в крови может
превышать верхнюю границу нормы и достигать 10 ммоль∙л-1 и более, что
характеризуется как состояние гипергликемии. Гипергликемия может возникать и
при снижении использования глюкозы тканями, что наблюдается при тяжелом
заболевании ‒ сахарном диабете. Связано это заболевание со снижением
выработки гормона инсулина в поджелудочной железе (гипофункция), который
усиливает проникновение глюкозы в ткани, либо с потерей чувствительности
инсулиновых рецепторов к гормону. Временное повышение глюкозы в крови сразу
после приема пищи, насыщенной углеводами, называется алиментарной, или пищевой
гипергликемией. Через 2-3 ч после приема пищи содержание глюкозы в крови
нормализуется. Состояние гипергликемии может наблюдаться у некоторых
спортсменов перед стартом: оно улучшает выполнение кратковременных физических
нагрузок, но ухудшает выполнение длительной работы. Повышение концентрации
глюкозы в крови до 8,8-10 ммоль∙л-1 (почечный барьер для глюкозы)
приводит к появлению ее в моче. Такое состояние называется глюкозурией.
Снижение уровня глюкозы в крови до 3 ммоль∙л-1
и ниже (гипогликемия) наблюдается очень редко, так как организм способен
синтезировать глюкозу из аминокислот и жиров в процессе глюконеогенеза.
Гипогликемия может возникнуть при истощении запасов гликогена в печени в
результате напряженной длительной физической работы, например при марафонском
беге, или длительном голодании. Снижение концентрации глюкозы в крови до 2
ммоль∙л-1 вызывает нарушение деятельности мозга, эритроцитов, почек, для
которых глюкоза является главным энергетическим субстратом. При этом возможна
потеря сознания - гипогликемический шок или даже смерть. Для предотвращения
такого состояния в практике спорта используется дополнительное углеводное питание
во время длительной физической работы.
Глюкоза крови в большей степени (около 70 %)
используется тканями как энергетический источник и в меньшей степени (30 %) ‒
для пластических процессов. Более 5 % поступившей с пищей глюкозы депонируется
печенью в процессе синтеза гликогена. При малоподвижном образе жизни и
значительном потреблении углеводов с пищей до 40 % глюкозы превращается в жиры,
в том числе в холестерин. Около 90 % глюкозы крови потребляет мозг, где глюкоза
служит основным энергетическим субстратом. При мышечной деятельности, особенно
при длительной работе, ее больше используют скелетные мышцы, в которых запас
углеводных ресурсов истощается.
В состоянии покоя мышцы поглощают около 20 %
общего количества глюкозы, поступившей в кровь, а при нагрузке мощностью 60 %
МПК ‒ более 80 % глюкозы крови. Связано это с усилением ее доставки
кровотоком, повышением скорости транспорта через мембраны мышц и утилизации
мышцами. На степень потребления мышцами глюкозы крови влияет вид выполняемой
нагрузки, уровень тренированности, питание, половые особенности, метаболическое
состояние организма. Высокий уровень гликогена в мышцах, что характерно для
высокотренированных спортсменов на выносливость, а также повышенное содержание
свободных жирных кислот в крови снижают потребление мышцами глюкозы крови.
Гипоксия стимулирует поступление глюкозы в скелетные мышцы. У женщин распад
гликогена и окисление глюкозы при мышечной работе менее выражены, чем у мужчин.
При мышечной деятельности возрастает мобилизация
глюкозы из печени, где она депонируется в виде гликогена. Гликоген распадается
до глюкозы, которая выходит в кровь, что препятствует развитию гипогликемии.
Выход глюкозы из печени в кровь усиливается в 2-3 раза при мышечной
деятельности умеренной интенсивности и в 7-10 раз ‒ при напряженной
работе. Высокий уровень глюкозы в крови благодаря гомеостатической функции
печени при мышечной деятельности поддерживается до тех пор, пока в печени не
исчерпается запас гликогена. За счет запасов гликогена печени мышцы могут
выполнять работу большой мощности в течение 20-40 мин.
При напряженной мышечной работе запас гликогена
в печени существенно уменьшается уже через 1-2 ч, что приводит к снижению
уровня глюкозы в крови. С увеличением продолжительности работы определенный
вклад в поддержание глюкозы крови вносит процесс глюконеогенеза.
В процессе глюконеогенеза, который активен в
печени и почках, глюкоза синтезируется из аминокислот, глицерина, молочной и
пировиноградной кислот, что предупреждает исчерпание гликогена в тканях. При этом
вклад глюконеогенеза в поддержание глюкозы крови при кратковременной работе
незначительный (10-20 %), а при продолжительной работе (в течение нескольких
часов) возрастает до 50 % по отношению к общей глюкозе, образующейся в печени.
6. Утомление.
Укажите причины развития утомления при беге на 1000м?
Основными причинами утомления при выполнении
длительных упражнений большой и умеренной мощности становятся факторы,
связанные со снижением уровня энергообеспечения работающих мышц (исчерпание
внутримышечных запасов гликогена, накопление продуктов неполного окисления
жиров, избыточное накопление NН3 и ИМФ, развитие гипогликемического состояния),
а также нарушение электрохимического сопряжения в работающих мышцах и ухудшение
деятельности ЦНС в условиях выраженной гипертермии, дегидратации и сдвига
электролитного баланса организма. Таким образом, при выполнении длительных
упражнений большой и умеренной мощности причины, приводящие к возникновению
утомления, носят комплексный характер.
В большинстве случаев первичным звеном в
развитии утомления при выполнении длительных упражнений большой и умеренной
мощности являются изменения в объеме и характере внутримышечных энергетических
субстратов. В широком диапазоне усилий при длительной работе (начиная от 25 %
VO2 max и выше) значительная доля в ресинтезе АТФ приходится на окисление
углеводов. Окисление жиров характерно только для упражнений, относительная
мощность которых не превышает 50 % уровня VO2 max.
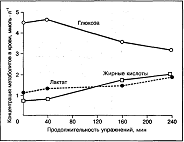
Рис. 4. Изменение
концентрации глюкозы, жирных кислот и лактата в крови при выполнении длительных
упражнений
Анаэробные источники энергии (КрФ и гликоген)
оказывают заметное влияние на энергетику работы только в тех видах длительных
упражнений, относительная мощность которых превышает значения лактатного и
креатинфосфатного порогов, локализованных на уровне 60-75 % VO2 max. В связи с
изменяющимся характером энергетического обеспечения при длительной работе
изменяется и динамика основных биохимических показателей крови (рис. 4). Содержание
глюкозы в крови в процессе выполнения длительной работы заметно снижается в
случае, когда длительность упражнения превышает 90 мин. Содержание молочной
кислоты и свободных жирных кислот в крови сохраняется на уровне покоя до тех
пор, пока не будет достигнуто значительное исчерпание углеводных ресурсов
организма. С этого момента содержание этих метаболитов в крови проявляет
тенденцию к повышению.
Конкретные причины утомления при длительной
работе могут быть обусловлены неспособностью работающих мышц поддерживать
заданную скорость ресинтеза АТФ из-за снижения углеводных запасов, а также
нарушениями в деятельности ЦНС из-за накопления аммиака и кетоновых тел в
организме.
Таким образом, при выполнении любого упражнения
можно выделить ведущие, наиболее нагружаемые звенья обмена веществ и функции
систем организма, возможности которых и определяют способность спортсмена
выполнять упражнения на требуемом уровне интенсивности и продолжительности. Это
могут быть регуляторные системы (ЦНС, вегетативная нервная, нейрогуморальная),
системы вегетативного обеспечения (дыхание, кровообращение, кровь) и
исполнительная (двигательная) система.
Комплексный анализ проблемы утомления в спорте,
проведенный физиологами, биохимиками, а также специалистами в области теории и
методики спортивной тренировки (Я.М. Коц, Н.Н. Яковлев, В.Н. Волков, Н.И.
Волков, В.Д. Моногаров, В.Н. Платонов и др.), убедительно показал, что
утомление следует рассматривать как следствие выхода из строя какого-либо
компонента в сложной системе органов и функций либо как нарушение взаимосвязи
между ними. Ведущим звеном в развитии утомления может стать любой орган и его
функция, если проявится несоответствие между уровнем физической нагрузки и
имеющимися функциональными резервами. Поэтому первопричиной снижения
работоспособности могут быть исчерпание энергетических резервов, тканевая
гипоксия, снижение ферментативной активности под влиянием "рабочего"
метаболизма тканей, нарушение целостности функциональных структур из-за
недостаточности их пластического обеспечения, изменение гомеостаза, нарушение
нервной и гормональной регуляции и др.
Выяснение механизмов утомления играет важную
роль в практике спорта для обоснования узловых положений спортивной тренировки.
В частности, утомление расценивается как фактор, стимулирующий мобилизацию
функциональных ресурсов, определяющий границы оптимального объема тренирующих
воздействий и обеспечивающий эффективность протекания адаптации, успешность
соревновательной деятельности и профилактику переадаптации.
. Понятие - выполнение
работы в «устойчивом состоянии» - приведите примеры
При переходе от состояния покоя к интенсивной
мышечной деятельности потребность в кислороде возрастает во много раз, однако
сразу она не может быть удовлетворена. Необходимо время, чтобы усилилась деятельность
систем дыхания и кровообращения и чтобы кровь, обогащенная кислородом, могла
дойти до работающих мышц. По мере усиления активности этих систем постепенно
увеличивается потребление кислорода в работающих мышцах. Если при работе ЧСС
превышает 150 уд∙мин-1, то скорость потребления О2 возрастает до тех пор,
пока не наступит истинное устойчивое состояние метаболических процессов, при
котором потребление О2 в данный момент времени точно соответствует потребности
организма в нем. макроэргический белок аэробный
глюкоза
Уровень потребления О2 в устойчивом состоянии
зависит от мощности выполняемого упражнения (рис. 5). При интенсивной работе
мощностью более 200 Вт (ЧСС 150-180 уд∙мин-1) устойчивое состояние не
устанавливается и потребление О2 может возрастать до конца работы либо до
достижения максимально возможного уровня. В последнем случае может наблюдаться
"ложное устойчивое состояние", когда потребление О2 некоторое время
(6-10 мин) поддерживается на максимальном уровне не потому, что потребность
организма в кислороде полностью удовлетворяется, а потому, что исчерпаны
возможности сердечнососудистой системы доставлять его к тканям. Эта система
существенно ограничивает доставку О2 к мышцам.

Рис. 5. Потребление
кислорода при выполнении упражнений различной интенсивности и продолжительности
Однако основным лимитирующим фактором на уровне
мышечных волокон является способность митохондрий утилизировать кислород и
способность окислительных ферментов использовать его в работающих мышцах.
Максимальный уровень потребления О2 не может поддерживаться долго: во время
длительной работы он снижается из-за утомления.
Количество кислорода, необходимое организму для
полного удовлетворения энергетических потребностей за счет аэробных процессов,
называется кислородным запросом работы. При интенсивной работе реальное
потребление кислорода ‒ кислородный приход ‒ составляет только
небольшую часть кислородного запроса. Разность между кислородным запросом
работы и реально потребляемым кислородом составляет кислородный дефицит
организма. В условиях кислородного дефицита активируются анаэробные реакции
ресинтеза АТФ, что приводит к накоплению в организме недоокисленных продуктов
анаэробного распада.
При работе в устойчивом состоянии часть анаэробных
метаболитов может окисляться за счет усиления аэробных реакций в процессе
работы, а другая их часть устраняется после работы. При работе, когда не
устанавливается устойчивое состояние или при «ложном» устойчивом состоянии,
количество недоокисленных продуктов постоянно увеличивается и устраняются они
только в восстановительном периоде. Для восстановления энергетических
источников и окисления недоокисленных продуктов требуется дополнительное
количество кислорода, поэтому некоторое время после окончания работы
потребление его продолжает оставаться повышенным по сравнению с уровнем покоя.
Этот излишек кислородного потребления в период восстановления получил название
"кислородный долг". Кислородный долг всегда больше кислородного
дефицита, и чем больше интенсивность и продолжительность работы, тем
значительнее это различие.
ЛИТЕРАТУРА
1. Волков
Н.И., Несен Э.Н., Осипенко А.А., Корсун С.Н. Биохимия мышечной деятельности. -
М.: Олимпийский спорт, 2001.
2. Мари
Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Перевод с англ. - М.:
Мир,1993.
. Физиология
человека. Косицкий К.И. - М.: Медицина, 1985.
. Филиппович
Ю.Б. Основы биохимии. Учеб. для хим. и биол. спец. пед. Ун-тов и ин-тов. - 4-е
изд., переб. и доп. - М.: изд-во «Агар», 1999.
. Яковлев
Н.Н. Биохимия спорта. - М.: Физкультура и спорт, 1974.
. Яковлев
Н.Н. Химия движения. - Л.: Наука, 1983.