Диссоциация воды. Окислительно-восстановительные реакции
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ
ФЕДЕРАЦИИ
Федеральное государственное
образовательное учреждение
Среднего профессионального
образования
"Поволжский государственный
межрегиональный
строительный колледж"
Специальность 270813
"Водоснабжение и водоотведение"
Отчетная работа
по практическим и лабораторным
работам
ПМ 03. Выполнение работ по очистке
природных и сточных вод
и контролю качественных показателей
МДК 03.01. Очистка и контроль качества природных
и сточных вод
Тема 1. Аналитическая химия
Выполнил:
студент Резаев Максим
Проверила:
Преподаватель Залевская О.И.
группы 11двс
Саратов 2011
Содержание
Практическая работа № 1
Тема: "Диссоциация воды"
Практическая работа № 2
Тема: "Окислительно-восстановительные реакции"
Лабораторная работа № 1
Тема: "Качественные реакции на катионы 1-ой аналитической
группы"
Лабораторная работа № 2
Тема: "Качественные реакции на катионы 2-ой аналитической
группы"
Лабораторная работа № 3
Тема: "Качественные реакции на катионы 3-ой аналитической
группы"
Лабораторная работа № 4
Тема: "Качественные реакции на катионы 4-ой аналитической
группы"
Лабораторная работа № 5
Тема: "Качественные реакции на катионы 5-ой аналитической
группы"
Лабораторная работа № 6
Тема: "Качественные реакции на катионы 6-ой аналитической
группы"
Лабораторная работа № 7
Тема: "Качественные реакции на анионы 1-ой аналитической
группы"
Лабораторная работа № 8
Тема: "Качественные реакции на анионы 2-ой аналитической
группы"
Лабораторная работа № 9
Тема: "Качественные реакции на анионы 3-ой аналитической
группы"
Практическая работа № 1
Тема:
"Диссоциация воды"
Цель работы: Определение водородного и
гидроксильного показателей.
Водородный показатель среды водного раствора электролита pH
равен отрицательному десятичному логарифму концентрации ионов водорода в этом
растворе:
= - lg [H+]
Гидроксильный показатель среды водного раствора электролита
pOH равен отрицательному десятичному логарифму концентрации гидроксильных ионов
в этом растворе:
= - lg [OH-]
При электролитической диссоциации воды образуется равное
количество ионов
+ и OH-: H2O ↔ H+
+ OH-
Величину произведения концентраций катионов H+ и
анионов OH - называют ионным произведением воды и обозначают KW
W = [H+] ∙ [OH-] = 10-14
Формулы для вычисления [H+] в водных растворах
кислот и оснований
|
Электролит
|
[H+]
|
|
Вода
|

|
|
Сильная кислота
|
Cкислота
|
|
Сильное
основание
|
KW/ Cкислота
|
|
Слабая кислота
|
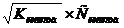
|
|
Слабое
основание
|
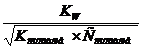
|
Условное обозначение:- полное произведение воды.
С - концентрация воды (моль/л).
С основание - концентрация основание (моль/л).
К основание - концентрация диссоциации оснований.
К кислота - константа диссоциации кислот.
Рассчитайте pH 5,6м раствора H2S
[H] + =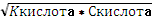
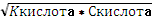 =
= 
 =
= 
 = 7,78*10-3
= 7,78*10-3
pH= - lg [H] + = - lg (7,78* 10-3) = - lg
7,78+3=13 - lg7,78=3-8,91-1=3-=3-0,11=2,89.
Ответ: 2,89
Практическая
работа № 2
Тема:
"Окислительно-восстановительные реакции"
Цель работы: Составление
окислительно-восстановительных реакций. Составление электронного баланса.
Окислительно-восстановительные реакции идут с изменением
степени окисления атомов реагирующих веществ.
Процесс отдачи электронов - окисление, а
частица, отдающая электроны - восстановитель.
Процесс присоединения электронов - восстановление,
а частица, присоединяющая электроны - окислитель.
Пример. Составьте электронные уравнения. Расставьте
коэффициенты в окислительно-восстановительной реакции. Укажите окислитель и
восстановитель, а так же какое вещество окисляется, какое - восстанавливается.
4 + H3PO4 + H2SO4
= MnSO4 + H3PO4 + K2SO4
+ H2O
Решение.
+1Mn+7O4-2+H3+1P+3O3-2+H2+1S+6O4-2→Mn+2S+6O4-2+H3+1P+5O4-2+K2+1S+6O42-+H2+1O-2
Составим электронные уравнения: Mn+7 + 5e - =
Mn+2 │2│окислитель (процесс восстановления), P+3
- 2e - = P+5│5│восстановитель (процесс
окисления),
KMnO4 + 5H3PO4 + 3H2SO4
= 2MnSO4 + 5H3PO4 + K2SO4
+ 3H2O
4 - окислитель, и восстанавливается в процессе
реакции; 3PO3 - восстановитель, и окисляется в процессе
реакции.
диссоциация вода окислительный восстановительный

Лабораторная
работа № 1
Тема:
"Качественные реакции на катионы 1-ой аналитической группы"
Цель работы: Изучение и обнаружение
катионов 1-ой аналитической группы.
|
Взаимодействующие
реагенты
|
Наблюдения
|
Уравнения
химических реакций
|
|
Реакции катиона
натрия
|
|
Cu, NaCl
|
Окрашивает
пламя в ярко-желтый цвет
|
|
|
Реакции катиона
калия
|
|
Cu, KCl
|
Окрашивает
пламя в фиолетовый цвет
|
|
|
Реакции катиона
аммония
|
|
NH4Cl,
Ca (OH) 2 (тв.)
|
Выделение
запаха аммиака
|
Ca (OH) 2↓
+ 2NH4Cl→CaCl2+ 2NH4OH→NH3
H2O↑ Ca (OH) 2↓ + 2NH4+
+ 2Cl-→Ca+2 + 2Cl - + 2NH3↑+
2H2O Ca (OH) 2↓ + 2NH4→Ca+2
+ 2NH3↑ + 2H2O
|
|
NH4Cl,
реактив Несслера
|
Образование
красно-бурого осадка
|
NH4Cl+2K2
[HgI4] +4KOH→ [OHg2NH2] I↓+7KI+KCl-+3H2O
NH4++Cl-+4K++2 [HgI4]
+4K++4OH→ [OHg2NH2] I↓+7K++7I+K++Cl-+
3H2O
|
Вывод: Катионы Na+,K+ -
обнаружили по изменению цвета пламени, катион NH4+
обнаружили по характерным реакциям (запах, осадок).
Лабораторная
работа № 2
Тема:
"Качественные реакции на катионы 2-ой аналитической группы"
Цель работы: Изучение и обнаружение
катионов 2-ой аналитической группы.
|
Взаимодействующие
реагенты
|
Наблюдения
|
Уравнения
химических реакций
|
|
Реакции катиона
серебра
|
|
AgNO3,
NaOH
|
Образование
бурого осадка
|
AgNO3
+ 2NaOH→Ag2O + H2O + 2NaNO3 2Ag++2NO3-+2Na+
+2OH-→Ag2O + H2O+2Na+ + 2NO3-
2Ag+ + 2OH-→AgO + H2O
|
|
AgNO3,
HCl
|
Образование белого
творожистого осадка
|
AgNO3
+ HCl → AgCl + HNO3 Ag+ + NO3 - +
H+ + Cl - → AgCl↓ + H+ + NO3-
Ag+ + Cl - → AgCl↓
|
|
AgNO3,
K2CrO4
|
Образование
красно-бурого осадка
|
2AgNO3
+H2CrO4→Ag2CrO4↓ +
2HNO3 2Ag+ + 2NO3 - + 2H+
+ CrO4-2→Ag2CrO4↓ +
2H+ + 2NO3- 2Ag+ + CrO4-2→Ag2CrO4↓
|
|
Реакции катиона
ртути (I)
|
|
Hg (NO3)
2, NaOH
|
Образование
черного осадка
|
Hg2
(NO3) 2 + 2NaOH→Hg2+2O-2↓
+ H2-O-2 + 2Na+NO3-
2Hg+ + 2NO3 - + 2Na+ + 2OH-→HgO2
+ H2O + 2Na+ + 2NO3- 2Hg+
+ 2OH→Hg2O↓+H2O
|
|
Hg (NO3)
2, HCl
|
Образование
белого осадка
|
Hg2
(NO3) 2 + 2HCl→Hg2Cl2↓
+ 2HNO3 2Hg+ +2NO3 - + 2H+
+ 2Cl-→Hg2Cl2 + 2H+ + 2NO3-
2Hg+ + 2Cl-→Hg2Cl2
|
|
Реакции катиона
свинца
|
|
Pb (NO3)
2, H2SO4
|
Образование
белого осадка
|
Pb (NO3)
2 + H2SO4→Pb+2SO-2
+ 2HN+O3- Pb+2 + 2NO3
- + 2H+ + SO4-2→PbSO4
+ 2H+ + 2NO3- Pb+2 + SO4-2→PbSO4
|
|
Pb (NO3)
2, HCl
|
Образование
белого кристаллического осадка
|
Pb (NO3)
2 + 2HCl→Pb+2Cl - + 2HNO3-
Pb+2 + 2NO3 - + 2H+ + 2Cl-→PbCl2↓
+ 2H+ + 2NO3- Pb+2 + 2Cl-→PbCl2
|
|
Pb (NO3)
2, K2CrO4
|
Образование
желтого осадка
|
Вывод: Катионы Ag,Hg2,Pb, имеют групповой
реагент: HCl, т.к., в результате реакций образуется белый осадок.
Лабораторная
работа № 3
Тема:
"Качественные реакции на катионы 3-ой аналитической группы"
Цель работы: Изучение и обнаружение
катионов 3-ой аналитической группы.
|
Взаимодействующие
реагенты
|
Наблюдения
|
Уравнения
химических реакций
|
|
Реакции катиона
бария
|
|
BaCl2,
H2SO4
|
Образование
белого осадка
|
BaCl2
+ H2SO4→BaSO4↓ + 2HCl Ba+2
+ 2Cl - + 2H+ + SO4-2→BaSO4↓
+ 2H+ + 2Cl- Ba+2 + SO4-2→BaSO4↓
|
|
Ba (NO3)
2, K2Cr2O7
|
Образование
желтого осадка
|
K2Cr2O7+
2Ba (NO3) 2+H2O→2BaCrO4↓+
2KNO3+ 2HNO3 2K++Cr2O7-2+2Ba+2+4NO3-+H2O→2BaCrO4+2K++2NO3-+2H++2NO3-
Cr2O7-2 + 2Ba+2 + H2O→2BaCrO4↓
+ 2H+
|
|
BaCl2,
H2CO3
|
Образование
белого осадка
|
BaCl2
+ K2CO→Ba+2CO3-2 + 2K+Cl-
Ba+2 + 2Cl - + 2K+ + CO3-2→Ba2+2CO3-3
+ 2K+ + 2Cl- Ba+2 + CO3-2→Ba+2CO3-2
|
|
Реакции катиона
стронция
|
|
SrCl2,
H2SO4
|
Образование
белого осадка
|
SrCl2 +
H2SO4→Sr+2SO4-2
+ 2H+Cl- Sr+2 + 2Cl - + 2H+ +
SO4-2→Sr+2SO4-2
+ 2H+ + 2Cl- Sr+2 + SO4-2→Sr+2SO4-2
|
|
Реакции катиона
кальция
|
|
CaCl2,
H2SO4
|
Образование
белого осадка
|
CaCl2
+ H2SO4→Ca+2SO4-2
+ 2H+Cl- Ca+2 +2Cl - + 2H+
+ SO4-2 + Ca+2SO4-2 +
2H+ + 2Cl- Ca+2 + SO4-2→CaSO4
|
|
CaCl2,
K2CO3
|
Образование
белого осадка
|
CaCl2
+ K2CO3→Ca+2CO3-2
+ 2K+ + Cl- Ca+2 + 2Cl - + 2K+
+ CO3-2→Ca-2CO3-2
+ 2K+ + 2Cl- Ca+2 + CO3-2→CaCO3
|
Вывод: Катионы Ba+2, Sr+2,
Ca+2, имеет групповой реагент H2SO4, т.к. в результате реакций
образуется белый осадок.
Лабораторная
работа № 4
Тема:
"Качественные реакции на катионы 4-ой аналитической группы"
Цель работы: Изучение и обнаружение
катионов 4-ой аналитической группы.
|
Взаимодействующие
реагенты
|
Наблюдения
|
Уравнения
химических реакций
|
|
Реакции катиона
алюминия
|
|
Al2
(SO4) 3, NaOH
|
Образование
белого осадка
|
Al2
(SO4) 3 + 6NaOH→2Al (OH) 3↓ +
3Na2SO4 2Al+3 3SO4-2 +
6Na+ + 6OH-→2Al (OH) 3↓ + 6Na+
+ 3SO4-2 2Al+3 + 6OH-→2Al
(OH) 3↓
|
|
AlCl3,
CH3COONa
|
Образование
белого хлопьевидного осадка
|
AlCl3+3CH3COONa+H2O→Al
(OH) 2CH3COO↓+3NaCl+2CH3COOH Al+3+3Cl
- + 3CH3COOO-+3Na++ H2O→Al
(OH) 2CH3COO↓+3Na++ 3Cl-+
2CH3COO-+2H+ Al+3 +CH3COO-→Al
(OH) 2CH3COO↓
|
|
Реакции катиона
хрома
|
|
CrCl3,
NaOH
|
Образование
серо-зеленого осадка
|
CrCl3
+ 3NaOH→Cr (OH) ↓ + 3NaCl Cr+3 + 3Cl - +
3Na+ + 3OH-→Cr (OH) 3↓ + 3Na+
+ 3Cl- Cr+3 + 3OH-→Cr (OH) 3↓
|
|
Реакции катиона
цинка
|
|
ZnSO4,
NaOH
|
Образование
белого аморфного осадка
|
ZnSO4
+ 2NaOH→Zn (OH) ↓ + Na2SO4 Zn+2
+ SO4-2+ 2Na+ + 2OH-→Zn
(OH) 2↓+2Na+ + SO4-2 Zn+2
+ 2OH-→Zn (OH) 2↓
|
|
ZnSO4,
K4 [Fe (CN) 6]
|
Образование
белого осадка
|
ZnSO4+
K4 [Fe (CN) 6] → K2Zn [Fe (CN) 6]
↓+ K2SO4 Zn+2 + SO4-2
+ 4K+ + [Fe (CN) 6] - 4→K2Zn
[Fe (CN) 6] ↓+ 2K+SO4-2 Zn+2
+ 2K+ + [Fe (CN) 6] - 4→K2Zn
[Fe (CN) 6] ↓
|
|
Реакции катиона
мышьяка (III)
|
|
AsCl3,
ZnCl2
|
Образование
черного осадка
|
2AsCl3+
3ZnCl2+6HCl→2As↓+3H2 [SnCl6] 2As+3
+ 6Cl - + 3Zn+2 + 6Cl - + 6H+ +
6Cl-→2As↓+ 6H+3 [SnCl6] - 2 2As+3
+6Cl - + 3Zn+2 + 6Cl - + 6Cl-→2As+
3 [SnCl6] - 2
|
|
Na2HAsO4,
AgNO3
|
Образование
шоколадно-бурого осадка
|
Na2HAsO4+3AgNO3→Ag3
AsO3↓+2NaNO3+ HNO3 2Na+ +
HAsO3-2 + 3Ag+ + 3NO3-→Ag3AsO3↓+
2Na+ +2NO3-+H++ NO3-
HAsO3-2 + 3Ag+→Ag3AsO3↓
+ H+
|
|
Реакции катиона
олова (IV)
|
|
SnCl2,
NaOH
|
Образование
белого осадка
|
SnCl2+
2NaOH→Sn (OH) 2↓+ 2NaCl Sn+2 + 2Cl - +
2Na+ + 2OH-→Sn (OH) 2↓+ 2Na+
+ 2Cl- Sn+2 + 2OH-→Sn (OH) 2↓
|
|
Na2
[SnCl6], NaOH
|
Образование
белого осадка
|
Na2
[SnCl6] +4NaOH→H4SnO4↓+6NaCl 2Na+
+ [SnCl6] - 2 + 4Na+ + 4OH-→H4SnO4↓+
6Na+ + 6Cl- [SnCl6] - 2 + 4OH-→H4SnO4↓
+ 6Cl -
|
Вывод: Катионы Al+3,Cr+3,Zn+2,As,Sn, имеют
групповой реагент NaOH, H2O2, т.к. в результате реакций образуется белый
осадок.
Лабораторная
работа № 5
Тема:
"Качественные реакции на катионы 5-ой аналитической группы"
Цель работы: Изучение и обнаружение
катионов 5-ой аналитической группы.
|
Взаимодействующие
реагенты
|
Наблюдения
|
|
Реакции катиона
висмута
|
|
BiCl3,
NaOH
|
Образование
белого осадка
|
BiCl3+3NaOH→Bi
(OH) 3↓+3NaNO3 Bi+3+3Cl-+3Na++3OH-→Bi
(OH) 3↓+3Na++3Cl- Bi+3+3OH-→Bi
(OH) 3↓
|
|
BiCl3,
K2Cr2O7
|
Образование
желтого осадка
|
2BiCl3+3K2Cr2O7→Bi2
(Cr2O7) 3↓+6Cl 2Bi+3+6Cl-+6K++3Cr2O7-2→Bi2
(Cr2O7) 3↓+6K+ 2Bi+3+3Cr2O7-2→Bi2
(Cr2O7) 3↓
|
|
BiCl3,
Na2HPO4
|
Образование
белого кристаллического осадка
|
2BiCl3
+ 3Na2HPO4-2→Bi2+3
(HPO4) 3-↓+ 6Na+Cl-
2Bi+3 + 6Cl - + 6Na+ + 3HPO4-2→Bi2-3
(HPO4) 3-↓+ 6Na+ + 6Cl-
2Bi+3 + 3HPO4-2→Bi2+3
(HPO4) 3↓
|
|
Реакции катиона
железа (II)
|
|
FeCl2,
NaOH
|
Образование
грязно-зеленого осадка
|
FeCl2
+ 2NaOH→Fe (OH) 2↓ + 2NaCl Fe+2 + 2Cl
- + 2Na+ +2OH-→Fe (OH) 2↓+
2Na+ + 2Cl- Fe+2 + 2OH-→Fe
(OH) 2-↓
|
|
FeCl2,
K3 [Fe (CN) 6]
|
Образование
синего осадка
|
3Fe+2Cl2
- + 2K3+ [Fe (CN) 6] →Fe3+2
[Fe (CN) 6] 2-3↓+ 6K+Cl 3Fe+2
+ 6Cl - + 6K+ + 2 [Fe (CN) 6] - 3→Fe3+2
[Fe (CN) 6] 2-3↓+6K+ + 6Cl-
3Fe+2 + 2 [Fe (CN) 6] - 3→Fe3+2
[Fe (CN) 6] 2-3↓
|
|
Реакции катиона
железа (III)
|
|
FeCl3,
NaOH
|
Образование
красно-бурого осадка
|
Fe+3Cl3
- + 3Na+OH-→Fe+3 (OH) 3-↓
+ 3Na+Cl- Fe+3 + 3Cl - + 3Na+
+ 3OH-→Fe+3 (OH3) +3Na+ +
3Cl- Fe+3 + 3OH-→Fe+3 (OH)
- 3↓
|
|
FeCl3,
K4 [Fe (CN) 6]
|
Образование
синего осадка
|
4Fe+3Cl3
- + 3K4 [Fe (CN) 6] →Fe4+3
[Fe (CN) 6] 3-4↓ + 12K+Cl-
4Fe+3 + 12Cl - + 12K+ + 3 [Fe (CN) 6]
- 4→Fe4+3 [Fe (CN6)] 3-4
+ 12K++12Cl- 4Fe+3 + 3 [Fe (CN6)]
- 4→Fe4+3 [Fe (CN6)] 3-4↓
|
|
FeCl3,
KCNS
|
Образование
кроваво-красного раствора
|
Fe+3Cl3
- + 3K+CNS-→Fe+3 (CNS) 3
- + 3K+Cl- Fe+3 + 3Cl - +
3K+ + 3CNS-→Fe+3 + 3CNS3
- + 3K+ + Cl-
|
|
Реакции катиона
магния
|
|
MgCl2,
NaOH
|
Образование
белого осадка
|
MgCl2
+ 2NaOH→Mg (OH) + 2NaCl Mg+2 + 2Cl - + 2Na+
+ 2OH-→Mg (OH) 2↓+ 2Na+ + 2Cl-
Mg+2 + 2OH-→Mg (OH) ↓
|
|
MgCl2,
Na2HPO4
|
Образование
белого кристаллического осадка
|
MgCl2+
Na2HPO4+NH4OH→Mg NH4PO4↓+2NaCl+H2O
Mg+2 + 2Cl - + 2Na+ + HPO4-2
+ NH4+ + OH-→MgNH4PO4↓+2Na+
+2Cl-+H2O Mg+2+HPO4-2+NH4+
+OH-→MgNH4PO4↓+ H2O
|
|
MgCl2,
K2CO3
|
Образование
белого кристаллического осадка
|
MgCl2
+ K2CO3→Mg (CO3) ↓+2KCl Mg+2
+ 2Cl - + 2K+ + CO3-2→MgCO3↓
+2K+ + 2Cl- Mg+2 + CO3-2→MgCO3↓
|
|
Реакции катиона
марганца
|
|
MnCl2,
NaOH
|
Образование
белого осадка
|
MnCl2
+ 2NaOH→Mn (OH) 2↓ + 2NaCl Mn+2 + 2Cl
- + 2Na+ + 2OH-→Mn (OH) 2↓+
2Na+ + 2Cl- Mn+2 + 2OH-→Mn
(OH) 2↓
|
Вывод: Катионы имеют групповой реагент, в
результате реакций образует цвет раствора.
Лабораторная
работа № 6
Тема:
"Качественные реакции на катионы 6-ой аналитической группы"
Цель работы: Изучение и обнаружение
катионов 6-ой аналитической группы.
|
Взаимодействующие
реагенты
|
Наблюдения
|
Уравнения
химических реакций
|
|
Реакции катиона
кобальта
|
|
CoSO4,
NaOH
|
Образование
темно-бурого осадка
|
Co+2SO4-2
+ 2Na+OH-→Co+ (OH) 2-↓+
Na2+ SO4-2 Co+2 + SO4-2
+ 2Na+ + 2OH-→Co+2 (OH) 2-↓
+ 2Na+ + SO4-2 Co+2 + 2OH-→Co+2
(OH) 2-↓
|
|
CoSO4,
NH4OH
|
Образование
темно-бурого осадка
|
CoSO4
+ 2NH4OH→ (NH) 2SO4 + Co (OH) 2↓
Co+2 + SO4-2 + 2NH4+ +
2OH-→ 2NH4+ + SO4-2
+ Co (OH) 2↓ Co+2 + OH-→Co (OH) 2↓
|
|
CoSO4,
KNO2
|
Образование
желтого кристаллического осадка
|
CoSO4
+ 2KNO2→K2SO4 + Co (NO2) 2↓
Co+2+SO4-2 +2K+ + 2NO2-→2K+
+ SO4-2 + Co (NO2) 2↓ Co+2
+ 2NO2-→Co (NO) 2↓
|
|
Реакции катиона
никеля
|
|
NiSO4,
NaOH
|
Образование
аморфного зеленого осадка
|
NiSO4
+ 2NaOH→Ni (OH) 2↓+Na2SO4 Ni+2
+ SO4-2 + 2Na+ + 2OH-→Ni
(OH) 2↓ + 2Na+ +SO4-2 Ni+2
+ 2OH-→Ni (OH) 2↓
|
|
Реакции катиона
меди
|
|
CuSO4,
NaOH
|
Образование
голубого осадка
|
CuSO4
+ 2NaOH→Cu (OH) ↓+ Na2SO4 Cu+2 +
SO4-2 + 2Na+ + 2OH-→Cu (OH)
2↓+ 2Na+ + SO4-2 Cu+2
+ 2OH-→Cu (OH) 2↓
|
|
CuSO4,
NH4OH
|
Образование
голубовато-зеленого осадка
|
Cu+2SO4-2
+ 2NH4OH→Cu (OH) 2↓ + (NH4) 2SO4-2
Cu+2 + SO4-2 + 2NH4+ +
2OH-→Cu (OH) 2↓ + 2NH4+
+ SO4-2 Cu+2 + 2OH-→Cu (OH)
2↓
|
|
CuSO4,
K4 [Fe (CN) 6]
|
Образование
красно-бурого осадка
|
|
Реакции катиона
кадмия
|
|
CdSO4,
NaOH
|
Образование
белого осадка
|
Cd+2SO4-2
+ 2NaOH-→Cd+2 (OH) 2-↓+
Na2+SO4-2 Cd+2 + SO4-2
+2Na+ + 2OH-→Cd (OH) 2 - +
2Na+ + SO4-2 Cd+2 + 2OH-→Cd
(OH) 2-↓
|
|
CdSO4,
NH4OH
|
Образование
белого осадка
|
Cd+2SO4-2+
2NH4OH→Cd (OH) 2-↓+ (NH4)
2 + SO4-2 Cd+2 + SO4-2
+ 2NH4+ + 2OH-→Cd (OH2) - ↓+
2NH4+ + SO4-2 Cd+2 +
2OH-→Cd+2 (OH) - ↓
|
|
Реакции катиона
ртути
|
|
HgSO4,
NaOH
|
Образование
желтого осадка
|
Hg+2SO4-2
+ 2Na+OH-→HgO+ H2O↓+ Na2+SO4-2
Hg+2 + SO4-2 + 2Na+ + 2OH-→HgO+
H2O↓ + 2Na+ + SO4-2 Hg+2
+ 2OH-→HgO+H2O↓
|
|
HgSO4,
K2CrO4
|
Образование
желтого осадка
|
Hg+2SO4-2
+ K2+CrO4-2→Hg+2CrO4-2
+ K2+SO4-2 Hg+2 +SO4-2
+ 2K+ + CrO4-2→Hg+2CrO4-2↓+2K+
+SO4-2 Hg+2CrO4-2→Hg+2CrO4-2↓
|
Вывод: Катионы Co,Cd,Cu,Ni,Hg, имеют групповой
реагент NH4OH, т.к. в результате реакции образует цвет, в цвет раствора.
Лабораторная
работа № 7
Тема:
"Качественные реакции на анионы 1-ой аналитической группы"
Цель работы: Изучение и обнаружение
анионов 1-ой аналитической группы.
|
Взаимодействующие
реагенты
|
Наблюдения
|
Уравнения
химических реакций
|
|
Реакции
хлорид-ионов
|
|
NaCl, AgNO3
|
Образование
белого творожистого осадка
|
Na+Cl
- + Ag+NO3-→NaCl↓ + AgNO3
Na++ Cl - + Ag+ + NO3-→AgCl↓+
Na+ + NO3- Cl - + Ag+→AgCl↓
|
|
KCl, KMnO4
|
Обесцвечивание
раствора, выделение газа
|
10KCl-+2KMn+5O4-2+8H2SO4-2→5Cl2-+2Mn+2SO4-2+6K2+SO4-2+8H2O
5 10 2Cl - 2e Cl20
в-ль, ок-ние 2 Mn+7 +5e Mn+2 ок-ль, в-ние
|
|
Реакции
бромид-ионов
|
|
KBr, AgNO3
|
Образование
желтого творожистого осадка
|
K+Br
- + Ag+NO3-→KNO3+
AgBr↓ K+ + Br - + Ag+ + NO3-→K+
+ NO3+ + AgBr↓ Br - + Ag-→AgBr↓
|
|
Реакции
иоид-ионов
|
|
KI, AgNO3
|
Образование
желтого творожистого осадка
|
K+I
- + Ag+NO3-→K+NO3
- + AgI↓ K+ + I - + Ag - + NO3-→K+
+ NO3 - + Ag+I-↓ I
- + Ag+→AgI↓
|
|
KI, KMnO4
|
Выделение
свободного йода
|
10K+I-+
2K+Mn+7O4-2+8H2+S+5O4-2→5I2-+2Mn-2S+6O4-2+
6K2+SO4-2+8H2O 3 Mn+7
+ 5e Mn+2 ок-ль, в-ние. 5 2J - 2e J20 в-ль,
ок-ние.
|
|
Реакции
сульфид-ионов
|
|
Na2S,
AgNO3
|
Образование
черного осадка
|
Na2+S
+ 2AgNO3→2NaNO3 + Ag2S↓ 2Na+
+ S-2 + 2Ag+ + 2NO3-→2Na+
+ 2NO3 - + Ag2S S-2 + 2Ag+→Ag2S↓
|
|
Na2S,
Pb (CH3COO) 2
|
Образование
черного пятна
|
Na2S
+ Pb (CH3OOO) 2→2Na (CH3OOO) + PbS 2Na+
+ S-2 + Pb+2 + 2 (CH3OOO) →2Na+
+ 2CH3OOO + PbS↓ S-2 + Pb+ + PbS↓
|
|
Na2S,
Cd (NO3) 2
|
Образование
канареечно-желтого осадка
|
Na2S
+ Cd (NO3) 2→2NaNO3 + CdS↓ 2Na+
+ S-2 + Cd+2 + 2NO3-→2Na+
+ 2NO3 - + CdS↓ S-2 + Cd→CdS↓
|
Вывод: Катионы Cl,Br, I,S, имеют групповой
реагент AgNO3, т.к. в результате образуется цвет, осадка в цвет раствора.
Лабораторная
работа № 8
Тема:
"Качественные реакции на анионы 2-ой аналитической группы"
Цель работы: Изучение и обнаружение
анионов 2-ой аналитической группы.
|
Взаимодействующие
реагенты
|
Наблюдения
|
Уравнения
химических реакций
|
|
Реакции
сульфат-ионов
|
|
Na2SO4,
BaCl2
|
Образование
белого кристаллического осадка
|
Na2+SO4
- + Ba+2Cl2-→2NaCl + BaSO4↓
2Na2+ + SO4-2 + Ba+2 +
2Cl-→2Na+ + 2Cl - + BaSO4↓
SO4-2 + Ba+2→BaSO4↓
|
|
Na2SO4,
Pb (CH3COO) 2
|
Образование
белого осадка
|
Na2SO4
+ Pb (CH3COO) 2→2Na (CH3COO) +
PbSO4↓ 2Na+ + SO4-2 + Pb+2
+ 2CH3COO-→2Na+ + 2CH3COO
- + PbSO4 Pb+2 + SO4-2→PbSO4
|
|
Реакции
сульфит-ионов
|
|
Na2SO3,
BaCl2
|
Образование
белого осадка
|
Na2SO3
+ BaCl2→2NaCl + BaSO3 2Na+ + SO3-2
+ Ba+2 + 2Cl-→2Na+ + 2Cl - +
BaSO3↓ SO3-2 + Ba+2→BaSO3↓
|
|
Na2SO3,
KMnO4
|
Обесцвечивание
раствора
|
Na2SO3
+ 2KMnO→K2SO3 + 2NaMnO4 2Na+
+ SO3-2 + 2K+ + 2MnO-→2Na+
+ 2MnO4 - + 2K+ + SO3-2
|
|
Реакции
тиосульфат-ионов
|
|
Na2S2O3,
BaCl2
|
Na2S2O3
+ BaCl2→BaS2O3 + 2NaCl 2Na+
+ SO3-2 + Ba+2 + 2Cl-→BaS2O3↓
+ 2Na+ + 2Cl- S2O3-2 +
2Ba+2→Ba2S2O3↓
|
|
Na2S2O3,
AgNO3
|
Образование
белого осадка
|
Na2S2O3
+ 2AgNO3→2NaNO3 + Ag2S2O3↓
2Na+ + S2O3-2 + 2Ag+ +
2NO3-→2Na+ + 2NO3 - +
Ag2S2O3↓ S2O3-2
+2Ag+→Ag2S2O3↓
|
|
Реакции
карбонат-ионов
|
|
Na2CO3,
BaCl2
|
Образование
белого осадка
|
Na2CO3
+ BaCl2→2NaCl + BaCO3↓ 2Na+ + CO3-2
+ Ba+2 + 2Cl-→2Na+ + 2Cl - +
BaCO3↓ CO3-2 + Ba+2→BaCO3↓
|
|
Na2CO3,
HCl
|
Выделение газа
|
Na2CO3
+ 2HCl→2NaCl + H2CO3→H2O→CO2↑
2Na+ + CO3-2 + 2H+ + 2Cl
- + 2Na+ + 2Cl - + H2O + CO2↑
CO + 2H+→H2O + CO2↑
|
|
Реакции
фосфат-ионов
|
|
Na2HPO4,
BaCl2
|
Образование
белого осадка
|
Na2HPO4
+ BaCl2→2NaCl + BaHPO4↓ 2Na+ +
HPO4-2 + Ba+2 + 2Cl-→2Na+
+ 2Cl - + BaHPO4↓ HPO4-2 +
Ba+2→BaHPO4↓
|
Вывод: Катионы,SO4,SO3,S2O3,CO3,PO4,
имеют групповой реагент BaCl2, в результате цвет осадка в цвет
раствора.
Лабораторная
работа № 9
Тема:
"Качественные реакции на анионы 3-ой аналитической группы"
Цель работы: Изучение и обнаружение
анионов 3-ой аналитической группы.
|
Взаимодействующие
реагенты
|
Наблюдения
|
Уравнения
химических реакций
|
|
Реакции
нитрат-ионов
|
|
HNO3,
FeSO4,
|
Образование
коричневого осадка
|
2H+N+5O3-2+6Fe+SO4-2+3H2+SO4-2→3Fe2+2
(SO4) 3-2+H2+O-2+2N+O-2↑
1 N+5 +3e N+2 ок-ль, в-ние 3 3 Fe+
- 1e Fe2+3 в-ль, ок-ние FeSO4+NO↑→
[Fe (NO) SO4]
|
|
HNO3,
Cu, H2SO4
|
Выделение
бурого газа
|
2H+N+5O3-2+3Cu+
3H2+SO4-2→3Cu+2SO4-2+4H2+O-2+2N+2O-2↑
2 N+5 +3e N+2 ок-ль, в-ние. 3 6 Cu0 - 2e
Cu+2 в-ль, ок-ние. NO↑+O2→ NO2↑
|
|
Реакции
нитрит-ионов
|
|
NaNO2,
H2SO4
|
Выделение
бурого газа
|
2Na+NO3-2+H2+SO4-2→
2H+N+5O2-2+Na2+SO4-2
2Na+ + 2NO3 - + 2H+ + SO4-2→2H+
+ 2NO2 - + 2Na+ + SO4-2
HNO2→ NO2↑+ NO↑+H2O
|
|
HNO2,
KI, CH3COOH
|
Образование
коричневого осадка
|
2H+N+3O2-+2KI-+2CH3COOH-→I2↓+2CH3COOH+2N+3O-2↑+2H2+O-2
1 2I - 2e I20 в-ль, ок-ние. 2 2 N+3
+1e N+2 ок-ль, в-ние.
|
Вывод: Для каждого аниона, NO3, NO2, объединяет
выделение бурого газа.