Изучение дискретного строения вещества в физике средней школы
Министерство образования Республики
Беларусь
Учреждение образования
Брестский Государственный
Университет имени А.С. Пушкина
Физический факультет
Кафедра методики преподавания физики
и ОТД
Курсовая работа
По методике преподавания физики
Изучение дискретного строения
вещества в физике средней школы
Студента Бурова Дениса
Научный руководитель
Кивако А.М.
Брест 2011
ОГЛАВЛЕНИЕ
Введение
Первый этап
Второй этап
Заключение
Список
использованных источников
Введение
В курсе физики средней школы дается представления о таких понятиях, как
дискретное строение вещества, масса, взаимодействие, сила, энергия. В ходе
данной курсовой работе мы остановимся на формировании некоторых понятий и их
взаимосвязи.
Развитие знаний о дискретном строении вещества в систематическом курсе
физики проходит в два этапа. Первый этап проходит в 6-ом классе. В это время
учащиеся:
знакомятся с дискретным строением вещества;
наблюдают экспериментальное подтверждение дискретного строения;
узнают об атомах и молекулах;
получают представления о тепловом движении частиц, их взаимодействии;
узнают об агрегатных состояниях веществ.
Опираясь на знания о частицах вещества (атомах и молекулах), о
непрерывном хаотическом движении и взаимодействии частиц, полученные на
предыдущем этапе, в разделе «Молекулярная физика» учащиеся:
изучают характеристики атомов и молекул (диаметр, масса);
рассматривают особенности взаимодействия атомов в молекуле
(одновременность действия сил притяжения и отталкивания, зависимость действия
сил от расстояния между частицами, радиус действия сил, электромагнитная
природа сил);
обсуждают экспериментальные доказательства существования частиц и их
непрерывного хаотического движения (броуновское движение), экспериментальное
определение скорости теплового движения частиц газа (опыт Штерна).
Рассмотрение этих вопросов позволяет ввести основные положения
атомно-молекулярного учения о строении вещества, которое, в свою очередь, дает
возможность изучить агрегатные состояния вещества (газообразное, жидкое,
твердое): особенности, основные свойства, применение.
Изучение различных агрегатных состояний вещества позволяет рассмотреть
следующие вопросы интегрированного характера: состояние вещества на Земле как
космическом теле, газ - основное состояние вещества во Вселенной, межзвездная
пыль, кристаллы в природе (образование горных пород и минералов, кристаллы и
жизнь).
Атомно-молекулярное учение о строении вещества дает возможность объяснить
явление диффузии, причину броуновского движения, свойства газов, жидкостей и
твердых тел, процессы испарения и конденсации, кипения, плавления и
кристаллизации, смачивание и несмачивание. Изучение вопроса об испарении
позволяет:
показать, что это явление объясняет истечение газа из атмосфер звезд и
планет, образование хвоста кометы;
обратить внимание на значение испарения в жизни живых организмов, технике
и быту.
Первый этап
Цели уроков:
Образовательные: вызвать объективную необходимость изучения нового материала;
способствовать овладению знаниями по теме “Строение вещества. Молекулы”.
Развивающие: содействовать развитию речи, мышления, познавательных и
общетрудовых умений; продолжить работу по формированию умений делать выводы из
наблюдений.
Воспитательные: формировать добросовестное отношение к учебному труду,
положительную мотивацию к учению; способствовать воспитанию гуманности,
дисциплинированности, эстетического восприятия мира.
Опыты: делимость куска мела, испарение капельки спирта, деформация резинового
шарика, смешивание гороха и пшена, воды и спирта, изменение объема стального шарика
при изменении температуры.
Все окружающее человека - вода, воздух, горы, деревья - обладают своими
свойствами. Объекты отличаются по форме, цвету, запаху, у них различные
свойства. Две маленькие капли воды сливаются в одну, но в то же время два стальных
шарика при ударе отскакивают друг от друга. Немного нагрев кусок воска, мы
наблюдаем, как он превращается в жидкость. Почему это происходит? Почему каучук
упругий, а воск мягкий? Почему при нагревании твердые тела превращаются в
жидкости, а жидкости - в газ? Чтобы ответить на этот вопрос, необходимо иметь
представление о строении вещества. Знания о строении вещества помогают не
только объяснять суть явления, они помогают предсказывать, как будет
происходить явление, что нужно сделать, чтобы его ускорить или замедлить, т.е.
помогают управлять явлениями. Изучив строение тел, можно объяснить их свойства,
а также создать новые вещества с нужными свойствами - твердые и прочные сплавы,
жароупорные материалы. Так были созданы такие материалы, как пластмассы, каучук,
капрон, лавсан, нашедшие широкое применение в технике, медицине и быту. О
строении вещества помогают судить некоторые явления и опыты. И сегодня мы с
вами проведём опыты, которые нам помогут узнать о строении вещества.
Опыт 1
У каждого из учеников на порте лежит по кусочку мела. Учащимся
предлагается разломать его, после чего еще раз разделить его на части.
Вывод: Дробление веществ доказывает их дискретность (делимость).
Возможен и обратный процесс - получение целого из отдельных частей (две
капли воды могут слиться в одну большую каплю, из отдельных кирпичей можно
построить большой дом, множество песчинок образуют песчаные дюны).
Опыт 2
Учитель капает немного спирта на фильтровальную бумагу. Пятно через
некоторое время исчезает. Выясняется причины исчезновения жидкости.
Вывод: Вещество состоит из частиц, это так же объясняет распространение запаха,
испарение жидкости и твердых тел.
Опыт 3
Берем воздушный шарик и надавливаем на него. У учащихся спрашивается о
количестве и о размерах частиц воздуха до сжатия и во время сжатия.
Вывод: Количество частиц воздуха, находящихся в шарике до сжатия и во время,
остается постоянным. Так же остаются постоянными и размеры этих частиц. Между
частицами воздуха есть промежутки.
Опыт 4
Смешиваем горох и пшено, взятые в равных объемах. Тщательно встряхиваем
емкость со смесью. Получили заметно меньший объем, чем сумма объёмов гороха и
пшена, взятых в отдельности.
Вывод: Между частицами есть промежутки.
Все эти опыты указывают на то, что вещества состоят из отдельных частиц,
разделенных промежутками. Изменение расстояния между частицами приводит к
изменению объема тела.
Опыт 5. Возьмем металлический шарик и кольцо. Ученика показывается, что шарик
легко проходит через кольцо. После чего шарик нагревается на спиртовке. Демонстрируется,
что уже шарик не проходит через кольцо. Шарик охлаждают, после чего он опять
проходит сквозь кольцо.
Вывод: При нагревании расстояние между частицами увеличивается, при охлаждении -
расстояния уменьшаются.
Далее учителем вводятся элементарные представления о строении атомов и
молекул.
Атомы каждого вида принято обозначать специальными символами. Например:
(записываем на доске и в тетрадях): “О - атом кислорода, H - атом водорода, С -
атом углерода” (слайд 26).
Молекулы также обозначаются специальными символами (химическими
формулами). Например: О2 - молекула кислорода. Она состоит из 2-х атомов
кислорода. Н2 - молекула водорода. Она состоит из 2-х атомов водорода. Н2О -
молекула воды. Она состоит из 2-х атомов водорода и одного атома кислорода (слайд
27).
Атомов в природе чуть больше 100, но их комбинации создают то огромное
многообразие веществ, которое окружает нас. В природе 88 атомов, остальные
получены в лабораториях. Существуют молекулы-гиганты, в которых содержатся
тысячи и сотни тысяч атомов. Это молекулы каучука, клетчатки, других
органических веществ. Самые большие молекулы из известных - молекулы некоторых
белковых веществ весят приблизительно в миллион раз больше молекулы воды.
Молекула гемоглобина, красящего вещества крови, состоит из 1400 атомов,
молекула пенициллина - из 41 атома. При помощи шариков можно конструировать
модели молекул. (Демонстрация пространственных кристаллических решеток). М.В.
Ломоносов (1711-1765) (слайд 28) - великий просветитель и основатель науки в
России писал, что молекула может быть однородной и разнородной. В первом случае
в молекуле группируются однородные атомы, во втором - молекула состоит из
нескольких видов атомов. Если какое-либо тело составлено из однородных молекул,
то его надо считать простым. Если тело состоит из молекул, построенных из
различных атомов, Ломоносов называл его смешанным (слайд 29). Не все тела
состоят из молекул. Есть тела, состоящие из атомов (алмаз, графит), ионов
(поваренная соль). Атомы очень маленькие частицы, но и они имеют сложное
строение. Существуют ещё более мелкие частицы (протоны, нейтроны, электроны), о
которых вы узнаете позже.
Второй этап
Цели уроков:
Образовательные: сформировать понятия “дискретность”, “хаотичность”,
“диффузия”, “агрегатное состояние”, сформулировать основные положения МКТ,
показать сущность физических явлений, руководствуясь основным положениями МКТ,
способствовать развитию мышления, умению структурировать информацию;
воспитывать эмоционально-ценностные отношения к миру.
Развивающие: содействовать развитию речи, мышления, познавательных и
общетрудовых умений; продолжить работу по формированию умений делать выводы из
наблюдений.
Воспитательные: формировать добросовестное отношение к учебному труду,
положительную мотивацию к учению; способствовать воспитанию гуманности,
дисциплинированности, эстетического восприятия мира.
Основы молекулярно-кинетической теории строения вещества
1. Постановка задачи
Вряд ли для кого-то, кто взялся за чтение этой книги, будет откровением
сообщение о том, что окружающие нас тела состоят из мельчайших частиц.
Наверняка читателю не только знакомы такие слова, как молекула, атом, ион,
протон, нейтрон, электрон, но у него есть и какие-то представления о том, что
это за частицы. Сама мысль о том, что вещества состоят из “кирпичиков”
высказывалась еще в древности Левкиппом и Демокритом. Но на протяжении 2400 лет
гипотеза об атомарном строении вещества так и оставалась всего лишь гипотезой.
И хотя были все основания полагать, что гипотеза верна, непосредственно увидеть
атомы и молекулы не удавалось даже в самый сильный микроскоп. И только после
того, как Эрвином Мюллером из университета шт. Пенсильвания (США) был
изобретен, в 1951 г. построен и к 1960 г. технически усовершенствован ионный
микроскоп, стало возможным получить изображения атомов отдельных веществ.

Из сказанного следует, что даже сейчас провести непосредственные
наблюдения молекул, атомов исключительно сложно, а во многих случаях и
принципиально невозможно.
Но, даже если бы перед нами не существовало никаких материальных и
технических трудностей и мы свободно могли бы воспользоваться ионным
микроскопом для того, чтобы изучать строение и свойства различных веществ, вряд
ли это нас полностью удовлетворило бы. Согласитесь, что надо иметь богатое
воображение, чтобы на основе фотографий типа приведенной выше, делать далеко
идущие выводы о микроструктуре вещества и, тем более, о его свойствах. Кроме
того, вопрос можно поставить и таким образом: из каких источников была получена
интересующая нас информация еще до изобретения ионного микроскопа? Каким
образом мы сами, в условиях школьного кабинета физики, можем получить
достоверные сведения о том, что недоступно нашему непосредственному восприятию?
Как можно проверить полученные сведения?
Таким образом, начнем с исходных позиций: с постановки задачи и поиска ее
решения на основе нашего личного опыта.
2. Опытные факты и некоторые закономерности
Попытаемся ответить на вопрос: каково строение веществ, из которых
состоят окружающие нас тела?
Для начала ограничимся самыми общими сведениями по интересующему нас
вопросу.
Более основательно понять строение и свойства вещества можно
проанализировав опосредованные данные, полученные в ходе самых разных опытов.
Если деревянные, металлические брусочки, листки бумаги крепко прижать
друг к другу, они не становятся цельным телом. После снятия нагрузки, тела
легко отделяются друг от друга.
Если два листка бумаги смазать клеем и после этого соединить друг с
другом, листки слипаются. После того как клей застынет, листки практически
невозможно отделить друг от друга.
Если два, предварительно размягченных, кусочка пластилина прижать друг к
другу, они слипаются и образуют единый кусок пластилина.

Если с помощью ножа сделать гладкие ровные срезы с торцов двух свинцовых
цилиндриков и после этого крепко прижать цилиндрики друг к другу, они прочно
соединяются между собой.
Если один конец цилиндриков закрепить на горизонтальной перекладине, а ко
второму их концу подвешивать гири (последовательно 1, 2, 3 кг, и т.д.),
цилиндрики разрываются только при весьма значительной силе, действующей на них.

Если две стальные пластинки с очень хорошо отшлифованными, ровными,
чистыми поверхностями прижать друг к другу, пластинки прочно прилипнут друг к
другу.
По крайней мере, веса одной из пластинок будет недостаточно, чтобы
оторваться от другой пластинки. Если поверхности пластинок слегка загрязнить,
например, нанеся на них тонкий слой мела, слипание пластинок при их
соприкосновении происходить не будет.

Если в цилиндр, заполненный газом, например, воздухом, находящимся при
нормальном атмосферном давлении, вставить поршень с хорошо притертой манжетой и
подействовать на этот поршень с некоторой силой, газ, находящийся в цилиндре,
достаточно легко сожмется. Если снять с поршня нагрузку, газ вновь расширится,
проявляя тем самым свои упругие свойства.

Если в цилиндр, заполненный жидкостью, например, водой, вставить поршень
с хорошо притертой манжетой и подействовать на этот поршень с очень большой
силой, жидкость своего объема заметным образом не изменит. Она лишь будет
просачиваться сквозь тончайший зазор между стенками цилиндра и поршнем.
Если в сосуд с раствором кислоты, например серной, бросить кусочек мела,
в сосуде начинается бурная химическая реакция, которая сопровождается
выделением газа.
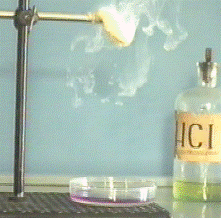
Если в небольшую открытую чашку налить нашатырный спирт, а над чашкой
укрепить ватку, смоченную соляной кислотой, то через некоторое время над чашкой
появятся густые белые клубы, состоящие из мельчайших кристалликов нашатыря.
Нашатырь образуется в результате химической реакции выделяющегося из
нашатырного спирта аммиака и испаряющегося с ватки хлористого водорода. По
характеру движения клубов, можно судить о том, что перемешивание газов, аммиака
и хлористого водорода, происходит самопроизвольно, безо всякого вмешательства
из вне. Такое перемешивание носит название диффузии.
Если в комнате, с практически неподвижным воздухом, открыть флакон,
заполненный хорошо испаряющейся пахучей жидкостью, например духами, запах этой
жидкости вскоре самопроизвольно распространится по всей комнате.
Если в высокий цилиндрический сосуд налить раствор медного купороса, а
сверху, очень аккуратно, воду, между жидкостями образуется четкая граница их
раздела.
Эта граница постепенно будет размываться. Жидкости самопроизвольно будут
перемешиваться.

Диффузия в жидкостях идет существенно медленнее, чем в газах. При
комнатной температуре, для превращения раствора медного купороса и воды,
находящихся в цилиндрическом сосуде, в однородную жидкость потребуется даже не
одна неделя.
При очень большом увеличении, в загрязненных жидкостях и газах можно
наблюдать движение мельчайших частиц вещества, называемое броуновским движением
по имени английского ботаника, впервые наблюдавшего и описавшего его в 1827г.
Для наблюдения броуновского движения частиц можно использовать микроскоп,
дающий очень большое увеличение.
На предметное стеклышко помещается слабый раствор акварельной краски,
раствор прикрывается тонким покровным стеклышком. Стекла помещаются под
объективом микроскопа, наблюдение ведется в окуляр.
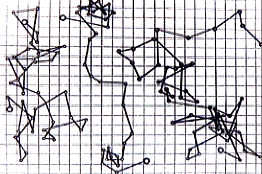
Если сосредоточить внимание на какой- либо одной частичке и долго
наблюдать за ней, то движение частички можно уподобить маленьким прыжкам.
Частичка как бы прыгает под воздействием внезапных толчков и так же внезапно
останавливается. Сравнивая траектории нескольких броуновских частиц, можно
отметить, что они совершенно непохожи друг на друга. Движение броуновских
частиц хаотично и беспрерывно, перемещения их случайны.
В то же время, движение броуновских частиц подчиняется вполне
определенному закону, который был установлен Альбертом Эйнштейном и Марианом
Смолуховским.
Суть этого закона заключается в следующем. Из механики нам известно, что
перемещение тела при равномерном движении пропорционально времени x ~ t, а при
равнопеременном квадрату времени x~t2.
Броуновская
частица совершает неравнопеременное движение. Если ее смещения за равные
промежутки времени спроецировать на одно направление, возвести проекции
смещений 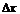 в квадрат
в квадрат 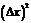 и
вычислить среднее значение квадратов смещений
и
вычислить среднее значение квадратов смещений  , то
окажется, что
, то
окажется, что  ~ t.
~ t.
Закон,
установленный Эйнштейном и Смолуховским является примером статистического
закона, который описывает поведение не отдельной частицы, а их огромного
количества. Статистические законы принципиально отличаются от законов
классической механики.
3.
Объяснение опытных фактов
Все
эти и многие другие, на первый взгляд разрозненные, факты можно объяснить, если
представить себе, что:
1. Все вещества состоят из частиц.
2. Частицы хаотично и беспрерывно
движутся.
3. Частицы взаимодействуют между cобой
посредством сил притяжения и отталкивания.
Мельчайшая электронейтральная частица вещества, обладающая всеми его
химическими свойствами, называется молекулой.
Наименьшая частица химического элемента, т.е. наименьшая частица
вещества, не делящаяся при химических реакциях и являющаяся носителем
химических свойств элемента, называется атомом.
Молекула вещества может состоять из одного или нескольких атомов.
Одни и те же вещества могут существовать в различных агрегатных
состояниях - газообразном, жидком, твердом.
Вероятно, это различие обусловлено характером расположения, движения и
взаимодействия молекул в веществе.

Модель льда модель воды модель водяного
пара
Чисто качественно, можно представить, что в газе молекулы находятся на
очень больших расстояниях друг от друга и взаимодействуют между собой только
при соударениях.
В жидкостях расстояния между молекулами сравнимы с их размерами, поэтому
плотности жидкостей, как правило, больше плотностей газов.
В твердых телах, вероятно, межмолекулярные расстояния еще меньше, чем в
жидкостях, либо соизмеримы с ними.
Между молекулами жидкостей действуют значительные силы притяжения. За
счет этого жидкости сохраняют свой объем. Но силы притяжения здесь не так
велики, чтобы жидкости имели свою собственную форму, как это бывает у твердых
тел.
Если наши представления о строении веществ верны, то следует ожидать
существования достаточно неожиданного явления.
При смешивании двух разнородных жидкостей, молекулы одной жидкости,
проникая в промежутки между молекулами другой жидкости, отталкиваются от них
слабее, чем друг от друга. В результате этого, объем смеси может оказаться
меньше суммы объемов смешиваемых жидкостей, взятых порознь.
Подобный эффект действительно имеет место, например, при смешивании воды
и спирта. Проверить это можно следующим образом. Если в узкую длинную пробирку
налить подкрашенную воду, а поверх нее спирт, между жидкостями будет
наблюдаться достаточно четкая граница их раздела. Общую высоту двух столбов
жидкости можно отметить с помощью ободка. Если после этого пробирку закрыть для
предотвращения вытекания жидкости и тщательно перемешать воду и спирт путем
переворачивания и встряхивания пробирки, то окажется, что объем раствора спирта
в воде меньше суммы объемов спирта и воды до их перемешивания.
Для моделирования процесса смешивания некоторых разнородных жидкостей и
пояснения эффекта уменьшения объема смеси по отношению к сумме объемов
жидкостей до их перемешивания, можно воспользоваться горохом и пшеном. Частицы
гороха и пшена имитируют молекулы различных жидкостей.
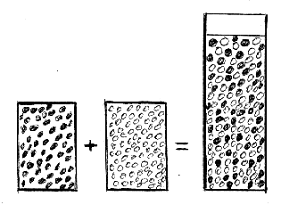
Для демонстрации модели эффекта, до половины высокого прозрачного
цилиндрического сосуда насыпается горох. Поверх гороха, до самого верха сосуда
насыпается пшено. После этого содержимое сосуда аккуратно пересыпается в
коробку, где производится перемешивание частиц гороха и пшена. Смесь аккуратно
возвращается в цилиндрический сосуд. Оказывается, что смесь существенно не
доходит по края сосуда.
Размеры молекул разных веществ, вероятно, не одинаковы. По всей видимости,
различны и подвижности молекул разных веществ.
Например, известно, что детский резиновый шарик, заполненный водородом,
уменьшает свой объем значительно быстрее, чем если бы он был заполнен воздухом.
Если предположить, что молекулы водорода меньше и подвижнее молекул азота
и кислорода, из которых в основном состоит воздух, то становится понятным, что
они быстрее просачиваются сквозь мельчайшие отверстия, которые могут остаться
при завязывании шарика.
Если это так, то можно заранее предсказать и результат опыта с пористым
глиняным цилиндром, который соединен с манометром.

Если на этот цилиндр надеть несколько более широкий стакан, заполненный
водородом, то молекулы водорода будут входить через поры внутрь цилиндра
быстрее, чем молекулы воздуха выходить. Давление внутри цилиндра возрастет.
Если широкий стакан убрать, молекулы водорода выйдут из цилиндра быстрее, чем
туда вернутся молекулы воздуха. Давление внутри цилиндра сначала сравняется с
атмосферным, а затем на некоторое время уменьшится по отношению к нему.
Соответствующий эксперимент действительно дает ожидаемые результаты.
Поскольку эксперименты подтверждают следствия, полученные путем
логических рассуждений, основанных в свою очередь на предположениях о строении
вещества, вероятно, эти предположения не лишены смысла и могут быть
использованы в дальнейшем для объяснения различных физических явлений.
4. Взаимодействие молекул
Одна из выдвинутых нами посылок касалась взаимодействия молекул.
Возникает вопрос: какова природа этого взаимодействия?
Мы считаем, что между молекулами одновременно действуют силы притяжения и
отталкивания. В то же время, мы знаем, что силы притяжения и отталкивания
существуют между электрическими зарядами.
Если представить себе молекулы в виде диполей (частиц со смещенными
относительно центра положительными и отрицательными зарядами), то можно,
пользуясь соответствующими законами, найти зависимость силы взаимодействия двух
соседних молекул от расстояния между их центрами.

Зная эту зависимость, можно отобразить ее графически.
Соответствующим образом можно построить график зависимости энергии взаимодействия
двух соседних молекул от расстояния между их центрами.
Согласно принципу минимума энергии, взаимодействующие молекулы будут
стремиться перейти в состояние с наименьшей из возможных значений энергией.
Минимальной энергии будет соответствовать некоторое расстояние между
молекулами.

Если система молекул, а значит и каждая из них в отдельности, поглотит
извне некоторое количество теплоты, то это приведет к изменению энергии
взаимодействия рассматриваемых молекул. Новому значению энергии на графике
будет соответствовать два значения расстояния между молекулами. Это означает,
что молекулы будут совершать колебательное движение относительно друг друга. В
силу асимметричности графика, среднее расстояние между молекулами будет
увеличиваться.
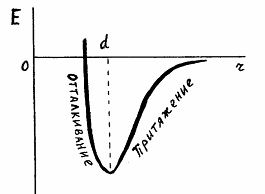
Приведенные рассуждения позволяют объяснить тепловое расширение тел.
Поскольку ветвь графика, соответствующая притяжению молекул,
асимптотически уходит в бесконечность, то при некотором значении энергии
взаимодействия молекул, связь между ними должна разорваться. Если разрыв связей
происходит на границе раздела жидкости и газа, мы говорим об испарении
жидкости.
5. Измерения в микромире. Значения некоторых микропараметров
вещества
Опыты свидетельствуют, что молекулы очень малы. Непосредственно увидеть
их нам не удается. Но все-таки, как же определить или хотя бы оценить размеры,
массу молекул, их число в каком-либо теле?
Один из простейших опытов, позволяющих оценить размеры молекул, состоит в
следующем. Капля масла падает на поверхность воды. Масло, растекаясь, образует
очень тонкую пленку. Толщина этой пленки, по крайней мере, не меньше диаметра
молекул.
Для одного из опытов по образованию масляной пленки результаты таковы.
Масса капли m = 0,8 мг = 8 10 -7 кг.
Плотность масла ρ = 900 кг/м3.
Площадь масляного пятна S = 0,55 м2.
Объем капли


Толщина
масляной пленки, предположительно соизмеримая с диаметром молекулы:
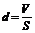
 .
.
Объем
одной молекулы
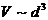
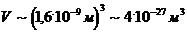 .
.
Если
предположить, что молекулы в капле упакованы плотно, то число молекул в капле:
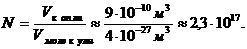
Массу
же одной молекулы можно оценить, разделив массу капли на число молекул,
находящихся в ней:
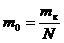 ;
;
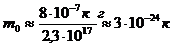 г.
г.
Эти
числа, конечно же, неточны, но важно, что мы на основе простейших опытов можем
их сами получить. Кроме того, они могут дать нам какие-то представления о
масштабах микромира. Одно только сопоставление, которое нетрудно провести
самостоятельно, оказывается весьма впечатляющим.
Если
бы каждая молекула, находящаяся в нашей капельке масла, выросла до размеров
макового зернышка, то сама капля разрослась до таких размеров, что для нее
потребовалось бы несколько железнодорожных цистерн.
Массы
молекул настолько малы, что часто бывает неудобно выражать их в килограммах или
даже в дольных единицах - граммах или миллиграммах.
Для
молекул удобно выбрать свой эталон массы. Зная его соотношение с килограммом,
можно лишь в случае особой необходимости, или на заключительном этапе
вычислений, представлять значение массы микрочастиц в килограммах.
Как
и любой эталон, эталон для измерения массы молекул выбирается в значительной
мере произвольно, из соображений удобства.
В
настоящее время существует договоренность сравнивать массы всех молекул с 1/12
массы атома углерода - 12, называемой атомной единицей массы (1а.е.м. 1,66 .10-27 кг ).
1,66 .10-27 кг ).  При таком способе определения масса молекул является
величиной относительной. Она называется относительной молекулярной (атомной)
массой вещества и обозначается Mr (Аr).
При таком способе определения масса молекул является
величиной относительной. Она называется относительной молекулярной (атомной)
массой вещества и обозначается Mr (Аr).
Относительная
молекулярная (атомная) масса вещества - это физическая величина, равная
отношению массы молекулы (атома) данного вещества к 1/12 массы атома
углерода-12.
Согласно
определению,

Физическая
величина, определяемая числом структурных элементов (этими элементами могут
быть атомы, молекулы, ионы, электроны и другие частицы или их группы),
содержащихся в системе, называется количеством вещества системы.
Под
системой (от греческого слова systema - соединение, составленное из частей)
понимают множество структурных элементов, определенным образом связанных друг с
другом и образующих единство, целостность.
Единица
количества вещества системы - моль. В СИ - это одна из семи основных единиц.
Моль
равен количеству вещества системы, содержащей столько же структурных элементов,
сколько содержится атомов в углероде-12 массой 0,012 кг.
Моль
является расчетной единицей, поэтому эталона для его воспроизведения не
существует.
Как
видно из определения, точное количество частиц в моле не указано. Принято считать
его равным числу Авогадро.
Значение
числа Авогадро известно из курса химии. Приближенно оно равно:

Если
обозначить количество вещества буквой n, а число
структурных элементов в некоторой системе буквой N, то
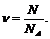
Моль
служит для образования производных молярных величин, в частности, молярной
массы. Определяющее уравнение молярной массы имеет вид:
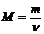 ,
,
где
M - молярная масса однородного вещества;- масса однородного вещества;
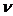 -
количество вещества.
-
количество вещества.
Молярная
масса - это физическая величина, определяемая отношением массы однородного
вещества к его количеству.
Молярная
масса показывает, какова масса одного моля однородного вещества.
Чтобы
получить единицу молярной массы СИ, надо в определяющее уравнение молярной
массы подставить единицы массы - 1 кг и количества вещества - 1 моль.
Получаем:
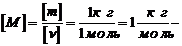 .
.
Молярная
масса связана с относительной молекулярной массой соотношением:

Значения
приведенных величин позволяют путем вычислений оценить порядок величины
размеров молекул.
Если
считать, что молекулы в жидкости упакованы плотно и каждая из них вписывается в
куб объемом V1 с ребром d, то
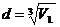
Объем
одной молекулы связан с объемом Vm одного моля
жидкости и числом Авогадро NA соотношением:

Объем
одного моля жидкости выражается через ее молярную массу М и плотность 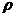 :
:
вещество молекула
хаотичный диффузия
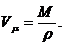
Таким
образом, диаметр молекулы равен:
Для
воды:
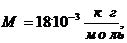

Вычисляя,
имеем:
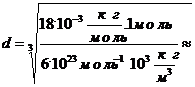
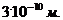
Из
приведенных выше сведений любопытным является вопрос о происхождении числа
Авогадро. Действительно, невозможно вообразить, что это число принципиально
могло бы быть получено путем непосредственных подсчетов. Тогда встает вопрос: а
как оно было найдено опосредованными методами?
История
вопроса примерно такова. В начале XIX в Гей-Люссак на опыте установил закон,
согласно которому при химических реакциях соединение газов всегда происходит
таким образом, что один объем одного газа соединяется только с кратными
объемами другого газа.
Объясняя
результаты опытов Гей-Люссака, итальянский ученый Авогадро в 1811 г. выдвинул
гипотезу о том, что при одних и тех же температуре и давлении равные объемы
газов содержат одно и то же число молекул. Будучи согласованной с рядом других
сведений, полученных химиками, гипотеза Авогадро в дальнейшем получила статус
закона.
Закон
Авогадро можно сформулировать и следующим образом: 1моль любого вещества в
газообразном состоянии при одинаковых давлении и температуре занимает вполне
определенный объем. При нормальных условиях (p = 101,325 Па и t=0oC)
этот объем равен примерно 22,4 л.
Из
закона Авогадро следует, что отношение плотностей газов, взятых при одних и тех
же условиях, (макроскопических и непосредственно измеряемых величин), равно
отношению масс их молекул, (микроскопических и непосредственно неизмеряемых
величин). Это отношение позволяет сравнивать массы молекул, так как плотность
газа равна произведению концентрации n (числа молекул в единице объема) на
массу одной молекулы m0 :
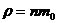
 .
.
Закон
Авогадро позволил определить и число молекул в моле любого вещества, получившее
название числа Авогадро.
Впервые
значение числа Авогадро определил в 1908 г. французский физик Перрен.
Идея
метода Перрена строилась на гипотезе о том, что мельчайшие, взвешенные в
жидкости частички, совершающие броуновское движение в поле тяготения,
распределяются по высоте согласно тем же законам, что и молекулы газов,
входящих в состав воздуха. В уравнение, показывающее, чему равно отношение
плотностей газа на разных высотах, наряду с другими величинами, входит и масса
молекулы. Зная, чему равны плотности различных газов на разных высотах, и
измерив концентрацию броуновских частиц на разной глубине, можно сравнить массы
молекул с массой броуновских частиц. Масса броуновских частиц, какими бы
маленькими они ни были, величина измеряемая. Следовательно, подсчет числа,
тщательным образом подготовленных, одинаковых по размеру, однородных
броуновских частиц, в конечном счете позволяет определить массы молекул
различных газов.

На рисунке показана схема установки Перрена, состоящей из микроскопа с
малой глубиной поля зрения и кюветы с эмульсией, а также сильно увеличенный вид
этой кюветы сбоку, показывающий распределение броуновских частиц по глубине.

Зная массу одного моля газа и массу одной его молекулы, уже нетрудно
сосчитать число молекул в моле:

Повторить
опыты Перрена в условиях школьного кабинета физики вряд ли удастся, но можно
попытаться хотя бы определить порядок величины числа Авогадро на основе данных
уже известного нам простого эксперимента, который мы вполне можем поставить
самостоятельно. Это эксперимент с получением тончайшей масляной пленки на
поверхности воды.
Если
объем капли V, площадь масляного пятна S, толщина слоя d, объем одной молекулы
V1, то:
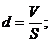

Тогда
объем и масса моля вещества:
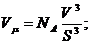
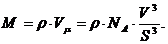
Отсюда:
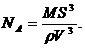
В
числах это может выглядеть так:


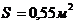



Одно из основных положений молекулярно-кинетической теории гласит, что
молекулы находятся в беспрерывном движении. Сражу же возникает вопрос: а каковы
скорости движения молекул?
6. Опытное определение скоростей молекул
Впервые прямые измерения скоростей молекул были проведены в 1920 г.
немецким физиком О. Штерном.
Идея опыта Штерна состояла в следующем. По оси двух соосных цилиндров,
большого и малого, натягивается посеребренная проволока. В малом цилиндре
делается узкая щель. Если по проволоке пропускается электрический ток,
проволока накаляется, серебро испаряется и его молекулы разлетаются в разные
стороны. Молекулы, пролетевшие в щель, оставляют на стенке большого цилиндра
след.
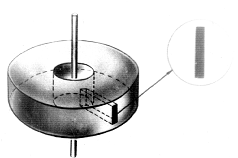
Если цилиндры будут вращаться вокруг общей оси с одинаковой угловой
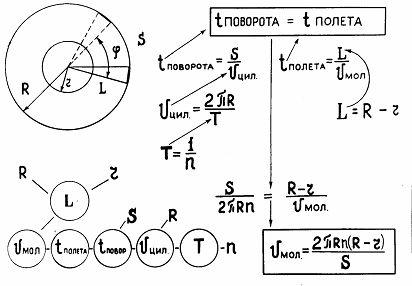
скоростью, то за время, которое необходимо молекулам для того, чтобы пролететь
путь L между цилиндрами, внешний цилиндр успеет повернуться на некоторый угол,
вследствие чего след от молекулярного пучка сместится на величину S от метки,
оставленной им в первом случае. Время поворота внешнего цилиндра относительно
внутреннего можно выразить через смещение полоски и линейную скорость вращения
v цил . При равномерном вращении, скорость большого цилиндра выражается через
его радиус R и период обращения T.
Период же рассчитывается через число оборотов в единицу времени n. Время
полета молекул от одного цилиндра до другого выражается через радиусы цилиндров
R , r и искомую скорость v мол. Все отмеченные связи представлены ниже двумя
способами. В одном случае рассуждения ведутся от искомой величины - скорости
газовых молекул. Эта величина связывается с другими величинами. Те, в свою
очередь, со следующими. Если величина нам неизвестна, она обводится кружком,
если известна или принципиально определяема, то нет.
Во втором случае рассуждения ведутся от основной идеи. В данном случае,
это идея о равенстве времен пролета молекулярным пучком расстояния между
цилиндрами и поворота цилиндров на некоторый угол, заданный направлениями на
две отметки на стенках внешнего цилиндра.
Опыт Штерна дал следующий результат. Смещенная полоска серебра на внешнем
цилиндре оказалась размытой, что могло быть объяснено различием скоростей
молекул.
На графике приведена кривая распределения молекул по скоростям. На оси
абсцисс отложено значение модуля скорости молекул. На оси ординат -
относительное число молекул, скорости которых лежат в некотором интервале v.
Пик кривой соответствует скорости молекул, которая называется наиболее
вероятной скоростью.
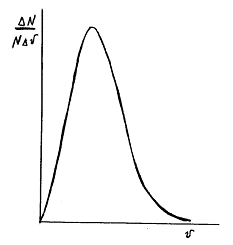
С повышением температуры наиболее вероятная скорость молекул возрастает.
График показывает, что лишь относительно небольшое число молекул обладает очень
маленькими и очень большими скоростями. Значение же скоростей подавляющего
большинства молекул лежит в довольно узком диапазоне. В опытах Штерна значение
именно этих скоростей получилось порядка нескольких сот метров в секунду.
7. Некоторые применения знаний о строении и свойствах
вещества
Физические эффекты, основанные на явлениях диффузии, хаотичного движения
молекул, их взаимодействия друг с другом на малых расстояниях, находят широкое
применение как в быту, так и в технике.
Так, за счет диффузии происходит засолка овощей.
Склеивание различных конструкций происходит за счет взаимодействия
молекул.
Можно было бы назвать еще множество применений молекулярных явлений.
Однако, ограничимся упоминанием лишь одного из них, не столь широко известного,
как упомянутые выше.
В технике существует проблема создания высокого вакуума. Он, в частности,
необходим для изготовления кинескопов к телевизорам, рентгеновских трубок.
Обычные механические насосы не могут понижать атмосферное давление до
необходимой величины.
Для решения задачи используются диффузионные насосы.

Поток молекул ртути, образованный при ее интенсивном испарении, с
огромной скоростью движется вдоль цилиндра. Стенки цилиндра охлаждаются водой.
За счет этого молекулярный пучок в нижней части цилиндра охлаждается, а
скорости молекул уменьшаются. Таким образом, в верхней части цилиндра находятся
молекулы, обладающие большими скоростями, а в нижней - маленькими. Попавшие в
цилиндр молекулы воздуха испытывают удары со стороны молекул ртути,
нескомпенсированные с разных сторон. В результате, они приобретают импульсы,
направленные вниз. Попадая в цилиндр через верхнее отверстие, молекулы воздуха
продвигаются к нижнему отверстию, а оттуда уже удаляются с помощью
механического насоса. Диффузионный насос, работая совместно с механическим,
способен понижать давление воздуха до миллиардных долей нормального
атмосферного давления. В промышленности цилиндры изготовляются из прочного
металла, а ртуть заменяется маслом.
Заключение
Современная жизнь ставит человека в чрезвычайно изменчивые условия,
требует от него решения все новых и новых задач. Эффективное решение этих задач
невозможно без определенного опыта деятельности по поиску подходов к проблеме,
проигрыванию ситуации в уме, прогнозированию последствий тех или иных действий,
проведению анализа результатов, поиску новых подходов. Второй этап построен на
необходимость в сведениях о молекулярном строении вещества. Главная задача-
напомнить учащимся основные постулаты МКТ, показать их место в современной
системе научных знаний.
В курсовой работе рассматривается методика изучения и техника
демонстрационных опытов, которые входят в темы «Строение вещества» (изучается в
курсе физики 6-го класса), а также «Основы молекулярно-кинетической теории»
(изучается в курсе физики 10-го класса).
Автор не стремился везде и во всех деталях истолковывать физику
демонстрируемых явлений и закономерностей. Эту задачу решают соответствующие
курсы физики. В описаниях подробно раскрывается методика и техника
эксперимента.
При описании демонстрационных опытов применялось учебное оборудование по
физике, имеющееся в школах. В тех случаях, когда этого оборудования оказывалось
недостаточно, приведены самодельные приборы и методы их изготовления.
Список использованных источников
1. Учебные
программы для общеобразовательных учреждений с русским языком обучения. - Мн.
Национальный институт образования , 2009г.
2. Книга
для чтения по физике: Учебн. Пособие для учащихся 6-7 классов сред. Шк. / Сост.
И.Г. Кириллова. - 2-е изд., перераб. - М.: Просвещение, 1986. - 207 с.
. Методика
преподавания физики в 7-8 классах средней школы: Пособие для учителя/ А.В.
Усова, В.П. Орехов, С.Е. Каменецкий и др.; Под ред. А.В. Усовой. - 4-е изд.,
перераб. - М.: Просвещение, 1990. - 319 с.
. А.Е.
Гуревич, Д.А. Исаев, Л.С. Понтак. Физика и химия. 5-6 кл.: Учебн. для
общеобразоват. учебн. заведений / А.Е. Гуревич, Д.А. Исаев, Л.С. Понтак. - М.:
Дрофа, 2001. - 192 с.
. Полянский
С.Е. Поурочные разработки по физике. 7 класс. М.: “ВАКО”, 2004, 240 с
. В.В.
Жилко, А.В. Лавриненко, Л.Г. Маркович. Физика. Учебное пособие для 10 класса
общеобразовательной школы с русским языком обучения. - Мн., «Народная асвета»,
2001г.
. А.А.
Покровский. Демонстрационный эксперимент по физике. Том 2. - М. «Просвещение»,
1972г.