Влияние фотохимических реакций на процесс лазерного электрохимического осаждения
Влияние фотохимических реакций на
процесс лазерного электрохимического осаждения
Содержание
Введение
1. Элементарные процессы при лазерном излучении
1.1 Поглощение света
1.2 Фотоперенос электрона
1.3 Сольватированный и квазисвободный электроны
2. Реакции фотодиссоциации и фотозамещения
2.1 Гомолитические реакции
2.2 Гетеролитические системы
2.3 Обратные связи в лазерной термохимии
3. Процессы радиационной химии
3.1 Три стадии радиационно-химического процесса
3.2 Радиолиз воды и других неорганических жидкостей
3.3 Радиационно-химические превращения в гетерогенных системах
4. Условия преобладания теплового или фотохимического механизма
реакции под действием ИК-излучения
4.1 Радиационная и тепловая заселенности колебательно-возбужденных
состояний
4.2 Экспериментальные критерии выбора между тепловым и
фотохимическим механизмом реакции
Заключение
Список использованных источников
Введение
Предметом изучения фотоэлектрохимии в целом являются
процессы, протекающие под действием электромагнитного излучения на электродах
самой разнообразной природы. Традиционными объектами исследования
фотоэлектрохимии являлись реакции фотовозбужденных частиц из раствора на
металлических электродах. Электродные реакции - это гетерогенные химические
реакции, которые протекают на границе раздела электрод-электролит и
сопровождаются переносом электрического заряда через эту границу. Естественно,
что эти реакции подчиняются всем основным закономерностям химической кинетики,
но имеют свою специфику, которая обусловлена особенностями переноса заряда
через границу фаз. Энергетика, а, следовательно, и скорость переноса заряда из
одной фазы в другую зависят от разности электрических потенциалов между этими
фазами. В результате наряду с обычными переменными химической кинетики - концентрацией,
температурой и т.д. - в электрохимической кинетике появляется дополнительная
зависимая переменная - электродный потенциал [1]. Эта величина, а вместе с ней
и скорость электродной реакции могут весьма сильно изменяться в результате
поляризации электрода.
Процессы прохождения электрического тока в физико-химических
и электрохимических системах, например, под воздействием внешнего
электрического поля, освещения, изменения состава раствора сопровождаются
перемещением носителей зарядов. В металлических электродах такими носителями
служат электроны. В электролитах заряд переносится ионами.
Если в растворе, находящемся в контакте с электродом,
присутствуют фоточувствительные атомы или молекулы, то в результате облучения
возможно инициирование электрохимических реакций с участием фотовозбужденных
частиц. Кванты света выступают здесь в роли своеобразных дополнительных
реагентов, увеличивающих скорость протекания электродных процессов. Изучение
электрохимических реакций, в которых принимают участие фотовозбужденные
реагенты, имеет значение как в связи с получившими особенное развитие в
последние годы прикладными исследованиями, так и в целях более глубокого
понимания структуры и свойств фоточувствительных атомов и молекул.
С появлением лазеров сразу же возник вопрос о возможности
стимулирования химических реакций действием лазерного излучения. Лазерное
излучение отличается от получаемого с помощью других источников (тепловых,
газовых), в первую очередь когерентностью, монохроматичностью и большой
мощностью. Особый интерес вызвали возможности использовать уникальную
монохроматичность для осуществления селективных (резонансных) фотопроцессов, а
высокую мощность - для осуществления многофотонных процессов, которые и
стимулировали широкие исследования в этих направлениях.
При взаимодействии квантов видимого и ультрафиолетового
диапазонов излучения концентрация первичных возбужденных частиц или продуктов
диссоциации обычно на много превышают термически равновесные. В этих случаях не
возникает вопроса о конкуренции термических реакций с фотохимическим процессом.
При этом характерные времена фотохимических процессов сопоставимы с характерным
временем столкновительных процессов. Но воздействие на вещество ИК-излучения
сопровождается тепловым разогревом, что приводит к еще большей равновесной
концентрации колебательно-возбужденных частиц. Поэтому всякий раз возникает
вопрос, чем обусловлена реакция под действием ИК-излучения: равновесным
тепловым разогревом или участием более реакционно-способных
колебательно-возбужденных частиц, генерируемых излучением. Одна из возможностей
осуществления фотохимических превращений связана с возбуждением не основных
колебательных состояний молекул, а возбужденных.
лазерное электрохимическое осаждение фотохимический
В большинстве литературных источников фотохимические процессы
вообще не рассматриваются. В этих книгах считают, что под действием
ИК-излучения фотохимические превращения незначительны по сравнению с тепловыми
процессами. И только в некоторых из них уделяется хоть какое-то внимание этим
процессам. Малый объем экспериментального материала позволяет лишь
предположительно обсуждать, по какому механизму протекает процесс лазерного
электрохимического осаждение.
В данной курсовой работе рассмотрен ряд фотохимических
процессов, возникающих при лазерном осаждении металлов из растворов на
электроды.
1. Элементарные процессы при лазерном излучении
1.1
Поглощение света
Элементарный акт, посредством которого
квант излучения вступает в химический процесс, состоит в поглощении этого
кванта. Процесс поглощения излучения заключается в том, что под действием
электромагнитного поля молекулы вещества переходят из основного состояния в
состояние с более высокой энергией. В зависимости от энергии поглощаемого
фотона молекулы вещества переходят в возбужденные вращательные, колебательные,
электронные или ядерные состояния либо происходит отрыв электрона от молекулы
(фотоионизация). В конденсированной фазе образуются также коллективные
возбужденные состояния (плазмоны и др.) [2].
Поглощение фотонов видимого света и
УФ-излучения связано с переходом молекул в возбужденные электронные состояния.
Дальний ультрафиолет, энергия фотонов
которого превышает потенциал ионизации вещества (обычно выше 6 эВ), вызывает
также фотоионизацию.
Анализ спектров поглощения веществ позволяет определять характер
возбужденных состояний, образующихся при поглощении соответствующих фотонов.
Для характеристики спектров поглощения обычно используют молярные коэффициенты
поглощения 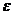 .
.
В соответствии с законом Бугера-Ламберта - Бера поглощение 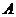 плоскопараллельного слоя раствора
выражается следующим образом:
плоскопараллельного слоя раствора
выражается следующим образом:
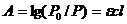 (1.1)
(1.1)
где 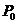 и
и 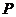 - интенсивности
падающего на образец и прошедшего света; с - концентрация вещества в
растворе;
- интенсивности
падающего на образец и прошедшего света; с - концентрация вещества в
растворе; 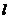 - толщина слоя поглощения.
- толщина слоя поглощения.
Поглощение инфракрасного излучения связано с возбуждением
колебаний и вращений молекул. Оно тоже подчиняется закону Бугера -
Ламберта-Бера. Помимо молярного коэффициента поглощения используется сечение
поглощения 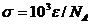 . Полосы поглощения в
колебательно-вращательных спектрах значительно уже, чем в электронных спектрах.
Для ИК-спектров многих классов молекул свойственно наличие так называемых
характеристических частот, связанных с колебаниями определенных типов связей
или групп.
. Полосы поглощения в
колебательно-вращательных спектрах значительно уже, чем в электронных спектрах.
Для ИК-спектров многих классов молекул свойственно наличие так называемых
характеристических частот, связанных с колебаниями определенных типов связей
или групп.
Поглощать свет может и молекула в электронном, колебательном и
вращательном возбужденном состоянии, поэтому в принципе возможны новые
квантовые процессы. Основное их условие - достаточное время жизни возбужденного
состояния, чтобы при данной интенсивности света возбужденная частица могла
поглотить еще один фотон.
Конечные стабильные продукты фотолиза, радиолиза, воздействия
плазмы и других процессов химии высоких энергий, как правило, возникают в
результате сложной последовательности быстрых реакций частиц различного типа,
имеющих избыточную потенциальную энергию и поэтому высокую реакционную
способность.
При поступлении энергии в среде возникают первичные активные
частицы или промежуточные продукты первого поколения, которые затем в серии
последовательных превращений переходят в промежуточные продукты последующих
поколений и порождают конечные продукты.
Промежуточные продукты процесса весьма разнообразны по своим
свойствам. Их происхождение связано с потерей и приобретением электрона
(ионизации), приобретением орбитальным электроном дополнительной кинетической
энергии (электронное возбуждение), возбуждением колебательных и вращательных
уровней, разрывом и образованием новых химических связей (распад, сольватация и
др.). Промежуточные частицы некоторых видов могут быть термодинамически
устойчивы и по одиночке существовать неопределенно долго, но все они обладают
высокой реакционной способностью по отношению к промежуточным продуктам того же
или другого вида и ко многим стабильным молекулам.
При электронном ударе молекулы происходит ее ионизация и
возбуждение. Обычно считалось, что образуется электронно-возбужденные состояния
с энергией, меньше первого потенциала ионизации. Однако возможно возбуждение и
глубоко лежащего электрона с энергией выше первого потенциала ионизации. Для
атома несущественно, какой электрон возбужден, и если энергия возбуждения выше
первого потенциала ионизации, то всегда происходит автоионизация. В молекулах,
однако, возможны и конкурентные процессы расхода энергии возбуждения, поэтому
для такого сверхвозбужденного состояния, т.е. состояния, энергия возбуждения
которого выше первого потенциала ионизации, могут иметь место следующие
процессы [2]
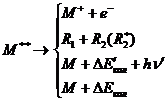 (1.2)
(1.2)
1) автоионизация
2) преддиссоциация
) излучательная релаксация
) безызлучательная релаксация,
так что выход ионизации ниже выхода сверхвозбужденного
состояния.
Могут существовать следующие типы сверхвозбужденных
состояний:
) одноэлектронное возбуждение ридбергского типа с
большим главным квантовым числом;
2) возбуждение электронов на орбиталях, у которых
потенциал ионизации выше первого потенциала ионизации;
) одновременное возбуждение двух и более электронов и
молекул.
Для всех типов сверхвозбужденных состояний необходимо
определенное время для передачи энергии между электронными уровнями
(автоионизация предполагается безынерционной). Образование сверхвозбужденных
состояний может происходить как в результате прямого воздействия ионизирующего
излучения, так и вследствие распада плазмонов в конденсированной фазе.
Первичные возбужденные ионы, получившие при ионизации избыток
внутренней энергии, диссоциируют, давая осколочный ион с меньшей массой и
нейтральную частицу. Предшественниками осколочных ионов являются возбужденные
молекулярные ионы. Это указывает, что при электронном ударе и другом
аналогичном воздействии главным образом возникают возбужденные молекулярные
ионы. Глубокий распад, требующий большую энергию, как правило, менее вероятен,
чем менее глубокий. Это согласуется с тем, что вероятность передачи энергии при
акте взаимодействия ионизирующего излучения с веществом тем меньше, чем больше
эта энергия. Некоторые из первичных возбужденных молекулярных ионов имеют
настолько малое время жизни, что не дезактивируются даже в конденсированной
фазе, а распадаются. Осколочные ионы возникают также за счет распада
сверхвозбужденного состояния. Поскольку предшественники осколочных ионов имеют
различную избыточную энергию, то и константы скорости их распада неодинаковы.
Следовательно, для каждого возбужденного молекулярного иона существует
распределение по константам скорости распада и соответственно по эффективности
подавления их распада столкновительной дезактивацией.
Внешние воздействия могут вывести систему из
квазиравновесного состояния, в результате чего путь реакции может радикально
отличаться от равновесного. Системе, находящейся в каком-либо возбужденном
электронном состоянии, соответствует своя поверхность потенциальной энергии.
Топографии поверхностей в основном и возбужденном состояниях различаются. В
возбужденном состоянии на поверхности потенциальной энергии могут исчезать
старые и возникать новые по сравнению со случаем основного состояния
потенциальные барьеры, появляться новые энергетические минимумы и пропадать
старые минимумы, формироваться новые и перекрываться старые пути реакции. На
поверхности потенциальной энергии возможны любые неравновесные траектории, лишь
бы они не были запрещены теми или иными законами сохранения (правилами отбора).
Поэтому характер протекания химических процессов в основном и возбужденном
состояниях может быть качественно различным. Избыточная энергия реагентов в ходе
реакции трансформируется в колебательную энергию продуктов [3].
Как правило, время пребывания системы в возбужденном
состоянии конечно. Это обусловлено либо тем, что рассматриваемое возбужденное
состояние не является стационарным квантовомеханическим состоянием, либо тем,
что система взаимодействует со своим окружением, т.е. с внешними полями или с
другими частицами.
В элементарных актах возбужденные атомы, молекулы и т.п.
выступают как новые частицы, обладающие своим строением, своими характерными
свойствами и т.д. В этой связи процесс образования возбужденных частиц под
действием излучения следует рассматривать, как химическую реакцию, в которой
свет участвует как вещество - реагент, как равноправный участник реакции.
Энергия, вводимая в среду при поглощении света, может
необратимо теряться за счет диссипативных процессов, таких как радиационная или
безызлучательная релаксация между различными степенями свободы реагирующих
молекул. Релаксационные процессы, равно как и процессы внутримолекулярного
переноса энергии, играют весьма важную роль в лазерной химии.
Результатом действия релаксационных процессов в закрытой по
энергообмену и массообмену системе является установление термодинамически
равновесного состояния с единой температурой для всех степеней свободы. Для
систем, обменивающихся с окружающей средой энергией и (или) веществом, т.е. для
диссипативных систем, релаксационные процессы проявляются по-разному в
зависимости от скорости их протекания. Если скорость релаксации велика по
сравнению со скоростью изменения распределения населенностей в объеме системы
под действием окружения, то система близка к равновесной. В обратном случае
даже стационарное состояние может сильно отличаться от термодинамически
равновесного. В интересной области сопоставимых скоростей релаксации и
взаимодействия с окружением возможно возникновение устойчивых нестационарных
режимов, например автоколебаний.
Молекулы характеризуются колебательной (V), поступательной (Т) и
вращательной (R)
степенями свободы, между которыми могут происходить релаксационные процессы
обмена энергией. Скорости соответствующих релаксаций сильно зависят от вида
процесса. Обычно выделяют колебательно-колебательную (V-V),
колебательно-поступательную (V-T) и колебательно-вращательную (V-R) релаксации.
Если система находится в каком-либо возбужденном электронном
состоянии, то появляются новые каналы релаксации. Так, электронная энергия
может переходить в энергию колебательного движения основного электронного
терма, она может теряться за счет спонтанного испускания фотонов (радиационный
распад возбужденного состояния). Возможен также столкновительный перенос
энергии электронного возбуждения от одной молекулы к другой (е-е-релаксация). В
ходе е-е-релаксации может происходить также и изменение
колебательно-вращательного состояния молекулы.
Скорость е-е-релаксации существенно зависит от типа молекулы.
Выделяют четыре группы молекул: двухатомные, малоатомные, небольшие
многоатомные и большие молекулы. В двух - и малоатомных молекулах
е-е-релаксация протекает быстро. В случае больших молекул е-е-релаксация сильно
замедлена. Дело в том, что высокая плотность колебательно-вращательных уровней,
характерная для таких молекул, приводит к образованию емкого резервуара, легко
поглощающего значительную часть энергии столкновения.
Перекачка энергии между различными группами уровней может
носить, как периодический характер, так и гораздо более сложный стохастический
характер. При этом молекула, сохраняющая энергию возбуждения, отличается от
невозбужденных молекул. Но это отличие проявляется в каждый данный момент
времени по различному в зависимости от того, как распределено возбуждение по
степеням свободы молекулы.
В действительности молекула всегда взаимодействует со своим
окружением (полем излучения, другими молекулами), и поэтому ее энергия не
сохраняется. В процессе столкновений молекула может, как терять, так и
приобретать энергию. Следовательно, ее состояние может отличаться от состояния
"среднестатистической" молекулы ансамбля. Характерные времена
релаксации индивидуальной и "среднестатистической" молекул
различаются.
Причиной нагрева ансамбля молекул при поглощении излучения
является релаксация внутренней энергии молекул в поступательные степени свободы
(е-Т, V-T, R-T). Для
"среднестатистической" молекулы время прямой е-Т-релаксации обычно
превышает время V-T-релаксации,
которая, в свою очередь, много медленнее R-T-релаксации.
Более вероятными процессами оказываются переход энергии
электронного возбуждения на другие внутренние степени свободы молекулы,
например колебательные, и ее последующая релаксация в энергию поступательного
движения.
Для учета влияния релаксационных процессов на химическую
кинетику следует решить кинетическое уравнение для сложной многокомпонентной
смеси, состоящей из молекул участвующих в реакции вещества в основном и
различных возбужденных состояниях. Для этого необходимо знать сечение упругих и
неупругих столкновений. Как правило, такая задача неразрешима [3].
Первичный акт поглощения ИК-излучения сопровождается
селективным возбуждением определенного колебания в молекуле. В дальнейшем
энергия колебательного возбуждения претерпевает различные превращения в
результате релаксационных процессов. В сложных многоатомных молекулах при
высоких уровнях возбуждения наиболее быстро протекает внутримолекулярный размен
колебательной энергии, в результате чего энергия перераспределяется
статистически по всем колебательным степеням свободы. На этом этапе
утрачивается селективность возбуждения отдельной связи или группы связей. В
дальнейшем в результате столкновений происходит обмен колебательной энергии с
невозбужденными молекулами. Поскольку процесс колебательно-колебательной
релаксации происходит быстрее, чем передача колебательной энергии на
поступательные степени свободы, в системе устанавливается единая колебательная
температура, превышающая поступательную температуру в системе. На этой стадии
уже утрачивается и селективность возбуждения отдельной молекулы. Последний этап
релаксации сводится к установлению равновесия по всем степеням свободы, т.е.
приводит к равновесному тепловому разогреву системы.
1.2
Фотоперенос электрона
Первичные химические реакции возбужденных молекул
подразделяют обычно на перенос электрона, диссоциацию и т.д. Для возбужденных
молекул возможны, по крайней мере, три типа механизма: адиабатическое превращение
для потенциальной поверхности возбужденного состояния, диабатический переход на
потенциальную поверхность основного состояния продуктов реакции и, наконец, так
называемые реакции из "горячего" (нетермализованного, сильно
колебательно - возбужденного) основного электронного состояния, образующего в
результате конверсии из возбужденных электронных состояний.
Характер химических реакций возбужденных молекул определяется
формой потенциальной поверхности соответствующего возбужденного состояния,
наличием на ней энергетических барьеров или "воронок", ведущих к
переходу в ниже лежащие электронные состояния. При возбуждении молекул их
потенциал ионизации уменьшается, а сродство к электрону возрастает на энергию
возбуждения. Поэтому возбужденные молекулы оказываются одновременно и сильными
донорами, и сильными акцепторами электрона, и направления переноса электрона
определяется главным образом свойствами реагента. Для протекания переноса
электрона необходимо, чтобы энергия возбуждения превышала разность редокс-потенциала
донора и акцептора электрона.
При возбуждении наиболее сильно изменяются электронодонорные
и акцепторные свойства молекул. Потенциал ионизации уменьшается на значение
энергии возбуждения, а сродство к электрону возрастает на ту же величину. Обменные
взаимодействия между молекулами проявляются на расстояниях до 1 нм, существенно
превышающих их кинетические радиусы. По всем этим причинам химическое
взаимодействие начинается с электронного. Процессы фотопереноса электрона
являются ключевыми стадиями многих фотохимических реакций. Характер первичных
продуктов переноса электрона зависит от конкретных свойств реагирующих молекул
и полярности среды.
1) прямая фотоионизация молекулы с образованием свободного или
сольватированного электрона и последующим захватом его другими молекулами
среды; б) реакция возбужденной молекулы D*, образовавшейся в результате поглощения фотона, с акцептором (А)
электрона; в) перенос электрона непосредственно в акте поглощения фотона при
возбуждении светом с 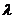 полосы переноса заряда комплексов донорно-акцепторного типа.
полосы переноса заряда комплексов донорно-акцепторного типа.
В первом случае необходима энергия фотона, превышающая потенциал
ионизации 1е молекулы. Потенциалы ионизации большинства
молекул значительно превышают энергии возбуждения нижних синглетных и
триплетных состояний, поэтому с энергетической точки зрения прямая
фотоионизация является невыгодной и требует коротковолнового света.
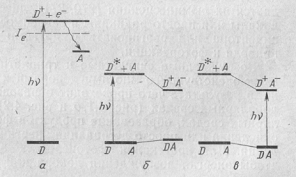
Рисунок 1.1 Схема процессов фотопереноса
электрона путем прямой фотоионизации (а), переноса электрона в возбужденном
состоянии (б) и фотовозбуждения комплекса с переносом заряда (в).
Поглощение фотона с 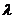 полосы переноса заряда комплексов, образованных в основном
состоянии молекулами донора и акцептора электрона (эта полоса не обязательно
является самой длинноволновой), непосредственно приводит к переносу электрона
от одного компонента комплекса к другому (рис.1.1, в). По существу этот тип
переноса электрона представляет собой возбуждение составной молекулы DA, связь в которой осуществляется за счет
слабого переноса заряда (обычно менее 0,1-0,2 заряда электрона) в состояние с
переносом заряда
полосы переноса заряда комплексов, образованных в основном
состоянии молекулами донора и акцептора электрона (эта полоса не обязательно
является самой длинноволновой), непосредственно приводит к переносу электрона
от одного компонента комплекса к другому (рис.1.1, в). По существу этот тип
переноса электрона представляет собой возбуждение составной молекулы DA, связь в которой осуществляется за счет
слабого переноса заряда (обычно менее 0,1-0,2 заряда электрона) в состояние с
переносом заряда 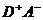 (где степень переноса заряда составляет
0,8-0,9). Если основное состояние комплекса является высокополярным, то при
возбуждении происходит обратный перенос электрона и получается малополярное
возбужденное состояние. Необходимая для возбуждения в полосе переноса заряда
энергия фотона зависит от потенциала ионизации донора, сродства к электрону
акцептора, зарядов молекул донора и акцептора и полярности растворителя [2].
(где степень переноса заряда составляет
0,8-0,9). Если основное состояние комплекса является высокополярным, то при
возбуждении происходит обратный перенос электрона и получается малополярное
возбужденное состояние. Необходимая для возбуждения в полосе переноса заряда
энергия фотона зависит от потенциала ионизации донора, сродства к электрону
акцептора, зарядов молекул донора и акцептора и полярности растворителя [2].
Для различных пар доноров и акцепторов выполняются следующие
соотношения (в электронвольтах):
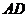
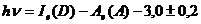 (1.3)
(1.3)
Энергия, необходимая для фотопереноса электрона в комплексе
из нейтральных молекул, на несколько электронвольт ниже потенциала ионизации
донора электрона. Для заряженных частиц при переходе в конденсированную фазу
энергии ионизации и присоединения электрона изменяются на энергию сольватации
иона, что составляет несколько электронвольт. Поэтому фактически энергия
переноса электрона в комплексе и этих случаях меньше энергии фотоионизации
донора. Образующиеся возбужденные состояния комплекса с переносом заряда могут
быть стабильными, диссоциировать на ионы радикала или просто радикала в
зависимости от заряда донора и акцептора или реагировать с другими компонентами
среды, приводя к фотореакции.
Возбужденные синглетные и триплетные состояния молекул
взаимодействуют со многими донорами и акцепторами электрона, в результате чего
происходит образование эксиплексов в малополярных средах, ион-радикалов в
полярных средах, образование продуктов фотовосстановления или окисления или
просто деградация энергии электронного возбуждения. В жидких растворах реакции
фотопереноса электрона представляют собой последовательность диффузионной
стадии и собственно переноса электрона [2]:
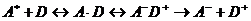 (1.4)
(1.4)
В результате изоэнергетического переноса электрона в комплексе
столкновения  образуется ион-радикальная пара
образуется ион-радикальная пара 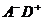 в неравновесной конфигурации ядер и
сольватного окружения. Колебательная релаксация и релаксация сольватного
окружения приводят в зависимости от условий к образованию эксиплекса,
ион-радикалов или других продуктов.
в неравновесной конфигурации ядер и
сольватного окружения. Колебательная релаксация и релаксация сольватного
окружения приводят в зависимости от условий к образованию эксиплекса,
ион-радикалов или других продуктов.
Элементарный акт переноса электрона между молекулами может быть
представлен как изоэнергетический подбарьерный (туннельный) переход электрона
от донора к акцептору. В качестве координаты реакции при этом используют не
положение электрона, а ядерные координаты взаимодействующих молекул и
сольватного положения. Скорость переноса электрона определяется как энергией
активации, так и вероятностью туннелирования электрона.
1.3
Сольватированный и квазисвободный электроны
В полярных жидкостях генерированный излучением избыточный
(освобожденный из молекул) электрон переходит в локализованное состояние,
образуя сольватированный электрон. Сольватированный электрон рассматривается
как самостоятельная химическая частица, представляющая собой электрон в
сферической плоскости, окруженной молекулами растворителя. Электрон делокализован
между всеми ближайшими молекулами растворителя.
Образование сольватированного электрона, как обычно полагают,
происходит по следующей схеме. Вследствие тепловых флуктуаций два диполя
растворителя поворачиваются друг к другу своими положительными полюсами. Между
ними возникает потенциальная яма, глубина которой определяется величиной
диполей и углом их поворота друг к другу. При достаточно близком прохождении
избыточный электрон попадает в эту яму, создавая в ней поле отрицательного
заряда; молекулы растворителя постепенно ориентируются своими диполями, занимая
оптимальное положение, соответствующее минимуму потенциальной энергии.
Образование сольватированного электрона может происходить, если выполняется
условие [2]:
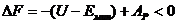 , (1.5)
, (1.5)
где 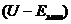 - энергия связи электрона в потенциальной
яме с глубиной
- энергия связи электрона в потенциальной
яме с глубиной 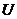 ;
; 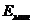 - энергия основного состояния сольватированного электрона,
отсчитываемая от дна потенциальной ямы;
- энергия основного состояния сольватированного электрона,
отсчитываемая от дна потенциальной ямы; 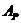 - работа по реорганизации среды (переориентация диполей,
установление оптимального расстояния между ними).
- работа по реорганизации среды (переориентация диполей,
установление оптимального расстояния между ними).
Поскольку концентрация ловушек избыточного электрона -
флуктуационно созданных ориентаций диполей растворителя, способных захватить
избыточный электрон - в жидкости достаточно велика, а скорость движения
квазисвободных электронов очень велика, процесс сольватации происходит весьма
быстро - за времена порядка пикосекунд. Процесс сольватации протекает за
времена, когда реорганизация среды еще не произошла, и среду характеризует
высокочастотная диэлектрическая проницаемость.
Состояние квазисвободного электрона в жидкости определяется
свойствами последней, главным образом, значением энергии перехода электрона из
вакуума в жидкость без перестройки структуры жидкости. Жидкости подразделяются
на те, в которых электрон будет сольватироваться, и на те, в которых будет
существовать только квазисвободный электрон.
Свойства сольватированного электрона характеризуется подвижностью
избыточного электрона в электрическом поле, что указывает на степень
связанности электрона со средой. В различных веществах значения подвижности
различаются на шесть - семь порядков.
Это различие легко связать с представлением о равновесии между
свободным и локализованным (сольватированным) состоянием электрона. При таком
предположении подвижность избыточного электрона  будет равна сумме подвижностей его квазисвободного
будет равна сумме подвижностей его квазисвободного  и локализованного
и локализованного 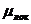 состояний [2]
состояний [2]
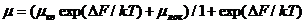 , (1.6)
, (1.6)
где  - изменение энергии Гемгольца.
- изменение энергии Гемгольца.
Сольватированный электрон - весьма реакционноспособная частица.
Значения его константы скорости являются предельными для
диффузионно-контролируемых реакций для многих систем.
Сольватированный электрон может принимать участие в реакциях
присоединения. Сольватированный электрон ведет себя почти как
"нормальная" химическая частица - его константа скорости уменьшается
при повышении вязкости, хотя и не так сильно, как следовало бы ожидать.
В неполярных соединениях не только подвижность определяет
константы скорости реакций избыточного электрона, но и другие факторы.
В то же время значение константы указывает на то, что в реакции
участвует только квазисвободный электрон.
2. Реакции
фотодиссоциации и фотозамещения
2.1
Гомолитические реакции
В конденсированной фазе первичные продукты диссоциации
оказываются окружены клеткой растворителя, которая препятствует их разделению и
способствует рекомбинации в основное состояние исходной молекулы. Сам процесс
диссоциации возбужденной молекулы может происходить, особенно в случае
образования заряженных частиц, в результате взаимодействия с растворителем.
Вследствие этого квантовый выход прямой фотодиссоциации в конденсированной фазе
может быть значительно меньше единицы.
Предиссоциацию можно представить как внутримолекулярный
перенос энергии электронного возбуждения, приводящий к образованию
диссоциативного возбужденного электронного состояния. Предиссоциации
проявляются в спектрах поглощения простых молекул в виде исчезновения
колебательной структуры в некоторой области длин волн. В спектрах возбуждения
флуоресценции в этой области резко падает квантовый выход.
Реакции фотодиссоциации в зависимости от характера разрыва
связи классифицируются на гомолитические и гетеролитические. Первичными
продуктами фотодиссоциации могут быть радикалы, ион-радикалы, ионы, молекулы.
При взаимодействии первичных продуктов фотодиссоциации с присутствующими в
системе реагентами образуются продукты замещения.
При поглощении фотона молекула может немедленно
диссоциировать либо сначала образовать относительно стабильное возбужденное
состояние, из которого может наблюдаться люминесценция. Природу возбужденного
состояния для простых молекул можно определить из анализа структуры спектров
поглощения и испускания.
Прямая фотодиссоциация происходит в тех случаях, когда
возбужденное состояние (синглетное или триплетное) является диссоциативным.
Такой процесс является адиабатическим и может приводить к образованию одного из
продуктов в возбужденном состоянии.
Реакции фотозамещения являются сложными, по крайней мере,
двухстадийными процессами и протекают путем фотодиссоциации субстрата и
последующего присоединения реагента или отрыва от него атома либо путем
присоединения реагента к возбужденной молекуле и последующего отщепления
замещаемой группы [2].
2.2
Гетеролитические системы
В жидких растворах в зависимости от сольватирующей способности
растворителя фотоперенос протона приводит к образованию свободных ионов или
ионных пар либо останавливается на стадии образования комплекса с водородной
связью. В протонных растворителях обычно образуются сольватированные ионы. В
жидких растворах реакцию переноса протона между молекулами кислоты 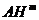 и основания
и основания 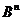 можно разделить на стадии образования и
распада комплексов с водородной связью и кинетическую стадию собственно
переноса протона [2]:
можно разделить на стадии образования и
распада комплексов с водородной связью и кинетическую стадию собственно
переноса протона [2]:
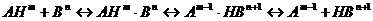 (2.1)
(2.1)
Если в качестве одного из реагентов выступает растворитель, то
первая стадия этой схемы отсутствует, поскольку все молекулы субстрата уже в
основном состоянии связаны водородными связями с растворителем. Суммарная
(эффективная) константа скорости взаимодействия 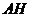 и
и 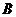 выражается через константы скорости
диффузии реагентов
выражается через константы скорости
диффузии реагентов 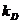 и продуктов
и продуктов и прямого и обратного переноса протона
и прямого и обратного переноса протона  и
и 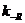 в комплексе следующим образом:
в комплексе следующим образом:
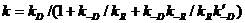 . (2.2)
. (2.2)
Константы скорости диффузии (образования 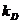 и распада
и распада 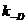 комплексов с водородной связью) частиц с зарядами
комплексов с водородной связью) частиц с зарядами 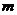 и
и 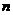 равны
равны
 (2.3)
(2.3)
где  - расстояние между реагентами в
реактивном комплексе;
- расстояние между реагентами в
реактивном комплексе; 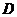 - сумма коэффициентов диффузии реагентов;
- сумма коэффициентов диффузии реагентов;
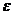 - диэлектрическая проницаемость
растворителя;
- диэлектрическая проницаемость
растворителя; 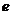 - заряд электронов;
- заряд электронов; 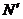 - число молекул в миллемоле.
- число молекул в миллемоле.
При 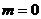 и (или)
и (или) 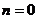 эти уравнения приобретают вид
эти уравнения приобретают вид
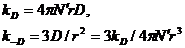 (2.4)
(2.4)
Анализ экспериментальных данных для водных растворов показал, что
для большинства реакций фотопереноса протона независимо от зарядов реагентов
характерна единая зависимость констант скорости от энергии Гиббса стадии
переноса протона.
Таким образом, перенос протона по водородной связи лимитируется не
движением самого протона, а релаксационными процессами в сольватной оболочке
растворителя, связанными с перемещением заряда в процессе реакции.
2.3 Обратные
связи в лазерной термохимии
Будучи представлена сама себе, химически активная среда с течением
времени переходит в стационарное состояние, отвечающее термодинамическому
равновесию. Это состояние единственно, устойчиво и характеризуется равенством
скоростей прямых и обратных реакций. Под действием внешнего по отношению к ней
излучения система становится макроскопически неравновесной. Вместе с тем распределение
энергии по всем внутренним степеням свободы молекул среды может оставаться
близким к максвелл-больцмановскому с некоторой единой эффективной температурой T=T (x, y, z, t). Такое
макроскопическое описание подразумевает, что характерные скорости изменения
температуры малы по сравнению со скоростями элементарных реакционных процессов
(V-V,V-T), а
пространственные масштабы изменения температуры малы по сравнению с
характерными микроскопическими длинами (размерами атомов, молекул, расстояниями
между ними и т.п.). По существу, что означает, что действие излучения сводится
к макроскопически равновесному вводу лазерной энергии в систему. При выполнении
указанных условий поведение химически активной среды полностью определяется
полем температуры T (x, y, z, t) и пространственным распределением
концентрации реагентов 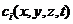 . В свою очередь величины Т и
. В свою очередь величины Т и 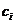 находятся из уравнений теплопроводности и
химической кинетики. У этой на первый взгляд простой системы возможен далеко не
тривиальный отклик на воздействие лазерного излучения даже постоянной мощности.
находятся из уравнений теплопроводности и
химической кинетики. У этой на первый взгляд простой системы возможен далеко не
тривиальный отклик на воздействие лазерного излучения даже постоянной мощности.
Если на систему действует лазерное излучение, то [3]
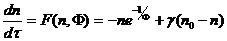 , (2.5)
, (2.5)
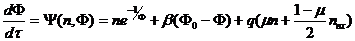 , (2.6)
, (2.6)
Здесь 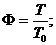
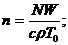
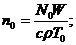
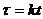 ;
; 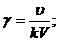
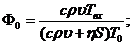
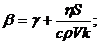

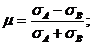
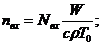
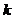 и
и 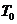 - константы реакции;
- константы реакции; 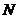 - плотность исходного вещества;
- плотность исходного вещества; 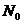 - его плотность в потоке, поступающем в
реактор;
- его плотность в потоке, поступающем в
реактор;  - объемная скорость поступления вещества;
- объемная скорость поступления вещества;
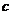 и
и  - удельная теплоемкость вещества и его массовая плотность;
- удельная теплоемкость вещества и его массовая плотность; 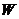 - теплота химической реакции в расчете на
одну реагирующую частицу;
- теплота химической реакции в расчете на
одну реагирующую частицу; 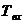 - температура поступающего вещества;
- температура поступающего вещества; 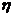 - константа теплообмена со стенками,
имеющими площадь S и температуру
- константа теплообмена со стенками,
имеющими площадь S и температуру 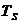 ;
; 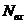 - полная плотность смеси; h - толщина реактора в направлении распространения излучения;
- полная плотность смеси; h - толщина реактора в направлении распространения излучения; 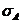 и
и 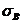 - сечения поглощения веществами А и В соответственно.
- сечения поглощения веществами А и В соответственно.
Из вида полученных уравнений легко понять, что изменение параметра
селективности μ
качественно меняет структуру их решений. Физически это означает, что изменение
только длины волны излучения при одинаковых начальных условиях, одной и той же
мощности может качественно менять динамику системы.
В случае μ=1
(рисунок 2.1) поглощение осуществляется исходным веществом, и система выходит на
стационарное состояние, отвечающее малой наработке продукта реакции [3]. При μ=0 реализуется стационарное состояние с
большим выходом продукта. В случае μ=-1, когда поглощение осуществляется продуктом
реакции, система выходит на режим незатухающих колебаний.
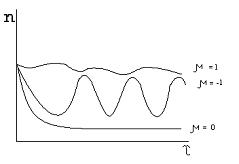
Рисунок 2.1 Зависимость выхода продукта от времени при различных
значениях параметра селективности.
Если одновременно изменять лазерные параметры - мощность излучения
q и селективность воздействия μ, то можно реализовать достаточно широкий
набор стационарных и колебательных режимов, между которыми возможны
разнообразные переключения - переключения между устойчивыми стационарным
состоянием и автоколебательным режимом и т.д.
Рассмотрим закрытый по массообмену реактор, в котором протекает
обратимая химическая реакция
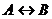 .
.
Ее уравнение кинетики имеет вид
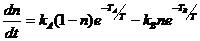 . (2.7)
. (2.7)
А уравнение теплового баланса имеет вид
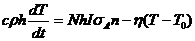 , (2.8)
, (2.8)
где 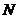 - плотность смеси молекул
- плотность смеси молекул 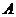 и
и 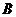 ;
; 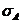 - сечение резонансного поглощения
излучения веществом
- сечение резонансного поглощения
излучения веществом 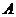 ;
; 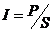 - интенсивность излучения;
- интенсивность излучения; 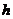 - линейный размер реактора по направлению распространения
излучения;
- линейный размер реактора по направлению распространения
излучения; 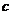 и
и  - удельная теплоемкость вещества и его массовая плотность;
- удельная теплоемкость вещества и его массовая плотность; 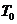 - температура стенок;
- температура стенок; 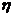 - константа теплообмена.
- константа теплообмена.
Система (2.7) и (2.8) представляет собой идеализированную схему,
демонстрирующую лишь принципиальную возможность термохимической бистабильности
при обратимой реакции. Здесь надо принять во внимание, что в действительности
хорошо разделяются два диапазона длин волн, в каждом из которых модель (2.7),
(2.8) требует своих принципиальных видоизменений. Это - видимый и УФ-диапазоны,
где 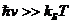 , и ИК-диапазон, где
, и ИК-диапазон, где 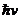 ~
~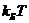 .
.
В видимой и УФ-областях спектра, как правило, существенную роль
играют фотохимические процессы с участием фотовозбужденных молекул (обычно это
возбужденные электронные состояния). При этом характерные времена
фотохимических процессов сопоставимы с характерным временем столкновительных
процессов. Поэтому полное описание кинетики реакций под действием видимого и
УФ-излучений требует включение в модель типа (2.7), (2.8) дополнительных
уравнений, описывающих фотохимические каналы. Следует также учитывать, что в
силу условия 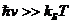 сечения резонансного поглощения излучения
в этих областях спектра практически не зависят от температуры существенных
степеней свободы системы.
сечения резонансного поглощения излучения
в этих областях спектра практически не зависят от температуры существенных
степеней свободы системы.
Качественно другой является ситуация в ИК-диапазоне. В силу
условия 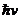 ~
~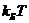 фотохимические каналы реакции мало вероятны (кроме реакций
свободных радикалов). Дело в том, что стабильные молекулы имеют энергии
активации или диссоциации
фотохимические каналы реакции мало вероятны (кроме реакций
свободных радикалов). Дело в том, что стабильные молекулы имеют энергии
активации или диссоциации 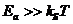 . Поэтому при умеренной интенсивности
излучения такие каналы маловероятны. Только высокие интенсивности, приводящие к
существенно многофотонным процессам возбуждения, могут создавать
микроскопическую неравновесность, при которой существенны фотохимические
ИК-каналы реакции.
. Поэтому при умеренной интенсивности
излучения такие каналы маловероятны. Только высокие интенсивности, приводящие к
существенно многофотонным процессам возбуждения, могут создавать
микроскопическую неравновесность, при которой существенны фотохимические
ИК-каналы реакции.
Рассмотрим случай, когда интенсивность является умеренной, когда
среда остается микроскопически равновесной, и изменение концентрации
компонентов описывается обычным уравнением макроскопической кинетики типа
(2.7).
Однако принципиальной при этом оказывается зависимость сечения
поглощения от длины волны излучения и температуры среды, качественно меняющая
уравнение теплового баланса.
При изменении температуры распределение частиц по энергетическим
уровням меняется в соответствии с больцмановским законом [3]:
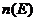 ~
~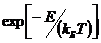 ,
, 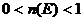 .
.
Сечение поглощения излучения при разрешенном правилами отбора
переходе между двумя уровнями энергии 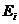 и
и 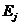 определяется соотношением
определяется соотношением
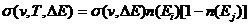 . (2.9)
. (2.9)
При 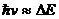 ~
~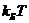 сечение
сечение 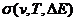 сильно зависит от температуры. При
сильно зависит от температуры. При 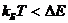 сечение перехода зависит от температуры
аррениусовским образом [3]:
сечение перехода зависит от температуры
аррениусовским образом [3]:
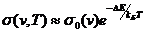 . (2.10)
. (2.10)
При электронных переходах, как правило, 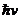 ~
~ ~1эВ, что существенно превышает тепловую энергию
~1эВ, что существенно превышает тепловую энергию 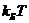 .
.
Последнее соотношение иллюстрирует существование температурной
зависимости сечения резонансного поглощения в ИК-диапазоне. В действительности
это выражение является упрощенным, так как в нем не учтен ряд существенных
факторов, таких как температурная зависимость ширины линии, наличие
доплеровского сдвига, многомодовость колебательного спектра молекул и т.д.
В ИК-области уравнение теплового баланса должно учитывать зависимость
лазерного энерговклада от длины волны и температуры. Такая двухпараметрическая
зависимость сечений поглощения приводит к качественным отличиям в динамике
системы по сравнению с моделью (2.7), (2.8), в которой сечение 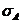 считалось не зависящим от температуры.
Реальные химические процессы в большинстве случаев многокомпонентны,
многоканальны и многостадийны. Поскольку динамика таких процессов может быть
еще более сложной вплоть до перехода в статистические режимы изменения
концентрации компонентов и температуры среды. В отсутствие излучения динамика
этих реакций может быть тривиальной. Включение излучения может кардинально
менять их динамику. Без детального изучения кинетики реакций предсказать
возможные режимы их протекания в присутствии лазерного излучения может
оказаться затруднительным. С другой стороны, изучение динамических режимов при
различных условиях лазерного нагрева может дать информацию о кинетике
элементарных актов реакции.
считалось не зависящим от температуры.
Реальные химические процессы в большинстве случаев многокомпонентны,
многоканальны и многостадийны. Поскольку динамика таких процессов может быть
еще более сложной вплоть до перехода в статистические режимы изменения
концентрации компонентов и температуры среды. В отсутствие излучения динамика
этих реакций может быть тривиальной. Включение излучения может кардинально
менять их динамику. Без детального изучения кинетики реакций предсказать
возможные режимы их протекания в присутствии лазерного излучения может
оказаться затруднительным. С другой стороны, изучение динамических режимов при
различных условиях лазерного нагрева может дать информацию о кинетике
элементарных актов реакции.
Скорость окислительно-восстановительной реакции обычно
лимитируется переносом реагентов через слой вещества. Существенным является то
обстоятельство, что в процессе переноса участвуют заряженные частицы (ионы
металла, электроны и т.д.). Перенос заряженных частиц, прежде всего электронов,
приводит к разделению зарядов и, тем самым, к возникновению сильных
электрических полей. Для теоретического описания такого процесса следует решать
самосогласованную задачу, включающую в себя уравнения переноса разного рода заряженных
частиц в неоднородном поле и уравнение Пуассона для потенциала поля.
Эффективность ввода лазерной энергии в вещество определяется
поглощательной способностью, которая в свою очередь зависит от параметров
излучения (длины волны, поляризации, угла падения), а также от толщины окисного
слоя. В ИК-области, как правило, поглощательная способность металлов мала.
Так как поглощательная способность зависит от толщины окисного
слоя, то очевидно установление обратной связи между темпом нагрева темпом протекания
реакции. Этот канал обратной связи имеет место только при нагреве лазерным
излучением (оптическая обратная связь). Оптическая обратная связь может быть
как положительной (на участке, где поглощательная способность возрастает), так
и отрицательной. Положительная обратная связь приводит к возникновению так
называемой термической неустойчивости - лавинообразный рост температуры. Этот
рост температуры фактически наблюдается после того, как толщина окисного слоя
возрастает на столько, что изменение поглощения начинает существенно менять
тепловой баланс. Это означает, что термодинамическая неустойчивость не сразу
после начала облучения развивается, а лишь по истечении некоторого характерного
времени, называемого временем активации
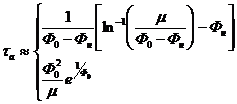 . (2.11)
. (2.11)
Первый (при  ) из предельных случаев соответствует так
называемой быстрой активации и реализуется при достаточно высоких мощностях
лазерного излучения. Второй случай (при
) из предельных случаев соответствует так
называемой быстрой активации и реализуется при достаточно высоких мощностях
лазерного излучения. Второй случай (при 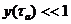 ) отвечает так называемой медленной активации, когда значение
температуры на активационном участке близко к стационарному значению
) отвечает так называемой медленной активации, когда значение
температуры на активационном участке близко к стационарному значению 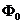 .
.
Даже без участия фотохимических процессов динамика нагрева и итог
химической реакции оказываются сильно зависящими от длины волны излучения.
3. Процессы
радиационной химии
3.1 Три
стадии радиационно-химического процесса
Весь радиолиз от начального момента
воздействия ионизирующего излучения на вещество до окончания процесса
образования стабильных продуктов принято делить на три последовательные стадии.
1.
Первая
стадия радиолиза - взаимодействие ионизирующего излучения с веществом и
образование промежуточных продуктов первого поколения. Ее обычно называют
физической стадией радиолиза.
2.
Вторая
стадия - процессы, протекающие за время существования трека. Эту стадию обычно
называют физико-химической, или негомогенной.
3. Третья стадия - процессы, протекающие в
объеме системы после "размывания" трековых структур в результате
диффузии. Ее принято называть химической, или гомогенной.
В жидкости проявляются гомогенная и негомогенная стадии.
Считается, что негомогенная стадия завершается за 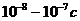 в жидкостях вязкостью порядка одного
мПа·с. С увеличением вязкости уменьшается коэффициент диффузии и возрастает
время размывания трековых структур.
в жидкостях вязкостью порядка одного
мПа·с. С увеличением вязкости уменьшается коэффициент диффузии и возрастает
время размывания трековых структур.
Время окончания гомогенной стадии, которая в основном определяется
реакциями рекомбинации радикалов, может достаточно широко варьироваться, так
как скорость рекомбинации зависит от общей концентрации радикалов,
следовательно, от мощности дозы.
Поскольку скорость ионизирующих частиц всегда велика (по
определению понятия ионизации она выше скорости электрона на орбитали атома -
значения для валентных электронов порядка 108 см/с), а поперечные
размеры молекул малы - порядка долей нанометра, то и время взаимодействия ничтожно,
существенно меньше времени внутримолекулярных колебаний. Согласно принципу
Франка - Кондона в течение этой стадии невозможны никакие химические процессы,
поскольку химические процессы связаны с перестройкой молекул на атомном уровне,
и могут протекать только процессы с перестройкой электронной подсистемы атомов
и молекул, т.е. только физические процессы.
Процессы перестройки электронной подсистемы молекул - это процессы
электронного возбуждения и ионизации [2]. Эти два процесса приводят к появлению
следующих типов активных химических частиц для вещества М: ионов М+,
в конденсированной фазе - дырка h+, возбужденных ионов 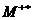 , двухкратно заряженных ионов М2+
(вероятность двухкратной ионизации возрастает с увеличением числа атомов в
молекуле), электронов с некоторой кинетической энергией, синглетных и
триплетных возбужденных состояний М* (могут возникать и высшие триплетные и
синглетные состояния), сверхвозбужденных состояний
, двухкратно заряженных ионов М2+
(вероятность двухкратной ионизации возрастает с увеличением числа атомов в
молекуле), электронов с некоторой кинетической энергией, синглетных и
триплетных возбужденных состояний М* (могут возникать и высшие триплетные и
синглетные состояния), сверхвозбужденных состояний 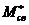 , обладающих энергией, превышающей первый
потенциал ионизации молекул среды, в конденсированной фазе могут также
возникать плазмоны как коллективное сверхвозбужденное состояние. Протекающие на
физической стадии радиолиза процессы можно выразить следующим уравнением:
, обладающих энергией, превышающей первый
потенциал ионизации молекул среды, в конденсированной фазе могут также
возникать плазмоны как коллективное сверхвозбужденное состояние. Протекающие на
физической стадии радиолиза процессы можно выразить следующим уравнением:
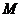 ~→
~→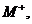
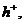
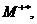
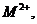
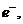
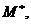
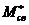 . (3.1)
. (3.1)
Общее количество возникших частиц и соотношение между ними зависит
от химического состава системы, его агрегатного состояния, вида и энергии
ионизирующего излучения.
Первый процесс, который следует обсудить, - поведение
освобожденного электрона и дырки. Электрон имеет в начальный момент некоторую
кинетическую энергию и термализуется, уходя на некоторое расстояние от
"своей" дырки. Дырка также обладает высокой подвижностью, хотя и
несколько меньшей, чем у электрона, так что и дырка и электрон движутся
совместно, образуя связанную пару зарядов. Из-за разности подвижности
расстояние между дыркой и электроном возрастает во времени до того момента,
когда электрон термализуется. При этом основная часть электронов остается в
пределах радиуса Онзагера и, если не произойдет каких-то дополнительных
событий, то эти электроны должны возвратиться к "своей" дырке и
нейтрализовать ее. Так и происходит в неполярных системах. В полярных системах
возможна сольватация электрона в ловушках системы (дефектах структуры).
Коэффициент диффузии сольватированного электрона на много порядков ниже, чем у
квазисвободного, так что его скорость движения резко снижается. Одновременно
снижается и скорость движения дырки, так что она превращается в катион-радикал 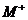 (возможно, что медленно движущаяся дырка
превращается в катион-радикал также на дефектах структуры жидкой системы).
Нейтрализация зарядов - процесс очень быстрый, поскольку в них участвуют
квазичастицы - дырка и квазисвободный электрон. Выход сольватированных
электронов ниже первичного выхода пар ионов, хотя время сольватации весьма
мало.
(возможно, что медленно движущаяся дырка
превращается в катион-радикал также на дефектах структуры жидкой системы).
Нейтрализация зарядов - процесс очень быстрый, поскольку в них участвуют
квазичастицы - дырка и квазисвободный электрон. Выход сольватированных
электронов ниже первичного выхода пар ионов, хотя время сольватации весьма
мало.
К моменту, когда диффузия частиц с массой, близкой к массе
исходной молекулы, становится заметной (порядка сотни пикосекунд), в облученной
системе, кроме реакций сольватации электрона и трансформации дырки в
катион-радикал, происходят и реакции распада и изомеризации катион-радикалов.
Если таковые возможны, распад сверхвозбужденных состояний, ионно-молекулярные
реакции катион-радикалов, которые приводят к возникновению радикалов и
стабильных ионов. О превращениях первичных возбужденных состояний известно, что
высшие синглетные и триплетные состояния переходят в низшие. При нейтрализации
зарядов также образуются низшие синглетные и триплетные возбужденные состояния.
В случае неполярных соединений время жизни зарядов намного больше. Таким
образом, к моменту времени в несколько пикосекунд мы имеем состав промежуточных
частиц: 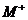 ,
, 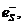
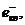

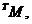
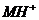 осколочные ионы, радикалы, стабильные конечные продукты.
осколочные ионы, радикалы, стабильные конечные продукты.
После преодоления пикосекундного временного барьера диффузия
становится заметной и наступает период бимолекулярных реакций в трековых структурах.
В основном в этот период происходят реакции радикалов и ион-радикалов между
собой в любой комбинации. Поскольку пространственное распределение
промежуточных частиц неодинаково в трековых формах различного типа, именно в
этот момент проявляется эффект вида излучения. Наиболее четко он проявляется в
том случае, если участвующие в реакциях рекомбинации радикалы обладают
существенно отличающимися свойствами, как это наблюдается для воды и метанола.
Если же соединение может реагировать с короткоживущими продуктами,
то соответствующая реакция заменяет промежуточную частицу предыдущую поколения
па частицу последующего поколения за время внутритрековых реакций. Образующиеся
при этом частицы имеют другие константы скорости и доля рекомбинировавших и
нейтрализовавшихся в треке промежуточных частиц меняется.
В каждой одиночной трековой форме не все радикалы могут
рекомбинировать и образовать конечные продукты рекомбинации и
диспропорционирования, часть из них избегает рекомбинации и выходит в объем
системы.
3.2 Радиолиз
воды и других неорганических жидкостей
Радиолиз воды изучен лучше, чем любого другого соединения.
Конечными продуктами радиолиза воды являются водород, пероксид водорода,
кислород. Пероксид водорода накапливается до относительно небольших концентраций
и затем разрушается до воды и кислорода, так что при больших дозах при
радиолизе воды накапливаются только водород и кислород в стехиометрическом
соотношении 2: 1 [2].
В первичном акте возникают молекулярные ионы 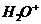 , электроны и возбужденные состояния.
Электроны после термализации либо гидратируются -
, электроны и возбужденные состояния.
Электроны после термализации либо гидратируются - 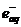 , либо нейтрализуют молекулярные ионы:
, либо нейтрализуют молекулярные ионы:
 (3.2)
(3.2)
Характер образующихся возбужденных состояний не установлен, но
судя по имеющимся экспериментальным данным, они участвуют в реакциях [6]:
 , (3.3)
, (3.3)
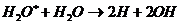 , (3.4)
, (3.4)
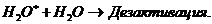 (3.5)
(3.5)
Выход продукта по реакции (3.2) равен 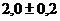 . Поскольку выход гидратировонных
электронов за пикосекундные времена известен -
. Поскольку выход гидратировонных
электронов за пикосекундные времена известен - 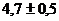 , то суммарный выход ионизации составляет
, то суммарный выход ионизации составляет 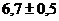 пар ионов на 100 эВ, что существенно выше
выхода ионизации в парах воды - 3,4. Это различие согласуется с изменением
первого потенциала ионизации при переходе в жидкую фазу.
пар ионов на 100 эВ, что существенно выше
выхода ионизации в парах воды - 3,4. Это различие согласуется с изменением
первого потенциала ионизации при переходе в жидкую фазу.
Возбужденные состояния воды, как первичные, так и возникшие по
реакции (3.2) по-видимому, имеют малое время жизни, и реакции (3.3) - (3.5)
заканчиваются за время порядка  . Таким образом еще до начала реакции рекомбинации возникает
конечный продукт радиолиза - молекулярный водород. К концу трековых реакций
. Таким образом еще до начала реакции рекомбинации возникает
конечный продукт радиолиза - молекулярный водород. К концу трековых реакций 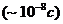 имеется следующий набор продуктов:
молекулярные -
имеется следующий набор продуктов:
молекулярные - 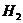 и
и 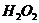 , радикальные -
, радикальные - 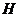 ,
, 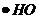 ,
, 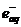 , ионные -
, ионные - 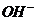 и
и 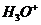 .
.
В результате в системе на гомогенной стадии радиолиза остаются
только три конечных продукта: 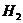 ,
, 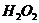 и
и 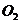 , выходы которых очень зависят от условий проведения радиолиза.
Если в облучаемой воде содержатся акцепторы гидратированного электрона, атомов H и радикалов
, выходы которых очень зависят от условий проведения радиолиза.
Если в облучаемой воде содержатся акцепторы гидратированного электрона, атомов H и радикалов 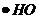 , то эти акцепторы, захватывая радикальные продукты радиолиза,
препятствуют их рекомбинации и разрушению ими молекулярных продуктов радиолиза.
Выход окислительно-восстановительных или иных превращений частиц акцептора
соответствует наблюдаемому выходу разрушения воды.
, то эти акцепторы, захватывая радикальные продукты радиолиза,
препятствуют их рекомбинации и разрушению ими молекулярных продуктов радиолиза.
Выход окислительно-восстановительных или иных превращений частиц акцептора
соответствует наблюдаемому выходу разрушения воды.
Выходы радикальных и молекулярных продуктов радиолиза являются
своеобразными константами - одинаковы для всех разбавленных водных растворов,
но зависит от pH раствора и от вида излучения.
Радиационно-химическое превращение различных веществ в
разбавленных водных растворов происходит в результате их реакций с радикальными
продуктами радиолиза и с пероксидом водорода.
При малых концентрациях, когда акцептор не вмешивается в трековые
реакции, для определения выходов тех или иных продуктов превращения
растворенных веществ удобно использовать выходы радикальных и молекулярных
продуктов радиолиза воды.
Превращение растворенного вещества за счет взаимодействия с
продуктами радиолиза любого растворителя получило название косвенного действия
излучения. В разбавленных растворах превращение растворенного вещества идет
только в результате косвенного действия излучения. В концентрированных
растворах, где электронная доля 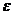 (электронная доля - отношение числа электронов, принадлежащих
данному компоненту системы, к числу электронов, принадлежащих всем компонентам
системы) растворенного вещества становится значимой, заметным становится и
прямое действие излучения на растворенное вещество. Появляются продукты его
ионизации и возбуждения, тогда как при косвенном действии излучения они не
образуются, поскольку превращение идет на радикальной стадии. Первичные
продукты из каждого компонента раствора или смеси веществ по механизму
прямого действия излучения распределяются пропорционально их электронным долям.
(электронная доля - отношение числа электронов, принадлежащих
данному компоненту системы, к числу электронов, принадлежащих всем компонентам
системы) растворенного вещества становится значимой, заметным становится и
прямое действие излучения на растворенное вещество. Появляются продукты его
ионизации и возбуждения, тогда как при косвенном действии излучения они не
образуются, поскольку превращение идет на радикальной стадии. Первичные
продукты из каждого компонента раствора или смеси веществ по механизму
прямого действия излучения распределяются пропорционально их электронным долям.
При радиолизе других неорганических жидкостей проявляются те же
закономерности, что и при радиолизе воды, можно выделить молекулярные и
радикальные продукты радиолиза, с их помощью описать превращения растворенных
веществ при облучении, выделить эффекты в треке и объеме системы [2].
3.3
Радиационно-химические превращения в гетерогенных системах
Наличие поверхности раздела между фазами или между компонентами
системы и скачкообразное изменение физико-химических свойств на границе раздела
существенно усложняет картину радиационно-химических процессов: приходится
рассматривать процессы в каждой фазе отдельно и взаимное влияние фаз в
процессах и свойствах. В системе твердое тело - адсорбированное вещество
выделяют пять зон: твердое тело (I); монослой (II), слой, размерами соответствующим средней длине
диффузии атома или иона с поверхности твердого тела (III); слой, размерами
соответствующий пробегу электронов Оже (IV) и зону влияния
электрического поля адсорбента (V). Для общности к ним следовало бы добавить зону, в которой
возможна миграция энергии из твердого тела и адсорбат. В твердом теле также
выделяют несколько зон, соответствующих передаче заряда, атомов и возбуждения
от адсорбированного вещества. Необходимо учитывать и изменение
физико-химических свойств в обоих компонентах при удалении от границы раздела
фаз (краевые эффекты). Таким образом, получается весьма сложная картина
процессов радиолиза в гетерогенных системах [2].
4. Условия
преобладания теплового или фотохимического механизма реакции под действием
ИК-излучения
4.1
Радиационная и тепловая заселенности колебательно-возбужденных состояний
Условия преобладания теплового или фотохимического механизма
реакции под действием непрерывного ИК-излучения можно получить, рассмотрев
радиационную и тепловую заселенность колебательно-возбужденнных состояний на
примере двухуровневой системы, описываемой следующей кинетической системой [4]:
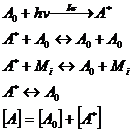 (4.1)
(4.1)
где 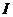 - поток возбуждающих квантов;
- поток возбуждающих квантов;  - сечение поглощения их молекулой А.
- сечение поглощения их молекулой А.
Константы скорости дезактивации возбужденных частиц 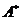 на невозбужденных молекулах
на невозбужденных молекулах  , на других частицах
, на других частицах 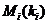 и на стенке
и на стенке 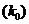 связаны с константами соответствующих
обратных процессов термической активации
связаны с константами соответствующих
обратных процессов термической активации 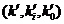
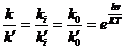 , (4.2)
, (4.2)
где 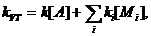
 .
.
Воспользуемся неравенством
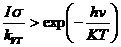 . (4.3)
. (4.3)
Левая часть этого неравенства представляет собой изменение
стационарной заселенности возбужденного уровня, вызываемого излучением в
условиях, далеких от насыщения, правая часть - равновесную заселенность. Это
упрощение показывает, что достигнуть существенно равновесного заселения
возбужденных состояний посредством излучения можно при любых давлениях
(суммарная константа V-T-релаксации 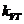 зависит от давления), используя достаточно большую мощность
лазера.
зависит от давления), используя достаточно большую мощность
лазера.
При рассмотрении не учитывалось, что облучение вещества неизбежно
сопровождается равновесным тепловым разогревом. Полагая, что при не слишком
высоких интенсивностях излучения разогрев лазерным лучом пропорционален
скорости поглощения им лазерного излучения
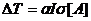 , (4.4)
, (4.4)
тогда 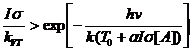 . (4.5)
. (4.5)
В этом неравенстве правая часть дает зависимость теплового вклада,
в котором учтен разогрев. На рисунке 4.1 в случае (1) тепловой вклад при любых
значениях интенсивности излучения преобладает над радиационным [4]. В этих
условиях химические реакции под действием непрерывного лазерного ИК-излучения
будут протекать в основном по тепловому механизму. В случае (3) имеется область
интенсивностей, где преобладает радиационный вклад в заселенность. Причем
существует оптимальное значение интенсивности, соответствующее максимальному
отношению радиационного и теплового вкладов. При этом фотохимический механизм
будет преобладать над тепловым. В ситуации (2), которую назовем критической,
существует единственное значение, при котором радиационный вклад равен
тепловому. Критическая ситуация определяется условием касания прямой
радиационной заселенности и кривой тепловой заселенности.

Рисунок 4.1 Зависимость отношения радиационного и теплового
вкладов от интенсивности излучения.
В сложных молекулах V-T-релаксация высоких колебательных уровней может идти
значительно быстрее, чем нижних. Если лазерным излучением возбуждать не
основной переход молекулы, а переходы с более высоких колебательных уровней,
равновесная заселенность, которых невелика, то заселенность возбужденного
уровня будет определяться конкуренцией накачки с V-V-релаксацией.
Так как для абсолютного большинства молекул скорость V-V-релаксации
значительно превышает скорость V-T-релаксации, что эквивалентно условию 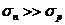 , что означает необходимость практически
полного отсутствия поглощения лазерного излучения основным колебательным
переходом молекулы, дающий главный вклад в равновесный тепловой разогрев.
, что означает необходимость практически
полного отсутствия поглощения лазерного излучения основным колебательным
переходом молекулы, дающий главный вклад в равновесный тепловой разогрев.
Таким образом, анализ тепловой и радиационной заселенности
возбужденных состояний, образующихся при поглощении непрерывных лазерных
ИК-излучений молекулами в основном колебательном состоянии, показывает, что
неравновесные условия могут достигаться лишь при низких давлениях. При более
высоких давлениях отклонения от равновесности незначительны и химические
превращения под действием ИК-излучений должны протекать в основном по тепловому
механизму.
Одна из возможностей осуществления неравновесных, истинно
фотохимических превращений при сравнительно высоких давлениях связано с
возбуждением не основных колебательных состояний, а возбужденных. Их малые
концентрации приводят к значительному снижению разогрева и позволяют наблюдать
эффект действия ИК-излучения в чистом виде, не осложненном побочными тепловыми
процессами. Таких доказательств в литературе нет.
Другой способ осуществления неравновесных ИК-излучений при высоких
давлениях - возбуждение не стабильных молекул, а активных промежуточных
продуктов сложных химических реакций - атомов или свободных радикалов,
концентрации которых в стационарно реагирующих системах, как правило, на
несколько порядков меньше концентрации стабильных молекул. При этом
неравновесный режим протекания реакции под действием ИК-излучения может
осуществляться при значительно больших давлениях реагирующих молекул, чем при
их непосредственном возбуждении. Важным преимуществом возбуждения активных
промежуточных продуктов является также снижение роли обмена энергии возбуждения
между ними в силу их малой концентрации.
4.2
Экспериментальные критерии выбора между тепловым и фотохимическим механизмом
реакции
Зачастую механизмы термических реакций неизвестны и
количественная информация о колебательной релаксации соответствующих молекул
отсутствует. Найти чисто расчетным путем диапазон условий, при которых та или
иная реакция должна протекать по фотохимическому или тепловому механизму,
практически невозможно. Поэтому целесообразно рассмотреть экспериментальные
критерии выбора теплового и фотохимического механизма реакции.
При изучении литературы было замечено, что даже при высоких
давлениях закономерности многих реакций, индуцируемых лазерным ИК-излучением,
существенно отличаются от закономерностей тепловых реакций. Но само по себе
такое отличие без тщательного анализа не может служить доказательством
фотохимического механизма процесса.
Простейшим критерием фотохимического механизма может служить
отличие состава продуктов и скоростей их образования по сравнению с тепловым
процессом, проведенным при той же температуре. Однако реализовать на практике
не так уж и просто этот критерий. Так как довольно сложно обеспечить
идентичность или учесть различие температурных полей в условиях лазерного и
обычного нагрева. Нагрев лазерным излучением существенно отличается от обычного
нагрева стенкой неравномерностью температуры по сечению реактора. Вдоль луча
лазера достигаются высокие температуры, в то время как стенки могут оставаться
холодными.
Подавляющее большинство химических реакций являются сложными
процессами, состоящими из большого числа элементарных стадий, часть из них
может протекать на стенках реактора. Тогда суммарная скорость и состав
продуктов сложной реакции могут быть различными при проведении ее в обычном
реакторе и при лазерном нагреве, если даже механизм действия ИК-излучения чисто
тепловой.
Экспериментальное доказательство этого приводится в литературном
источнике [4] на примере облучения стехиометрической смеси 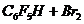 при суммарном давлении 40 торр излучением
двадцати ваттного непрерывного
при суммарном давлении 40 торр излучением
двадцати ваттного непрерывного 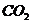 -лазера. Реакция проходит на 50% за 10 мин. Продуктами реакции
являются
-лазера. Реакция проходит на 50% за 10 мин. Продуктами реакции
являются 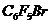 и
и  . При обычном нагреве в стеклянном реакторе реакция протекала со
сравнимой (по расходу
. При обычном нагреве в стеклянном реакторе реакция протекала со
сравнимой (по расходу 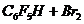 ) скоростью при 600ºС. Продуктами данной реакции на ряду с
) скоростью при 600ºС. Продуктами данной реакции на ряду с 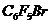 и
и  обнаружены мета-
обнаружены мета-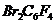 , различные фторсодержащие олефины и значительное количество
, различные фторсодержащие олефины и значительное количество 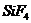 , а на стенках выпадала сажа. Образование
, а на стенках выпадала сажа. Образование 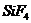 указывает на участие в реакции материала
стенки. Очевидно, в реакторе протекают гетерогенные процессы, которые сведены к
минимуму или совсем отсутствуют при лазерном нагреве. Таким образом, в данной
реакции различия в составе продуктов при обычном и лазерном нагреве находят
естественное объяснение в рамках теплового механизма и не могут служить
аргументом в пользу фотохимического механизма.
указывает на участие в реакции материала
стенки. Очевидно, в реакторе протекают гетерогенные процессы, которые сведены к
минимуму или совсем отсутствуют при лазерном нагреве. Таким образом, в данной
реакции различия в составе продуктов при обычном и лазерном нагреве находят
естественное объяснение в рамках теплового механизма и не могут служить
аргументом в пользу фотохимического механизма.
Инициированные светом 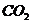 - лазера бимолекулярные реакции наблюдались для ряда систем, в
том числе для смесей
- лазера бимолекулярные реакции наблюдались для ряда систем, в
том числе для смесей 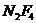 с
с 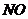 ,
,  и т.д. [5]. Тот факт, что все вещества,
входящие в перечисленные выше смеси, не диссоциируют в условиях, при которых
протекали реакции в смесях, позволил предположить, что наблюдаемые процессы
начинаются не со стадии диссоциации колебательно-возбужденных молекул, а со
стадии экзотермической бимолекулярной реакции с участием
колебательно-возбужденных молекул. Например, при взаимодействии
и т.д. [5]. Тот факт, что все вещества,
входящие в перечисленные выше смеси, не диссоциируют в условиях, при которых
протекали реакции в смесях, позволил предположить, что наблюдаемые процессы
начинаются не со стадии диссоциации колебательно-возбужденных молекул, а со
стадии экзотермической бимолекулярной реакции с участием
колебательно-возбужденных молекул. Например, при взаимодействии 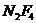 и
и 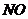 такой экзотермической реакцией является стадия образования
такой экзотермической реакцией является стадия образования 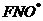 . Сопоставление лазерно-химических реакций
с термическими обнаруживает их существенное различие. Так, при нагревании
смесей
. Сопоставление лазерно-химических реакций
с термическими обнаруживает их существенное различие. Так, при нагревании
смесей 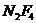 с
с 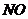 и
и 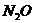 происходит лишь распад
происходит лишь распад 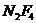 , а взаимодействие с окислами азота отсутствует.
Это можно объяснить тем, что образующиеся при поглощении монохроматического
ИК-излучения молекулы, колебательное возбуждение которых локализовано лишь на
определенных степенях свободы, отличаются по своим химическим свойствам от
колебательно-возбужденных молекул, с которыми имеют дело при термических
превращениях и в которых все внутренние степени свободы возбуждаются
одновременно.
, а взаимодействие с окислами азота отсутствует.
Это можно объяснить тем, что образующиеся при поглощении монохроматического
ИК-излучения молекулы, колебательное возбуждение которых локализовано лишь на
определенных степенях свободы, отличаются по своим химическим свойствам от
колебательно-возбужденных молекул, с которыми имеют дело при термических
превращениях и в которых все внутренние степени свободы возбуждаются
одновременно.
Сравнить скорости реакции, идущие под действием ИК-излучения, и
реакции в той же смеси, нагретой до соответствующей температуры обычным
способом, очень сложно. Температуру в зоне лазерного луча измерить крайне
трудно. А определение температуры в зоне реакции расчетным путем возможно лишь
при кондуктивном механизме теплопроводности, преобладающем при низких
интенсивностях ИК-излучения, т.е. при малых разогревах. Поэтому делать
достоверные выводы о тепловом или фотохимическом механизме действия на реакцию
ИК-излучения на основе сравнения ее скорости со скоростью ИК-излучения можно
лишь при малых интенсивностях излучения или при низких концентрациях
поглощающего компонента. Реакции, идущие с достаточными для экспериментальных
измерений скоростями при низких давлениях и сравнительно невысоких
температурах, должны обладать низким активационным барьером.
Примером процесса, на основе которого делается вывод о нетепловом
действии ИК-излучения, является фотоинициированное разложение двуокиси хлора,
протекающее по механизму цепной реакции с вырожденным разветвлением [4]. Схема
реакции включает в себя большое число элементарных стадий. Ускорение одних
стадий за счет колебательного возбуждения 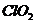 может приводить к сокращению периода индукции разложения, а
ускорение других стадий - к его удлинению, т.е. торможению реакции. С ростом
температуры период индукции реакции сокращается. На рисунке 4.2 (кривая 1)
экспериментальные точки получены путем усреднения большого числа измерений.
Видно, что при давлении 0,7 торр ИК-излучение увеличивает период индукции, т.е.
тормозит реакцию, а при давлениях, больших 1 торр, уменьшает период индукции,
т.е. ускоряет реакцию. Ускорение реакции при давлениях, больших 1 торр,
естественно связать с равновесным тепловым разогревом за счет поглощения
лазерного излучения. Из экспериментально известной температурной зависимости
периода индукции разложения
может приводить к сокращению периода индукции разложения, а
ускорение других стадий - к его удлинению, т.е. торможению реакции. С ростом
температуры период индукции реакции сокращается. На рисунке 4.2 (кривая 1)
экспериментальные точки получены путем усреднения большого числа измерений.
Видно, что при давлении 0,7 торр ИК-излучение увеличивает период индукции, т.е.
тормозит реакцию, а при давлениях, больших 1 торр, уменьшает период индукции,
т.е. ускоряет реакцию. Ускорение реакции при давлениях, больших 1 торр,
естественно связать с равновесным тепловым разогревом за счет поглощения
лазерного излучения. Из экспериментально известной температурной зависимости
периода индукции разложения 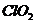 и величины разогрева можно рассчитать зависимость относительного
изменения периода индукции за счет равновесного теплового разогрева, вызываемого
лазерным излучением (кривая 2). Разность кривых 1 и 2 дает кривую 3, которая
характеризует эффект влияния ИК-излучения в термических условиях. Полученный
результат не позволяет сделать выбор элементарной стадии, ускорение которой
приводит к торможению реакции, но доказывает равновесное, т.е. фотохимическое,
действие на реакцию ИК-излучения при низких давлениях, в отличие от эффектов
ускорения, которые могут быть соизмеримы с действием равновесного теплового
разогрева.
и величины разогрева можно рассчитать зависимость относительного
изменения периода индукции за счет равновесного теплового разогрева, вызываемого
лазерным излучением (кривая 2). Разность кривых 1 и 2 дает кривую 3, которая
характеризует эффект влияния ИК-излучения в термических условиях. Полученный
результат не позволяет сделать выбор элементарной стадии, ускорение которой
приводит к торможению реакции, но доказывает равновесное, т.е. фотохимическое,
действие на реакцию ИК-излучения при низких давлениях, в отличие от эффектов
ускорения, которые могут быть соизмеримы с действием равновесного теплового
разогрева.
Рисунок 4.2. Зависимость относительного изменения периода индукции
разложения двуокиси хлора под действием ИК-излучения от давления.
Поскольку далеко не все вещества имеют полосы или линии поглощения
в области генерации существующих ИК-лазеров, широкое распространение получила
сенсибилизация их соединениями, хорошо поглощающими ИК-излучение. При высоких
давлениях сенсибилизатор исполняет роль нагревателя. Когда V-T-релаксация
может стать медленнее лазерной накачки, возможны и неравновесные химические
превращения используемого вещества, возбуждаемого за счет передачи
колебательной энергии при столкновениях с сенсибилизатором [6].
Если и само исследуемое вещество имеет линии поглощения,
неперекрывающиеся со спектром поглощения сенсибилизатора, появляется
возможность сравнительного изучения закономерностей реакции под действием
различных лазерных линий, поглощаемых сенсибилизатором или самим веществом. При
этом их концентрации подбирают так, чтобы поглощаемая в реакционном сосуде
энергия лазерного излучения была одинакова на обеих лазерных линиях. Это должно
обеспечить одинаковые температуры и их распределения в обоих случаях. Если
механизм реакции тепловой, то характер химических превращений не должен
зависеть от того, поглощается ИК-излучение сенсибилизатором или самим
веществом. При нетепловом механизме можно ожидать таких различий, так как
колебательные температуры реагента при двух способах возбуждения могут быть
неодинаковыми.
Такой подход был использован при изучении механизма разложения 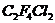 на
на 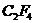 и
и 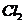 под действием излучения непрерывного
под действием излучения непрерывного 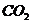 -лазера. Молекула
-лазера. Молекула 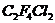 имеет полосы поглощения 921 и 1051
имеет полосы поглощения 921 и 1051 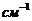 с примерно равными коэффициентами
поглощения. Установлено, что скорость разложения
с примерно равными коэффициентами
поглощения. Установлено, что скорость разложения 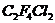 при давлениях 300-400 торр под действием излучения
при давлениях 300-400 торр под действием излучения 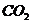 -лазера мощностью 4 Вт (при диаметре луча
1мм) в 160 раз выше при действии его на полосу 921
-лазера мощностью 4 Вт (при диаметре луча
1мм) в 160 раз выше при действии его на полосу 921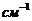 по сравнению с действием на полосу 1051
по сравнению с действием на полосу 1051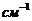 той же молекулы. Отсюда делается вывод о
нетепловом механизме действия ИК-излучения. Разница в скоростях реакции
объясняется различием скоростей передачи колебательной энергии с возбуждаемой
моды на разрываемые связи.
той же молекулы. Отсюда делается вывод о
нетепловом механизме действия ИК-излучения. Разница в скоростях реакции
объясняется различием скоростей передачи колебательной энергии с возбуждаемой
моды на разрываемые связи.
В дальнейшем было более детально исследована эта реакция. Измерили
скорость реакции при действии на 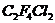 других линий
других линий 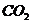 -лазера, а не только совпадающих с центрами соответствующих полос
поглощения (921 и 1051
-лазера, а не только совпадающих с центрами соответствующих полос
поглощения (921 и 1051 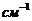 ). При этом было установлено, что
максимумы скорости вовсе не совпадают с максимумами поглощения холодного газа,
а сдвинуты в более длинноволновую сторону, что хорошо согласуется с появлением
"горячих" полос поглощения. Оказалось, что максимальная скорость
разложения больше при возбуждении вблизи полосы 1051
). При этом было установлено, что
максимумы скорости вовсе не совпадают с максимумами поглощения холодного газа,
а сдвинуты в более длинноволновую сторону, что хорошо согласуется с появлением
"горячих" полос поглощения. Оказалось, что максимальная скорость
разложения больше при возбуждении вблизи полосы 1051 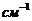 , а не 921
, а не 921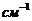 , а скорости различаются не в 160 раз, а лишь в 3 раза. Одинаковые
количества поглощенной энергии и одинаковые скорости пробной реакции циклизации
перфторбутадиена в перфторциклобутан, протекающей с меньшим активационным
барьером, могут свидетельствовать об одинаковой температуре в кювете. Однако
распределение температуры в кювете при поглощении излучения с различными длина
волн могут быть различны. Для разложения
, а скорости различаются не в 160 раз, а лишь в 3 раза. Одинаковые
количества поглощенной энергии и одинаковые скорости пробной реакции циклизации
перфторбутадиена в перфторциклобутан, протекающей с меньшим активационным
барьером, могут свидетельствовать об одинаковой температуре в кювете. Однако
распределение температуры в кювете при поглощении излучения с различными длина
волн могут быть различны. Для разложения 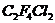 , энергия активации которого больше, чем у пробной реакции, эти
различия могут существенно влиять на его скорость.
, энергия активации которого больше, чем у пробной реакции, эти
различия могут существенно влиять на его скорость.
Приведенный пример демонстрирует трудность интерпретации
результатов экспериментов, основанных на сравнении скоростей процессов при
возбуждении разных полос ИК-поглощения. Эти трудности связаны со сложностью
обеспечения идентичности температурных профилей при возбуждении различных полос
поглощения и тем самым исключения различий в скоростях и направлении тепловых
процессов.
Рассматриваемый прием может быть успешно применен для доказательства
фотохимического механизма реакции при достаточно низких давлениях, когда
влиянием теплового разогрева можно пренебречь. При этом следует иметь в виду,
что заметные отличия скоростей при возбуждении различных компонент смеси можно
получить лишь в том случае, если исключено влияние быстрых процессов V-V-релаксации,
приводящих к выравниванию колебательных температур компонент [4].
Заключение
Анализ экспериментальных результатов по изучению химических
реакций под действием излучений с длительностями импульсов большими времени
колебательно-поступательной релаксации ИК - лазеров при высоких давлениях
показывает, что в настоящее время нет надежных и бесспорных доказательств
протекания их по фотохимическому, а не по тепловому механизму. При низких давлениях
имеется целый ряд процессов, фотохимический механизм которых можно считать
доказанным.
Несмотря на то, что химические реакции под действием лазерных
ИК-излучений протекают, по-видимому, в основном по тепловому механизму, их
закономерности могут существенно отличатся от закономерностей при обычном
нагреве, и их изучение, несомненно, представляет большой научный и практический
интерес.
Только высокие интенсивности, приводящие к существенно
многофотонным процессам возбуждения, могут создавать микроскопическую
неравновесность, при которой существенны фотохимические ИК-каналы реакций. При
умеренной интенсивности излучения такие каналы маловероятны.
Найти чисто расчетным путем диапазон условий, при которых та
или иная реакция должна протекать по фотохимическому или тепловому механизму,
практически невозможно. Простейшим критерием фотохимического механизма может
служить отличие состава продуктов и скоростей их образования по сравнению с
тепловым процессом, проведенным при той же температуре. Однако применение этого
критерия - непростая задача, поскольку довольно сложно обеспечить идентичность
или учесть различие температурных полей в условиях лазерного и обычного
нагрева.
Список
использованных источников
1.
Гуревич Ю.Я., Плесков Ю.В. Фотоэлектрохимия полупроводников. Москва: Наука.
1983.
.
Бугаенко Л.Т. и др. Химия высоких энергий. / Л.Т. Бугаенко, М.Г. Кузьмин, Л.С.
Полак. Под общей редакцией Л.С. Полака. Москва: Химия. 1988.364с.
.
Карлов Н.В. и др. Лазерная термохимия: [Лекции] / Н.В. Карлов, Н.А. Кириченко,
Б.С. Лукьянчук. Москва: Наука. 1992.295с.
.
Молин Ю.Н. и другие. Инфракрасная фотохимия. / Ю.Н. Молин, В.Н. Панфилов, А.К.
Петров. - Москва: Наука. 1985.253с.
.
Ямпольский Ю.П. Излучение лазера и химическая реакция. Москва:
"Знание". 1973.62с.
.
Турро Н. Дж. Молекулярная фотохимия. Перевод с английского В.А. Белякова и
кандидата хим. наук А.Л. Бучаченко. Под редакцией д-ра физ. - мат. наук Р.Ф.
Васильева. Москва: Мир, 1967.328с.
.
Химическое осаждение металлов из водных растворов. / Под редакцией В.В. Свиридова.
Минск: Издательство Университетское. 1987.270с.
.
Индуцируемые лазером химические процессы // Галберт Г., Акерхальт Дж., Дэйнен
В. и др. // Редактор Дж. Стейнфелд; перевод с англ.Э.Е. Санд-Галиева, под
ред.В. В. Коршака, Н.В. Карлова // Москва: Мир; 1984.309с.
.
Тепломассоперенос при фазовых и химических превращениях: Сборник научных
трудов/ АН БССР, Институт тепло - и массообмена им. А.В. Лыкова. [Редкол.: С.А.
Жданок, Л.А. Сергеева]. Минск: ИТМО, 1990.152с.
.
Козин Л.Ф. Электроосаждение и растворение многовалентных металлов. /АН УССР,
Институт общ. и неорг. химии. Киев: Наук. Думка, 1989.462с.
.
Тереньев В.А. Термодинамика водородной связи. Саратов: Издательство Сарат.
университета. 1973.258с.
.
Гиллет Дж. Фотофизика и фотохимия полимеров: Введение в изучение фотопроцессов
в макромолекулах. Пер. с англ. Москва: Мир. 1988.435с.
.
Крюков А.И. и др. Фотоперенос электрона и его прикладные аспекты. / А.И.
Крюков, В.П. Шерстюк, И.И. Цилунг. Киев: Наукова Думка. 1982. 237с.
.
Физическая химия: Современные проблемы // Ежегодник. Под ред. Я.М. Колотыркина
// Москва: Химия. 1987.262с.