Производство амилазы
Введение
Амилазы использовались человеком
давно, однако их изучение началось с открытия Кирхгофом в 1814 г. вещества,
способного превращать крахмал в сахар. Препарат, полученный Кирхгофом из
пшеничной муки, обладал способностью разжижать крахмальный клейстер и
превращать его в сахарный сироп. Аналогичное явление автор наблюдал при
смешивание крахмального клейстера с ячменным солодом. Уже в этих первых
исследованиях Кирхгоф отметил губительное действие на это вещество серной
кислоты. В то же время он подчеркнул, что сахарообразование является необходимы
условием для сбраживания крахмалсодержащих материалов и таким образом положил
начало научному объяснению технологии брожения.
Биологически активное вещество в
дальнейшем было выделено из солода и подверглось детальному изучению. Было
обнаружено, что его действие на крахмал проходит через три стадии: разжижение,
декстринизацию и осахаривание. Это привело к признанию существования в солоде
двух различных компонентов, которые в дальнейшем были по лучены в отдельности и
названы а-амилазой (декстринирующий компонент) и β-амилазой(осахаривающий компонент).
α-Амилазы
и β-амилазы широко
распространены в высших растениях. Наиболее важным источником амилаз являются
хлебные злаки, зерно которых в проросшем состоянии (в виде солода) находит
широкое применение в промышленном гидролизе крахмала. Солод из ячменя, ржи,
пшеницы, овса, проса в настоящее время используется для осахаривания крахмала в
спиртовом производстве.
1. Общая характеристика амилаз
Классификация ферментов
|
Класс
|
Катализируемая реакция
|
Тип реакции
|
Важнейшие подклассы
|
|
КФ 1 Оксидоредуктазы
|
Окислительно-восстановительные реакции. Перенос атомов H и O или
электроновот одного субстрата на другой
|
AH + B → A + BH (восстановленный) A + O → AO
(окисленный)
|
дегидрогеназа, оксидаза, пероксидаза,редуктаза, монооксидаза,
диоксигеназа
|
|
КФ 2 Трансферазы
|
Перенос функциональной группы от одного субстрата на другой. Это
может быть метильная, ацильная, фосфатная группа или аминогруппа.
|
AB + C → A + BC
|
аминотрансфераза, фосфотрансфераза, C1-трансфераза,
гликозилтрансфераза
|
|
КФ 3 Гидролазы
|
Образование двух продуктов из одного субстрата в результате
гидролиза.
|
AB + H2O → AOH + BH
|
эстераза, гликозил-гидролаза, пептидаза,амидаза
|
|
КФ 4 Лиазы (синтазы)
|
Негидролитическое добавление или удаление группы к или от
субстрата. Образование C-C, C-N, C-O или C-S связи.
|
RCOCOOH → RCOH + CO2
|
C-O-лиаза, C-S-лиаза, C-N-лиаза, C-C-лиаза
|
|
КФ 5 Изомеразы
|
Внутримолекулярная перестановка, то есть изомеризация молекулы
субстрата.
|
AB → BA
|
эпимераза, цис-транс-изомераза,внутримолекулярная
оксидоредуктаза и др.
|
|
КФ 6 Лигазы(синтетазы)
|
Соединение двух молекул в результате синтеза новой C-O, C-S, C-N
или C-Cсвязи, сопряжённое с одновременным гидролизом АТФ.
|
X + Y+ ATP → XY + ADP + Pi
|
C-O-лигаза, C-S-лигаза, C-N-лигаза, C-C-лигаза
|
Согласно современной классификации и
номенклатуре ферментов а- амилаза получила название α-1,4-глюкан-4глюкангидролаза;
β -амилаза - α
-1,4-глюкавмальтогидролаза; глюкоамилаза-α -1,4-глюкогидролаза;олиго- 1,6-глюкозидаза декстрин-6-глюкангидролаза.
Роль α-амилаз при гидролизе крахмала исключительно велика. Из трех
основных функций при действии на клейстеризованный крахмал (разжижение,
декстринизация, осахаривание) разжижение и декстринизация зависят от α-амилаз. Они атакуют не
только клейстеризованный, но и нативный крахмал, разрушая крахмальные зерна.
α-Амилазы
различного происхождения имеют много общих свойств: хорошо растворяются в воде
или в сильно разбавленных растворах солей.
Более концентрированные растворы
солей (например, 20 - 30%ные растворы сульфата аммония) вызывают осаждение этих
ферментов, α-Амилазы
легко растворяются в разбавленных растворах этилового спирта, но осаждаются при
его концентрации в среде свыше 60%. Белок α-амилаз обладает слабокислыми свойствами; изоэлектрическая точка
ферментов колеблется в пределах pH 4,2-5,7. Молекулярная масса солодовой α-амилазы 60000, α-амилаз микроскопических
грибов - 45000--50000. Многие из известных ныне α-амилаз получены либо в высокоочищенном, либо в кристаллическом
виде.
Действуя на целое крахмальное зерно α-амилаза атакует его,
разрыхляя поверхность и образуя каналы и бороздки, т.е как бы раскладывает
зерно на части. Клейстеризованный крахмал гидролизуется ею с образование не
окрашиваемых йодом продуктов в основном низкомолекулярных декстринов. Процесс
гидролиза крахмала многостадийный.

а - ферментативный гидролиз амилозы;
б - начальная стадия гидролиза амилопектина; в - конечная стадия осахаривания
амилопектина.
Рисунок 1.1 Стадия гидролиза
крахмала α-амилазой:
В результате воздействия а- амилазы
на первых стадиях процесса в гидролизате накапливаются декстрины, затем
появляются неокрашивающиеся йодом тетра- и тримальтоза, которые очень медленно
гидролизуются α-
амилазой до ди- и моносахаридов. Все α-амилазы проявляют наименьшее сродство к гидролизу концевых связей
в субстрате. Некоторые же or-амилазы, особенно грибного происхождения, на
второй стадии процесса гидролизуют субстрат более глубоко с образованием
небольшого количества мальтозы и глюкозы.
Ионы кальция оказывают
стабилизирующее действие на а -амилазы. Это впервые было обнаружено
Воллерштейном, затем подтверждено Накамурой. В настоящее время это явление
отмечено почти для всех амилаз. Однако теоретически этот вопрос применительно к
промышленному гидролизу крахмала до сих пор не разработан.
α-Амилаза
солода и глюкоамилаза микроскопических грибов являются осахаривающими
ферментами, образующими при гидролизе крахмалаебраживаемые сахара- мальтозу и
глюкозу соответственно.
β-Амилаза
-типичный представитель амилаз высших растений. Ее действие на крахмал,
содержащий α
-гликозильные связи, ведет к образованию β -мальтозы. Это явление было первым признанным примером

а-гидролиз амилозы; б-гидролиз
наружных ветвей амилопектина (β-декстрин обведен пунктирной линией)
Рисунок 1.2 Действие β-амилазы на крахмал
Открытие глюкоамилаз, называемых
иначе γ-амилазами,
амилоглюкозидазами, α-глюкозидазами или така-амилазами В, связано с исследованием
ферментов микроскопических грибов, используемых в производстве спирта.
Согласно новой номенклатуре
глюкоамилаза должна расщеплять лишь α - 1,4-связи в поли- и олигосахаридах. Однако установлено, что этот
фермент расщепляет также α-1,6-глюкозидные связи. Поэтому для глюкоамилазы предложено
систематическое название α-1,4-:1,6-глюкан-4:6- глюкангидролаза.Таким образом, под рабочим
названием глюкоамилазы следует иметь в виду фермент, расщепляющий в крахмале и
олигосахаридах α-1,4- и α-1,6-глюкозидные связи. Существование в микроскопических грибах
таких ферментов, как олиго- 1,6-глюкозидаза (конечная декстриназа) и
изомальтаза, расщепляющих α-1,6- связи,некоторые исследователи ставят под сомнение. Весьма
активная глюкоамилаза содержится в микроскопических грибах.
. Обзор возможных способов получения
Амилолитические препараты могут быть
получены из поверхностных и глубинных культур. Получение препаратов амилаз из
поверхностных культур. Средой для выращивания продуцентов являются пшеничные
отруби с добавлением до 25 % солодовых ростков, увлажненные водой, подкисленной
0,1 н. раствором серной или соляной кислоты. Выход готовой культуры составляет
обычно от 70 до 80 % массы среды. Продуцентами а- амилазы и глюкоамилазы чаще
всего используются микроскопические грибы A. oryzae, A. awamori, A. niger, R.
delemar и др. В Японии при твердофазном культивировании применяют бактерии В.
subtilis и В. amylosolvents. Режимы выращивания зависят от физиологии
продуцента.
Экстракт из поверхностной культуры
может быть использован для получения очищенных амилолитических препаратов путем
осаждения ферментов органическими растворителями или нейтральными солями.
Амилазы выпадают в осадок почти полностью (93-96 %) при концентрации этанола в
растворе 69-72 %, ацетона 60-62 и изопропанола 54-55%. Но сейчас поверхностная
культура не считается перспективным сырьем для производства высокоочищенных
амилолитических препаратов.
Получение препаратов амилаз из
глубинных культур. В настоящее время в нашей стране для получения
амилолитических ферментных препаратов преимущественно используется глубинный
способ культивирования продуцентов. В качестве продуцентов используют грибы
рода Aspergillus (A. oryzae, A. usamii, A. batatae), спороносные бактерии,
относящиеся к группам В. subtilis - mesentericus, дрожжеподобные организмы
родов Endomycopsis, Endomyces и многие другие микроорганизмы.
Источники азота. Выбор сред для
каждого продуцента про водится опытным путем с учетом физиологических
потребностей продуцента и условий производства. Например, при изучении
факторов, влияющих на биосинтез ферментов, было показано, что культура В.
subtilis 103 весьма чувствительна к источнику азота в среде (табл. 1.1.).
Таблица 1.1
|
Источник азота
|
Активность α-амилазы, ед. 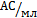
|
рН исходной среды
|
рН Культуральной жидкости
|
Содержание биомассы, г на 100 мл
|
|
Цитрат аммония двузамещаемый
|
82,8
|
6,9
|
7,5
|
0,84
|
|
KN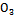
|
14,4
|
6,9
|
0,11
|
|
N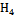 N N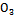
|
0
|
6,9
|
4,45
|
0,26
|
|
(N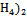 S S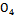
|
0
|
6,9
|
4,8
|
0,40
|
|
(N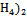 HP HP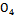
|
86,4
|
6,9
|
5,6
|
0,80
|
|
N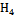 Cl Cl
|
43,2
|
6,9
|
7,4
|
0,40
|
|
Казеин
|
24,0
|
6,9
|
7,7
|
0,80
|
|
Пептон
|
43,2
|
6,9
|
7,5
|
1,00
|
|
Кукурузный экстракт
|
36,0
|
6,8
|
7,6
|
1,00
|
|
Глютеин
|
14,4
|
7,0
|
6,8
|
0,74
|
Наилучшие результаты согласно данным
К. А. Калунянца и др. (1979) наблюдаются в присутствии двузамещенного цитрата
аммония - 82,8 ед. АС/мл и (NH4)2HP04 - 86,4 ед. АС/мл. Органические источники
азота менее эффективны, чем неорганические.
Дополнительное введение азота в виде
экстрактов из растительного, животного и микробного материала к (NH4)2HP04
позволяет на 30-40 % повысить продуцирующую способность бактерий и достичь
активности 110-114 ед. АС/мл(табл 1.2.).
Таблица 1.2
|
Вариант среды
|
(N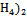 HP HP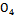
|
Азотсодержащая добавка
|
Количество довавки
|
рН Исходной среды
|
рН готовая культуральная жидкость
|
Актив. α-амилаз ед. 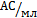
|
|
1
|
1,0
|
Пептон
|
0,9
|
6,9
|
7,2
|
108,4
|
|
2
|
1,0
|
Кукурузный Экстракт
|
0,9
|
6,8
|
7,3
|
111,6
|
|
3
|
1,0
|
Экстракт солодовых ростков
|
5,0
|
6,8
|
114,0
|
|
4
|
1,2
|
Кукурузный экстракт и пивные осадочные дрожжи
|
0,8 и 0,4
|
6,7
|
7,2
|
111,6
|
Источники углерода. Главным
источником углерода в среде для всех продуцентов α-амилазы является крахмал различного происхождения. Используют
чаще всего крахмал картофельный или кукурузный, который вводится в среду в
клейстеризованном состоянии. Вместо крахмала может применяться
крахмалсодержащее сырье, например ячменная или кукурузная мука. Все эти
компоненты используются в нативном виде или в виде различных гидролизатов.
Установлено, что биосинтез α-амилазы протекает более
интенсивно, если крахмал частично гидролизовать в процессе приготовления
питательной среды, не допуская при этом накопления в среде низкомолекулярных
дисахаров (мальтозы) и особенно глюкозы (табл 1.3.).
Таблица 1.3
|
Вариант среды
|
Способ обработки крахмала в питательной среде
|
рН готовой культуральной жидкости
|
Активность α-амилазы в КЖ
ед. 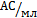
|
Активность α-амилазы в КЖ %
от контроля
|
|
1
|
Гидролизат крахмала при длительности гидролиза τ=10
мин
|
5,70
|
177,0
|
158,5
|
|
2
|
Гидролизат крахмала при τ=60 мин
|
5,65
|
168,0
|
150,5
|
|
3
|
Гидролизат крахмала при τ=1,5 ч
|
5,72
|
180,0
|
161,0
|
|
4
|
Гидролизат крахмала при τ=18
ч
|
5,68
|
180,0
|
161,0
|
Поэтому, если состав среды
предусматривает высокое содержание крахмала, целесообразно вводить его порциями
по мере потребления культурой микроорганизма, что позволяет избежать явления
катаболитной репрессии синтеза а - или глюкоамилазы (рис. 1.3)

-контроль; 2-дробный режим введения
крахмала в количестве 0,5 %
Рисунок 1.3 Влияние дробного
введения крахмала
. Обоснование целесообразности
использования биотехнологический приемов в производстве амилаз
Амилазы для промышленного применения
получают только биотехнологическими приемами - биосинтезом с помощью
микроорганизмов, так как в растениях их содержится в небольших количествах и
выделять их экономически не целесообразно.
При биотехнологических приемах
используются мягкие режимы выращивания биомассы продуцента и выделение
ферментов (амилаз), так как основная масса продуцентов относится к мезофильным
микроорганизмам, оптимум роста для которых находится при температуре 28-36°С.
Использование ферментов -
биологических катализаторов - очень заманчивая вещь. Ведь они по многим своим
свойствам, прежде всего активности и избирательности действия (специфичности),
намного превосходят катализаторы химические. Ферменты обеспечивают
осуществление химических реакций без высоких температур и давлений, а ускоряют
их в миллионы и миллиарды раз. При этом каждый фермент катализирует только одну
определённую реакцию.
Биологические катализаторы можно
использовать также не извлекая их из живых организмов, прямо в бактериальных
клетках, например. Этот способ, собственно, есть основа всякого
микробиологического производства, и применяется он издавна.
Разработка способа повышения
устойчивости ферментов значительно расширяет возможности их использования. С
помощью ферментов можно, например, получать сахар из растительных отходов, и
этот процесс будет экономически рентабельным. Уже создана опытная установка для
непрерывного производства сахара из клетчатки.
. Описание технологических стадий и
режимов производства амилолитического ферментного препарата
В Последовательность стадий
получения ферментного препарата, содержащего α-амилазу, представлена на рисунке 1.4
В настоящее время для получения
амилолитических ферментных препаратов преимущественно используется глубинный
способ культивирования.
Продуцентами при данном способе
культивирования являются: микроскопические грибы рода Aspergillus (A. Oryzae,
A. Ussamii, А. Batatae), спороносные бактерии, относящиеся к группам Bacillus.
Subtilis-mesentericus, дрожжеподобные организмы родов Endomucopsis, Endomyces и
многие другие микроорганизмы.

Рисунок 1.4. Схема получения
ферментного препарата
Приготовление посевного материала.
Этапы получения посевной культуры следующие: 1) обновление исходной культуры на
агаризованной среде; 2) выращивание культуры продуцента на жидкой среде в
колбах на качалке; 3) культивирование продуцента в малом, а затем, если
требуется, в большом инокуляторе. Посевная доза при засеве производственной
среды составляет 4% по объему.
Компонентами среды являются:
кукурузная мука, крахмал, патока, гидролизатыказеина и дрожжей, древесины,
липиды, минеральные соли. (Содержание СВ от 1,5 до 15,5 %, pH от 3,5- 8,5)
Приготовление питательной среды
включает в себя составление композиции для роста биомассы и накопления
ферментов. В питательную среду входит следующий состав (в %): (NH4)2HPO4 - 0.8;
КН2РО4 -0.1; KNO3 -0.11; кукурузный экстракт - 1. Среду стерилизуют для
удаления посторонней микрофлоры при температуре 121 °С в течение 1 часа.
Температура культивирования: 26-32 С для грибов, а для бактерий 32-35 С. Режим
аэрации: 50- 60 м3/ч м3.
Ферментация - процесс,
осуществляемый с помощью культивирования микроорганизмов. Ферментация - это
комплекс процессов, в который входят рост и развитие клеток, биосинтез
ферментов, тепловыделение, транспорт метаболитов в культуральную жидкость.
Исходный pH питательной среды 6,5-7,0 поддерживают на оптимальном уровне с
помощью мела. Процесс протекает при температуре 35 °С и длительность
ферментации составляет 55 -60 ч. На рост и развитие клеток существенное влияние
оказывает концентрация питательных веществ в субстрате.
Фильтрация - процесс разделения
суспензии с использованием пористых перегородок, которые задерживают твердую
фазу суспензии и пропускает ее жидкую фазу. Полученную биомассу продуцента
вместе с нерастворимыми частицами среды при необходимости стерилизуют,
высушивают и используют на корм животным. Фильтрат культуральной жидкости
нестабилен, он не может хранится и должен немедленно направляться на дальнейшую
обработку для получения очищенных ферментных препаратов.
Выпаривание - процесс
концентрирования растворов путем частичного испарения жидкого растворителя.
Фильтраты глубинной культуры являются нестабильными при хранении. Для получения
готовых форм их необходимо сконцентрировать. Ферменты очень чувствительны к
термической обработке и нуждаются в мягких режимах концентрирования. При
температуре греющего пара 90-100"С и при температуре кипения 35- 40 С
потери активации не превышают 10%.
Сепарирование - разделение под
действием центробежных сил. Во вращающемся потоке на взвешенную частицу
действует центробежная сила, направляющая ее от центра к периферии.
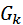 =
=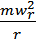
где Gk - центробежная сила, m-масса
частицы, r-радиус вращения, wr -окружная скорость.
Сепарирование применяется, когда
концентрация взвешенных частиц в жидкости, их размер не очень велики
Образовавшийся осадок балластных
веществ удаляется из культуральной жидкости, а очищенная жидкость подвергается
осаждению.
Осаждение - выделение целевого
продукта путем добавления к жидкости реагента, взаимодействующего с
растворенным продуктом и переводящего его в твердую фазу. Широкое
распространение, для выделения ферментов из водных растворов, получил метод
осаждения этанолом, изопропанолом и ацетоном. Добавление таких реагентов
вызывают потерю растворимости белковых молекул, и сопровождается образованием
осадка из-за снижения полярности среды в присутствии осадителя. В водной среде
энергия притяжения молекул фермента и диполей воды (энергия сольватации)
превосходит взаимопритяжение молекул фермента, в связи, с чем образуется
устойчивый раствор. При определенной концентрации органического растворителя
энергия сольватации становится меньше энергии связи между диполями воды и
молекулами растворителя, так как он обладает более сильной полярностью. В
результате сольватная оболочка белковой молекулы разрушается, что приводит к
коагуляции белка. При осаждении 2-2,5 объемами изопропанола активность
ферментов в осадках сохраняется на 93-95% от исходной, pH обрабатываемого
раствора 6,5-6,8.
Стандартизация ферментных
препаратов. Для получения постоянной активности в препараты вводится
наполнитель в определенном количестве, которое зависит от полученной активности
в культуре и препарате. Желательно, чтобы наполнитель по отношению к ферменту
выступал и в роли стабилизатора, а не просто инертного соединения. Известно,
что хорошим стабилизатором амилолитических ферментов хлористый натрий. С внесением
наполнителя в виде 1 % хлористого натрия показали возможность получения из
фильтрата культуральной жидкости и грибной культуры сухих амилолитических
ферментных препаратов с индексом ГЗх. Количество наполнителя можно рассчитать
по формуле:
S=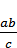 -b
-b
где S - количество наполнителя,
необходимое для получения стандартного по активности препарата, кг; а -
активность исходного препарата, ед. ФА/г; b - количество исходного препарата,
кг; с - стандартная активность препарата, ед. ФА/г/
Сушка - удаление влаги из твердых и
пастообразных материалов путем ее испарения и отводом образовавшихся паров.
Движущей силой этого процесса является разница давлений насыщенных паров над
влажным материалом и в газе.
Р = р* -р
Для обезвоживания ферментных
растворов применяют сушку в вакуум-сушильных шкафах, распылительных и
сублимационных установках. При высушивании ферментсодержащих материалов имеется
ряд трудностей, связанных с большой термолабильностью ферментов.
. Химический состав и
физико-химические свойства сырья и полуфабрикатов
Кукурузная мука. Является самым
дешевым продуктом из всех зерновых и ее цена зависит от степени измельчения
(помола).
Таблица 1.5. Химический состав сырья
|
Содержание
|
%
|
|
Крахмал
|
67-70
|
|
Другие углеводы
|
10
|
|
Белки
|
12
|
|
Глютетелин
|
30
|
|
Зеин
|
50
|
|
Количество зольных веществ
|
0,92
|
|
Ангидрид фосфорной кислоты
|
45
|
|
Окись калия
|
30
|
|
Окись магния
|
15
|
|
Влажность не должна превышать
|
15
|
Гидролизаты древесины. Сама
древесина является не очень «вкусным» сырьем для микроорганизмов, но после
предварительной обработки - высокотемпературного кислотного гидролиза -
превращается в гидролизаты. Целлюлоза и пентозаны гидролизуются до глюкозы и
других сахаров. Содержание сахаров зависит от породы древесины и технологии
гидролиза и составляет 4-8%. Кроме древесины можно использовать для тех же
целей различные целлюлозосодержащие сельскохозяйственные отходы (солому,
кукурузные кочерыжки, стебли хлопчатника и т.п.).
Дрожжевые гидролизаты в высушенном
виде содержат до 52% органического азота, в основном в виде аминокислот.
Кукурузный экстракт - отход
крахмалопаточного производства, получающийся путем упаривания жидкости от
замачивания («настоя») кукурузных зерен (замочная жидкость) с содержанием сухих
веществ не ниже 48%. В процессе замачивания происходит ферментный гидролиз
белков кукурузы, вследствие чего около половины азотсодержащих веществ
экстракта представляет собой смесь аминокислот, полипептидов и белков. Экстракт
- темная вязкая жидкость, содержит 6,4-8% общего азота, не более 24% золы. В
золу входят фосфор, калий, магний, причем фосфор - до 5%, частично в связанном
состоянии в виде фитина. Имеются также витамины группы В (биотин), ростовые
вещества и биостимуляторы. Таким образом, кукурузный экстракт представляет
собой хорошую смесь источника питания.
Продуценты. Плесневые грибы рода
Aspergillius, видов niger, orizae, usamii, awamori, batatae; рода Rhizopus,
видов delemar, tonkinensis, niveus, japonicum и др., а также отдельные
представители Neurospora crassa и Mucor.
Плесневые грибы очень широко
распространены в природе; основное место их обитания - почва. Несмотря на
наличие многих родов и видов плесневых грибов все они характеризуются
нитевидным строением тела и специфическим строением плодоносящих органов. Тело
гриба состоит из длинных переплетенных нитей сероватого или белого цвета,
называемых гифами. Гифы распространяются по поверхности питательного субстрата,
образуя мицелий и частично врастают в него. Некоторые гифы, поднимающиеся над
поверхностью в виде легкого пушка, имеют более сложное строение и представляют
собой органы плодоношения, называемые конидие или спорангиеносцами. У мукоровых
грибов на конце спорангиеносца находится шаровидное вздутие, окруженное
оболочкой, внутри которого образуются споры. У аспергиллов конец конидиеносца
имеет булавовидное утолщение, от которого отходят удлиненные клетки, называемые
стеригмами; от стеригм отшнуровываются более мелкие круглые клетки - конидии.
Отделившиеся конидии или споры,
попадая в благоприятные условия, начинают прорастать, затем гифы ветвятся,
образуя мицелий; при истощении питательных веществ в среде гриб переходит - в
стадию споро- или конидиебразования. Споры и конидии плесневых грибов содержат
пигменты, что и придает зрелым культурам характерную окраску.
Аспергиллы являются типичными
аэрофилами, поэтому они могут развиваться только на поверхности твердой или
жидкой среды или в жидкой, достаточно аэрируемой среде. Оптимальная температура
для, большинства аспергиллов 25-30°С, для некоторых - до 35°С. Большинство
грибов при поверхностном культивировании могут переносить кратковременное
повышение температуры до 40 и даже 45°С без заметной потери активности
ферментов. Оптимальная влажность среды для них около 65%.
Для питания аспергиллов необходимы
азотистые и минеральные вещества. В качестве источника углевода кроме
моносахаридов, многих олиго- и полисахаридов могут служить спирты и
органические кислоты, однако для накопления амилазы в среде обязательно должны
присутствовать крахмал, декстрины или мальтоза. На средах, содержащих другие
сахара, в том числе глюкозу грибы амилазы не образуют. Источником азота могут
быть белки и их гидролизаты, аммонийные соли и нитраты.
. Расчет теоретического выхода
целевого продукта
. Составляем предварительную
рецептуру синтетической питательной среды для выращивания биомассы:
компонент «С» - амилаза,
компонент «N» - кукурузный экстракт,
(NH4), НР04.
Компонент «О» - воздух.
. Составляем стехиометрическое
уравнение:
уА А + vВ+ v С→ +
+ F+
F+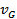 G (4.1)
G (4.1)
3. Для расчета стехиометрических
коэффициентов составим формулу биомассы бактерий.
Элементарный состав биомассы: С
-53%, Н-7%, N-12%, О- 20%, S-1% и золы -4%. В первом приближении формула
биомассы бактерий имеет вид:

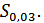
В гипотетической молекуле биомассы
не может быть дробных атомов, поэтому умножим коэффициенты на 100:  Н 700 0125 N 8б Р,0 S, В стехиометрических расчет допускается
пренебрегать малоколичественными элементами (S). Для расчетов принимают
молекулярную массу такой, чтобы в ней оказался I атом углерода. Для этого
поделим на 442: CH1,8O0,3N0,24
Н 700 0125 N 8б Р,0 S, В стехиометрических расчет допускается
пренебрегать малоколичественными элементами (S). Для расчетов принимают
молекулярную массу такой, чтобы в ней оказался I атом углерода. Для этого
поделим на 442: CH1,8O0,3N0,24
. Производим расчет С-моля биомассы
бактерий:
M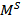 с-моль=пс ММС +п н ММ н
+ n 0 ММ 0 + n N ММ N (4.2)
с-моль=пс ММС +п н ММ н
+ n 0 ММ 0 + n N ММ N (4.2)
ММS с-моль=l *12+1.8* 1+0.5* 16+0.2*
14=30
Расчет С-моля субстрата определяют
исходя из формулы амилазы (С6Н1206)n так же как и для С-моля биомассы по
формуле (4.2). После деления коэффициентов на 6 она имеет вид: (СН2O)n (4.3).
Тогда молекулярная масса С-моля амилазы равна:
ММБМ с -моль=1
*12+1,8*1+0,5*16+0,2*14=24,6
. Определяем теоретический выход
биомассы по формуле:
= ММS c-моль/ММБМс-моль (4.4)
Подставив численные значения,
получим: УБМ=24,6/30=0.85
. Для определения количества
субстрата затрачиваемого биомассой на энергетические нужды рассчитываем
энергетический выход биомассы по формуле:
ɳ=γs/γx (4.5)
где γ
s,γ x- энергия, заключенная в субстрате и
биомассе соответственно.
Расчет величин γs и γл осуществляем,
используя степень восстановленное™ по элементам углероду, водороду, кислороду,
азоту.
. Степень восстановленности
С-моля амилазы рассчитаем по формуле:
γs=4m
+ 1n - 2р - 3q, (4.7)
где 4,1,2,3 - числа свободных
электронов, соответственно С, Н, О, N; m,n,p,q- индексы атомов при углероде,
водороде, кислороде, азоте соответственно.
Подставив численные значения,
получим: Γs
=4* 1+1 *2-2* 1=4
Аналогично рассчитаем степень восстановления
биомассы:
γs=4*
1 + 1* 1.8-2*0.5-3*0.19-3*0.2=4.2
Рассчитаем энергетический выход: ɳ =4/4.2=0.95
От этой величины можно перейти к
обычному выходу биомассы:
БМ=ɳ MMsс-моль/MMБМс-моль (4.9)БМ= 0.95*0.85=0.807
. Составляем стехиометрическое уравнение
для синтеза биомассы бактерий, исходя из теоретического выхода биомассы Y БМ =
0.85, т.е. из 1кг пектина образуется 0.807 кг биомассы. Общее стехиометрическое
соотношение обмена веществ имеет вид:
s [S]+ v02[O2]+ vNH3[NH3] →X +
vp[P]+ vco2[СО2]
По рецептуре на долю
углеродсодержащего сырья (кукурузной муки) приходится 2 кг с влажностью 10%.
Доля СВ 1.8 кг. Количество амилазы составляет:
Х=(1.8*22)/100 = 0.396 кг,
где 22 - содержание амилазы в
кукурузной муке (в %).
х = 0.9*7/100=0.063 кг, где 0.9 -
масса кукурузного экстракта, кг,
- содержание общего азота в
кукурузном экстракте, в %.
Азот из (NH4)2 НРО 4:
0.8*28/132=0.169 кг, где 0.8 - масса соли, кг,
- молекулярная масса соли, кг/кмоль
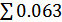 +
0.169 = 0.232 КГ
+
0.169 = 0.232 КГ
. Рассчитаем стехиометрические
коэффициенты обмена веществ.
=
0.396/2=0.198=0.232/(0.45=0.8)=0.186+ vNH3 *3 = 1.58 +
vpnp=(vsns+vNH3*3-1.8)/np= (0.198 * 7 + 0.186 *3 -1.8)/1256 = 0.0006=1 + vpmp
+vCQ2= vsms -1 - vpmp= 0.198 * 6 - 1 - 0.0006 * 510 = 0.178
Общее стехиометрическое соотношение
обмена веществ имеет вид:
((С6H12O6)n) + 0.186(NH3)→CH1.8O
0.3N 0.24 +
(C510H12560413N250) + 0.178(CO2)
. Особенности применения продукта в
производстве продуктов питания
амилаза биотехнологический
Амилазы находят применение почти во
всех областях, где перерабатывается крахмалсодержащее сырьё. Амилазы
используются для осахаривания зернового и картофельного крахмала. Самым большим
потребителем амилолитических ферментов является спиртовая и пивоваренная
промышленности, где в настоящее время солод (пророщенное зерно) успешно
заменяется амилолитическими ферментными препаратами. Эти препараты используются
в хлебопечении, а также в крахмалопаточном производстве для получения различных
видов паток, глюкозы и глюкозо- фруктозных сиропов. Амилазы используются для
улучшения качества концентратов и быстроразвариваемых блюд, большую перспективу
представляют амилолитические ферментные препараты для промышленности,
изготовляющей моющие средства. Там термостабильные и щелочеустойчивые амилазы
могут быть прекрасной биологической добавкой для снятия углеводных загрязнений.
Амилазы используются в текстильной промышленности для расшлихтовки тканей и
приготовления высококонцентрированных клейстеров крахмала в процессе крашения
тканей. В последнее время уделяется внимание использованию амилаз при
переработке различных крахмалсодержащих отходов в кормовые белковые препараты.
Высокоочищенные амилазы применяются для аналитических целей и в медицине.
В настоящее время большое внимание
уделяется разработкам схем по применению концентрированных ферментных
препаратов в хлебопечении. Показано, что ферментные препараты могут быть широко
использованы в качестве улучшителей хлебопекарных свойств как пшеничной, так и
ржаной муки. При добавлении препарата амилоризина П 10х в количестве 0,002-
0,004 % к массе муки повышается удельный объём хлеба, существенно улучшаются
физико- механические свойства мякиша, становится более интенсивной окраска
корки и более приятным вкус и аромат. Амилолитические препараты из Asp.oryzae и
A. awamori оказывают положительное влияние на процесс приготовления заквасок и
жидких дрожжей. В связи с улучшением бродильной активности заквасок и жидких
дрожжей сокращается продолжительность брожения полуфабрикатов на 25- 30 % и
длительность расстойки при одновременном улучшении качества хлеба. Нельзя
забывать о том, что в подавляющем большинстве случаев ферментные препараты
представляют собой комплексы большого числа ферментов. При действии этих комплексов
может присходить не только гидролиз крахмала, но и гидролиз других компонентов
муки. С этой точки зрения весьма нежелательно присутствие в препаратах активных
протеиназ. Отмечено, например, что протеиназа препарата П 10х Asp. Oryzae
оказывает отрицательное воздействие на клейковину муки из мягких пшениц. В то
же время она неоходима при переработке муки из твёрдых пшениц, когда
воздействие фермента на недостаточно эластичную клейковину дает положительный
эффект. В последнее время обращено внимание на использование в хлебопечении
препаратов, содержащих активную глюкоамилазу. Особая роль отводится препаратам
из Asp. Awamori и Rh. Delemar, содержащих малоактивную протеиназу.
В пивоваренном производстве главная
задача- получить высокий выход экстрактивных веществ из перерабатываемого
сырья. Основным сырьём здесь является солод. Выход экстракта находится в тесной
взаимосвязи с активностью гидролаз, образованных при солодоращении и со
степенью растворения солода. Особенно велика роль амилаз. Она заключается в максимальном
извлечении крахмала из солода и переводе этого субстрата и сбраживаемые
углеводы. Однако в пивоварении в противоположность спиртовому производству не
стремяться осахарить конечные декстрины. Они необходимы в сусле, поскольку в
дальнейшем создают полноту вкуса пива, в определенной степени обуславливают его
пеностойкость.
Гидролиз крахмала в сбраживаемые
сахара (мальтозу, глюкозу) и конечные декстрины осуществляется в процессе
затирания. Основными факторами, с помощью которых регулируют специфичность и
интенсивность действия амилаз, являются температура и pH среды. Интервал
температур 60- 65"С является оптимальным для образования сбраживаемых
сахаров. В интервале температур 70- 75"С происходит быстрый перевод
крахмала в экстракт с образованием большого количества декстринов. Регулируя
продолжительность эти двух температурных фаз, можно добиваться оптимального
соотношения между количеством сбраживаемых сахаров и декстринов, определенной
степени сбраживания пива, его высокой коллоидной стойкости и пеностойкости.
Важное значение здесь имеет не только активность амилаз солода, но и их
различная термостабильность.
Существенное влияние на гидролиз
крахмала при затирании окозывает концентрация Н - ионов. При высоких значениях
pH (6,2-6,5) скорость гидролиза крахмала уменьшается, замедляется фильтрация
сусла, а пиво становится менее стойким при хранении. Оптимальным pH при
затирании следует считать 5,3- 5,6, чего можно достичь внесением в затор
молочной кислоты.
Список используемой литературы
1. Иванова А.А. Л.И. Войно,
И.С. Иванова. Пищевая биотехнология. М.: Колос С, 2008 - 427 с.
2. Грачева И.М. Технология
ферментных препаратов - М.: Агропромиздат., 2008 - 358с.
. Бирюков В.В. Основы
промышленной биотехнологии: Учеб. пособие для вузов. - М.: Колосс, 2004.
. Кислухина О. В.
Ферменты в производстве пищи и кормов. Издательство: М.: ДеЛи принт, 2002 г
. Кулев Д.Х., Шарова
Н.Ю. Биосинтез и выделение лимонной кислоты и амилолитических ферментов.
Издательство. М., ДеЛи принт, 2008.
. Сайты: Биотехнология,
Ферменты
. Патенты РФ, источник -
www.fips.ru