Получение 2-метилпропена дегидратацией 2,2-диметилэтанола-1
Дипломная работа
ПОЛУЧЕНИЕ 2-МЕТИЛПРОПЕНА
ДЕГИДРАТАЦИЕЙ
,2-ДИМЕТИЛЭТАНОЛА-1
Аннотация
В работе рассмотрен метод получения 2-метилпропена
(дальше изобутилена) дегидратацией 2,2-диметилэтанола-1 (дальше третбутилового спирта).
Представлен обзор возможных методов получения изобутилена. Проведен анализ
основной реакции (рассмотрены физические и химические свойства реагентов, их
электронная структура). В работе разобрана кинетика и механизм реакции.
Особое внимание уделено термодинамическому расчету и выбору типа
реактора. Приведены расчеты материального и теплового баланса. Представлена
операторная модель химико-технологической системы.
Работа содержит ХХ страниц, 8 рисунков, 5 таблиц, 48 литературных ссылок.
Содержание
Введение
. Литературный обзор
.1 Методы получения целевого продукта
.1.1 Получение изобутилена дегидрированием изобутана
.1.2 Получение изобутилена дегидрированием бутановой фракции
с последующей изомеризации
.1.3 Методы извлечения изобутилена из углеводородной фракции
С4
1.1.4
Получение изобутилена из втор-бутил хлорида
.1.5 Получение изобутилена из трет-бутил хлорида
.1.6 Получение изобутилена из трет-бутилмеркаптана
.1.7 Получение изобутилена из диизобутилена
.1.8 Получение изобутилена из триизобутилена
.1.9 Получение изобутилена из втор-и-н-бутанолов
.1.10 Получение изобутилена из изобутанола
.1.11 Получение изобутилена из трет-бутилового спирта
.1.12 Другие методы получение изобутилена
.2 Анализ основной реакции
.2.1 Физические свойства реагентов и продуктов реакции
.2.2 Электронная структура реагентов и продуктов реакции
.2.3 Химические свойства реагентов и продуктов реакции
. Термодинамический анализ основной реакции
.1 Подготовка исходной информации
.2 Расчет термодинамических функций
. Кинетика и механизм реакции получения изобутилена
.1 Механизм реакции и его обоснование
.2 Анализ факторов, влияющих на основную реакцию
.2.1 Влияние строения субстрата
.2.2 Влияние строения атакующей частицы
.2.3 Влияние строения уходящей группы
.2.4 Влияние растворителя
.3 Катализ основной реакции
.4 Кинетическая модель реакции
. Выбор типа реактора
.Расчет реактора
.1 Материальный баланс
.2 Тепловой баланс
.3 Расчет объема реактора
. Операторная модель химико-технологической системы
Вывод
Список литературы
Введение
Изобутилен является важнейшим и достаточно многотонажным мономером
алифатического ряда.
Впервые он был выделен из продуктов высокотемпературного разложения
животных жиров и описан Фарадеем в 1825 году.
Чистый изобутилен получен Бутлеровым в 1868 году по
реакции дегидратации трет-бутилового спирта разбавленной серной кислотой
При вдыхании изобутилен оказывает наркотическое
действие [1]. Интенсивность токсикологического действия зависит от концентрации
мономера и индивидуальных особенностей организма. Признаки отравления:
расстройство желудка, головная боль и тошнота. На более поздней стадии
наблюдается расстройство зрения и потеря сознания. Длительное пребывание в
загазованном помещении может привести к смертельному исходу.
При хранении и работе с изобутиленом необходимо соблюдать правила техники
безопасности, общие для всех горючих веществ.
На сегодняшний день на основе изобутилена получают синтетические каучуки:
изопреновый, полиизобутеленовый, пластмассы, топливо, смазки, присадки к
маслам, поверхностноактивные вещества, разнообразные добавки и другие продукты,
которые используются практически во всех отраслях народного хозяйства. На
волжском заводе ОАО ”КАУЧУК” используют изобутилен для производства метил
третбутилового эфира - высокооктановой добавки к бензину, а также изделий из
пластмассы.
Исходя из вышесказанного, следует, что потребность в изобутилене
постоянно растет.
Многие аспекты химии и технологии изобутилена и продуктов на его основе
не ясны и, в лучшем случае, дискуссионные. Поэтому глубокий интерес к
фундаментальным и перспективным исследования изобутилена поддерживается уже
много десятилетий и постоянно стимулируется новыми экспериментальными данными.
Таким образом, проблема получения изобутилена актуальна и на сегодняшний
день, при этом, достаточно хорошо разработана в научной литературе.
Целью данной работы является формирование химической концепции процесса
дегидратации трет-бутилового спирта, как метода получения изобутилена.
Для реализации вышеуказанной цели необходимо решить следующие задачи:
. Выполнить теоретический анализ предложенного метода, рассмотреть
особенности химической реакции, термодинамики, кинетики и механизма изучаемой
реакции.
. Сделать выбор типа реактора, осуществить расчеты теплового и
материального балансов, объема реактора и поверхности теплообмена.
. Предложить операторную схему получения изобутилена.
1. Литературный обзор
.1 Методы получения целевого продукта
Процессы получения изобутилена можно разделить на две
большие группы: специализированные процессы с максимальным выходом изобутилена
или фракции углеводородов С4 и процессы, в которых они являются
побочными продуктами.
Первая группа включает: 1) высокотемпературный пиролиз
жидкого и газообразного сырья - сухие газы переработки нефти, попутные газы
нефтедобычи, этан, пропан, бутаны, прямогонные и газовые бензины, в отдельных
случаях рафинаты каталитического риформинга (после извлечения ароматических
углеводородов), газойлевые фракции, нефть и нефтяные остатки; 2) термический
крекинг высокомолекулярных парафинов, полученных при переработке нефти; Эти два
метода сопровождаются побочными нежелательными реакциями деструкции
образовавшихся олефинов, их гидрирование и дегидрирование. 3) селективную
полимеризацию или деполимеризацию полимеров олефинов;
4) каталитическое дегидрирование парафинов (бутаны, пентаны, нормальные
парафины); 5) дегидратацию спиртов; 6) реакции изомеризации и т.д.[1].
Рассмотрим более подробно некоторые из этих методов.
1.1.1
Получение изобутилена дегидрированием изобутана (И)
Данный процесс протекает по реакции:
(CH3
)3 ─CH (CH3 )2C=СH2 + H2
Для протекания реакции дегидрирования оптимальна
температура 550- 600 °С [2]. Повышение температуры вызывает нежелательные
реакции крекинга. С повышением давления глубина дегидрирования изобутана
в изобутилен заметно уменьшается. Наиболее подходящими катализаторами являются
алюмохромовые соединения. В промышленности выход изобутилена в реакторах
секционного типа с псевдоожиженным слоем катализатора составляют не менее 42
масс.% на пропущенный и 82 масс.% на разложенный изобутан [1]. Запатентован
метод дегидратации изобутана в присутствии азота [3].
1.1.2
Дегидрирование бутановой фракции с последующей изомеризацией в изобутилен
Процесс
протекает по следующей схеме
CH3─ CH2 ─CH=CH2 бутилен
н CH3─ CH2
─CH2─CH3
CH3─ CH=CH─CH3 транс-бутилен
CH3─ CH=CH─CH3 цис-бутиле
Примерный состав продуктов реакции дегидрирования н-бутилена
следующий: 34 масс.% н-бутилена, 38 масс% транс-изомера и 28 масс.% цис-изомера
[2].
В качестве катализатора используют оксид хрома на оксиде
алюминия. Температура процесса 497-502 0С [2]. Изомеризация a,b-бутиленов в изобутилен
проходит при 302-542 0С. В качестве катализатора применяют Н3РО4
на силикагеле, кремнеземе или шамоте; А12О3 и другие [4].
Изучением этой реакции занимались Херд, Голберт, Тропш, Перриш
и Этлор [4]. Тропш пришел к выводу, что изомеризация требует затраты энергии в
количестве 58102 кДж. Это подтвердилось работами Форста, Ридковского и
Серябряковского [4].
Токиямо Йосихиро [5] изучил процесс дегидрирования бутана и последующей
изомеризацию a-бутена
в изобутилен при 5000С; в качестве катализатора применялась платина нанесенная
на силикаты железа. Бекхет [6] изучил изомеризацию н-бутена в изобутилен
на кремнийалюминиевых катализаторах.
Чен Хонг-во [7] установил, что селективность изомеризации возрастает при
введении ZSM-23, в качестве катализатора к
ферритному углеводороду на микропористой структуре. Для увеличения
селективности Пеллет Ригис [8] использовал в качестве катализатора цеолиты при
температуре 360-650 0С.
В промышленности Хорев и Морозов [9] запатентовали метод
изомеризации н-бутана при температуре 160-200 0С на катализаторах
состава: Cu2O3 40-50
масс%, Ni2O3 25-40 масс.%, Fe2O3 0.2 масс.%, остальное SiO2.
По данным Саматкина и Киямовой [10] в декабре 1995 года в России в ОАО
НИХХ введено в эксплуатацию производство изобутилена изомеризацией н-бутиленов.
В качестве катализатора используется А12О3
при температуре не выше 5400С. Производительность установки
8-16 т/ч.
При изомеризации углеводородов фракции С4 с
последующим дегидрированием в изобутилен, изомеризация бутановой фракции
проводится на катализаторах А1Сl3, А1Вг3, ВР3, НС1 и т.п.
Дегидрирование изобутана на хромалюминийоксидных катализаторах проводится по
непрерывной схеме при температуре 537-6020С [2].
Выход изобутилена при 50% конверсии достигает 42% при
селективности 82% (в пересчете на изобутилен) [1].
Мирзабекова и Мамедов [11] заявили метод конверсии
изобутилена при 610-6800С в присутствии СО2 на
катализаторах, содержащих: 2-6 масс.% Сr, 2-6 масс.% Mn закрепленных на А12О3.
В результате реакции дегидратации получают
бутан-изобутиленовую фракцию углеводородов из которой сначала извлекают
бутадиен, а потом изобутилен.
1.1.3
Метод извлечения изобутилена из фракции С4.
Гютенборг [12] выделял два основных метода извлечения: а) физический,
включающий в себя абсорбцию, экстракционную и азеотропную дистилляцию, а также
ректификацию; б) химический основанный на взаимодействии изобутилена с
различными органическими веществами. В качестве физических методов большинство
фирм используют метод жидкой абсорбции. Абсорбентом может быть керосиновая
фракция. При этом исходный газ может содержать: 21,2% СН4, 12,1% С3Н8,
47,5% н-С4Н10 и 19,1% изобутилена. Абсорбент движется
частично противотоком, частично прямотоком по отношению к газу. Изобутилен
абсорбируется практически нацело [4].
Поскольку компоненты фракции С4. имеют весьма
близкие температуры кипения, то добавление соответствующих агентов, уменьшает
упругость паров различных углеводородов и увеличивает их летучесть, улучшает
фракционную разгонку смеси. Если добавленный агент находится в остатке, то
такой процесс называется экстрактивной дистилляцией. Если же агент уходит с
дистиллятным паром, то это азеотропная дистилляция. Ректификация обычно служит
для предварительной очистки изобутилен-изобутановой фракции.
В химических методах извлечения изобутилена из фракции С4
наиболее часто применяются:
а) сернокислый метод. Этот метод основан на исследованиях
А.М. Бутлерова, который еще в 1873 году показал, что в результате
взаимодействия разбавленной Н2SO4 (при концентрации 55-65 % и
температуре -13-42 0С) [1] с изобутиленом образуется бутилсерная кислота по
реакции:
(CH3)2C=CH2
+ Н2SO4 ® (CH3)3C-ОSO3H
При этом протекают реакции олигомеризации
(преимущественно ди - и триизобутиленов), но потеря изобутана при этом
невелика.
Изобутилсерная кислота при разбавлении водой
гидролизуется с образованием трет-бутилового спирта:
(CH3)3C-ОSO3H → (CH3 )3CОН + Н2SO4
Рядом исследований было показано, что чем выше
концентрация кислоты (в пределах от 45 до 70%), тем больше возможность
поглощения (кроме изобутилена) других углеводородов; чем ниже концентрация
кислоты, тем медленнее идет этот процесс [1]. Температура также оказывает
большое влияние на взаимодействие углеводородов с серной кислотой: повышение температуры
способствует развитию процессов полимеризации. Извлечение изобутилена лучше
проводить при температурах 10-30 °С.
Изобутилен абсорбируется 65%-ной серной кислотой на
холоду почти количественно. При низких температурах (от -10 до + 10 °С) потери
изобутилена в результате полимеризации невелики. При работе с концентрированной
кислотой необходимо сильно охлаждать реакционную смесь, так как в противном
случае легко образуются полимеры. Кроме того, в реакцию с концентрированной
кислотой вступают и другие ненасыщенные углеводороды.
Реакция между серной кислотой и углеводородами С4 идет в
тонком слое на поверхности кислоты. Поэтому для успешного поглощения
изобутилена серной кислотой необходимо интенсивное перемешивание реагирующих
веществ [13].
б) извлечение изобутилена из фракции С4
с использованием ионообменных полимеров (сульфинированные сополимеры
с дивинилом типа КУ-2 и др.)
Так же, как и в сернокислом способе, включает гидратацию
изобутилена в трет-бутилового спирта и последующую дегидратацию спирта в олефин
[12]. Особенностью метода является отсутствие высокоагрессивных коррозионных
сред, возможность многократного использования катализаторов и высокая (99,95
масс.%) чистота получаемого изобутилена [1]. Клименко, Верховная, Менилло [12]
изучали эффективность большинства отечественных катализаторов. Наиболее
активным оказался КУ-2.
В промышленности реализован метод извлечения
изобутилена из фракции С4 взаимодействием трет-олефина со
спиртом на ионных катализаторах макропористой структуры Амберлис-25, а также
SiO2∙А12О3 или
активированного угля с помощью разложения трет-бутилового эфира при температуре
37-202 °С.[1]
(CH3 )2C=CH2 + CH3ОН катионит (CH3 )2C+О─ СН3
(CH3 )2CОСН3 катионит (CH3 )2C=CH2 + Н2O
К.Г. Шароноав и А.М Рожков [14] выделили изобутилен пиролизом или
каталитическим воздействием спиртов за счет реакции изобутилена с изобутаном с
последующим разложением эфира. Ими же заявлен способ выделения изобутилена при
температуре 90─115 °С и давлении 0,1─0,2 мПа в присутствии
кислотного крупно пористого ионита [15]. С.Ю. Павловым и И.П. Карповым [16]
запатентован метод получения изобутилена из метил-трет-бутилового эфира в
присутствии гетерогенных катализаторов, температуре 45─80 °С и давлении 1─3
ата.
Л.С.Кофман выделял изобутилен с помощью СаО при температуре 0─80 °С
[2]. В.Н. Забористовым и Р.М.Яруллиной запатентован метод выделения изобутилена
на анионообменных смолах типа [N(CH3)3]+OH─, =NН,
при температуре 18─30°С [17].
В промышленности используется метод, основанный на обработке фракции С4 раствором CH3Cl и HCl c последующей
дегидратацией трет-бутилового спирта [12].
Далиным и Письманом [18] запатентован метод выделения изобутилена из фракции С4 при температуре 190─200
°С и давлении 4─6 атм. В качестве катализатора использовался g-А12О3. В США запатентован метод выделения
изобутилена из фракции С4 на катализаторах
РbО3,
нанесенных на А12О3 [19].
1.1.4
Метод получения изобутилена из вторичного бутилхлорида
Процесс протекает по следующей реакции:
CH3─ CHCl ─CH2─CH3
→ (CH3
)2C=CH2 + НCl
Для получения изобутилена из вторичного бутилхлорида
необходимо, чтобы отщепление хлористого водорода сопровождалось изомеризацией
углеводородного скелета. Жессю [4] обрабатывал н-бутилены хлористым водородом,
получая вторичный бутилхлорид. Последний пропускался при 300-500°С над
металлхлоридными катализаторами типа А1С13 или ВеС12. В
полученном газе содержался изобутилен, который Жессю поглощал 60%-ной серной
кислотой.
1.1.5
Метод получения изобутилена из третичного бутилхлорида
Процесс протекает по следующей реакции:
(CH3
)3ССl → (CH3 )2C=CH2 + НCl
Нефт [4] получил изобутилен, пропуская бутилхлорид
через слой пемзы нагретой до температуры 400-500°С. Если пемзу заменить Са(ОН)2,
то отходящие газы будут содержать только изобутилен. В одном из немецких
патентов [4] предложено получать изобутилен из
третичного бутилхлорида, либо путем каталитического отщепления НCl, либо путем омыления алкилхлорида
водой с дегидратацией образовавшегося трет-бутанола.
Согласно другим источникам, возможно провести данные реакции при
температуре не более 260°С в присутствии инертного
углерода. В США [4] запатентован метод, в котором реактор-колонна
заполняется алифатической маслянистой фракцией. Колонна работает при
температуре верха 54,4°С и температуре низа
260°С. Образующийся НCl отводят сверху в виде паров, а изобутилен отгоняют из смеси
с маслом дистилляцией.
1.1.6
Метод получения изобутилена из третичного бутилмеркаптана
Метод основан на реакции:
(CH3
)3СSH → (CH3 )2C=CH2 + Н2S
В США третичный бутилмеркаптан разогревают до 100°С
или 230-400°С и пропускают через пустотелый
или заполненный катализатором реактор. В качестве катализатора используют Н2SO4 или Н3РO4. Время контакта колеблется от
нескольких секунд до многих минут. Продукты разложения промывают
трикалийфосфатом для удаления Н2S. Затем промывают NaOH, чтобы удалить непрореагировавший меркаптан [4].
1.1.7
Метод получения изобутилена из диизобутилена
Метод основан на реакции:
(CH3
)3С-CH2-С(CH3)=CH2 →
2(CH3 )2─CH=CH2
Деполимеризацию ведут при температурах
175-370 °С над активным глиноземом, над фосфорной кислотой на носителе
кизельгуре.
При соответствующем выборе температуры
можно осуществлять такой процесс, при котором над катализатором пропускается
смесь низкомолекулярных полимеризатов моно- и диолефинов, а деполимеризации
селективно подвергаются только те углеводороды, которые при расщеплении
образуют изобутилен. Именно такой процесс был запатентован в США группой
исследователей [1]. В качестве катализаторов они используют фуллерову землю,
активированный бентонит или окись алюминия, а также фосфорную кислоту в чистом
виде или на носителях. При пропускании над этими катализаторами при 315-425 °С
смеси, содержащей низкомолекулярные полимеры изобутилена, нормального бутилена
и дивинила, а также низкомолекулярные сополимеры изобутиленов, н-бутиленов и
дивинила, расщепляется только полимер изобутилена при определенной объемной
скорости. При деполимеризации диизобутилена активность катализатора зачастую
очень быстро падает, так как на его поверхности отлагается кокс. В одном из
патентов [4] поэтому рекомендуется работать с поверхностно-активным
алюмосиликатным катализатором, крекирующая способность которого уменьшена за
счет обработки паром при 690° С.
В США также запатентован процесс
деполимеризации диизобутилена в псевдоожиженном слое катализатора, причем этот
процесс протекает в особенно мягких условиях [4]. Катализатором служит
синтетический гель SiO2 - А12О3, содержащий 12 масс.% А12О3.
Сырье, диизобутилен, подается в реактор на уровне кипящего слоя. При
температуре 525 °С и скорости газа 0,5-2 -м/с диизобутилен деполимеризуется
в изобутилен.
В промышленности для деполимеризации используется
активный глинозем над Н3РO4 при
температуре 179-370 °С [4]. По данным Усенко и
Гусейнова [20] цеолиты, содержащие каолин и бетаин дают высокий выход
изобутилена. В патенте Гусейнова и Муханглинского [21] в присутствии СО2
и О2 на цеолитах NaX, NaX-3X, NaX-3Y при температуре 250-400 °С получается высококонцентрированный
изобутилен.
1.1.8
Метод получения изобутилена из триизобутилена
Процесс описывается реакцией:
С12
Н24 → 3(CH3
)2C=CH2
изобутилен
реагент реакция дегидратация
Деполимеризация триизобутилена, по всей вероятности, идет
через промежуточную стадию диизобутилена. За это говорят наблюдения Лебедева и
Коблянского [4], которые над флоридином как катализатором получили диизобутилен
и изобутилен. Это наблюдение подтверждается количественными исследованиями
Лебедева и Лившица [4], которые обнаружили в продуктах реакции, проведенной при
180-190 °С, 27,1% изобутилена и 65,6% диизобутилена [4]. Оболенцев в качестве
катализаторов использовал алюмосиликаты при температурах 200, 300, 367 °С.
Гринсфольд и Воуг расщепили триизобутилен при температуре 350 °С над SiO2-─ZrO2-─ А12О3
с очень большим выходом. Для промышленного процесса справедливо все, что
говорилось о процессе деполимеризации диизобутилена. Запатентован [1] процесс
термической (при температуре 230-260 °С ) и каталитической (при 205-230 °С,
катализатор - флоридская земля и глинозем ) деполимеризации.
Также применяется термоокислительная деструкция полиизобутиленов,
запатентованная Сангаловым и Минскером [22]. Процесс проходит при 200-400° С на катализаторах строения Ме+ (R Al Hal3 )─.
1.1.9
Метод получения изобутилена из втор- и н-бутиловых спиртов
Процесс протекает по следующей схеме:
CH3
-CH2-CH2-CH2ОН → (CH3
)2C=CH2 + Н2O
Сандеран, используя в качестве
катализатора А1РО4, получил из первичного н-бутилового спирта при
300 °С 27 % изобутилена [4].
Из вторичного бутилового спирта изобутилен
получал Ипатьев. Он пропускал при 450 °С через медную трубку, заполненную ZnCl2, вторичный бутиловый
спирт, получая при этом газ с высоким содержанием изобутилена [1].
Согласно одному из патентов [4],
н-бутиловый спирт при температурах порядка 250- 320 °С пропускается в паровой
фазе над катализаторами из глинозема и оксида магния, кислой земли и (или)
кизельгура. Образуется изобутилен в результате дегидратационной изомеризации.
По другому патенту процесс проводится по такой же схеме, причем катализатором,
над которым пропускается парообразный спирт, служит бетонит, к которому может
быть добавлен глинозем.
1.1.10
Метод получения изобутилена из изобутанола
Процесс протекает по следующей схеме:
(CH3 )2CН− CH2
−ОН →
(CH3 )2C=CH2 + Н2O
Будучи связана с разрывом одной связи С-Н и одной связи С-ОН,
эта реакция эндотермическая и протекает с приемлемыми выходами только при
повышенных температурах.
Отщепление воды от изобутанола может осуществляться как
мокрым, так и сухим путем, т.е. либо в водном растворе, либо в безводной среде,
чаще всего в паровой фазе [4]:
1). Отщепление воды от изобутанола мокрым
путем.
Наилучшим реагентом для этой цели является
серная кислота. При подогреве изобутилового спирта с 3-4 масс.% серной кислоты
при 140-150 °С начинает бурно выделяться изобутилен [2]. При добавлении
сульфата алюминия реакция начинает идти достаточно интенсивно и при более
низкой температуре порядка 120-125 °С [1]. Коновалов [4] нагревал изобутанол,
серную кислоту, воду и известь (в соотношении 1:1:0,25:0,05) до равномерного
газообразования. При этом был получен газ, состоявший на 2/3
из изобутилена и на 1/3 из н-бутиленов.
Лермонтов применил, при том же соотношении компонентов,
стеклянный порошок вместо извести, а Хелль и Ротберг - кварцевый песок [4].
). Отщепление воды от изобутанола сухим путем. Для отщепления
воды от изобутанола сухим путем ле Бель и Грин использовали в качестве
катализатора хлорид цинка, расплавляя его в бутыли, после чего в эту бутыль
вливали по капле изобутиловый спирт [1]. Фаворский и Дебу усовершенствовали
этот метод, вводя изобутанол под поверхность расплавленного хлорида цинка [1].
Нэфт использовал в качестве катализатора пятиокись фосфора на пемзе и получил
при 430-480 °С 72% изобутилена и 28% н-бутиленов [4]. Мэль и Де Годон
дегидратировали изобутанол при 185-190 °С над обезвоженными квасцами [4].
Современные процессы получения изобутилена
каталитической дегидратацей изобутанола основаны на работах Ипатьева, который
проводил свои опыты при 500-600 °С в обогреваемых трубках, наполненных хлоридом
цинка или осколками битых графитовых тиглей [4]. Сабатье получал изобутилен из
изобутилового спирта при 300-340 °С. В качестве катализаторов он использовал
группу дегидратирующих окислов, синюю вольфрамовую бронзу (М2О-W2О5 ХWО3), ториевую
землю (ТhО2)
и окись алюминия.
В работах Андрианова и Андреева [4] окись
алюминия также служила катализатором при получении радиоактивного изобутилена.
Множество работ посвящено выбору носителей для катализатора. Рид и Присли
[4] использовали пемзу в качестве носителя для
окиси алюминия и дегидратировали спирт при 450-475 °С. Коффин и Маас работали с
глиноземом, дегидратируя спирт при 250-300 °С [1]. Слисаренко и Чен [4] при 450
°С получили из изобутанола над природными саратовскими глинами изобутилен
чистоты 79 %.
Следует отметить, что данный способ сопровождается изомеризацией и полимеризацией, и это подтверждается в работах Ипатьева, Сабатье, Матиньон, Мурэ и Доде [1].
Известен способ получения изобутилена разложением
изобутилового спирта в трубчатом реакторе. В качестве теплоносителя используются
пары ртути [23].
1.1.11
Метод получения изобутилена из трет-бутилового спирта
Процесс протекает по следующей реакции
(CH3 )3C-ОН → (CH3 )2C=CH2 + Н2O
При дегидратации трет-бутилового спирта
мокрым путем в качестве дегидратирующего агента Бутлеров использовал
разбавленную серную кислоту [4]. Точно также и Сандеран получил при 83 °С в
присутствии 3-4 масс.%. серной кислоты чистейший изобутилен из трет-бутилового
спирта [4]. Другие авторы рекомендуют для дегидратации при атмосферном давлении
серную кислоту крепостью не выше 50 %, лучше - 30%, и температуру 70-85 °С [1].
Добавление 0,02-0,5 моля сульфатов двухвалентных металлов увеличивает выход
изобутилена и снижает склонность последнего к полимеризации.
По данным Ипатьева и Монро [4],
дегидратация производится при температурах 100-400° С и давлении до 300 атм с
помощью водных растворов крепких кислот концентрацией не более 5 масс.%.
или же солей, которые, гидролизуясь, дают такие же значения рН (3-7). По этому
методу в присутствии очень небольших количеств водного раствора хлорида никеля
при температуре 200°С и давлении 112 атм из трет-бутилового спирта было
получено 84% изобутилена. Л. Густаво и Л. Эдгаро [24] проводили дегидратацию
трет-бутилового спирта в присутствии ZrO2 и вольфрама. А. Филиппо и М. Надери [25]
предлагают для этих же целей использовать основные катализаторы EST-10, ETAS-10 и AM-6. Некоторые авторы
предлагают использовать в качестве водоотнимающего агента помимо серной и
фосфорной, щавелевую и бензосульфо- кислоты, а также некоторые соли типа K2SO4, СuSO4, ZnCl2 [26].
Гусейновым и Муханглинским [27]
запатентован метод, где в качестве катализатора используется цеолиты состава Na2O3: Al2O3: 2.5×SiO5, при температуре
200-300°С и водном растворе трет-бутилового спирта.
Исследуя дегидратацию третичного
бутилового спирта сухим путем, Ипатьев пропускал 70 г трет-бутилового
спирта при 480-500 °С через стеклянные или фарфоровые трубки, наполненные
осколками графитовых тиглей, и получал при этом в течение 16 минут 18 литров
газа, представлявшего собой почти чистый изобутилен [4]. Точно так же
Щитовецким над глиноземом был получен чистый изобутилен [1]. Сандаран
дегидратировал третичный бутиловый спирт над фосфатом, силикатом и
сульфатом алюминия [4]. При попытках дегидрировать трет-бутиловый спирт над
медью, высаженной на оксидах тория или алюминия, вместо дегидрирования
произошла дегидратация [4].
Как и в случае изобутилового спирта,
третичный бутиловый спирт может быть дегидратирован с помощью
катионообменников. Зюссманн дегидратировал третичный бутиловый спирт над
катионообменником типа сульфонированного угля «Зеокарб Н» в кипящем ксилоле
[4]. При нагреве трет-бутилового спирта с катионообмениками, полученными путем
поликонденсации сульфонированных фенолов с формальдегидом, трет-бутиловый спирт
дегидратировался на 73% с образованием изобутилена [4]. Каспелло и Абелла [28]
использовали ионообменные смолы типа Амберлис-15 в периодическом реакторе при
температуре 50-76 °С и в непрерывном при 80°С. Обенаус и Гревинг запатентовали
способ получения изобутилена на ионообменной смоле - сульфонированном
сополимере стирола и дивинилбензола при 90-140 °С и давлении 0,2-0,25 атм.
использованием трет-бутилового спирта в виде 60-90 масс.% водного раствора, с
последующим разделение смеси путем перегонки. Селективность изобутилена
составляет 99,98 % [29].
Промышленный процесс дегидратации трет-бутилового спирта
осуществляется над катализатором оксидом алюминия [4]. Также разработан метод
получения изобутилена путем реактивной дистилляции при температуре не
выше 100 °С и давлении 50-101 кПа [30]. Петерс [1] разработал метод
дегидратации трет-бутилового спирта в реакционно-дистилляционной колонне. В
качестве катализатора использовались катиониты при температуре 90°С. Выход
изобутилена составлял 97 %.
Изучен метод разложения трет-бутилового спирта на смоле
КУ-2ФПП [31]. Изобутилен-ректификат получается чистоты 99,9%.
1.1.12
Другие метод получения изобутилена
─ пиролиз неопентана или аренов [1]:
При температуре 577 °С протекает следующая реакция:
(CH3 )4С → (CH3
)2C=CH2 + СН4
а при температуре 412 °С протекает следующая
реакция:
С6 Н5─С(CH3
)3 →
(CH3 )2C=CH2 + С6 Н6
─ олигомеризация этилена:
В США запатентован метод олигомеризация этилена на
катализаторах ZSM35 (SiО2, Al2О3, H2О, Na) с образованием
изобутилена [32].
─ получение изобутилена из синтез-газа:
Комиджа Теруаки исследовал этот метод, используя в качестве
катализаторов ZrО2 [33].
─ получение изобутилена с помощью металлорганических
соединений.
Такие реакции протекают аномально, т.к. вместо присоединения
трет-бутильного радикала к углероду происходит восстановление группы С=О [1].
(CH3)3С(О)-Cl + 2СH3─C(CH3)2MgCl →
→
2 (CH3)2C=CH2 +
(CH3)3С-CH2ОMgCl + MgCl2
─ получение изобутилена из ацетона:
Данный процесс протекает при температуре 167-452°С на
алюмосиликатах по следующей реакции:
(CH3 )2С=О ® (CH3 )2С=СН-С(О)- CH3 + Н2O ®
(CH3 )2C=CH2 +CH3 СООН
А.И. Башкиров получил изобутилен из ацетоновой
смеси при 300-500 °С на кремнийвольфрамовых катализаторах [34].
─ получение изобутилена и пропилена:
Современный способ получение изобутилена и пропилена,
запатентован Миначевым и Ходяковым. Пиролиз изобутана проводят при 500-700 °С
на углях БАУ, АТИ, КАД. Выход изобутилена составляет 15 -30 %, пропилена 10-25
%. Суммарная селективность 82-60 % [35].
Обоснование
выбора реакции.
Дегидратация третичного бутилового спирта
имеет историческое значение, так как именно с помощью этой реакции Бутлеров в
1868 г. впервые получил чистый изобутилен путем отщепления воды от спирта [4].
Эта реакция подвергалась многим исследованиям, которые показали, что третичный
бутиловый спирт легко дегидратируется. В дальнейшем мы будем рассматривать
именно эту реакцию, поскольку разрыв связи С─ОН в данном случае
происходит значительно легче по сравнению с другими спиртами. Теплоемкость
третичного бутилового спирта значительно выше, чем у других спиртов и это
способствует более экономичному проведению процесса дегидратации. И, наконец,
изобутилен при этом способе получается очень высокой чистоты, так как, здесь
отсутствуют нежелательные побочные реакции [1].
1.2 Анализ основной реакции
(CH3 )3C-ОН → (CH3 )2C=CH2 + Н2O
1.2.1
Физические свойства реагентов и продуктов реакции
Для полного анализа предложенной реакции необходимо прежде всего
рассмотреть наиболее важные физические свойства (См.табл.1.2.1) [36].
Таблица
1.2.1.
Физические
свойства реагентов
|
Формула вещества
физические свойства
|
(СН3)3С-ОН
|
(СН3)2С=СН2
|
Н2О
|
|
1
|
2
|
3
|
4
|
|
Фазовое состояние
|
Легко плавящееся твердое
вещество
|
Бесцветный газ
|
Жидкость
|
|
Молекулярная масса, г/моль
|
74,12
|
56
|
18
|
|
Ткип, 0С
|
82,5
|
-6,896
|
100
|
|
Тпл, 0С
|
25,5
|
-140,337
|
0
|
|
n20 d
|
1,3954
|
1,384
|
1,333
|
|
d20
|
0,7887
|
0,5942
|
0,9982
|
|
Твосп., 0С
|
10
|
455
|
|
|
Тсамовосп., 0С
|
480
|
465,2
|
|
|
Растворимость
|
Неограниченно растворяется
в воде, образуя с ней азеотропную смесь 1,8% . Хорошо растворим в органических
растворителях.
|
Растворим в спиртах,
эфирах, углеводородах и воде. С некоторыми соединениями образует азеотропную
смесь в воде
|
|
|
Примечание
|
Имеет неприятный запах
плесени.
|
При вдыхании оказывает
наркотическое действие, расстройство желудка.
|
|
1.2.2 Электронная
структура реагентов, продуктов реакции и катализатора
Химическое поведение, реакционная способность молекулы зависит от природы
составляющих ее атомов и от их взаимного расположения. Образуя молекулы, атомы
изменяют свое состояние, влияют друг на друга. Наиболее сильно взаимодействуют
между собой атомы, образующие химические связи.
Реагенты и продукты изучаемой реакции имеют неполярные (С-С, С=С) и
полярные (С-Н, С-О, О-Н) ковалентные связи, возникающие в результате обобщения
не спаренных валентных электронов с противоположными спинами. Зная число
электронов во внешней оболочке атомов, для любого органического и
неорганического соединения легко написать октетные формулы. В них учитываются
только внешние электроны атомов, как образующих так и не образующих химические
связи [26].
В молекулах трет-бутилового спирта и
изобутилена имеются электронные пары принадлежащие только одному атому
(углероду или кислороду) это т.н. неподеленные электронные пары. Они имеют
очень большое значение в химии органических соединений и называется p-электронами
В молекуле трет-бутилового спирта
проявляется индуктивный эффект -смещение электронной плотности вдоль s-связи от одного атома к другому в
следствии их различной электроотрицательности; при этом происходит поляризация
связи. В данном случае наблюдается индукционный I-эффект, т.к. атом кислорода
более электроотрицателен и оттягивает на себя электронную плотность. В группах
СН3 может проявляется эффект сверхсопряжения - частичное смещение s электронов трех С-Н связей на
соседнюю С-С связь. В этой молекуле три группы СН3 могут оказывать
такое воздействие. Но на основании имеющихся экспериментальных данных считают,
что в статическом состоянии сверхсопряжения нет, а во время химической реакции
проявляется [37].
Атомы углерода находятся в состоянии
гибридизации sp3 - гибридизации. Молекула трет-бутилового спирта представляет собой диполь. Она
содержит полярные связи С-Н, С-О, О-Н и имеет следующий вид:
CH3
↓ δ+ δ− δ+
CH3 → C → О ← Н
↑
CH3
В молекуле изобутилена проявляется индукционный I-эффект, и эффект
сверхсопряжения вследствие чего атомы радикалов связанных с ненасыщенной
группой являются активированными. Двойная связь (s и p) сказывается на реакционной способности молекулы, т.к. p-связь менее прочная, чем s под воздействием реагентов [26].
Молекула изобутилена имеет следующее электронное строение:
H
| δ+ δ-
H − C ® C = CH2
|
H H − C − H
|
H
Молекула воды имеет угловое строение. Угол ÐН-О-Н =104,50.. Связь О-Н
в молекуле воды является полярной, на атоме кислорода существует частично
отрицательный заряд d─, на
атоме водорода частично положительный заряд d+ . В целом молекула воды является диполем [38].
δ- δ+
O −− H
δ+ |
H
Молекулы воды и спирта образуют водородные связи. Они оказывает большое
влияние на свойства веществ. Это особый вид меж- или внутри- молекулярного
взаимодействия осуществляется протонизированным атомом водорода и атомом
имеющим электронноотрицательный характер.
В качестве катализатора предпологается использовать ионообменные
смолы. Это так называемые синтетические иониты, представляющие собой
нерастворимые в воде и органических растворителях высокомолекулярные
полиэлектролиты, способные обменивать подвижные ионы при контакте с растворами
электролитов. В зависимости от типа ионогенной группы их разделяют на аниониты
и катиониты [39].
В присутствии ионитов дегидратация протекает при более низкой
температуре, чем на обычно применяемых в гетерогенном катализе оксидных
катализаторах. В сравнении с классическим гомогенным кислотным катализом иониты
позволяют избежать агрессивной среды в реакторе и обеспечивают селективное, а
иногда и более быстрое протекание дегидратации, в результате достигается
повышение выхода целевых продуктов [40].
Используемые нами катиониты КУ-2 являются структурируемым полимером,
полученным суспензионной сополимеризацией стирола и дивинилбензола.
Сульфо-группы вводят в сополимер путем сульфохлорирования с последующим
омылением продукта реакции.
КУ-2 имеет макропористую структуру - это система, где твердая фаза
пронизана порами достигающими нескольких десятков нм (рис 1.2.2.).
Макропористые ионообменные смолы являются агломератами беспорядочно упакованных
сферолитов, между которыми имеется непрерывная сеть пор. Эти смолы обладают
наибольшей механической прочностью (в сравнении с гелевидными ионитами) [39].
Рис. 1.2.2.
Макропористая структура ионита
КУ-2 выпускается в виде прозрачных шариков от желтого до
темно-коричневого цвета и имеет следующее строение:
−СН2 −СН−СН2
−СН−СН2 −СН−
| | |

| SO3H |
−СН2 −СН−СН2
−СН−СН2 −СН−
1.2.3
Химические свойства реагентов и продуктов реакции
Рассмотрим наиболее типичные реакции, в которые могут вступать реагенты и
продукты реакции.
.2.3.1
Химические свойства трет-бутилового спирта
Они обусловлены присутствием реакционноспособной гидроксильной группы -
ОН. Реакции с участием этой группы проходят либо с разрывом связи О-Н либо
связи С-О [38].
Реакции замещения:
). Замещение атома водорода в группе -ОН вследствие разрыва связи О-Н.
взаимодействие с активными металлами:
(СН3)3С-ОН
+ 2Nа → 2(СН3)3С-ОNа + Н2
Третбутанолят натрия
- реакция этерификации (под действием температуры и водоотнимающего
реагента):
(СН3)3С-ОН
+ С2Н5ОН → СН3СООС2Н5
третбутилацетат
(СН3)3С-ОН
+ НОNO2 → (СН3)3С-О-NO2 + Н2О
третбутиловый эфир азотной кислоты
). Замещение ОН -группы вследствие разрыва связи С-О.
образование галогеналканов (под действием температуры и водоотнимающего
реагента):
(СН3)3С-ОН
+ НВr → (СН3)3С-Вr + Н2О
бромтретбутан
(СН3)3С-ОН
+ РCl5 → (СН3)3С-Cl +POCl3 +
НСl
- образование аминов (под действием температуры и Al2O3):
(СН3)3С-ОН
+ НNН2 → (СН3)3С- NН2 + Н2О
третбутиламин
Реакции отщепления:
Внутремолекулярная дегидратация (под действием температуры и
водоотнимающего реагента):
(СН3)3С-ОН→
(СН3)2С=СН2 + Н2О
дегидрирование не характерно для трет-бутилового спирта.
Реакции окисления:
полное окисление:
(СН3)3С-ОН
+6О2 → 4СО2 + 5 Н2О
неполное окисление [35]:
(СН3)3С-ОН
+ [О] → (СН3)3С-НО + Н2О
уксусный альдегид
1.2.3.2
Химические свойства изобутелена
Высокую реакционную способность изобутилена обуславливает наличие π-связи и двух электродонорных СН3-групп.
Он способен вступать в различные реакции присоединения и окисления [38]:
.Реакции присоединения:
гидрирование:
(СН3)2С=СН2
+ Н2 → (СН3)3-СН
трет-бутан
галогенирование:
(СН3)2С=СН2
+ Вr2 → (СН3)2С Вr -С(Вr)Н2
- присоединение галогенводородов:
(СН3)2С=СН2
+ НCl → (СН3)3С Cl
трет-бутил хлорид
- присоединение хлорноватисиой кислоты:
(СН3)2С=СН2
+ НОCl → (СН3)2-С(ОН) СН2Cl
гидратация:
(СН3)2С=СН2
+ Н2О → (СН3)3-С(ОН)
образование нитрозитов:
(СН3)2С=СН2
+ NО-ОNO → (СН3)2-С(NО) СН2NO2
присоединение сероводорода (под действием температуры и фосфорной
кислоты):
(СН3)2С=СН2
+ Н2S → (СН3)3СSH
присоединение серной кислоты:
(СН3)2С=СН2
+ Н2SО4 → (СН3)3СОSО2ОH
взаимодействие со спиртами (под действием водоотнимающего реагента):
(СН3)2С=СН2
+ СН3ОН → (СН3)3СО СН3
- присоединение аммиака протекает при нагревании:
(СН3)2С=СН2
+ NН3 → (СН3)3СNН2
реакция карбонилирования:
(СН3)2С=СН2
+ Н2О +СО → (СН3)2СН-
СН2СООН
. Реакции окисления:
горение:
(СН3)2С=СН2
+ 6О2 → 4СО2 + 4 Н2О
взаимодействие с кислородом в присутствии катализатора:
(СН3)2С=СН2
+ 6О2 → (СН3)2С-СН2
\/ О
неполное окисление по действием окислителя типа КМnО4, K2Cr2О4,
в присутствие NaOH
(СН3)2С=СН2
+ 2КМnО4 + 4 Н2О → 3(СН3)2
С(ОН)-СН2(ОН) + 2MnO2 +
+ 2 KOH
. Реакция полимеризации:
(СН3)2С=СН2
→ (-С(СН3)2СН2 -С(СН3)2-СН2
-)n
1.2.3.3
Химические свойства воды
Вода ─ одно из наиболее реакционноспособных соединений [38].
Проявление окислительно-восстановительных свойств возможно при взаимодействии
воды с активными восстановителями или окислителями:
Вода окислитель: 2Na + Н2О = 2NaOH + Н2
- Вода восстановитель: 2F2 + 2 Н2О = 4HF + O2
- Внутремолекулярный окислительно-восстановительный процесс
(при 1000 С0):
Н2О
= 2Н2 + O2
Кислотно-восстановительные свойства воды проявляются в следующих
процессах:
Самоионизация (характерна для жидкой воды):
ион гидрокси
гидроксония ион
Вода является амфотерным электролитом:
Н3 +
Н+ОН- = NН4+ + ОН-
NаCN + Н+ОН- = NaOH
+ Н+СN
3. Реакции гидратации:
гидратация оксидов:
2О + Н2О = Н2SО4
NaO + Н2О
= 2 NaOH
гидратация органических соединений под действием солей ртути:
СН=СН +
Н2О = (СН3)3С-НО
уксусный
альдегид
- образование кристаллогидратов:
CuSО4 +Н2О = CuSО4 *Н2О
. Реакции гидролиза:
- гидролиз солей
2CО3 + Н2О =
NaHCО3 + NaОН
FеСl3
+ Н2О = FеОНСl2 + НСl2S3 + 6Н2О
= 2Al(OH)3 + 2 Н2S
гидролиз карбидов металлов:
4С3 + 12Н2О =
4Al(OH)3 + 3 СН4
гидролиз сложных эфиров (при воздействии температуры и водоотнимающего
средства):
СН3СООС2Н5
+ Н2О → СН3СООН + С2Н5ОН
гидролиз полисахаридов (при воздействии температуры и водоотнимающего
средства):
(С6Н10О5
) n + Н2О → n С6Н10О6
гидролиз белка до аминокислот:
NН2 −СН2 −
CО−NH−CH(CH3) COOH +
Н2О →
NН2 −СН2 −
CОOH + NН2
−CH(CH3) COOH
2. Термодинамический анализ основной реакции
.1
Подготовка исходной информации
Расчет констант химического равновесия производится по термодинамическим
данным, которые взяты в справочной литературе [41] для изобутилена и воды. Для
трет-бутилового эфира они рассчитывались при помощи эмпирических данных.
Для исследуемой реакции:
(CH3)3COH
→ (CH3)2C=CH2 + H2O
рассчитывается значение энтальпии ( Н0298),
энтропии (
Н0298),
энтропии ( S0298) и температурных коэффициентов
(а,в,с,d, c | ) при температуре 298 К для всех веществ участвующих в
реакции. Эти данные представлены в таблице 2.1
S0298) и температурных коэффициентов
(а,в,с,d, c | ) при температуре 298 К для всех веществ участвующих в
реакции. Эти данные представлены в таблице 2.1
Изменение энтальпии, энтропии и температурных коэффициентов
рассчитываются по закону Гесса:
 Н0298 =
Н0298 =  Н0298((CH3)2CH=CH2
) +
Н0298((CH3)2CH=CH2
) +  Н0298(H2O
) -
Н0298(H2O
) -  Н0298((CH3)3COH)
Н0298((CH3)3COH)
 S0298 = S0298
((CH3)2CH=CH2 ) + S0298
(H2O ) - S0298 ((CH3)3COH
)
S0298 = S0298
((CH3)2CH=CH2 ) + S0298
(H2O ) - S0298 ((CH3)3COH
)
 а = а((CH3)2CH=CH2) + а(H2O
) - а((CH3)3COH )
а = а((CH3)2CH=CH2) + а(H2O
) - а((CH3)3COH )
 в = в((CH3)2CH=CH2) + в(H2O)
- в((CH3)3COH )
в = в((CH3)2CH=CH2) + в(H2O)
- в((CH3)3COH )
Аналогичным образом рассчитывают с и c |.
Таблица 2.1
Исходные и
расчетные данные термодинамики дегидратации трет-бутилового
спирта
|
Вещества
|
 Н0298 Дж/моль Н0298 Дж/моль
|
S0298
Дж/моль*К
|
а Дж/моль*К
|
в * 103 Дж/моль*К
|
с * 106
Дж/моль*К
|
d * 109
Дж/моль*К
|
c | *
10-5 Дж/моль*К
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
|
(CH3)2C=CH2
|
-13990
|
293.6
|
7.08
|
321.63
|
-166.07
|
33.5
|
---------
|
|
H2O
|
-241840
|
188.74
|
30.00
|
10.71
|
----
|
----
|
0.33
|
|
сумма продуктов реакции
|
-255830
|
482.34
|
37.08
|
332.34
|
-166.07
|
33.5
|
0.33
|
|
(CH3)3COH
|
-303010
|
317.79
|
20.42
|
398.2
|
-146.6
|
-----
|
-----
|
|

|
47180
|
164.55
|
16.66
|
-56.86
|
-19.47
|
35.5
|
0.33
|
2.2 Расчет
термодинамических функций
Для исследуемой реакции выбираем интервал температур от 50 до 160 0С,
т.к. оптимальная температура 90 0С лежит именно в этом интервале.
Изменение энтальпии при указанных температурах определяется по закону
Кирхгоффа:
 Н0r.t =
Н0r.t =  Н0298 +
Н0298 +  а(Т-298) +
а(Т-298) +  в/2(T2 -2982 )
+
в/2(T2 -2982 )
+ с/3(T3 - 2983
) +
с/3(T3 - 2983
) +  d/4(T4 - 2984 )
+
d/4(T4 - 2984 )
+  c | (1/298-1/T)
c | (1/298-1/T)
Произведем расчет тепловых эффектов реакции в интервале температур от 323
до 433 К с шагом 10 К.
 Н0r.323 = 47180 + 16,66*(323-298)
- 56,86*10-3 /2(3232 -2982 ) -
19.47*10-6 /3(3233 - 2983 )+ +33.5*10-9/4(3234
- 2984 ) + 0.33*105 (1/298-1/323) = 47141.57
Дж/моль
Н0r.323 = 47180 + 16,66*(323-298)
- 56,86*10-3 /2(3232 -2982 ) -
19.47*10-6 /3(3233 - 2983 )+ +33.5*10-9/4(3234
- 2984 ) + 0.33*105 (1/298-1/323) = 47141.57
Дж/моль
 Н0r.333 47180 + 16,66*
(333298) - 56,86*10-3 /2(3332 -2982
) - 19.47*10-6 /3(3333 - 2983 )
+33.5*10-9/4(3334 - 2984 ) + 0.33*105
(1/298-1/333) = 47115.57 Дж/моль
Н0r.333 47180 + 16,66*
(333298) - 56,86*10-3 /2(3332 -2982
) - 19.47*10-6 /3(3333 - 2983 )
+33.5*10-9/4(3334 - 2984 ) + 0.33*105
(1/298-1/333) = 47115.57 Дж/моль
 Н0r.343 = 47180 + 16,66*
(343-298) - 56,86*10-3 /2(3432 -2982
) - 19.47*10-6 /3(3433 - 2983 )+
+33.5*10-9/4(3434 - 2984 ) + 0.33*105
(1/298-1/343) = 47083 Дж/моль
Н0r.343 = 47180 + 16,66*
(343-298) - 56,86*10-3 /2(3432 -2982
) - 19.47*10-6 /3(3433 - 2983 )+
+33.5*10-9/4(3434 - 2984 ) + 0.33*105
(1/298-1/343) = 47083 Дж/моль
Значения при других температурах приведены в таблице 2.2.
Определяем изменение энтропие реакции при заданных температурах.
Энтропия определяется по формуле:
 S0r.t =
S0r.t =  S0298 +
S0298 + аln(T/298) +
аln(T/298) +  в(T -298 ) +
в(T -298 ) + c/2(T2 - 2982 ) +
c/2(T2 - 2982 ) + d/3(T3 - 2983
) +
d/3(T3 - 2983
) +  c | (1/2982
-1/T2 )
c | (1/2982
-1/T2 )
S0r.323= 164,55 +16,66*ln(323/298)
- 56,86*10-3 (323 -298 ) -19,47*10-6
/2 (3232 - 2982 )+ 33,5*10-9/3(3233
- 2983 ) + 0,33*105 (1/2982 -1/3232
)= 164,46Дж/моль К0r.333 =164,55 +16,66*ln(333/298)
- 56,86*10-3 (333 -298 ) -19,47*10-6
/2 (3332 - 2982 )+ 33,5*10-9/3(3333
- 2983 ) + 0,33*105(1/2982 -1/3332
)= 164,39 Дж/моль К0r.343= 164,55 +16,66*ln(343/298)
- 56,86*10-3 (343 -298 ) -19,47*10-6
/2
(3432 - 2982 )+ 33,5*10-9/3(3433
- 2983 ) + 0,33*105(1/2982 -1/3432
)=164,29 Дж/моль К
Значения при других температурах приведены в таблице 2.2.
Изменение изобарно-изотермического потенциала реакции для каждой
температуры определяется по уравнению:
 G0r.t =
G0r.t =  Н0r.t -
Т
Н0r.t -
Т S0r.t
S0r.t
 G0r.323 = 47141 - 323*164,46 = -5,977
кДж/моль
G0r.323 = 47141 - 323*164,46 = -5,977
кДж/моль
 G0r.333 = 47115 - 333*164,39 = -7,624
кДж/моль
G0r.333 = 47115 - 333*164,39 = -7,624
кДж/моль
 G0r.343 = 47083 - 343*164,29 = -9,271
кДж/моль
G0r.343 = 47083 - 343*164,29 = -9,271
кДж/моль
Значения при других температурах приведены в таблице 2.2.
Константа равновесия реакции при заданных температурах определяется по
уравнению нормального химического сродства:
 G0r.t =-RТlnKp, отсюда lnKp
= -
G0r.t =-RТlnKp, отсюда lnKp
= - G0r.t /RТ тогда
Kp = exp(-
G0r.t /RТ тогда
Kp = exp(- G0r.t /RТ)
G0r.t /RТ)
Kp1 = exp( 5977 /8,314*323 ) = 9,26p2
= exp( 7624 /8,314*333 ) = 15,7p3 = exp( 9271 /8,314*343
) = 25,81
Значения при других температурах приведены в таблице 2.2.
Обобщенные расчетные данные сведем в таблице 2.2
Таблица 2.2
Термодинамические
функции реакции.
|
№ п/п
|
Т, К
|
 Н0r,t кДж/моль Н0r,t кДж/моль
|
 S0r,t Дж/моль*К S0r,t Дж/моль*К
|
 G0r,t кДж/моль G0r,t кДж/моль
|
Kp
|
|
1
|
2
|
3
|
4
|
5
|
6
|
|
1
|
323
|
47,141
|
164,46
|
-5,977
|
9,26
|
|
2
|
333
|
47,115
|
164,39
|
-7,624
|
15,7
|
|
3
|
343
|
47,083
|
164,29
|
-9,271
|
25,81
|
|
1
|
2
|
3
|
4
|
5
|
6
|
|
4
|
353
|
47,045
|
164,19
|
-10,916
|
41,81
|
|
5
|
363
|
47,001
|
164,08
|
-12,560
|
64,19
|
|
6
|
373
|
46,951
|
163,95
|
-14,203
|
97,52
|
|
7
|
383
|
46,895
|
163,81
|
-15,844
|
144,88
|
|
8
|
393
|
46,833
|
163,66
|
-17,484
|
210,84
|
|
9
|
403
|
46,766
|
164,49
|
-19,122
|
310,02
|
|
10
|
413
|
46,693
|
163,32
|
-20,758
|
547,48
|
|
11
|
423
|
46,614
|
163,14
|
-22,392
|
629,52
|
|
12
|
433
|
46,529
|
162,94
|
-24,025
|
791,30
|
По полученным данным построим соответствующие графики:
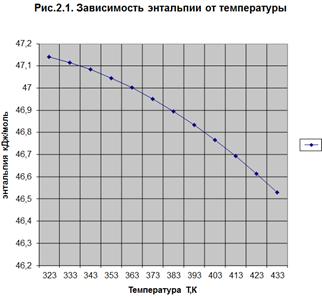
ΔН0r,t = f(T) (Рис. 2.1.)
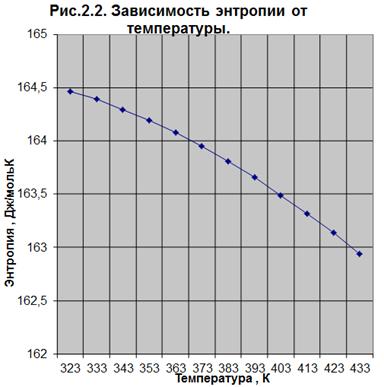
ΔS0r,t =
f(T) (Рис. .2.2.)
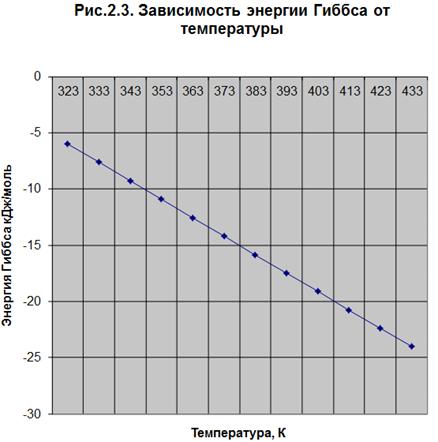
ΔG0r,t = f(T) (Рис. .2.3.)p =
f(T) (Рис. 2.4.)
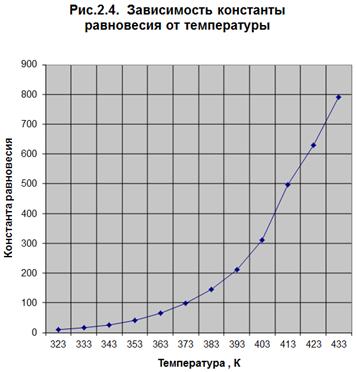
Выводы: Термодинамический расчет показал, что по мере увеличения температуры,
тепловой эффект реакции уменьшается. По значению энтальпии ( Н0r,t) реакция
эндотермическая. Энтропия уменьшается с увеличением температуры. В указанных
условиях реакция протекает самопроизвольно, т.к. значения энергии Гиббса отрицательны
(
Н0r,t) реакция
эндотермическая. Энтропия уменьшается с увеличением температуры. В указанных
условиях реакция протекает самопроизвольно, т.к. значения энергии Гиббса отрицательны
( G0r.t < 0). Лучше проводить реакцию при повышенных температурах,
т.к. минимальное значение
G0r.t < 0). Лучше проводить реакцию при повышенных температурах,
т.к. минимальное значение  G0r.433= -24,025, а константа
равновесия имеет максимальное значение Кp =791,30 при температуре 433 К.
G0r.433= -24,025, а константа
равновесия имеет максимальное значение Кp =791,30 при температуре 433 К.
Так как с увеличением температуры значение константы равновесия
увеличивается и равновесие смещается в сторону продуктов реакции, то
реакционную смесь нужно нагревать (при этом не стоит забывать об образовании
побочных продуктов реакции). Также на смещение равновесия в сторону продуктов
реакции влияет уменьшение парциального давления, концентрации спирта и т.д. (по
принципу Ле-Шателье). С увеличением температуры увеличивается скорость реакции.
3. Кинетика и механизм реакции получения изобутилена
.1
Механизм реакции и его обоснование
Решение вопроса о механизме образования непредельных углеводородов из
спиртов при проведении дегидратации последних в кислой среде осложняется тем,
что в условиях реакции получающиеся непредельные углеводороды могут
изомеризоваться, превращаясь в более устойчивые структурные или стерические
изомеры. При обсуждении вопроса о механизме образования непредельных соединений
с точки зрения электронной теории, Ингольд принял во внимание тот факт, что
реакции отщепления очень часто сопутствуют реакциям замещения и, следовательно,
с большей долей вероятности можно предложить существование аналогичных
начальных механизмов процессов [37].
Реакция дегидратации трет-бутилового спирта протекает по механизму Е1, с
образованием промежуточного комплекса [26] :
H CH3
| |
(CH3)3C-OH+H+ ↔
(CH3)3 C- O + ↔ CH3-C+-
+H2O (I)
|
|
H CH3
CH3 CH2
| ||
CH3-C+ ↔
CH − CH3 (II)
| |
CH3 CH3
Реакция отщепления обусловливается изменением состояния связи С-ОН в
молекуле в следствии взаимодействия ее с растворителем.
На первой стадии образуется карбианион, а на второй образуется
непредельное соединение [37].
Очевидно, что условия, способствующие реакциям замещения должны ускорять
также и реакции отщепления (Е1), поскольку в обоих случаях
существенной стадией является образование карбониевого иона [43].
3.2 Анализ
факторов, влияющих на основную реакцию
.2.1
Влияние строения субстрата
Строение субстрата оказывает значительное влияние на ход реакции, т.к. из
субстрата образуется катион, который может влиять на направление реакции. При
образовании карбкатиона атом углерода переходит из первичного тетраэдрического
состояния в более устойчивое планарное состояние, в котором три метильные
группы максимально удалены друг от другой. В ряду от СН3+
до (CН3)3C+ стабильность карбониевого иона возрастает и
обусловлена влиянием индуктивных эффектов [37].
При постепенном замещении Н-атомов CН3- группами в метиловом спирте скорость реакции
бимолекулярного отщепления падает, а мономолекулярного возрастает.
Таким образом, можно заключить, что строение трет-бутилового спирта
способствует протеканию реакции по Е1 механизму, так как подход Н+-
частицы к С-атому, при котором происходит процесс отщепления стерически
наиболее затруднен. Ионизация же по связи С-ОН в трет-бутаноле, наоборот,
требует меньшей затраты энергии, чем в случае изопропанола, и т.д.
Иными словами, чем более разветвленными являются молекулы спирта, тем
более «сжатыми» они оказываются при превращении в промежуточную структуру - карбоиневый
ион. «Сжатие» уменьшается, если происходит потеря протона, что делает
отщепление наиболее предпочтительнее по сравнению с реакцией замещения [43].
Таким образом, можно заключить, что стерические затруднения вызванные
наличием трех метильных групп в молекуле трет-бутанола способствует протеканию
реакции по механизму отщепления Е1, а не замещения.
3.2.2
Влияние строения атакующей частицы
Атакующая частица Н+, определяет наличие кислотной среды в
реакционной смеси, что способствует отщеплению ОН-группы. Отщепление происходит
за счет начальной протонизации, приводящей к образованию положительно
заряженных частиц (а не нейтральных молекул).
3.2.3
Влияние строения уходящей группы
Скорость реакции протекающей по механизму Е1, зависит от
природы покидающей группы. Чем ниже энергия связи этой группы с атомом углерода
и чем выше способность покидающей группы давать анион, тем легче должна
проходить реакция по Е1 механизму. Энергия связи С-О, равная
314кДж/моль [41], способствует протеканию реакции по механизму Е1.
Чем большей основностью обладает уходящая группа, тем в большей степени
увеличивается вероятность отрыва водорода и образования олефина. Увеличение
объема уходящей группы также приводит к увеличению выхода продуктов отщепления
[37].
3.2.4
Влияние растворителя
При диссоциации нейтрального субстарата на ионы переходное состояние
более полярно, чем исходный субстрат. Это приводит к тому, что при увеличении
диэлектрической проницаемости (полярности) сольватация переходного состояния
увеличивается сильнее, и становится больше чем в исходном субстарте. Это
приводит к повышению стабильности ионов и увеличению скорости по двухстадийному
механизму [43].
При использовании протонных растворителей (Н2О), кроме
неспецифичной сольватации наблюдается специфичная сольватация, связанная с
образованием водородных связей с уходящей группой. С другой стороны, чтобы
увеличить скорость отщепления необходимо уменьшить полярность растворителя.
Поэтому в качестве растворителя вместо воды можно использовать этилцеллозольв [1].
Но поскольку вода как растворитель используется в технологических целях,
то предполагается ее использование в минимальных количествах для разбавления
трет-бутанола.
3.3
Катализ изучаемой реакции
В качестве катализатора предпологается использовать катиониты КУ-2.
Большая часть исследованных реакций дегидратации на ионитах протекает по
ионному механизму. На первой стадии трет-бутиловый спирт взаимодействует с
ионитом, образуя оксониевый ион ион [40]:
(CН3)3COH +R SO3H →
(CН3)3C -O+H2+RSO-3,
который переходит в результате отщепления воды в карбониевый ион:
(CН3)3C-O+H2
→ (CН3)3C++H2O
Карбониевый ион может отщепить протон (присоединяющийся затем к катиону)
с образованием олифина:
(CН3)3C+ → (CН3)2С=CН2
или же вступить в реакцию со следующей молекулой спирта:
(CН3)3C++(CН3)3COH → (CН3)3 C-О+H-C(CН3)3
с переходом образовавшегося оксониевого иона в простой эфир и отщеплением
протона:
(CН3)3C- О+H- C(CН3)3
→ (CН3)3С-O-C (CН3)3+Н+
Альтернативным путем превращения карбониевого иона может быть взаимодействие
с молекулой олефина, ведущее к образованию полимеров:
(CН3)2С=CН2 → (CН3)2СН−CН =C−(CН3)2
Большое влияние на каталитическую активность ионитов в реакцию
дегидратации оказывает их влажность. Это влияние нельзя охватить одной общей
закономерностью [40].
Количественная трактовка этого вопроса для реакций, выполняемых в
присутствии полимеризационных катионитов, возможна на основе модели
Ленгмюра-Хиншельвуда. При таком подходе, изучив резкое снижение скорости
выделения изобутилена по мере разложения трет-бутилового спирта на столе
дуаэкс-50W, которое авторы исследования
объясняют блокировкой и иноктивацией активных групп в выделяющейся водой
(реакция1), что затрудняет образование промежуточного комплекса А со спиртом и
таким образом мешает течению основных реакции 2:
G+W
=GW (1)+ G = AG=C4H8 + H2O (2)
где G - активные группы;
GW -
комплекс воды и активных групп;
W -
вода;
AG -
комплекс спирта спирта и активных групп катализаторов;
А - спирт;
Теоретические расчеты, выполненные на основании этой модели, позволили
построить кривую зависимости удельной скорости образования олефина от мольной
доли воды в простой разнице фазе (рис. 3.3.1).
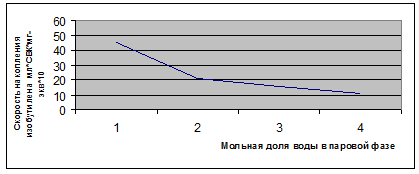
Рис. 3.3.1 Зависимость удельной скорости образования изобутилена при
разложении трет-бутанола на катионине дауэке -50х2 от мольной доли воды в
парообразной фазе.
Чтобы избежать тормозящего влияние воды на каталитические реакции многие
авторы применяли азеотропную отгонку.
Однако же всегда присутствие воды в ионите или реакционной массе оказывает
неблагоприятное влияние на кинетику накопления продуктов реакции. Порой в
присутствии влаги затрудняется течение нежелательных побочных процессов,
усиливаются протонодонорные свойства сульфогрупп или же благодаря набуханию
катиониты создаются благоприятные условия для протекания реакции во всем объеме
зерна [44]. Зависимость степени набухания катализатора от содержания
трет-бутанола (рис. 3.3.2) являются важным технологическим параметром,
определющим размер дегидратора [44].
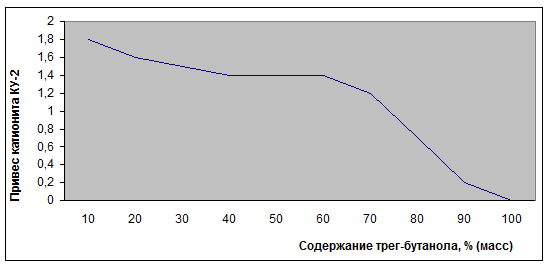
Рис. 3.3.2
Зависимость набухаемости катионита КУ-2 в водных растворах труг-бутанола от его
концентрации.
3.4
Кинетическая модель реакции
Изучение кинетических закономерностей процесса дегидратации
трет-бутанола, с помощью ионообменных смол и количественная обработка
результатов приводится в работах Фриллета, Моувера и Рубина, а также Чаплица,
Самохваловой, Тюряева [12].
Фриллет и другие рассматривали реакцию дегидратации на сульфокатионите Dowex-50, как поверхностно каталитическую,
а не как реакцию, протекающую в гомогенной сфере, а сульфокатионит - как
пористое твердое тело с каталитическими участками, распределенными на
внутренних поверхностях. Вывод кинетического уравнения авторы основывают на
модели Ленгмюра-Хиншельвуда, в которой постулируется концентрирующая сорбция
спирта и воды.
Уравнение скорости реакции имело вид:
R=(dn/dt)/N = k3[A]/([A]+
(1/ka)+ (kw/ka)[W])
где: R=(dn/dt)/N - удельная скорость дегидратации;
n -
количество прореагировавшего спирта;
N -
гигруемая кислотность катализатора;
[А], [W] - мольные доли спирта и воды
соответственно;
k3 - константа скорости дегидратации;
ka.kw- константы адсорбционного равновесия спирта и воды соответственно;
t - время контакта.
Экспериментальная проверка кинетического уравнения была проведена в
статических условиях при температуре кипения и показала применимость данного
уравнения для описания кинетики дегидратации трет-бутанола на катионите.
Чаплиц, Самохвалова, Тюряев нашли, что скорость процесса дегидратации
трег-бутанола на сульфонатионитах КУ-1, КУ-2 хорошо описывается уравнением
Фороста [44]:
α + βυ0y = υ0 ln(1/1-y)
где υ0 - скорость подачи трег-бутанола, м/л кат ч;
y -
степень превращения спирта;
α,β- коэффициенты, не зависящие от υ0 и y.
Значение коэффициента β с незначительной ошибкой может быть
принято равным 1 при температуре 70-90°С и концентрация трет-бутанола 53-58%
(масс).
Выводы: Реакция дегидратации протекает по механизму отщепления в две
стадии. Этому способствует строение субстрата, атакующей частицы и уходящая
группа. Так как отсутствуют экспериментальные данные по кинетике и механизму
реакции дегидратации трет-бутилового спирта, была предложена кинетическая
модель для реакций дегидратации трет-бутилового спирта в водных растворах на
катионитах. Такие реакции протекают подчиняются модели Лэнгмюра-Хиншельвуда.
Также кинетика реакции хорошо описывается уравнением Фореста
Экспериментальные данные свидетельствуют о том, что скорость реакции
замедляется по мере увеличения содержания воды в системе. Поэтому количество
воды нужно поддерживать в определенном количестве, чтобы реакционная смесь
находилась в равновесии с набухшим катализатором.
4. Выбор типа реактора
На основании анализа разделов 1-3 были установлены факторы, которые
определяют выбор типа реактора:
. Фазовые состояния реагентов. Реакционная смесь представляет собой
жидкофазную гетерогенно - каталитическую систему, состоящую из трет -
бутилового спирта и воды в жидком состоянии и макропористого катализатора.
Смесь трет бутилового спирта и воды применяется, во первых, по экономическим
соображениям, чтобы избежать обогрева трет - бутилового спирта и
соответствующих коммуникаций. Это необходимо, т.к. спирт имеет высокую
температуру плавления (25,5оС); воду необходимо добавить в
количестве 20% чтобы водный раствор трет - бутилового спирта не застывал на
холоде [4]. Во вторых, вода необходима, чтобы поступающая реакционная смесь и
набухший в воде катализатор находились в постоянном равновесии. Таким образом,
фазовое состояние реакционной массы - жидкость.
. Температурный режим, его влияние на селективность. Для достижения
максимального выхода и селективности необходимо поддерживать температуру в
реакционной среде в пределах 90-140оС. При повышенных температурах,
например, 110оС реактор работает в адиабатическом режиме. Предпочтительной
с экономичной точки зрения, является температура 100-130оС, т.к. в
этом случае выход изобутилена и срок службы катализатора являются оптимальными
[29]. При дальнейшем повышении температуры происходит разрушение катализатора и
падает селективность процесса, а также увеличивается выход полиизобутиленов и
эфиров. Таким образом, температурный режим является одним из главных факторов
образования изобутилена.
. Тепловой эффект реакции. Реакция жидкофазной дегидратации изобутилена
эндотермична. Таким образом, в процессе синтеза к реактору необходимо подводить
тепло, чтобы компенсировать его потери в результате реакции. Следовательно,
реактор должен быть снабжен устройством теплообмена. В качестве теплоносителя
возможно использование водяного пара.
. Применение давления (0,16-0,8 мПа).
Для процессов протекающих при таких давлениях рекомендуют применять сталь
Х17Н13М2Т [45] или 1Х18Н10Т[46]. Давление необходимо, чтобы поддерживать
реакционную смесь в жидком состоянии. Во избежание нарушений технологического
режима реактор должен быть полностью герметичен.
. Катализатор. Выбранный нами катализатор имеет макропористую структуру.
Поэтому необходимо применение конструкции для нахождения катализатора.
Так как исходная смесь пропускается через катализатор только в одном
направлении, сверху вниз, то нет необходимости ограничивать слой ионита
решетками. Для удержания катионита используют дренажное устройство. Это
наиболее сложный элемент реактора. Широкое распространение получило дренажное
устройство, состоящее из диска с закрепленными в нем фильтрующими колпачками.
Диск закрепляется между днищем и корпусом реактора.
Применяют также трубчатые дренажные устройства [47]. В качестве более
простого дренажного устройства могут быть использованы колосовидные решетки на
которые укладывается слой фильтрующего материала: стекловаты, тканевого или
нетканевого полотна, изготовленного из какого-либо волокнистого материала или
простые фильтровальные металлические сетки [48]. Остановим свой выбор на
дренажном устройстве с колпачками, т.к. оно подойдет для любого количества
катализатора. Исходя из того, что катализатор КУ-2 имеет повышенный срок
стабильной работы (5000-6000 ч.[31]) целесообразно использовать реактор с
неподвижным слоем катализатора, который отличается простотой конструкции.
Таким образом, можно заключить, что нам необходим реактор колонного типа,
с устройством для распределения жидкости, нахождения катализатора и рубашкой
для обогрева реакционной смеси и поддержания нужной температуры.
Схема реактора приведена на рис. 4.
Реактор представляет собой герметичную колонну 1 с выпуклым днищем 2 и
крышкой 3, выдерживающей давление до 58,8х104 Па. В верхней части
реактора установлено распределительное устройство 4 для разбрызгивания
подаваемой в реактор исходной смеси с целью равномерного распределения потока
жидкости по всей поверхности слоя катализатора 5.

Рис.
4.Реактор для проведения дегидратации трет-бутилового спирта.
В нижней части реактора расположено дренажное устройство 6, задерживающее
зерна катионита и не препятствующее потоку жидкости. Реактор оборудован
рубашкой 8 с целью поддержания заданной температуры смеси (т.к. реакция
эндотермична).
Для загрузки - выгрузки катализатора, ремонта реактора предусмотрено два
гермичных люка 7.
Реактор может оборудоваться смотровыми окнами 9, расположенными по его
высоте так, чтобы можно было наблюдать за слоем катионита в любой момент.
В таком реакторе необходимо предусмотреть значительное свободное
пространство над слоем катионита, равное или превышающее объем находящегося в
реакторе набухшего катионита, если будет необходима регенерация катализатора
5. Расчет
реактора
5.1
Материальный баланс
Материальный баланс процесса дегидратации трет-бутилового спирта
рассчитывается исходя из проведения реакции на катализаторе КУ-2 с
использованием водного раствора трет-бутилового спирта. Процесс осуществляется
при температуре 100-140оС; выход до 99,98%, конверсия
трет-бутилового спирта 100%. Селективность получаемого изобутилена составляет
99,98% [29]. Селективность побочной реакции - образования димеров - составляет
100-99,98%-0,02%.
Таким образом, исходящими данными для расчета материального баланса
являются;
Выход fc -99,98%.
Степень превращения xa -100%.
Селективность основной реакции φосн -99,98%.
Селективность побочной реакции φпоб -0,02%
Исходим из того, что все реагенты берутся без примесей.
В реакторе протекает реакция дегидратации трет-бутилового спирта
(основная реакция):
(CН3)3 C-OH → CH −C−CН3+H2O
|
CН3
А также реакция образования олефинов С8:
CН3
CН3
| |
CН=C(CН3)2 CН3 -C -CН2 - C= CН2
CН3
CН3
Общее выражение для материального баланса процесса имеет вид:
∑Gприх. = ∑Gрасх. + ∑Gпотр.
где ∑Gприх. - мольный поток, приходящий в
реактор;
∑Gрасх. - мольный поток, уходящий из
реактора;
∑Gпотр.. - потери (для теоретического расчета
баланса принимаем∑Gпотр
=0).
Для процесса дегидрации трет-бутилового спирта выражение материального
баланса будет иметь вид:
Gтбс+ Gводы = Gи+ Gводы+ Gтбс+ Gс8+ G'воды
где Gтбс - мольный поток трет-бутилового спирта;
Gи- мольный поток, полученного
изобутилена;
Gводы- мольный поток воды (20%);
G'воды-
мольный поток воды, образовавшийся в результате реакции;
Gс8- мольный поток, образовавшихся в
результате побочной реакции диизобутиленов.
Расчет материального баланса ведется исходя из образования 1 кмоль/мин.
изобутилена.
Производительность реактора Gn0=
1 кмоль/мин
1. Производительность реактора с учетом выхода продукта
G'n0 = Gn0 /f = 1/0.9998 кмоль/мин =1,0002
кмоль/мин
Приход:
2. Количество трет-бутилового спирта пошедшего на получение изобутилена:
Gn1 = G'n0 νи/ νтбс = 1,0002 • 1/1 = 1,0002 кмоль/мин
3. Количество трет-бутилового спирта с учетом селективности основной
массы:
Gn2 = Gn1 /φосн = 1,0002/0,9998 = 1,0004 кмоль/мин
4. Количество трет-бутилового спирта с учетом степени превращения:
Gn3 = Gn2 / Ха = 1,0004/1 = 1,0004 кмоль/мин
5. Количество трет-бутилового спирта расходуемого на побочную реакцию:
Gn4 = Gn2 − Gn1 = 1,0004 − 1,0002 = 0,0002
кмоль/мин
Расход:
1. Количество получаемого изобутилена:
Gn5 = G'n0 = 1,0002 кмоль/мин
. Количество получаемой воды:
Gn1 = Gn0 • νводы/ νтбс = 1,0002 кмоль/мин
. Количество диизобутилена С8, получаемого в побочной реакции:
Gn2 = Gn4 • νс8/ νи = 1,0002•0,5 = 0,0001 кмоль/мин
. Количество воды, поступающей в реактор вместе с трет-бутиловым спиртом.
Исходя из мольного соотношения ТБС/вода = 80%/20%:
Gводы
= Gтбс • 20%/ 80% = 1,0004• 20/80 = 0,2501
кмоль/мин
Сведем полученные результаты в таблицу 5.1.
Таблица 5.1.
Материальный
баланс дегидрации ТБС.
|
Приход
|
Gn
|
Gm
|
Расход
|
Gn
|
Gm
|
|
кмоль/мин
|
%
|
кг/мин
|
%
|
|
кмоль/мин
|
%
|
кг/мин
|
%
|
|
Трет-бутиловый спирт
|
1,0004
|
80
|
74,0296
|
94,3
|
Изобути-лен
|
1,0002
|
44,4
|
56,0112
|
71,3
|
|
Вода
|
0,2501
|
20
|
4,5018
|
5,7
|
вода
|
1,0002
|
44,4
|
18,0036
|
22,9
|
|
|
|
|
|
Диизобу-тилен
|
0,0001
|
0,1
|
0,0112
|
0,01
|
|
|
|
|
|
вода
|
0,2501
|
11,1
|
4,5018
|
5,7
|
|
Итого
|
1,2505
|
100
|
78,5314
|
100
|
Итого
|
2,2506
|
100
|
78,5278
|
100
|
5.2
Тепловой баланс
Уравнения теплового баланса в общем случае имеет вид:
∑Qприх. = ∑Qрасх. + ∑Qпот.
Уравнение теплового баланса для процесса дегидратации трет-бутилового
спирта имеет вид:
Qисх.
± Qг. ± Qf = Qпрод. ± Qпот.
Расчет теплового баланса проведен на основе материального баланса и
следующих данных:
температура на входе в реактор - 140°С (413К)
температура на выходе из реактора - 100°С (373К) [29]
тепловые потери - 5% [45].
1. Количество теплоты, поступающая с исходными веществами:
∑Qисх. =∑Gi •Сpi•Tн
Сpi =  а +
а +  в +
в +  с
с
Сртбс413 = 20,42 + 398,2•413•10-3 −
146,6•4132•10-6 = 159,87
Срводы413 = 30 + 4,42 + 0,91 = 34,6
Qисх =
(1,0004•159,87•413 + 0,2501•34,6•413) = 69626,59 Дж/моль
2. Теплота, поглощающаяся в процессе реакции
Qг = − HG
HG
Реакция протекает при средней температуре 120°С [29].
 Н0r.t =
Н0r.t =  Н0298 +
Н0298 +  а(Т-298) +
а(Т-298) +  в/2(T2 -2982 )
+
в/2(T2 -2982 )
+ с/3(T3 - 2983
)
с/3(T3 - 2983
)
а). Целевая реакция при температуре 393 К  Н0и = 46833
Дж/мольК
Н0и = 46833
Дж/мольК
(см. термодинамический расчет).
б). Побочная реакция:  Н0298 = ∑νi
Н0298 = ∑νi Н0298 пр.р-и −
∑νi
Н0298 пр.р-и −
∑νi Н0298 исх.в-в
Н0298 исх.в-в
Н0298 =  Н0298 c8 − 2•
Н0298 c8 − 2• Н0298 и
Н0298 и
 a = ∑νi
a = ∑νi a пр.р-и − ∑νi
a пр.р-и − ∑νi a исх в-в=20,96 − 2•7,08 = 6,8
a исх в-в=20,96 − 2•7,08 = 6,8
 в = ∑νi
в = ∑νi в пр.р-и −
∑νi
в пр.р-и −
∑νi висх в-в=−627,94 − 2•321,63 = 15,32
висх в-в=−627,94 − 2•321,63 = 15,32
 с = ∑νi
с = ∑νi спр.р-и −
∑νi
спр.р-и −
∑νi с исх в-в=−341,32 − 2•(−166,07)
= -9,18
с исх в-в=−341,32 − 2•(−166,07)
= -9,18
Энтальпия реакции при 393 К:
 Н0поб,39
= −97720,20+ 95•6,8 − 15,32•62645•10-3/2 −
9,18•34234865•10-6 /3=
Н0поб,39
= −97720,20+ 95•6,8 − 15,32•62645•10-3/2 −
9,18•34234865•10-6 /3=
=− 97658,61 Дж/мольК
Общая теплота с учетом селективности:
Qr = −∑ H GI φ = −(46833•1.2501•0.9998 −(
−97658.61•2.2506•0.0002)) = =−58596.91 Дж/моль
H GI φ = −(46833•1.2501•0.9998 −(
−97658.61•2.2506•0.0002)) = =−58596.91 Дж/моль
3. Количество теплоты, уходящее с продуктами реакции:
Qреаг = ∑Gi •Сpi•Tк
Сри373 = 7,08 + 119,96 - 23,11+1,74 = 105,67
Срводы373 = 30+ 3,99+0,24 = 34,23
Срс8,373 = 20,96 + 234,22 −47,44 = 207,74
Qреаг = 105,67•1,0002•373+
34,23•1,2503•373+207,74•0,0001•373 =
= 55394,1 Дж/моль
4. Суммируем приходящее тепло:
Qприх = Qисх + Qг = 69626,59 − 58596,91 =
11029,69 Дж/моль
Определим потери тепла:
Qпот = Qприх • % = 11029,69 • 0,05 = 551,48 Дж/моль
5. Суммируем тепло, расходуемое в процессе:
Qрасх = Qреак + Qпот = 55394,1 + 551,48 = 55945,58 Дж/моль
Определим количество теплоты, которое необходимо подводить к реактору:
Qf = Qрасх − Qприх = 55945,58 − 11029,69 = 44915,89 Дж/моль
Определим поверхность теплообмена:
F=Qr/(K• T•60)
= 44915,89/200•40•60 = 93,5 м2
T•60)
= 44915,89/200•40•60 = 93,5 м2
Где К=100−200вт/м2с
 T =
413-393 =40К
T =
413-393 =40К
Сведем данные теплового баланса в таблицу 5.2
Тепловой
баланс дегидратации ТБС.
Таблица 5.2
|
Приход
|
Дж/моль
|
%
|
Расход
|
Дж/моль
|
%
|
|
Qприх
|
69626,59
|
60,8
|
Qрасх
|
55394,1
|
48,4
|
|
Qf
|
44915,89
|
39,2
|
Qпот
|
551,48
|
0,4
|
|
|
|
Qr
|
58596,91
|
50,7
|
|
Всего
|
114542,48
|
100
|
Всего
|
114542,49
|
100
|
5.3 Расчет
объема реактора
В реакторе идеального вытеснения (РИВ) исходная смесь движется в одну
сторону с постоянной и одинаковой скоростью. Такой режим называется
«поршневым».
Объем реактора РИВ рассчитывается по формуле:
V = Gv0 •τ;
где Gvo - объемный расход реакторной массы, τ
- время пребывания
реакторной массы в реакторе:
xi
τ = Сi0∫dxi/υr
0
тогда: xi
τ = Сv0Сi0 ∫dxi / υr
0
Так как не известна кинетика реакция, определить по уравнению время
пребывания не представляется возможным.
В литературных источниках приводится размеры нескольких лабораторных
установок: диаметр 2,29 см., высота 80 см, [29], либо диаметр 25 мм, высота
280мм, [49].
В промышленности используются следующие аппараты колонного типа:
диаметром 2м и высотой 15м [45]; диаметр 2-3м с высотой 6-6,5м [47].
Что касается высоты слоя катализатора, то она обычно колеблется в
пределах от 0,5 до 2 диаметров аппарата [48], а также возможно соотношение 1:4.
[47].
Если использовать для расчетов диаметр 2м и высоту 15м, то объем реактора
составит:
V=πd2 h/4=3.14*4*15/4=47.1
м3
При этом объем катализатора может составлять от 1 до 8 м3
6. Операторная схема получения изобутилена
Операторная схема процесса жидкофазной дегидратации третбутанола
представлена на рис. 6.

Рис. 6.
Операторная схема процесса дегидратации третбутилового спирта,
где ТБ - третбутиловый спирт, С8 - димеры изобутилена, продукт
побочной реакции, И - изобутилен.
Исходное
сырье - третбутиловый спирт и вода смешиваются в смесителе 1 и подается в
теплообменник 2, где смесь нагревается (до 50-60оС). Затем исходная
смесь поступает в компрессор 3, где сжимается до рабочего давления (1Мпа) и
нагревается в теплообменнике 4 до начальной температуры (140оС).
Нагретая жидкая смесь, подается в реактор 5, который обогревается
теплоносителем из теплообменника 10. Из реактора 5, жидкая смесь, содержащая ТБ,
Н2О, С4Н8 поступает в колонну 6. Из верхней
части колонны 6 выделяется азеотропная смесь С4Н8, и Н2О,
она подается в сборник 7, здесь вода выделяется в качестве сепаратной фазы и
отводится. Изобутилен направляется на склад. Из нижней части колонны 6 выходит
смесь содержащая ТБ, Н2О и С8 ( 0,3%).
0,3%).
Основное
количество этого продукта возвращается на реакцию. Меньшая часть подается в
колонну 8. Из головной части колонны 8 отводится тройная смесь ТБ,Н2О
и С8 (около 50% С8).
Продукт,
получаемый из низа колонны 8 подается в колонну 9, из верхней части которой
отводят азеотропную смесь ТБ и Н2О, которую направляют на реакцию.
Из низа колонны 9 получают воду, которую отводят.
Выводы
Разработка и оптимизация методов получения изобутилена является
актуальной проблемой химической технологии. Так как на его основе получают
широкий спектор продуктов востребованных в народном хозяйстве. Это и различные
синтетические каучуки, топлива, смазки, присадки к маслам и высокооктановые
добавки к бензину
). В разделе 1 был приведен обзор различных методы и способы получения
целевого продукта. На основе анализа выбран метод получения изобутилена
дегидратацией трет-бутилового спирта. Эта реакция имеет историческое значение и
помимо этого метод экономичнее других, а изобутилен получается высокой чистоты.
Существует два основных принципиальных способа осуществления целевой реакции:
гомогенный - с применением в качестве катализатора серной кислоты, фосфорной
кислоты, щавелевой и бензсульфо кислот, и гетерогенный - в присутствии твердых
катализаторов типа цеолитов, ZrO2, К2SO4., СuSO4, ZnCl2 или катионитов.
На наш взгляд, наиболее целесообразным является применение гетерофазной
дегидратации трет-бутилового спирта на катионитах. Это объясняется прежде всего
высокими технологическими показателями и простотой аппаратурного оформления. В
частности предлагается осуществлять процесс при температуре 140-1000С
и давлении 0,1мПа. В качестве катализатора используются катиониты КУ-2 (сульфонированный
сополимер стирола и дивинилбензола). Он имеет макропористую структуру, обладает
высокой селективностью и повышенным сроком службы. При анализе химических
свойств реагента и продуктов реакции мы пришли к выводу, что в условиях
проведения процесса возможно образование эфиров и ди- и тримеров изобутилена в
качестве побочных продуктов реакции. При применении катионитов КУ-2 образуются
только димеры.
). В разделе 2 показано, что реакция дегидратации трет-бутилового спирта
термодинамические осуществима в широком интервале температур. С увеличением
температуры увеличивается значение энтропии, константы равновесия и равновесие
смещается в сторону образования продуктов реакции. По принципу Ле-Шателье, на
смещение равновесия вправо влияет уменьшение парциального давления и
концентрации спирта.
Реакция эндотермическая, т.е. сопровождается поглощением тепла, что
обуславливает необходимость применения теплоносителя для поддержания
температуры химической реакции.
). Так как отсутствуют экспериментальные данные по кинетике и механизму
реакции дегидратации трет-бутилового спирта, то в разделе 3 была предложена
общая кинетическая модель для реакций дегидратации спиртов на катионитах..
Такие реакции протекают подчиняются модели Лэнгмюра-Хиншельвуда. Также кинетика
реакции хорошо описывается уравнением Фореста.
Экспериментальные данные свидетельствуют о том, что скорость реакции
замедляется по мере увеличения содержания воды в системе. Поэтому количество
воды нужно поддерживать в определенном количестве, чтобы реакционная смесь
находилась в равновесии с набухшим катализатором.
). По результатам предыдущих разделов в разделе 4 делается выбор
реактора. Агрегатное состояние реагентов и продуктов реакции, температурный
режим и высокий срок каталитической активности определяют необходимость
применения реактора колонного типа с неподвижным слоем катализатора и рубашкой
для обогрева. Катализатор помещают на дренажное колпачковое устройство.
Предварительно катализатор набухает в воде или реакционной смеси. Смесь
реакционных веществ предварительно нагревают и сжимают до рабочего давления.
Так как процесс сопровождается значительным поглощении тепла, в рубашку
реактора подается теплоноситель - пар.
). В разделе 5 найдены некоторые показатели для предлагаемого реактора.
Расход трет-бутилового и воды для получения 1 кмоля в минуту целевого продукта
составляют 1,2505 моль. Тепловая нагрузка на реактор составляет 44,915
кДж/моль. С учетом тепловой нагрузки поверхность теплопередачи равна 93,5 м2.
). В разделе 6 предложена возможная операторная схема процесса.
Предусмотрено возвращение непрореагировавших реагентов в зону химического
превращения При разделении прошедшей через реактор смеси, возможно образование
азеотропной смеси изобутилена и воды и воды и трет-бутилового спирта поэтому
необходимо применять несколько разделительных колонн. Помимо этого в процессе
предусмотрено использование теплообменников и компрессора для создания
необходимых технологических условий.
СПИСОК
ЛИТЕРАТУРЫ
1. Минскер
К.С., Сангалов Ю.А., Изобутилен и его полимеры, -М.:Химия, 1986. - 224с.
. Литвинов
О.Б. Основы технологии синтеза каучуков. -М.:Химия, 1972. - 528с.
. Миракла
И. Метод дегидрирования изобутана. Патент. Россия №5010201/04
. Гютербок
Г. Полиизобутилен и сополимеры изобутилена, Л.:Гостоптехиздат, 1962, 363с.
. Такияма
Йосихиро. Исследование прямого синтеза изобутилена и бутана // Kyushu daigaku Kogaku Shuho=Technol Repots Kyushu Univ.- 1998-71 №4 с.340-342 Япон.
6. Bekheet M.E. Селективная
изомеризация н-бутиленов. // Petrol Sci and Texnol. 1999-17 №1-2 с.189-206.
7. Chen
Hong-vo, yu La-jia. Влияние
ферритных цеолитов допированных ZSM-23
на селективность изомеризации бутена в изобутилен. // Ximen daxual Xuebao. Zitan Kexuc ban=J.Xiamen Univ. Natur Sci. 2000.39 №4 с. 570-576. Кит.
. Pellet Rigis J. Изомеризация н-бутиленов в изобутилен. Патент. США
№5491276.
. Хорев
Ю.М., Морозов Е.В. Изомеризация н-бутилена. -Патент. Россия №551315.
.
Тезисы докладов V конференции по
интенсификации нефтехимических процессов. Нижнекамск: Нефтехимия 99, 1999. Том
1.
. Мирзабекова
С.Р., Мамедов А.Х.. Заявка № 93018269104. Россия “способ конверсии изобутана в
изобутилен ”.
. Чаплиц Д.Н.
Промышленные методы выделения изобутилена. - М.:ЦНИИТЭнефтехим, 1971. - 42с.
13.
Башкагов Т.В., Жигалин Я.Л. Технология синтетического каучука. - Л.: Химия,
1987. - 360с.
14.
Шаронов К.Г., Рожнов А.М.. Извлечение изобутилена из промышленных бутан -
бутиленовых фракций. // Журнал прикладной химии. 2001.74 №4 с.670-674.
.
Шаронов К.Г., Рожнов А.М Заявка № 96111390/04. Россия “Способ выделения
изобутилена ”.
.
Павлов С.Ю., Карпов Н.Л. -Патент. Россия №2083541. “Способ получения
изобутилена из метил - или этилтретбутилового эфира ”.
.
Забористов В.П., Ярулина Р.М. -Патент. Россия №695996. “Точная очистка
изобутилена на анионообменных смолах ”.
.
Письман С.С., Далин М.А.. -Патент. Россия №2083541. “Способ выделения
изобутилена из углеводородной фракции С4 ”.
. Adoms J.R. -Патент. CША №6242661. “Способ отделения
изобутилена от Н-бутиленов”.
.
Усенко М.И., Гусейнов М.М. “Способ получения изобутилена ”. -Патент. Россия
№516667.
.
Гусейнов М.М. Муханглинский Ф.Ф. “Способ получения изобутилена высокой
концентрации”.-Патент. Россия №667538.
.
Сангалов Ю.А., Минскер К.С.. “Термоокислительная деструкция полиизобутилена ”.
-Патент. Россия №729177
.
Общая химическая технология органических веществ. Под ред. Зыкова Д.Д.
-М.:Химия, 1966. - 528с.
. Larsen Custavo, Lotero Edgar -Реакции
дегидратации спиртов в присутствии ZrO2,содержащего
вольфроматы. //J.Catal -1997.-169 №1 с. 67-75.
. Philippou. A., Naderi.
M.Дегидратация трет-бутанола на
основных катализаторах EST-10.
// Catal / Lett -1998-53 №3-4 c.221-224.
.
Петров А.А., Бальян Х.В., Трощенко А.Т..Органическая химия - М.: Высшая школа,
1973. - 623с.
.
Гусейнов М.М., Мухаглинский Ф.Ф.. “Способ получения изобутилена ”. -Патент.
Россия №540855.
. Abella L., Caspillo P. Изучение
кинетики дегидратации трет-бутанола катализированного ионообменными смолами. //
Int. J. Chen Kinet -1999-31 №12 с.854-859
.
Обенаус Ф., Гревинт Б. “Способ получения изобутилена ”.-Патент. ФРГ №1132787А.
. Abella L., Caspillo P. Дегидратации
трет-бутанола путем реактивной дистилляции. // Int. J. Chem Eng.Jap-1999-32
№6 с.742-745.
.
Кирпичнеков П.А., Лаакумович А.Г. Химия и технология мономеров для
синтетических каучуков - Л.:Химия, 1981. - 528с.
. Han Seott “Процесс селективной конверсии изобутилена ”.-Патент.
США №5475181.
33.
Maruga Ken-ichi, Komidga Teruaki. Образование из синтез газа на циркониевых катализаторах. //Sohokibai=Catalysts and Catalysis.-1999.41 №6 с. 397-399.
.
Башкиров А.Н., Крюков Ю.Б. “Извлечение изобутилена из смеси ацетона.”-Патент.
Россия №438631.
.
Микачев М.К., Ходаков Ю.С. “Способ совместного получения изобутилена и
пропилена ”.-Патент. России №472924.
.
Краткий справочник по химии. // Под. ред. Уреленко О.Д. - Киев: Наукова думка.
1974 991с.
.
Темникова Т.И. Курс теоретических основ органической химии. - Л: Химия 1968,
586с.
.
Егоров А.С., Дионисьев В.Д. Химия. -Ростов на Дону: Феникс 1996 736с.
.
Энциклопедия полимеров./ Под. ред. Кабанова. − М.: Советская энциклопедия
1974г. Том 2-3
.
Полянский Н.Г. Катализ ионитами.-М.: Химия. 1981, 246с.
.
Краткий справочник физико-химических величин./Под ред. Разведеля А.А.
Пономарева А.М. - Санкт-Петербург, 1999. 184с.
.
Киреев В.А. Курс физической химии. М.: Химия. 1975,776с.
.
Сайкс П. Механизм реакции в органической химии. М.:Химия. 1973, 316с.
.
Лиакумович.Н.Г. Химия и технология мономеров для синтетических каучуков.-
Л.:Химия. 1981,246с.
.
Чаплиц Д.Н.Дегидратация трет-бутилового спирта в реакторе новой конструкции.
//Химическая промышленность.1966, №10 с.734-736.
.
Чаплиц Д.Н.Дегидратация триметилкатбинольной фракции на катионите КУ-1.
//Химическая промышленность.1968, №9 с.658-660.
.
Ионообменные методы очистки веществ. /Под. ред. Чикина Г.А. Воронеж: ВГУ,
1984-372с.
.
Михаил Р., Кырлогану К. Реакторы в химической промышленности. Л.: Химия, 1968,
388 с.
.
Чаплиц Д.Н., Самохвалова И.Д. Кинетика дегидратации трет-бутилового спирта на
ионообменной смоле. // Химическая промышленность.1966, №5 с.334-338.