Стеклообразование в системах NaF – MeF2 – CdSO4 (Me – Ca, Ba)
ВВЕДЕНИЕ
Проблеме стеклования неорганических веществ
посвящено значительное число работ. Исследования оксидных, сульфидных,
галогенидных, сульфатных или смешанных стекол и построение структурных моделей
стеклообразования в большинстве случаев основывается на сравнении результатов,
полученных различными методами исследований кристаллических и стеклообразных
систем близкого химического состава. Такой подход справедлив в том случае, если
ближнее окружение центрального атома предполагается идентичным как для кристаллического,
так и для стеклообразного состояний. В дополнение к данному подходу, который
основывается на знаниях кристаллохимии, в последнее время делаются попытки
развить новый способ описания закономерностей стеклообразования с
использованием представлений о расплавленном состоянии. Использование
комплексно-кластерной модели строения солевых расплавов раскрывает широкие
перспективы в понимании химических и физико-химических закономерностей процесса
стеклообразования, причин формирования той или иной сетки стекла, влияния
химической природы и концентрации компонентов стеклообразующей системы на
структуру и свойства получаемого стекла [1].
В структурных моделях авторы предлагали
количественные критерии стеклования, основанные на изучении классов стекол,
содержащих бинарные соединения: оксиды, халькогениды, галогениды. В работах
Байдакова Л.А. предложен метод расчета стеклообразующей способности вещества на
основе квантовых характеристик атомов, входящих в данное вещество, и учета
природы взаимодействия между ними [2].
Целью настоящей работы является определение
областей стеклования и физико-химических свойств стекол в системах NaF - MeF2 -
CdSO4 (Me - Ca, Ba).
Задачами исследования являются:
Построение диаграмм плавкости систем CdSO4 -
NaF; CaF2 - CdSO4; NaF - BaF2; BaF2 - CdSO4.
Теоретическое и экспериментальное определение
областей стеклования расплавов образцов систем NaF -
CaF2 -
CdSO4 и NaF - ВaF2 - CdSO4, условий
получения стекол, изучение термической стабильности и оптической прозрачности
стекол.
Научная новизна работы заключается в следующих
результатах:
Впервые построены диаграммы плавкости 4 систем в
температурном интервале от 500 К до температур полного расплава.
В системах NaF - CaF2 -
CdSO4 и NaF - ВaF2 - CdSO4 расчетным
путем определены области стеклования, границы которых подтверждены
экспериментальными исследованиями. Имеющаяся корреляция между расчетными
значениями областей стеклования и результатами эксперимента свидетельствует о
достоверности выбора критериев стеклообразования.
Определены характеристические температуры,
критерии термической стабильности и области прозрачности стекол. С увеличением
радиуса иона щелочноземельного металла область стеклования и термическая
стабильность стекол увеличивается. Область прозрачности синтезированных стекол
находится в интервале от 258-270 нм до 7-8 мкм.
Практическая значимость.
Определены области стеклования в системах NaF -
CaF2 -
CdSO4 и NaF - ВaF2 - CdSO4.
Синтезированные стекла, обладающие высокими значениями пороговых длин волн в
инфракрасной области (до 8.0 мкм), предложены к использованию в качестве ИК
окон.
Представлена возможность использования концепции
расчета стеклообразующей способности ковалентного расплава для систем, имеющих
соединения со сложным анионом.
Полученные результаты могут быть использованы
как справочные данные, дополняющие представления о химии фторсульфатных стекол.
На защиту выносятся:
Диаграммы плавкости систем CdSO4 - NaF; CaF2 -
CdSO4; NaF - BaF2; BaF2 - CdSO4.
Теоретический расчет стеклообразующей
способности ковалентного расплава и экспериментальное подтверждение областей
стеклования в системах NaF - CaF2 -
CdSO4 и NaF - ВaF2 - CdSO4.
Термическая стабильности и оптическая
прозрачность полученных стекол.
Апробация работы. Результаты работы были
представлены на XXI Российской молодежной научной конференции (Екатеринбург,
2011); студенческой научной конференции (Тюмень, ТюмГУ, 2011 - диплом первой
степени).
Публикации. По теме диссертации опубликовано 2
научные статьи (Вестник ТюмГУ, 2009, 2011) и 1 тезис доклада.
ГЛАВА 1. ЛИТЕРАТУРНЫЙ ОБЗОР
1.1 Стеклообразное состояние веществ
1.1.1 Определение стекол
Стекла представляют собой аморфные тела,
получаемые путем переохлаждения расплава, независимо от их химического состава
и температурной области затвердевания, и обладающие в результате постепенного
увеличения вязкости механическими свойствами твердых тел, причем процесс
перехода из жидкого состояния в стеклообразное должен быть обратимым
(определение, предложенное комиссией по научной терминологии АН СССР) [3].
Наряду с кристаллическим состоянием для твердых
веществ довольно распространенной формой существования является стеклообразное
состояние. Для этого состояния вещества характерно наличие некоторых
специфических физико-химических особенностей, выделяющих стеклообразные
вещества среди других твердых тел.
К числу физико-химических особенностей
относятся:
изотропность стеклообразных веществ, что
означает независимость значений свойств от направления их измерения. Такая
особенность стеклообразных веществ определяется их своеобразной структурой;
стеклообразное состояние характеризуется
избыточным запасом энергии по сравнению с внутренней энергией того же вещества
в кристаллическом состоянии. Как и изотропность, это свойство также
определяется специфической структурой стеклообразных веществ, отличающихся от
структуры кристаллов;
стекло отличается от кристаллических веществ
поведением в процессе перехода из расплавленного в твердое состояние. В отличие
от расплавов кристаллических веществ, для которых характерно резкое повышение
вязкости при температуре кристаллизации и скачкообразный переход в твердое
состояние, расплавы стекол, при понижении температур, делаются все более и
более вязкими и, в конце концов, становятся механически твердым телом. Таким
образом, процесс перехода из жидкого состояния в твердое стеклообразное
совершается в более или менее широком интервале температур. Следует отметить,
что переход из жидкого состояния в твердое является обратимым и может быть
повторен при соблюдении определенных режимов множество раз;
физико-химические свойства стекол при переходе
из расплавленного жидкого состояния в твердое состояние изменяются непрерывно
[4, 5, 6].
1.1.2 Условия стеклообразования
Принципиальное отличие при переходе вещества из
расплавленного состояния в кристаллическое и стеклообразное заключается в
следующем: переход в кристаллическое состояние сопровождается скачкообразным
изменением удельного объема, энтальпии, энтропии, вязкости и других свойств.
При переходе же из расплавленного состояния в стеклообразное жидкость
переохлаждается ниже точки фазового равновесия и ее свойства непрерывным
образом изменяются с температурой.
Стеклование является релаксационным процессом,
вследствие чего переход в стеклообразное состояние должен зависеть от скорости
охлаждения. Имеется достаточно много экспериментальных данных, подтверждающих
такую взаимосвязь.
Процесс стеклообразования определяется
следующими факторами:
внутренними, зависящими от природы веществ,
находящихся в расплавленном состоянии; эти факторы стеклования расплавов
связаны со строением атомов, входящих в состав расплава, и характером сил
взаимодействия между ними;
внешними, зависящими от условий термообработки.
Наиболее общим условием перехода в
стеклообразное состояние является возможность переохлаждения расплава до таких
температур, при которых вязкость становится достаточно большой, достигая
значений порядка 1013 Па×с. Очевидно, что расплав
перейдет в стеклообразное состояние, если в процессе охлаждения в нем не
возникнет ни одного зародыша кристаллизации, что исключает процесс
кристаллизации полностью.
Кристаллизация может быть подавленна полностью
путем создания достаточно большой скорости охлаждения в температурном интервале
зародышеобразования. Из экспериментальных данных может быть определена
минимальная скорость охлаждения, необходимая для подавления кристаллизации.
Все вещества по способности к стеклообразованию
можно разделить на четыре большие группы:
) Стеклобразователи, т.е. вещества, которые при
охлаждении из расплава образуют стекла. Это такие классические
стеклообразователи как SiO2, P2O5.
) Условные стеклообразователи, т.е. вещества,
которые сами по себе стекол не образуют, но способны их образовывать в смеси с
другими веществами.
Например: Ga2S3, CdSO4 - условные
стеклообразователи, сами стекло не образуют.
) Модификаторы - вещества, которые в смеси с
условными стеклообразователями способствуют образованию стекла. К ним,
например, относятся соединения щелочных и щелочноземельных металлов.
) Вещества, которые не имеют отношения к
стеклообразованию. [7].
1.1.3 Свойства стекол
Все типы стекол, независимо от их химического
состава и температурной области затвердевания, обладают специфическими
свойствами, которые отличают их от кристаллов и жидкостей.
Сопоставление понятий “свойство - состав”
стеклообразных систем показывает, что большинство свойств в первом приближении
можно разделить на две группы - простые и сложные. К первой группе относятся
свойства, находящиеся в сравнительно несложной зависимости от молярного состава
и поэтому поддающиеся количественному расчету, например: молярный объем,
показатель преломления, средняя дисперсия, термический коэффициент линейного
расширения, диэлектрическая проницаемость, модуль упругости, удельная
теплоемкость, коэффициент теплопроводности.
Ко второй группе относятся свойства гораздо
более чувствительные к изменению состава. Зависимость их от состава сложна и
часто не поддается количественным обобщениям. Это такие свойства как: вязкость,
электропроводность, скорость диффузии ионов, диэлектрические потери, химическая
стойкость, светопропускание, твердость, поверхностное натяжение,
кристаллизационная способность и др. Расчет этих свойств возможен лишь в
частных случаях.
На свойства первой группы различные компоненты
оказывают соизмеримое воздействие, которое можно выразить теми или иными
критериями одного порядка.
Свойства второй группы в решающей мере зависят
от концентрации щелочей или от концентрации каких либо других избранных
компонентов.
К особой группе свойств следует отнести
прочностные характеристики стекол. Влияние состава на прочность стеклянных
изделий, исключая стеклянное волокно, обычно трудно выявить, так как более
важную роль играют другие факторы, обусловленные внешними воздействиями.
К важнейшим свойствам стекла относят:
. Стекла рентгеноаморфны вследствие
неупорядоченного атомного строения. В структуре стекла отсутствует дальний
порядок, т. е. систематическая повторяемость элементарных объемов структуры,
характерная для кристаллических веществ.
Если ориентировочно определить межплоскостное
расстояние, соответствующее максимуму аморфного гало, то оно оказывается
близким основному дифракционному максимуму кристобалита - 0,415 нм. Однако в
структуре стекла частицы находятся не на строго определенных расстояниях, как в
кристобалите или других кристаллических модификациях кварца, а на расстояниях
больших и меньших относительно некоторого среднестатистического значения.
. Стекла изотропны, если они однородны по
составу, свободны от напряжений и дефектов. Изотропия свойств стекол, как и
других аморфных сред, обусловлена отсутствием направленной в пространстве
ориентации частиц. Оптическая анизотропия может возникнуть в стекле в
результате действия растягивающих или сжимающих напряжений (явления оптической
анизотропии) [8].
Свойства размягченного и расплавленного стекла.
Вязкость - свойство жидкостей оказывать
сопротивление перемещению одной части жидкости другой. Согласно постулату
Ньютона, сила необходимая для поддержания постоянной разности скоростей между
двумя движущимися параллельными слоями жидкости, равна: F=hs
где h - динамическая
вязкость- поверхность раздела фаз
 - градиент
скорости
- градиент
скорости
Различают также кинематическую вязкость:
u = 

Силикатные расплавы, если они не содержат
кристаллических взвешенных частиц, ведут себя как нормальные ньютоновские
жидкости. Однако в области размягчения в них нередко наблюдаются характерные
признаки структурирования.
Вязкость является основным свойством стеклообразующего
расплава. Вязкость характеризует внутреннее трение, возникающее при перемещении
одного слоя расплава относительно другого. Вязкость выражается силой (на
единицу площади соприкосновения двух слоев), которая достаточна для поддержания
определенной скорости перемещения одного слоя относительно другого. Единица
измерения вязкости Па∙с. Вязкость имеет важное значение для
технологических процессов получения стекла и изделий из него: определяет
скорости варки, осветления и гомогенизации стекла. Скорость растворения и
химического взаимодействия компонентов в расплаве и диффузионных процессов тем
больше, чем меньше вязкость стекломассы. Скорость осветления, которая
выражается скоростью подъема газовых пузырей, также увеличивается с уменьшением
вязкости. Широкий диапазон изменения вязкости обеспечивает возможность
формования стекла различными способами. С вязкостью связаны процессы
термической обработки стеклоизделий. При отжиге вязкость определяет скорость
снятия внутренних напряжений. При закалке быстрое возрастание вязкости
“замораживает” определенное распределение напряжений и изделие приобретает
повышенную прочность. Важнейшей технологической характеристикой является
зависимость вязкости стекла от температуры. Характер изменения вязкости стекла
при изменении температуры служит основой для определения температурных режимов
варки, формования и термообработки.
Плавкость - практическая величина,
характеризующая скорость размягчения стекла и растекания вязкого расплава по
твердой поверхности при различных температурах. Плавкость представляет собой
сложную функцию вязкости, поверхностной энергии на границах фаз,
кристаллизационной способности, температуры начала кристаллизации и плотности
состава.
Смачивающая способность - способность расплава
по отношению к различным твердым поверхностям смачивать их, и характеризуется
краевым углом смачивания и краевым углом растекания и оттекания.
Оптические свойства стекла.
Показатель преломления и дисперсия - способность
стекла преломлять падающий на него свет, принято характеризовать посредством
показателя преломления для желтого луча, испускаемого накаленными парами натрия
( nД ), либо светящимся гейслеровской трубке
гелием. Разница между этими величинами ничтожна, так как длины волн весьма
близки.
Показатель преломления равен отношению синуса
угла падения лучей к синусу угла преломления. Показатель преломления зависит от
длины волны света и свойств среды.
Дисперсия это отношение показателя преломления,
уменьшенного на единицу, к средней дисперсии.
u = (nД - 1)/(nF - nC)
Дисперсия света - разложение светового луча в
спектре при его преломлении. Величина дисперсии света стекла прямо зависит от
химического состава материала. Наличие в стекломассе тяжелых оксидов
увеличивает показатель дисперсии.
Отражение света - это возвращение светового луча
при его падении на поверхность двух сред, имеющих различные показатели
преломления.
Коэффициент отражения - отношение светового
потока, отраженного стеклом, к световому потоку, падающему на него. Количество
света, отраженного стеклом, тем больше, чем больше угол его падения. Количество
света, отраженного от поверхности стекла, составляет около 4 %. Коэффициент
отражения зависит от состояния поверхности и наличия на ней различных веществ.
Поглощением света определяют способность той или
иной среды уменьшать интенсивность прохождения светового луча. Показатель
поглощения света стекол невысок. Он увеличивается лишь при изготовлении стекла
с применением различных красителей, а также особых способов обработки готовых
изделий.
Пропускание и поглощение стекол оценивают на
спектрофотометрах с применением плоскопараллельных образцов стекла. Эта оценка
имеет важную значимость в производстве окрашенных стекол. Показатели
пропускания (поглощения) в видимой области спектра важны для оценки цвета
бытовых, сигнальных и других окрашенных стекол. Показатели пропускания
(поглощения) в инфракрасной области спектра важны для варки стекла и формования
изделий (теплопрозрачность стекол), а в ультрафиолетовой области спектра - для
эксплуатационных свойств стекол (изделия из увиолевого стекла должны пропускать
ультрафиолетовые лучи, а тарные стекла - задерживать их для сохранности
содержимого тарных изделий). При неравномерном охлаждении или нагревании в
стекле возникают внутренние напряжения, вызывающие двойное лучепреломление.
Рассеяние света - это отклонение световых лучей
в различных направлениях. Показатель рассеяния света зависит от качества
поверхности стекла. Так, проходя сквозь шероховатую поверхность, луч частично
рассеивается, и потому такое стекло выглядит полупрозрачным.
Явление рассеяния света относится к непрозрачным
стеклам. В обычном прозрачном стекле рассеяния света практически не происходит.
Пучок лучей света, направленный на матовую поверхность, выходит с другой
стороны разбитым на множество направлений вследствие неодинакового преломления
отдельных лучей на неровной (матовой) поверхности стекла. В глушеных стеклах
находятся угловатые или сферические частицы глушителей, отличающиеся
показателем преломления от основной массы стекла. Лучи света, падающие на
стекло, претерпевают многократное преломление и отражение, что и вызывает
рассеяние света. Размеры частиц глушителей в стекле составляют 0,2-10 мкм. С
увеличением размера частиц рассеяние света стеклом возрастает [9].
1.2 Кристаллизация оптических стекол
Одним из очень распространенных пороков,
возникающих при производстве оптического стекла, является наличие в стекле
кристаллических включений. Эти включения приводят к рассеянию света, нарушают
однородность оптического стекла, искажают изображение; вокруг кристаллов
возникают сильные напряжения, которые нельзя уничтожить отжигом, и т.п.
Так как стекло представляет собой
переохлажденную жидкость, то его кристаллизация может рассматриваться как
частный случай кристаллизации жидкости. Поэтому закономерности, известные для
кристаллизации жидкости, можно распространять на стекла. В жидком состоянии, по
сравнению с кристаллическим, вещество обладает избытком свободной энергии.
Поэтому если по достижении соответствующей температуры от вещества отвести
некоторое количество энергии, то теоретически оно обязательно должно
закристаллизоваться. Однако нередко жидкость застывает в виде стекла.
Несмотря на то, что в кристаллическом состоянии
вещество обладает меньшим запасом свободной энергии и поэтому является более
устойчивым, самопроизвольно процесс перехода из стеклообразного состояния в
кристаллическое не происходит. Чтобы этот процесс начался, необходимо затратить
определенное количество энергии для преодоления потенциального барьера перехода
из метастабильного стеклообразного состояния в стабильное кристаллическое.
Наиболее благоприятными с этой точки зрения являются поверхности раздела фаз,
так как они обладают избытком энергии по сравнению с массой стекла и
образование на них кристаллического зародыша происходит с большей легкостью.
Поэтому необходимым условием кристаллизации стекол является наличие границ
фазового раздела. В одних случаях этими границами являются микроповерхности:
микрокристаллики, капли микрорасслаивания, ничтожные примеси и пр., а в других
- макроповерхности: стенки сосуда, граница стекло - воздух и т. п.
Опыт показывает, что кристаллизация стекол
бывает либо поверхностной, т.е. такой, которая начинается у поверхности раздела
стекло-воздух или стекло-стенка сосуда, в котором оно находится, либо объемной,
т.е. такой, которая начинается сразу по всей массе кристаллизуемого образца на
микроповерхности раздела. Для большинства оптических стекол характерна
поверхностная кристаллизация.
По Тамману, способность стекла к кристаллизации
определяется двумя моментами: числом центров кристаллизации, образующихся в
единицу времени в единице объема (так называемая самопроизвольная
кристаллизация), и линейной скоростью роста кристаллов в определенном
направлении.
Для определения кристаллизационной способности
стекол применяют несколько методов.
Метод закалки заключается в том, что небольшой
осколок стекла, помещенный в платиновую фольгу, выдерживается некоторое время в
термостатированной печи; после закалки образца измеряется максимальная длина образовавшихся
в нем кристаллов. При одновременном выдерживании в термостатированной печи
большого количества осколков различных стекол он получил название «метода
массовой кристаллизации».
Политермический метод - выдерживание образца
стекла в печи с постоянным распределением температуры и последующее определение
степени его кристаллизации. Этот метод самый распространенный.
Разновидностью политермического метода изучения
кристаллизационной способности стекол является так называемый двойной
политермический метод, позволяющий достаточно быстро изучать влияние
предварительной термической обработки стекла на степень и характер его
кристаллизации.
В описанных методах изучение кристаллизации
происходит в две стадии: выдерживание стекла в печи в течение определенного
времени и затем, после замораживания того состояния, которое было достигнуто,
исследование характера кристаллизации и выделившихся из стекла кристаллических
фаз. Но есть методы, которые дают возможность непосредственного наблюдения за
процессом кристаллизации стекла во время его термической обработки. Здесь
применяется так называемый высокотемпературный микроскоп.
Оптические стекла исключительно разнообразны по
своему химическому составу и поэтому очень сильно отличаются друг от друга по
характеру и степени кристаллизации. Однако для большинства оптических стекол
один признак является общим - они обладают поверхностной кристаллизацией,
начинающейся у поверхностей раздела стекло-воздух и стекло-стенки сосуда, в
котором они варятся. И только в очень редких случаях наблюдается объемная
кристаллизация, начинающаяся сразу по всей массе стекла.
У одних стекол кристаллизация так и остается
поверхностной и с увеличением длительности термической обработки происходит
только усиление кристаллизации и утолщение поверхностного кристаллического
слоя. Это характерно для вязких стекол, например богатых кремнеземом, а также
для стекол, у которых выделяющаяся кристаллическая фаза по своей плотности не
очень отличается от плотности самого стекла.
У других стекол кристаллы, предварительно
образовавшись на поверхностях раздела, не остаются на них, а проникают в толщу
стекла в результате отрыва от поверхностного слоя. Этому способствуют
конвекционные потоки и резкое различие в плотности кристаллов и стекла.
Последнее приводит к всплыванию или уплотнению кристаллов. В отличие от
поверхностной, такая кристаллизация названа глубинной.
Иногда высокотемпературной кристаллизации
способствует селективное улетучивание компонентов стекла, которое вызывает
образование на поверхности расплава слоя, обогащенного компонентом, входящим в
состав выделяющейся кристаллической фазы.
Особенно опасной является глубинная или объемная
кристаллизация, так как достаточно образоваться ничтожному количеству
кристаллов, чтобы все стекло было приведено в полную негодность.
Единственной возможностью предупреждения
кристаллизации стекла, склонного к глубинной кристаллизации, а также
неустойчивых стекол является отливка или выработка при температуре выше верхней
границы кристаллизации и быстрое охлаждение расплава до температуры, меньшей,
чем это отвечает нижней границе кристаллизации.
Иногда при большой кристаллизационной
способности, высокой верхней границе кристаллизации, наличии глубинной
кристаллизации и прочих неблагоприятных условиях нельзя получить стекло без
кристаллических образований только путем изменения температурно-временного
режима варки и разделки стекломассы. В этом случае необходимо понизить
кристаллизационную способность стекла или изменить характер кристаллизации, что
достигается соответствующим изменением его химического состава.
Для изменения состава стекла с целью понижения
его кристаллизационной способности применяется метод, основанный на следующем
правиле: в стеклообразующих системах, в пределах поля кристаллизации данного
соединения, максимальной кристаллизационной способностью обладает стекло,
соответствующее составу соединения; для стекол других составов в этом же поле
кристаллизации наблюдается уменьшение кристаллизационной способности по мере
удаления их составов от состава соединения; кристаллизационная способность
достигает минимума в области совместной кристаллизации данного соединения с
соединениями другого химического состава.
1.3 Химические и физико-химические
свойства NaF, CaF2, BaF2 и CdSO4
Благодаря особенностям химии фтора фториды
металлов во многих отношениях отличны от других галогенидов. Вследствие
близости атомных и ионных радиусов фтора и кислорода многие фториды и оксиды
металлов характеризуются аналогичным составом и кристаллохимическим строением,
например NaF и СаО. Другие галогениды с таким же формульным составом нередко
имеют другую структуру и даже могут давать молекулярные решетки. Это
свидетельствует о высокой ионности фторидов по сравнению с другими галогенидами
металлов. Наивысшая окислительная активность и наибольшая ОЭО фтора
обосновывают тот факт, что фториды металлов наиболее тугоплавки и термически
стабильны по сравнению с другими галогенидами.
Обращает на себя внимание большое значение то,
что энергия Гиббса для фторида резко отличается от других галогенидов. Это одна
из причин малой растворимости в воде (искл. фторид калия и некоторых других
металлов). Таким образом, даже по растворимости фториды в какой-то мере
противостоят остальным галогенидам металлов. Во фторидах металлы способны
проявлять высшие степени окисления. При этом образование низших фторидов
металлов мало характерно и они менее стабильны. Из металлов IА-группы
наибольшим сродством к фтору обладает литий, а для натрия и металлов подгруппы
калия значения энергии Гиббса образования фторидов практически одинаковы, что
наблюдается и для s-металлов II группы периодической системы. Из sр-металлов
наиболее прочный фторид образует алюминий. В подгруппах sр-металлов сверху вниз
стабильность фторидов несколько уменьшается. Подобно алюминию металлы подгруппы
скандия и лантаноиды образуют с фтором устойчивые характеристические
трифториды. Все лантаноиды характеризуются практически одинаковыми значениями
энергии Гиббса образования трифторидов. В подгруппах металлов с полностью
заселенными электронами d-орбиталями в соответствии с уменьшением металличности
элементов сверху вниз уменьшается энергия Гиббса образования их фторидов. В то
же время для подгрупп металлов с дефектными d-орбиталями, как и следовало
ожидать, наблюдается обратная картина. Фториды металлов с преимущественно
ионной связью функционируют как основные вещества. Поэтому они образуют
комплексы с фторидами металлов в высокой степени окисления, проявляющими себя
как кислотные фториды. Хотя фторид-ион является лигандом не очень сильного
кристаллического поля (образует, как правило, высокоспиновые комплексы), тем не
менее, фторокомплексы металлов характеризуются большой прочностью и высокими
координационными числами [10 - 14].
Фторид натрия. Мало растворим в воде (4,11 г/л
при 0оС). Взаимодействует почти со всеми фторидами металлов III - VII групп и
Be с образованием фторметаллатов натрия, например:
3NaF + AlF3 = Na3AlF6.
При растворении в HF, а также при взаимодействии
с газообразным фтороводородом образует бифторид натрия NaHF2:
NaF + HF = NaHF2.
В природе NaF встречается в виде минерала
виллиомита [15].
Кристаллический CaF2 получают при нейтрализации
карбоната кальция разбавленной плавиковой кислотой. При действии ионов F- на
раствор соли кальция, CaF2 выпадает виде студенистого осадка. CaF2 очень трудно
растворим в воде (16 мг/л при 18оС), однако легко образует коллоидные растворы.
С фтористым водородом дает легко растворимую кислую соль CaF2∙2HF∙6H2O.
Некоторые другие вещества также повышают его растворимость. Безводный фтористый
кальций представляет собой порошок, плавящийся без разложения при 1403оС
(т.кип. 2500оС). При нагревании с концентрированной серной кислотой выделяется
фтористый водород в соответствии с уравнением
CaF2 + H2SO4 = CaSO4 + 2HF.
В разбавленных сильных кислотах фтористый кальций
почти не растворим. В природе он распространен в значительных количествах в
виде плавикового шпата (флюорита). Кроме производства плавиковой кислоты и
травления стекла, фтористый кальций находит применение в эмалевой
промышленности в качестве средства для глушения эмалей (придания им
непрозрачности), а также как антисептик.
Фтористый кальций имеет особо высокую теплоту
образования и поэтому даже при высоких температурах он очень устойчив к
действию восстановителей, и, прежде всего, расплавленных металлов [12, 14, 15].
Фторид бария представляет собой бесцветные
кристаллы. До 970°С устойчива α-фаза
с кубической кристаллической решеткой типа флюорита (а = 0,62001 нм,
пространственная группа Fm3m); плотность 4,893 г/см3. При 970°С переходит в
разупорядоченную фазу (∆Н перехода 5,4 кДж/моль), при 1207°С - в γ-фазу
(∆Н0 перехода 2,5 кДж/моль).
Температура плавления tпл = 1368°С, температура
кипения около 2250°С; С°р = 71,0 Дж/(моль*К); 
 = 17,5 кДж/моль;
= 17,5 кДж/моль; 
 = 271 кДж/моль,
= 271 кДж/моль, 
 - 1136 кДж/моль;
S298 = 96,4 Дж/(моль*К).
- 1136 кДж/моль;
S298 = 96,4 Дж/(моль*К).
Плохо растворим в воде (1,607 г/л при 20°С),
лучше - в водных растворах HF, не растворяется в органических растворителях.
Выше 500°С гидролизуется парами воды; с HF способен образовывать термически
неустойчивые гидрофториды.
Фторид бария встречается в природе в виде
редкого минерала франкдиксонита. Фторид бария используется для изготовления
плоскопараллельных пластин, линз и призм. Диапазон пропускания: 0,15 мкм - 9
мкм. Фторид бария выращивается вакуумным методом Стокбаргера.
Фторид бария - компонент стекол, эмалей, флюсов,
защитных покрытий на металлах, материал для ИК-оптики и лазеров (прозрачен в
области 71430-833 см-1); сорбент при очистке UF6. Фторид бария токсичен. ПДК 1
мг/м3 (в пересчете на HF) [16].
Сульфат кадмия CdSO4 (молекулярная масса 208,47
г/моль) представляет собой белый кристаллический порошок, кристаллизующийся в
ромбической системе. Он легко растворим в воде, но нерастворим в спирте.
Сульфат кристаллизуется из водного раствора в моноклинной системе с 8/3
молекулами воды (CdSO4·8/3H2O), устойчив до 74°С, но при более высокой
температуре переходит в одноводный сульфат (CdSO4·H2O). Существуют
кристаллогидраты CdSO4.nH2O (n = 7, 6, 4, 1). С повышением температуры
растворимость сульфата несколько возрастает, но при дальнейшем повышении
температуры снижается [17].
1.4 Критерии стабильности стекол
Для оценки стабильности стекла используется ряд
критериев, основанных на характеристических температурах Tg (соответствует
переходу стекла в состояние переохлажденного расплава), Тх (соответствует
началу кристаллизации), Тс (соответствует концу кристаллизации), Тl
(температура ликвидуса).
В первом приближении мерой термической
стабильности стекол является величина Tg/Тх. Чем она выше, тем больше
стеклообразующая способность системы и тем медленнее идет процесс
расстекловывания при нагреве стекла вблизи Tg. Это так называемое «правило двух
третей», согласно которому для большинства стеклообразующих систем в широком
интервале температур (100-2000 К) и при скорости охлаждения расплава
10-2<Vохл<10 К/с, выполняется условие Tg/Тх ≈ 2/3. при этом
уменьшение приведенной температуры стеклования трактуется как снижение
тенденции системы к стеклообразованию.
Кроме Tg/Тх для количественной оценки
термической стабильности стекол используют величины разница между температурой
начала кристаллизации и температурой стеклования:
∆Т = Тх - Tg,
приведенная температура:
Н´
= ∆Т/Tg,
критерий Груби, определяет способность к
стеклованию образцов:
Нr = ∆Т/(Тl - Тх).
Чем выше значение Нr, тем легче получить стекло
и тем выше его устойчивость. При Нr ~ 0,1 получение стекла затруднительно и
требует специального подбора условий эксперимента, при Нr = 0,5 стекло можно
получить, охлаждая расплав на воздухе, при Нr > 1,0 устойчивость стекла
высока.
Критерий стабильности стекла, вычисляемый по
уравнению Саде-Пуле [18], учитывающий как Tg, так и разности между
температурами начала кристаллизации и максимума экзотермики:
S = (Тс - Тх) (Тх - Тg)/Tg [19, 32, 33]
1.5 Количественный критерий
стеклообразующей способности вещества на основе учета природы химической связи
Данный подход не связан с предварительным
экспериментальным исследованием каких-либо свойств вещества, его структуры и
т.п., достаточно лишь знать состав вещества и положение химических элементов,
входящих в него, в периодической системе. Последнее и определяет вклад каждого
элемента в зарядовое число Z, главное квантовое число валентных электронов n,
осуществляющих химическую связь, орбитальное квантовое число l и усредненное
магнитное квантовое число ml на атом АхВу, для которого х+у…=1, где А, В - типы
атомов вещества. В [19 - 21] было установлено, что исходя из атомно-структурных
характеристик компонентов вещества Z, n, l, ml можно рассчитать теоретическую
стеклообразующую способность ковалентного расплава GT. Расчет проводится по
формуле:

 (1)
(1)
Величина n является средним значением главного
квантового числа валентных электронов, осуществляющих химическую связь, и
рассчитывается по формуле:

 , (2)
, (2)
где n - среднее главное число валентных
электронов i - го элемента; Ni - его мольная доля в стекле.
Величина Z - средний заряд ядра элементов,
входящих в состав данного вещества:
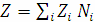
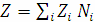 , (3)
, (3)
где Zi - значение заряда ядра в формульной
единице i -го элемента.
Величина К - жесткость электронного каркаса
химических связей (ЭКХИС) является функцией электронной структуры свободного
атома, определяемой квантовыми числами, и для ковалентных веществ может быть
рассчитана, исходя из представлений Р.Л. Мюллера о дискретно-локализованных
связях в структурных единицах (СЕ), составляющих данное ковалентное вещество,
как отношение числа связей λ в
СЕ к числу атомов в ней ν, т.е. 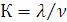
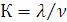 . Однако такой
подход справедлив для преимущественно ковалентных веществ, у которых число
связей атома равно его координационному числу. При значительной поляризации
химических связей, как, например, в оксидах или галогенидах s - элементов,
представление о дискретно-локализованных связях и расчет жесткости (ЭКХИС) по
соотношению становится некорректным. Различие рассчитанных и реальных величин
жесткости каркаса связей в таких веществах обусловлено вкладом ионной
составляющей в химическое взаимодействие компонентов. Для учета этого вклада,
увеличивающего число эффективных связей центрального атома с окружением, была
введена поправка для соединений модификаторов. К ним отнесены вещества,
катионообразователи которых имеют электроотрицательность ЭО <1,6. Это
позволило использовать представление о валентных возможностях химических
элементов, определяемых их электронной структурой, для расчета жесткости ЭКХИС
в соответствующих сложных веществах. Так, число неспареных валентных электронов
u химического элемента с ЭО <1,6 может быть взято за основу расчета К:
. Однако такой
подход справедлив для преимущественно ковалентных веществ, у которых число
связей атома равно его координационному числу. При значительной поляризации
химических связей, как, например, в оксидах или галогенидах s - элементов,
представление о дискретно-локализованных связях и расчет жесткости (ЭКХИС) по
соотношению становится некорректным. Различие рассчитанных и реальных величин
жесткости каркаса связей в таких веществах обусловлено вкладом ионной
составляющей в химическое взаимодействие компонентов. Для учета этого вклада,
увеличивающего число эффективных связей центрального атома с окружением, была
введена поправка для соединений модификаторов. К ним отнесены вещества,
катионообразователи которых имеют электроотрицательность ЭО <1,6. Это
позволило использовать представление о валентных возможностях химических
элементов, определяемых их электронной структурой, для расчета жесткости ЭКХИС
в соответствующих сложных веществах. Так, число неспареных валентных электронов
u химического элемента с ЭО <1,6 может быть взято за основу расчета К:

Первое слагаемое является суммой произведений
числа неспареных электронов i-х свободных атомов или степеней окисления i-х
катионообразователей в сложном веществе, удовлетворяющих критерию ЭО<
1,6, на их мольную долю Nik . Этот член учитывает ионный вклад
катионообразователей.
Второе - сумма (x/y)i - отношение индексов i-х
катионообразователей и анионообразователей на мольную долю i-х
анионообразователей. Учитывает вклад ковалентной составляющей связи металл -
неметалл (Me - F).
Третье - сумма (x/y)i мольных долей i-х доноров
Nid, т.е. учитывает вклады донорно-акцепторного взаимодействия металл -
неметалл (Ме←F).
Четвертое - эффективное число химических связей
в веществе, влияющее на жесткость структуры, может быть рассчитана только с
учетом всех факторов, влияющих на природу химического взаимодействия атомов, в
том числе металлизация связи, которая учтена добавочным членом:
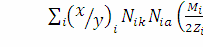
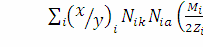
где Nik, Nia -мольные доли i-х катионо- и
анионообразователей элементов, входящих в вещество; Мi -средняя мольная масса.
Множитель Mi/2Zi-1 монотонно возрастает по мере
увеличения порядкового номера элементов Zi, отражая тем самым усиление
металлизации химических связей.
Условием стеклообразования ковалентного расплава
является следующее соотношение:
0,09 £ GТ £
0,36.
Кроме этого, для классических
стеклообразователей по Захариасену, расплавы, которые стеклуются при их
самопроизвольном охлаждении (скорость охлаждения < 100 град/с).
Кроме величины GТ необходимо учитывать величину
стеклообразующей способности, рассчитанную из полуэмпирического уравнения,
которое справедливо для классических стеклообразователей:

 (5)
(5)
где А, В - эмпирические константы: А = 30,84; В
= 9,04
Вторым условием образования стекла условными
стеклообразователями в сочетании с модификаторами сетки является соотношение:

 (6)
(6)
Если же величина относительного отклонения  лежит
в пределах от 10 до 12 %, то расплав способен стекловаться, но только при
быстрых скоростях охлаждения (q > 100 град/с) [2,
22, 23].
лежит
в пределах от 10 до 12 %, то расплав способен стекловаться, но только при
быстрых скоростях охлаждения (q > 100 град/с) [2,
22, 23].
1.6 Диаграммы плавкости систем
NaF - MeF2, NaF - CdSO4, MeF2 - CdSO4 (Me - Ca,
Ba)
В литературе представлена диаграмма плавкости
системы NaF - CaF2 (рис. 1.1) [24]. Система эвтектического типа с ограниченными
областями твердых растворов на основе исходных компонентов. Образование твердых
растворов установлено при помощи термодинамических расчетов. Получено
достаточное соответствие между теоретическими и экспериментальными данными.
Состав эвтектики определен методом визуально-политермического анализа и
приходится на 68 мол. % CaF2. Температура плавления эвтектики составляет 8180С.

Рис. 1.1 - Диаграмма плавкости системы NaF -
CaF2 [24]
Данных по другим системам в литературе не
обнаружено.
ГЛАВА 2. ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ
АНАЛИЗА
2.1 Понятие о методах
физико-химического анализа
До конца ХIХ в. основным методом изучения
химических систем являлся препаративный метод, основанный на выделении из
системы данного вещества различными способами (кристаллизация, перегонка и др.)
и изучении состава и свойств (оптических, магнитных, электрических, объемных и
т.д.). Препаративный метод имеет большое значение для развития химии и широко
применяется до настоящего времени, особенно в органической химии. Однако этот
метод оказался недостаточным при изучении многих систем, таких как растворы, расплавы,
смолы, стекла и многокомпонентные системы [25].
На базе учения о химическом равновесии был
разработан новый метод исследования химических систем - метод
физико-химического анализа. Основы физико-химического анализа были заложены в
конце 19 в. Дж. Гиббсом, Д.И. Менделеевым, Я. Вант-Гоффом. Развитие этого
метода работами А. Ле-Шателье, Г. Таммана, Х. Розебома и особенно Н.С.
Курнакова и его школы
Термин физико-химический анализ был введен Н.С.
Курнаковым в 1913 г. Многочисленные работы Н.С. Курнакова по изучению
металлических, органических и соленых систем показали, что метод
физико-химического является важным, а иногда и единственным методом
исследования сложных систем. По определению Н.С. Курнакова, метод
физико-химического анализа есть «геометрический метод исследования химических
превращений [25 - 28].
В Большой Советской Энциклопедии дано
определение: «Физико-химический анализ - это метод исследования
физико-химических систем, посредством которого устанавливают характер
компонентов системы на основе изучения соотношений между её физическими
свойствами и составом» [29].
Физико-химический анализ представляет собой
обширный раздел общей химии и имеет сложную структуру. В физико-химическом
анализе можно выделить следующие составляющие:
понятийный аппарат физико-химического анализа;
основы учения о термодинамических равновесиях, в
котором, прежде всего, следует выделить правило фаз Гиббса;
разработка теоретических основ
физико-химического анализа, в термодинамический вывод основных типов диаграмм
состояния, их графическое представление, установление взаимосвязи между ними;
разработка теоретических основ аппаратуры и
методик экспериментальных методов исследования систем;
методологическая часть, позволяющая выбрать
необходимые методы;
объекты исследования;
результаты изучения диаграмм конкретных
физико-химических систем.
Физико-химический анализ оперирует такими
понятиями, как система, компоненты, фаза, состояние системы, фазовое
равновесие, диаграмма. Эти основные понятия имеют следующие определения:
Компоненты - индивидуальные вещества, которые,
будучи взяты в наименьшем числе, достаточны для построения всей системы, причем
предполагается, что система находится в равновесном состоянии [27, 30].
Фаза - совокупность частей системы,
тождественных по химическому составу и термодинамическим свойствам и
находящихся между собою в термодинамическом равновесии [25, 27, 30].
Термодинамически равновесным, или равновесным,
называется такое состояние термодинамической системы, не изменяющееся во
времени и не сопровождающееся переносом через систему вещества или энергии
[27].
Фазовым, или гетерогенным равновесием называется
равновесие в системе, состоящей из двух или большего числа фаз [25].
В основе физико-химического анализа лежат
правило фаз и впервые введённые Н.С. Курнаковым принципы непрерывности и
соответствия.
Правило фаз - соотношение термодинамики,
согласно которому для любой равновесной системы сумма числа фаз j и
вариантности V равна числу компонентов k, увеличенному на число параметров n,
определяющих равновесное состояние системы: j + v = k + n. При этом параметры
состояния - температура Т, давление р, напряжённости электрического и
магнитного полей и др. - должны быть одинаковыми во всех фазах. Если состояние
системы может изменяться лишь под действием Т и р, причём размеры фаз таковы,
что можно пренебречь величиной их поверхностной энергии, то правило фаз
принимает вид: v = k + 2-j [25, 27, 30, 31].
Согласно принципу непрерывности, при непрерывных
изменениях параметров состояния свойства системы изменяются также непрерывно
(при условии, что число её фаз остаётся постоянным); при изменении числа фаз
некоторые свойства изменяются скачком (претерпевают разрыв непрерывности).
Согласно принципу соответствия, каждой фазе или
совокупности фаз системы соответствует определённый геометрический образ
(точка, линия, поверхность, объём) на диаграмме состав - свойство. Так, началу
кристаллизации фазы (или фаз) соответствуют кривые (или поверхности) ликвидуса,
над которыми расположена область существования одной жидкой фазы (раствора или
расплава); концу кристаллизации соответствуют линии (или поверхности) солидуса,
ниже которых существуют лишь твёрдые фазы [25, 27 - 29].
В физико-химическом анализе измеряют различные
физические свойства систем, чаще всего температуры фазовых переходов
(термический анализ) и другие тепловые свойства (теплопроводность,
теплоёмкость, тепловое расширение), электрические (электрическая проводимость,
диэлектрическая проницаемость), оптические (показатель преломления, вращение
плоскости поляризации света), плотность, вязкость, твёрдость и другие, а также
зависимость скорости происходящих в системе превращений от её состава. Широко
используют изучение исследуемых объектов посредством рентгеновского
структурного анализа, микроскопической металлографии и др.
Объекты физико-химического анализа
классифицированы по числу компонентов в системе. Различают однокомпонентные,
двухкомпонентные, трехкомпонентные и т. д. системы.
2.2 Рентгенофазовый анализ (РФА)
Рентгенофазовый анализ (РФА) - это метод
количественного и качественного определения фазового состава кристаллических
образцов, основанный на изучении дифракции рентгеновских лучей [32].
Рентгенофазовый анализ применяется для
определения фазового состава образца, идентификации (индицирования) фаз,
определения кристаллохимических параметров элементарной ячейки. Идентификацию
(индицирование) фаз проводили с использованием дифрактометрических данных,
представленных в литературных источниках, картотеке PDF-2. Основным методом
фазового анализа является метод порошка, который получил широкое
распространение из-за его простоты и универсальности [33].
Фазовым анализом называется установление наличия
фаз в исследуемом образце, их идентификация (качественный анализ) и определение
относительного содержания фаз (количественный анализ). Каждое кристаллическое
вещество характеризуется атомным составом, кристаллической решеткой и
расположением атомов в элементарной ячейке и поэтому дает специфическую
рентгеновскую дифракционную картину. Таким образом, получаемая в эксперименте
рентгеновская дифракционная картина многофазного поликристаллического образца
есть сумма рентгенограмм всех фаз, находящихся в образце. Дифракционной
характеристикой вещества служит спектр значений межплоскостных расстояний d и
относительных интенсивностей (I) отражений от этих плоскостей, полученной на
монохроматическом излучении [26, 27].
Фазовый рентгеноструктурный анализ основан на
том, что каждая фаза имеет свою специфическую кристаллическую решетку с
определенными параметрами и ей соответствует на рентгенограмме своя система
линий. Поэтому в общем случае при съемке вещества, представляющего собой смесь
нескольких фаз, получается рентгенограмма, на которой присутствуют линии всех
фаз входящих в состав образца. Проводя расчет и индицирование линии рентгенограммы,
можно получить точные данные о качественном составе исследуемого вещества.
Применив специальные методы фазового анализа можно определить не только
качественный, но и количественный фазовый состав. Интенсивность линий различных
фаз на рентгенограмме зависит от многих факторов, в том числе и от количества
той или иной фазы. С увеличением содержания фазы в смеси интенсивность
принадлежащих ей линий возрастает. Однако надежное определение наличия той или
иной фазы в смеси возможно лишь при некоторых минимальных ее количествах.
Уменьшение количества какой-то фазы может привести к практически полному
исчезновению ее линий на рентгенограмме.
Качественный фазовый анализ. Для решения вопроса
о том, какая фаза присутствует в пробе, нет необходимости в определении ее
кристаллической структуры, а достаточно, рассчитав рентгенограмму или
дифрактограмму, снятую по методу порошка, сравнить полученный ряд
межплоскостных расстояний с табличными значениями. Совпадение (в пределах
ошибок эксперимента) опытных и табличных значений d/n и относительной
интенсивности линий позволяет однозначно идентифицировать присутствующую в
образце фазу. Межплоскостные расстояния для различных неорганических фаз
имеются в ряде справочников. Современные дифрактометрические базы данных
составлены в электронном виде (PDF, PDF 2.0, PDF 4.0). Среди отечественных
электронных дифрактометрических баз данных наиболее известен комплекс программ
PDWin 4.0.
В данной работе метод рентгенофазового анализа
использовали для регистрации дифрактограмм аморфных веществ и подтверждения
отсутствия в них кристаллической фазы. Рентгеноаморфность стекол контролировали
на рентгеновских дифрактометрах «ДРОН-3М» или «ДРОН-7» в CuKa
фильтрованном излучении (Ni-фильтр) или CоKa фильтрованном
излучении (Fe-фильтр). Рентгенограммы стекол имеют вид, характерный для
аморфных образцов, а именно: отсутствие рефлексов отражения, наблюдаемых от
кристаллографических плоскостей, и наличие в ближних углах широкого
галлообразного максимума, отвечающего за ближний порядок.
Количественный фазовый анализ. Количественный
фазовый анализ, т.е. определение количества какой-либо одной или ряда фаз в
многофазных композициях, основан на том, что интенсивность линий данной фазы
пропорциональна объемной доле данной фазы в смеси. Анализ основан на
количественном сравнении интенсивности линий разных фаз друг с другом или с
интенсивностью линии эталона, снимаемого в тех же условиях. Существует много
разновидностей методов рентгеновского количественного фазового анализа,
описанных в специальной литературе. В любом из них происходит сравнение
интенсивности так называемых “аналитических” линий каждой фазы - обычно линия
наибольшей интенсивности, свободная от наложения других линий анализируемой или
остальных фаз многофазного образца. Для выделения аналитических линий
необходимо предварительно провести качественный фазовый анализ.
Определение параметров элементарной ячейки. Для
решения ряда задач, связанных с изучением твердого тела, необходимо предельно
точное определение периодов кристаллической решетки. Они зависят от
температуры, от концентрации примеси, напряжений, возникающих при упругой
деформации. Измеряя с большой точностью периоды решетки при постоянной
температуре, можно определить содержание растворенного элемента в твердом
растворе, структурный тип твердого раствора, измерить упругие напряжения в
материале. Сопоставляя периоды решетки одного и того же вещества, измеренные
при разных температурах, находят коэффициенты термического расширения. По
периодам решетки кристаллов, закаленных с высоких температур, можно оценить
концентрацию вакансий при температуре нагрева под закалку. Анализируя изменение
периодов пересыщенного твердого раствора при его распаде, можно установить
закономерности кинетики этого процесса, вызывающие существенные изменения
свойств сплава. Это далеко не полный перечень задач, которые можно решать путем
точных измерений периодов решетки.
Параметры ячейки определяются путем измерения
межплоскостных расстояний для ряда линий с известными индексами отражения hkl.
Число линий должно быть, по крайней мере, равно числу неизвестных параметров.
Однако часто достаточная информация (например, о составе твердого раствора)
может быть получена путем измерений межплоскостного расстояния по какой-либо
одной линии. В любом случае важно измерить межплоскостные расстояния с возможно
большей точностью. Точность определения зависит от угла поворота образца. Для
многих веществ при повороте угла больше 60° наблюдается дуплет линий α1
и
а2. В этом случае d определяется по длине соответствующих излучений. Зная
точное значение межплоскостного расстояния и, воспользовавшись квадратичными
формами, связывающими d2 и периоды решеток, можно вычислить периоды решеток для
всех кристаллографических систем. Например, для кубической системы:
1/d2 = a2 / (h2 + k2 + l2);
для тетрагональной системы:
1/d2 = (h2 + k2 )/a2 + l2/c2 .
Для определения параметров элементарных ячеек
фаз средних и низких сингоний используют компьютерные программы POWDER 2.0 и
PDWin 4.0. В этих программах достаточно ввести точное положение межплоскостных
расстояний, индексы Миллера (hkl), а также сингонию. По этим данным программы
рассчитывают параметры э. я. фаз, а также объем элементарной ячейки [33, 34].
2.3 Дифференциально-термический
анализ (ДТА)
Термический анализ - это физико-химический метод
изучения превращений, протекающих в веществе с выделением или поглощением
теплоты (экзотермических или эндотермических). При термическом анализе
устанавливается сам факт превращений, температура (интервал температур)
превращения, знак теплового эффекта, а также изменение фазовых равновесий в
зависимости от состава. Изменяемой величиной (переменной) является температура,
хотя она сама может являться функцией времени, либо разность (дифференциал)
температур: δТ/δτ
или
δτ/δТ.
Второй случай δτ/ΔТ есть
дифференциально-термический анализ ДТА [30, 31, 33].
Съёмку проводят на установках ДТА-4, ВДТА-2,
ДТА-1, ДТА-1М.
Основные характеристики установки ДТА-4:
бифилярный Та-нагреватель, дифференциальная схема термопар ВР 5/20 или ПП- 1,
атмосфера инертного газа с возможным избыточным давлением до 1 атм,
программируемый нагрев со скоростью 2 - 100 К/мин. в интервале температур 295 -
1870 К.
ВДТА-2. Подковообразный W - нагреватель,
инертная атмосфера, ВР 5/20 струнная термопара дифференциальной схемы, программируемый
нагрев со скоростью 5-200 К/мин. до 2350 К.
ДТА-1. Дифференциальная схема термопар ПП-1,
съемка на воздухе до 1470 К, интервалы скоростей программируемого нагрева 5 -
25 К/мин. Высокая чувствительность к слабым тепловым эффектам.
Схема установки ДТА-1М приведена на рис. 2.1.
Установка дифференциально-термического, прямого термического анализов и оценки
теплоты плавления. Устройством сбора данных и управления является компьютер.
Датчиками температур служат термопары ПП-1 в сочетании с модулями аналогового
ввода. Блок управления нагревом состоит из модуля аналогового вывода,
тиристорного регулятора напряжения и нагревательного элемента. Все устройства
аналогового ввода/вывода подключены к линии последовательной передачи данных
стандарта RS485, для подключения линии RS485 к компьютеру, с интерфейсом RS5232
применяется преобразователь RS485↔RS2З2.

Рис. 2.1 - Установка
дифференциально-термического анализа
Размеры образцов должны быть минимальными с
целью минимизации градиента температуры в образце. При этом температурные
превращения тоже минимизируется. Кроме того, малые размеры выгодны
экономически: снижаются расходы материалов и уменьшаются габариты печи.
При построении фазовых диаграмм следует
пользоваться данными, полученными при нагреве, так как при охлаждении возможно
появление эффекта переохлаждения и, кроме того, повышается опасность
загрязнения образца после расплавления. Чем меньше скорость нагрева, тем ближе
состояние пробы к равновесному, меньше высота пика, но тем больше разрешение
отдельных термических эффектов. Чем больше скорость, тем меньше загрязнение
тигля (ампулы) и деталей печи пробой, меньше разрушение печи, выше
производительность.
Исходя из этих качественных особенностей, для
исследования берется проба массой 0,3 - 0,5 г. Образец растирают до порошка и
помещают в кварцевую ампулу. Ампулу вакуумируют до остаточного давления 10-4 -
10-5 мм рт. ст. и запаивают. В качестве эталона используют прокаленный А12О3.
Обработка полученных термограмм проводится по
стандартным методикам.
Совокупность данных ДТА в сочетании с
результатами других методов анализа является основой для установления природы
процесса, реакции, вызывающих проявление теплового эффекта [25, 33].
2.4 Микроструктурный анализ (МСА)
оптический стекло рентгенофазовый
химический
Методы микроструктурного и дюрометрического
анализов использовали для идентификации фаз, определения фазового состава
образцов, определения последовательности кристаллизации фаз, положения границ
областей гомогенности, размера зёрен, макродефектов структуры (винтовые
дислокации, ямки, трещины, ступеньки). Например, исходя из взаимного
расположения кристаллов сопряжённых фаз, их количественного соотношения судили
о последовательности кристаллизации фаз из расплава, составе образующихся
эвтектик. По появлению в образцах кристаллов второй фазы определяли положение
границ областей гомогенности.
Метод основывается на визуальном наблюдении под
микроскопом микроструктуры сплавов в отражённом или проходящем свете, в
зависимости от природы изучаемых систем. В настоящей работе наблюдения
проводили в отражённом свете (образцы не прозрачны) с помощью
металлографического микроскопа МЕТАМ-22 РВ. Изображение через цифровой аппарат
NIKON переносили в компьютер. Синтезированные в виде объёмных слитков образцы
анализировали на микроскопе МС-2 на предмет однородности в различных участках.
Для анализов отбирали пробы из различных
участков образцов, которые заливали эпоксидной смолой. При последующей
механической обработке получали случайные срезы образцов. Для полировки шлифов
использовали пасту ГОИ, пасты АСМ различной зернистости.
При выявлении фазового состава образцов большую
роль играет селективность применяемых травителей, состав которых, как правило,
выбирают исходя из свойств исследуемых объектов. В настоящей работе для
усиления контрастности окраски фаз, выявления дефектов поверхности использовали
в качестве травителя растворы НСl различных концентраций (1 : 100 - 1 : 200)
[25].
2.5 Видимая и ИК-спектроскопия
Электронные спектры в видимой области используют
для изучения координации атомов в стеклах, содержащих переходные металлы. При
этом часто параллельно проводят исследования магнитных свойств этих же стекол.
При интерпретации спектров опираются на представления теории кристаллического
поля и теории поля лигандов.
ИК-спектроскопия является методом быстрого
структурно-группового анализа вещества, позволяющим определять его строение и
количественный состав в различных агрегатных состояниях и широком интервале
температур [35, 36].
Спектры поглощения в видимой области возникают в
результате электронных переходов в атомах и молекулах. Поглощение же в
ИК-области обусловлено переходами между колебательными уровнями, отвечающими
разной колебательной энергии функциональных групп. В ИК-спектроскопии чаще
всего используют среднюю часть ИК-области, 4000-200 см-1. Для интерпретации
ИК-спектров составлены специальные каталоги и таблицы, в которых указаны
характеристические частоты колебаний различных групп.
Значения молярных коэффициентов экстинкции для
ИК-области меньше, чем для видимой области, поэтому с помощью ИК-спектроскопии
можно исследовать или чистые вещества, или очень концентрированные растворы.
Растворы исследовать сложнее, чем твердые вещества, поскольку растворитель
часто поглощает в этой же области. Чтобы повысить чувствительность и
разрешающую способность метода, в современных модификациях используют
ИК-спектроскопию с Фурье-преобразованием.
Экспериментально регистрируют кривые
распределения по длинам волн (волновым числам или частотам) оптической
плотности, интенсивности люминесценции
<#"518436.files/image020.gif"> а)
 б) б)
|
|
 в) в)
|
 г) г)
|
|
Рис.
3.1 - Диаграммы плавкости систем: а) CdSO4 - NaF; б) CaF2 - CdSO4; в) NaF -
BaF2; г) BaF2 - CdSO4. Результаты методов физико-химического анализа: 1 -
ДТА; 2 - МСА, РФА (двухфазный)
|
3.2. Расчет стеклообразующей
способности расплавов систем NaF - MeF2 - CdSO4 (Me - Ca, Ba), содержащих
тройное соединение
Концепция расчета стеклообразующей способности
вещества, основанная на квантовых характеристиках атомов, входящих в данное
вещество, и учете природы взаимодействия между ними, предложена авторами в
работах [2]. Методика данной концепции расчета приведена в гл. 1, настоящей
работы. Количественным критерием возможности образования вещества в
стеклообразном состоянии в данной методике является величина теоретической
стеклообразующей способности ковалентного расплава, которая рассчитывается по
формуле: 
Сложность использования данной методики для
систем с участием сульфата кадмия заключается в том, что в предыдущих работах
данная методика была применена только к системам, содержащих бинарные
соединения. Исходя из этого не ясно, как использовать данную методику при
расчете стеклообразующей способности ковалентного расплава систем, содержащих
тройное соединение.
Для того, чтобы определить возможность
распространения данного метода расчета для тройных соединений, были
использованы системы NaF - MeF2 - CdSO4 (Me - Сa, Ba). Кроме того, использованы
два подхода к решению проблемы существования сложного сульфат-аниона при
расчете величины стеклообразующей способности. Первый («кадмий - сера -
кислород») из них состоял в том, что сульфат кадмия разбивали на составляющие
атомы в определенных степенях окисления: Cd+2, S+6, O-2, а затем рассчитывали
все необходимые характеристики согласно используемой методики. Второй («кадмий
- сульфат-ион») подход заключался в том, что для сложного сульфат-аниона нами
было предложено рассчитывать средневзвешенные значения главного числа валентных
электронов n(SO42-), заряда ядер элементов Z(SO42-) и молярной массы М(SO42-),
а затем использовать полученные значения в расчетах. Средневзвешенные значения
рассчитывали по формулам, учитывая мольные доли атомов в анионе: n(SO42-) =
1/5n(S) + 4/5n(O); Z(SO42-) = 1/5Z(S) +4/5Z(O), М(SO42-) = 1/5М(S) +4/5М(O),
которые составили n(SO42-) = 2,2; Z(SO42-) = 9,6 и М(SO42-) = 19,2.
Затем, используя эти два подхода и условия
стеклования расплава, проведен расчет теоретически возможных областей
стеклования и определение составов стеклующихся расплавов в квазитройных
системах NaF - MeF2 - CdSO4 (Me - Ca, Ba).
При расчете жесткости электронного каркаса
химических связей исходя из значений электроотрицательности для атомов натрия и
щелочноземельных элементов (ЭОNa = 0.93; ЭОCa = 1.04; ЭОBa = 0.97) были учтены
ионная, ковалентная и донорно-акцепторная, а для кадмия (ЭОCd = 1.69) -
ковалентная и донорно-акцепторная составляющие уравнения:
 .
.
Четвертый член данного уравнения использовали в
расчетах для учета металлизации связей в веществе, причем по мере возрастания
порядкового номера щелочноземельных элементов наблюдается усиление металлизации
химических связей, что отражается в возрастании множителя  в
этом члене.
в
этом члене.
Математический расчет стеклообразующей
способности ковалентного расплава в системах NaF - MeF2 - CdSO4 (Me - Ca, Ba)
для двух выбранных подходов расчета выполнен в «MS Excel» и представлен в табл.
3.1-3.2 (первый подход) и табл. 3.3-3.4 (второй подход).
Из рис. 3.2. видно, что область стеклования,
рассчитанная с учетом первого подхода («кадмий - сера - кислород») во всех
рассчитанных системах одинакова и не изменяется с изменением природы
щелочноземельного элемента, что не согласуется с одним из Захариасена, согласно
которого при увеличении атомного радиуса катиона-модификатора сетки стекла
(ионы
Таблица 3.1 - Атомные характеристики и
стеклообразующая способность расплавов образцов в системах NaF - СаF2 - CdSO4
(используя подход «кадмий - сера - кислород»)
|
Состав
|
n
|
Z
|
K
|
GT
|
Gnэ
|
Δ,%
|
Примечание
|
|
0,1NaF-0,1CaF2-0,8CdSO4
|
2,6603
|
15,585
|
1,412
|
0,241
|
0,2352
|
2,4260
|
стеклуется
|
|
0,2NaF-0,1CaF2-0,7CdSO4
|
2,6530
|
15,306
|
1,359
|
0,235
|
0,2381
|
-1,0768
|
стеклуется
|
|
0,3NaF-0,1CaF2-0,6CdSO4
|
2,6444
|
14,977
|
1,298
|
0,229
|
0,2426
|
-5,1564
|
стеклуется
|
|
0,4NaF-0,1CaF2-0,5CdSO4
|
2,6341
|
14,585
|
1,226
|
0,221
|
0,2460
|
-9,9667
|
стекл.;q>1000/c
|
|
0,5NaF-0,1CaF2-0,4CdSO4
|
2,6216
|
14,108
|
1,139
|
0,212
|
0,2513
|
-15,7201
|
не
стеклуется
|
|
0,6NaF-0,1CaF2-0,3CdSO4
|
2,6060
|
13,515
|
1,035
|
0,199
|
0,2583
|
-22,7185
|
не
стеклуется
|
|
0,7NaF-0,1CaF2-0,2CdSO4
|
2,5862
|
12,758
|
0,905
|
0,183
|
0,2676
|
-31,4031
|
не
стеклуется
|
|
0,8NaF-0,1CaF2-0,1CdSO4
|
2,56
|
11,76
|
0,742
|
0,161
|
0,2808
|
-42,4372
|
не
стеклуется
|
|
0,1NaF-0,2CaF2-0,7CdSO4
|
2,66
|
15,36
|
1,348
|
0,233
|
0,2375
|
-1,7544
|
стеклуется
|
|
0,2NaF-0,2CaF2-0,6CdSO4
|
2,6521
|
15,043
|
1,287
|
0,227
|
0,2409
|
-5,7879
|
стеклуется
|
|
0,3NaF-0,2CaF2-0,5CdSO4
|
2,6438
|
14,666
|
1,217
|
0,219
|
0,245
|
-10,5234
|
стекл.;q>1000/c
|
|
0,4NaF-0,2CaF2-0,4CdSO4
|
2,6315
|
14,21
|
1,132
|
0,209
|
0,2501
|
-16,1587
|
не
стеклуется
|
|
0,5NaF-0,2CaF2-0,3CdSO4
|
2,6176
|
13,647
|
1,031
|
0,197
|
-22,9711
|
не
стеклуется
|
|
0,6NaF-0,2CaF2-0,2CdSO4
|
2,6
|
12,933
|
0,906
|
0,182
|
0,2654
|
-31,36
|
не
стеклуется
|
|
0,7NaF-0,2CaF2-0,1CdSO4
|
2,5769
|
12
|
0,75
|
0,161
|
0,2776
|
-41,9153
|
не
стеклуется
|
|
0,1NaF-0,3CaF2-0,6CdSO4
|
2,6595
|
15,106
|
1,277
|
0,224
|
0,2402
|
-6,3751
|
стеклуется
|
|
0,2NaF-0,3CaF2-0,5CdSO4
|
2,6511
|
14,744
|
1,208
|
0,217
|
0,2441
|
-11,034
|
стекл.;q>1000/c
|
|
0,3NaF-0,3CaF2-0,4CdSO4
|
2,6413
|
14,307
|
1,125
|
0,207
|
0,249
|
-16,5529
|
не
стеклуется
|
|
0,4NaF-0,3CaF2-0,3CdSO4
|
2,6284
|
13,771
|
1,027
|
0,196
|
0,2552
|
-23,1846
|
не
стеклуется
|
|
0,5NaF-0,3CaF2-0,2CdSO4
|
2,6123
|
13,096
|
0,907
|
0,18
|
0,2634
|
-31,2923
|
не
стеклуется
|
|
0,6NaF-0,3CaF2-0,1CdSO4
|
2,5924
|
12,222
|
0,758
|
0,16
|
0,2746
|
-41,4026
|
не
стеклуется
|
|
0,1NaF-0,4CaF2-0,5CdSO4
|
2,6598
|
14,818
|
1,200
|
0,215
|
0,2433
|
-11,5057
|
стекл.;q>1000/c
|
|
0,2NaF-0,4CaF2-0,4CdSO4
|
2,6500
|
14,4
|
1,119
|
0,206
|
0,248
|
-16,9083
|
не
стеклуется
|
|
0,3NaF-0,4CaF2-0,3CdSO4
|
2,6385
|
13,888
|
1,024
|
0,194
|
0,2538
|
-23,3652
|
не
стеклуется
|
|
0,4NaF-0,4CaF2-0,2CdSO4
|
2,6250
|
13,25
|
0,908
|
0,179
|
0,2615
|
-31,2061
|
не
стеклуется
|
|
0,5NaF-0,4CaF2-0,1CdSO4
|
2,6075
|
12,428
|
0,766
|
0,16
|
0,2719
|
-40,9027
|
не
стеклуется
|
|
0,1NaF-0,5CaF2-0,4CdSO4
|
2,6584
|
14,487
|
1,114
|
0,204
|
0,247
|
-17,2298
|
не
стеклуется
|
|
0,2NaF-0,5CaF2-0,3CdSO4
|
2,6489
|
14
|
1,021
|
0,193
|
0,2525
|
-23,3652
|
не
стеклуется
|
|
0,3NaF-0,5CaF2-0,2CdSO4
|
2,6360
|
13,393
|
0,909
|
0,178
|
0,2597
|
-31,2061
|
не
стеклуется
|
|
0,4NaF-0,5CaF2-0,1CdSO4
|
2,6206
|
12,62
|
0,773
|
0,16
|
0,2694
|
-40,4178
|
не
стеклуется
|
|
0,1NaF-0,6CaF2-0,3CdSO4
|
2,6571
|
14,105
|
1,018
|
0,1919
|
0,2513
|
-23,6476
|
не
стеклуется
|
|
0,2NaF-0,6CaF2-0,2CdSO4
|
2,6475
|
13,529
|
0,91
|
0,1781
|
0,2581
|
-30,9959
|
не
стеклуется
|
|
0,3NaF-0,6CaF2-0,1CdSO4
|
2,6332
|
12,8
|
0,779
|
0,1604
|
0,2671
|
-39,9489
|
не
стеклуется
|
|
0,1NaF-0,7CaF2-0,2CdSO4
|
2,6570
|
13,657
|
0,911
|
0,1773
|
0,2566
|
-30,8783
|
не
стеклуется
|
|
0,2NaF-0,7CaF2-0,1CdSO4
|
2,6456
|
12,967
|
0,786
|
0,1603
|
0,265
|
-39,4968
|
не
стеклуется
|
|
0,1NaF-0,8CaF2-0,1CdSO4
|
2,656
|
13,125
|
0,792
|
0,1603
|
0,263
|
-39,0614
|
не
стеклуется
|
|
0,1NaF-0,9CaF2-0CdSO4
|
2,6551
|
12,482
|
0,658
|
0,14
|
0,2712
|
-48,3524
|
не
стеклуется
|
|
0,1NaF-0CaF2-0,9CdSO4
|
2,6616
|
15,786
|
1,469
|
0,2477
|
0,2332
|
6,224
|
стеклуется
|
|
0NaF-0,9CaF2-0,1CdSO4
|
2,6660
|
13,272
|
0,797
|
0,1602
|
0,2612
|
-38,6427
|
не
стеклуется
|
|
0NaF-0,1CaF2-0,9CdSO4
|
2,6660
|
15,824
|
1,457
|
0,2455
|
0,2328
|
5,4655
|
стеклуется
|
|
0,9NaF-0CaF2-0,1CdSO4
|
2,5411
|
11,5
|
0,734
|
0,1622
|
0,284
|
-42,9628
|
не
стеклуется
|
|
0,9NaF-0,1CaF2-0CdSO4
|
2,5232
|
10,38
|
0,534
|
0,1298
|
0,3009
|
-56,8401
|
не
стеклуется
|
|
0NaF-0,2CaF2-0,8CdSO4
|
2,666
|
15,629
|
1,399
|
0,2348
|
0,237
|
1,7212
|
стеклуется
|
|
0NaF-0,3CaF2-0,7CdSO4
|
2,666
|
15,111
|
1,337
|
0,2375
|
0,241
|
-2,3891
|
стеклуется
|
|
0NaF-0,4CaF2-0,6CdSO4
|
2,666
|
15,166
|
1,268
|
0,2392
|
0,245
|
-6,9223
|
стеклуется
|
|
0NaF-0,5CaF2-0,5CdSO4
|
2,666
|
14,888
|
1,192
|
0,2426
|
0.2426
|
-11,9405
|
стекл.;q>1000/c
|
|
0NaF-0,6CaF2-0,4CdSO4
|
2,666
|
14,571
|
1,109
|
0,2461
|
0,2461
|
-17,5216
|
не
стеклуется
|
|
Состав
|
n
|
Z
|
K
|
GT
|
Gnэ
|
Δ,%
|
Примечание
|
|
0NaF-0,7CaF2-0,3CdSO4
|
2,666
|
14,205
|
1,016
|
0,2506
|
0.233
|
-23,7576
|
не
стеклуется
|
|
0NaF-0,8CaF2-0,2CdSO4
|
2,666
|
13,777
|
0,912
|
0,2551
|
0,234
|
-30,7554
|
не
стеклуется
|
|
0,8NaF-0CaF2-0,2CdSO4
|
2,571
|
12,571
|
0,905
|
0,2708
|
0,237
|
-31,4135
|
не
стеклуется
|
|
0,7NaF-0CaF2-0,3CdSO4
|
2,5935
|
13,375
|
1,04
|
0,2604
|
0,239
|
-22,4197
|
не
стеклуется
|
|
0,6NaF-0CaF2-0,4CdSO4
|
2,6116
|
14
|
1,148
|
0,252
|
0,242
|
-15,2304
|
не
стеклуется
|
|
0,5NaF-0CaF2-0,5CdSO4
|
2,6254
|
14,5
|
1,236
|
0,2462
|
0,246
|
-9,3584
|
стеклуется
|
|
0,4NaF-0CaF2-0,6CdSO4
|
2,6368
|
14,909
|
1,309
|
0,2423
|
0,242
|
-4,4766
|
стеклуется
|
|
0,3NaF-0CaF2-0,7CdSO4
|
2,6469
|
15,25
|
1,371
|
0,2386
|
0,238
|
-0,3529
|
стеклуется
|
|
0,2NaF-0CaF2-0,8CdSO4
|
2,6547
|
15,5425
|
1,424
|
0,236
|
3,174
|
стеклуется
|
|
0NaF-0CaF2-1CdSO4
|
2,666
|
16
|
1,509
|
0,2315
|
0,231
|
8,888
|
стеклуется
|
Таблица 3.2 - Атомные характеристики и
стеклообразующая способность расплавов образцов в системах NaF - BaF2 - CdSO4
(используя подход «кадмий - сера - кислород»)
|
Состав
|
n
|
Z
|
K
|
GT
|
Gnэ
|
Δ,%
|
Примечание
|
|
0,1NaF-0,1BaF2-0,8CdSO4
|
2,6981
|
16,2641
|
1,4129
|
0,2343
|
0,2284
|
2,6083
|
стеклуется
|
|
0,2NaF-0,1BaF2-0,7CdSO4
|
2,6938
|
16,0408
|
1,3607
|
0,2285
|
0,2306
|
-0,9223
|
стеклуется
|
|
0,3NaF-0,1BaF2-0,6CdSO4
|
2,8888
|
15,7777
|
1,2998
|
0,2215
|
0,2332
|
-5,0411
|
стеклуется
|
|
0,4NaF-0,1BaF2-0,5CdSO4
|
2,6829
|
15,4634
|
1,2281
|
0,2130
|
0,2365
|
-9,9057
|
стекл.;q>1000/c
|
|
0,5NaF-0,1BaF2-0,4CdSO4
|
2,6756
|
15,0810
|
1,1424
|
0,2026
|
0,2405
|
-15,7346
|
не
стеклуется
|
|
0,6NaF-0,1BaF2-0,3CdSO4
|
2,6666
|
14,6060
|
1,0385
|
0,1896
|
0,2457
|
-22,8369
|
не
стеклуется
|
|
0,7NaF-0,1BaF2-0,2CdSO4
|
2,6551
|
14
|
0,9101
|
0,1726
|
0,2525
|
-31,6601
|
не
стеклуется
|
|
0,8NaF-0,1BaF2-0,1CdSO4
|
2,64
|
13,2
|
0,7489
|
0,149
|
0,2621
|
-42,861
|
не
стеклуется
|
|
0,1NaF-0,2BaF2-0,7CdSO4
|
2,74
|
16,8
|
1,3506
|
0,2202
|
0,2232
|
-1,3469
|
стеклуется
|
|
0,2NaF-0,2BaF2-0,6CdSO4
|
2,7391
|
16,6087
|
1,2907
|
0,2128
|
0,2251
|
-5,4349
|
стеклуется
|
|
0,3NaF-0,2BaF2-0,5CdSO4
|
2,738
|
16,3809
|
1,2204
|
0,204
|
0,2272
|
-10,2476
|
стекл.;
q>1000/c
|
|
0,4NaF-0,2BaF2-0,4CdSO4
|
2,7368
|
16,1052
|
1,137
|
0,1932
|
0,23
|
-15,9905
|
не
стеклуется
|
|
0,5NaF-0,2BaF2-0,3CdSO4
|
2,7352
|
15,7647
|
1,0365
|
0,1798
|
0,2334
|
-22,9509
|
не
стеклуется
|
|
0,6NaF-0,2BaF2-0,2CdSO4
|
2,7333
|
15,3333
|
0,9136
|
0,1628
|
0,2378
|
-31,5364
|
не
стеклуется
|
|
0,7NaF-0,2BaF2-0,1CdSO4
|
2,7307
|
14,7692
|
0,7608
|
0,1406
|
0,2439
|
-42,3272
|
не
стеклуется
|
|
0,1NaF-0,3BaF2-0,6CdSO4
|
2,7872
|
17,4042
|
1,2819
|
0,2053
|
0,2177
|
-5,6981
|
стеклуется
|
|
0,2NaF-0,3BaF2-0,5CdSO4
|
2,7906
|
17,2558
|
1,2131
|
0,1961
|
0,219
|
-10,4378
|
стекл.;
q>1000/c
|
|
0,3NaF-0,3BaF2-0,4CdSO4
|
2,7948
|
17,0769
|
1,1318
|
0,1852
|
0,2207
|
-16,0701
|
не
стеклуется
|
|
0,4NaF-0,3BaF2-0,3CdSO4
|
2,8
|
16,8571
|
1,03446
|
0,1718
|
0,2227
|
-22,8605
|
не
стеклуется
|
|
0,5NaF-0,3BaF2-0,2CdSO4
|
2,8064
|
16,5806
|
0,9163
|
0,155
|
0,2253
|
-31,1806
|
не
стеклуется
|
|
0,6NaF-0,3BaF2-0,1CdSO4
|
2,8148
|
16,2222
|
0,7709
|
0,1337
|
0,2288
|
-41,5484
|
не
стеклуется
|
|
0,1NaF-0,4BaF2-0,5CdSO4
|
2,8409
|
18,0909
|
1,2061
|
0,1894
|
0,2116
|
-10,5150
|
стекл.;
q>1000/c
|
|
0,2NaF-0,4BaF2-0,4CdSO4
|
2,85
|
18
|
1,1267
|
0,1784
|
0,2124
|
-16,023
|
не
стеклуется
|
|
0,3NaF-0,4BaF2-0,3CdSO4
|
2,8611
|
17,8888
|
1,0323
|
0,1651
|
0,2134
|
-22,6308
|
не
стеклуется
|
|
0,4NaF-0,4BaF2-0,2CdSO4
|
2,875
|
17,75
|
0,9185
|
0,1487
|
0,2146
|
-30,6777
|
не
стеклуется
|
|
0,5NaF-0,4BaF2-0,1CdSO4
|
2,8928
|
17,5714
|
0,7796
|
0,1283
|
0,2162
|
-40,6308
|
не
стеклуется
|
|
0,1NaF-0,5BaF2-0,4CdSO4
|
2,9024
|
18,878
|
1,1219
|
0,1725
|
0,205
|
-15,8843
|
не
стеклуется
|
|
0,2NaF-0,5BaF2-0,3CdSO4
|
2,9189
|
18,8648
|
1,0303
|
0,1594
|
0,2051
|
-22,3054
|
не
стеклуется
|
|
0,3NaF-0,5BaF2-0,2CdSO4
|
2,9393
|
18,8484
|
0,9205
|
0,1435
|
0,2053
|
-30,0817
|
не
стеклуется
|
|
0,4NaF-0,5BaF2-0,1CdSO4
|
2,9655
|
18,8275
|
0,7875
|
0,124
|
0,2054
|
-39,6375
|
не
стеклуется
|
|
0,1NaF-0,6BaF2-0,3CdSO4
|
736
|
19,7894
|
1,0283
|
0,1545
|
0,1978
|
-21,9145
|
не
стеклуется
|
|
0,2NaF-0,6BaF2-0,2CdSO4
|
3
|
19,8823
|
0,9222
|
0,1391
|
0,1971
|
-29,4279
|
не
стеклуется
|
|
0,3NaF-0,6BaF2-0,1CdSO4
|
3,0333
|
20
|
0,7945
|
0,1205
|
0,1962
|
-38,6075
|
не
стеклуется
|
|
0,1NaF-0,7BaF2
-0,2CdSO4
|
3,0571
|
20,8571
|
0,9238
|
0,1354
|
0,19
|
-28,7402
|
не
стеклуется
|
|
0,2NaF-0,7BaF2-0,1CdSO4
|
3,0967
|
21,0967
|
0,801
|
0,1175
|
0,1883
|
-37,5652
|
не
стеклуется
|
|
0,1NaF-0,8BaF2-0,1CdSO4
|
3,1562
|
22,125
|
0,8069
|
0,1151
|
0,1813
|
-36,5266
|
не
стеклуется
|
Таблица 3.3 - Атомные характеристики и
стеклообразующая способность расплавов образцов в системах NaF - СаF2 - CdSO4
(используя подход «кадмий - сульфат-анион»)
|
Состав
|
n
|
Z
|
K
|
GT
|
Gnэ
|
Δ,%
|
Примечание
|
|
|
0,1NaF-0,1CaF2-0,8CdSO4
|
3,3619
|
24,7047
|
1,4884
|
0,2025
|
0,1658
|
22,1661
|
не
стеклуется
|
|
|
0,2NaF-0,1CaF2-0,7CdSO4
|
3,2571
|
22,9142
|
1,3098
|
0,1861
|
0,1763
|
5,5914
|
стеклуется
|
|
|
0,3NaF-0,1CaF2-0,6CdSO4
|
3,1523
|
21,1238
|
1,1484
|
0,1713
|
0,1881
|
-8,9046
|
стеклуется
|
|
|
0,4NaF-0,1CaF2-0,5CdSO4
|
3,0476
|
19,3333
|
1,004
|
0,1582
|
0,2014
|
-21,4237
|
не
стеклуется
|
|
|
0,5NaF-0,1CaF2-0,4CdSO4
|
17,5428
|
0,8767
|
0,147
|
0,2164
|
-32,0584
|
не
стеклуется
|
|
|
0,6NaF-0,1CaF2-0,3CdSO4
|
2,838
|
15,7523
|
0,7662
|
0,138
|
0,2335
|
-40,8868
|
не
стеклуется
|
|
|
0,7NaF-0,1CaF2-0,2CdSO4
|
2,7333
|
13,9619
|
0,6725
|
0,1316
|
0,253
|
-47,9636
|
не
стеклуется
|
|
|
0,8NaF-0,1CaF2-0,1CdSO4
|
2,6285
|
12,1714
|
0,5953
|
0,1285
|
0,2753
|
-53,3019
|
не
стеклуется
|
|
|
0,1NaF-0,2CaF2-0,7CdSO4
|
3,2454
|
22,6909
|
1,2598
|
0,1802
|
0,1777
|
1,3891
|
стеклуется
|
|
|
0,2NaF-0,2CaF2-0,6CdSO4
|
3,1454
|
20,9818
|
1,1147
|
0,1671
|
0,1891
|
-11,6407
|
стекл.;
q>1000/c
|
|
|
0,3NaF-0,2CaF2-0,5CdSO4
|
3,0454
|
19,2727
|
0,9845
|
0,1555
|
0,2019
|
-22,9449
|
не
стеклуется
|
|
|
0,4NaF-0,2CaF2-0,4CdSO4
|
2,9454
|
17,5636
|
0,8692
|
0,1457
|
0,2162
|
-32,5978
|
не
стеклуется
|
|
|
0,5NaF-0,2CaF2-0,3CdSO4
|
2,8454
|
15,8554
|
0,7687
|
0,1379
|
0,2325
|
-40,6608
|
не
стеклуется
|
|
|
0,6NaF-0,2CaF2-0,2CdSO4
|
2,7454
|
14,1454
|
0,6829
|
0,1325
|
0,2509
|
-47,1752
|
не
стеклуется
|
|
|
0,7NaF-0,2CaF2-0,1CdSO4
|
2,6454
|
12,4363
|
0,6115
|
0,13
|
0,2718
|
-52,1472
|
не
стеклуется
|
|
|
0,1NaF-0,3CaF2-0,6CdSO4
|
3,1391
|
20,8521
|
1,0879
|
0,1637
|
0,19
|
-13,8258
|
не
стеклуется
|
|
|
0,2NaF-0,3CaF2-0,5CdSO4
|
3,0434
|
19,2173
|
0,9695
|
0,1535
|
0,2023
|
-24,1161
|
не
стеклуется
|
|
|
0,3NaF-0,3CaF2-0,4CdSO4
|
2,9478
|
17,5826
|
0,8643
|
0,1449
|
0,2161
|
-32,9456
|
не
стеклуется
|
|
|
0,4NaF-0,3CaF2-0,3CdSO4
|
2,8521
|
15,9478
|
0,7721
|
0,1381
|
0,2315
|
-40,3634
|
не
стеклуется
|
|
|
0,5NaF-0,3CaF2-0,2CdSO4
|
2,7565
|
14,313
|
0,6929
|
0,1334
|
0,249
|
-46,4005
|
не
стеклуется
|
|
|
0,6NaF-0,3CaF2-0,1CdSO4
|
2,6608
|
12,6782
|
0,6265
|
0,1315
|
0,2687
|
-51,0586
|
не
стеклуется
|
|
|
0,1NaF-0,4CaF2-0,5CdSO4
|
3,0416
|
19,1666
|
0,9579
|
0,152
|
0,2027
|
-25,0246
|
не
стеклуется
|
|
|
0,2NaF-0,4CaF2-0,4CdSO4
|
2,95
|
17,6
|
0,8612
|
0,1443
|
0,2159
|
-33,1546
|
не
стеклуется
|
|
|
0,3NaF-0,4CaF2-0,3CdSO4
|
2,8583
|
16,0333
|
0,7762
|
0,1383
|
0,2307
|
-40,0212
|
не
стеклуется
|
|
|
0,4NaF-0,4CaF2-0,2CdSO4
|
2,7666
|
14,4666
|
0,7027
|
0,1343
|
0,2472
|
-45,6481
|
не
стеклуется
|
|
|
Состав
|
n
|
Z
|
K
|
GT
|
Gnэ
|
Δ,%
|
Примечание
|
|
0,5NaF-0,4CaF2-0,1CdSO4
|
2,675
|
12,9
|
0,6406
|
0,1328
|
0,2658
|
-50,0339
|
не
стеклуется
|
|
0,1NaF-0,5CaF2-0,4CdSO4
|
2,952
|
17,616
|
0,8595
|
0,144
|
0,2158
|
-33,2616
|
не
стеклуется
|
|
0,2NaF-0,5CaF2-0,3CdSO4
|
2,864
|
16,112
|
0,7806
|
0,1387
|
0,2299
|
-39,6523
|
не
стеклуется
|
|
0,3NaF-0,5CaF2-0,2CdSO4
|
2,776
|
14,608
|
0,7121
|
0,1353
|
0,2456
|
-44,9228
|
не
стеклуется
|
|
0,4NaF-0,5CaF2-0,1CdSO4
|
2,688
|
13,104
|
0,6538
|
0,1341
|
0,2633
|
-49,0697
|
не
стеклуется
|
|
0,1NaF-0,6CaF2-0,3CdSO4
|
2,8692
|
16,18464
|
0,7852
|
0,1392
|
0,2292
|
-39,269
|
не
стеклуется
|
|
0,2NaF-0,6CaF2-0,2CdSO4
|
2,7846
|
14,7384
|
0,721
|
0,1362
|
0,2442
|
-44,227
|
не
стеклуется
|
|
0,3NaF-0,6CaF2-0,1CdSO4
|
2,7
|
13,2923
|
0,6661
|
0,1353
|
0,261
|
-48,1624
|
не
стеклуется
|
|
0,1NaF-0,7CaF2-0,2CdSO4
|
2,7925
|
14,8592
|
0,7295
|
0,1371
|
0,2429
|
-43,5614
|
не
стеклуется
|
|
0,2NaF-0,7CaF2-0,1CdSO4
|
2,7111
|
13,4666
|
0,6776
|
0,1364
|
0,2588
|
-47,3082
|
не
стеклуется
|
|
0,1NaF-0,8CaF2-0,1CdSO4
|
2,7214
|
13,6285
|
0,6883
|
0,1374
|
0,2569
|
-46,5033
|
не
стеклуется
|
|
0,1NaF-0,9CaF2-0CdSO4
|
2,6551
|
12,48276
|
0,6585
|
0,14
|
0,2712
|
-48,3524
|
не
стеклуется
|
|
0,1NaF-0CaF2-0,9CdSO4
|
3,49
|
26,92
|
1,7947
|
0,2326
|
0,1542
|
50,8323
|
не
стеклуется
|
|
0NaF-0,9CaF2-0,1CdSO4
|
2,731
|
13,7793
|
0,6985
|
0,1384
|
0,2551
|
-45,7441
|
не
стеклуется
|
|
0NaF-0,1CaF2-0,9CdSO4
|
3,4666
|
26,4952
|
1,6842
|
0,2203
|
0,1563
|
40,9269
|
не
стеклуется
|
|
0,9NaF-0CaF2-0,1CdSO4
|
2,61
|
11,88
|
0,578
|
0,1269
|
0,2792
|
-54,5231
|
не
стеклуется
|
|
0,9NaF-0,1CaF2-0CdSO4
|
2,5238
|
10,3809
|
0,5341
|
0,1298
|
0,3009
|
-56,8402
|
не
стеклуется
|
|
0NaF-0,2CaF2-0,8CdSO4
|
3,3454
|
24,4
|
1,42
|
0,1946
|
0,1675
|
16,2272
|
не
стеклуется
|
|
0NaF-0,3CaF2-0,7CdSO4
|
3,2347
|
22,4869
|
1,2194
|
0,1754
|
0,179
|
-2,0147
|
стеклуется
|
|
0NaF-0,4CaF2-0,6CdSO4
|
3,1333
|
20,7333
|
1,0662
|
0,1611
|
0,1909
|
-15,592
|
не
стеклуется
|
|
0NaF-0,5CaF2-0,5CdSO4
|
3,04
|
19,12
|
0,9488
|
0,1508
|
0,2031
|
-25,7329
|
не
стеклуется
|
|
0NaF-0,6CaF2-0,4CdSO4
|
2,9538
|
17,6307
|
0,8587
|
0,1438
|
0,2156
|
-33,2934
|
не
стеклуется
|
2,874
|
16,2518
|
0,7899
|
0,1396
|
0,2285
|
-38,8799
|
не
стеклуется
|
|
0,8NaF-0CaF2-0,2CdSO4
|
2,72
|
13,76
|
0,6621
|
0,1308
|
0,2553
|
-48,7509
|
не
стеклуется
|
|
0,7NaF-0CaF2-0,3CdSO4
|
2,83
|
15,64
|
0,7652
|
0,1384
|
0,2346
|
-41,0015
|
не
стеклуется
|
|
0,6NaF-0CaF2-0,4CdSO4
|
2,94
|
17,52
|
0,8876
|
0,1489
|
0,2166
|
-31,2511
|
не
стеклуется
|
|
0,5NaF-0CaF2-0,5CdSO4
|
3,05
|
19,4
|
1,0296
|
0,1618
|
0,2009
|
-19,4272
|
не
стеклуется
|
|
0,4NaF-0CaF2-0,6CdSO4
|
3,16
|
21,28
|
1,1912
|
0,1768
|
0,189
|
-5,429
|
стеклуется
|
|
0,3NaF-0CaF2-0,7CdSO4
|
3,27
|
23,16
|
1,3726
|
0,1938
|
0,1748
|
10,8599
|
стекл.;
q>1000/c
|
|
0,2NaF-0CaF2-0,8CdSO4
|
3,38
|
25,04
|
1,5737
|
0,2124
|
0,1639
|
29,5664
|
не
стеклуется
|
|
0NaF-0,8CaF2-0,2CdSO4
|
2,8
|
14,9714
|
0,7376
|
0,1379
|
0,2417
|
-42,9261
|
не
стеклуется
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 3.4 - Атомные характеристики и
стеклообразующая способность расплавов образцов в системах NaF - BaF2 - CdSO4
(используя подход «кадмий - сульфат-анион»)
|
Состав
|
n
|
Z
|
K
|
GT
|
Gnэ
|
Δ,%
|
Примечание
|
|
0,1NaF-0,1BaF2-0,8CdSO4
|
3,4571
|
26,419
|
1,4916
|
0,1952
|
0,1567
|
24,5313
|
не
стеклуется
|
|
0,2NaF-0,1BaF2-0,7CdSO4
|
3,3523
|
24,6285
|
1,3134
|
0,1787
|
0,1662
|
7,5526
|
стеклуется
|
|
0,3NaF-0,1BaF2-0,6CdSO4
|
3,2476
|
22,8381
|
1,1523
|
0,1638
|
0,1768
|
-7,3186
|
стеклуется
|
|
0,4NaF-0,1BaF2-0,5CdSO4
|
3,1428
|
21,0476
|
1,0084
|
0,1505
|
0,1886
|
-20,1876
|
не
стеклуется
|
|
0,5NaF-0,1BaF2-0,4CdSO4
|
3,038
|
19,2571
|
0,8816
|
0,139
|
0,202
|
-31,1522
|
не
стеклуется
|
|
0,6NaF-0,1BaF2-0,3CdSO4
|
2,9333
|
17,4666
|
0,7719
|
0,1296
|
0,2171
|
-40,2996
|
не
стеклуется
|
|
0,7NaF-0,1BaF2-0,2CdSO4
|
2,8285
|
15,6761
|
0,6791
|
0,1225
|
0,2343
|
-47,7003
|
не
стеклуется
|
|
0,8NaF-0,1BaF2-0,1CdSO4
|
2,7238
|
13,8857
|
0,6032
|
0,1183
|
0,2539
|
-53,3949
|
не
стеклуется
|
|
0,1NaF-0,2BaF2-0,7CdSO4
|
3,4272
|
25,9636
|
1,2658
|
0,167
|
0,159
|
50,0515
|
не
стеклуется
|
|
0,2NaF-0,2BaF2-0,6CdSO4
|
3,3272
|
24,2545
|
1,1213
|
0,1538
|
0,1683
|
-8,6228
|
стеклуется
|
|
0,3NaF-0,2BaF2-0,5CdSO4
|
3,2272
|
22,5454
|
0,9918
|
0,1419
|
0,1786
|
-20,5298
|
не
стеклуется
|
|
0,4NaF-0,2BaF2-0,4CdSO4
|
3,1272
|
20,8363
|
0,8773
|
0,1316
|
0,1601
|
-30,7527
|
не
стеклуется
|
|
0,5NaF-0,2BaF2-0,3CdSO4
|
3,0272
|
19,1272
|
0,7779
|
0,1231
|
0,203
|
-39,3675
|
не
стеклуется
|
|
0,6NaF-0,2BaF2-0,2CdSO4
|
2,9272
|
17,4181
|
0,6934
|
0,1165
|
0,2175
|
-46,4385
|
не
стеклуется
|
|
0,7NaF-0,2BaF2-0,1CdSO4
|
2,8272
|
15,709
|
0,6238
|
0,1122
|
0,2339
|
-52,0126
|
не
стеклуется
|
|
Состав
|
n
|
Z
|
K
|
GT
|
Gnэ
|
Δ,%
|
Примечание
|
|
|
0,1NaF-0,3BaF2-0,6CdSO4
|
3,4
|
25,5478
|
1,0962
|
0,1458
|
0,1612
|
-9,5151
|
стекл.;
q>1000/c
|
|
|
0,2NaF-0,3BaF2-0,5CdSO4
|
3,3043
|
23,913
|
0,9787
|
0,1352
|
0,1703
|
-20,594
|
не
стеклуется
|
|
|
0,3NaF-0,3BaF2-0,4CdSO4
|
3,2086
|
22,2782
|
0,8744
|
0,1259
|
0,1803
|
-30,1712
|
не
стеклуется
|
|
|
0,4NaF-0,3BaF2-0,3CdSO4
|
3,113
|
20,6434
|
0,7835
|
0,1181
|
0,1915
|
-38,313
|
не
стеклуется
|
|
|
0,5NaF-0,3BaF2-0,2CdSO4
|
3,01739
|
19,0087
|
0,7058
|
0,112
|
0,204
|
-45,0778
|
не
стеклуется
|
|
|
0,6NaF-0,3BaF2-0,1CdSO4
|
2,9217
|
17,3739
|
0,6414
|
0,1078
|
0,2179
|
-50,5124
|
не
стеклуется
|
|
|
0,1NaF-0,4BaF2-0,5CdSO4
|
3,375
|
25,1666
|
0,9682
|
0,1298
|
0,1632
|
-20,469
|
не
стеклуется
|
|
|
0,2NaF-0,4BaF2-0,4CdSO4
|
3,2833
|
23,7
|
0,8726
|
0,1214
|
0,1721
|
-29,4793
|
не
стеклуется
|
|
|
0,3NaF-0,4BaF2-0,3CdSO4
|
3,1916
|
22,0333
|
0,7889
|
0,1142
|
0,1819
|
-37,1993
|
не
стеклуется
|
|
|
0,4NaF-0,4BaF2-0,2CdSO4
|
3,1
|
20,4666
|
0,7169
|
0,1086
|
0,1928
|
-43,6812
|
не
стеклуется
|
|
|
0,5NaF-0,4BaF2-0,1CdSO4
|
3,0083
|
18,9
|
0,6569
|
0,1045
|
0,2049
|
-48,6969
|
не
стеклуется
|
|
|
0,1NaF-0,5BaF2-0,4CdSO4
|
3,352
|
24,816
|
0,8716
|
0,1177
|
0,1651
|
-28,7224
|
не
стеклуется
|
|
|
0,2NaF-0,5BaF2-0,3CdSO4
|
3,264
|
23,312
|
0,794
|
0,111
|
0,1738
|
-36,0637
|
не
стеклуется
|
|
|
0,3NaF-0,5BaF2-0,2CdSO4
|
3,174
|
21,808
|
0,727
|
0,1058
|
0,1834
|
-42,2846
|
не
стеклуется
|
|
|
0,4NaF-0,5BaF2-0,1CdSO4
|
3,088
|
20,304
|
0,6707
|
0,102
|
0,194
|
-47,4264
|
не
стеклуется
|
|
|
0,1NaF-0,6BaF2-0,3CdSO4
|
3,3307
|
24,4923
|
0,799
|
0,1086
|
0,1669
|
-34,9294
|
не
стеклуется
|
|
|
0,2NaF-0,6BaF2-0,2CdSO4
|
3,246
|
23,0461
|
0,7363
|
0,1037
|
0,1755
|
-40,9072
|
не
стеклуется
|
|
|
0,3NaF-0,6BaF2-0,1CdSO4
|
3,1615
|
21,6
|
0,6831
|
0,0999
|
0,1848
|
не
стеклуется
|
|
|
0,1NaF-0,7BaF2
-0,2CdSO4
|
3,3111
|
24,1925
|
0,74487
|
0,1019
|
0,1686
|
-39,5676
|
не
стеклуется
|
|
|
0,2NaF-0,7BaF2-0,1CdSO4
|
3,2296
|
22,8
|
0,6946
|
0,0983
|
0,177
|
-44,4263
|
не
стеклуется
|
|
|
0,1NaF-0,8BaF2-0,1CdSO4
|
3,2928
|
23,9142
|
0,7051
|
0,097
|
0,1703
|
-42,9911
|
не
стеклуется
|
|
|
0,1NaF-0,9BaF2-0CdSO4
|
3,2758
|
23,6551
|
0,6766
|
0,9037
|
0,1718
|
-45,4663
|
не
стеклуется
|
|
|
0,1NaF-0BaF2-0,9CdSO4
|
3,49
|
26,92
|
1,7947
|
0,2326
|
0,1542
|
50,8232
|
не
стеклуется
|
|
|
0NaF-0,9BaF2-0,1CdSO4
|
3,3517
|
24,9517
|
0,7148
|
0,096
|
0,1644
|
-41,6057
|
не
стеклуется
|
|
|
0NaF-0,1BaF2-0,9CdSO4
|
3,5619
|
28,2095
|
1,6871
|
0,213
|
0,1482
|
43,7272
|
не
стеклуется
|
|
|
0,9NaF-0BaF2-0,1CdSO4
|
2,61
|
11,88
|
0,578
|
0,1269
|
0,2792
|
-54,5231
|
не
стеклуется
|
|
|
0,9NaF-0,1BaF2-0CdSO4
|
2,619
|
12,0952
|
0,5439
|
0,1177
|
0,2763
|
-57,3741
|
не
стеклуется
|
|
|
0NaF-0,2F2-0,8CdSO4
|
3,5272
|
27,6727
|
1,4252
|
0,1816
|
0,1506
|
20,5816
|
не
стеклуется
|
|
|
0NaF-0,3BaF2-0,7CdSO4
|
3,4956
|
27,1826
|
1,227
|
0,1578
|
0,153
|
3,1364
|
стеклуется
|
|
|
0NaF-0,4BaF2-0,6CdSO4
|
3,4666
|
26,733
|
1,0757
|
0,1394
|
0,1551
|
-10,1105
|
стекл.;
q>1000/c
|
|
|
0NaF-0,5BaF2-0,5CdSO4
|
3,44
|
26,32
|
0,9599
|
0,1254
|
0,1572
|
-20,2138
|
не
стеклуется
|
|
|
0NaF-0,6BaF2-0,4CdSO4
|
3,4153
|
25,9384
|
0,8713
|
0,1147
|
0,1591
|
-27,9297
|
не
стеклуется
|
|
|
0NaF-0,7BaF2-0,3CdSO4
|
3,3925
|
25,5815
|
0,8038
|
0,1065
|
0,161
|
-33,8106
|
не
стеклуется
|
|
|
0NaF-0,8BaF2-0,2CdSO4
|
3,3714
|
25,2571
|
0,7528
|
0,1004
|
0,1627
|
-38,2664
|
не
стеклуется
|
|
|
0,8NaF-0BaF2-0,2CdSO4
|
2,72
|
13,76
|
0,6621
|
0,1308
|
0,2553
|
-48,7509
|
не
стеклуется
|
|
|
0,7NaF-0BaF2-0,3CdSO4
|
2,83
|
15,64
|
0,7652
|
0,1384
|
0,2346
|
-41,0015
|
не
стеклуется
|
|
|
0,6NaF-0BaF2-0,4CdSO4
|
2,94
|
17,52
|
0,8876
|
0,1489
|
0,2166
|
-31,2511
|
не
стеклуется
|
|
|
0,5NaF-0BaF2-0,5CdSO4
|
3,05
|
19,4
|
1,0296
|
0,1618
|
0,2009
|
-19,4272
|
не
стеклуется
|
|
|
0,4NaF-0BaF2-0,6CdSO4
|
3,16
|
21,28
|
1,1912
|
0,1768
|
0,187
|
-5,429
|
стеклуется
|
|
|
0,3NaF-0BaF2-0,7CdSO4
|
3,27
|
23,16
|
1,3726
|
0,1938
|
0,1714
|
10,8599
|
стекл.;
q>1000/c
|
|
|
0,2NaF-0BaF2-0,8CdSO4
|
3,38
|
25,04
|
1,5737
|
0,2124
|
0,1639
|
29,5664
|
не
стеклуется
|
|
|
0NaF-0BaF2-1CdSO4
|
3,6
|
28,8
|
2,0356
|
0,2544
|
0,1455
|
74,7373
|
не
стеклуется
|
|
|
|
|
|
|
|
|
|
|
|
щелочноземельных элементов) область стеклования
должна увеличиваться в сторону увеличения его содержания, что не наблюдается на
диаграммах областей стеклования систем. Кроме того, согласно выполненного
расчета получается, что сам сульфат кадмия тоже стеклуется, т.е. сам является
стеклообразователем. На самом деле, сульфат кадмия является условным
стеклообразователем, т.е. стеклуется в присутствии катионов модификаторов сетки
стекла или других стабилизирующих стекло веществ. Исходя из вышесказанного,
можно сделать вывод, что данным подход («кадмий - сера - кислород»)
неправомерен и подобный расчет является неверным.

Рис. 3.2 - Теоретически рассчитанные области
стеклования в системах NaF - MeF2 - CdSO4 (Me - Ca, Ba), рассчитанные по
первому подходу («кадмий - сера - кислород»).
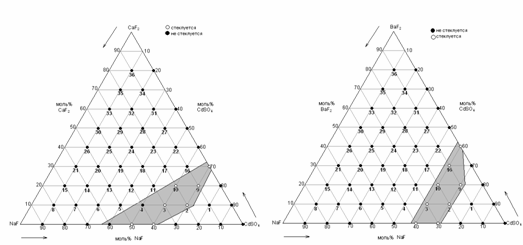
Рис. 3.3 - Теоретические области стеклования в
системах NaF - MeF2 - CdSO4 (Me - Ca, Ba). Подход «кадмий - сульфат анион»
Второй подход («кадмий - сульфат-ион»)
подтверждает правило Захариасена, а также то, что сульфат кадмия не способен
самостоятельно стекловаться. Следовательно, методика расчета стеклообразующей
способности вещества на основе учета природы химической связи может быть
применена не только для систем с участием бинарных соединений (с простым анионом),
но и с участием тройных соединений (со сложным анионом). При этом, для сложного
аниона необходимо предварительно рассчитывать используемые квантовые
характеристики в виде средневзвешенных значений [39, 40].
3.3 Определение областей стеклования
в системах NaF - МеF2 - CdSO4 (Me - Ca, Ba)
Для подтверждения правомерности выполненного
расчета (подход «кадмий - сульфат-ион») теоретической области стеклования
проведено сравнение полученных данных с экспериментально определенными
областями стеклования.
В системах NaF - МеF2 - CdSO4 (Me - Ca, Ba)
проведено выборочное получение стекол из теоретической области стеклования и
вне ее. В качестве исходных материалов для синтеза стекол использовали товарные
вещества NaF(«хч»), СaF2 («хч»), BaF2 («хч») и CdSO4 («осч»). Навески
ингредиентов рассчитывали исходя из валового химического состава образца и его
массы. Массы образцов составляли 5 грамм. Расчет навесок образцов в системе
представлен в таблицах 3.5 - 3.9. Навески исходных веществ взвешивали на
аналитических весах ВЛР - 200 с точностью 2×10-3 г. Навески
веществ смешивали и тщательно перетирали в фарфоровой ступке.
Таблица 3.5 - Массы навесок исходных веществ для
синтеза стекол в системе NaF - CdSO4
|
№
|
Состав
|
m(NaF),
г
|
m(CdSO4),
г
|
|
1
|
0,7NaF
- 0,3CdSO4
|
1,598
|
3,401
|
|
2
|
0,6NaF
- 0,4CdSO4
|
1,160
|
3,839
|
|
3
|
0,5NaF
- 0,5CdSO4
|
0,838
|
4,161
|
|
4
|
0,4NaF
- 0,6CdSO4
|
0,591
|
4,408
|
|
5
|
0,3NaF
- 0,7CdSO4
|
0,397
|
4,602
|
|
6
|
0,2NaF
- 0,8CdSO4
|
0,239
|
4,760
|
Таблица 3.6 - Масса навесок исходных веществ для
синтеза стекол в системе NaF - СaF2 - CdSO4
|
№
|
Состав
|
m
(NaF), г
|
m
(CaF2), г
|
m
(CdSO4), г
|
|
1
|
0,1NaF
- 0,1CaF2 - 0,8CdSO4
|
0,093
|
0,224
|
3,683
|
|
2
|
0,2NaF
- 0,1CaF2 - 0,7CdSO4
|
0,204
|
0,0,247
|
3,548
|
|
3
|
0,3NaF
- 0,1CaF2 - 0,6CdSO4
|
0,341
|
0,274
|
3,384
|
|
4
|
0,4NaF
- 0,1CaF2 - 0,5CdSO4
|
0,512
|
0,309
|
3,178
|
|
5
|
0,5NaF
- 0,1CaF2 - 0,4CdSO4
|
0,733
|
0,355
|
2,912
|
|
6
|
0,1NaF
- 0,2CaF2 - 0,7CdSO4
|
0,098
|
0,476
|
3,425
|
|
7
|
0,4NaF
- 0,2CaF2 - 0,6CdSO4
|
0,557
|
0,674
|
2,768
|
|
8
|
0,2NaF
- 0,2CaF2 - 0,6CdSO4
|
0,218
|
0,528
|
3,253
|
|
9
|
0,3NaF
- 0,2CaF2 - 0,5CdSO4
|
0,367
|
0,592
|
3,040
|
|
10
|
0,2NaF
- 0,3CaF2 - 0,5CdSO4
|
0,235
|
0,851
|
2,914
|
|
11
|
0,1NaF
- 0,3CaF2 - 0,6CdSO4
|
0,105
|
0,763
|
3,132
|
Таблица 3.7 - Масса навесок исходных веществ для
синтеза стекол в системе СaF2 - CdSO4
|
№
|
Состав
|
m
(CaF2), г
|
m
(CdSO4), г
|
|
1
|
0,2CaF2
- 0,8CdSO4
|
0,342
|
3,658
|
|
2
|
0,3CaF2
- 0,7CdSO4
|
0,553
|
3,447
|
|
3
|
0,4CaF2
- 0,6CdSO4
|
0,799
|
3,201
|
Таблица 3.8 - Массы навесок исходных веществ для
синтеза стекол в системе NaF - BaF2 - CdSO4
|
№
|
Состав
|
m(NaF),
г
|
m(BaF2),
г
|
m(CdSO4),
г
|
|
1
|
0,4NaF
- 0,1BaF2 - 0,5CdSO4
|
0,601
|
0,632
|
3,761
|
|
2
|
0,3NaF
- 0,1BaF2 - 0,6CdSO4
|
0,405
|
0,564
|
4,029
|
|
3
|
0,2NaF
- 0,1BaF2 - 0,7CdSO4
|
0,244
|
0,510
|
4,245
|
|
4
|
0,1NaF
- 0,1BaF2 - 0,8CdSO4
|
0,111
|
0,465
|
4,423
|
|
5
|
0,3NaF
- 0,2BaF2 - 0,5CdSO4
|
0,414
|
1,154
|
3,431
|
|
6
|
0,2NaF
- 0,2BaF2 - 0,6CdSO4
|
0,249
|
1,040
|
3,710
|
|
7
|
0,1NaF
- 0,2BaF2 - 0,7CdSO4
|
0,113
|
0,946
|
3,939
|
0,2NaF
- 0,3BaF2 - 0,5CdSO4
|
0,254
|
1,591
|
3,154
|
|
9
|
0,1NaF
- 0,3BaF2 - 0,6CdSO4
|
0,115
|
1,445
|
3,438
|
|
10
|
0,1NaF
- 0,4BaF2 - 0,5CdSO4
|
0,117
|
1,963
|
2,918
|
Таблица 3.9 - Массы навесок исходных веществ для
синтеза стекол в системе BaF2 - CdSO4
|
№
|
Состав
|
m(BaF2),
г
|
m(CdSO4),
г
|
|
1
|
0,5BaF2
- 0,5CdSO4
|
2,284
|
2,715
|
|
2
|
0,4BaF2
- 0,6CdSO4
|
1,796
|
3,203
|
|
3
|
0,3BaF2
- 0,7CdSO4
|
1,324
|
3,675
|
|
4
|
0,2BaF2
-0,8CdSO4
|
0,868
|
4,131
|
Навески шихты плавили в атмосфере воздуха в
муфельной печи в алундовых, фарфоровых или стеклоуглеродных тиглях при
температуре 850-1000°С в зависимости от состава исходной шихты. Выдержка
стеклообразующей шихты в расплаве составляла 30 минут. В связи с тем, что
стеклообразование в любой системе существенно зависит от скорости охлаждения,
расплав закаляли «прессованием» между двумя массивными стальными пластинами,
поверхность которых была отполирована с помощью алмазных паст. При этом,
скорость охлаждения расплава составляла несколько сотен градусов в секунду.
Такое резкое охлаждение позволило получить стеклообразные образцы в более
широкой области концентраций. Образцы составов: 0,6NaF -
0,4CdSO4; 0,5NaF - 0,5CdSO4; 0,4NaF -
0,6CdSO4; 0,4NaF - 0,1CaF2 -
0,5CdSO4; 0,3NaF - 0,1CaF2 -
0,6CdSO4; 0,2NaF - 0,1CaF2 -
0,7CdSO4; 0,2NaF - 0,2CaF2 -
0,6CdSO4; 0,1NaF - 0,2CaF2 -
0,7CdSO4; 0,4NaF - 0,1BaF2 -
0,5CdSO4; 0,3NaF - 0,1BaF2 -
0,6CdSO4; 0,2NaF - 0,2BaF2 -
0,6CdSO4; 0,1NaF - 0,2BaF2 -
0,7CdSO4; 0,1NaF - 0,3BaF2 -
0.6CdSO4; были получены в стеклообразном состоянии. Они представляли собой
плоскопараллельные пластины площадью в несколько квадратных сантиметров и
толщиной от 0,25 до 0,5 мм. Стекла были прозрачны на просвет и не окрашены. При
просмотре под микроскопом (х200) в стеклах не было обнаружено посторонних включений,
в том числе и кристаллического характера. Отсутствие окраски полученных стекол
косвенно свидетельствует, что они не проявляют полупроводниковых свойств.
Образцы же составов: 0.3NaF - 0.2CaF2 -
0,5CdSO4; 0,1NaF - 0,1CaF2 -
0,8CdSO4; 0,3CaF2 - 0,7CdSO4; 0,2NaF -
0,8CdSO4; 0,2NaF - 0,1BaF2 -
0,7CdSO4; 0,6NaF - 0,1BaF2 -
0,3CdSO4; 0,5NaF - 0,1BaF2 -
0,4CdSO4; 0,4NaF - 0,2BaF2 -
0,4CdSO4;и т.д. не стекловались. Они были белого цвета, не прозрачные на
просвет.
Теоретически рассчитанные и экспериментально определенные
области стеклования в системах NaF - МеF2 - CdSO4 (Me - Ca, Ba) представлены на
рис. 3.4. Из них видно достаточно удовлетворительное совпадение расчетных и
экспериментальных результатов определения областей стеклования.

Рис. 3.4 - Теоретически рассчитанные и
экспериментально определенные области стеклования в системах NaF - MeF2 - CdSO4
(Me - Ca, Ba). Подход «кадмий - сульфат анион». Результаты расчета: 1 - не
стеклуется; 2 - стеклуется. Результаты эксперимента: -
область стеклования
Область стеклования является ограниченной и
присоединяется к бинарному разрезу NaF - CdSO4. В бинарной системе NaF - CdSO4
область стеклования находится в пределах 40 - 60 мол. % CdSO4. Введение в
двойную систему NaF - CdSO4 фторида кальция, фторида бария, фторида цинка,
фторида стронция, которые являются модификаторами сетки стекла, приводит к
закономерному распространению области стеклующихся составов в тройной системе
по направлению к СаF2, BaF2 Следует отметить, что границы областей
стеклообразования определены ориентировочно, поскольку они сильно зависят от
условий эксперимента, в частности, от скорости охлаждения стеклующегося
расплава [39, 40].
Рентгеноаморфность получаемых стекол
контролировалась методом рентгенофазового анализа на рентгеновском
дифрактометре «ДРОН-7» в СuKa фильтрованном излучении
(Ni-фильтр). Для всех стеклообразных образцов были получены рентгенограммы
(рис. 3.5), имеющие вид, характерный для аморфных материалов, а именно,
отсутствие рефлексов отражения, наблюдаемых от кристаллографических плоскостей,
существующих в кристаллических образцах. Однородность стекол контролировалась
визуально путем их просмотра на просвет под микроскопом при увеличении х200.
Никаких посторонних кристаллических включений на синтезированных стеклах не
наблюдалось, в том числе и кристаллического характера. На рентгенограммах таких
образцов отсутствовали рефлексы, характерные для кристаллических фаз. Наблюдали
один большой галлообразный максимум, характеризующий наличие ближнего порядка в
стеклообразных материалах.

Рис. 3.5 - Рентгенограмма образца состава 0,2NaF
- 0,1CaF2 - 0,7CdSO4. ДРОН-7, CuKa-излучение (Ni -
фильтр), Θ = 20 - 60о
Для нестеклующихся составов полученные
рентгенограммы содержали рефлексы отражения от кристаллографических плоскостей,
характерный вид которых представлен на рис. 3.6.
Рис. 3.6 - Рентгенограмма образца состава 0,3NaF
- 0,2CaF2 - 0,5CdSO4. ДРОН-7, CuKa-излучение (Ni -
фильтр), Θ = 20 - 60о
Таким образом, проведенный расчет показал
удовлетворительное совпадение с экспериментально полученными результатами.
Получение стекол составов, находящихся в рассчитанной области стеклования, а
также отсутствие стеклообразования в образцах вне ее, также доказывает
правомерность выбранного подхода («кадмий - сульфат-ион») для применения
расчета стеклообразующей способности ковалентного расплава на основе учета
природы химической связи в системах с участием соединений, содержащих сложный
анион.
3.4 Исследование свойств стекол,
образующихся в системах NaF - МеF2 - CdSO4 (Me - Ca, Ba)
3.4.1 Оптическая прозрачность стекол
Для изучения оптической прозрачности стекол,
синтезированных на основе сульфата кадмия, были использованы пластинки из
стеклообразных образцов площадью ~ 100 мм2 и толщиной
0.25 - 0.50 мм. ИК-спектры образцов в среднем ИК-диапазоне (2,5 - 25 мкм, 4000
- 400 см-1) регистрировали на ИК Фурье спектрометре ФСМ-1201, а в видимой
области (0,35-0,9 мкм) - SPECORD-40. Полученные стеклянные пластинки являются
прозрачными для ИК-излучения в диапазоне до 7 - 8 мкм (1300 - 1200 см-1),
пропускание составляет 60-80 % (рис. 3.7 - 3.8). В коротковолновой области
наблюдается ограничение пропускания. В видимой области спектра все полученные
стекла обладают широкой полосой пропускания во всем видимом диапазоне длин волн
от 350 нм до 900 нм, а пропускание составляет 50 - 65 % (рис. 3.9). В
УФ-диапазоне коротковолновый край поглощения находится в пределах 259-267 нм.
Ширина запрещенной зоны, рассчитанная по формуле ∆Е(эВ)=1,24/λ(мкм)
[41], составляет 4,8-4,6 эВ. Исходя из рассчитанной величины ∆Е,
получаемые стекла следует считать диэлектриками.
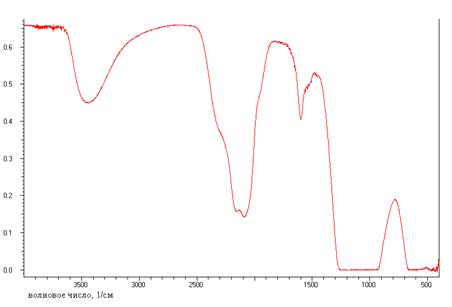
Рис. 3.7 - ИК-спектр пропускания стеклообразного
образца состава 0,2NaF - 0,2СаF2 - 0,6CdSO4. Толщина образца 0.4 мм

Рис. 3.8 - ИК-спектр стеклообразного образца
состава 0,5NaF - 0,1BaF2 - 0,4CdSO4. Толщина образца 0,3 мм

Рис. 3.9 - УФ-спектр стеклообразного образца
состава 0,5NaF - 0,1BaF2 - 0,4CdSO4. Толщина образца 0,3 мм
Для анализа существующих полос поглощения в
синтезированных стеклообразных материалах, были зарегистрированы ИК-спектры их
порошков, приготовленных в виде таблеток с прокаленным КBr (рис. 3.10-3.11).
Масса стеклообразного образца составляла 0,5 % от массы таблетки. Для
изготовления таблетки использовали 1 мг перетертого до пудрообразного состояния
стеклообразного образца и 200 мг прокаленного бромида натрия. Исходные порошки
тонко измельчали и смешивали на шаровой мельнице. Прессование проводили под
вакуумом при давлении 7 - 8 т/см2.
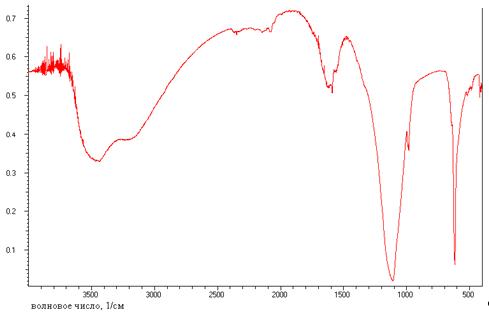
Рис. 3.10 - ИК-спектр пропускания аморфного
образца состава 0,2NaF - 0,2СаF2 - 0,6CdSO4 в прокаленном КBr. Толщина образца
0.4 мм
В полученных ИК-спектрах наблюдали полосы,
характеризующие колебания гидроксогрупп молекул воды в области спектра 3500 -
3400 см-1 и 1620 см-1 [42], несмотря на то, что расплав шихты выдерживали при
температуре 1270 К, а отгонка воды из соединения заканчивается при температурах
ниже 500 К. Вероятно это связано с тем, что полученные стекла весьма
гигроскопичны и в процессе хранения поглощают влагу. Полосы при 1100 см-1, 980
см-1 и 620 см-1 отнесены к валентным колебаниям связей в сульфат-анионе, полосы
при 587см-1, 553 см-1 и 484 см-1 к валентным колебаниям связей в молекулах
СаF2, полоса при 426 см-1 соответственно к валентным колебаниям в молекулах
NaF, что хорошо согласуется с литературными данными [41]. Полосы в области
2400-2150 см-1 по их положению и небольшой интенсивности отнесены к обертонам
низкочастотных колебаний.

Рис. 3.11 - ИК-спектр пропускания аморфного
образца состава 0.5NaF - 0.1BaF2 - 0.4CdSO4 в прокаленном КBr. Толщина образца
0,3 мм
3.4.2 Термические характеристики
стекол в системах NaF - МеF2 - CdSO4 (Me - Ca, Ba)
Образцы стекол, полученные в системах NaF - МеF2
- CdSO4 (Me - Ca, Ba) при охлаждении расплавов со скоростью ~ 103 град/с, были
использованы для исследования их термической стабильности.
Определение температуры стеклования (Тg), начала
кристаллизации (Тх), максимума экзотермического пика кристаллизации (Тс) и
температуры ликвидуса (Тl) для всех стеклообразных образцов проводили методом
дифференциально-термического анализа (ДТА) при скорости нагрева образцов 15
град/мин. В качестве эталона использовали Al2O3. Ошибка в определении
температур тепловых эффектов составляла 0,3 - 0,5 % от измеряемой величины.
На рис. 3.12 - 3.13 приведены характерные
термограммы стекол, образующихся в системе NaF - МеF2 - CdSO4 (Me - Ca, Ba), на
которых показаны все проявляющиеся тепловые эффекты, соответствующие переходу
стекла в состояние переохлажденного расплава, его кристаллизации и последующему
плавлению.

Рис. 3.12 - Дифференциально-термическая кривая
стеклообразного образца состава 0,3NaF - 0,1СаF2 - 0,6CdSO4. ДТА-1М скорость
нагрева 15 град/мин. Тg - температура стеклования, Тх - температура начала
кристаллизации, Тс - температура максимума экзотермического пика
кристаллизации, Тl - температура ликвидуса
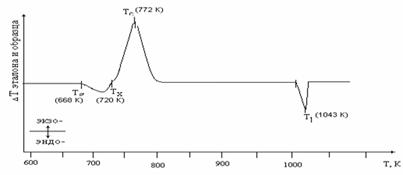
Рис. 3.13 - Дифференциально-термическая кривая
образца стекла состава 0,3NaF - 0,1BaF2 - 0,6CdSO4. ДТА-1М. Тg - температура
стеклования, Тх - температура начала кристаллизации; Тс - температура конца
кристаллизации; Тl - температура ликвидуса
Методом дифференциально-термического анализа
определены характеристические температуры синтезированных стекол, значения
которых позволяют отнести данные стекла к числу легкоплавких. Результаты ДТА
исследованных образцов стекол приведены в табл. 3.10 - 3.11, из которых видно:
что температура стеклования (Tg) синтезированных стекол лежит в пределах
619-706 К для системы NaF - СaF2 - CdSO4, 485-515 К для системы NaF - BaF2 -
CdSO4; температура начала кристаллизации (Tx) 672-764 для системы NaF - СaF2 -
CdSO4, 520-540 для системы NaF - BaF2 - CdSO4; температура плавления (Тl)
998-1158 и для системы NaF - BaF2 - CdSO4 795-830 К.
Кристаллизация стекол протекает в одну стадию.
Плавление образцов является одностадийным, реже двухстадийным процессом. Внутри
области стеклообразования изменение температурных характеристик немонотонно.
Таблица 3.10 - Значения характеристических
температур стекол, образующихся в системе NaF - СаF2 - CdSO4
|
№
|
Состав
|
Тg,
К
|
Тx,
К
|
Тc,
К
|
Тl,
К
|
|
1
|
0.6NaF-0.4CdSO4
|
700
|
545
|
566
|
1130
|
|
2
|
0.5NaF-0.5CdSO4
|
729
|
577
|
594
|
1175
|
|
3
|
0.4NaF-0.6CdSO4
|
750
|
627
|
632
|
1210
|
|
4
|
0.4NaF-0.1СaF2
-0.5CdSO4
|
638
|
693
|
735
|
998
|
|
5
|
0.3NaF-0.1СaF2
-0.6CdSO4
|
677
|
730
|
778
|
1075
|
|
6
|
0.2NaF-0.1СaF2
-0.7CdSO4
|
710
|
760
|
799
|
1127
|
|
7
|
0.2NaF-0.2СaF2
-0.6CdSO4
|
800
|
845
|
890
|
1270
|
|
8
|
0.1NaF-0.2СaF2
-0.7CdSO4
|
811
|
852
|
892
|
1287
|
Таблица 3.11 - Значения характеристических
температур стекол, образующихся в системе NaF - BaF2 - CdSO4
|
№
|
Состав
|
Тg
|
Тx
|
Тc
|
Тl
|
|
1
|
0,4CdSO4
- 0,6NaF
|
750
|
780
|
802
|
1210
|
|
2
|
0,5CdSO4
- 0,5NaF
|
729
|
762
|
780
|
1175
|
|
3
|
0,6CdSO4
- 0,4NaF
|
700
|
735
|
756
|
1130
|
|
4
|
0,4NaF
- 0,1BaF2 - 0,5CdSO4
|
624
|
681
|
746
|
960
|
|
5
|
0,3NaF
- 0,1BaF2 - 0,6CdSO4
|
668
|
720
|
772
|
1043
|
|
6
|
0,2NaF
- 0,2BaF2 - 0,6CdSO4
|
680
|
730
|
804
|
1080
|
|
7
|
0,1NaF
- 0,3BaF2 - 0,6CdSO4
|
700
|
750
|
822
|
1110
|
|
8
|
0,1NaF
- 0,2BaF2 - 0,7CdSO4
|
713
|
761
|
833
|
1130
|
Для оценки термической стабильности полученных
стекол использовали ряд критериев, к которым относят величину Тg, разницу между
температурой начала кристаллизации и температурой стеклования ∆Т,
критерий Груби Нr, и другие, рассчитанные значения которых представлены в табл.
3.12 - 3.13.
Таблица 3.12 - Критерии термической стабильности
фторсульфатных стекол, образующихся в системе NaF - СаF2 - CdSO4
|
№
|
Состав
|
Tg/Tl
|
DТ, К
|
Нr
|
H`
|
S,
K
|
|
1
|
0.6NaF-0.4CdSO4
|
0,62
|
35
|
0,088
|
0,050
|
1,05
|
|
2
|
0,5NaF
- 0,5CdSO4
|
0,62
|
33
|
0,079
|
0,452
|
0,815
|
|
3
|
0,4NaF
- 0,6CdSO4
|
0,62
|
30
|
0,069
|
0,040
|
0,88
|
|
4
|
0,4NaF
- 0,1СaF2 - 0,5CdSO4
|
0,64
|
55
|
0,180
|
0,086
|
3,62
|
|
5
|
0,3NaF
- 0,1СaF2 - 0,6CdSO4
|
0,63
|
53
|
0,153
|
0,078
|
3,75
|
|
6
|
0,2NaF
- 0,1СaF2 - 0,7CdSO4
|
0,63
|
50
|
0,136
|
0,070
|
2,74
|
|
7
|
0,2NaF
- 0,2СaF2 - 0,6CdSO4
|
0,63
|
45
|
0,106
|
0,056
|
2,53
|
|
8
|
0,1NaF
- 0,2СaF2 - 0,7CdSO4
|
0,63
|
41
|
0,094
|
0,051
|
2,02
|
Таблица 3.13 - Параметры термической
стабильности фторсульфатных стекол, образующихся в системе NaF - BaF2 - CdSO4
|
№
|
Состав
|
Tg/Tl
|
DТ, К
|
Нr
|
H`
|
S,
K
|
|
1
|
0,4CdSO4
- 0,6NaF
|
0,62
|
35
|
0,088
|
0,050
|
1,05
|
|
2
|
0,5CdSO4
- 0,5NaF
|
0,62
|
33
|
0,079
|
0,452
|
0,815
|
|
3
|
0,6CdSO4
- 0,4NaF
|
0,62
|
30
|
0,069
|
0,04
|
0,88
|
|
4
|
0,4NaF
- 0,1BaF2 - 0,5CdSO4
|
0,65
|
57
|
0,204
|
0,091
|
5,93
|
|
5
|
0,3NaF
- 0,1BaF2 - 0,6CdSO4
|
0,64
|
52
|
0,161
|
0,077
|
4,047
|
|
6
|
0,2NaF
- 0,2BaF2 - 0,6CdSO4
|
0,63
|
50
|
0,143
|
0,073
|
5,441
|
|
7
|
0,1NaF
- 0,3BaF2 - 0,6CdSO4
|
0,63
|
50
|
0,127
|
0,071
|
5,142
|
|
8
|
0,1NaF
- 0,2BaF2 - 0,7CdSO4
|
0,63
|
48
|
0,130
|
0,067
|
4,817
|
Как следует из таблиц 3.11 - 3.12, величина
приведенной температуры стеклования Tg/Tl находится в пределах 0.61 - 0.63 для
систем NaF - МеF2 - CdSO4 (Me - Ca, Ba), что достаточно хорошо коррелирует с
правилом «двух третей», согласно которому для большинства стеклообразующих
систем (как органических, так и неорганических) в широком интервале температур
(100 - 2000 К) и при скоростях охлаждения расплава от 0.01 до 10 К/с,
выполняется условие Tg/Tl ≈ 2/3. При этом, уменьшение приведенной
температуры стеклования, трактуется как снижение тенденции системы к
стеклообразованию. В нашем случае снижение величины Tg/Tl является
незначительным, однако определены при высоких, до 1000 град/с, скоростях
охлаждения расплавов.
Величина Нr находится в пределах от 0,069 до
0,204, что свидетельствует о том, что стекла, образующиеся в тройной системе
NaF - МеF2 - CdSO4 (Me - Ca, Ba) могут быть получены только при определенных
условиях закаливания образцов, а именно, при высоких скоростях охлаждения
расплавов. Однако, термическая устойчивость данных стекол невелика, что
подтверждается небольшими термическими эффектами Тg и Тc на термограммах
стеклообразных образцов [43].
Введение в стекло, образующееся по разрезу NaF -
CdSO4, фторида кальция, фторида бария и повышение его содержания в стекле
приводит к заметному увеличению практически всех критериев термической
стабильности стекол. В то же время, стекла, содержащие фторид бария, по всем
величинам критериев превосходят соответствующие величины для стекол, содержащих
фторид кальция, что согласуется с правилом Захариасена, согласно которому
термическая стабильность стекол увеличивается с увеличением ионного радиуса
металла, являющегося модификатором сетки стекла [44].
По данным дифференциально-термического анализа
стеклообразных образцов, синтезированных в тройных системах NaF - МеF2 - CdSO4
(Me = Ca, Ba), ориентировочно определены линии ликвидуса и состав тройных
эвтектик. В системе NaF - СаF2 - CdSO4 тройная эвтектика ориентировочно
приходится на состав 0,4NaF - 0,1СаF2 - 0,5CdSO4, температура плавления тройной
эвтектики приблизительно 980 К. В системе NaF - BaF2 - CdSO4 ориентировочные
координаты тройной эвтектики составляют 0,4NaF - 0,1BaF2 - 0,5CdSO4 при
температуре около 940 К (рис. 3.14 - 3.15). Образцы данных составов имеют
минимальную температуру ликвидуса и характеризуются максимальными значениями
критериев термической стабильности, что соответствует положению о том, что
наиболее высокой термической стабильностью обладают стекла, составы которых
приходятся на эвтектику и эвтектические линии. Наименьшей термической
стабильностью обладают стекла, составы которых соответствуют химическому
соединению.

Рис. 3.14 - Область стеклования и
ориентировочная диаграмма плавкости системы NaF - СаF2 - CdSO4
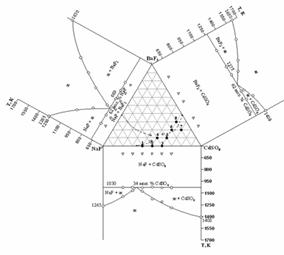
Рис. 3.15 - Область стеклования и
ориентировочная диаграмма плавкости системы NaF - BaF2 - CdSO4
При относительном сравнении значений величин
термической стабильности некоторых многокомпонентных фторидных стекол (табл. 3.14)
с подобными значениями величин для полученных в данной работе стекол на основе
сульфата кадмия, позволяет сделать вывод о более низкой стабильности стекол на
основе CdSO4. Это закономерно должно приводить к существенному усложнению
процесса получения стекол на основе сульфата кадмия, что отражается в высоких
скоростях закаливания фторсульфатных расплавов. При небольших скоростях
охлаждения (простая отливка расплава на металлическую пластину без
дополнительного прессования расплава сверху другой пластиной) образцы были
частично или полностью закристаллизованы.
Таблица 3.14 - Параметры термической
стабильности некоторых фторидных стекол
|
№
|
Состав,
мол. %
|
Tg,
K
|
Tg/Tl
|
∆T,
K
|
Нr
|
H`
|
S,
K
|
|
1
|
54ZrF4-23BaF2-4LaF3-3AlF3-16NaF
|
535
|
0.72
|
164
|
4.32
|
0.31
|
-
|
|
2
|
30GaF3-25SrF2-25CdF2-15ZnF2-5ThF4
|
601
|
0.69
|
85
|
0.47
|
0.14
|
0.99
|
|
3
|
36InF3-20ZnF2-20BaF2-20SrF2-4GaF3
|
582
|
0.68
|
105
|
0.18
|
4.32
|
|
4
|
20YF3-40AlF3-20BaF2-20CaF2
|
713
|
0.66
|
103
|
0.38
|
0.14
|
2.02
|
|
5
|
30PbF2-20GaF3-15InF3-20CdF2-15ZnF2
|
516
|
-
|
111
|
-
|
0.22
|
4.3
|
Таким образом, изучение стеклообразования в
тройной системе NaF - МеF2 - CdSO4 (Me - Ca, Ba) показало, что при высоких (до
1000 град/с) скоростях закаливания, можно получить образцы, находящиеся в
стеклообразном состоянии.
ВЫВОДЫ
Впервые построены диаграммы плавкости четырех
систем CdSO4 - NaF; CaF2 - CdSO4; NaF - BaF2; BaF2 - CdSO4. Все диаграммы
эвтектического типа без взаимной растворимости исходных компонентов.
В системах NaF - MeF2 - CdSO4 (Me - Ca, Ba)
впервые расчетным путем определены области стеклования, границы которых
подтверждены экспериментальными исследованиями. Область стеклования примыкает к
бинарному разрезу NaF - CdSO4 и распространяется в направлении к BaF2, CaF2.
Определены характеристические температуры
фторсульфатных стекол и рассчитаны критерии их термической стабильности. Для
всех полученных стекол выполняется правило Каузмана (правило «двух третей»).
Введение в кадмий - натриевые стекла фторидов кальция или бария приводит к
заметному повышению их устойчивости к кристаллизации, что отражается в
увеличении всех значений критериев термической стабильности. Критерий Груби
(Нr) для всех стекол находится в пределах от 0.069 до 0.204, что
свидетельствует о низкой термической стабильности стекол и требует высоких
(более 100 град/с) скоростей охлаждения расплавов при синтезе стекол.
Все полученные стекла прозрачны в УФ, видимой и
ИК областях спектра от 258-270 нм до 7-8 мкм. В длинноволновой области
ограничение пропускания обусловлено началом фундаментального поглощения, а в
коротковолновой - собственными колебаниями решетки. Синтезированные стекла
являются диэлектриками, Еg = 4,6- 4,8 эВ
ЛИТЕРАТУРА
1. Петрова
Е.М. Закономерности формирования структуры стекол на основе FeF3, GaF3, InF3 и
ZrF4 / Автореф. дис. канд. хим. наук // Сибирск. гос. техн. ун-т.: Красноярск,
1998. -29с.
2. Байдаков
Л.А. Количественный критерий стеклообразующей способности вещества на основе
учета природы химической связи // Физика и химия стекла, 1994. Т.20. №3. С.
341-347.
. Мазурин
О.В. Стекло: природа и строение. - Л., 1985
. Демкиной
Л.И. Физико-химические основы производства оптического стекла. - Л.: Химия,
1976. С. 456.
. Качалов
Н.Н. Стекло. - М.: Изд-во АН СССР, 1959.
. Шульц
М.М., Мазурин О.В., Порай-Кошиц Е.А. Стекло: природа и строение. - Л.: Знание,
1985. С. 32.
. Краева
Н.В., Кертман А.В., Андреев О.В. Стеклообразование в системах Ga2S3-MeS-MeF2
(Me = Mg, Ca, Sr, Ba) // Тез. докл. Всеросс. конф. «Химия твердого тела и
функциональные материалы»; УрО РАН. - Екатеринбург, 2004. С. 224.
. Федоров
П.П., Закалюкин Р.М., Игнатьева Л.Н., Бузник В.М. Фториндатные стекла // Успехи
химии, 2000. Т.69. №8. С.767-779.
. Плахотник
В.Н. Фториды вокруг нас. // Соросовский образовательный журнал. №2, 1998. С.95.
. Ахметов
Н.С. Общая и неорганическая химия: Учеб. для вузов. - М.: Высшая школа, 1981. -
679 с.
. Реми
Г. Курс неорганической химии. В 2-х кн. Кн. 2. - М.: Мир, 1966. - 836 с.
. Рипан
Р., Четяну И. Неорганическая химия. - М.: Мир, 1971. - 560 с.
. Некрасов
Е.Б. Основы общей химии 3-е изд., испр. и доп. - М.: Химия, 1973. - 656 с.
. Рысс
И.Г. Химия фтора и его неорганических соединений. - М.: Госхимиздат, 1956. -
718 с.
. Исикава
Н., Кобаяси Е. Фтор: химия и применение. - М.: Мир, 1982. - 276 с.
. Угай
Я.А. Неорганическая химия: Учеб. для хим. спец. вузов. - М.: Высшая школа,
1989. - 463 с.
. Рабинович
В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - 67 с.
. Бабицына
А.А., Емельянова Т.А., Федоров В.А. Стеклообразование в системах ZrF4 - BaF2 -
AlF3 - NaF, ZrF4 - BaF2 - LaF3 - NaF, ZrF4 - BaF2 - LaF3 - AlF3. // Неорган.
материалы, 2002. Т.38. №5. С. 622-631.
19. Байдаков
Л.А., Блинов Л.Н., Почепцова Н.С. К вопросу о взаимосвязи стеклообразного
состояния вещества с его фундаментальными характеристиками // Письма ЖТФ. 1986.
Т.12. №15. С. 954-957.
. Байдаков
Л. А., Блинов Л. Н. О корреляции между атомно-структурными характеристиками
расплавов и их способностью к стеклообразованию // Физ. и хим. стекла, 1987.
Т.13. №3. С. 340-345.
. Байдаков
Л.А., Блинов Л.Н., Байдаков Е.Л. Квантовые характеристики атомов и стеклообразующая
способность вещества // Изв. АН СССР. Неорган. Матер, 1989. Т.25. №9. С.
1582-1584.
. Кертман
А.В., Краева Н.В., Мичкарева В.В. и др. Математический прогноз
стеклообразования в системах MeS-MeF2-Ga2S3 (Me=Mg,Ca,Sr,Ba) // Сб.трудов XVII
Межд. научн. конф. «Математические методы в технике и технологии», 1-3 июня
2004, Кострома // Кострома: Изд-во КГТУ, 2004. Т.9, С.90-91.
23. Кертман
А.В., Мичкарева В.В., Носов И.И. и др. Расчет и исследование стеклообразования
в системах MeS-Ga2S3 (Me=Mg,Ca,Sr,Ba) // Вестник ТюмГУ, 2001. №3. С.192-197.
. Диаграммы
плавкости солевых систем. Часть I. Двойные солевые системы с общим анионом [от
AgBr - CsBr до In2(WO4)3 - Rb2WO4]. Справочник. Под ред. В.И. Посыпайко, Е.А.
Алексеевой. - М.: «МЕТАЛЛУРГИЯ», 1977. С. 415.
. Аносов
В.Я., Озерова М.И., Фиалков Ю.Я. Основы физико-химического анализа. - М.:
Наука, 1976. 503 с.
. Аносов
В.Я., Погодин С.А. Основные начала физико-химического анализа. - М.: АН СССР,
1947. 863 с.
. Курнаков
Н.С. Введение в физико-химический анализ. - М.-Л.: АН СССР, 1940.
. Погодин
С.А. Физико-химический анализ. БСЭ - 3-е изд. - М. 1974.
. Древинг
В.П., Калашников Я.А. Правило фаз. - М.: Изд-во Моск. Унив., 1964. 454 с.
. Погодин
С.А. Фаз правило. БСЭ - 3-е изд. - М. 1974.
. Ветроградский
В.А., Егорова Л.С. Интерпретация термической кривой при
дифференциально-термическом анализе. Инж. - физ. журн., 1979. Т.36. №3. 480 с.
32. Ковба
Л.М., Трунов В.К. Рентгенофазовый анализ. - М.: Изд-во Моск. Университета,
1976. 232 с.
33. Андреев
О.В., Хритохин Н.А., Кертман А.В. Рентгенография - Тюмень: ТюмГУ, 1990. 114 с.
34. Горелик
С.С., Скаков Ю.А., Расторгуев Л.Н. Рентгенографический и электронно-оптический
анализ. - М.: «МИСИС», 2002. - 358 с.
. Кельнера
Р., Мерме Ж.М, Отто М., Видмер М. Аналитическая химия. Проблемы и подходы. Пер.
с англ. // - М.:Мир: ООО «Издательство АСТ», 2004. Т.1. 608 с.
. Бахшиев
Н. Г. Введение в молекулярную спектроскопию
<http://www.xumuk.ru/encyklopedia/2/4162.html>, 2-е изд. - Л.: 1987.
37. Коффи
У., Ивенс М., Григолини П. Молекулярная диффузия
<http://www.xumuk.ru/encyklopedia/1442.html> и спектры. Пер. с англ.,
1987.
38. Эльвинг
Ф., Хортон Ч., Уиллард Х. Аналитическая химия фтора / в кн. Фтор и его
соединения - М.: Иностр. лит-ра, 1956. Т.2. С. 45-178.
39. Кертман
А.В., Игнатьева Л.В. Применение метода расчета стеклообразующей способности
расплава к системам, содержащих тройное соединение // Вестник ТюмГУ, 2009. №.6.
С. 241-245.
. Игнатьева
Л.В., Кертман А.В. Стеклообразование в системах NaF - MeF2 - CdSO4 (Me - Ca,
Sr, Ba, Zn) // Проблемы теоретической и экспериментальной химии: тез. докл. XXI
Росс. молодеж. науч. конф., посвящ. 150-летию со дня рожд. академика Н.Д.
Зелинского, Екатеринбург, 19 - 23 апр. 2011 г. - Екатеринбург: Изд-во Урал.
Ун-та, 2011. С. 336-337.
. Ормонт
Б.Ф. Введение в физическую химию и кристаллохимию полупроводников. / Б.Ф.
Ормонт. - М.: Высшая школа, 1982. - 528 с.
. Накомото
К. ИК-спектры и спектры КР неорганических и координационных соединений: пер. с
англ. / К. Накомото. - М.: Мир, 1991. - 536 с.
43. Кертман
А.В., Игнатьева Л.В. Термическая стабильность стекол в системах NaF - MeF2 -
CdSO4 (Me - Ca, Ba) // Вестник ТюмГУ, 2011. №5. С.195-199
44. Горшков
В.С., Савельев В.Г., Федоров Н.Ф. Физическая химия силикатов и других
тугоплавких соединений. - М.: Высшая школа, 1988. - 400 с.