Аминокислоты и их свойства
ФГОУ СПО «ВПТ»
Реферат
«АМИНОКИСЛОТЫ
и их свойства»
Выполнила:
студентка ЭКО-13
Должикова Мария
Проверила:
Федорова Н.А.
2012 год
Содержание
аминокислота химический
раствор изомерия
Введение
1. Îáùèå
õèìè÷åñêèå ñâîéñòâà
<../AppData/Local/Temp/Rar$DI00.856/Àìèíîêèñëîòû/Àìèíîêèñëîòû.html>
. Èçîìåðèÿ
<../AppData/Local/Temp/Rar$DI00.856/Àìèíîêèñëîòû/Àìèíîêèñëîòû.html>
3.
α-ΐμθνξκθρλξςϋ
αελκξβ
<../AppData/Local/Temp/Rar$DI00.856/ΐμθνξκθρλξςϋ/ΐμθνξκθρλξςϋ.html>
.1 Êëàññèôèêàöèÿ
ñòàíäàðòíûõ
àìèíîêèñëîò
ïî R-ãðóïïàì
<../AppData/Local/Temp/Rar$DI00.856/Àìèíîêèñëîòû/Àìèíîêèñëîòû.html>
.2 Классификация стандартных
аминокислот по функциональным группам
4. Кислотно-основное
равновесие в растворе б-аминокислот <../AppData/Local/Temp/Rar$DI00.856/Аминокислоты/Аминокислоты.html>
5. Некоторые химические
свойства α-аминокислот
Заключение
<../AppData/Local/Temp/Rar$DI00.856/Аминокислоты/Аминокислоты.html>
Введение
По современным данным, биомасса единовременно живущих на Земле организмов
составляет 1,8·1012-2,4·1012 т в пересчете на сухое вещество. В
организмах, составляющих биомассу Земли, обнаружено свыше 60 химических
элементов. Среди них условно выделяют группу элементов, встречающихся в составе
любого организма. К их числу относят C, N, H, O, S, P, Na, K, Са, Mg, Zn, Fe, Mn и др. Первым шести элементам приписывают исключительную роль
в биосистемах, так как из них построены важнейшие соединения, составляющие
основу живой материи - белки, нуклеиновые кислоты, углеводы, липиды и др.
Примерно 75% биомассы составляет вода. Вторым же по количественному
содержанию в биологических объектах, но, несомненно, первым и главным по
значению классом соединений являются белки. Белки состоят из мономерных единиц,
т.е. аминокислот.
Аминокислоты
(аминокарбоновые кислоты) - органические соединения, в молекуле которых
одновременно содержатся карбоксильные
<#"518252.files/image001.gif">
Рис.1.
Конфигурация α-аминокислот
Все природные аминокислоты, входящие в состав белков, относятся именно к
L-ряду.
Данную особенность «живых» аминокислот трудно объяснить, так как в
реакциях между оптически неактивными веществами или рацематами (из которых,
видимо, состояла древняя Земля) L и D-формы образуются в одинаковых
количествах. Креационисты, естественно, могут объяснить это божьим умыслом,
остальным же приходится считать, что это - просто результат случайного стечения
обстоятельств: самая первая молекула, с которой смог начаться матричный синтез,
была оптически активной, а других пригодных молекул почему-то не образовалось.
Оптические
изомеры аминокислот претерпевают медленную самопроизвольную неферментативную
рацемизацию. Например, в белке дентине
<#"518252.files/image002.gif">
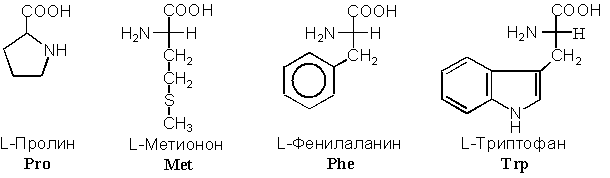
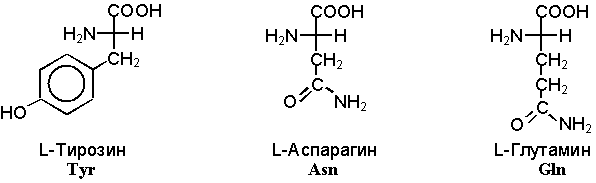
ПОЛЯРНЫЕ НЕЗАРЯЖЕННЫЕ АМИНОКИСЛОТЫ
ЗАРЯЖЕННЫЕ АМИНОКИСЛОТЫ


Рис.2. Наиболее
распространенные α-аминокислоты
Сразу следует указать, что в нейтральных растворах все аминокислоты
ионизованы (то есть, заряжены). Приведенный выше термин «заряженные
аминокислоты» относится исключительно к боковому радикалу аминокислоты и
отражает тот факт, что в боковом радикале содержится функциональная группа,
которая либо теряет протон при рH, близком к 7, (отрицательно заряженные
аминокислоты), либо, наоборот, присоединяет (положительно заряженные
аминокислоты).
Из
20 -аминокислот, приведенных на Рис.2, 17 обладают одним хиральным
центром (то есть, могут существовать в виде двух энантиомеров), одна ахиральна
(глицин) и две имеют два хиральных центра (изолейцин и треонин). Каждая из этих
двух аминокислот может существовать в виде четырех стереоизомеров. Рассмотрим
стереохимию и номенклатуру этих соединений на примере треонина (Рис. 3).

Рис.
3. Стереоизомеры треонина
Встречающийся в белках L-треонин является (2-S, 3-R)-стереоизомером. Его
энантиомер называют D-треонином. Для обозначения их диастереомеров используют
приставку «алло» (алло по-гречески означает другой).
3.2
Классификация стандартных аминокислот по функциональным группам
· Алифатические
o Моноаминомонокарбоновые:
аланин
<#"518252.files/image008.gif">
Рис.
4. Кислотно-основное равновесие в растворе α-аминокислот
В свою очередь, неионизованная карбоксильная группа (-I-эффект) должна
понижать основность аминогруппы, а ионизованный карбоксил за счет сильного
+I-эффекта будет усиливать основные свойства NH2-группы.
В
сильно кислой среде -аминокислоты существуют в виде двухосновной
кислоты (катион на Рис. 4). В сильно щелочной среде будет преобладать анион. В
нейтральных средах могут присутствовать две незаряженные формы - нейтральная и
биполярная (последнюю часто называют цвиттер-ионом). Соотношение нейтральной и
биполярной форм определяется относительной силой двух кислотных группировок
катиона (-COOH и -NH3+). Чем больше кислотность карбоксильной группы по
сравнению с аммонийной (или чем основнее аминогруппа по сравнению с
карбоксилат-анионом), тем сильнее равновесие сдвинуто в сторону цвиттер-иона.
Α-Аминокислоты в нейтральных средах существуют практически полностью в
виде цвиттер-иона.
Характеристическое
значение рH, при котором концентрация цвиттер-иона максимальна называют
изоэлектрической точкой (pI).. Поскольку в целом молекула цвиттер-иона
электронейтральна, электропроводность раствора в такой точке будет минимальной,
а молекула аминокислоты не будет смещаться в электрическом поле.
При
отсутствии ионизирующихся групп в боковом радикале изоэлектрическая точка лежит
при pH, численно равном среднему арифметическому двух величин pKэфф.
В
Табл. 1 приведены величины pKэфф и pI некоторых аминокислот.
Табл.
1. Экспериментально измеренные pK и изоэлектрические точки α-аминокислот
|
Аминокислота
|
pKэфф
|
pI
|
|
COOH
|
α
-NH2
|
Боковая группа
|
|
|
Aланин
|
2,3
|
9,9
|
-
|
6,0
|
|
Аргинин
|
1,8
|
9,0
|
12,5
|
11,2
|
|
Аспарагин
|
2,0
|
8,8
|
-
|
|
Аспарагиновая кислота
|
2,0
|
10,0
|
3,9
|
2,8
|
|
Валин
|
2,3
|
9,6
|
-
|
6,0
|
|
Гистидин
|
1,8
|
9,2
|
6,0
|
7,5
|
|
Глицин
|
2,4
|
9,8
|
-
|
6,0
|
|
Глутамин
|
2,2
|
9,1
|
-
|
5,7
|
|
Глутаминовая кислота
|
2,2
|
9,7
|
4,3
|
3,2
|
|
Изолейцин
|
2,4
|
9,7
|
-
|
6,0
|
|
Лейцин
|
2,4
|
9,6
|
-
|
6,0
|
|
Лизин
|
2,2
|
9,2
|
10,8
|
9,6
|
|
Метионин
|
2,3
|
9,2
|
-
|
5,7
|
|
Пролин
|
2,0
|
10,6
|
-
|
6,3
|
|
Серин
|
2,1
|
9,2
|
-
|
5,7
|
|
Тирозин
|
2,2
|
9,1
|
10,9
|
5,7
|
|
Треонин
|
2,6
|
10,4
|
-
|
5,6
|
2,4
|
9,4
|
-
|
5,9
|
|
Фенилаланин
|
1,8
|
9,1
|
-
|
5,5
|
|
Цистеин
|
1,8
|
10,8
|
8,3
|
5,1
|
Практически важно, что в изоэлектрической точке аминокислоты обладают
наименьшей растворимостью.
5. Некоторые
химические свойства α -аминокислот
Химические свойства α -аминокислот в основном определяются
поведением содержащихся в них функциональных групп - карбоксильной группы,
аминогруппы и функциональной группы бокового радикала (коль скоро таковая
присутствует). Здесь мы остановимся на химических особенностях, интересных с
биохимической точки зрения.
Для
обнаружения небольших количеств аминокислот наиболее широко используется
нингидриновая реакция (Рис. 5).
При
нагревании аминокислот с избытком нингидрина образуется продукт лилового цвета,
если аминокислота содержит свободную -аминогруппу, и желтый продукт,
если, как у пролина, ее -аминогруппа защищена. Этот метод обладает
высокой чувствительностью и используется как для качественного, так и для
количественного (колориметрического) определения аминокислот.



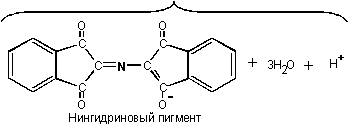
Рис.
5. Нингидриновая реакция, используемая для обнаружения и количественного
определения α-аминокислот. Атомы аминокислоты отмечены жирным
шрифтом. Пигмент содержит две молекулы нингидрина и атом азота аминокислоты
Для
определения аминокислотной последовательности пептидов важное значение имеет
реакция аминокислот с 1-фтор-2,4-динитробензолом (Рис. 6).
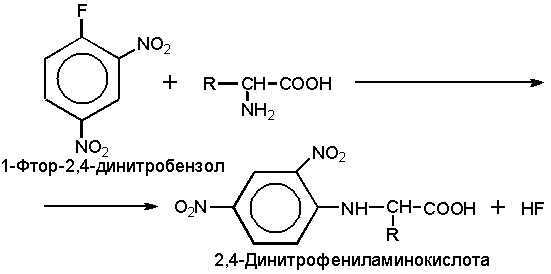
Рис.
6. Образование 2,4-динитрофенильных производных аминокислот
SH-Группа
цистеина чрезвычайно легко в окислительных условиях образует S-S-связь (Рис.
7).
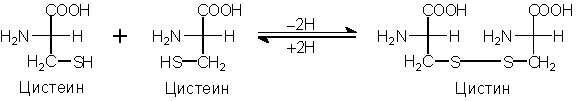
Рис. 7. Цистеин и цистин. Образование S-S-мостиков. В
белках встречается как цистин, так и цистеин
Эта реакция проходит уже в присутствии газообразного кислорода. Обратная
реакция легко протекает под действием даже слабых восстановителей. Образование
S-S-связей играет важную роль в организации третичной структуры белка.
Отметим, что все α -аминокислоты, входящие в состав белков, имеют атом
водорода у α -углеродного атома. Это очень важная особенность, на которой
основан метаболизм α -аминокислот в живых организмах.
Заключение
Аминокислоты - это «кирпичики», из которых построены молекулы важнейших
биополимеров - белков. Многообразие функций, осуществляемых белками в живых
организмах, определяется их химической структурой и физико-химическими
свойствами.
Для понимания строения и свойств аминокислот, которые являются
соединениями со смешанными функциями и проявляют как свойства карбоновых
кислот, так и свойства аминов, необходимо изучение и азотсодержащих
органических соединений, и карбоновых кислот.