Вещества цитотоксического действия
Вещества цитотоксического действия
Введение
Цитотоксическим - называется повреждающее действие веществ на организм
путем формирования глубоких структурных и функциональных изменений в клетках,
приводящих к их гибели. В основе такого действия лежит прямое или
опосредованное иными механизмами поражение внутриклеточных структур,
сопровождающееся грубыми нарушениями генетического аппарата клеток и клеточных
мембран, процессов синтеза белка и других видов пластического обмена.
Цитотоксиканты - вещества, токсическое действие которых обусловлено
первичным повреждением структурных элементов клетки (мембран, генома, аппарата
синтеза белка, пластического обмена), что является основным в вызываемом ими
токсическом процессе. Уже первые признаки даже самых легких клинических форм
отравления ими сопровождаются повреждением клеток.
Группа отравляющих токсических веществ цитотоксического действия включает
целый ряд различных по химическому строению веществ. Особый интерес
представляют токсичные химические вещества, способные при экстремальных
ситуациях вызывать массовые санитарные потери: боевые отравляющие вещества
кожно-нарывного действия (сернистый и азотистый иприт, люизит), некоторые
промышленные агенты (соединения мышьяка, ртути, эпоксиды, метилбромид, метилхлорид,
диметилсульфат и др.), фитотоксиканты и пестициды, а также их токсичные примеси
(диоксин и диоксиноподобные соединения), а также некоторые другие соединения.
Отравляющие и высокотоксичные вещества цитотоксического действия объединяет
способность вызывать воспалительно-некротические изменения тканей на путях
проникновения в организм.
Классификация цитотоксикантов:
. Мышьяк, некоторые металлы и их производные;
. Элементорганические соединения:
-- сероорганические соединения (галогенированные тиоэфиры - сернистый
иприт),
-- азоторганические соединения (галогенированные алифатические амины и
некоторые аминосоединения жирного ряда: азотистый иприт, этиленимин)
-- мышьякорганические соединения (галогенированные алифатические арсины:
люизит),
-- органические окиси и перекиси (этиленоксид) и др.
. Галогенированные полициклические ароматические углеводороды:
-- галогенированные диоксины,
-- галогенированные бензофураны,
-- бифенилы и др.
. Сложные гетероциклические соединения:
-- афлатоксины,
-- трихотеценовые микотоксины,
-- аманитин и др.
В основе механизма токсического действия цитотоксикантов лежит
ингибирование синтеза белка и клеточного деления с образованием аддуктов
нуклеиновых кислот (иприты); ингибирование синтеза белка и клеточного деления
без образования аддуктов нуклеиновых кислот (рицин), взаимодействие с
SH-группами белков (люизит, мышьяк и другие тиоловые яды), а также токсическая
модификация пластического обмена (галогенированные диоксины, бифенилы и др.).
Поэтому в соответствии с особенностями механизма действия цитотоксиканты
подразделяются на основные группы:
. Ингибиторы синтеза белка и клеточного деления.
.1. Образующие аддукты нуклеиновых кислот (иприты). Аддукты -
комплексы молекулы цитотоксиканта с пуриновыми (пиримидиновыми) основаниями
нуклеиновых кислот молекулы ДНК.
.2. Не образующие аддукты нуклеиновых кислот (рицин),
. Тиоловые яды ( мышьяк и его органические и неорганические
соединения; ртуть и ее соединения(этилмеркурхлорид); а также кадмий, медь,
железо, кобальт, цинк, марганец, молибден, ванадий, никель и их неорганические
и органические дериваты.
. Токсичные модификаторы пластического обмена (галогенированные
диоксины, бифенилы и др. ).
Вещества цитотоксического действия могут быть классифицированы также
следующим образом:
. Боевые отравляющие вещества (иприт, люизит);
. Промышленные и народнохозяйственные агенты (хлористый метил,
хлористый метилен, бромистый метил, йодистый метил, диоксин, металлы);
. Природные яды (рицин, афлатоксины и др.).
Некоторые вещества цитотоксического действия могут быть использованы в
качестве лекарственных препаратов, их классифицируют следующим образом:
. Противоопухолевае препараты;
. Антибиотики;
. Биологически активные природные соединения - фитонциды.
Общим в действии токсикантов этой группы на организм является:
. Медленное, постепенное развитие интоксикации (продолжительный
скрытый период, постепенное развитие токсического процесса);
. Универсальность повреждающего действия, когда практически в
токсический процесс вовлечены все органы и системы;
. Основные формы вызываемых в органах и тканях нарушений -
воспалительно-некротические изменения, угнетение процессов клеточного деления,
угнетение процессов клеточного деления, глубокие функциональные расстройства
внутренних органов.
1. Ингибиторы синтеза белка и клеточного деления
.1 Образующие аддукты нуклеиновых кислот
иприт рицин мышьяк
цитотоксический
Аддукты нуклеиновых кислот, соединяются с азотистыми основаниями
нуклеиновых кислот ковалентно, они преимущественно поражают делящиеся клетки. Наибольшей
чувствительностью к цитотоксикантам, образующим аддукты нуклеиновых кислот,
обладают органы и системы с большим потенциалом к клеточному делению.
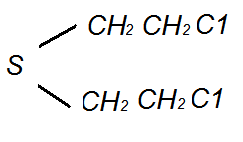 Иприты
Иприты
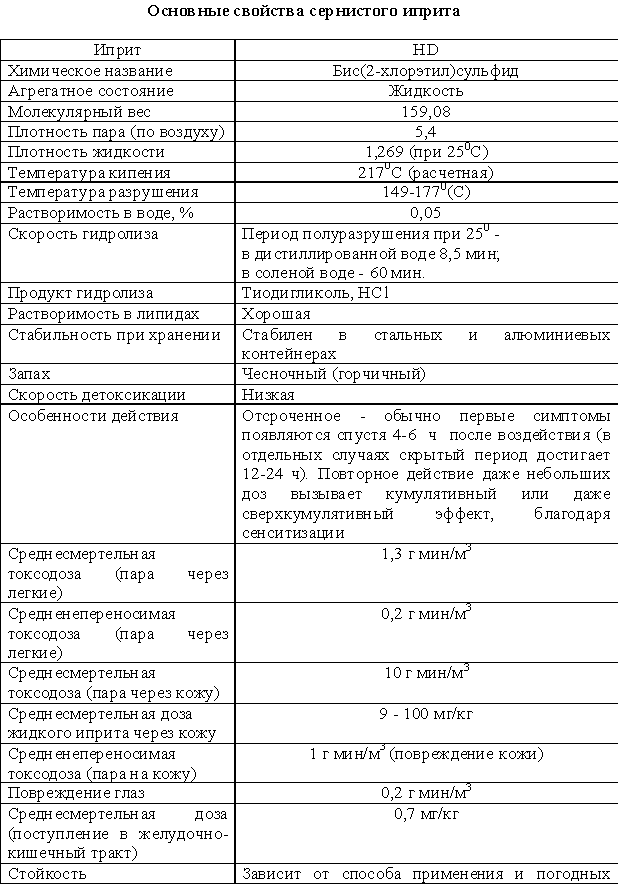
Перегнанный (сернистый) иприт - дихлордиэтилсульфид.
Бесцветная маслянистая жидкость без запаха. При разложении продукта и при
наличии технических примесей появляется горчичный запах (горчичный яд).
Основное боевое состояние сернистого иприта - пары или капли.
Летучесть незначительная, но уже через 3 минуты после вдыхания паров
иприта в условиях максимального насыщения в организм проникает смертельная
токсодоза. Пары иприта тяжелее воздуха в 5,5 раза. Жидкий иприт в воде
растворяется плохо и опускается на дно водоемов, на воде остается пленка.
Хорошая растворимость в жирах определяет высокие дерматотропные свойства. В
смеси с дихлорэтаном, зарином, зоманом может применяться в зимнее время, т. к.
такие смеси замерзают при температуре - ниже минус 20 градусов С. Для дегазации
может использоваться - дихлорамин.
Обладает кожнонарывным
действием, т. к. взаимодействует со структурными белками клеточных мембран.
Иприт обладает кумулятивными свойствами, контакт с этим ядом вызывает
сенсибилизацию к нему.
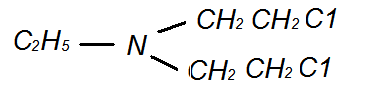
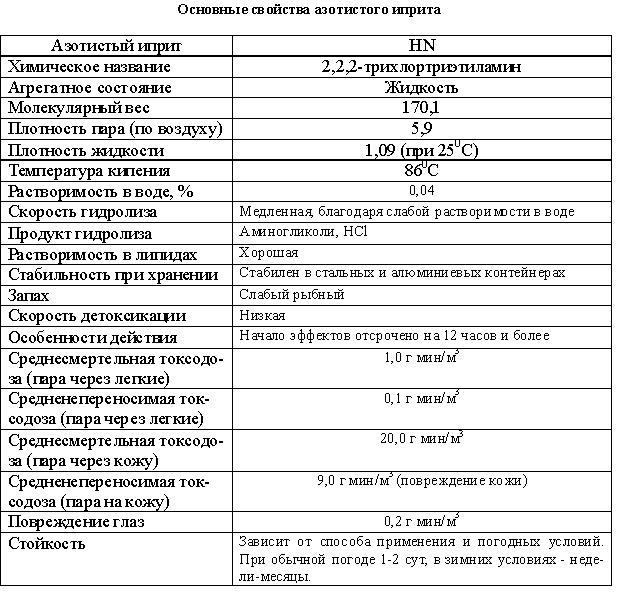
Азотистый иприт - этил-(дихлордиэтил)-амин.
Азотистый иприт - маслянистая слегка темная или бесцветная жидкость,
легко растворяется в органических растворителях, практически не растворима в
воде.
Сернистый, азотистый, кислородный иприты - обладают высокой температурой
кипения, давление насыщенных паров ипритов - незначительное, возрастает с
увеличением температуры. В обычных условиях иприты испаряются медленно,
создавая при заражении местности стойкий очаг поражения. Кроме того, иприты
обладают высокой стойкостью к разрушающему действию факторов внешней среды.
Сернистый иприт сохраняется 18 часов, азотистый иприт - 12 часов.
Они способны надолго заражать различные объекты и могут представлять
опасность при авариях на объектах по уничтожению химического оружия, при
производстве морских инженерных работ в акваториях, где производилось
затопление отравляющих веществ, а также при террористических актах. При боевом
применении ипритов формируется стойкий очаг поражения.
Связь алкильных радикалов в молекулах токсикантов может быть разрушена
путем гидролиза. Конечными продуктами гидролиза являются нетоксичные
соединения, поэтому реакция может быть использована для дегазации зараженных
объектов. Гидролизу подвергается только растворившееся количество ипритов. А т.
к. растворимость ипритов очень низкая, находящиеся в воде ОВ долго сохраняют
свою токсичность. Процесс гидролиза можно ускорить в условиях очень большого
избытка воды и нагревания зараженной жидкости с добавлением разбавленных
щелочей.
Иприты способны проникать в организм любым путем: ингаляционно (в виде
паров и аэрозолей), через неповрежденную кожу, раневую и ожоговую поверхности
(в капельно-жидкой форме), и через рот с зараженной водой и продуктами. Контакт
с веществами не сопровождается неприятными ощущениями (немой контакт). В
организме вещества подвергаются дегалогенированию. При этом возможно
образование промежуточных продуктов (сульфоний-катиона и иммоний-катиона) с
действием которых на молекулы мишени связывают механизм токсического действия
ипритов. Сернистый иприт подвергается окислению с образованием моно- и
ди-сульфоксидов. Только глубокое окисление ведет к потере токсических свойств и
полному разрушению молекулы до кислоты серной, хлористого водорода, углекислого
газа и воды. При хлорировании ипритов в водной и безводной среде их молекулы
разрушаются, что приводит к потере токсических свойств.
Патогенез:
После поступления в кровь иприты быстро распределяются в организме.
Метаболизм идет очень быстро. Поражение ипритами складывается из местного и
резорбтивного действия. Местное действие проявляется в виде эриматозного,
эриматозно-буллезного, язвенно-некротического дерматита.
Резорбтивное действие характеризуется угнетением кроветворения, ЦНС,
нарушением кровообращения, пищеварения, всех видов обмена веществ,
терморегуляции. Подавляется иммунная система, поэтому отмечается наклонность к
присоединению вторичной инфекции.
Анализ клинических особенностей поражений ипритами позволяет произвести
сопоставление с ионизирующими излучениями. Их сходство проявляется в действии
на кровь, на регенеративную способность тканей, в развитии кахексии и
депрессии, угнетении имуннореактивных систем. Поэтому иприты нередко называют
лучевыми ядами. Под влиянием ипритов происходит остановка процессов клеточной
дифференцировки, что именуется цитостатическим действием. Большие дозы ОВ
повреждают хромосомный аппарат ядра клетки, что лежит в основе мутагенеза.
Увеличение дозы и времени контакта иприта с клетками вызывает распад ядра и
разрушение структуры клетки, что называется цитотоксическим действием.
Цитотоксическое действие ипритов объясняется алкилированием пуриновых оснований
нуклеотидов, образованием ковалентных связей с белками, ингибированием ряда
ферментов, активацией перекисных процессов и угнетением антиоксидантной
системы, угнетением обмена цитокинов.
К повреждению клеток при действии ипритов приводят: алкилирование
нуклеиновых кислот, повреждение смежных участков комплементарных нитей ДНК,
препятствующее нормальной репарации, угнетение процесса энергообразования в
клетке, нарушения внутриклеточного обмена кальция и последующая активация
фосфолипаз и гидролаз.
Последовательно происходящие на молекулярно-мембранном уровне
цистостатические, мутагенные и цитотоксические изменения получили название
алкилирующего действия ипритов.
Алкилирование - биохимическая реакция вытеснения атомов водорода из
аминных и сульфгидрильных групп, из аминных и нуклеиновых кислот. Молекула
иприта вытесняет функциональную группу нукдеотида. Одновременно с повреждением
синтеза нуклеиновых кислот происходит нарушение полимеризации аминокислот,
усиливается распад полипептидов, нарушается функциональная активность ферментных
систем. Они ингибируют синтез белка и клеточного деления с образованием
аддуктов нуклеиновых кислот. Ведущим механизмом при интоксикации ипритами
является повреждение структуры полинуклеотидов и нарушение энергетического
обеспечения функций организма. Яды этой группы повреждают пуриновые основания
ДНК и РНК, что приводит к нарушению последовательности нуклеотидов в них,
разрушению полинуклеотидных цепей, образованию сшивок, что, в свою очередь,
ведет к угнетению кроветворения, нарушению иммуногенеза, иммунодепрессии,
угнетению репаративных процессов, появлению генетических дефектов. Иприты
обладают способностью избирательно блокировать альфа- адренорецепторы сосудов,
что ведет к патологическому депонированию крови, уменьшению кровотока в большом
круге кровообращения, падению АД, развитию коллапса. В организме формируется
цепь тяжелых рефлекторных расстройств. С места повреждения исходит афферентная
импульсация, воспринимаемая как чувство боли и нестерпимого зуда, приводящая к
нарушению функций внутренних органов. Развиваются гипоксия, гипотония и другие
изменения, характерные для ипритного шока. Развитие гипотонии углубляется
специфическим действием иприта на альфа- адренорецепторы. Иприты обладают
кожно-нарывным действием, взаимодействуя со структурными белками клеточных
мембран, происходит извращение структуры мембранных белков, что ведет к
нарушению клеточной проницаемости и пузыреобразованию вследствие выпотевания
цитоплазмы под верхний слой кожи.
Таким образом, в формировании ипритных поражений принимают участие такие
механизмы, как местное алкилирующее действие ипритов
(воспалительно-некротическое действие), общее алкилирующее действие
(радиомиметический синдром), рефлекторное и адреноблокирующее действие.
Подводя итог, можно так сформулировать механизм токсического действия
ипритов:
. Алкилирование пуриновых оснований нуклеотидов;
. Образование ковалентных связей с белками;
. Ингибирование ряда ферментов;
. Активация перекисных процессов, угнетение антиоксидантных
систем;
Клиника:
Иприты относятся к веществам кожно-нарывного действия. Токсичные агенты,
вызывающие воспалительно-некротические изменения на путях проникновения в
организм в сочетании с резорбтивным действием, называются кожно-нарывными ОВ.
Иприт проникает через все. Проявления поражения ипритами в зависимости от
пути поступления в организм характеризуются поражением кожных покровов, глаз,
органов дыхания и желудочно-кишечного тракта. Поэтому различают кожную,
глазную, легочную, желудочно-кишечную формы поражения. Поражение кожи протекает
в форме эритематозного, эритематозно-буллезного, язвенно-некротического
дерматита.
Дерматотоксичность - это свойство химических веществ, действуя на
организм немеханическим путем , вызывать повреждение кожных покровов.
Воздействие осуществляется двумя способами:
. Прямым контактом кожных покровов с парообразными, жидкими,
твердыми веществами (фенолы, формальдегид, амины, кислоты, щелочи, металлы);
. Путем резорбтивного действия с развитием системных эффектов.
Поражение кожи: Для поражения кожи парообразным ипритом характерно:
диффузность поражения, преимущественное поражение участков, богатых потовыми и
сальными железами. Наиболее чувствительны к действию ипритов - паховая область,
подмышечные впадины, далее в порядке убывания чувствительности: лицо, ладони,
стопы. Поражение кожи при попадании капель жидкого иприта характеризуется:
глубоким повреждением, вялостью репаративных процессов, присоединением
вторичной инфекции, образованием рубцов в периоде последствий.
Степень поражения кожных покровов при действии ипритов зависит от :
агрегатного состояния токсиканта, продолжительности контакта с веществом,
температуры и влажности воздуха, анатомической области поверхности кожи.
При накожной аппликации иприт проступает в организм через: потовые
железы, сальные железы, волосяные фолликулы, клеточные и соединительно-тканные
элементы кожи.
Различают периоды: скрытый (продолжается от 5 до 15 часов), эриматозный,
поверхностный буллезный (появление пузырьков с белым содержимым вокруг эритемы
- симптом ипритного или жемчужного ожерелья) глубокий буллезный (слияние мелких
пузырьков крупные), язвенно-некротический и рубцевание. По площади заражения
кожи поражение протекает в форме- локального или распространенного
(диффузного), по глубине поражения кожи - поверхностного или глубокого. Хотя
вещества хорошо всасываются через кожные покровы и вызывает их глубокие
поражения, вероятность летальных исходов при данном способе воздействия -
наименьшая.
Поражение глаз: возможно в виде катарального коньюктивита, гнойного
коньюктивита:
Поражение органов дыхания: проявляется в форме назофарингита, ларингита,
трахеобронхита, очаговой пневмонии. Для ингаляционных (легочных) поражений
ипритом резорбтивные явления более характерны. Ингаляционное отравление
является наиболее опасным. Именно при этом способе воздействия весьма вероятны
тяжелые и крайне тяжелые формы поражения со смертельным исходом.
При попадании ипритов внутрь: развивается язвенный стоматит, острый
гастрит и гастроэнтерит. Общая интоксикация проявляется в виде токсической
энцефалопатии, ОСС недостаточности, токсической нефропатии, депрессии
кроветворения. Резорбтивное действие наиболее сильно проявляется у азотистого
иприта. По тяжести общерезорбтивных явлений различают клинические формы:
тяжелая (острая), средняя, легкая. Хроническое поражение азотистым и сернистым
ипритом определяют как кахектическую форму. Сочетанные ипритные поражения
характеризуются проникновением ипритов в организм несколькими путями. При
сочетанных поражениях развиваются: генерализованное поражение кожных покровов,
дыхательных путей, глаз и желудочно-кишечного тракта. Это создает условия для
всасывания ипритов в кровь и развития выраженных резорбтивных изменений.
Клиника резорбтивного действия характеризуется развитием следующих периодов:
скрытый (до суток); токсический шок (1 неделя); радиомиметический (2-3-я
неделя); ипритная кахексия (4-6-я неделя); период исходов, восстановления,
осложнений и последствий (до года и больше). Признаками резорбтивного действия
азотистого иприта являются: шоковое состояние, частые судороги, жидкий стул,
радиомиметический синдром.
Для действия ипритов характерны:
-- вялость течения воспалительных процессов,
-- слабость репаративных механизмов,
-- скудность клеточных реакций, дисбаланс в продукции цитокинов.
Особенности клинической картины поражения ипритами (отличие от люизитного
поражения):
--- «немой» контакт, что объясняется анальгезирующим действием ипритов на
чувствительные нервные окончания (бессимптомность контакта),
--- наличие скрытого периода действия яда: от 2-4 часов при поражении
глаз до 6-12 часов - при поражении органов дыхания и кожи, присоединение
вторичной инфекции,
-- вялое течение репаративных процессов, замедленное заживление;
-- наличие эффекта функциональной кумуляции: пораженные ткани после
заживления становятся повышенночувствительными как к повторным воздействиям
иприта, так и к другим неспецифическим агентам внешней среды. Сенсибилизация к
повторному действию токсикантов, обострение поражений под влиянием
неспецифических агентов внешней среды.
Медицинская помощь при отравлении ипритами
Поскольку иприты проникают в организм через кожные покровы, то
использование защитных костюмов и противогазов является обязательной мерой
профилактики. Для предотвращения местного и общего поражения через кожу
необходима специальная одежда, т.к. через хлоптачобумажную ткань иприт
достаточно легко проникает.
Первая помощь в очаге:
. Предупреждение и устранение местных воспалительно-некротических
изменений - обработка открытых участков кожи рецептурой ИПП (полидегазирующая
жидкость) или 1-15% водно-спиртовыми растворами хлорамина. Обработка глаз водой
из фляги; надевание противогаза.
. Предупреждение и устранение токсического шока - вдыхание
фицилина под маской противогаза
. Предупреждение и устранение радиомиметического синдрома при
ипритных поражениях достигается теми же средствами, что и при поражениях
ионизирующими излучениями. Аминотиоловые соединения - цистамин - 5-6 таблеток,
прессорные амины - мексамин, мезатон. Димекарб 1-2 таблетки (до заражения)
Искусственное вызывание рвоты при попадании ОВ внутрь вне зоны заражения.
Эвакуация из очага.
Доврачебная помощь при выходе из очага заражения:
. Предупреждение и устранение местных воспалительно-некротических
изменений - дополнительная частичная специальная обработка - дополнительно
обработать открытые участки кожи и прилегающее к ним обмундирование или одежду
рецептурой ИПП. При отсутствии ИПП обработку провести 5-15% растворами
хлораминов и дихлораминов, кашицей хлорной извести. Снятие противогаза, При
попадании в глаза капель ОВ - обильно промывать глаза водой или 2% раствором
натрия гидрокарбоната; заложить за веки 30% глазную унитиоловую мазь. Промыть
полости рта и носа водой.
. Предупреждение и устранение токсического шока- при тяжелых
ингаляционных поражениях - вдыхание притоводымной смеси или фицилина; промедол
2% 1 мл в/м; кофеин бензоат натрия 10% 1 мл п/к; ингаляция кислородом. При
гипотонии - в/м 1 мл кордиамина. При пероральном отравлении - беззондовое
промывание желудка, внутрь - 30-50 г активированного угля на 100 мл воды. При
поражении люизитом - ввести в/м 5 мл 5% раствора унитиола.
. Предупреждение и устранение радиомиметического синдрома -
диметкарб 1-2 таблетки (при ингаляционных и кожных поражениях).
Первая врачебная помощь
. Предупреждение и устранение местных воспалительно-некротических
изменений - замена одежды, частичная специальная обработка; влажно-высыхающие
фурацилиновые повязки, сменяемые через каждые 3 часа; повязки с 0,5%
преднизолоновой мазью; повязки с 1-2% раствором хлорамина или противоожоговой
эмульсией. При поражении глаз промывать 2% раствором натрия гидрокарбоната, 0,
25% раствором хлорамина, затем закапывать в глаза 1% раствор атропина сульфата,
1% раствор димедрола и 5% раствор токоферола. Заложить за веко 5% левомицетиновую
глазную мазь. При поражении люизитом - заложить за веко - 30% унитиоловую мазь
- антибиотики; преднизолон внутрь 10 таблеток по 5 мг.
. Предупреждение и устранение токсического шока и
радиомиметического синдрома- обтирание пораженных участков кожи 1% раствором
ментода и димедрола; закапывание в глаза 0,5 % раствора дикаина; вдыхание
фицилина; феназепам в таблетках (при жалобах на боли и зуд); феназепам 3% 1 мл
в/м ( при судорогах); инфузионная терапия при падении артериального давления.
В/в 30% раствор тиосульфата натрия по определенной схеме; 2% раствор нуклеината
натрия в/м 5 мл; димедрол 1 таблетке 2 раза в день; диметкарб по 1 таблетке 2-3
раза в день. В/в ввести рецептуру из равных количеств 30% раствора натрия
тиосульфата и 5% раствора натрия цитрата по определенной схеме. При отравлении
люизитом ввести 5-10 мл 5% раствора унитиола в/м. При пероральном отравлении -
промыть желудок с помощью зонда 0,02% раствором калия перманганата. В/м 1 мл 1%
раствора мезатона, 400-800 мл 5% раствора глюкозы; 200 мл 1% раствора кальция
хлорида в/в. При развитии отека легких - в/в фуросемид, преднизолон или
гидрокартизон, строфантин или коргликон в растворе натрия хлорида. Ингаляция
кислорода с пеногасителем. При нарастающем отеке гортани- в/в преднизолон, кальция
глюконат, раствор димедрола, эуфилина, адреналина. При отсутствии эффекта -
трахеостомия, ингаляция кислорода. Экстренная эвакуация после купирования
токсического отека легких в положении лежа. В пути продолжать противошоковую
терапию. Ингаляцию кислорода.
Квалифицированная и специализированная медицинская помощь
. Предупреждение и устранение местных воспалительно-некротических
изменений - санитарная обработка; при буллезном дерматите отсасывание жидкости
из пузырей. В случае наполнения пузырей - удаление оболочки пузыря и
накладывание влажно-высыхающей повязки. Смазывание эрозий на слизистых
масляными эмульсиями красок ( 1-2% водным раствором бриллиантовой зелени или
метиленовой сини), после подсыхания эрозии накладывают повязку с 5%
синтомициновой мазью. Применение влажно-высыхающих повязок и местных ванн из
1-2% раствора хлорамина, 3% раствора борной кислоты или 0,002% раствора
фурацилина. Язвенно-некротические дерматиты лечат 5% линиментом дибунола, мазью
Вишневского; 1% протарголовой мазью на ланолине. Масляные щелочные ингаляции;
антибиотики по схеме; остальное тоже, что при первой врачебной помощи. Лечение
поражений глаз - за веки 5% синтомициновыя или 30% унитиоловая глазная мазь.
. Предупреждение и устранение токсического шока и
радиомиметического синдрома. Полная санитарная обработка. Предупреждение и
лечение ипритного шока достигается путем ликвидации афферентной импульсации с
места поражения, нормализацией основных процессов в ЦНС, восстановления
нарушенного кровообращения, дыхания и обмена веществ.При поражении люизитом
продолжать антидотную терапию унитиолом по 5 мо 5% раствора в/м, а при тяжелых
поражениях - в/в тоже по определенной схеме. Ускорение удаления всосавшегося
яда в/в введение специальной поляризующей смеси (раствор глюкозы, инсулин,
раствор калия хлорида, магния сульфата и рибоксина), волювена 400 мл реамберина
400 мл, лактосола 400 мл; физиологического раствора до 7 л в сутки, 25%
раствора магния сульфата 10 мл, 10% раствора кальция глюконата 10 мл 3-4 раза в
сутки. Симптоматическая и поддерживающая терапия. В/в 40% раствор глюкозы,
преднизолон, комплекс витаминов. При развитии признаков острой почечной
недостаточности - лазикс в/в до появления мочи. Дополнительно - в/в раствор
эуфилина, раствор никотиновой кислоты и новокаина. При неэффективности ланных
мероприятий - гемодиализ. При нарастающей печеночной недостаточности - витамины
группы В и С, стероидные гормоны, гепатопротекторы, гипербарическая
оксигенация, обменный плазмаферез. При развитии гиперкоагуляции - в/в гепарин,
свежезамороженная плазма, контрикал в растворе натрия хлорида. Для профилактики
инфекционных осложнений - антибиотики . для профилактики осложнений со стороны
желудочно-кишечного тракта - раствор кваматела. При выраженных нарушениях
дыхания - ИВЛ. Противоаритмические средства. как при оказании первой врачебной
помощи, дополнительно- введение эпокрина.
Дегазация для разложения ипритов на местности или различных поверхностях
пригодны любые средства окисляющего или хлорирующего действия, если они сами не
повреждают дегазируемые поверхности. Для дегазации можно использовать растворы
гипохлорита натрия, суспензии или растворы гипохлорита кальция и его солей,
хлорную известь. Металлические и деревянные поверхности могут быть рбработаны
растворами N-хлораминов аренсульфокислот (ДТ-2, ДТ-6) в дихлорэтане, а также
алкоголятов алифатических спиртов, эфиро- или аминоспиртов со щелочными
металлами в различных растворителях. Последние пригодны для дегазации кожи.
1.2 Необразующие аддукты нуклеиновых кислот
Рицин
Яд растительного происхождения, растительный гликопротеид. Обнаружен в
оболочке семян клещевины. Семена - каплевидной формы, мраморной окраски
Клещевина - многолетнее травянистое растение семейства молочайных. Выращивается
как масляничное растение для производства касторового масла. Отравление
возможно при приеме в пищу семян, содержащих алкалоид рицин, смертельной дозой
считается 0,02 г, которая может содержаться в 2-3 семенах. Расчетная
смертельная доза вещества для человека при приеме через рот составляет около
0,3 мг/кг. Жмых, остающийся после отжатия касторового масла, содержит до 3%
рицина. Отходы этого производства могут послужить источником получения яда,
смертельные дозы которого для различных животных составляют от 1 до 100 мкг/кг.
Рицин является наиболее древним представителем группы биологических токсинов.
Рицин мало пригоден для заражения воздуха, но его можно использовать в виде
аэрозолей для снаряжения холодного оружия и огнестрельных боеприпасов. При
ингаляции мелкодисперсного аэрозоля его токсичность значительно выше. Небольшие
повреждения кожных покровов становятся смертельно опасными в случае
проникновения в рану рицина. Через неповрежденную кожу рицин не оказывает
токсического действия.
Очищенный рицин представляет собой белый, не имеющий запаха, легко диспергируемый
в воздухе и растворимый в воде порошок, устойчивый к воздействию температуры.
Вещество мало устойчиво в водных растворах и при хранении постепенно теряет
токсичность.
Патогенез
Вещество легко проникает в организм через легкие, раневые поверхности,
значительно хуже через желудочно-кишечный тракт. Молекула рицина состоит из
двух субъединиц А и В, которые соединены между собой дисульфидной связью.
Субъединицы сами по себе не токсичны, токсическое действие проявляется только
при условии кооперативного действия обеих субъединиц в составе молекулы рицина.
Взаимодействуя с клетками, формирующими альвеолярно-капиллярный барьер и
слизистую оболочку желудочно-кишечного тракта , рицин проникает в поверхность
клеточной мембраны с трансформированием ее цепи. Фиксация рицина на мембране
клеток и его проникновение в клетку осуществляется с помощью В-субъединицы,
которая связывается со специфическим рецептором. После проникновения рицина в
клетку происходит освобождение А-субъединицы, которая и оказывает повреждающее
действие. Связываясь с большой субъединицей рибосомы, А-цепь рицина приводит к
нарушению синтеза белка. Рицин избирательно связывается с углеводными
компонентами поверхности клеточной мембраны, активирует протеолитические
процессы, инициируя разрушение клеточных белков, что приводит к гибели клеток.
Клиника
Симптомы отравления рицином проявляются через 1-3 суток после попадания
яда в организм даже при воздействии дозы, многократно превышающей смертельную,
и строго зависят от пути поступления яда в организм.
Проявление интоксикации складывается из картины местного и резорбтивного
действия, в основе которого лежат цитотоксические и цитостатические эффекты.
Рицин отличает высокая ингаляционная токсичность. При ингаляции рицином
развивается острая пневмония и смерть в течение 36-48 часов от отека легких.
При более легком поражении развивается тяжелое острое воспаление слизистой
оболочки дыхательных путей с перибронхиальным отеком ткани, переходящее в
гнойный трахеобронхит и крайне тяжелую очаговую пневмонию, завершающуюся
некрозом легочной ткани.
Клиническая картина перорального отравления рицином напоминает
интоксикацию (пищевую) и характеризуетя повышением температуры тела, диареей,
развитием дыхательной и почечно-печеночной недостаточности, вплоть до развития
эндотоксического шока. В ряде случаев описаны явления гемолиза и
геморрагического энтерита. При пероральном воздействии превалируют явления
гастроинтестинального синдрома: тошнота, рвота, лихорадка, жажда, сухость в
горле, кровавый понос. Происходит быстрое изъязвление слизистой оболочки
желудка и тонкой кишки с некрозом мезентеральных лимфатических узлов.
При попадании в раны через 12-24 часа у отравленных наблюдается сильный
озноб, повышение температуры тела до 41 градуса С, сильная головная боль и
общая слабость, мидриаз, судороги, резкое падение артериального давления. В
дальнейшем развивается тяжелое поражение печени почек. Общность симптомов
отравления рицином и бактериальной интоксикации обусловлена способностью
лектинов, в том числе и рицина, связываться с рецептором липополисахаридов
(бактериальных эндотоксинов), экспрессируемых макрофагами, посредством которых
инициируется каскад воспалительных реакций при участии эффектов иммунной
системы.
Летальный исход наступает на 2-7 сутки.
При попадании аэрозоля и , особенно, порошкообразного рицина в глаза
развивается воспалительный процесс, переходящий в тяжелый панофтальмит с
последующей гибелью глаза. В легких случаях наблюдаются: конъюнктивит, острый
ринит, хроническое воспаление бронхов.
Лечение
Первая и доврачебная помощь
Надеть противогаз или респиратор при нахождении в зараженной зоне.
Частичная санитарная обработка. Обеспечение адекватного дыхания (санация
носоглотки, установка воздуховода, вентиляция легких через маску с помощью
мешка Амбу). При сохранении сознания - беззондовое промывание желудка 2%
раствором натрия гидрокарбоната, обильное питье, активированный уголь. Для
ослабления местного действия рицина - тщательно промыть глаза, слизистые
оболочки носоглотки и полости рта 4% раствором натрия гидрокарбоната или
физиологическим раствором, или водой. Кожу обработать 2% раствором
формальдегида или 60-70% раствором этилового спирта. Транспортировка в
положении лежа на боку.
Первая врачебная помощь
Устранение острых дыхательных и сердечно-сосудистых расстройств - туалет
полости рта, введение воздуховода и оксигенотерапия. Зондовое промывание
желудка 2% раствором натрия гидрокарбоната, с последующим введением 30-50 г
активированного угля и 30 г солевого слабительного (магния сульфат). Внутрь - обволакивающие
средства - альмагель, коалин. Сифонная клизма, слабительное (30 г магния
сульфата в 500 мл воды). Обильное и частое питье со стимуляцией диуреза
(гипотиазид или фуросемид внутрь). Инфузионная терапия: в/в 400-800 мл 5%
раствора глюкозы. Транспортировка в положении лежа на боку.
Квалифицированная и специализированная медицинская помощь.
При отравлении тяжелой степени - максимально быстрая госпитализация в
отделение анестезиологии и реанимации. Лечение - симптоматическое. Применение
антидотов D-галактозы и брефелдина А (ингибитора транспорта рицина в аппарате
Гольджи). Для предотвращения осаждение гемоглобина в клубочковом аппарате почек
проводят ощелачивание мочи в/в введением 4% раствора натрия гидрокарбоната под
контролем кислотно-основного состояния. При болях в глазах - местно -0,3%
раствор дикаина. Для защиты слизистой оболочки желудочно-кишечного тракта -
перорально - омепразол 40 мг 2 раза в сутки, маалокс-70 по 1 пакету 3 раза в
сутки, угольные сорбенты по 30-50 г/сут. При обезвоживании 1-2 степени -
перорально - регидрон (1 пакет растворить в 1 литре кипяченой воды) 50-100
мл/кг в течение 4-10 часов, а при 3-4 степени - в/в капельно физиологический
раствор или равные его объемы с 5% раствором глюкозы в количестве 1000-1500 мл.
При тяжелых и очень тяжелых формах - в/в капельно раствор «Трисоль»,
реополиглюкин в/в капельно 500 мл. Симптоматическая и поддерживающая терапия.
При развитии острой дыхательной недостаточности - интубация трахеи, ИВЛ. По
показаниям - лечение токсического отека легких.
Оказание помощи при отравлении рицином проводится по общим правилам
лечения острых интоксикаций.
2. Тиоловые яды
К тиоловым ядам относятся вещества, в основе механизма токсического
действия которых лежит способность связываться с сульфгидрильными группами,
входящими в структуру большого количества биологических молекул, среди которых
структурные белки, энзимы, нуклеиновые кислоты, регуляторы биологической
активности и т.д. Рибосомы клеток млекопитающего содержат около 120
сульфгидрильных групп, причем примерно половина из них имеет функциональное
значение для осуществления белкового синтеза. Гормоны полипептидной структуры,
такие как инсулин и глюкагон, также содержат сульфгидрильные группы в молекулах
и т.д.
Образование комплекса токсиканта с SH-группами биомолекул сопровождается их повреждением,
нарушением функции, что и инициирует развитие токсического процесса.
К числу тиоловых ядов, прежде всего, относятся мышьяк (и его органические
и неорганические дериваты, в том числе люизит, какодиловая кислота), ртуть (в
том числе этилмеркурхлорид), цинк, хром, никель, кадмий и их многочисленные
соединения.
Сродство различных тиоловых ядов к разным соединениям, содержащим SH-группы, неодинаково. Неодинакова и
токсикокинетика ядов. Этим объясняются различия токсичности веществ и
особенности формирующегося токсического процесса.
Среди веществ рассматриваемой группы для военной медицины наибольший
интерес представляют соединения мышьяка.
.1 Соединения мышьяка
На основе мышьяка в начале ХХ века были созданы высокотоксичные боевые
отравляющие вещества, запасы которых в настоящее время подлежат уничтожению.
Общая
характеристика
Мышьяк (As) - переходный элемент V группы периодической системы,
металлоид, атомный номер 33, атомная масса 74,9. В природе встречается в виде
минералов: ауропигмент (As2O3), реальгар (As4S4), арсенопирит (FeAsS), примесей к рудам различных металлов. Способен взаимодействовать с
углеродом, водородом, кислородом, хлором, серой и образовывать многочисленные
соединения.
По особенностям строения и биологической активности соединения мышьяка
подразделяют на 3 основные группы:
а) неорганические соединения;
б) органические соединения;
в) арсин (AsH3).
К настоящему времени синтезировано более 6000 неорганических и
органических соединений мышьяка. В группе неорганических соединений выделяют
соединения трехвалентного (As+3 -
арсениты) (триоксид мышьяка, арсенит натрия, трихлорид мышьяка и т.д.) и
пятивалентного (As+5 - арсенаты)
мышьяка (пятиокись мышьяка, мышьяковая кислота и т.д.).
Среди органических соединениях также различают вещества, в которых мышьяк
может находиться в трех- и пятивалентном состоянии. Кроме того, выделяют
алкильные и арильные органические производные этого элемент. К числу наиболее
опасных органических соединений трехвалентного мышьяка относятся хлорсодержащие
алкильные производные - метилдихлоарсин, этилдихлорарсин, дихлорвинилхлорарсин,
трихлорвиниларсин и b-хлорвинилдихлорарсин
- известное боевое отравляющее вещество кожно-нарывного действия (люизит).
Арильные производные трехвалентного мышьяка, представляющие интерес для военной
медицины, это, прежде всего вещества, раздражающие носоглотку, например адамсит
(фенарсазинхлорид) - боевое отравляющее вещество (смотри раздел “ОВТВ
раздражающего действия”).
Представителями группы органических производных пятивалентного мышьяка
являются, в частности, метиларсоновая кислота, диметиларсиновая кислота
(какодиловая кислота). Последнее вещество входило в состав “голубой жидкости”,
применявшейся американскими войсками в период Вьетнамской войны (70-е годы ХХ
века) в качестве фитотоксиканта.
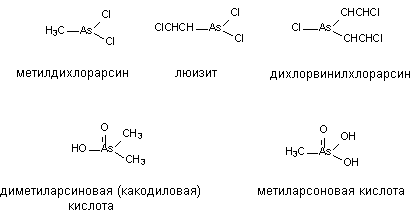
Некоторые представители мышьякорганических соединений
Некоторые соединения мышьяка обладают высокой биологической активностью
при местном и резорбтивном действии на организм. При резорбции наиболее
токсичными являются арсин (AsH3 -
см. раздел “ОВТВ общеядовитого действия”), хлорсодержащие органические
соединения трехвалентного металла (люизит, этилдихлорарсин и др.), а также
неорганические соединения трехвалентного мышьяка (арсенит натрия, триоксид
мышьяка). Менее токсичны неорганические соединения пятивалентного мышьяка
(арсенат натрия, пятиокись мышьяка). Органические соединения пятивалентного
мышьяка (какодиловая кислота, метиларсоновая ксилота и др.) по большей части
относятся к числу малотоксичных соединений.
При местном действии наивысшей активностью обладает люизит - органическое
соединение трехвалентного мышьяка (вызывает воспалительные изменения покровных
тканей) и ароматические производные трехвалентного мышьяка (адамсит -
раздражающее действие на слизистые оболочки глаз и дыхательных путей).
Токсические процессы, развивающиеся в результате острого действия
неорганических соединений мышьяка и металлорганических соединений, имеют
существенные особенности.
Отравляющие вещества, имеющие в структуре арильные производные
трехвалентного мышьяка, относятся к кожно-нарывным ОВ.
.1.1 Неорганические соединения мышьяка
Арсенит натрия (NaAsO2)
Хотя достаточно высокой токсичностью обладают все соединения мышьяка в
качестве диверсионных агентов наибольшую опасность представляют триоксид
мышьяка (As2O3), мышьяковистая кислота (НAsO2) и ее соли, в частности арсенит натрия. Токсичность
неорганических соединений существенно зависит от их способности растворяться в
воде. Так, водорастворимый арсенит натрия примерно в 10 раз более токсичен, чем
хуже растворимый в воде оксид металла.
Арсенит натрия (NaAsO2)
- белый порошок, умеренно растворимый в воде. Достаточно стоек при хранении.
Для людей смертельное количество вещества при приеме через рот составляет 30 -
120 мг. Смертельной дозой для человека может оказаться 200 мг триоксида As
(As2О3).
Токсикокинетика
Около 90% попавшего в желудочно-кишечный тракт вещества абсорбируется. В
виде аэрозоля возможно проникновение арсенита натрия через легкие.
После поступления в кровь вещество довольно быстро перераспределяется в
органы и ткани (в крови неотравленных людей содержание мышьяка находится в
пределах 0,002 - 0,007 мг/л). Наивысшие концентрации металла в тканях
отмечаются через час после внутривенного введения арсенита натрия
экспериментальным животным. Наибольшее его количество определяется в печени,
почках, коже (в последующем в её придатках - ногтях, волосах), легких и
селезенке. Металл проникает через гематоэнцефалический барьер, однако
концентрация его в головном мозге ниже, чем в других органах.
В большинстве органов содержание металла быстро падает (за 48 часов - в
10 - 60 раз). Исключение составляет кожа, где и через двое суток определяется
большое количество мышьяка (до 30% от максимального уровня). Высокое сродство
металла к коже и её придаткам объясняют большим содержанием сульфгидрильных
белков (в частности кератина), с которыми As образует прочный комплекс.
Выделение As осуществляется
главным образом с мочой. Скорость экскреции достаточно высока - в первые сутки
выделяется до 30 - 50% введенного количества, более 80% - в течение 2,5 суток.
Перед экскрецией As подвергается реакции метилирования. Большая его часть
выводится из организма в форме монометиларсоновой и диметиларсиновой кислот.
У лабораторных животных (обезьяны) через 1 - 2 дня после введения
соединений трехвалентного мышьяка в крови обнаруживали менее 1% от введенной
дозы. В этот период уровень металла в цельной крови в 2 - 7 раз выше, чем в
плазме.
В норме мышьяк определяется в моче в количестве 0,01-0,15 мг/л.
Клиника
Острое пероральное отравление мышьяком сопровождается поражением
желудочно-кишечного тракта, нервной системы, сердечно-сосудистой системы,
системы крови, почек, печени.При приеме через рот очень больших доз токсиканта
развивается так называемая “паралитическая форма” отравления. Уже через
несколько минут после воздействия яда появляются тошнота, рвота, боли в животе,
профузный понос. Затем присоединяются болезненные тонические судороги, кожа
приобретает цианотичный оттенок. Через несколько часов возможен смертельный
исход на фоне полной утраты сознания, расслабления мускулатуры тела, глубокого
коллапса.
Чаще острое отравление характеризуется признаками тяжелого гастроэнтерита
с постепенным развитием клиники. Первые симптомы появляются через полчаса - час
после приема яда. Если мышьяк содержится в большом количестве пищи, начало
заболевания может быть еще более отсрочено. Картина развивающегося отравления
напоминает холеру. Основные симптомы поражения: чесночный или металлический
привкус во рту, сухость и жжение слизистой губ и полости рта, сильная жажда,
тошнота, дисфагия, боли в животе, рвота. Если в течение нескольких часов рвота
не прекращается в рвотных массах появляются следы крови. По прошествии нескольких
часов (как правило около суток) присоединяется сильный понос, гематомезис.
Развиваются признаки обезвоживания организма, гиповолемия, падение
артериального давления, нарушение электролитного баланса. Сознание спутано,
состояние напоминает делирий. На ЭКГ регистрируются тахикардия, удлинение
интервала QT, изменение зубца Т, желудочковая
фибрилляция. Количество отделяемой мочи снижается, в моче определяется белок, а
через 2 - 3 суток и кровь. В крови выявляются лейкопения, нормо- и
микроцитарная анемия, тромбоцитопения и т.д. Возможно развитие гемолиза.
Проявления острой несмертельной интоксикации неорганическими соединениями
мышьяка представлены на таблице. Спустя несколько недель после воздействия
мышька иногда развивается отсроченная нейропатия.
Проявления острого отравления мышьяковистокислым натрием
|
Органы и системы
|
Признаки
|
Время появления
|
|
Общие эффекты
|
Жажда
Гиповолемия-гипотензия
|
Минуты Минуты
|
|
ЖКТ
|
Чесночный/металлический
привкус во рту Жжение слизистой Тошнота, рвота Диарея Абдоминальные боли
Гематомезис, мелена Стул в виде рисового отвара
|
Немедленно Немедленно
Минуты Минуты-часы Минуты-часы Часы Часы
|
|
Кровь
|
Гемолиз Гематурия
Лимфопения Панцитопения
|
Часы Дни Недели Недели
|
|
Печень
|
Жировое перерождение
Центролобулярный некроз
|
Дни Дни
|
|
Почки
|
Гематурия, протеинурия
Острая почечная недостаточность
|
Часы-дни Часы-дни
|
|
Нервная система
|
Спутанность сознания,
делирий Энцефалопатия Судороги Сенсомоторная нейропатия
|
Часы Минуты-часы
Минуты-часы Недели
|
.1.2 Галогенированные алифатические арсины
Важнейшими представителями ОВТВ из группы органических производных
мышьяка являются галогенированные алифатические арсины, такие как метил-,
этилдихлорарсины, дихлорвинилхлорарсин и др. По своим токсическим свойствами
эти вещества достаточно близки. Типичным представителем группы является боевое
отравляющее вещество, относимое к группе “кожно-нарывных”, b-хлорвинилдихлорарсин (люизит).
Люизит
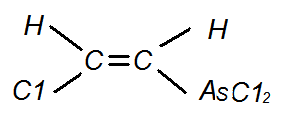
Цис-изомер B-хлорвинилдихлорарсина

Транс-изомер B-хлорвинилдихлорарсина
Люизит синтезирован в 1917 г. американским химиком Льюисом и независимо
от него немецким химиком Виландом.
Физико-химические свойства. Токсичность
Свежеперегнанный люизит - бесцветная, умеренно летучая жидкость; при
хранении через некоторое время приобретает темную окраску с фиолетовым
оттенком. Запах люизита напоминает запах растертых листьев герани. Температура
кипения +196,40С, температура замерзания -44,70С. Относительная плотность паров
люизита по воздуху равна 7,2, пары значительно тяжелее воздуха. Люизит хорошо
растворяется в органических растворителях, в жирах, смазках, впитывается в
резину, лакокрасочные покрытия, пористые материалы. Вещество примерно в 2 раза
тяжелее воды, в которой оно растворяется плохо (не более 0,05%). Растворившийся
в воде люизит довольно быстро гидролизуется образованием хлорвиниларсеноксида,
уступающего по токсичности исходному агенту. Слабые щелочи ускоряют гидролиз.
Люизит легко окисляется всеми окислителями (йодом, перекисью водорода,
хлораминами и т.д.) с образованием малотоксичной хлорвинилмышьяковой кислоты.
Попавший в окружающую среду люизит формирует зоны стойкого химического
заражения. В зависимости от погодных условий вещество сохраняется на местности
от суток (дождливая, теплая погода) до месяца (холодное время года).
Обладает кожно-нарывным и общеядовитым (резорбтивным) действием при любом
пути воздействия на организм.
Местное действие обусловлено легкостью его взаимодействия с белками
кожных покровов и тканей, проявляет выраженное местное раздражающее действие,
на месте аппликации - воспалительно-некротические изменения.
Люизит в парообразном состоянии уже в концентрации 0,002 г/м3 вызывает
раздражение глаз. LCt50 вещества при
ингаляции составляет примерно 1,2 - 1,5 г мин/м3 при действии через кожу -
около 100 г мин/м3. Повреждающая глаз токсодоза паров люизита составляет менее
0,3 г мин/м3, кожи - более 1,5 г мин/м3. При попадании люизита в
желудочно-кишечный тракт смертельная доза для человека составляет 2 - 10 мг/кг.
Благодаря высокой растворимости в липидах люизит сравнительно быстро
всасывается через кожу и слизистые оболочки дыхательных путей и
желудочно-кишечного тракта в кровь и ею разносится по органам и тканям
организма. Вещество легко преодолевает гисто-гематические барьеры, и проникает
внутрь клеток через клеточные мембраны. Стенки сосудов очень чувствительны к
действию соединений мышьяка. Под воздействием люизита усиливается их
проницаемость и в ткани выходит плазма крови вместе с форменными элементами - в
этом проявляется резорбтивное действие люизита.
Спонтанно и при участии ферментативных систем вещество подвергается
гидролизу, окислению, дегалогенированию, даелкилированию. В результате
образуются многочисленные мышьяк-содержащие метаболиты, выделяющиеся из
организма со скоростью выделения неорганических соединений металла (см. выше).
Клиника
Люизит, в отличие от иприта почти не имеет периода скрытого действия.
Признаки поражения ипритом проявляются уже через 2-5 минут после попадания яда
в организм.
Клиника поражения люизитом складывается из местного и резорбтивного
действия яда. Местное действие характеризуется воспалительно-некротическими
изменениями и явлением раздражения тканей на месте аппликации. Резорбтивное
действие проявляется нарушением пластического и энергетического обмена в
органах и тканях, структурными изменениями и гибелью клеток, с которыми
взаимодействует токсикант (сосудистая система, нервная система, паренхиматозные
органы).
Поражение органов дыхания
Люизит в парообразном состоянии и в форме аэрозоля уже в низких концентрациях
оказывает выраженное раздражающее действие на слизистую оболочку верхних
дыхательных путей. Пораженные ощущают першение и царапанье в горле, появляются
чихание, насморк, кашель, слюнотечение, осиплость голоса. Объективно
обнаруживаются гиперемия слизистых оболочек зева, гортани и носа и их
отечность. При прекращении контакта с ОВ все эти проявления интоксикации через
сутки - двое исчезают. В более тяжелых случаях через час - полтора после
воздействия развиваются прогрессирующие воспалительно-некротические изменения
слизистой оболочки трахеи и бронхов. Пораженные ощущают затруднение при
дыхании, появляется кашель, отделяется гнойная мокрота с прожилками крови и
обрывками некротизированной слизистой дыхательных путей. При аускультации
выслушиваются сухие и влажные хрипы. Такая картина острой интоксикации
сохраняется в течение нескольких недель. При действии в концентрациях, близких
к смертельным, люизит вызывает развитие токсического отека легких с характерной
симптоматикой (см. раздел “ОВТВ удушающего действия”). При этом
воспалительно-некротические изменения дыхательных путей носят выраженный
характер. Выздоровление при благоприятном течении наступает только через
полтора - два месяца. Развитие токсического отека легких более вероятно при
интоксикации люизитом, чем ипритом.
Глаза очень чувствительны к люизиту. При действии паров люизита в момент
контакта появляются чувство жжения, боль в области глаз, слезотечение.Легкая
степень поражения органа зрения характеризуется симптомами катарального
конъюнктивита (покраснение конъюнктивы, обильное слезотечение, светобоязнь).
После прекращения действия токсиканта симптомы раздражения довольно быстро
проходят.
При увеличении времени контакта или повышении концентрации паров ОВ
наблюдается поражение средней степени тяжести: симптомы раздражения конъюнктивы
более выражены, наблюдаются отек конъюнктивы и век, развивается стойкий
блефароспазм. В конъюнктиве появляются мелкоточечные кровоизлияния, постепенно
катаральный конъюнктивит переходит в гнойный. Процесс может затянуться на
несколько недель.
Действуя в более высоких концентрациях, яд вызывает развитие поражения
тяжелой формы, при которой в процесс вовлекаются не только веки, конъюнктива,
но и роговая оболочка глаза. В этих случаях, помимо симптомов описанных выше,
через 5-8 ч появляются признаки помутнения роговицы. Через 10-14 дней кератит
проходит, а через 20-30 дней наступает выздоровление.
При попадании в глаза люизита в капельно-жидком виде быстро развиваются
выраженный отек всех тканей глаза, резкая гиперемия конъюнктивы, появляются
кровоизлияния. Затем формируются очаги некроза роговицы. Процессу некротизации,
кроме роговицы, подвергаются слизистая оболочка, подслизистая, клетчатка и
мышцы глаза (панофтальмит). Такое поражение заканчивается потерей глаза.
Поражение кожи
Действуя в капельно-жидком состоянии люизит быстро проникает в толщу кожи
(в течение 3-5 мин). Скрытый период практически отсутствует. Сразу развивается
явление раздражения: ощущаются боль, жжение на месте воздействия. Затем
проявляются воспалительные изменения кожи, выраженность которых определяет
степень тяжести поражения. Поражения кожи протекают в форме
воспалительно-некротических изменений разной степени выраженности. Легкое
поражение характеризуется появлением болезненной эритемы. Поражение средней
степени тяжести приводит к образованию в течение нескольких часов
поверхностного пузыря. Последний быстро вскрывается. Эрозивная поверхность
эпителизируется в течение 1 - 2 недель. Тяжелое поражение - это глубокая,
длительно незаживающая язва.
При поражении кожи парами люизита наблюдается скрытый период
продолжительностью 4-6 ч, за которым следует период формирования разлитой
эритемы прежде всего на открытых участках кожи. Действуя в высоких
концентрациях вещество может вызвать развитие поверхностных пузырей. Заживление
наступает в среднем через 8-15 дней. При защите органов дыхания смертельное
поражение парообразным люизитом практически не возможно.
Сравнительная характеристика поражения кожи люизитом и ипритом
представлена в таблице:
Сравнительно характеристика поражения кожи ипритом и люизитом (в жидком
состоянии)
|
Характер действия ОВ
|
Люизит
|
Иприт
|
|
Растекание капель
|
Значительное
|
Более слабое
|
|
Время всасывания
|
5 мин
|
20-30 мин
|
|
Скрытый период
|
Отсутствует
|
4-6 ч
|
|
Эритема
|
Яркая, имеет четкие границы
со здоровой кожей (появляется через 30 мин)
|
Неяркая (цвет семги), не
имеет четких границ со здоровой кожей
|
|
Отек кожи
|
Резко выражен
|
Не выражен
|
|
Пузыри
|
Через 12-13 ч единичные,
большие
|
Через 24 ч, сначала мелкие
в виде ожерелья
|
|
Язва
|
Дно ярко-красное с
мелкоточечными кровоизлияниями, может захватывать кожу и подлежащие ткани,
глубокая, чистая язва, без гнойного отделяемого.
|
Дно язвы бледное, глубина
язвы меньшая
|
|
Максимум воспалительных
изменений на месте поражения
|
Через 48 ч
|
Через 10-12 дней
|
|
Продолжительность течения
|
2-3 недели
|
6-8 недель
|
|
Пигментация вокруг
поражения
|
Отсутствует (имеется
шелушение)
|
Стойкая
|
Местное поражение люизитом характеризуется обильной экссудацией, отеком
тканей и сосудистыми явлениями (резкая гиперемия и кровоизлияния). При
люизитном воздействии наблюдается более быстрый темп воспалительного процесса с
быстрым его разрешением.
Поражение желудочно-кишечного тракта
Поражение желудочно-кишечного тракта развивается при попадании люизита
внутрь с зараженной водой или продовольствием и проявляется признаками тяжелого
геморрагического гастроэнтерита. Почти сразу после воздействия появляются
слюнотечение, тошнота, обильная и упорная рвота (рвотные массы с запахом
люизита и примесью крови), боли в животе, понос. В эксперименте, отравленные
животные угнетены, отказываются принимать пищу, теряют в весе. Смерть может
наступить в течение 2 - 3 суток после приема токсиканта. При введении в желудок
очень большого количества люизита (несколько смертельных доз) летальный исход наблюдается
в первые часы интоксикации. При вскрытии обнаруживаются
воспалительно-некротические изменения слизистой оболочки, подслизистого слоя по
ходу пищеварительного тракта, глубокие язвы, доходящие до мышечного слоя в
пищеводе или даже серозной оболочки в желудке. При несмертельном отравлении
выздоровление происходит медленно.
Функциональные нарушения деятельности желудочно-кишечного тракта в форме
тошноты, рвоты, поноса наблюдаются также и при иных способах аппликации
вещества (ингаляционном, накожном) и являются проявлениями резорбтивного
действия яда.
Резорбтивное действие
При тяжелых поражениях люизитом, одновременно с местными проявлениями,
независимо от места аппликации, развиваются симптомы, обусловленные
резорбтивным действием яда. Отравленные экспериментальные животные вялы,
отказываются от пищи, рефлексы ослаблены. Состояние угнетения отмечается на
протяжении всего периода интоксикации. Перед смертью животные не реагируют на
раздражители (корнеальный рефлекс сохраняется до наступления смерти).
Люизит, как и другие соединения трехвалентного мышьяка, является, прежде
всего, сосудистым ядом. Наиболее характерно для люизитной интоксикации -
прогрессирующее падение артериального давления, которое у экспериментальных
животных, перед их гибелью может доходить до нулевых значений. Снижение
давления крови наблюдается и в случае более легких поражений, заканчивающихся
выздоровлением. При этом расстройства сердечной деятельности выражены
сравнительно слабо и характеризуются учащением или замедлением частоты сердечных
сокращений.
Люизит вызывает усиление проницаемости сосудов (артериол и капилляров).
Под влиянием токсиканта происходит выход жидкой части крови в серозные полости
и межклеточное пространство тканей. Развивается отек легких, гидроторакс,
гидроперикард и т.д. В более тяжелых случаях нарушение проницаемость сосудов
выражено столь значительно, что это приводит к кровоизлияниям во внутренние
органы (легкие, почки, сердечную мышцу, под эндокард и т.д.), сначала точечным,
а затем и обширным. Происходит сгущение крови, при котором возрастает ее
вязкость. Смерть наступает на высоте сгущения крови.
Уже в ближайшие часы после воздействия в крови увеличивается количество
эритроцитов, гемоглобина; через 4 - 6 часов эти изменения достигают максимума.
В начальном периоде интоксикации развивается лейкоцитоз, который в тяжелых
случаях перерастает в лейкопению. Развитие выраженной лейкопении, лимфо- и
эозинопении рассматривается как плохой прогностический признак. Выраженность
изменений со стороны системы крови зависит от дозы вещества, а также от
интенсивности воспалительного процесса на месте его аппликации.
При затяжном течении отравления снижение массы тела, потеря аппетита и
адинамия свидетельствуют о нарушении обмена веществ. Особенно страдает
углеводный обмен (отмечается повышение содержания сахара, пировиноградной и
молочной кислот в крови). В результате накопления кислых продуктов в крови
наблюдается сдвиг кислотно-основного состояния. Развивается метаболический
ацидоз. Признаком нарушения жирового обмена является гипохолестеринемия. В
более позднем периоде интоксикации (3 - 10 сутки) на первый план выступают
изменения белкового обмена (повышается содержание продуктов распада белка -
общего азота, азота мочевины, в моче и т.д.).
При вскрытии погибших животных выявляются дегенеративные изменения
паренхиматозных органов (жировая дистрофия, некроз паренхимы, перерождение
эпителия). Отчетливо выражены дистрофические изменения нервных клеток различных
отделов ЦНС, солнечного сплетения и т.д. в виде вакуолизации, сморщивания,
пикноза ядер, кариорексиса.
Таким образом, для резорбтивного действия люизита характерными являются
сосудистые расстройства, а также дегенеративные изменения со стороны клеток
нервной системы и паренхиматозных органов.
Патогенез
Люизит обладает избирательным алкилирующим действием. Блокирует
дитиоловые группы биомолекул (аминных и нуклеиновых кислот, ферментов). Отсюда
его название - «тиоловый яд». Основной точкой приложения люизита дитиоловые
ферменты пируватдегидрогеназного комплекса митохондрий, вследствие чего
развивается блокада важнейших звеньев углеводного и энергетического обменов
через окислительное декарбоксилирование пирувата.
Механизм действия люизита (его местное и резорбтивное действие) и его
клиническая картина отравления существенно отличается от механизма действия и
клинической картины отравления ипритами. Радиомиметический синдром (общее
алкилирующее действие) для люизитных поражений не характерен.
Лечение люизитных поражений
. Меркаптопропанол - британский антилюизит БАЛ - выпускается в
ампулах по 1 или 3 мл 10% масляного раствора, вводится в/м.
. Димеркаптопропансульфонат натрия (Унитиол), выпускается в
ампулах и в порошке. Ампулы содержат 5 мл 5% раствора, вводят п/к, в/м, в/в. Из
порошка готовят 100-150 мл 5% раствора для промывания желудка. Для лечения глаз
используют 10% мазь. Для местного лечения люизитных поражений кожи накладывают
повязки с 30% унитиоловой мазью. Унитиол захватывает и выводит свободный и
фиксированный в тканях мышьяк. Унитиол является комплексообразователем, поэтому
способствует выведению токсических и радиоактивных веществ из организма.
. Липоевая кислота - природный антидот мышьяк- и металлосодержащих
ядов. Относится к витаминам группы В. натриевые и этилендиаминовые соли хорошо
растворяются в воде. Выпускается в ампулах и таблетках, содержащих повышенное
количество дозы препарата, Содержимое ампулы растворяют в 250 мл 0,9% раствора
натрия хлорида и вводят в течение 30 минут 1 раз в сутки.
При попадании люизита кожу, удалить ватным тампоном и обработать кожу раствором
из ИПП растворами ДТ-1, аммиаком или перекисью водорода. Кроме этого смотри
раздел «Меропрития медицинской защиты и средства медицинской защиты при
отравлении соединениями мышьяка» и ипритом.
Дегазация
Для дегазации используются те же средства, что и при ипритном заражении:
жидкость противохимических пакетов, вещества, содержащие окислители,
хлорсодержащие жидкости. Применение окислителей для дегазации мышьяк содержащих
соединений на покровных тканях основано на окислении трехвалентного мышьяка в пятивалентный.
.1.3 Галогенированные ароматические арсины
Высокотоксичным представителем группы ароматических арсинов является
фенилдихлорарсин. Это соединение также рассматривали как возможное ОВ
кожно-нарывного действия. Поскольку в структуру токсиканта входит арильный
радикал вещество, помимо свойств, присущих всем галогенированным органически
производным трехвалентного мышьяка (люизиту), обладает сильно выраженным
раздражающим действием. Основные свойства вещества представлены в таблице:
Основные свойства фенилдихлорарсина
|
Молекулярный вес
|
222,91
|
|
Плотность пара (по воздуху)
|
|
Плотность жидкости
|
1,65 (при 250С)
|
|
Температура кипения
|
252-2550С
|
|
Скорость гидролиза
|
Высокая
|
|
Продукты гидролиза
|
НСl и фениларсиноксид
|
|
Стабильность при хранении
|
Стабилен
|
|
Запах
|
Отсутствует
|
|
Средняя концентрация
органолептического определения (раздражение носоглотки)
|
0,0009 г/м3
|
|
Среднесмертельная доза
(ингаляционно)
|
2,6 г мин/м3
|
|
Средненепереносимая доза
(рвотное действие)
|
0,016 г мин/м3
|
|
Средненепереносимая доза
(кожно-нарывное действие)
|
1,8 г мин/м3
|
|
Клинические эффекты
|
Действие на кожу и глаза.
(на глаза - немедленное; на кожу - отсрочено на 30 мин - 1 час) Резорбтивное
действие (см. люизит)
|
Механизм
токсического действия соединений мышьяка
В 1925 году Фегтлиным было высказано предположение, что токсическое
действие соединений трехвалентного мышьяка, сопровождающееся значительным
нарушением функций и гибелью клеток различных органов и тканей, обусловлено их
способностью к взаимодействию с сульфгидрильными группами биологических
молекул. Предпосылкой к этому послужили данные о способности арсенитов
взаимодействовать с сероводородом с образованием сульфидов мышьяка:
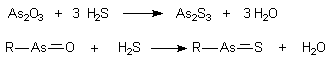
По мнению автора, основным объектом токсического воздействия в клетках
является глутатион, сульфгидрильные группы которого в процессе реакции
блокируются:

Было установлено, что предварительное введение глутатиона защищает
лабораторных животных от арсеноксида и арсенита натрия, вводимых в смертельных
дозах.
Теоретически отравление мышьяком может сопровождаться нарушением
активности всех SH-содержащих
молекул (см. выше). Однако в начале сороковых годов ХХ века Томпсоном и
соавторами было показано, что реакции соединений мышьяка, и в частности
люизита, с тиоловыми группами протекают двояко. При взаимодействии арсенитов с
монотиолами образуются малопрочные, легко гидролизуемые соединения. При
взаимодействии же токсикантов с молекулами, в которых две тиоловые группы
расположены рядом (в положении 1,2, либо - 1,3) образуются прочные, не
поддающиеся гидролизу циклические соединения:
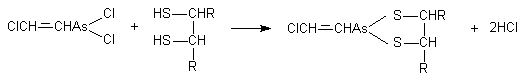
Была высказана гипотеза (Питерс, Томпсон, Стокен), согласно которой
токсическое действие различных соединений мышьяка обусловлено главным образом
их реакцией с молекулами со смежным расположением SH-групп, в результате чего образуются прочные циклические
структуры.
В частности, токсиканты активно связывается с липоевой кислотой,
являющейся коэнзимом пируватоксидазного ферментного комплекса, регулирующего
превращение пировиноградной кислоты (конечного продукта гликолиза) в активную
форму уксусной кислоты (ацетил КоА), утилизируемую циклом Кребса. Происходит
блокада цикла Кребса и энергообразования. В результате в крови и тканях накапливается
пировиноградная кислота, пируват, развивется ацидоз. Блокируется цикл
трикарбоновых кислот - нарушаются процессы энергетического обмена в клетках
действия). различных органов (в этой связи люизит можно рассматривать и как
вещество общеядовитого действия.
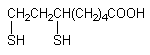 липоевая кислота
липоевая кислота
Взаимодействием мышьяк содержащих веществ с сульфгидрильными группами
можно объяснить и их гипотензивное действие. Так, полагают, что рецепторные
структуры для оксида азота, активного регулятора сосудистого тонуса, включают в
качестве функционально-значимых элементов SH-группы. В основе расслабляющего действия NO на сосуды лежит его способность
образовывать с SH-группами
нестабильные нитрозотиолы (период полусуществования комплекса в организме -
около 3 - 5 секунд):

Падение артериального давления, наблюдаемое при отравлении соединениями
мышьяка, может быть объяснено образованием относительно стойких связей As с SH-группами сосудистых рецепторов оксида азота.
Широкое представительство в организме лигандов с высоким сродством к
мышьяку и их большая роль в поддержании гомеостаза лежат в основе способности
токсикантов действовать практически на все органы и системы, инициируя
различные формы токсических процессов. Этим, в частности, можно объяснить
развитие не только тяжелых воспалительно-некротических изменений в покровных
тканях при непосредственном действии на них токсикантов, но и целый ряд
функциональных нарушений со стороны ЦНС, печени, миокарда и т.д., наблюдаемых
при отравлении соединениями мышьяка.
Способностью взаимодействовать с сульфгидрильными группами молекул и
молекулярных комплексов, регулирующих процессы, лежащие в основе клеточного
деления, можно объяснить и канцерогенное действие соединений мышьяка (по данным
МАИР - мышьяк канцероген для человека).
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
использование индивидуальных технических средств защиты (средства защиты
кожи; средства защиты органов дыхания) в зоне химического заражения;
участие медицинской службы в проведении химической разведки в районе
расположения войск, проведение экспертизы воды и продовольствия на зараженность
ОВТВ;
запрет на использование воды и продовольствия из непроверенных
источников;
обучение личного состава правилам поведения на зараженной местности.
Специальные профилактические медицинские мероприятия:
проведение частичной санитарной обработки (использование ИПП) в зоне
химического заражения;
проведение санитарной обработки пораженных на передовых этапах
медицинской эвакуации.
Специальные лечебные мероприятия:
применение антидотов и средств патогенетической и симптоматической
терапии состояний, угрожающих жизни, здоровью, дееспособности пораженного, в
ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной
(элементы) помощи пострадавшим.
подготовка и проведение эвакуации
Медицинские средства защиты
Средства, применяемые при отравлениях мышьяк содержащими веществами,
представлены препаратами трех групп:
. Препараты для обезвреживания мышьяка, не всосавшегося во внутренние
среды организма, на поверхности кожи, слизистой глаз, в просвете
желудочно-кишечного тракта;
. Лечебные антидоты;
. Средства симптоматической и патогенетической помощи пострадавшим.
Средства для обезвреживания мышьяка на покровных тканях. При попадании
капельно-жидкого ОВ на кожу или одежду в первые 5-10 мин производят частичную
санитарную обработку с помощью содержимого индивидуального противохимического
пакета. Помимо содержимого ИПП, для обезвреживания мышьяка на поверхности кожи
могут быть использованы вещества, которые окисляют, хлорируют или приводят к
гидролизу его соединения. Дегазирующие свойства окислителей основаны на
превращении трехвалентного мышьяка, входящего в состав люизита, в
пятивалентный, и снижении, в связи с этим, токсичности образующихся соединений.
В качестве окислителей могут быть использованы растворы 5% монохлорамина, 5%
марганцовокислого калия в 5% уксусной кислоте, 5-10% раствор йода, 40%
гидропирита (перекис мочевины).
Для ослабления поражений кожи люизитом в виде мази применяют
комплексообраователи из группы дитиолов: 3,5% или 5% мазь
2,3-димеркаптопропанола под названием “дикаптол” или 30% мазь унитиола.
При поражении глаз люизитом необходимо промыть глаз водой либо 0,25%
раствором хлорамина и ввести в коньюнктивальный мешок на 1 - 2 минуты 30% мазь
унитиола (затем глаз опять промыть).
При поражении слизистых оболочек дыхательных путей необходимо провести
обмывание слизистой растворами 0,05% KMnO4, 0,25 - 1% хлорамина.
При попадании соединений мышьяка с зараженной водой или пищей необходимо
обильно промыть желудок и пищевод раствором марганцовокислого калия (0,05%
раствор). После этого следует назначить внутрь 5 мл 5% раствора унитиола.
Специфические противоядия соединений мышьяка
Как уже указывалось, Фегтлин и Розенталь еще в начале ХХ века установили
защитную роль глутатиона против токсического действия арсеноксида и арсенита
натрия. Позже было показано, что защитными свойствами обладают и другие
соединения, содержащие одну сульфгидрильную группу (монотиолы): цистин,
цистеин, ацетилцистеин, тиоэтиленгликоль, тиогликонат натрия, тиомалоновая
кислота и т.д. Однако одновременно отмечалась малая активность монотиолов при
лечении мышьяковых и особенно люизитных отравлений.
Работами Стокена и Томпсона было показано, что существенно повысить
эффективность антидотной терапии можно, используя дитиольные соединения -
вещества, образующие прочные циклические комплексы с мышьяком. Из препаратов
такого типа весьма эффективным оказался 2,3-димеркаптопропанол, синтезированный
в Великобритании в 1941 - 1942 гг и вошедший в медицинскую практику под
названием “Британский антилюизит” (БАЛ). Под влиянием БАЛ скорость выведения
мышьяка из организма отравленных с мочой увеличивается в 5 - 10 раз, особенно в
первый день после воздействия токсиканта. По данным разработчиков
терапевтический эффект БАЛ при отравлении люизитом и другими соединениями
мышьяка обусловлен его способностью реагировать не только со свободными
токсикантами, циркулирующими в крови (химический антагонизм), но и с мышьяком,
который уже успел связаться с сульфгидрильными группами в тканях. Вследствие
этого БАЛ не только предотвращает токсическое действие яда на биомолекулы, но и
восстанавливает их физиологическую активность (биохимический антагонизм):
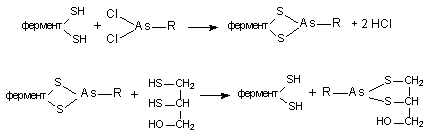
,3-Димеркаптопропанол - бесцветная маслянистая жидкость с запахом
меркаптана. В воде растворяется плохо (менее 6%), хорошо в органических
растворителях. Для практических целей БАЛ рекомендуют применять внутримышечно в
виде 5 - 10% раствора в масле из расчета 2 - 3 мг/кг.
Отдельные свойства 2,3-димеркаптопропанола понижают его ценность, как
средства медицинской защиты. К таковым относятся: высокая токсичность
(смертельная доза для крыс - около 200 мг/кг; непереносимая доза для человека,
вызывающая тошноту, рвоту, головокружение и т.д. - около 5 мг/кг) и плохая
растворимость в воде (и, следовательно, невозможность внутривенного способа
введения). Это дало повод для поиска новых средств.
В настоящее время в литературе имеется описание большого количества
тиоловых соединений, испытанных в качестве антидотов мышьяка. Среди них
дитиоэтиленгликоль, 2,3-димеркаптопропилэтиловый эфир,
2,3-димеркаптопропил-глюкозид, 2,3-димеркаптопропиламин, димеркаптосукцинат и
т.д. Лишь некоторые из них нашли применение в клинической практике.
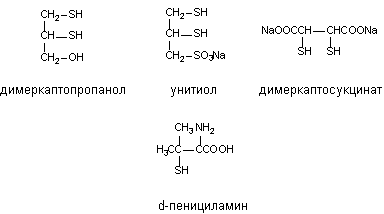
Структура некоторых комплексообразователей из групп ди- и монотиолов
В нашей стране профессором А.И. Черкесом и соавторами был разработан
антидот - 2,3-димеркаптопропансульфонат натрия (унитиол), тоже относящийся к
группе дитиолов, лишенный недостатков БАЛ. Это вещество хорошо растворимо в
воде. Широта терапевтического действия - 1:20. Унитиол, так же как БАЛ,
взаимодействует в крови и тканях отравленного и со свободным люизитом, и с
ядом, уже связавшимся с молекулами-мишненями. Комплекс “люизит-унитиол”,
называемый тиоарсенитом, малотоксичен, хорошо растворим в воде, и легко
выводится из организма с мочой. Под влиянием унитиола у отравленных
нормализуется состояние сердечно-сосудистой системы и системы крови:
восстанавливается уровень кровяного давления, коллапс и сгущение крови, как
правило, не развиваются. Отмечается нормализация биохимических показателей.
Лечебная эффективность антидота в известной мере определяется сроками начала
лечения. Наилучшие результаты наблюдались при введении вещества в течение
первых 0,5 - 1 час после отравления мышьяком. Однако введение унитиола и через
4 - 6 часов после отравления обеспечивает выживание экспериментальных животных,
отравленных абсолютно смертельными дозами яда.
Унитиол выпускается в ампулах по 5 мл 5% водного раствора. Поскольку,
после введения, унитиол определяется в крови в течение лишь 5 часов, при
отравлениях соединениями мышьяка, его вводят подкожно или внутримышечно по
следующей схеме: в 1-е сутки - по 1 ампуле 4-6 раз с интервалом 4-6 ч; во 2-3-и
сутки - по 1 ампуле 2-3 раза с интервалом 8-12 ч; в последующие 4-5-е сутки -
по 1 ампуле в сутки.
Д-пенициламин (группа монотиолов) образует менее прочные комплексы с
металлом, чем дитиолы, но в отличии от последних хорошо всасываются в
желудочно-кишечном тракте и потому может быть назначен через рот.
Необходимо отметить, что применение специфических противоядий (дитиолов)
при отравлениях соединениями мышьяка не всегда устраняет симптомы интоксикации.
Достаточно резистентными оказываются нарушения со стороны ЦНС, обмена веществ
при тяжелых формах отравления, а также в случае применения антидота в поздние
периоды интоксикации. Поэтому при оказании медицинской помощи отравленным
мышьяксодержащими веществами следует широко использовать и симптоматические
средства терапии. Важнейшим направлением оказания помощи является борьба с
развивающейся острой сердечно-сосудистой недостаточностью.
3. Токсичные модификаторы пластического обмена
К числу модификаторов пластического обмена принадлежат
полигалогенированные ароматические углеводороды (ПАУ), среди которых наибольшей
биологической активностью обладают диоксин и диоксиноподобные вещества. По
степени токсичности ПАУ можно выстроить в следующий ряд: дибензо- пара
диоксины-дибензофураны--- бифенилы-нафталены.
-- диоксины (соединения, содержащие различное количество атомов галогена,
два бензольных кольца, два атома кислорода, называются галогенированными
диоксинами):
Диоксин
Например:
,3,7,8 тетрахлордибензо парадиоксин; 2,3,6,7 тетрахлордибензо
парадиоксин.
-- дибензофураны (соединения, содержащие различное количество атомов
галогена, два бензольных кольца, один атом кислорода, называются
галогенированными бензофуранами):
Бензофуран
Например:
,3,7,8 тетрахлор дибензофуран
-- бифенилы (соединения, содержание различное количество атомов галогена,
два бензольных кольца и не содержащие атома кислорода, называются
галогенированными бифенилами):
Бифенил
Например:
,3,4,4 тетрахлор бифенил; 2,3,6,7 тетрахлор бифенил
,3,6,6 - тетрахлорнафтален
Диоксины и диоксиноподобные вещества
Являются продуктами горения, обладающими цитотоксическимдействием.
Механизм образования диоксинов - высокотемпературные процессы хлорирования
органических веществ, пиролитическая переработка и сжигание органических
соединений.
Диоксины обладают наибольшей биологической активностью в классе
полигалогенированных ароматических углеводородов. Являются экотоксикантами. Они
обладают высокой токсичностью, наибольшей биологической активностью, стойкостью
в окружающей среде, способностью к длительной материальной кумуляции в богатых
липидами тканях и прежде всего в жировой, характерным своеобразием клинических
проявлений интоксикации. Диоксины очень медленно выводятся из организма. Период
полувыведения ТХДД из организма человека составляет в среднем - 7 лет.
Особенностью токсикокинетики диоксинов является феномен энтерогепетической
рециркуляции. После поступления в кровь диоксины распределяются во всех органах
и тканях, накапливаясь, как уже было сказано, в жировой ткани. Характерна
большя отсроченность токсических эффектов диоксина. Токсикологические
характеристики диоксинов и диоксиноподобных соединений зависят от положения
атомов хлора в молекуле. Особенно токсичны вещества, содержащие галогены в тех
же местах, что и в молекуле 2,3,7,8 - тетрахлордибензо-парадиоксина ( ТХДД) -
самого токсичного из диоксинов. Семейство диоксинов очень обширное, токсичность
их различна, и человек, сталкиваясь с ними, подвергается воздействию их смесей.
Токсичность смесей оценивается по особым системам, где каждому соединению
присваивается коэффициент токсичности относительно 2,3,7,8- ТХДД, и общая
токсичность смеси выражается в эквивалентном количестве этого соединения (так
называемый «диоксиновый эквивалент»).
Основная опасность диоксинов заключается не столько в острой токсичности,
сколько в кумуляции действия и отдаленных последствиях хронического отравления
в малых дозах.
В настоящее время место лидера полихлорбифенильных соединений занял
диоксин (2,3,6,7 - тетрахлордибензо пара- диоксин):
Это белое кристаллическое вещество, с температурой плавления 305,5
градусов С, температурой кипения 800 градусов С, хорошо растворяется в маслах,
плохо в воде. Среди 10 млн синтезированных химических соединений диоксин -
самое стойкое, его период полураспада - 10 лет. Среди 10 млн химических веществ
диоксин - самое токсичное. Расчетная смертельная доза для человека при
энтеральном введении равна 3,5 мкг/кг, при загрязнении через кожные покровы -
70 мкг/кг. Диоксин обладает сильнейшим эмбриотоксическим и тератогенным
действием.
Патогенез
Механизм действия диоксина связан с наличием в его структуре четырех и
может быть шести алкилирующих групп (четыре атома хлора и две эпоксидные группы
в диоксановом кольце). Возможно «сшивание” молекулы нуклеотида в 4-6 точках.
Диоксин во многом сходен с классическими алкилирующими агентами - сернистым и
азотистым ипритами.
Диоксин - один из самых мощных индукторов микросомальных ферментов. А т.
к. он долго присутствует в организме, наблюдается стойкая индукция
микросомальных энзимов. С этим свойством связывают механизм его токсичесокого
действия. Токсическое действие диоксина связано с длительной оккупацией
цитозольного Аh-рецептора клеток органов -мишеней (печени, кожи и др.), что
сопровождается образованием свободных радикалов, которые активируют перекисное
окисление липидов в мембране клеток и субклеточных образований, приводящих к
нарушению биохимических и физиологических процессов в различных клетках.
Токсическому действию подвергаются: гепатоциты, энтероциты, нервные и
эмбриональные клетки. Это обусловливает многообразный характер токсического
действия диоксина: токсическое поражение печени, кожи, ЦНС, синдром истощения,
угнетения иммунитета и развитие инфекционных осложнений, нарушение
репродуктивной функции, тератогенное и канцерогенное действие. Действие
диоксинов на человека обусловлено их влиянием на рецепторы клеток,
ответственных за работу гормональной системы.
Клиника
Обычно развивается после латентного периода, длящегося 2-3 недели и очень
медленно. Поэтому факт воздействия яда остается незамеченным. Необходимо
организовывать тщательное наблюдение за состоянием здоровья людей. Тяжесть
поражения делится на три степени.
. Легкая степень отравления - головная боль, головокружение,
тошнота, рвота, диарея, конъюнктивит, кашель. Наиболее характерный и
специфический признак - развитие угревой сыпи (хлоракне). Морфологическая
основа хлоракне - сквамозная метаплазия эпителия сальных желез и превращение их
в кератин-содержащие цисты.
. Средняя степень тяжести отравления - усиливаются проявления
общей интоксикации, отмечаются токсические невриты и полиневриты. Появляются
анорексия, боли в области печени, раздражительность, утомляемость, бессонница.
Хлоракне распространяется шире и завершается образованием глубоких рубцов или
червеобразной атрофодермией.
. Тяжелая степень тяжести отравления - вначале преобладают
симптомы общей интоксикации ( истощение, анорексия, общее угнетение, адинамия,
лейкоцитоз). Позднее присоединяются симптомы органоспецифичесокй патологии:
поражение печени, тканей иммунокомпетентных систем, проявления
панцитопенического синдрома и др. Характерным признаком интоксикации являются
отеки. Наблюдаются тяжелые формы поражения кожи. Развивается поздняя кожная
порфирия, сопровождающаяся повышением чувствительности к солнечному излучению,
ранимостью кожных покровов, эритематозными и буллезными высыпаниями на открытых
участках тела (по типу фотодермита) и гиперпигментацией кожи. При исследовании
крови отмечаются анемия и панцитопения. Летальный исход наступает через 2-4
недели.
При не смертельных острых поражениях токсический процесс растягивается на
многие месяцы, а иногда и годы.
Л.А. Федоров систематизировал признаки поражения диоксином следующим
образом:
-- кожные эффекты: хлоракне, гиперкератоз, гиперпигментация, гирсутизм,
эластоз;
-- системные эффекты: фиброз печени, повышение активности трансаминазв
сыворотке крови, гиперхолистеринемия, потеря аппетита, потеря массы тела,
нарушения пищеварения, боли в мышцах, увеличение лимфатических узлов, нарушения
со стороны ССС, выделительной системы, дыхательных путей, поджелудочной железы;
-- неврологические эффекты: половая дисфункция, головная боль,
неврастения, расстройства зрения, изменения вкуса, обоняния, слуха;
-- эффекты в отношении психической сферы: расстройства сна, депрессия.
Потеря активности, нехарактерные приступы гнева.
Таким образом, на основе клинических и экспериментальных данных можно
систематизировать эффекты действия диоксина следующим образом:
эмбриотоксические и тератогенные эффекты; имуннотоксические эффекты;
патологические изменения эпителиальных и эктодермальных тканей (чешуйчатая
метаплазия кератиноцитов, трансформация клеток сальных желез с формированием
«хлоракне», гипоплазия и деформация ногтей, кариозный процесс в зубах;
поражение эпителия желудочно-кишечного тракта); гепатотоксическое действие;
геморрагические проявления; эндокринно-токсические эффекты, нейротропное
действие, канцерогенная активность.
В настоящее время считается доказанным, что диоксины являются прямыми
канцерогенами для человека. Диоксины и диоксиноподобные вещества относятся к
веществам первой группы опасности из-за канцерогенности.
Профилактика и лечение
Учитывая стойкость диоксинов в окружающей среде, необходимо иметь в виду,
что проведение дегазационных мероприятий в зонах химического заражения очень
затруднено. В подобных случаях проводят демонтаж и захоронение технологического
оборудования. Всем членам аварийных бригад выдают 2 комплекта нательного белья
с носками, трикотажные перчатки, брюки, противогазы с аэрозольным фильтром,
пневмокостюмы (типа ЛГ), в которых предусмотрена подача чистого воздуха.
Лечение
Первая помощь
Надевание противогаза с аэрозольным фильтром или изолирующего
противогаза. Удаление пострадавшего из зараженной атмосферы.
Доврачебная помощь
То же, что и выше, ингаляция кислорода. При попадании препаратов,
содержащих диоксин на кожу, необходимо удалить их при помощи марлевого тампона,
не втирая, а затем обработать участок кожи проточной водой в течение 15 минут.
Первая врачебная помощь
Проведение санитарной обработки со сменой белья, обуви и одежды,
многократно промыть глаза и закапать в них несколько капель 2% раствора
адреналина в новокаине. При попадании диоксина в желудок следует вызвать рвоту,
немедленно промыть желудок большим (10-15 л) количеством воды, дать
активированный уголь и затем солевое слабительное. Транспортировка на
дальнейший этап оказания медицинской помощи в фиксированном боковом положении.
Квалифицированная и специализированная медицинская помощь
Лечение с помощью симптоматических и некоторых патогенетических средств с
учетом ведущих симптомокомплексов в специализ ированных лечебных учреждениях.
Профилактика токсической гепатонефропатии: десенсибилизирующие средства,
гормоны, интенсивная витаминотерапия (витамины группы В, аскорбиновая кислота,
никотиновая кислота, фолиевая и липоевая кислоты, витамин А, эссенциале).
Всем членам аварийных бригад, участвующих в ликвидации последствий аварий
с выбросом диоксина и диоксиноподобных соединений выдают 2 комплекта нательного
хлопчатобумажного белья с носками, трикотажные перчатки, хлопчатобумажные
куртки и брюки, костюмы из поливинилхлоридного пластика. Для защиты органов
дыхания могут быть использованы любые противогазы с аэрозольным фильтром.
Костюмы из пластиката рецептур «80/277» и «80/193» отличаются морозостойстью
соответственно до -15 и -25 градусов Цельсия. Изделия из пластиката рецептуры
«80 АМ» армированы капроновой сеткой. В пневмокостюмах типа ЛГ предусмотрена
подача чистого воздуха. Эти костюмы можно дегазировать не снимая с работника.
Комплект «КЗП-1» (куртка, брюки, плащ-халат) на основе пленочных материалов
предназначен для защиты при температуре от -20 до 50 градусов Цельсия. Стирка
хлопчатобумажных изделий осуществляется в мыльном растворе с применением
поверхностно-активных веществ. Средства индивидуальной защиты из пластика по
окончании рабочей смены подлежат очистке путем орошения и протирания 5%
раствором пищевой соды, тщательному ополаскиванию проточной водой и высушивают.
Полихлорированные бифенилы (ПХБ)
Полихлорированные бифенилы (ПХБ) это класс синтетических хлорсодержащих
полициклических соединений.

Структура одного из изомеров полихлорированных бифенилов
Хлор может замещать атомы водорода при любом атоме углерода. На рисунке
представлена структура 3,5,3*,5*-тетрахлорбифенила. Теоретически возможно
существование 209 изомеров вещества.
ПХБ при остром воздействии обладают сравнительно низкой токсичностью.
Сравнительное изучение изомеров показывает, что хлорзамещенные в мета- и
параположении более токсичны.
Средняя смертельная доза колеблется в интервале от 0,5 до 11,3 г/кг в
зависимости от строения изомера и вида экспериментального животного.
ПХБ широко использовались при производстве электрооборудования, в
частности трансформаторов и усилителей, а также в качестве наполнителей при
производстве красителей и пестицидов, смазочных материалов для турбин, для
производства гидравлических систем, текстиля, бумаги, флуоресцентных ламп,
телевизионных приемников и др. Такое широкое использование ПХБ было обусловлено
их невысокой термостойкостью, химической стабильностью, диэлектрическими
свойствами, что позволяло применять вещества для производства изделий, в
которых применение других охлаждающих агентов было сопряжено с высокой
опасностью взрывов или воспламенения.
В 70-е годы в лабораторных и натурных исследованиях была установлена
высокая опасность этих веществ, обусловленная способностью персистировать в
окружающей среде и токсичностью для лабораторных животных. В 1979 году
производство веществ в США было запрещено.
Токсикокинетика
В организм ПХБ могут проникать через кожу, легкие и желудочно-кишечный
тракт. На производстве основной способ поступления веществ - через кожные
покровы, в то время как в повседневной жизни большее количество веществ
поступает в организм с контаминированной пищей.
Попав в кровь, вещества быстро накапливаются в печени и мышцах, откуда,
затем, перераспредляются в жировую ткань. Коэффициент распределения веществ в
мозге : печени : жире составляет в среднем - 1 : 3,5 : 81.
Среднее содержание ПХБ в сыворотке крови людей, проживающих в “чисты”
регионах составляет примерно 7 частей на миллиард, у лиц, профессионально контактирующих
с ПХБ - может достигать 3300.
ПХБ метаболизируют в основном в печени с образованием гидроксилированных
фенольных соединений, через промежуточный продукт - ареноксид. Возможно
дегалогенирование соединений. Скорость метаболизма зависит от структуры изомера
и вида экспериментального животного, на котором изучается процесс. Собаки и
грызуны метаболизируют ПХБ с большей скоростью, чем приматы. Основные пути
выведения: с желчью в содержимое кишечника и через почки с мочой.
Как и диоксины ПХБ являются индукторами Р-450-зависимых оксидаз смешанной
функции в печени, легких и тонком кишечнике. Их введение в организм
сопровождается усилением метаболизма других ксенобиотиков. Индукторная
способность различных изомеров ПХБ неодинакова.
Основные проявления острой интоксикации
Проявления интоксикации ПХБ чрезвычайно напоминают эффекты, развивающиеся
при отравлении диоксинами.
В эксперименте на животных подострые и хронические воздействия приводят к
развитию многообразных эффектов: прогрессивному падению веса, хлоракне,
выпадению волос, отекам, инволюции тимуса и лимфоидной ткани, гепатомегалии,
угнетению костного мозга, нарушению репродуктивных функций. У животных,
подвергшихся воздействию ПХБ в пренатальном, неонатальном и постнатальном
периоде, развиваются неврологические знаки, проявляющиеся, главным образом,
нарушением поведения: склонностью к стереотипным “манежным” движениям, гипер-
или гипоактивности. У взрослых животных нейротоксические свойства веществ не
выявляются.
В действующих дозах вещества вызывают понижение веса иммунокомпетентных
органов, включая селезенку, тимус, лимфатические узлы. Функциональное состояние
иммунной системы не однозначно: при действии высоких доз ПХБ. отмечается
иммуносупрессивное (снижением уровня антител, особенно IgA, IgM),
а малых - активирующее (повышение уровня IgG) действие. Имеются данные об увеличении частоты
инфекционных заболеваний среди животных, подвергшихся воздействию ПХБ.
Получены многочисленные данные, свидетельствующие о мутагенном и
канцерогенном действии ПХБ.
Токсический процесс, вызываемый ПХБ у человека изучен недостаточно.
Наиболее достоверным эффектом является патология кожных покровов, и в
частности, хлоракне (см. “Диоксин”). В некоторых исследованиях выявлена связь
между действием ПХБ и развитием таких общих неблагоприятных эффектов, как
частая головная боль, утомляемость, нервозность.
Механизм
токсического действия полигалогенированных ароматических углеводородов
Токсическое действие полигалогенированных ароматических углеводородов в
настоящее время во многом связывают с их чрезвычайно высокой активностью, как
индукторов ферментов гладкого эндоплазматического ретикулума печени, почек,
легких, кожи и других органов (микросомальных ферментов), участвующих в
метаболизме чужеродных соединений и некоторых эндогенных веществ.
2,3,7,8-тетрахлордибензо-пара-диоксин (ТХДД) является самым сильным из
известных индукторов, в частности, монооксигеназ. Его эффективная доза
составляет 1 мкг/кг массы (в подавляющем большинстве случаев другие
ксенобиотики проявляют свойства индукторов данной группы энзимов, действуя в
значительно больших дозах - более 10 мг/кг).
Индукция активности предполагает синтез дополнительного количества того
или иного энзима (белка) в органах и тканях de novo. Поскольку блокаторы синтеза ДНК (гидроксимочевина)
не препятствуют индукции микросомальных энзимов диоксином и диоксиноподобными
веществами, а ингибиторы синтеза РНК (актиномицин Д) и белка (пуромицин,
циклогексимид) блокируют процесс, делатся вывод, что феномен индукции
реализуется на уровне транскрипции генетической информации клетки.
В соответствие с существующими представлениями механизм действия ПАУ, и в
частности ТХДД, состоит во взаимодействии вещества с цитозольными
белками-регуляторами активности генов, отвечающих за синтез микросомальных
ферментов. В норме, при поступлении ксенобиотиков в организм, а затем и в
клетки (печени, почек и т.д.), они образуют в цитоплазме комплексы с
белками-регуляторами, которые мигрирует в ядро клетки, где, взаимодействуя с
ДНК, вызывают дерепрессию регуляторных генов и, тем самым, активирует синтез
того или иного энзима. В случае ТХДД такой рецепторный цитоплазматический
протеин-регулятор идентифицирован. В частности установлено, что синтез
гидроксилазы ароматических улеводородов (aryl hydrocarbon hydroxylase) в гепатоцитах мышей, чувствительных
к ароматическим углеводородам, регулируется локусом единственного доминантного
гена (обозначается - Ah) и
может быть усилен при проникновении в ядро клетки, образующегося в цитоплазме
комплекса ТХДД с определенным протеином. Этот цитозольный белок-регулятор гена
получил название Ah-рецепторный
протеин.
Индукция, вызываемая полициклическими углеводородами не сопровождается
выраженной пролиферацией гладкого эндоплазматического ретикулума, но
существенно возрастает активность Р-450-зависимых монооксигеназ,
УДФГ-трансферазы, гидроксиолаз и других энзимов.
Поскольку диоксин и диоксиноподобные вещества длительное время
сохраняются в организме, наблюдается стойкая индукция микросомальных энзимов.
При этом существенно изменяется не только скорость, но и характер
биопревращений разнообразных чужеродных веществ, поступающих в организм
(ксенобиотиков) и целого ряда эндогенных (прежде всего липофильных)
биологически активных веществ, метаболизируемых при участии этой группы энзимов.
В частности, существенно модифицируется метаболизм стероидов, порфиринов и
каротиноидов, к числу которых относятся многие гормоны, витамины, коферменты и
структурные элементы клеток.
Стойкая активация диоксином биопревращения некоторых ксенобиотиков, поступающих
в организм с водой, продовольствием, вдыхаемым воздухом, может приводит к
усиленному образованию реактивных промежуточных метаболитов и вторичному
поражению ими различных органов и тканей. Модификация обмена стероидов
(андрогенов, эстрогенов, анаболических стероидов, кортикосероидов, желчных
кислот), порфиринов (простетические группы гемопротеинов, цитохромы, витамин
В12 и т.д.), каротиноидов (витамины группы “А”), как известно, сопровождается
выраженным нарушением обмена веществ. И тот и другой эффект, в сочетании,
проявляются клинической картиной вялотекущего токсического процесса, описание
которого дано выше.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
использование индивидуальных технических средств защиты (средства защиты
кожи; средства защиты органов дыхания) в зоне химического заражения;
участие медицинской службы в проведении химической разведки в районе
расположения войск, экспертиза воды и продовольствия на зараженность ОВТВ;
запрет на использование воды и продовольствия из непроверенных
источников;
обучение личного состава правилам поведения на зараженной местности.
Специальные профилактические медицинские мероприятия:
проведение санитарной обработки пораженных на передовых этапах
медицинской эвакуации.
Специальные лечебные мероприятия:
своевременное выявление пораженных;
подготовка и проведение эвакуации
Медицинские средства защиты
Поскольку клиника острого поражения веществами развивается крайне
замедленно факт воздействия веществами, как правило, остается незамеченным.
Основная задача медицинской службы, в случае появления признаков поражения у
отдельных военнослужащих, сводится к организации тщательного наблюдения за
состоянием здоровья всего личного состава подразделения, выявлению пораженных с
признаками заболевания, снижающими их военно-профессиональную
работоспособность, и их своевременной госпитализации.
Специфические антагонисты (антидоты) токсического действия
полигалогенированных ароматических углеводородов отсутствуют.