Сульфирование и сульфирующие агенты
Введение
Сульфированием в широком смысле этого понятия
называют процессы, приводящие к вхождению в молекулу органического соединения
сульфогруппы -SO3H. В более узком смысле этого слова под сульфированием
понимают процесс замещения атома водорода в органическом соединении
сульфогруппой, осуществляемый путем обработки веществ различными сульфирующими
агентами. При этом образуются сульфокислоты R-SO3H, в которых сульфогруппа
связана с первичным, вторичным или третичным атомом углерода или с каким-нибудь
циклом. К этой категории можно отнести и реакции образования сложных эфиров
серной кислоты R−OSO3H, в которых сульфогруппа связана с атомом углерода
через кислород. Исходными продуктами при сульфировании служат, главным образом,
ароматические и гетероароматические соединения и их производные. Реже
используются вещества алифатического и алициклического ряда. Сульфогруппа может
вводиться в молекулу соединения как с целью придания ему новых свойств, так и с
целью дальнейшей замены сульфогруппы на гидроксил, аминогруппу и т.п.
Наибольшее промышленное применение нашли реакции
сульфирования алкилароматических углеводородов, высших жирных спиртов и α-олефинов.
Сульфопроизводные этих углеводородов служат
исходным сырьем для получения красителей, поверхностно-активных веществ (ПАВ),
синтетических моющих средств и т.д.[1].
Сульфокислоты применяют как дубители и
катализаторы (толуолсульфокислота, контакты Петрова и Твитчела). Сульфированием
сшитых полимеров и сополимеров (особенно стирола с дивинилбензолом) получают
наиболее распространенный тип ионообменных смол (сульфокатиониты), используемых
для извлечения катионов редких металлов, для обессоливания, в качестве
катализаторов и т. д.[2].
1. Сульфирующие агенты
Выбор сульфирующего агента не может быть
произвольным, а должен быть для каждого отдельного случая обоснован с учетом
получения максимального выхода желаемого продукта и минимального количества
отработанной кислоты. В качестве сульфирующих агентов используют
концентрированную серную кислоту(концентрированная серная кислота 92 - 94 % H2SO4
− купоросное масло или моногидрат - 98 - 100 % H2SO4);
олеум с содержанием SO3 от 10 до 12 %, хлорсульфоновую кислоту ClSO3H,
сульфирующий комплекс (хлорсульфоновая кислота - мочевина - формамид),
сульфаминовую кислоту NH2SO3H; пиридинсульфотриоксид С5Н5N∙SO3,
диоксансульфотриоксид С4Н8О2∙SO3,
триоксид серы (наиболее широко стал применяться в последнее время) [1].
Как сульфирующий агент серная кислота обладает
невысокой активностью, поэтому сульфирование проводят при повышенной температуре
(от 80 до 100 °С и более). Реакционная масса состоит из двух фаз, причем сама
химическая реакция протекает в кислотной фазе и уже при небольшом перемешивании
лимитируется скоростью химического превращения без существенного влияния
диффузионных факторов.
Необходимо учитывать, что концентрированная H2SO4
является довольно сильным окислителем, особенно при нагревании. Сама
концентрированная H2SO4 не способна сульфировать
органические соединения. Это, в частности, доказывается тем, что при добавлении
сульфата натрия к серной кислоте скорость сульфирования резко падает и при
увеличении концентрации сульфата процесс останавливается, так как всякая
диссоциация H2SO4 подавляется и сульфирующие частицы образоваться не могут.
В связи с рассмотрением вопроса о механизме
сульфирования необходимо обсудить строение и основные свойства, как серной
кислоты, так и олеума.
Безводная серная кислота при комнатной
температуре представляет собой в сильной мере ассоциированное соединение с
длинными образованными за счет водородных связей, цепевидными молекулами:
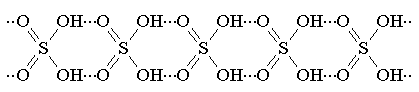
При повышении температуры эти цепочки
разрушаются.
Жидкая 100 %-ая серная кислота (tпл = 10,4 °С)
является ионизирующим растворителем, однако, ее собственная ионизация незначительна
и, в первом приближении, соответствует уравнению:

Безводная серная кислота кипит с разложением до
образования азеотропной смеси состава 98,3 % H2SO4 и 1,7
% Н2О (tкип = 338,8°С). Серная кислота смешивается
с водой и SO3 в любых соотношениях. В водных растворах она полностью
диссоциирована:
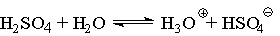
С водой серная кислота образует гидраты с
характерными температурами плавления: H2SO4×Н2О
(tпл = +8,5 °С), H2SO4 2Н2О
(tпл = -39
°С),
H2SO4×4Н2О
(tпл = -28
°С).
При растворении SO3 в
концентрированной серной кислоте образуется целая серия полимерных кислот:
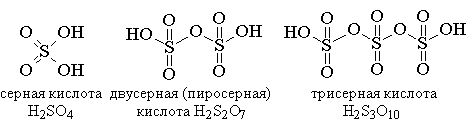
и т.д.
Концентрация серной кислоты оказывает решающее
влияние на ход процесса сульфирования. Чем выше концентрация исходной кислоты,
тем меньше ее понадобится для проведения процесса. Однако следует иметь в виду,
что повышение концентрации сульфирующего агента может привести к нежелательным
побочным эффектам (образование полисульфокислот, сульфонов, окисление
реакционной массы и т.д.).
Одним из основных недостатков сульфирования
серной кислотой является необходимость использования избытка сульфирующего
агента, что, в свою очередь, приводит к необходимости затраты больших количеств
нейтрализующих средств на стадии выделения продукта, технологическому
усложнению этой стадии и образованию большого количества отходов производства.
В значительной мере устранить эти недостатки можно либо оптимизацией процесса,
либо удалением образующейся воды из реакционной массы.
От выбора концентрации сульфирующего агента
зависит также место вхождения сульфогруппы в ароматическое ядро. Например, для
получения a-нафталинсульфокислоты, рационально применять
более концентрированную кислоту, чтобы предотвратить ее десульфирование. При
получении b-нафталинсульфокислоты следует брать серную
кислоту несколько меньшей концентрации, чтобы способствовать гидролизу
побочного a-изомера (b-изомер в этих
условиях не десульфируется). Олеум и серную кислоту нестандартных концентраций
готовят путем смешения стандартного сырья в необходимых пропорциях. При этом
необходимо учитывать тепловой эффект процесса смешения. Процесс приготовления
кислоты нужной концентрации следует вести так, чтобы температура в массе не
превышала 55 ± 5 °С, так как при более высокой
температуре усиливается коррозия, а при смешении олеума происходит также
испарение серного ангидрида.
Одним из способов устранения недостатка процесса
сульфирования (накопление в производстве значительных количеств отработанной
кислоты) является применение для сульфирования не серной кислоты, а серного
ангидрида как такового или в виде соединений, которые могут его выделять. При
использование в качестве сульфирующего агента серного ангидрида, вода не
образуется:

Серный ангидрид является очень энергичным
сульфирующим агентом, пригодным для сульфирования малоактивных соединений.
Недостатком этого сульфирующего агента является возможность протекания побочных
реакций (окисление, образование сульфонов и др.). Кроме того, сульфирование
серным ангидридом, особенно в отсутствие жидкого разбавителя, технологически
сложно. По мере образования сульфокислоты реакционная масса загустевает,
затрудняется отвод тепла, создаются местные перегревы, резко ухудшается контакт
серного ангидрида с субстратом. Если повышение температуры нежелательно или не
приводит к снижению вязкости реакционной массы, процесс рекомендуется проводить
в две стадии. Сначала сульфируют парами серного ангидрида до загустевания
реакционной массы (обычно до глубины превращения 75 ± 5 %), а затем завершают
реакцию действием олеума. Это позволяет снизить расход сульфирующих агентов (в
пересчете на SO3) почти вдвое по сравнению с сульфированием олеумом в одну
стадию.
Серный ангидрид может поступать на предприятие в
жидком стабилизированном виде в баллонах под давлением либо получаться
непосредственно на предприятии обжигом пирита и последующим каталитическим
окислением SO2 в SO3. Последний способ практикуется на
производствах большой мощности, например, на заводах по синтезу
поверхностно-активных веществ (ПАВ) сульфированием (сульфатированием) первичных
спиртов, олефинов, алкилбензолов и т.п.
Перспективным является использование растворов
серного ангидрида в сернистом ангидриде. Сульфирование ведут в жидком сернистом
ангидриде при температуре его кипения (минус 10 °С). Отвод
тепла осуществляется за счет испарения растворителя. Ароматические соединения,
как правило, хорошо растворяются в диоксиде серы, а потому реакция протекает в
гомогенной среде. Избыток серного ангидрида составляет обычно не более 5%.
Другим способом является использование растворов
SO3 в неводных инертных растворителях − дихлорэтане или
метиленхлориде. Использование этого метода позволило, например, почти вдвое
увеличить выход a-нафталинсульфокислоты и
1,5-нафталиндисульфокислоты, используемой в синтезе диазолина:
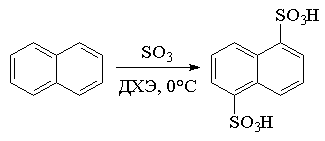
При сульфировании малоактивных субстратов
используют олеум (обычно 25 %-ный или 65 %-ный).
Смесь H2SO4, H2S2O7, H2S3O10, H2S4O13 -
густая маслянистая, дымящая на воздухе жидкость, - называется
олеумом. Пары над олеумом состоят главным образом из SO3, а в парах над серной
кислотой SO3 почти нет. При использовании олеума и свободного триоксида серы, в
отличие от сульфирования серной кислотой протекает значительное число побочных
реакций. Высокая активность этих агентов делает возможным вступление в
ароматическое ядро второй сульфогруппы по типичной схеме последовательных
превращений [2]:
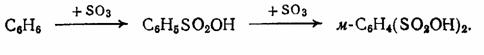
На примере сульфирования додецилбензолов (сырье
для производства моющих веществ) можно показать влияние сульфирующего агента на
теплоту реакции таблица 1 [1].
Таблица 1 - Влияние сульфирующего агента на
теплоту реакции.
|
Сульфирующий
агент
|
Теплота
реакции, кДж/кг
|
|
SO3
(пар)
|
2124,0
|
|
SO3
(жидкость)
|
1600,6
|
|
Олеум
(20 % SO3)
|
1265,4
|
|
H2SO4
(98 %-ная)
|
1005,6
|
Для замещения галоида или группы −NO2
на сульфогруппу используют сульфиты щелочных металлов:
С2Н5Br
+ Na2SO3 → C2H5 -SO3Na
+ NaBr или
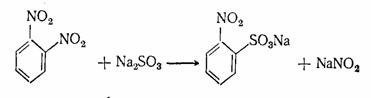
Для получения сульфокислот аминоантрахинов также
часто применяют сульфиты [3].
2. Теоретические основы процесса
.1 Химия, механизмы, термодинамическе факторы
Сульфирование начинается обычно как гетерогенный
процесс. Спустя непродолжительное время после начала реакции масса
гомогенизируется, и основное время процесс протекает как гомогенный.
Тепловой эффект сульфирования (образуются связи
С−SO3H) также зависит от природы агента сульфирования,
сульфируемого соединения и условий, определяющих исходное и конечное состояние
реагентов. Для оценки теплового эффекта в качестве эталона используют тепловой
эффект сульфирования исследуемого соединения в паровой фазе серным ангидридом.
Реакции сульфирования протекают с выделением
тепла за счет разбавления кислоты образующейся водой. Теплота реакции зависит
от природы сульфирующего агента и сульфируемого соединения. Обычно для оценки
теплоты реакции в качестве эталона используют теплоту сульфирования
исследуемого соединения в паровой фазе триоксидом серы.
Тепловой эффект сульфирования серной кислотой
относительно невелик, так как он является суммой экзотермического эффекта
взаимодействия SO3 с субстратом и эндотермического эффекта
диссоциации H2SO4 с образованием SO3. Тепловой
эффект сульфирования серным ангидридом (олеумом) высок и составляет около 200
кДж/моль.
Большую часть промышленных процессов
осуществляют без катализаторов, но известен ряд реакций сульфирования, где
катализаторы используют (например, при сульфировании аитрахинона применяют
сульфат ртути). В качестве катализаторов можно использовать также медь, натрий,
бихромат калия, ванадат аммония, иод, которые избирательно изменяют или общую
скорость реакции, или скорость образования какого-либо изомера.
Сульфирование серной кислотой является обратимой
реакцией. (Следует отметить, что в отсутствие воды обратимость практически не
проявляется, так как константы скорости обратных реакций на пять порядков ниже
констант скоростей реакций, ведущих к образованию целевых продуктов).
Равновесие реакции при обычных условиях сдвинуто
вправо, но при повышенной температуре и одновременной отгонке углеводорода
иногда проводят обратный процесс, используемый для разделения изомерных
алкилбензолов. Гидролиз (десульфирование) является кислотно-каталитической
реакцией. Скорость ее возрастает с увеличением концентрации кислоты.
Установлено, что при повышении температуры на десять градусов цельсия скорость
гидролиза возрастает от 2,5 до 3,5 раза. Скорость десульфирования зависит также
от природы заместителя в молекуле алкилсульфокислот. Опытным путем установлено,
что чем легче образуется сульфокислота, тем легче она десульфируется.
Изменение температуры сказывается также и на
характере образующихся продуктов. Так, при сульфировании фенола серной кислотой
при комнатной температуре образуется преимущественно орто-изомер, а при 100 °С
− пара-изомер. При обработке фенола, взятого в избытке, купоросным
маслом при 180 °С получают
4,4/-дигидроксифенилсульфон:
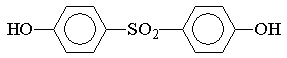
образование которого объясняют электрофильной
атакой ArSO2Å исходного субстрата. При
сульфировании хлорбензола моногидратом при 90 ±10 °С
образуется практически только п-хлорбензолсульфокислота.
В зависимости от активности субстрата и
желательного направления реакции температура ведения процесса может колебаться
от минус 10 °С до плюс 180 °С. В связи с
этим процесс может идти в одних случаях с нагревом, а в других - с охлаждением
реакционной массы.
Поскольку процесс сульфирования описывается
рядом параллельных и последовательных реакций, максимальный выход целевого
продукта может быть достигнут не только при определенной температуре,
соотношении реагентов, концентрации серной кислоты, но и при определенной
продолжительности ведения процесса.
Основными побочными продуктами сульфирования
являются сульфоны
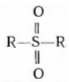
полисульфоновые кислоты, продукты окисления
(оксипроизводные и другие кислородсодержащие соединения), деалкилирования и
изомеризации. Количество и состав побочных продуктов зависит от условий
проведения процесса. Например, при прямом сульфировании бензола триоксидом серы
образуется около 30 % дифенилсульфона; при использовании жидкого диоксида серы
- всего от одного до пяти процентов.
Сульфирование относиться к типичным реакциям
электрофильного замещения в ароматическое ядро. Реакция тормозится водой,
находившейся в исходной кислоте и образующейся при сульфировании, причем
скорость реакции часто описывается уравнением: r = k[ArH] / [H2O]n.
Скорость образования сульфонов различных
производных бензола уменьшается в ряду: бензол > толуол > о-ксилол >
додецилбензол; она уменьшается также в присутствии сульфата или
бензолсульфоната натрия [1].
Реакции ароматических соединений с олеумом
протекают в две стадии. Первая состоит в превращении избыточного триоксида
серы:
Эта реакция необратима и высокоэкзотермична, ее
тепловой эффект зависит от концентрации олеума, составляя 180 кДж/моль для 20
%-го олеума. Во второй стадии в сульфировании начинает принимать участие серная
кислота.
Сульфирование свободным триоксидом серы
+ SO3 → ArSO2OH
также протекает необратимо и относится к одной
из самых экзотермичных реакций органического синтеза.
Механизм первой стадии сульфирования
ароматических углеводородов олеумом и их реакций со свободным триоксидом серы
состоит в электрофильной атаке углеводорода молекулой SO3 через промежуточные π
и σ-комплексы:

Реакция имеет первый порядок по ArH и SO3 и
протекает практически моментально. Вследствие этого при гетерофазном процессе
скорость зависит от диффузионных факторов и в значительной степени от
интенсивности перемешивания и отвода большого количества выделяющегося тепла.
При сульфировании олеумом и триоксидом серы
образуется некоторое количество сульфонов. Другая побочная реакция состоит в
образовании ангидридов сульфокислот, выход которых растет при избытке SO3:
ArSO2OH + SO3 → (ArSO2)2O + H2SO4
При действии небольшого количества воды можно
превратить ангидриды в целевые сульфокислоты. Эти побочные реакции и деструкцию
алкильных групп под действием SO3 ограничивают оптимальным соотношением
реагентов, способом их смешения и главным образом температурой, которая при
сульфировании олеумом и SO3, обычно изменяется от минус 10 до 50 ± 10 °С [2].
.2 Кинетика процесса сульфирования
Скорость процесса сульфирования, глубина, состав
и выход продуктов зависят от структуры исходного соединения, условий проведения
процесса и сульфирующего агента.
Качественно было установлено, что при обработке
алканов концентрированной серной кислотой скорость дегидрирования и
изомеризации (в особенности алканов с третичными атомами водорода)
увеличивается с ростом температуры и может превысить скорость других реакций.
При обработке алканов SO3 порядо образования
скоростей алкилсульфокислот, сульфонов, алкильных сложных эфиров серной
кислоты, ангидридов сульфоновых кислот и т. д. приблизительно одинаков.
Кинетика взаимодействия алканов с SO2 в
присутствии кислорода и промоторов или в присутствии кислорода, промоторов и
воды изучена недостаточно. Более подробно изучена кинетика сульфирования
ароматических соединений.
Реакции сульфирования серным ангидридом
ароматических соединений имеют второй порядок по отношению к SO3 и первый - по
отношению к сульфируемому ароматическому соединению.
Энергия активации реакции сульфирования
трехокисью серы составляет около 4,8 ккал/моль для бензола и 11,4 ккал/моль для
нитробензола. Для реакций, аналогичных реакциям сульфирования олеумом
п-нитротолуола, были установлены кинетические соотношения пер вого порядка по
отношению к SO3 и ароматическому соединению. Энергия активации их составляет от
14 до 18 ккал/моль. Скорость сульфирования п-нитротолуола серной кислотой
(моногидратом) примерно в 100 раз меньше скорости сульфирования его олеумом,
содержащим 2,4 % SO3.
Константа скорости реакции уменьшается с
уменьшением концентрации Н2SO4. Это связано с изменением соотношения различных
молекулярных групп (SO3, S2O6, Н2SO4, НSO4−, Н3SO4+, S+O3Н и т. д.),
которые могут существовать в системе при различных концентрациях кислоты.
Скорость сульфирования 92 %-ной серной кислотой
обратно пропорциональна квадратному корню из содержания воды в системе. Условно
принято считать, что если серная кислота содержит воду, то простейшей частицей
при сульфировании является все та же трехокись серы.
Критерием качественной оценки скорости
сульфирования углеродов с различной структурой служит величина минимальной
концентрации (π) Н2SO4, при
которой становится заметной скорость реакции. Но применять этот параметр в
качестве критерия оценки относительных скоростей сульфирования неудобно, так
как он зависит от многих факторов (эффективность контактирования, соотношения
реагентов и т. д.).
Были, однако, определены константы скоростей и
энергии активации реакций сульфирования некоторых ароматических соединений
серной кислотой - моногидратом (тадлица 2) и серным ангидридом (таблица 3).
Таблица 2 - Константы скорости и энергии
активации сульфирования некоторых соединений серной кислотой (моногидратом)
|
Соединение
|
k∙106
(40 °С), 1/(моль ∙с−1)
|
Энергия
активации (Е), ккал/моль
|
|
Бензол
|
15,50
|
7,50
|
|
Толуол
|
78,70
|
6,70
|
|
м-Ксилол
|
116,70
|
6,40
|
|
Нафталин
|
141,30
|
6,10
|
|
Хлорбензол
|
10,60
|
8,90
|
|
n-Хлортолуол
|
17,10
|
7,40
|
|
Нитробензол
|
0,24
|
11,06
|
|
n-Нитротолуол
|
3,30
|
9,77
|
Таблица 3 - Константы скорости и энергии
активации сульфирования некоторых соединений серным ангидридом
|
Соединение
|
k
(40 °С), 1/(моль ∙с−1)
|
Энергия
активации (Е), ккал/моль
|
|
Бензол
|
48,8
|
4,80
|
|
Хлорбензол
|
2,4
|
7,72
|
|
Нитробензол
|
7,8
∙10 −6
|
11,40
|
|
n-Нитротолуол
|
9,5
∙10 −6
|
11,02
|
Скорость сульфирования полициклических углеводородов
намного больше, чем моноциклических; в результате реакции образуются
полисульфопроизводные, даже при небольшй общей степени конверсии в продукты
сульфирования.
Вообще ароматические соединения с двумя
заместителями в мета-положении один по отношению к другому сульфируются с
большими скоростями, чем с заместителями в пара-положении. Скорости замещения
на сульфогруппу в орто-, мета- и пара-положениях по-разному зависит от
температуры, поэтому состав продуктов реакции при различных температурах неодинаков
[3].
.3 Сульфирование парафинов и олефинов
Парафины нормального строения и циклопарафины
(содержащие более пяти атомов углерода в цикле) практически не реагируют с
концентрированной серной кислотой даже при нагревании. В случае изопарафинов
происходит разрыв цепи, в результате чего кроме других продуктов образуется
небольшое количество сульфокилот. При использовании концентрированной серной
кислоты с содержанием более 20% SO3 можно получить сульфокислоты из
н-парафинов, но с невысоким выходом. В этом случае одновременно протекают
реакции окисления с образованием SO2, а в случае шестичленных
циклопарафинов идет дегидрирование с образованием ароматических сульфокислот.
Поэтому в промышленности для получения алкилсульфокислот используют другие
методы: сульфоокисление и сульфохлорирование.
В отличие от парафинов олефины значительно легче
повергаются сульфированию. Производные продукты сульфирования олефинов служат
исходным сырьем для получения ПАВ.
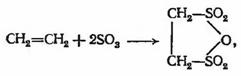
который гидролизуется сначала в этионовую, а
затем в изоэтионовую кислоту:
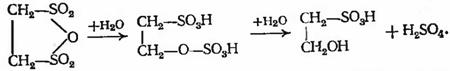
Изоэтионовая кислота служит исходным продуктом
для производства ПАВ - игепона А и игепона Т.
Высшие олефины с концевой двойной связью также
образуют карбилсульфаты, если действовать на них комплексным соединением
триоксида серы с диоксаном. Триоксид серы дает с диоксаном продукты
присоединения следующего состава:
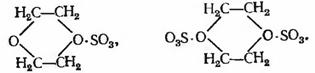
Оба эти соединения являются весьма активными
сульфирующими агентами, с которыми олефины реагируют следующим образом:

При гидролизе образующихся сульфатов получают β-оксиалкилсульфокислоты:
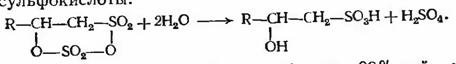
При сульфировании высших α-олефинов
98%-ной серной кислотой получают (при последующей нейтрализации) вторичные
алкилсульфаты - исходное сырье для производства СМС. Процесс идет по следующим
основным уравнениям:
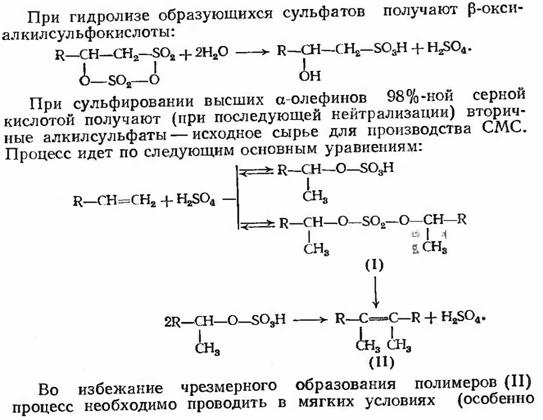
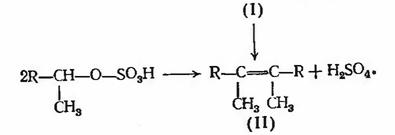
Во избежании чрезмерного образования полимеров
(II) процесс необходимо проводить в мягких условиях (особенно в отношении
температуры, концентрации серной кислоты и продолжительности реакции). Обычно
сульфирование проводят при температуре от плюс 5 до минус 15 °С (в зависимости
от температуры плавления исходного углеводорода), в растворителе - н-пентане
(соотношение пентан: олефин равно 1 : 1) при мольном соотношении Н2SO4:
олефин равное 1,5: 1,0. Равновесная смесь всегда содержит от 15 до 20 %
диалкилсульфатов (I) [1].
В промышленности нашел применение способ
сульфироваания олефинов парами SO3, разбавленными воздухом. Этим
путем получают новый тип ПАВ - α-алкенсульфонаты.
Их синтезируют из SO3 и α-олефинов,
получаемых термичееским крекингом парафина или алюминийорганическим синтезом.
Положительное свойство α-алкенсульфонатов
состоит в их способности давать хорошие моющие композиции (порошковые) даже с
небольшими добавками фосфатов или вообще без них. Это очень важно для охраны
природы, поскольку фосфаты вызывают усиленный рост подводных растений и
заиливание водоемов [2].
.4 Сульфирование ароматических углеводородов
Ароматические углеводороды и их производные
можно сульфировать 65 %-ной серной кислотой, олеумом или другими сульфирующими
агентами в относительно мягких условиях. Эта реакция являлась одной из первых
среди промышленно реализованных методов органического синтеза. Таким образом,
до сих пор получают фенолы (β-нафтол,
резорцин, крезолы), для чего соли сульфокислот подвергают щелочному плавлению
[2]:
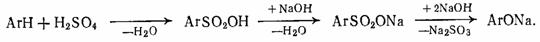
Бензол сульфируют 98 %-ной серной кислотой при
температуре 90 ± 10 °С, полученную бензолсульфокислоту можно сульфировать
дальше при 225 ± 25 °С. Вторая сульфогруппа присоединяется в метаположение по
отношению к первой, и образуется м-бензодисульфокислота. Последнюю сульфируют
при более высокой температуре (300 °С), получая 1,3,5-бензотрисульфокислоту
(выход ее небольшой, так как в этом случае процесс уже сопровождается
разложением). Последовательность реакций можно представить следующим образом:
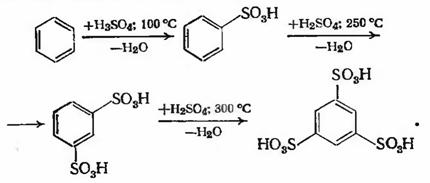
Методы сульфирования бензола:
непрерывный метод: жидкий бензол пропускают
через серную кислоту (противотоком), образующаяся бензолсульфокислота
растворима в бензоле и вымывается из бензольного слоя водой;
сульфирование бензола слабым олеумом при
температуре от 190 до 250 °С и давлении от одного до трех МПа, образование
сульфонов может быть подавлено добавлением бензолсульфоната натрия. В качестве
сульфирующего агента для получения бензолсульфокислоты используют также 100
%-ный триоксид серы;
жидкофазное сульфирование бензола осуществляют
действием двукратного количества моногидрата в периодически действующих
сульфаторах при температуре 60 °С в начале процесса и 105 °С в конце процесса;
сульфирование бензола в «парах».
При сульфировании толуола серной кислотой при
100 °С образуется смесь о-, п- и м-толуолсульфокислот:
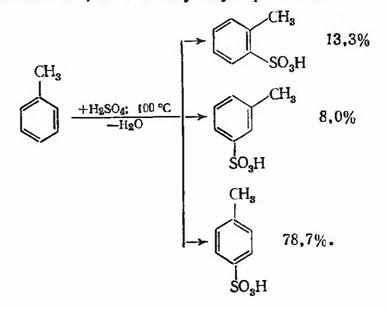
Соотношение этих изомеров зависит от
температуры. Если в качестве сульфирующего агента используют хлорсульфоновую
кислоту при низкой температуре (0 °С), то получают смесь, содержащую до 90 %
о-толуолсульфокислоты.
При сульфировании нафталина образуется много
изомерных сульфокислот, которые используют, в частности, как сырье при
производстве азокрасителей. Количество сульфогрупп в ядре и соотношение
изомеров зависят от температуры, концентрации сульфирующего агента и
продолжительности процесса. При сульфировании 98 %-ной серной кислотой при
низких температурах образуется в основном α-нафталинсульфокислота,
а при высоких - β-нафталинсульфокислота:
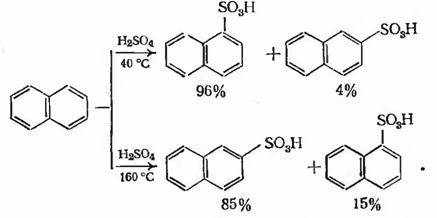
При более высоких температурах и более
длительном времени реакции образуются три - и тетрасульфоновые кислоты.
Природа группы, уже присоединенной к
ароматическому ядру, определяет положение сульфогруппы и в некоторой степени
скорость реакции.
Нитро- и сульфогруппы снижают реакционную
способность ароматического ядра; поэтому сульфирование нитропроизводных или
введение еще одной сульфогруппы требует более жестких условий реакции.
Заместители первого рода (−ОН, −NH2,
алкильные группы) увеличивают реакционную способность ароматического ядра и
позволяют проводить сульфирование в более мягких условиях и получать большее
число продуктов.
3. Технология процесса сульфирования
Основные технологические трудности - обеспечение
оптимальной температуры и минимальной концентрации сульфирующего агента,
разделение сульфокислот и предотвращение потерь (вследствие вторичных реакций,
растворимости сульфокислот в остаточной кислоте и т.п.). При сульфировании
ароматических соединений одной из проблем является более полное использование
сульфирующего агента с устранением его отходов в виде разбавленой кислоты или
солей. Наличие последних в сульфомассе, кроме того, усложняет технологию,
требуя отделения целевого продукта.
В промышленности процесс сульфирования чаще
всего проводят периодическим методом в жидкой гетерогенной системе. Иногда
применят метод, когда один из реагентов находится в газовой фазе, например при
сульфировании летучих углеводородов (так, бензол можно сульфировать, пропуская
его пары через серную кислоту при 160 °С) или в том случае, когда агенты
сульфирования находятся в парообразном состоянии.
Температурный режим обеспечивают, применяя реакторы
с косвенным нагревом - жидкостью (водой, маслом) или перегретым паром.
Теплопередача осуществляется через внешнюю рубашку или с помощью змеевика.
Порядок введения реагентов в сульфатор может
быть различным; чаще всего (особенно в случае летучих продуктов) серную кислоту
прибавляют к предварительно загруженному в реактор углеводороду.
Необходимую концентрацию серной кислоты
поддерживают удалением реакционной воды (перегонкой в вакууме или с парами
летучего продутка - ССl4, петролейного эфира и т.д.), применением
избытка серной кислоты или добавлением во время реакции олеума.
Сульфокислоты можно выделять путем разбавления
реакционной смеси водой с последующим охлаждением (при этом сульфокислоты
выпадают в осадок в виде солей щелочных или щелочноземельных металлов) [1].
Этот метод применяют лишь когда реакционная
смесь содержит небольшое количество Н2SO4, для того чтобы
в выпадающих в осадок сульфонатах количество Na2SO4 было
небольшим (от 2 до 5 %). Смесь можно использовать для щелочного плавления. Если
же в реакционной смеси содержится большое количество серной кислоты, то
сульфокислоты выделяют, обрабатывая смесь водной суспензией СаСО3
или известковым молоком:
2R−SO3H + CaCO3
→ (R−SO3)2Ca + CO2 + H2O
Серная кислота при этом образует СаSO4
- соединение, практически нерастворимое в воде, которое отделяют фильтрованием.
Фильтрат обрабатывают Na2CO3 и получают сульфонаты натрия
(R−SO3)2Ca + Na2CO3
→ 2RSO3Na + CaCO3
Нерастворимый карбонат кальция отделяют от
водного раствора сульфонатов натрия фильтрованием. Моно-, ди- и
трисульфокислоты и их изомеры иногда разделяют фракционной кристаллизацией их
кальциевых, бариевых или аммониевых солей.
Аппаратура установок сульфирования
изготавливается из чугуна (при сульфировании серной кислотой) и из стали (когда
применяют олеум) [3].
Метод сульфирования бензола «в парах
значительно» более эффективен, чем метод сульфирования с избытком серной
кислоты в автоклаве. Наиболее удобны для данного процесса аппараты барботажного
типа, так как в других аппаратах не удается создать достаточно развитую
поверхность фазового контакта или достигнуть требуемой продолжительности
соприкосновения ингридиентов.
Аппарат (рисунок 1) представляет собой чугунный
котел, снабженный паровой рубашкой, барботером для ввода паров бензола и соответствующей
арматурой и гарнитурой. Наибольшей коррозии подвергаются верхняя часть и крышка
сульфатора, соприкасающиеся с паровой фазой. В связи с этим сульфатор выполняют
из двух царг, что дает возможность в случае необходимости заменять только
верхнюю часть аппарата, а не демонтировать весь сульфатор.
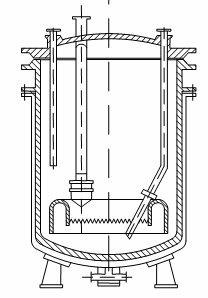
Рисунок 1 - Сульфатор для сульфирования бензола
«в парах»
Отношение высоты к диаметру в этом аппрате
несколько больше, чем в типовых реакционных котлах, так как при большей высоте
столба жидкости процесс протекает более активно и пары бензола в большей
степени насыщаются парами воды. Барботер сульфатора выполнен в виде колокола с
зубчатыми краями, что способствует более равномерному распределению паров
бензола в жидкости [4].
Окончание реакции определяют по отсутствию
исходного субстрата в отобранной пробе. Самым простым способом является
растворение пробы в воде. Отсутствие эмульсии или суспензии означает, что
реакция закончена, так как сульфокислоты растворимы в воде.
Схема реакционного узла для непрерывного
сульфирования бензола «в парах» приведена на рисунке 2.
Свежий и оборотный бензол испаряют и перегревают
в аппарате 5 и подают в реактор 1 через барботер. Серная кислота (в виде
купоросного масла с 90 %-ной H2SO4) непрерывно поступает
в тот же реактор. Он не имеет ни поверхностей теплообмена, ни мешалки (их
функции выполняют барботирующие через реакционную массу пары бензола,
подаваемые в 6-кратном избытке). Жидкость из реактора 1 перетекает в реактор 2,
в низ которого также поступают пары бензола, движущиеся противотоком к
жидкости. Колонна имеет колпачковые тарелки, на которых в слое реакционной
массы происходит сульфирование. Состав сульфомассы при движении ее сверху вниз
изменяется: она все более обогащается бензолсульфокислотой и обедняется серной
кислотой. Из куба реактора 2 сульфомасса направляется на дальнейшую
переработку. Пары бензола из аппратов 1 и 2 вместе с захваченными ими парами
воды конденсируются в холодильнике-конденсаторе 3, а конденсат разделяется в сепараторе
4 на водный и бензольный слой. Бензолный слой после предварительной
нейтрализации (на схеме не показана) возвращают в процесс.
Недостатком способа сульфирования бензола «в
парах» является большое количество обращающейся в производстве легко воспламеняющейся
жидкости (ЛВЖ).
Другой способ более полного использования SO3
состоит в применении олеума для сульфирования ароматических соединений. Олеум
имеет высокое начальное содержание SO3 и его расход на сульфирование
и образование отхода H2SO4 на единицу количества продукта
ниже, чем при использовании серной кислоты.
Сульфирование олеумом нередко проводят
периодическим способом, постепенно добавляя к олеуму при перемешивании и
охлаждении ароматический углеводород, но завершая реакцию при повышенной температуре.
Непрерывный процесс сульфирования олеумом при синтезе ПАВ (рисунок 3)
осуществляют в каскаде из трех или четырех реакторов с мешалками (на рисунке
изображены только 2). В первом реакторе, снабженном выносным рассольным
холодильником 2, ведут первую, наиболее экзотермичную, стадию почти полного
исчерпания избыточнного SO3, причем олеум и охлажденную реакционную
массу смешивают на всасывающей линии насоса 3. Остальные реакторы работают при
охлаждении водой, но при постепенно повышающейся температуре, чтобы полнее
использовать серную кислоту [2].
Оригинальное технологическое решение
используется в России для получения алкилбензолсульфокислоты. Сульфирование
осуществляют смесью диоксида (85 %) и триоксида серы (15 %). Жидкая
сульфирующая смесь поступает вместе с алкилбензолом в низ колонны, температура
процесса 20 °С. Алкибензолсульфокислота, содержащая до 2% диоксида серы,
непрерывно вытекает из колонны и далее нагревается до 400 °С. Удаляющийся
газообразный диоксид смешивается с уходящим из колонны и направляется на
окисление в конвертор.
Газообразный 100 %-ный SO2 смешивается с
кислородом, окисляется и конденсируется. Конденсат вновь направляется на
сульфирование.
Таким образом удается получить продукт высокого
качества и в процессе практически полностью отсутствуют отходы.
Алкилбензолсульфокислота передается на стадию нейтрализации.
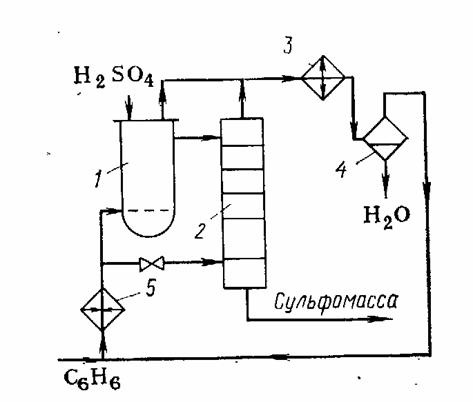
Рисунок 2 - Схема сульфирования бензола «в
парах».
,2 - реакторы; 3 - холодильник-конденсатор; 4 -
сепаратор; 5 - испаритель
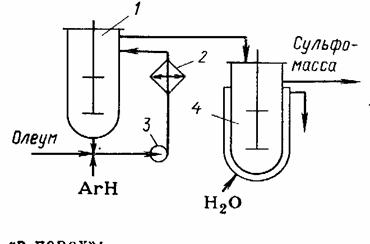
Рисунок 3 - Реакционный узел для сульфирования
олеумом.
, 4 - реакторы; 2 - выносной холодильник; 3 -
насос
4. Продукты сульфирования
Сульфирование применяется при производстве
промежуточных продуктов. Сульфогруппа может вводиться либо для придания
соединению большей растворимости, либо для дальнейшей замены сульфогруппы на
гидроксил, аминогруппу и т. п.
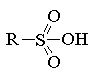
Сульфокислоты, как правило, являются твердыми
гигроскопичными кристаллическими веществами, хорошо растворимыми в воде и
обладающими ярко выраженным кислотным характером. Ароматические сульфокислоты
по силе близки к минеральным. В водных растворах они практически полностью
диссоциированы. Как правило, в результате сульфирования получается не одна
сульфокислота, а смесь сульфокислот, различающихся количеством сульфогрупп.
Выделение сульфокислот обычно встречает
трудности, так как они хорошо растворимы в сульфомассе. Поэтому сульфокислоты
чаще всего выделяют в виде солей, из которых свободные сульфокислоты могут быть
получены с помощью ионообменных смол. Бариевые и кальциевые соли сульфокислот в
противоположность щелочноземельным сульфатам, как правило, растворимы в воде,
что позволяет на стадии выделения продуктов реакции отделять избыточную серную
кислоту в виде нерастворимых сульфатов.
Число синтетических сульфокислот очень велико, и
они широко используются в практике.
Из природных сульфокислот следует, прежде всего,
отметить аминосульфокислоты: таурин и цистеиновую кислоту, которые играют
большую роль в процессе всасывания жиров в организме млекопитающих.
Ароматические сульфокислоты − полупродукты
в производстве фенолов, нафтолов, красителей, ионообменных смол, дезинфицирующих
средств (моно- и дихлорсульфамидов). Техническая смесь метан-, этан- и
пропансульфокислот используют в качестве растворителя, а также катализатора
этерификации, ацилирования, нитрования, нитрозирования и других процессов. Соли
алкансульфокислот − моющие средства, ПАВ, эмульгаторы, флотореагенты,
присадки к техническим маслам, ингибиторы коррозии и т. п.
В настоящее время наиболее многотоннажным
производством является получение алкилбензолсульфонатов (АБС), которые
используются в качестве анионных поверхностно-активных веществ (ПАВ).
Кроме того, реакции сульфирования ароматических
и гетероциклических соединений имеют определенное значение в синтезе ряда
лекарственных средств. Проведение реакций сульфокислот с нуклеофилами позволяет
синтезировать циано-, амино- и гидроксисоединения. Так сульфокислоты с помощью
реакции щелочного плавления превращаются в фенолы. Восстановление сульфокислот
позволяет синтезировать тиофенолы.
Гепарин - специфический
гетерополисахарид, препятствующий свертыванию крови и человека, и животных.
Гепарин выпускается в качестве лекарственного препарата для регулирования
свертываемости крови и лечения ряда других заболеваний. Были специально
синтезированы вещества, регулирующие свертываемость крови. Так, например,
препарат тромбовар (децилат) является эффективным средством для лечения
варикозного расширения вен. Многие поверхностно-активные вещества, содержащие
сульфогруппу, обладают сильным антимикробным действием. Ряд сульфо-БАВ способны
усиливать действие антибиотиков и сульфамидных препаратов. Среди сульфо-БАВ
имеются прекрасные стабилизаторы, что перспективно с точки зрения создания
инъекционных форм нерастворимых в воде препаратов.
Широким спектром биологической активности
обладают сульфированные полисахариды. В частности, декстрансульфат активирует
ряд ферментов, обладает иммунорегулирующими свойствами и т.д.
Сульфокислоты являются промежуточными веществами
в синтезе ряда химико-фармацевтических препаратов (диазолин, амидопирин и др.).
В ряде случаев сульфогруппа входит в состав лекарственного препарата, придавая
ему большую растворимость в воде. Последнее обусловливает снижение токсичности,
придает препарату несколько иную биологическую активность, а также создает
предпосылки для создания инъекционных лекарственных форм [4].
сульфирование углеводород агент
кинетика парафин
Список использованных источников
1.
Капкин, В.Д. Технология органического синтеза / В.Д. Капкин, Г.А. Савинецкая,
В.И. Чапурин. − М.: Химия, 1987. - 400 с.
.
Лебедев, Н.Н. Химия и технология основного органического и нефтехимического
синтеза / Н.Н. Лебедев. - М.: Химия, 1988. - 592 с.
.
Вынту, В. Технология нефтехимических производств / В. Вынту. - М.: Химия, 1968.
- 352 с.
.
Орехов, В.С. Технология органических полупродуктов / В.С. Орехов, Т.П. Дьячкова,
М.Ю. Субочева, М.А. Колмакова. - Тамбов.: издательство Тамбовского
государственного технического университета, 2007. - 140 с.