Развитие ключевых компетентностей учащихся в школьном курсе общей химии
Министерство
образования и науки РФ
ГОУ ВПО
Красноярский государственный педагогический университет имени В.П. Астафьева
Факультет
естествознания
Кафедра химии
ВЫПУСКНАЯ
КВАЛИФИКАЦИОННАЯ РАБОТА
РАЗВИТИЕ
КЛЮЧЕВЫХ КОМПЕТЕНТНОСТЕЙ УЧАЩИХСЯ В ШКОЛЬНОМ КУРСЕ ОБЩЕЙ ХИМИИ
студентки Смирновой Ксении Владимировны
Научный руководитель: Биркун Е.А.,
Красноярск
2010
Реферат
Тема: Развитие ключевых компетентностей учащихся в школьном
курсе общей химии
В данной работе решается проблема поиска эффективных путей формирования и
развития ключевых компетентностей учащихся.
Структура работы включает введение, 3 главы, выводы, библиографию,
приложения.
Компетентность определяется, как уже состоявшееся личностное качество
(совокупность качеств) ученика и минимальный опыт деятельности в заданной
сфере. К ключевым компетентностям относят коммуникативную, информационную,
учебно-познавательную, ценностно-смысловую и общекультурную компетентности. В
результате анализа методико-химической литературы сформулированы теоретические
основы, разработаны приемы и методы формирования и развития ключевых
компетентностей учащихся. Предложенная методика является лишь одним из
вариантов внедрения компетентностного подхода в успешном обучении школьников
химии. Учитель может использовать ее как полностью, так и частично.
Экспериментальным путем показано, что поставленная проблема имеет
решение, с помощью внедрения проектной и исследовательской деятельности,
проведения проблемных уроков и решения задач прикладного и исследовательского характера.
Вопросы диагностики ключевых компетентностей школьников мало освящены в
современной литературе, поэтому для учителей будущих поколений есть большое
поле для деятельности.
Содержание
Введение
Глава Ι. Содержание и методические основы
изучения школьного курса общей химии
Ι.1 Цели, задачи и структура школьного курса общей химии
Ι.2 Методические основы изучения курса общей химии
Ι.3 Анализ программы О.С. Габриеляна «Общая химия» 11 класс
Глава ΙΙ. Теоретические основы
компетентностного подхода
ΙΙ.1 Основные идеи компетентностного подхода
ΙΙ.2 Понятия «компетенция» и «компетентность»
ΙΙ.3 Реализация компетентностного подхода в современной школе
ΙΙ.4 Классификация ключевых компетентностей
Глава ΙΙΙ.
Содержание и результаты
педагогического эксперимента по внедрению компетентностного подхода в курсе
общей химии
ΙΙΙ.1 Организация учебного процесса на основе
компетентностного подхода
ΙΙΙ.2 Методика формирования ключевых компетентностей
учащихся в школьном курсе общей химии
ΙΙΙ.3 Проектная и исследовательская деятельность учащихся
как средство реализации компетентностного подхода при обучении химии в школе
ΙΙΙ.4 Оценка ключевых компетентностей учащихся по химии
ΙΙΙ.5 Результаты педагогического эксперимента по внедрению
компетентностного подхода
Выводы
Библиографический
список
Приложения
Введение
Система образования в настоящее время переживает этап реформирования,
связанный с изменением содержания, поиском оптимальных способов и технологий
обучения, способных удовлетворить возрастающие требования личности и
государства.
Назрела потребность в разработке новой модели выпускника школы,
акцентирующей внимание на приобретении опыта самостоятельной деятельности,
формирования готовности к дальнейшему обучению и социальной адаптации. В
результате мы наблюдаем в образовательной системе смену знаниевой парадигмы
компетентностной [1].
Концепция модернизации российского образования на период до 2010 года
поставила перед общеобразовательной школой ряд задач, одна из которых -
формирование ключевых компетентностей, определяющих современное качество
содержания образования [3].
Под ключевыми компетентностями понимается целостная система
универсальных знаний, умений, навыков, а также опыт самостоятельной
деятельности и личной ответственности обучающихся[3].
Ведущей идеей курса общей химии средней школы является единство
неорганической и органической химии на основе общности их понятий, законов и
теорий, а также на основе общих подходов к классификации веществ и
закономерностям протекания химических реакций между ними.
В преподавании общей химии создаются условия для развития как предметных
(специальных) компетентностей и надпредметных (ключевых) компетентностей.
Специальная (предметная) компетентность формируется содержанием учебного
предмета «химия». Ключевые (надпредметные) компетентности формируются процессом
обучения (формами, методами, технологиями обучении), а также за счет реализации
межпредметных связей химии с биологией, математикой, физикой, историей,
экологией. Система целенаправленного педагогического воздействия на учащихся
осуществляется через использование следующих форм организации учебного
процесса: работа в группах постоянного и сменного состава, выстраивание
индивидуальных образовательных траекторий, ролевое участие школьников в учебном
процессе, деятельностный подход к обучению.
Введение компетентностного подхода в нормативную и практическую
составляющую образования позволяет решать проблему, типичную для российской
школы, когда ученики могут хорошо усвоить теоретические знания, но испытывают
значительные трудности в деятельности, требующей использования этих знаний для
решения конкретных жизненных задач или проблемных ситуаций. Компетентностный
подход предполагает не усвоение учеником отдельных друг от друга знаний и
умений, а овладение ими в комплексе. В связи с этим меняется система методов
обучения.
Таким образом, проблема проводимого исследования состоит в поиске
эффективных путей формирования и развития ключевых компетентностей школьников
на уроках общей химии.
Целью работы является анализ теоретических обоснований и разработка
методических рекомендаций по составлению и использованию различных приемов для
формирования, развития и оценивания ключевых компетентностей школьников на
уроках общей химии.
Для решения изложенной проблемы и достижения поставленной цели были
выдвинуты следующие задачи:
Ø рассмотреть возможности использования компетентностного
подхода при обучении общей химии;
Ø выявить пути диагностики сформированности ключевых
компетентностей ученика;
Ø разработать методические рекомендации по составлению и
использованию заданий для формирования и развития ключевых компетентностей
школьников на уроках химии;
Ø апробировать выделенные приёмы в практике обучения химии.
Для проведения исследования была выдвинута гипотеза: если учебные занятия
в курсе общей химии средней школы систематически проводить на основе
планово-тематической диагностики, активном использовании проектных,
исследовательских и прикладных заданий, то можно повлиять на развитие ключевых
компетентностей учащихся.
Для решения задач использованы следующие методы исследования:
Ø изучение и анализ химической, психолого-педагогической и
методической литературы по теме исследования;
Ø выделение конкретных приемов работы и их реализация в
практике обучения школьников;
Ø диагностические задания и тесты.
Практическая значимость работы состоит в том, что методические рекомендации
могут быть использованы студентами и учителями при подготовке к урокам и
элективным занятиям по химии.
Апробация материалов исследования с учениками 11-х классов проводилась на
базе МОУ СОШ №24 города Красноярска. В результате работы проведена оценка
разработанной методики через диагностику ключевых компетентностей учеников на
начальном уровне и после проведения серии уроков.
Работа состоит из введения, трех глав и заключения. Библиографический
список содержит различные источники, включая электронные ресурсы и ресурсы сети
Интернет. Работа также содержит приложение, в котором приведен бланк заданий
для оценки уровня развития ключевых компетентностей учащихся в курсе общей химии.
Глава Ι. Содержание и методические основы
изучения школьного курса общей химии
Ι.1 Цели и задачи курса общей химии
Химия как учебный предмет средней школы, наряду с другими предметами,
формирует личность учащихся. Для достижения этой главной цели, стоящей перед
школой, обучение химии ставит перед собой задачи, решение которых
осуществляется с позиций единства образовательной, воспитательной и развивающей
функций обучения.
Школьный курс химии должен ознакомить учащихся с основами наук, т.е.:
обеспечить сознательное усвоение учащимися важнейших химических законов,
теорий, понятий, и методов химической науки;
формировать научное мировоззрение и понимание того, что химическое
образование как обязательный элемент культуры необходим каждому;
воспитывать трудолюбие, нравственность, интерес к науке, бережное
отношение к природе, понимание приоритета общечеловеческих ценностей;
развивать мышление учащихся, их самостоятельность и творческую
активность, обучать разнообразным видам учебной деятельности;
обеспечивать знакомство с ведущими направлениями химизации народного
хозяйства, с возрастающим значением химии;
формировать практические умения и навыки, способствовать профориентации,
готовить учащихся к сознательному выбору профессии.
Организация профильного обучения на старшей ступени средней школы требует
дифференциации целей обучения химии.
Цели обучения химии в классах естественнонаучной направленности
предусматривают углубленное изучение теории и понятий, усиление внимания к
практической стороне предмета, целенаправленная подготовка к продолжению
образования в вузах соответствующего профиля.
В физико-математических классах усиливается математическая компонента
химии как точной науки.
В общеобразовательных классах более подробно развертываются с некоторыми
дополнениями вопросы, изучавшиеся в основной школе (VIII-IX классах).
Современное содержание школьного курса химии получило научное обоснование
в работах крупнейших отечественных методистов: В.Н.Верховского, П.П.Лебедева,
Ю.В.Ходакова, С.Г.Шаповаленко, Л.А.Цветкова, И.Н.Черткова, Е.Е.Минченкова,
А.Д.Смирнова, Г.И.Шелинского, Н.Е.Кузнецовой, В.П.Гаркунова.
Методические концепции разработки содержания школьного курса химии четко
выражены у каждого из авторов школьных учебников по химии. Во всех курсах можно
выделить определенный набор дидактических единиц, составляющих структуру курса.
. Законы и теории. Периодический закон и периодическая система элементов
Д. И. Менделеева. Атомно-молекулярное учение. Теория строения вещества. Теория
электролитической диссоциации. Закономерности возникновения и протекания
химических реакций (учение о скорости химических реакций и о химическом
равновесии). Современная теория строения органических веществ. Постоянство
состава и закон сохранения массы веществ при химических реакциях, закон
Авогадро, закон сохранения и превращения энергии.
. Основные системы понятий. Вещество. Химический элемент.
Химическая реакция. Химическое производство.
. Факты.
. Методы химической науки.
Химия -наука экспериментально-теоретическая. Изучение веществ и процессов
основано на анализе фактов, полученных в результате эксперимента, и их
теоретическом объяснении и обобщении. Если факты можно объяснить на основе уже
имеющихся законов и теорий, то они служат подкреплению этих законов и теорий.
Но наиболее интересны факты, которые противоречат существующим теориям. И тогда
поиск их объяснения приводит к открытию новых законов, созданию новых теорий.
Такова логика химических открытий - в сочетании индуктивного (обобщение
накопленных фактов) и дедуктивного (применение теорий и законов к объяснению
фактов) путей исследования.
Чтобы объяснить факты ученые выдвигают гипотезы, которые проверяются
экспериментом. Экспериментальные данные подтверждают гипотезу, она превращается
в теорию. Атомно-молекулярное учение долгое время было гипотезой. Теория
существует до тех пор, пока не накопятся многочисленные факты, противоречащие
ей. Тогда возникает новая теория. Если теория объективно отражает явления
окружающего мира, то она не опровергает прежнюю, а расширяет границы ее
применения.
В школьном курсе химии также должна найти отражение сущность научных
химических методов, поэтому предусмотрено формирование определенных групп
умений, позволяющих приобщить учащихся к пониманию пути химического
исследования:
Ø проверка выдвинутой гипотезы экспериментом, вывод,
теоретическое осмысление, использование в практике;
Ø приобретение умений работать с посудой, материалами,
реактивами, инструментами, приборами, освоение приемов, операций, манипуляций,
техники химического эксперимента;
Ø освоение химической символики, методов моделирования веществ
и процессов.
. Вклад в науку выдающихся химиков.
Для учеников важно понять, что наука делается людьми и требует больших
знаний и затрат интеллектуальной энергии. Стремление успеху заставляет ученого
работать с полной отдачей. Каждый ученый - это личность, его творчество
уникально и заслуживает уважения. Ученики должны понять не только полученный
результат, но и многотрудный процесс научного поиска. Этот компонент содержания
несет мощную воспитательную нагрузку, убеждает в высокой ценности образования.
Рассмотрим связи между конкретными компонентами содержания. Главной
образовательной целью школьного курса химии, как уже говорилось, является
формирование научных понятий о веществе, химическом элементе, химической
реакции и химическом производстве. Эти понятия формируются на протяжении всего
курса химии, развиваются и совершенствуются, претерпевают в процессе изучения
количественные и качественные изменения.
Обогащение понятий новыми качественными характеристиками происходит при
изучении той или иной теории. Такой подход отражает в целом соотношение между
понятиями и теориями в науке. Важнейшие химические теории, разработанные в
разные исторические периоды развития науки, связаны между собой через понятия.
Это находит отражение в структуре содержания школьного курса химии.
В школьном курсе химии пять основных теоретических концепций:
— атомно-молекулярное учение;
— периодический закон, периодическая
система элементов Д. И. Менделеева и теория строения вещества;
— теория электролитической диссоциации;
— закономерности возникновения и
протекания химических реакций;
— современная теория строения
органических веществ.
Каждая из этих концепций представляет собой своеобразный рубеж, проходя
через который важнейшие понятия претерпевают качественные изменения,
развиваются и совершенствуются. Этим понятиям принадлежит решающая роль при
построении содержания различных курсов химии[11].
Школьный курс химии структурируется с учётом определённых
методологических, психолого-педагогических и научно-теоретических основ (см.
табл.1) [12].
Важнейшие основы построения курса химии Таблица 1.
|
Основы (пример)
|
Для чего? Что дают?
|
|
Методологические (теория
познания)
|
Обеспечивают пути (способы)
перехода от незнания к знанию
|
|
Психолого-педагогические
(теории воспитания, учения, понимания, развития)
|
Обеспечивают решение задач
обучающего, воспитывающего, развивающего характера
|
|
Научно-теоретические
(научно-теоретические концепции химии)
|
Обеспечивают фундамент
химического образования
|
Ι.2 Методические основы изучения курса
общей химии
В соответствии с федеральным компонентом государственного стандарта общее
образование по химии в средней (полной) школе представлено на двух уровнях - базовом
и профильном. Выпускники, изучавшие курс химии базового уровня, овладевают
умениями, необходимыми для безопасного и грамотного использования веществ в
повседневной жизни. В стандарте профильного уровня система химических знаний
значительно расширяется на основе углубления представлений о строении вещества,
химической связи и закономерностях химических реакций, рассматриваемых с точки
зрения учения о химической кинетике и термодинамике процессов. Тем самым
обеспечивается подготовка выпускников к продолжению образования в средних
специальных и высших учебных заведениях, профиль которых предусматривает
изучение химии.
Требования для базового и профильного уровней по числу элементов знаний и
умений.
Базовый уровень подготовки по химии предполагает усвоение примерно 70
элементов знаний и овладение 40 умениями, профильный - более 100 элементов
знаний и более чем 50 умений. Изучение химии на старшей ступени школы может
осуществляться в нескольких вариантах. Эти варианты изучения химии в старшей
школе не являются обязательными и служат для общеобразовательных учреждений
примерами построения их индивидуальных планов. Повышение уровня химической
подготовки учащихся разных профилей достигается за счет элективных курсов,
содержание которых ориентировано на углубленное изучение отдельных разделов
химии (2 - 3 часа в неделю). Рекомендуются следующие элективные курсы:
«Методика решения расчетных химических задач», «Методика решения
экспериментальных задач», «Основы химического анализа», «Химия растворов»,
«Химия жизни», «Пространственное и электронное строение органических
соединений», «Химия высокомолекулярных соединений».
Обучение химии в школе основано на химическом эксперименте. Химический
эксперимент и прежде всего лабораторные опыты и практические занятия служат главным
фактором проявления интереса к предмету. Попытка заменить реальный эксперимент
виртуальным - не лучший выход из положения, так как человек живет в реальном
мире окружающих его веществ, а не в виртуальном, и химический эксперимент -
основной источник знаний о веществе и химической реакции. В условиях всё
возрастающих требований к процессу обучения химии решение стоящих перед школой
задач невозможно без хорошо оборудованного кабинета химии. При использовании
средств обучения учитель учитывает следующие принципы: приоритет
деятельностного подхода в учебно-воспитательном процессе; перенос акцента с
репродуктивных форм учебной деятельности на самостоятельные,
поисково-исследовательские виды работы; развитие коммуникативных умений
учащихся.
Главным результатом школьного образования становится соответствие целям
опережающего развития. Школьники вовлекаются в исследовательские проекты и
творческие занятия, в ходе которых они учатся изобретать, понимать новое и
осваивать неожиданное, быть открытыми и способными выражать собственные мысли,
уметь принимать решения и помогать друг другу, формировать интересы и
осознавать возможности. Используя исследовательскую деятельность учащихся,
учитель может последовательно вести их к новым знаниям о свойствах веществ и
химических процессах.
На качество образования влияет оценка образовательных достижений
учащихся. С введением ЕГЭ важное значение приобретает совершенствование
методики контроля учебных достижений выпускников. Формы контроля разнообразны в
зависимости от конкретных целей и специфики изученного материала. В ходе
текущего контроля используются задания, аналогичные тем, которые представлены в
ЕГЭ. Широко используются практико-ориентированные задания и задания на
комплексное применение знаний из различных разделов курса.
Методы химического образования - это способы достижения целей и задач
химического образования посредством упорядоченной образовательной деятельности
учителя и учащихся. Учитель химии в процессе выбора и реализации оптимальных
методов химического образования учитывает уровни их функционирования:
. Методологический уровень. На этом уровне функционирует
интегративный подход, с целью реализации ведущей идеи о всеобщей связи и
взаимозависимости химических и других объектов познания.
. Общелогический уровень. Данный уровень объединяет методы:
индукции, дедукции, аналогии, анализа, синтеза, сравнения, сопоставления,
конкретизации, абстрагирования, обобщения, систематизации, моделирования,
прогнозирования, интеграции.
. Общепедагогический уровень. На данном уровне действуют такие
методы обучения, как методы изложения (лекция, рассказ, описание, повествование
и др.) беседа, самостоятельная работа.
. Дидактико-методический уровень. На этом уровне функционируют
специфические методы обучения химии, К ним относятся: методы исследования;
наблюдения химических объектов» химический эксперимент; моделирование;
объяснение химических фактов и явлений.
Различают важнейшие классы методов химического образования по характеру
выполняемых ими образовательных функций: методы обучения, воспитания и
развития, эти методы объединяют в группы:
) организационно-управленческие (словесные, наглядные, практические,
решение химических задач, составление химических загадок);
) мотивационно-стимулирующие (дидактические игры, учебные дискуссии,
убеждения в значимости знаний и др.)
) контрольно-оценочные (устный контроль- опрос, зачёт, письменный
контроль -различные диктанты, тесты)
Ведущие идеи современных учебно-методических пособий:
· материальное единство веществ природы, их генетическая связь;
· причинно-следственные связи между составом, строением,
свойствами и применением веществ;
· познаваемость веществ и закономерностей химических реакций;
· объясняющая и прогнозирующая роль теоретических знаний для
фактологического материала химии элементов;
· положение о том, что конкретное химическое соединение
представляет собой звено в непрерывной цепи превращений веществ и участвует в
круговороте химических элементов и в химической эволюции;
· положение о том, что законы природы объективны и познаваемы;
знание законов химии даёт возможность управлять химическими превращениями
веществ, находить экологически безопасные способы производства и охраны
окружающей среды от загрязнения;
· положение о том, что наука и практика взаимосвязаны:
требования практики - движущая сила развития науки, успехи практики обусловлены
достижениями науки;
· положение о том, что развитие химической науки и химизация
народного хозяйства служат интересам человека и общества в целом, имеют
гуманистический характер и призваны способствовать решению глобальных проблем
современности;
· преемственность между звеньями единого процесса
естественнонаучного образования в Российской Федерации основной, старшей и
высшей школами;
· личностная мотивация, т.е. максимальное соответствие выбранного
старшеклассниками профиля обучения для подготовки к успешной сдаче экзаменов и
эффективного продолжения обучения в соответствующем вузе.
Структура учебно-методических изданий решает три проблемы интеграции в
профильном обучении химии.
Первая - это внутрипредметная интеграция учебной дисциплины «Химия». Идея
такой интеграции диктует следующую очерёдность изучения разделов химии: в 10
классе, изучается органическая химия, в 11 классе, - химия общая. Изучение в 11
классе основ общей химии позволяет сформировать у выпускников средней школы
представление о химии как о целостной науке, показать единство её понятий,
законов и теорий, универсальность и применимость их как для неорганической, так
и для органической химии. Подавляющее большинство тестовых заданий ЕГЭ (более
90%) связано с общей и неорганической химией, а потому в 11, выпускном классе
логичнее изучать именно эти разделы химии, чтобы максимально помочь выпускнику
преодолеть это серьёзное испытание.
Вторая - это межпредметная интеграция, позволяющая на химической базе
объединить знания по физике, биологии, географии, экологии в единое понимание
естественного мира, т.е. сформировать целостную естественнонаучную картину
мира. Это позволит старшеклассникам осознать то, что без знаний по химии
восприятие окружающего мира будет неполным и ущербным, а люди, не получившие
таких знаний, могут стать неосознанно опасными для этого мира, так как
химически неграмотное обращение с веществами, материалами и процессами грозит
немалыми бедами.
Кроме этих двух ведущих интегрирующих идей, должна быть реализована и ещё
одна - интеграция химических знаний с гуманитарными дисциплинами: историей,
литературой, мировой художественной культурой. А это позволяет средствами
учебного предмета показать роль химии и в нехимической сфере человеческой
деятельности. [13]
Ι.3 Анализ программы О.С. Габриеляна
«Общая химия» 11 класс
По школьному учебному плану на изучение химии в 11 общеобразовательном
классе для реализации выбранной программы выделено 2 часа в неделю (68 часов в
год). Тематическое планирование составлено с использованием тематического
планирования расположенного в методическом пособии, по авторской программе О.С.
Габриеляна. Практикум разбит на отдельные практические работы, которые будут
проводиться после изучения соответствующей темы. Особенность программы состоит
в том, что сохраняется высокий теоретический уровень. Это достигается путем
вычисления укрупненной дидактической единицы, в роли которой выступает
основополагающее понятие «химический элемент и формы его существования
(свободные атомы, простые и сложные вещества)», следование строгой логике
принципа развивающего обучения, положенного в основу конструирования программы.
Программа по химии 11 класса разработана с опорой на курс основной школы.
Темы основного курса химии рассматриваются снова, но уже на более высоком,
расширенном и углубленном уровне. Автор делает это осознано с целью обеспечения
преемственности между основной и старшей ступенями обучения в
общеобразовательных учебных заведениях. В 11 классе изучается общая химия, ее
задача интегрировать знания учащихся по неорганической и органической химии на
самом высоком уровне с целью формирования у них единой химической картины мира.
Такое построение курса позволяет в полной мере использовать логические
операции мышления: анализ и синтез, сравнение и аналогию, систематизацию и
обобщение. Таким образом, содержание курса общей химии позволяет оптимально
развивать ключевые компетентности учащихся.
Глава ΙΙ. Теоретические основы
компетентностного подхода
ΙΙ.1 Основные идеи компетентностного подхода
В условиях современного развития общества востребованными становятся
такие качества личности, как мобильность, решительность, ответственность,
способность усваивать и применять знания в незнакомых ситуациях, способность
выстраивать коммуникацию с другими людьми.
Основным результатом деятельности образовательного учреждения должна
стать не система знаний, умений и навыков, а способность человека действовать в
конкретной жизненной ситуации.
«Компетентностный подход проявляется как обновление содержания
образования в ответ на изменяющуюся социально-экономическую реальность»
(И.Д.Фрумин).
Идеи компетентностного подхода как принципа образования рассматриваются в
работах А.М.Аронова, А.В.Баранникова, А.Г.Бермуса, В.А.Болотова, И.А.Зимней,
Г.Б. Голуба, В.В. Краевского, О.Е.Лебедева, М.В. Рыжакова, Ю.Г.Татура, Л.О.
Филатовой, И.Д.Фрумина, А.В.Хуторского, О. В. Чураковой, М.А., Чошанова,
П.Г.Щедровицкого.[25] Все исследователи, изучавшие природу компетентностей,
обращают внимание на ее многосторонний, разноплановый и системный характер.
Основные
идеи компетентностного подхода сформулированы . Филатовой
<#"514266.files/image001.gif">” - знака электролиза. Сегодня мы вторгаемся в область
электрохимии и рассмотрим явление электролиза. Запишем тему урока.
1.
Основная часть
Вопрос:
Что же называется электролизом? “Электро” - электрический ток, “лизис” -
разложение. Делается вывод, что электролиз - это процесс, в результате которого
происходит разложение вещества под действием постоянного электрического тока.
Разложить можно практически любое вещество, поместив его в электролизер. Но в
каком виде? Обычно в жидком, т.е. в виде раствора. На плакате изображено, что в
раствор электролита опускаются электроды, соединенные с источником постоянного
электрического тока. Отрицательно заряженный электрод называется катод и
условно обозначается К (-). Положительно заряженный электрод называется анод и
обозначается А (+). В межэлектродном пространстве находится диссоциирующий на
ионы электролит. Катионы, заряженные положительно, перемещаются в сторону
катода, а анионы, заряженные положительно, в сторону анода. На катоде будет
происходить электрохимическое восстановление катионов или молекул воды, а на
аноде электрохимическое окисление анионов или молекул воды. Дается определение:
электролиз - совокупность окислительно-восстановительных процессов, протекающих
в электролитах при пропускании постоянного электрического тока. Данный прибор
имитирует работу электролизера. Он поможет нам выполнить тестовое задание, текс
которого находиться у вас на столах:
Задача.
При электролизе раствора какой соли можно одновременно получить 0,2 моль
нерастворимого основания и 13,44 л газообразных продуктов (н.у.)? Напишите
уравнения процессов, происходящих на электродах в ионной и молекулярной
формах:1) CuSO4 ; 2) NaCl; 3) AlCl3.
Определим
соотношение количеств газообразных продуктов и нерастворимого основания,
выполним предварительные расчеты:(осадка) = 0,2 мольV (газов) = 13,44 л v
(газов): v (осадка) = ?(газов) =V(газов) : Vm = 13.44 : 22,4 = 0,6
мольv (газов): v (осадка) = 0,6 : 0,2 = 6 : 2 = 3 : 1
Из
текста задания ясно, что нам необходимо составить уравнения электролиза
растворов, определить катодные и анодные процессы, выполнить необходимые
расчеты. Кто первый хочет попробовать выполнить задание?
Напишем
сначала процесс электролитической диссоциации, происходящий в данном растворе.
А)
CuSO4 ->Cu2+ + SO42-
Катион
меди (II) будет перемещаться в сторону катода.
Но
поскольку в около катодном пространстве будут находиться также молекулы воды,
то мы запишем это таким образом:
К(-)
Cu2+H2O
Пользуясь
опорным конспектом определите катион меди (II) или молекулы воды будут
восстанавливаться на поверхности катода?
Катион
Cu2+ входит в 3 группу катионов и он будет восстанавливаться. Вода
восстановлению в данном случае не подвергается:
К(-)
Cu2+ + 2 е 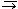 Cu0H2O
Cu0H2O
Определим
теперь процессы, происходящие на аноде.
Сульфат
- анион будет перемещаться в сторону анода, в около анодном пространстве будут
так же находиться молекулы воды:
А
(+) SO42-H2O
На
аноде будет происходить электрохимическое окисление молекул воды, так как анион
SO42 является анионом кислотного остатка оксокислоты и
окислению не подвергается (1 группа анионов):
А
(+) SO42- 2H2O- 4 е ->О20
+ 4Н+
Определим
соотношение коэффициентов так же, как в обычном электронном балансе:
К(-)
Cu2+ + 2 е ->Cu0 (2)H2O
А
(+) SO42- 2H2O- 4 е ->О20
+ 4Н+ (1)
Составим
электронно-ионное уравнение, с учетом коэффициентов:
Cu2+
+2H2O -> 2Cu0 + О20 + 4Н+
Полное
электронно-ионное уравнение напишем с учетом ионов, не участвовавших в
окислительно-восстановительном процессе:
2Cu2+ +2H2O + 2 SO42
-> 2Cu0 + О20
+ 4Н+
+ 2 SO42
Теперь
мы легко напишем суммарное уравнение электролиза, не забыв поставить знак
электролиза:
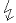 2CuSO4
+ 2 H2O -> O2 + 2Cu + 2H2SO4
2CuSO4
+ 2 H2O -> O2 + 2Cu + 2H2SO4
Получился
ли в результате реакции осадок? Определите это с помощью таблице растворимости.
В
результате реакции электролиза осадок не образовался.
Может
быть выделился газ?
В
около анодном пространстве происходит выделение кислорода.
Проверим
это опытным путем - проведем электролиз водного раствора сульфата меди (II).
Что вы наблюдаете? Поверхность одного из электродов покрывается пузырьками
газа. Перейдем к выполнению задания
NaCl -> Na+ + Cl - K (-) Na+
2H2O - 2 e
-> 2OH - + H2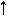 (2) (1)A (+)2Cl - - 2 e
-> Cl20 (2) (1)H2O
(2) (1)A (+)2Cl - - 2 e
-> Cl20 (2) (1)H2O
2H2O + 2Cl - ->2OH - +
H2 + Cl22Na+ + 2H2O + 2Cl -
->2OH + H2 + Cl20 + 2Na+
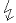 2
NaCl + 2H2O -> 2NaOH + H2
2
NaCl + 2H2O -> 2NaOH + H2 + Cl2
+ Cl2
Получились
ли теперь осадок и газообразные вещества? Осадка нет, но в около катодном
пространстве происходит выделение водорода, а в около анодном пространстве -
хлора. Проверим это опытным путем - проведем электролиз водного раствора
хлорида натрия. Что вы наблюдаете?
Поверхность
обоих электродов покрывается пузырьками газа, в присутствии фенолфталеина
раствор окрашивается в малиновый цвет.
Выполним
задание
3 -> Al3+ +
3Cl - K (-) Al3+
2H2O + 2 e 2OH - + H20
(6) (3)A(+)6Cl - - 6 e -> 3Cl20 (2) (1)H2O
H2O + 6Cl - -> 3H2
+6OH - + 3Cl26H2O + 6Cl -+2Al3+
-> 3H2 +6OH - + 3Cl2+2Al3+
 2AlCl3
+ 6H2O ->3H20
2AlCl3
+ 6H2O ->3H20 +3Cl2
+3Cl2 + 2Al(OH)3
+ 2Al(OH)3
С
помощью таблицы растворимости определяем, что вещество Al(OH)3 не
растворимо и выпадает в осадок. В около анодном пространстве выделяется
газообразный хлор, в около катодном пространстве - водород.
Проверим
это опытным путем - проведем электролиз водного раствора хлорида алюминия. Что
вы наблюдаете? Происходит помутнение раствора.
По
уравнению реакции определяем соотношение количеств газообразных продуктов и
осадка.
 2AlCl3
+ 6H2O ->3H20
2AlCl3
+ 6H2O ->3H20 +3Cl2
+3Cl2 + 2Al(OH)3
+ 2Al(OH)3 6 моль
газов 2 моль осадка(газов): v (осадка) = 6: 2 = 3 : 1
6 моль
газов 2 моль осадка(газов): v (осадка) = 6: 2 = 3 : 1
Это
в точности совпадает с нашими расчетами. Значит правильный ответ в этом задании
в)
3.
Разрешение проблемы. Мы выполнили с
вами задание, но алюминий в результате электролиза не получили. В качестве
сырья мы должны взять оксид алюминия, в воде не растворимый. Но электролит в
электролизере должен быть жидким. Как быть? Сделать расплав. Обратимся к тексту
учебника §18. Какой процесс протекает при электролизе расплава глинозема в
криолите?
Al2O3 - 2Al3 + + 3O2
- K (-) Al3+ + 3 e -> Al0 (4)A(+) 2O2 - -
4 e -> O02 (3)
 4Al3
+ + 6O2 - -> 4Al0 + 3O20
4Al3
+ + 6O2 - -> 4Al0 + 3O20
 2Al2O3
-> 4Al + 3O2
2Al2O3
-> 4Al + 3O2
Мы
рассмотрели с вами химические основы современного промышленного способа
получения алюминия.
4.
Практическое значение электролиза. Но
только ли для этого необходим электролиз? О практическом значении электролиза
послушаем сообщение. Ученик делает сообщение и выполняет демонстрационные
опыты.
5.
Подведение итогов, проверка результативности.
Проверим
результативность нашей совместной работы, напишем графический диктант, текст
которого вы видите на своих столах :
Графический
диктант.
1. Электролиз можно считать окислительно-восстановительной
реакцией, происходящей под воздействием электрического тока.
. Катод - отрицательно заряженный электрод;
. На катоде происходит процесс электрохимического окисления;
. Анион SO42 - будет окисляться на аноде в
водном растворе;
. Анион Cl - будет окисляться на аноде в водном
растворе;
. Катион Cu2 + будет восстанавливаться на катоде в
водном растворе;
. Алюминий получают электролизом расплава Al2O3
в криолите;
. При электролизе раствора NaCl можно получить щелочь NaOH и газы
H2 и Cl2.
Ученики заполняют бланк химического диктанта:
Фамилия, имя____________________1 2 3 4 5 6 7 8 9 10
 ДА
ДА НЕТ
НЕТ
Оценка:_______________
Учащимся
предлагается поменяться с соседом заполненными бланками, выставить друг другу
оценки по оценочной шкале: 5 - 6 правильных ответов - оценка “3”, 7 - 8
правильных ответов - оценка “4”, 9 - правильных ответов - оценка “5”. На доске
открывается шаблон с правильными ответами:
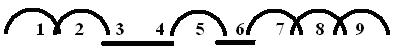
Прошу
поднять руку тех учеников, которые справились с графическим диктантам на
“хорошо” и “отлично”.
6.
Домашнее задание.
§18,
упражнение № 29, 31, 37(письменно).Трое учеников получают карточки с
дополнительным индивидуальным заданием:
Карточка
№ 1.Сколько килограмм алюминия можно получить при электролизе 1 тонны
глинозема?
Карточка
№ 2.При электролизе раствора какой соли можно одновременно получить 2 моль
нерастворимого гидроксида и 44,8 л газообразных продуктов (н.у.)? напишите
уравнения процессов, происходящих на электродах в ионной и молекулярной формах:
1) CuCl2;2) Cu(NO3)2;3)
Mg(NO3)2
Карточка
№ 3.В конце ХХ века появились новые данные о принципиальной возможности
получения металлического алюминия в древности. Институт прикладной физики
Китайского Академии наук сообщил о результатах исследования гробница полководца
Чжоу-Чжу, похороненного в 297 году н.э.. спектральный анализ орнамента,
украшающего саркофаг, показал, что он состоит из сплава: 85% алюминия, 10%
меди, 5% магния. Анализ повторяли несколько раз. Результаты оказались те же.
Как могли древние китайские мастера получить сплав алюминия?
Приложение
2
.
Металлический характер свойств элементов в ряду Mg - Ca - Sr - Ba:
a) уменьшается; b) возрастает;
c) не
изменяется; d) уменьшается, а затем возрастает.
.
Какой из приведённых эелементов назван в честь страны:
a) In; b) Si; c) Ra; d) Ru.
3.Какой
из приведенных элементов назван в честь континента:
a) N; b) Au; c) Am; d) At.
4.
Формула вещества с ковалентной полярной связью:
а)
NaCl; б) HCl; в) ВаО; г)
Ca3N2.
.
Причины резкого различия свойств воды и сероводорода заключаются в
особенностях:
а)
внутримолекулярной связи; б) межмолекулярной связи.
6.
Химические связи в веществах, формулы которых СН4 и CaCl2
соответственно:
а)
ионная и ковалентная полярная;
б)
ковалентная полярная и ионная;
в)
ковалентная неполярная и ионная;
г)
ковалентная полярная и металлическая.
.Коэффициент
перед формулой окислителя в уравнении реакции алюминия с бромом равен:
а)
1; б) 2; в) 3; г) 4.
.
К каким классам неорганических соединений относятся: NaOH, SO2, Na3PO4, H2SO4?
Класс
соединения Соединение
а)
соли …
б)
основания …
в)
оксиды …
г)
кислоты …
.
Распределите (условно) указанные ниже вещества по способности к растворимости в
воде:
a) хорошо
растворимые;
б)
малорастворимые;
в)
практически нерастворимые.
Вещество
Способность к растворимости
а)
сахар …
б)
хлорид серебра …
в)
поваренная соль …
г)
питьевая вода …
.
В признании особо значения теории электролитической диссоциации для развития
химии Нобелевская премия в 1903г., присуждена известному учёному?
_________________
.
Можно ли хранить раствор медного купороса в железном или оцинкованном ведре?
Ответ объясните.
.
Вы купили гашёную известь, но оказалось, что вам продали просроченный товар.
Можно ли использовать старую гашёную известь? Ответ обоснуйте.