Определение типичных осложнений, возникающих у пациентов кардиореанимационного отделения МУЗ 'ЦГБ' г.о. Сызрань
Оглавление
Введение
. История изучения инфаркта миокарда
. Анатомия миокарда
. Физиология миокарда
. Основные понятия инфаркта миокарда
.1 Классификация инфаркта миокарда
.2 Причины развития инфаркта миокарда
.3 Клиника инфаркта миокарда
.4 Атипичные формы инфаркта миокарда
.5 Диагностика инфаркта миокарда
.5.1 Программа обследования
.5.2 Экспресс-тесты для определения миокардиальных маркеров
.6 Дифференциальная диагностика инфаркта миокарда
.7 Прогноз у больных с инфарктом миокарда
.8 Осложнения инфаркта миокарда
.9 Лечение инфаркта миокарда
.9.1 Догоспитальный этап лечения
.9.2 Госпитальный этап лечения
.10 Реабилитация больных с инфарктом миокарда
. Заболеваемость инфарктом миокарда г. о. Сызрань
Заключение
Используемая литература
Приложение
Введение
Снижение летальности от инфаркта миокарда в нашей стране значительно
превосходит снижение ее в зарубежных странах. Объяснение этого положения
следует искать в лучшей организации здравоохранения в России, обеспечивающей
быструю догоспитальную помощь, своевременную госпитализацию и правильно
организованный режим и лечение больного в острой стадии заболевания и в не
менее ответственном для больного послеинфарктном периоде. Система непрерывного
наблюдения средним медицинским персоналом в поликлинических условиях после
выписки больного из стационара, широкое использование санаторно-курортного
лечения позволяют осуществлять постепенное включение больных в активную жизнь и
восстановление их трудоспособности. Систематический контроль среднего
медицинского персонала за правильным трудоустройством подобных больных
дополняет комплекс широких врачебных мероприятий, проводимых в отношении
больных инфарктом миокарда в нашей стране. Несмотря на это ежегодно в нашей
стране увеличивается число случаев инфаркта миокарда. Это заболевание
становится моложе, и поражает людей трудоспособного возраста, что подтверждает
актуальность исследования.
Цели дипломной работы:
Определение типичных осложнений, возникающих у пациентов
кардиореанимационного отделения МУЗ "ЦГБ" г.о. Сызрань с диагнозом
"инфаркт миокарда"; формирование информационной базы по теме
"Инфаркт миокарда".
Задачи работы:
1. Изучить учебную и научную литературу, материалы
специализированных медицинских сайтов по теме дипломной работы;
2. Определить количество больных с диагнозом "инфаркт
миокарда", поступивших в кардиореанимацию МУЗ "ЦГБ" г. о.
Сызрань за период с 2005 по 2009 года.
. Определить взаимосвязь между возрастом пациентов и частотой
возникновения инфаркта миокарда.
. Определить число повторных инфарктов миокарда.
. Провести анализ статистических данных по заболеваемости
инфарктом миокарда кардиореанимационного отделения МУЗ "ЦГБ" г.о.
Сызрань за 5 лет;
. Определить уровень смертности у больных с диагнозом
"инфаркт миокарда"
Объект исследования: статистические данные кардиореанимационного
отделения МУЗ "ЦГБ" г.о. Сызрань.
1. История
изучения инфаркта миокарда
г. - Ж. Крювельер впервые описал патологоанатомические признаки инфаркта
миокарда.
г. - А. Хаммером поставлен первый прижизненный диагноз.
-1891 гг. - Ф. Ф. Меринг (1883), Е. Лейден (1884), Г. Куршманн (1891)
осуществили единичные случаи прижизненной диагностики.
г. 19 декабря - В. П. Образцов и Н. Д. Стражеско сделали доклад "К
симптоматологии и диагностике тромбоза венечных артерий сердца" на I
съезде российских терапевтов в Москве. Материалом для доклада послужили
наблюдения авторов, сделанные в 1899-1908 гг. над тремя больными.
г. - Х. Хохгаус публикует в журнале "Deutsche medizinische
Wochenschrift" наблюдения, в которых, основываясь на описанной В. П.
Образцовым и Н. Д. Стражеско симптоматологии, поставил прижизненный диагноз ИМ
у четырех больных.
г. - Дж. Херрик в своей газете описал случаи прижизненной диагностики ИМ.
г. - Дж. Херрик и Ф. Смит дали описание ЭКГ-признаков при
экспериментальном ИМ.
г. - Г. Парди описал ЭКГ-признаки ИМ в клинической практике.
г. - Дж. Верн описал клинико-патологоанатомические параллели у 19
пациентов с ИМ.
г. - Дж. Паркинсон и Г. Бэдфорд подвели итоги своих исследований у 100
пациентов с ИМ в журнале "Lancet" - самом известном и авторитетном
медицинском издании Великобритании.
г. - С. Левайн описал группу из 145 своих пациентов с острым ИМ в первой
книге, полностью посвященной этой проблеме. Он выяснил частоту и риск
осложнений, возникающих вследствие различных аритмий, предложил медсестрам
внимательно следить за частотой и ритмом сердца. При использовании стетоскопа
они могли быстрее диагностировать аритмии и начинать их лечение в отсутствие
врача. Это было исключительно важное предложение, которое предвосхитило создание
отделений интенсивной терапии в будущем.
г. - ИМ "узаконен" как причина гибели пациентов в
"Международной классификации причин смерти".
г. - П. Уайт констатирует: "Специфического лечения (ИМ - авт.) не
существует - постельный режим должен быть назначен на протяжении нескольких
недель или месяцев". Летальность в эти годы составляла 40 %.
г. - Ч. Волфкрат и Ф. Вуд предложили использовать систему дополнительных
отведений ЭКГ, что улучшило диагностику ИМ и, соответственно, значительно
увеличило количество зарегистрированных ИМ.
г. - У. Док в статье "Злые последствия полного постельного
покоя" делает вывод: "Врачи должны всегда учитывать, что полный
постельный покой является глубоко антифизиологичной и определенно опасной
формой лечения".
-40-е гг. - проходили дискуссии по поводу двигательного режима, сроков
выписки и реабилитации.
-е гг. - становится очевидным, что ИМ является самой распространенной
патологией во всем мире.
г. - С. Левайн и Г. Лоун предложили "сидячее лечение" ИМ. На то
время это была революционная идея, вызвавшая большие споры.
Конец 50-х - начало 60-х гг. - разработаны методики коронарографии и
сердечно-легочной реанимации, дефибрилляции (М. Соунс, У. Коунховен, П. Золл,
В. Неговский). Это позволило улучшить прижизненную диагностику степени поражения
мыщцы сердца и увеличить выживаемость за счет проведения реанимационных
мероприятий.
г. - сообщение А. Флетчера и соавторов о первом применении стрептокиназы
с целью растворения тромба и уменьшения зоны поражения при ИМ.
г. 16 июля - Д. Юлианом в газете Торакального Научного общества
Великобритании предложена концепция отделения интенсивной терапии. Его статья
начиналась так: "Все палаты, принимающие пациентов с острым инфарктом
миокарда, должны иметь систему, где звуковой сигнал извещает об изменениях
сердечных ритмов и автоматически записывает это на ЭКГ. 1960-80-е гг. - начало
выработки современных стратегий лечения ИМ, внедрения новых лекарственных
препаратов для ограничения зоны поражения сердечной мышцы, предупреждения и
лечения осложнений.
г. - М. Де Вуд и соавторы доказали, что в основе возникновения ИМ лежит
острая закупорка тромботическими массами коронарной артерии. Это дало старт для
повсеместного внедрения тромболитической терапии.
Начало 80-х гг. - парламент Италии принял решение о проведении первого
широкомасштабного изучения влияния тромболитической терапии на выживаемость
пациентов в зависимости от времени начала лечения.
-е гг. - начало исследований, основанных на принципах доказательной
медицины (см. с. 74). Снижение летальности: в Англии - на 22 %, в Австрии и
Японии - на 32 %, в США - на 37 %.
-е гг. - начало XXI в. - начало внедрения догоспитального тромболизиса и
чрезкожного коронарного вмешательства, что снизило летальность до 3,3-6,7 %.
2. Анатомия
миокарда
Миокард состоит из клеток - кардиомиоцитов, они, подобно скелетной
мускулатуре, имеют поперечную исчерченность, но, в отличие от них, имеет всего
одно или два ядра, расположенных в центре клетки. Вокруг каждого кардиомиоцита
- соединительная ткань, богатая сетью капилляров.
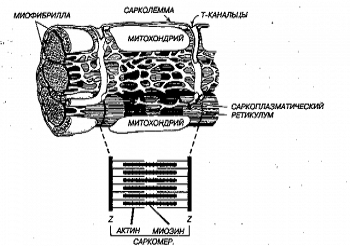
Рисунок 1. Схематическое представление ультраструктуры клетки миокарда
Каждая миокардиальная клетка состоит из миофибрилл, которые состоят из
длинных цепей индивидуальных саркомеров - основных сократительных единиц клетки.
Каждый саркомер состоит из нитевидных структур - перекрывающихся филаментов,
образованных сократительными белками - актином и миозином. Саркомеры в каждой
миокардиальной клетке располагаются последовательно, что придаёт волокнам
поперечно-полосатую исчерченность.
Клетка состоит из множества параллельных миофибрилл, окруженных
митохондриями. Т-канальцы представляют собой впячивания клеточной мембраны
(сарколеммы), увеличивающие поверхность клетки для транспорта ионов и
проведения электрического импульса. Внутриклеточный саркоплазматический
ретикулум содержит основную часть внутриклеточного кальция и связан с Т -
канальцами. Внизу.
Каждая миофибрилла состоит из серии соединяющихся между собой саркомеров,
границами которых служат Z-линии. Саркомер состоит из чередующихся тонких
(актин) и толстых (миозин) миофиламентов. Мембрана миокардиальных клеток
называется сарколеммой. Кардиомиоцит имеет особый участок мембраны (сарколеммы)
- вставочный диск. Это сложные мостики, соединяющие волокна сердца, образуя структурную
и электрическую связь между клетками.
Другой особенностью кардиомиоцитов является наличие глубоких пальцевидных
впячиваний в сарколемму поперечных канальцев (или Т-канальцы). Они увеличивают
площадь поверхности сарколеммы с внешней средой, обеспечивая быстрый и
синхронный трансмембранный транспорт ионов в процессе возбуждения и сокращения.
Саркоплазматический ретикулум представляет собой обширную внутриклеточную сеть
мембранных канальцев, объединенных с Т-канальцевой системой. Здесь содержится
внутриклеточный кальций, высвобождение которого является важным звеном
передачи возбуждения через мембрану и начала сокращения мышечного аппарата.
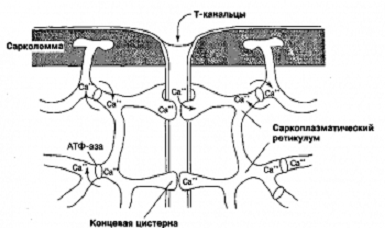
Рисунок 2. Схема канальцевых систем кардиомиоцита.
Для обслуживания огромных метаболических потребностей сердца -
образования АТФ между отдельными миофибриллами расположено огромное количество
митохондрий, которые занимают около 35% объёма клетки.
Т-канальцы, образованные впячиванием сарколеммы, под прямым углом
присоединяются к концевым цистернам саркоплазматического ретикулума. Такая
связь имеет важное значение для высвобождения кальция из саркоплазматического
ретикулума под действием электрического возбуждения на мембране.
3. Физиология
миокарда
Функция сердца - ритмическое нагнетание крови из вен в артерии, то есть
создание градиента давления, вследствие которого происходит её постоянное
движение. Это означает, что основной функцией сердца является обеспечение
кровообращения сообщением крови кинетической энергии. Сердце поэтому часто
ассоциируют с насосом. Его отличают исключительно высокие производительность,
скорость и гладкость переходных процессов, запас прочности и постоянное
обновление тканей.
Для обеспечения нормального существования организма в различных условиях
сердце может работать в достаточно широком диапазоне частот. Такое возможно
благодаря некоторым свойствам, таким как:
Автоматия сердца - это способность сердца ритмически сокращаться под
влиянием импульсов, зарождающихся в нем самом. Описана выше.
Возбудимость сердца - это способность сердечной мышцы возбуждаться от
различных раздражителей физической или химической природы, сопровождающееся
изменениями физико - химических свойств ткани.
Проводимость сердца - осуществляется в сердце электрическим путем
вследствие образования потенциала действия в клетках пейс-мейкерах. Местом
перехода возбуждения с одной клетки на другую, служат нексусы.
Сократимость сердца - сила сокращения сердечной мышцы прямо
пропорциональна начальной длине мышечных волокон
Рефрактерность миокарда - такое временое состояние не возбудимости
тканей.
Нагнетание крови обеспечивается посредством попеременного сокращения
(систола) и расслабления (диастола) миокарда. Волокна сердечной мышцы
сокращаются вследствие электрических импульсов (процессов возбуждения),
образующихся в мембране (оболочке) клеток. Эти импульсы появляются ритмически в
самом сердце. Свойство сердечной мышцы самостоятельно генерировать
периодические импульсы возбуждения называется автоматией.
Мышечное сокращение в сердце - хорошо организованный периодический
процесс. Функция периодической (хронотропной) организации этого процесса
обеспечивается проводящей системой.
В результате ритмического сокращения сердечной мышцы обеспечивается
периодическое изгнание крови в сосудистую систему. Период сокращения и
расслабления сердца составляет сердечный цикл. Он складывается из систолы
предсердий, систолы желудочков и общей паузы. Во время систолы предсердий
давление в них повышается от 1-2 мм рт. ст. до 6-9 мм рт. ст. в правом и до 8-9
мм рт. ст. в левом. В результате кровь через предсердно-желудочковые отверстия
подкачивается в желудочки. У человека кровь изгоняется, когда давление в левом
желудочке достигает 65-75 мм рт. ст., а в правом - 5-12 мм рт. ст. После этого
начинается диастола желудочков, давление в них быстро падает, вследствие чего
давление в крупных сосудах становится выше и полулунные клапаны захлопываются.
Как только давление в желудочках снизится до 0, открываются створчатые клапаны
и начинается фаза наполнения желудочков. Диастола желудочков заканчивается
фазой наполнения, обусловленной систолой предсердий.
Длительность фаз сердечного цикла - величина непостоянная и зависит от
частоты ритма сердца. При неизменном ритме длительность фаз может нарушаться
при расстройствах функций сердца.
Сила и частота сердечных сокращений могут меняться в соответствии с
потребностями организма, его органов и тканей в кислороде и питательных
веществах. Регуляция деятельности сердца осуществляется нейрогуморальными
регуляторными механизмами.
Сердце обладает и собственными механизмами регуляции. Одни из них связаны
со свойствами самих волокон миокарда - зависимостью между величиной ритма
сердца и силой сокращения его волокна, а также зависимостью энергии сокращений
волокна от степени растяжения его во время диастолы.
Упругие свойства материала миокарда, проявляемые вне процесса активного
сопряжения, называют пассивными. Наиболее вероятные носители упругих свойств -
опорно-трофический остов (в особенности - коллагеновые волокна) и
актомиозиновые мостики, имеющиеся в определенном количестве и в пассивной
мышце. Вклад опорно-трофического остова в упругие свойства миокарда возрастает
при склеротических процессах. Мостиковый компонент жесткости увеличивается при
ишемической контрактуре и воспалительных заболеваниях миокарда.
4. Основные
понятия инфаркта миокарда
Инфаркт миокарда является одной из форм некротического поражения
сердечной мышцы, которое вызывается острой недостаточностью тока крови по
сердечным артериям. Недостаточность венечного кровотока может быть вызвана либо
с внезапной приостановкой притока крови по артерии сердца, либо несоответствием
между возможностью венечных сосудов обеспечивать потребность миокарда в
кислороде и этой потребностью. Анатомической основой инфаркта миокарда у 98%
больных является состояние атеросклероза венечных сосудов. Внезапное нарушение
сердечного кровообращения, которое приводит к развитию инфаркта миокарда, может
возникнуть при стенозе венечной артерии из-за резко выраженного атеросклероза
или при образовании большой атеросклеротической бляшки, при резком увеличении
нагрузки на сердечную мышцу и повышении потребности миокарда в кислороде, в
результате облитерации просвета сосуда тромбом, при резком повышении нагрузки
на мышцу сердца и повышении потребности миокарда в поступлении кислорода, у
молодых людей в связи с нарушениями нервно-гуморального характера при спазме
коронарных сосудов на фоне умеренного атеросклероза.
Чаще всего инфаркт миокарда развивается при тромбозе коронарных сосудов.
Образование тромба в венечном сосуде обычно бывает связано с общими нарушениями
(уменьшение содержания в крови фибринолизина, гепарина и снижение возможности
их компенсаторного увеличения; повышение содержания свёртывающих факторов) и
местными изменениями (изъязвление или распад атеросклеротической бляшки,
возникновение шероховатостей на оболочке сосуда, замедление кровотока,
появление завихрений и т. д.). Иногда инфаркт миокарда возникает вслед за
повышением обычной для больного деятельности. В связи с повышением нагрузки
сердцу требуется усиленное поступление питательных веществ и кислорода. Но
подвергшиеся атеросклеротическим изменениям венечные артерии не способны
ответить адекватным повышением кровотока, что способствует развитию ишемии, а
иногда инфаркта миокарда.
4.1 Классификация
инфаркта миокарда
Существует несколько классификаций инфаркта миокарда:
по анатомии поражения (трансмуральный, интрамуральный,
субэндокардиальный, субэпикардиальный);
по локализации очага некроза (инфаркт миокарда левого желудочка, инфаркт
миокарда правого желудочка, изолированный инфаркт миокарда верхушки сердца,
септальный - инфаркт миокарда межжелудочковой перегородки, сочетанные
локализации);
по объему поражения (крупноочаговый (Q-инфаркт), мелкоочаговый (не
Q-инфаркт))
по стадиям развития (острейший, острый, подострый и период рубцевания).
В зависимости от площади поражения выделяют два типа инфаркта:
. Крупноочаговый инфаркт, трансмуральный (некроз, захватывающий все слои
миокарда), Q-инфаркт. Для данного типа характерна следующая картина ЭКГ

Рисунок
3. А - электрод, регистрирует зубец Q, Б - электрод, направленный на
регистрацию зубца R).
Измеряя
амплитуду зубцов R и Q, можно определить глубину поражения сердца в зоне
инфаркта. Существует деление крупноочагового инфаркта миокарда на
трансмуральный (в этом случае R-зубец будет отсутствовать) и субэпикардиальный.
При трансмуральном инфаркте миокарда регистрируется комплекс QS хотя бы в одном
из следующих отведений: aVL, I, II, III, aVF или QR (если Q больше 0,03 сек и
Q/R больше 1/3 зубца R во II, III, aVF).
.
Мелкоочаговый инфаркт (не Q-инфаркт).
Выделяют
два типа мелкоочагового инфаркта. Первый тип - субэндокардиальный инфаркт
(некроз участков сердца, прилегающих к эндокарду) (рис. 4).
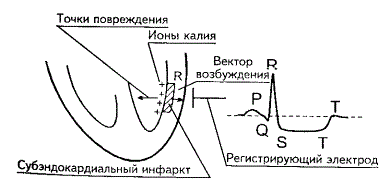
Рисунок
4. Субэндокардиальный инфаркт.
Основным
ЭКГ- признаком субэндокардиального инфаркта является смещение сегмента S-T ниже
изоэлектрической линии, при этом не регистрируется патологический Q зубец в
отведениях aVL и I.
Второй
тип мелкоочагового инфаркта - интрамуральный (омертвление стенки миокарда, но
при этом эндокард и эпикард не повреждены)
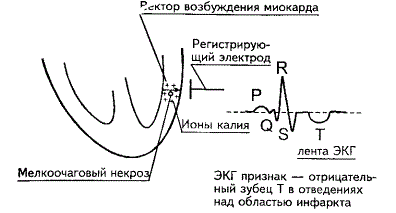
Рисунок
5. Интрамуральный инфаркт миокарда
Крупноочаговый
инфаркт имеет определенную стадийность и включает в себя следующие этапы:
.
Острейший - продолжается несколько минут или часов от развития ишемии до
возникновения некроза. Наблюдается неустойчивое артериальное давление. Возможны
боли. Отмечается артериальная гипертензия, иногда - снижение артериального
давления. Высока вероятность фибрилляции желудочков.
.
Острый - период, в течение которого образуется окончательный участок некроза,
происходит воспаление окружающих тканей и формируется рубец. Он длится от 2
часов до 10 дней (при затяжном и рецидивирующем течении - дольше). В этот
период происходит нарушение гемодинамики, которое может проявляться в виде
снижения артериального давления (чаще всего систолического) и доходить до
развития отека легких или кардиогенного шока. Ухудшение гемодинамики может привести
к нарушению кровоснабжения головного мозга, которое может проявляться в виде
неврологических симптомов, а у пожилых людей может вести и к нарушению психики.
В
первые дни инфаркта миокарда высока вероятность разрывов сердечной мышцы. У
больных с многососудистым стенозирующим поражением венечных артерий может
возникнуть ранняя постинфарктная стенокардия. В этот период на
электрокардиограмме будут видны следующие изменения:
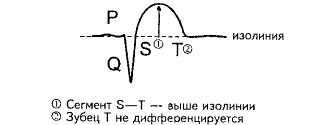
Рисунок
6. Ранняя постинфарктная стенокардия.
3.
Подострый - период, когда идет окончательное формирование рубца, замещается
некротическая ткань грануляционной. Это происходит до 4-5-й недели от начала
заболевания.
С
конца второй и до шестой недели заболевания может развиться постинфарктный
синдром (перикардит, плеврит, пневмония). В этот период на электрокардиограмме
будут видны следующие изменения:
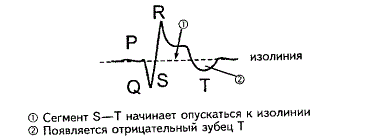
Рисунок
7. Постинфарктный синдром.
Период
рубцевания - после двух месяцев до двух-трех лет. Постинфарктный период -
период, когда окончательно формируется и уплотняется рубец, а сердце привыкает
к новым условиям работы. В этот период на электрокардиограмме видны следующие
изменения:
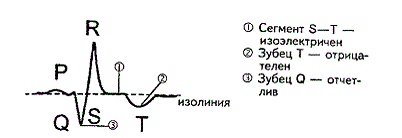
Рисунок
8. ЭКГ в период рубцевания
4.2 Причины
развития инфаркта миокарда
Основной причиной инфаркта миокарда является нарушение тока крови по
венечным артериям. Главными факторами развития данной патологии являются:
1. коронаротромбоз (острая закупорка просвета артерии), который
чаще всего ведет к крупноочаговому (трансмуральному) омертвлению стенок сердца;
2. коронаростеноз (острое сужение отверстия артерии
атеросклеротической бляшкой, тромбом), приводящий, как правило, к
крупноочаговому инфаркту миокарда;
. стенозирующий коронаросклероз (острое сужение просвета
нескольких венечных артерий), который приводит к мелкоочаговым, в основном
субэндокардиальным инфарктам миокарда.
В большинстве случаев инфаркт миокарда формируется на фоне атеросклероза,
артериальной гипертензии и сахарного диабета. Не последнюю роль в развитии
инфаркта миокарда играет курение, а также малоактивный образ жизни и ожирение. Провоцировать инфаркт миокарда могут состояния, повышающие
потребность миокарда в кислороде:
нервное перенапряжение,
чрезмерное физическое напряжение,
волнение,
перепады атмосферного давления,
оперативное вмешательство (реже).
Толчком к началу патологических изменений может служить охлаждение,
поэтому отмечается сезонность в возникновении инфаркта миокарда. Наибольший
процент заболеваемости наблюдается в зимние месяцы с низкими температурами,
наименьший - в летние.
Однако чрезмерная жара также может способствовать развитию данной
патологии. Увеличивается количество случаев инфаркта миокарда и после
эпидемических вспышек гриппа.
4.3 Клиника
инфаркта миокарда
инфаркт миокард диагностика лечение
1-ый острейший период (болевой) - до 2-х суток.
Заболевание протекает циклически, необходимо учитывать период болезни.
Чаще всего инфаркт миокарда начинается с болей за грудиной, нередко носящих
пульсирующий характер. Характерна обширная иррадиация болей: в руки, спину,
живот, голову и т.д. Больные беспокойны, тревожны, отмечают чувство страха
смерти. Часто присутствуют признаки сердечной и сосудистой недостаточности -
холодные конечности, липкий пот и др. Болевой
синдром длительный, нитроглицерином не купируется. Возникают различные
расстройства ритма сердца, падение АД. Перечисленные выше признаки характерны
для острейшего или болевого или ишемического первого периода. Объективно в этот
период можно найти:
увеличение АД;
увеличение частоты сердечных сокращений;
при аускультации иногда слышен патологический IV тон;
биохимических изменений в крови практически нет;
характерные признаки на ЭКГ.
-ой острый период (лихорадочный, воспалительный) - до двух недель.
Характеризуется возникновением некроза на месте ишемии. Появляются признаки
асептического воспаления, начинают всасываться продукты гидролиза некротических
масс. Боли как правило проходят. Самочувствие больного постепенно улучшается,
но сохраняется общая слабость, недомогание, тахикардия. Тоны сердца глухие.
Повышение температуры тела, обусловленное воспалительным процессом в миокарде,
обычно небольшое - до 38, появляется обычно на 3-й день заболевания. К концу
первой недели температура, как правило, нормализуется.
При исследовании крови во II периоде обычно находят:
лейкоцитоз, возникает к концу первых суток. Умеренный, нейтрофильный (
10-15 тыс. ), со сдвигом до палочек;
эозинофилы отсутствуют или эозинопения;
постепенное ускорение РОЭ с 3-5 дня заболевания, максимум - ко второй
неделе. К концу первого месяца приходит к норме.
появляется С-реактивный белок, который сохраняется до четырех недель;
повышается активность трансаминаз, особенно АСТ, через 5-6 часов и
держится 3-5-7 дней, достигая 50 Ед. В меньшей степени увеличивается
глутаминовая трансаминаза, которая возвращается к норме на 10 сутки. Повышается
также активность и лактатдегидрогеназы. Исследования последних лет показали,
что более специфичной по отношению к сердцу является креатинфосфокиназа, ее
активность растет при инфаркт миокарда до 4 Ед на 1 мл и сохраняется на высоком
уровне 3-5 дней. Считается, что существует прямая взаимосвязь между количеством
КФК и обширностью зоны некроза сердечной мышцы.
Признаки инфаркта миокарда четко представлены на ЭКГ:
. При проникающем инфаркте миокарда (т.е. зона некроза от перикарда до
эндокарда; трансмуральный):
смещение сегмента ST выше изолинии, форма выпуклая кверху - первый
признак проникающего инфаркта миокарда;
слияние зубца Т с сегментом ST - на 1-3 день;
глубокий и широкий зубец Q - основной главный признак;
уменьшение величины зубца R , иногда форма QS;
характерные дискордантные изменения - противоположные смещения ST и T (
например, в I и II стандартных отведениях по сравнению с изменением в III
стандартном отведении );
в среднем с 3-его дня наблюдается характерная обратная динамика изменений
ЭКГ: сегмент ST приближается к изолинии, появляется равномерный глубокий Т.
Зубец Q также приобретает обратную динамику. Но присутствуют измененный Q и
глубокий Т.
. При интрамуральном инфаркте миокарда:
нет глубокого зубца Q, смещение сегмента ST может быть не только вверх,
но и вниз.
Для правильной оценки важно повторное снятие ЭКГ. Хотя ЭКГ-признаки очень
помогают диагностике, диагноз должен опираться на все критерии диагностики
инфаркта миокарда:
клинические признаки;
ЭКГ-признаки;
биохимические признаки.
-ий подострый или период рубцевания - длится 4-6 недель. Характерным для
него является нормализация показателей крови. Нормализуется температура тела и
исчезают все признаки острого процесса. Изменяется ЭКГ. На месте некроза
развивается соединительнотканный рубец. Субъективно больной чувствует себя
здоровым.
-ый период реабилитации (восстановительный) - длится от 6 месяцев до 1
года. Клинически никаких признаков нет. В этот период происходит компенсаторная
гипертрофия интактных кардиомиоцитов, развиваются другие компенсаторные
механизмы. Происходит постепенное восстановление функций миокарда, но на ЭКГ
сохраняется патологический зубец Q.
4.4 Атипичные
формы инфаркта миокарда
1. Абдоминальная форма: протекает по типу патологии ЖКТ - с болями в
подложечной области, животе, с тошнотой, рвотой. Чаще всего гастралгическая
форма инфаркта миокарда встречает при инфаркте задней стенки левого желудочка.
В целом это редкий вариант.
. Астматическая форма: начинается с сердечной астмы и провоцируется как
отек легких, как исход. Боли могут отсутствовать. Астматическая форма чаще
встречается у пожилых людей или при повторном инфаркте или при очень обширных
инфарктах миокарда.
. Мозговая форма: на первый план выступают симптомы нарушения мозгового
кровообращения по типу инсульта( с потерей сознания ). Встречается чаще у
пожилых людей с атеросклерозом сосудов головного мозга.
. Немая или безболевая форма: иногда выявляется случайно при диспансеризации.
Вдруг "стало дурно", возникает резкая слабость, липкий пот. Затем все
кроме слабости проходит. Такая ситуация характерна в пожилом возрасте и при
повторных инфарктах миокарда.
. Аритмическая форма: главный признак - пароксизмальная тахикардия. Болевой
синдром может отсутствовать.
4.5
Диагностика инфаркта миокарда
Диагноз инфаркта миокарда ставится на основании анамнеза, клинической
картины заболевания, патогномоничных изменений ЭКГ, активности ферментов крови. Анамнез и клиническая картина считаются типичными при наличии
тяжелого и продолжительного приступа загрудинной боли (более 30-60 мин). Иногда
анамнез и клиника бывают атипичными - ангинозная боль выражена умеренно или
отсутствует совсем. Преобладающими могут быть другие симптомы - нарушение ритма
и проводимости, острая сердечная недостаточность. К патогномоничным изменениям ЭКГ относятся характерная динамика изменений
сегмента ST или зубца Т, сохраняющаяся более 1 сут (смещение сегмента ST выше
изолинии с последующим снижением его и формированием отрицательного зубца Т, а
также образование патологического стойко сохраняющегося зубца Q или комплекса
QRS). Ферменты сыворотки крови. Характерно
первоначальное повышение уровня ферментов сыворотки не менее чем на 50 % выше
верхней границы нормы с последующим снижением. Изменения должны быть четко
соотнесены с конкретным ферментом и временем, прошедшим с момента появления
первых симптомов до момента взятия крови. Повышение уровня ферментов без
последующего снижения не патогномонично для инфаркта миокарда. Диагноз "крупноочаговый (трансмуральный) инфаркт
миокарда" ставится на основании патогномоничных изменений ЭКГ
(патологического зубца Q или QS) и гиперферментемии даже при нетипичной
клинике. Диагноз "мелкоочаговый
(субэндокардиальный, интрамуральный) инфаркт миокарда" ставится в случае
развивающихся в динамике изменений сегмента ST или зубца Т (без патологических
изменений комплекса QRS) при наличии типичных изменений уровня ферментов в
крови.
4.5.1
Программа обследования
1. Тщательный анализ жалоб больного. Обратить внимание на следующие
характерные особенности:
.1. Наличие приступа боли с преимущественной локализацией за грудиной
продолжительностью более 20 мин, отличающегося от прежних приступов
интенсивностью.
.2. Отсутствие лечебного эффекта от нитроглицерина в отличие от прежних
приступов стенокардии.
.3. Сопровождение боли потливостью, слабостью, тошнотой, рвотой, чувством
нехватки воздуха.
.4. Более широкая иррадиация боли по сравнению с прежними приступами
стенокардии.
.5. Волнообразные нарастания боли.
.6. Повышение температуры тела на следующий день после приступа.
.7. При осложнении острой левожелудочковой недостаточностью - резкая
одышка, кашель с выделением пенистой розовой мокроты, "оральные"
хрипы.
.8. Наличие жалоб, обусловленных возможным кардиоген-ным шоком
(сильнейшая слабость, холодный липкий пот, с похолоданием дистальных отделов
конечностей и олиго-, анурия).
. Тщательный анализ данных анамнеза.
.1. Уточнить, является ли данный болевой приступ первым или ему
предшествовала недавно возникшая стенокардия напряжения и покоя. Имеет ли место
нарастание частоты, интенсивности и продолжительности давней стенокардии
напряжения (прогрессирующая стенокардия) или "ночная" стенокардия
покоя.
.2. Наличие инфаркта миокарда в прошлом, его локализация, тяжесть и
последствия.
.3. Наличие в анамнезе признаков недостаточности кровообращения, степень
их выраженности, эффективность предшествующей терапии.
.4. Наличие факторов риска (см. Факторы риска ИБС).
. Осмотр больного.
.1. Поведение больного, возможны беспокойство, возбуждение, чувство
страха смерти, крики, стоны или, наоборот, адинамия, прострация, спокойное
поведение.
.2. Состояние кожи и слизистых оболочек, цвет кожи. Возможны повышенная
потливость, холодный липкий пот на фоне резкой бледности кожи и цианоза
слизистых оболочек, акроцианоза, диффузного цианоза.
.3. Наличие периферических отеков, их давность.
.4. Число дыханий в минуту.
. Клиническое всестороннее обследование больного. Целенаправленный поиск
следующих осложнений инфаркта миокарда.
.1. Сердечная недостаточность (одышка, цианоз, набухание вен шеи,
тахикардия, эмбриокардия, галоп, влажные хрипы в легких, увеличение печени).
.2. Перикардит (боль в области сердца при дыхании, шум трения перикарда).
.3. Нарушения ритма (экстрасистолия, наджелудочковая тахикардия и
тахиаритмия, брадикардия, брадиаритмия).
.4. Признаки поражения сосочковых мышц (появление систолического шума на
верхушке сердца, акцента II тона на легочной артерии, одышки).
.5. Признаки перфорации перегородки (одышка, цианоз, систолический шум
пилящего характера над телом рукоятки грудины и слева от нее, признаки
недостаточности кровообращения по большому кругу).
.6. Наличие признаков кардиогенного шока (см. Кардиогенный шок).
. Лабораторные исследования.
.1. OAK. в динамике.
.2. БАК: АсАТ, АлАТ повторно в динамике от 1 до 7 сут, КФК (с первых
часов до 3-4-х сут), ЛДГ (с первых суток до 2-3 нед).
.3. Сахар, мочевина, билирубин, холестерин, триглицериды, альфа-амилаза,
миоглобин в крови и моче.
.4. Электролиты крови, кислотно-щелочное равновесие.
.5. Коагулограмма.
. Инструментальные исследования.
.1. ЭКГ-исследование с дополнительными отведениями и картированием сердца
(по показаниям).
.2. Рентгенография органов грудной клетки (при подозрении на осложнение
пневмонией, инфарктом легкого, застойными явлениями в малом круге).
.3. Эхокардиографическое исследование по показаниям (оценка объема и
размера ИМ, а также сократительной способности миокарда).
.4. Сцинтиграфия с 99мТс (для подтверждения диагноза инфаркта миокарда в
трудных случаях и оценки размеров инфаркта).
.5. Круглосуточное мониторное наблюдение.
4.5.2
Экспресс-тесты для определения миокардиальных маркеров
Современная диагностика инфаркта миокарда практически невозможна без
определения миокардиальных маркеров (ММ). Общепризнано, что ЭКГ-критерии
диагностики инфаркта миокарда недостаточны (при инфаркте миокарда почти в 50%
случаев ЭКГ-данные могут быть диагностически незначимыми). Наиболее ранним
миокардиальным маркером по времени резкого увеличения концентрации (в первые 2…4
часа с момента появления клинических симптомов), но наименее специфичным
является миоглобин.
Главными критериями биохимической диагностики инфаркта миокарда являются
подъем (в течение первых 4…24 часов), и последующее постепенное снижение (до
двух недель) концентрации сывороточного тропонина Тн, или подъем и более раннее
снижение концентрации креатинкиназы МВ. "Золотым стандартом" в
современной биохимической диагностике инфаркта миокарда признано определение
Тн, обладающего практически абсолютной миокардиальной специфичностью.
Тесты для
качественного бесприборного определения миокардиальных маркеров производства
компаний Veda.Lab (Франция), HUMAN (Германия)
- тропонин I (проба - сыворотка, плазма или цельная кровь;
чувствительность - 1 нг/мл)
миоглобин (проба - сыворотка, плазма, цельная кровь; чувствительность
-100 нг/мл)
креатинкиназа МВ (проба - сыворотка, плазма; чувствительность - 7 нг/мл)
Особенности:
анализ в автомобиле "скорой помощи", в реанимационном
отделении, в лаборатории, у постели пациента (по месту лечения)
индивидуальные тест-системы с визуальным учётом результатов
высокоспецифичный иммунохроматографический метод
время исследования - не более 20 минут от момента внесения пробы в
тест-систему (для миоглобина - не более 10 минут)
объём пробы - не более 50 мкл
все необходимое включено в наборы: тест-системы, флакон с буфером для
разведения проб (для миоглобина), пипетки
встроенный контроль выполнения теста
простая процедура, не требующая специального оборудования
4.6
Дифференциальная диагностика инфаркта миокарда
Таблица 1. Дифференциальная диагностика боли в
груди.
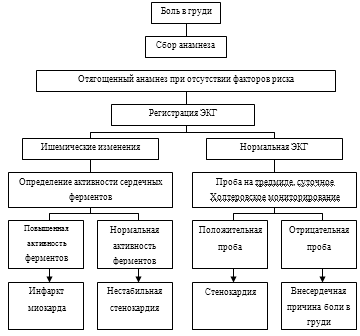
1. Стенокардия:
при инфаркте боли носят нарастающий характер;
большая интенсивность болей при инфаркте;
при инфаркте миокарда больные беспокойны, возбуждены;
при стенокардии - заторможены;
при инфаркте отсутствует эффект от нитроглицерина;
при инфаркте боли длительные, иногда часами. Более 30 минут;
при стенокардии четкая иррадиация, при инфаркте - обширная;
наличие сердечно-сосудистой недостаточности более свойственно инфаркту
миокарда;
окончательная диагностика по ЭКГ, ферментам.
. Острая коронарная недостаточность:
Это затянувшийся приступ стенокардии с очаговой дистрофии миокарда, т.е.
промежуточная форма.
длительность боли от 15 мин. до 1 часа, не более;
при обеих отсутствует эффект от нитроглицеринов;
изменения ЭКГ характеризуются смещением сегмента ST ниже изоуровня,
появляется отрицательный зубец Т. В отличии от стенокардии: приступ прошел, а
изменения на ЭКГ остаются. В отличии от инфаркта: изменения ЭКГ держатся только
1-3 дня и полностью обратимы;
нет повышения активности ферментов, т.к. нет некроза.
. Перикардит: болевой синдром сходен с таковым при инфаркте миокарда.
боль длительная, постоянная, пульсирующая, но нет нарастающего волнообразного
нарастания болей;
нет предвестников ( стабильной стенокардии );
боли четко связаны с дыханием и положением тела;
признаки воспаления ( повышение температуры, лейкоцитоз ) появляются не
после начала болей, а предшествуют или появляются вместе с ними;
шум трения перикарда, сохраняется долго;
на ЭКГ: смещение сегмента ST выше изолинии, как и при инфаркте миокарда,
но нет дискордантности и патологического зубца Q - главного признака инфаркта
миокарда. Подъем сегмента ST происходит практически во всех отведениях, т.к.
изменения в сердце носят диффузный характер, а не очаговый как при инфаркте
миокарда.
При перикардите, при возвращении сегмента ST на изолинию, зубец Т
остается положительным, при инфаркте - отрицательным.
. Эмболия ствола легочной артерии (как самостоятельное заболевание, а не
осложнение инфаркта миокарда).
1. возникает остро, резко ухудшается состояние больного;
2. острые загрудинные боли, охватывающие всю грудную клетку;
. при эмболии на первый план выступает дыхательная
недостаточность;
причиной эмболии бывает мерцательная аритмия, тромбофлебит, оперативные
вмешательства на органах малого таза;
чаще наблюдается эмболия правой легочной артерии, поэтому боли чаще
отдают вправо;
признаки острой сердечной недостаточности по правожелудочковому типу
ЭКГ напоминает инфаркт миокарда в правых V1, V2, есть признаки перегрузки
правого сердца, может быть блока да правой ножки пучка Гисса. Эти изменения
исчезают через 2-3 дня;
эмболия часто приводит к инфаркту легкого:
рентгенологически: затемнение клиновидной формы, чаще справа внизу.
. Расслаивающая аневризма аорты: чаще всего возникает у больных с высокой
артериальной гипертензией. Нет периода предвестников. Боли сразу носят острый
характер, кинжальные, характерно мигрирование болей по мере расслаивания. Боли
распространяются в поясничную область и нижние конечности. В процесс начинают
вовлекаться другие артерии - возникают симптомы окклюзии крупных артерий,
отходящих от аорты. Отсутствует пульс на лучевой артерии, может наблюдаться
слепота. На ЭКГ нет признаков инфаркта миокарда. Боли атипичны, не снимаются
наркотиками.
. Печеночная колика: необходимо дифференцировать с абдоминальной формой
инфаркта миокарда:
бывает чаще у женщин;
есть четкая связь с приемом пищи;
боли не носят нарастающего, волнообразного характера, чаще иррадиируют
вправо вверх;
часто повторная рвота;
локальная болезненность, однако это бывает и при инфаркте миокарда в
следствии увеличения печени;
помогает ЭКГ;
повышена ЛДГ-6, а при инфаркте - ЛДГ-1.
. Острый панкреатит:
тесная связь с едой, приемом жирного, сладкого, алкоголя;
опоясывающие боли;
повышенная активность ЛДГ-5;
повторная, часто неукротимая рвота;
помогает установление активности ферментов: амилаза мочи;
ЭКГ;
. Прободная язва желудка:
на рентгенограмме - воздух в брюшной полости ("надпеченочный
серп");
. Острый плеврит: связь с дыханием.
шум трения плевры;
воспалительная реакция организма с самого начала заболевания;
. Острые корешковые боли: (рак, туберкулез позвоночника, радикулит):
боли, связанные с положением тела.
. Спонтанный пневмоторакс:
признаки дыхательной недостаточности;
коробочный перкуторный тон;
отсутствие дыхания при аускультации (не всегда).
. Диафрагмальная грыжа:
боли связаны с положением тела;
боли проявляются после приема пищи;
тошнота, рвота;
может быть высокий тимпанит при перкуссии сердца;
. Крупозная пневмония: в случает захвата патологическим процессом
медиастенальной плевры могут быть боли за грудиной.
данные со стороны легких;
высокая лихорадка;
помогают ЭКГ и рентгенограмма;
4.7 Прогноз у
больных с инфарктом миокарда
В среднем около 30% инфарктов миокарда заканчивается летально до
госпитализации в течение первого часа с момента появления симптомов.
Госпитальная смертность в течение первых 28 дней инфаркта миокарда составляет
13-28%. 4-10% больных умирают в течение 1-го года после инфаркта миокарда
(среди лиц старше 65 лет смертность в течение 1-го года составляет 35%). Более
благоприятный прогноз у больных при раннем тромболизисе и восстановлении
кровотока в венечных артериях, при инфаркте миокарда нижней стенки левого
желудочка, сохранённой систолической функции левого желудочка, а также при
применении ацетилсалициловой кислоты, бета-адреноблокаторов, ингибиторов АПФ.
Менее благоприятен прогноз у больных с несвоевременной (запоздалой) и/или неадекватной
реперфузией или при её отсутствии, при снижении сократительной функции
миокарда, желудочковых нарушениях ритма сердца, большом размере инфаркта
миокарда (сахарный диабет, инфаркт миокарда в анамнезе), переднем инфаркте
миокарда, низком исходном АД, наличии отёка лёгких, значительной
продолжительности сохранения признаков ишемии миокарда на ЭКГ (подъёме или
депрессии сегмента ST), а также у больных пожилого возраста.
4.8
Осложнения инфаркта миокарда
К ранним осложнениям, развивающимся в первые дни заболевания, относятся
нарушения ритма и проводимости, кардиогенный шок, острая сердечная
недостаточность, разрывы сердца. К поздним, через 2-3 недели от начала
заболевания, относят постинфарктный синдром, хроническую недостаточность
кровообращения. Такие осложнения, как аневризма сердца, тромбоэмболии,
наблюдаются как в ранних, так и в поздних стадиях крупноочагового инфаркта
миокарда.
Нарушение ритма и проводимости сердца - наиболее частые осложнения
острого крупноочагового инфаркта миокарда. Иногда они могут быть первыми и
единственными проявлениями заболевания, особенно при повторных инфарктах
миокарда. При круглосуточном наблюдении на мониторах нарушения ритма и
проводимости регистрируются практически у всех больных в первые часы и сутки
заболевания и более чем у половины в последующие дни. Преобладает
экстрасистолия. Если на электрокардиограмме или при постоянном мониторировании
регистрируются политопные, групповые и ранние желудочковые экстрасистолы,
возникает опасность развития пароксизмальной желудочковой тахикардии и
фибрилляции желудочков. Примерно у четверти больных регистрируется предсердная
экстрасистолия, которая может быть предвестником пароксизмальной предсердной
тахикардии, мерцания или трепетания предсердий. У некоторых больных развивается мерцательная аритмия. Реже наблюдается
узловая предсердно-желудочковая тахикардия. Длительно существующая
пароксизмальная тахикардия или тахиаритмия ведет к образованию сердечной
недостаточности и аритмогенного шока. Наиболее тяжелые нарушения ритма - трепетание
и мерцание (фибрилляция) желудочков. Фибрилляция чаще развивается в связи с
тяжелыми некротическими изменениями значительной массы миокарда и, по существу,
является агональным ритмом.
При развитии крупноочагового инфаркта миокарда наблюдаются все виды
нарушений проводимости. Значительную опасность для больных представляет
предсердно-желудочковая блокада и особенно асистолия, которая может явиться
непосредственной причиной смерти.
Кардиогенный шок - одно из наиболее тяжелых осложнений инфаркта миокарда,
возникающее вследствие дезорганизации гемодинамики, ее нервной и гуморальной
регуляции и нарушения жизнедеятельности организма. Кардиогенный шок проявляется
расстройствами сознания, выраженной артериальной гипотензией, периферической
вазоконстрикцией с тяжелыми нарушениями микроциркуляции.
Основное значение в патогенезе кардиогенного шока имеет снижение
сократительной способности миокарда, в результате чего уменьшаются
систолический выброс и минутный объем сердца, артериальная перфузия коронарного
кровообращения. При этом повышается общее периферическое сопротивление,
особенно при реактивном шоке, что еще больше усугубляет нарушение гемодинамики.
Иногда общее периферическое сопротивление имеет тенденцию к снижению.
Гипотензия и артериальная гиповолемия приводят к развитию ацидоза,
отрицательно воздействующего на инотропную функцию миокарда. Гипоксия и ацидоз
повышают сосудистую проницаемость, вызывают расширение прекапиллярных артериол
и сужение посткапиллярных венул. Капиллярный объем крови резко увеличивается,
происходит секвестрация крови. В результате этого, а также вследствие
внутрисосудистого свертывания крови, агрегации тромбоцитов и лейкоцитов,
образования скопления эритроцитов и отложения фибрина резко нарушается
микроциркуляция.
Клинически определяется выраженная и длительная артериальная гипотензия.
Отмечаются бледная кожа, часто с цианотичным оттенком, иногда выраженный
акроцианоз, холодный пот, спавшиеся вены, малый частый пульс. При тяжелом
кардиогенном шоке наблюдаются функциональные нарушения функции почек,
характеризующиеся олигурией вплоть до развития анурии. Могут наблюдаться
различные нарушения ритма: тахи- или брадикардия, экстрасистолия,
предсердно-желудочковые блокады, мерцание и трепетание предсердий,
пароксизмальная тахикардия. Со стороны центральной и периферической нервной
системы наблюдаются психомоторное возбуждение или адинамия, спутанность
сознания или временная его потеря, расстройство кожной чувствительности,
изменение сухожильных рефлексов.
Сердечная недостаточность чаще всего проявляется в виде сердечной астмы и
отека легких, т. е. острой левожелудочковой недостаточностью, а также острой
недостаточностью правых отделов сердца - правожелудочковой недостаточностью.
Острая левожелудочковая недостаточность с явлениями сердечной астмы и
отека легких протекает особенно тяжело при инфаркте или разрыве сосочковой
мышцы. При крупноочаговом инфаркте миокарда, тем более трансмуральном, всегда
наблюдается латентная сердечная недостаточность.
Острая правожелудочковая недостаточность при крупноочаговом инфаркте
миокарда развивается редко. Клинически она проявляется увеличением печени,
которая становится болезненной при пальпации, набуханием шейных вен, развитием
более или менее выраженных отеков нижних конечностей.
В поздних стадиях течения инфаркта миокарда в постинфарктном периоде
может возникнуть хроническая недостаточность кровообращения.
Аневризма сердца развивается при трансмуральных обширных инфарктах
миокарда. Развивается ограниченное выпячивание стенки одной из камер сердца при
изменении контура сердца и увеличение его полости за счет выпячивания.
Аневризмы сердца бывают острыми, с развитием в первые недели инфаркта и
хроническими, развивающимися в поздние сроки вследствие выбухания рубцового
образования в мышце сердца. В большинстве случаев аневризмы поражают стенку
левого желудочка. В зависимости от формы различают диффузные, мешковидные и
грибовидные аневризмы.
Разрыв сердца представляет собой сквозное нарушение целости обычно всех
слоев сердца, возникающее, как правило, в результате обширного трансмурального
инфаркта миокарда. Внешний разрыв сердца составляет 10-15% всех причин смерти
при инфаркте миокарда. Внутренние разрывы (разрыв межжелудочковой перегородки,
отрыв капиллярной мышцы) выявляются значительно реже, чем внешние, не всегда
приводя к летальному исходу при инфаркте миокарда.
Больные старше 60 лет при развитии у них трансмурального инфаркта
миокарда, осложнившегося аневризмой, должны строго соблюдать охранительный
режим сердца в острый период болезни, так как наиболее подвергаются опасности
разрыва сердца. Смерть при разрыве сердца наступает чаще всего вследствие
рефлекторной остановки или тампонады сердца - сдавления сердца кровью,
заполнившей полость перикарда, в результате чего наступает его остановка. Если
у больного развивается прорыв в перикард, то наблюдается клиническая картина
шока. Длительность жизни больного исчисляется минутами, реже часами. В
последнем случае выражены признаки тампонады сердца: цианоз верхней половины
тела, а затем и всего туловища, резкое набухание шейных вен, малый частый
пульс, снижение артериального давления, смещение границ сердца.
Прижизненный диагноз разрыва сердца может быть поставлен в тех случаях,
когда у пожилого больного с обширным инфарктом миокарда, особенно с признаками
острой аневризмы сердца, отмечается длительное ангинозное состояние,
заканчивающееся обмороком с последующим развитием шока и признаков острой
тампонады сердца. При постоянном электрокардиографическом наблюдении в этих
случаях определенное время регистрируется синусовый ритм в отличие от
характерной ЭКГ-картины фибрилляции или асистолии желудочков. Кроме синусового
ритма может быть также предсердно-желудочковый ритм.
Разрыв межжелудочковой перегородки при обширном трансмуральном инфаркте
миокарда диагностируется по определенным клиническим проявлениям. При
аускультации отмечается грубый систолический, а возможно, и диастолический шум
в третьем и четвертом межреберьях слева от грудины или у верхушки сердца.
Появляется и нарастает острая недостаточность кровообращения по правожелудочковому
типу: набухают вены шеи, увеличивается печень, появляются периферические отеки.
На электрокардиограмме регистрируется картина перегрузки правых отделов сердца.
Возникают нарушения предсердно-желудочковой проводимости и
внутрижелудочковой проводимости. Летальность при этом виде осложнения почти
абсолютная.
Разрыв (отрыв) сосочковых мышц. Это осложнение характеризуется внезапным
появлением грубого систолического шума вследствие остро развивающейся
недостаточности митрального клапана. Одновременно развиваются признаки
кардиогенного шока и нарастает недостаточность кровообращения по
левожелудочковому типу. Длительность жизни больных не превышает суток.
Тромбоэмболические осложнения. Это частый вид осложнений, сопровождающих
развитие крупноочагового инфаркта миокарда. Они так же опасны для жизни
больного, как и развивающиеся аневризмы сердца с последующим его разрывом.
Тромбоэмболии могут произойти в любой артерии с развитием характерной
клинической картины. Могут быть тромбоэмболии легочных артерий, мезентериальных
сосудов, сосудов мозга, периферических артерий.
Постинфарктный синдром (синдром Дресслера). Это позднее осложнение
трансмурального инфаркта миокарда с характерной клинической триадой: диффузным
перикардитом, плевритом и пневмонией. При этом осложнении у больного
значительно повышается температура тела, в анализе крови отмечаются лейкоцитоз,
увеличение СОЭ, эозинофилия. В основе процесса лежит аутоаллергический
механизм, связанный с сенсибилизацией организма антигенами, поступающими из некротизированного
участка миокарда. Возникает синдром на 2-6-й неделе заболевания, хотя описаны
случаи более раннего и более позднего его развития.
При постинфарктном синдроме не всегда выражены все три признака. Чаще
более ярким клинически является один или два. В таких случаях говорят об
атипичных, или стертых, формах постинфарктного синдрома.
Кроме приведенных трех видов поражения в воспалительный процесс могут
вовлекаться синовиальные оболочки с упорными артралгиями, грудино-реберные
сочленения. Описаны случаи дерматитов, геморрагического васкулита, острого
гломерулонефрита. Существует так называемый синдром плеча и руки, проявляющийся
болью, ограничением подвижности в одном, чаще левом суставе.
Характерно рецидивирующее течение с периодами обострения и ремиссии.
Ремиссии возникают под влиянием лечения кортикостероидными гормонами. При
отмене этих лекарственных препаратов вновь возможно обострение заболевания.
Повторный инфаркт миокарда. При длительном хроническом течении
ишемической болезни сердца, на фоне постинфарктного кардиосклероза при
повторных тромбоэмболиях или эмболиях атеросклеротическими бляшками коронарных
артерий может развиться повторный инфаркт миокарда. Если возникает окклюзия уже
ранее поражавшейся коронарной артерии, повторный инфаркт миокарда развивается в
зоне предыдущих рубцов в миокарде, сформировавшихся после перенесенного первого
инфаркта миокарда. В очаге поражения также развиваются ишемия и некроз мышечной
ткани с соответствующей клиникой и диагностическими особенностями периодов. В
ряде случаев окклюзии подвергается одна и та же коронарная артерия. У таких
больных развиваются неоднократные повторные инфаркты миокарда с локализацией
некроза в одних и тех же областях сердечной мышцы. Но чаще, так как процесс
атеросклеротического повреждения с течением времени захватывает все новые и
новые сосуды, повторные инфаркты миокарда развиваются в бассейнах других ветвей
коронарных артерий. Если больной ранее перенес крупноочаговый инфаркт миокарда,
то повторный инфаркт миокарда может быть как крупноочаговым, так и
мелкоочаговым. В свою очередь больные, у которых в анамнезе отмечался
мелкоочаговый инфаркт миокарда, подвержены опасности развития у них
крупноочагового инфаркта миокарда. Повторные инфаркты миокарда могут развиться
через несколько месяцев или через много лет.
Клинически и по течению повторные инфаркты миокарда чаще не отличаются от
первого (или предыдущих). Но, так как атеросклеротическое поражение
сердечно-сосудистой системы прогрессирует, более выражен атеросклеротический
кардиосклероз, при повторных инфарктах миокарда чаще развиваются безболевые
формы. Более выражены явления острой сердечной недостаточности, развитие
тяжелых желудочковых тахиаритмий.
При типичной клинической картине развиваются ангинозные боли, могут быть
явления кардиогенного шока, развитие тахиаритмий.
Течение повторного инфаркта миокарда при любой форме его проявления имеет
классические периоды течения. Как и при первом инфаркте миокарда с течением
процесса изменяется картина электрокардиограммы, прослеживаются все фазы
патологических изменений в сердечной мышце, заканчивающиеся развитием
постинфарктного рубца. Могут быть диагностические затруднения при определении
мелких очагов некроза при развитии мелкоочагового повторного инфаркта миокарда
в зоне перенесенного ранее крупноочагового инфаркта миокарда.
Многократные повторные инфаркты миокарда, особенно крупноочаговые, ведут
к развитию сердечной недостаточности, нарушению в проводящей системе сердца,
часто развиваются все новые и новые формы аритмий и в конечном итоге они могут
стать причиной преждевременной смерти больного.
Кардиосклероз развивается при очаговом или диффузном разрастании
соединительной ткани в сердечной мышце после гибели в ней мышечных волокон. Как
правило, кардиосклероз является проявлением ишемической болезни. При этом
гибель мышечных волокон с замещением их соединительной тканью является
следствием коронарного склероза, который приводит к нарушению нормального
кровотока в венечных артериях с развитием ишемии и некроза мышечных волокон.
После инфаркта миокарда формируется очаговый постинфарктный кардиосклероз. Чаще
поражается левый желудочек. Обширность рубцовых полей зависит от величины зоны
инфаркта миокарда. Заместительный кардиосклероз наблюдается при стенозирующем
атеросклерозе венечных артерий сердца при отсутствии очаговых некротических
изменений в миокарде в силу постепенной, медленно развивающейся дистрофии,
атрофии и гибели отдельных мышечных волокон в связи с гипоксией и нарушением
метаболизма миокарда, сопровождающимися огрубением стромы.
Сердечная недостаточность является результатом снижения насосной функции
сердца. Она может быть острой и хронической, левого (левожелудочковая) и
правого (правожелудочковая) типов. При прогрессировании сердечной
недостаточности левого типа к ней присоединяется правожелудочковая сердечная
недостаточность, т.е. сердечная недостаточность становится тотальной.
Причиной сердечной недостаточности является атеросклеротическое или
постинфарктное атеросклеротическое поражение сердечной мышцы, приводящее к
нарушению сократительной способности миокарда. При преимущественном поражении
левых отделов сердца развивается сердечная недостаточность левого типа, при
преимущественном поражении правых отделов сердца - сердечная недостаточность
правого типа. При диффузном поражении миокарда, как правило, развивается
тотальная сердечная недостаточность с преимущественными симптомами
правожелудочковой недостаточности, так как в первую очередь нарушается
сократительная способность более слабых (правого по сравнению с левым) отделов
сердца.
Основным в патогенезе развития сердечной недостаточности считается
нарушение сократительной способности миокарда, являющееся следствием нарушений
обменных процессов в измененной патологическим состоянием сердечной мышце.
4.9 Лечение
инфаркта миокарда
4.9.1
Догоспитальный этап лечения
Неотложная терапия преследует несколько взаимосвязанных целей:
1. Купирование болевого синдрома.
2. Восстановление коронарного кровотока.
. Уменьшение работы сердца и потребности миокарда в кислороде.
. Ограничение размеров инфаркта миокарда.
. Лечение и профилактика осложнений инфаркта миокарда.
Применяемые для этого лекарственные средства представлены в приложение 1.
Подробно алгоритм оказания медицинской помощи больным острым инфарктом
миокарда на догоспитальном этапе рассмотрен в приложениях 2, 3, 4.
4.9.2
Госпитальный этап лечения
Реанимационный этап лечения инфаркта миокарда.
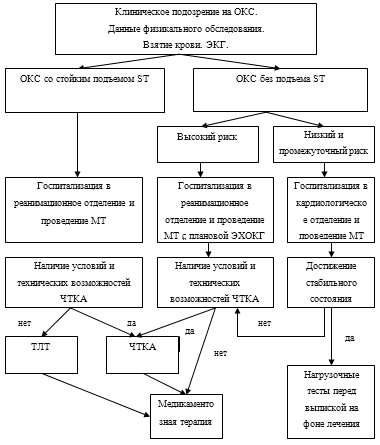
Критерии госпитализации больных в отделение реанимации и кардиологические
отделения.
. Больные, подлежащие госпитализации в отделение реанимации - больные с
высоким непосредственным риском смерти или развития инфаркта миокарда по
результатам начального наблюдения:
ОКС с подъемом сегмента SТ на
ЭКГ или "новой" блокадой левой ножки пучка Гиса;
наличие депрессий сегмента SТ на
ЭКГ/инверсии зубца Т, или "нормальной" ЭКГ при явной клинической
картине ОКС;
некупирующийся наркотическими анальгетиками приступ ангинозных болей
независимо от наличия изменений на ЭКГ и биохимических;
наличие повышенного уровня тропонина или МГБ;
нестабильная стенокардия III А, В, С;
угрожающие нарушения ритма (желудочковая тахикардия, фибрилляция
желудочков);
наличие в анамнезе АКШ и ЧТКА.
. Больные, подлежащие переводу в отделение реанимации:
повторные эпизоды ишемии миокарда (рецидивирующая боль, динамика
сегмента)
развитие гемодинамической нестабильности (гипотензия, признаки застойной
сердечной недостаточности).
. Больные, подлежащие госпитализации в кардиологическое отделение -
больные с низким риском смерти или развития инфаркта миокарда в ближайшее
время:
нестабильная стенокардия I
(А,В,С), II (А,В,С);
ОКС без подъема сегмента SТ на
ЭКГ при отсутствии повышения биохимических маркеров некроза миокарда.
Отделение реанимации.
Отделение реанимации обязано:
2. Проводить медикаментозную терапию, ориентируясь на критерии
адекватности медикаментозной терапии
. Завершить диагностику и в зависимости от поставленного диагноза
выбрать наиболее подходящий вариант ведения больного
Подробный алгоритм ведения больных с острым коронарным синдромом в
отделении кардиореанимации можно рассмотреть в приложении 4.
При поступлении в кардиореанимацию больных с и инфарктом миокарда про
водится прогностическое распределение больных по группам риска смерти в
зависимости от степени сердечной недостаточности по Killip.
Класс 1 -без признаков недостаточности кровообращения; летальность 2-6%
Класс 2 - признаки недостаточности кровообращения выражены умеренно
(выслушивается ритм галопа, в нижних отделах легких влажные хрипы); летальность
10-20%
Класс З - острая левожелудочковая недостаточность (отек легких)
летальность 30-40%
Класс 4 - кардиогенный шок; летальность более 50%
Без кардиохирургической помощи более 90%, в отделении 95%.
Всем больным с острым инфарктом миокарда проводится ингаляция кислорода с
использованием носовых канюль 2 литра в минуту.
Регистрация ЭКГ в кардиореанимации производится ежедневно.
Рентгенография грудной клетки с помощью портативного аппарата
производится при подозрении на застойные явления в малом круге кровообращения.
Лабораторные исследования производятся при поступлении больного в
отделение кардиореанимации: КФК-МВ, тропонин-Т, развернутый анализ крови,
сахар, мочевина, диастаза, билирубин, трансаминазы, калий, общий анализ мочи.
Определение холестерина, бетта-липопротеидов производится после перевода из
кардиореанимации в отделение. После отмены геперина проводится контрольное
определение фибриногена и тромбоцитов. Контроль диуреза проводится всем больным
в кардиореанимации и у больных с сердечной недостаточностью в отделении с
регулярным взвешиванием.
Повышают риск неблагоприятного исхода в госпитальном периоде:
возраст старше 60 лет
повторный инфаркт миокарда
недостаточность кровообращения предшествующая инфаркту миокарда
расширение зоны некроза в ранние сроки инфаркта миокарда
хронические обструктивные заболевания легких
сахарный диабет
ЧСС выше 100 в минуту
систолическое АД ниже 120 мм. рт. ст.
расширение полости левого желудочка и/или выраженная систолическая
дисфункция по данным ЭХОКГ
активность КФК в плазме крови> 2000МЕ
клинические признаки недостаточности кровообращения
фибрилляция желудочков, возникшая позднее 24 часов от начала инфаркта
миокарда
полная блокада левой ножки пучка Гисса, возникшая в ранние сроки инфаркта
миокарда
полная атриовентрикулярная блокада
нарастающая интенсивность ангинозной боли
передняя локализация инфаркта миокарда
депрессия S-Т в грудных
отведениях при нижнем инфаркте миокарда
мерцательная аритмия или трепетание предсердий в первую неделю инфаркта
миокарда
фракция выброса менее 40% по данным ЭХОКГ
повышение уровня креатинина во время госпитализации по поводу инфаркта
миокарда
повышение уровня мочевой кислоты в сыворотке крови
частая желудочковая экстрасистолия и в особенности желудочковая
тахикардия в госпитальном периоде за исключением первых 48 часов
ранняя постинфарктная стенокардия
При наличии осложнений при инфаркте миокарда в виде нарушения
проводимости по типу полной атриовентрикулярной блокады устанавливается
временная электрокардиостимуляция, а при необходимости больные переводятся в
более крупные центры для постановки постоянного кардиостимулятора.
Показания к временной электрокардиостимуляции при инфаркте миокарда:
полная поперечная блокада с медленным желудочковым ритмом и расширением
комплексов QRS
атриовентрикулярная блокада 2 степени типа Мобитц 2 при переднем инфаркте
миокарда
преходящая блокада ножек пучка Гиса
блокада правой ножки пучка Гиса и появившаяся блокада передней ветви
левой ножки
блокада правой ножки пучка Гиса и появившаяся блокада задней ветви левой
ножки
повторные эпизоды остановки синусового узла, не поддающейся терапии
атропином или требующие многократного введения этого препарата
синусовая брадикардия, сопровождающаяся стойкими признаками гипоперфузии
жизненно важных органов и требующая многократного введения атропина
появившаяся блокада левой ножки пучка Гиса, особенно в сочетании с
атриовентрикулярной блокадой
Показания к постоянной ЭКС:
двухпучковая блокада (полная блокада левой ножки пучка Гиса или блокада
правой ножки и одной из ветвей левой ножки) возникшая в результате инфаркта
миокарда и ведущая к атриовентрикулярной блокаде высокой степени
постоянная атриовентрикулярная блокада высокой степени, возникшая в
результате инфаркта миокарда
преходящая блокада ножек пучка Гиса в раннем периоде инфаркта миокарда
При наличии аритмий проводится суточное мониторирование ЭКГ, лечение и
профилактика. Широко проводится плановая кардиоверсия и экстренная при
фибрилляции предсердий по протоколу. В лечении больных с острой коронарной
патологией широко используются дополнительные методы обследования - УЗДГ-БЦС,
нижних конечностей, осмотр дна для выявления поражений органов мишеней
атеросклерозом, до компьютерной томографии.
Привлекаются узкие специалисты для дополнительных консультаций и
обследований. Больные с инфарктом миокарда при его развитии в других
учреждениях переводятся в кардиологическое отделение.
Для исключения безболевой ишемии и нарушения ритма проводится суточное
мониторирование ЭКГ, ВЭМ в постинфарктном периоде. При необходимости
чрезпищеводная кардиостимуляция.
4.10 Реабилитация
больных с инфарктом миокарда
Течение инфаркта миокарда, как и других острых заболеваний, имеет
определенную цикличность. Между подострым периодом инфаркта миокарда, который
больной проводит в стационаре, и постинфарктным кардиосклерозом, когда ишемическая
болезнь сердца приобретает более или менее спокойное течение, отчетливо
прослеживается еще один период - период выздоровления. В это время больные
лечатся в кардиологических санаториях (загородных филиалах больниц) при
кардиологических кабинетах поликлиник. Терапия направлена главным образом на
постепенное повышение физических и психологических возможностей больного, на
возвращение его к труду.
Период выздоровления после перенесенного инфаркта миокарда
характеризуется постепенной реадаптацией больного к внешним условиям среды при
сниженных резервных возможностях сердечно-сосудистой системы, в частности, при
уменьшении массы активно сокращающегося миокарда. В этот период постепенно
развивается компенсаторная гипертрофия сохранившегося миокарда, происходит
перестройка коронарного кровообращения путем образования коллатералей, после
длительного пребывания в постели и гиподинамии восстанавливает тонус и силу
скелетная мускулатура. Инфаркт миокарда является тяжелой психической травмой
для больного. Нередко еще в стационаре больной задает себе вопросы, сможет ли
он работать, как сложатся его отношения с коллективом после возвращения, каким
будет материальное положение его семьи и т. д. Эти вопросы с еще большей
остротой встают перед ним после выписки из больницы. Это нередко приводит к
соматогенно обусловленным невротическим состояниям, требующим психотерапии,
назначения седативных, психотропных средств и т. д. Детальное изучение
восстановительного периода помогает разработать реабилитационные мероприятия, улучшить
экспертизу трудоспособности.
Таким образом, в лечении больных соблюдается принцип этапности и
преемственности. Согласно многочисленным исследованиям это одно из важнейших
условий успешной реабилитации лиц, перенесших инфаркт миокарда.
Как показали динамические наблюдения за больными в восстановительном
периоде инфаркта миокарда, вскоре после выписки из стационара у подавляющего
большинства отмечается субъективное ухудшение. Оно складывается в основном из
четырех синдромов.
Главным остается сердечно-болевой синдром.
Второй синдром состоит преимущественно из клинико-функциональных
признаков, характерных для ранней стадии сердечной недостаточности.
Третий синдром проявляется в общей детренированности организма
(утомляемость, слабость, снижение мышечной силы, боли в мышцах ног при ходьбе,
головокружение и т. д.).
Четвертый состоит в основном из жалоб и симптомов невротического
происхождения (плохой сон, раздражительность, подавленное настроение, различные
фобии, в основном кардиофобии, импотенция и т. д.).
Наибольшую тревогу у больных, перенесших инфаркт миокарда, вызывает
сердечно-болевой синдром. Возобновление болей по миновании острого периода
заболевания больные обычно связывают с угрозой повторного инфаркта миокарда,
это порождает сомнения в эффективности лечения, подавляет стремление вернуться
на работу и т. д. Возникновение приступов стенокардии после инфаркта миокарда
обычно свидетельствует о распространенном стенозирующем атеросклерозе
коронарных артерий и является неблагоприятным прогностическим признаком в
отношении как жизни, так и трудоспособности. Сердечно-болевому синдрому у
больных, перенесших инфаркт миокарда, следует уделять серьезное внимание.
Однако не все боли в области сердца и за грудиной у больных, перенесших инфаркт
миокарда, следует рассматривать как грудную жабу, проявление хронической
коронарной недостаточности. Наряду с типичными приступами стенокардии в виде
сжимающих, давящих болей за грудиной и в области сердца с иррадиацией в нижнюю
челюсть, левое плечо, руки и быстрым эффектом от приема нитроглицерина у
больных, перенесших инфаркт миокарда, нередко наблюдаются боли невротического
происхождения. Они могут быть как незначительными, так и весьма интенсивными.
Такие боли приковывают к себе внимание больных и часто служат основной жалобой
при обращении к врачу. Невротические боли обычно локализуются в области левого
соска, могут распространяться на всю предсердечную область и нередко
иррадиируют в левую лопатку, левое плечо и руку. Эти боли, как правило, не
связаны с физической нагрузкой, чаще возникают после психоэмоционального
перенапряжения, могут длиться от нескольких секунд до нескольких часов, не
купируются нитроглицерином и лучше уступают приему седативных средств. При
болях в области сердца невротического происхождения практически всегда можно
выявить ряд симптомов, указывающих на изменения центральной нервной системы в
виде повышенной раздражительности, неустойчивости настроения, снижения
внимания, работоспособности и т. д.
По интенсивности можно выделить 3 степени кардиалгии.
При I степени больные жалуются на сравнительно редкие, слабые колющие,
ноющие боли в области левого соска без иррадиации. Эти боли возникают спонтанно
либо после волнения, переутомления, при перемене погоды, обычно проходят
самостоятельно и легко купируются седативными средствами (валидол, валериана,
валокордин). Такие больные сравнительно редко обращаются к врачу по поводу этих
болей, у них нет невротических расстройств или они незначительно выражены,
преимущественно имеют тревожно-депрессивную окраску.
При II степени больные жалуются на частые ноющие, колющие или давящие
боли в области сердца, иррадиирующие в левую лопатку и плечо. Боли продолжаются
от нескольких минут до 3-4 ч. Иногда боли длятся 2-3 дня, периодически
ослабевая и вновь усиливаясь. Невротические расстройства у больных этой группы
умеренно выражены, преобладают ипохондрические явления. Как правило, больные
жалуются на повышенную раздражительность, плохой сон, общую слабость,
сердцебиение, сниженную работоспособность, нередко на одышку, которая при
уточнении без труда квалифицируется как чувство неудовлетворенности вдохом.
Иногда больные говорят о покалывании в левом боку при глубоком вдохе, что
весьма напоминает боли при левостороннем сухом плеврите. У некоторых лиц
приступы болей в области сердца сочетаются с ознобом, похолоданием конечностей,
сухостью во рту, одышкой, учащением пульса и полиурией, что указывает на их
симпатико-адреналовое происхождение. Эти больные часто жалуются на боли, но
коронароактивные препараты не приносят им облегчения. Болезненной оказывается
также кожа, особенно неприятные ощущения вызывает разминание кожной складки в
левой части межлопаточного пространства. Такое разминание, хотя и весьма
болезненное, быстро снимает или уменьшает боль в области сердца, что в свою
очередь подтверждает ее экстракардиальное происхождение.
При III степени интенсивности болей невротического происхождения больные
жалуются на постоянные, периодически усиливающиеся боли в области сердца,
которые иррадиируют в левое плечо, лопатку, руку, левую половину головы,
изредка даже в левую ногу. Ярко выражено общее невротическое состояние.
Преобладают истерические и ипохондрические нарушения. Отмечается резкая и
весьма распространенная болезненность мышц, кожи, межреберий, паравертебральных
точек, над- и подключичных ямок слева. Болезненны мышцы левой руки (больше на
плече), места выхода нервов, имеется болезненность в области затылочной точки,
точек выхода тройничного нерва слева. Иногда при пальпации отмечается легкая
болезненность левой сонной и левой височной артерий. При длительном
существовании кардиалгии значительно снижается сила в левой руке, возможна
легкая атрофия мышц пояса верхних конечностей (чаще дельтовидной мышцы).
Толерантность к физической нагрузке у этих больных нередко снижена, они
прекращают работу на велоэргометре из-за резкой слабости, усталости или боязни
сердечного приступа.
Если боли по типу кардиалгии локализуются в области грудины, то
обнаруживается симметричное повышение чувствительности мягких тканей и
паравертебральных точек в соответствующих зонах.
Общими чертами невротических болей в области сердца являются их
распространенность, широкая иррадиация, связь с эмоциональными и
метеорологическими факторами, частое возникновение в покое, ночью, отсутствие
отчетливых изменений соматической иннервации, преимущественное нарушение
глубокой чувствительности, а также ряд трофических расстройств.
Выявление зон нарушения чувствительности в области грудной клетки и пояса
верхних конечностей можно использовать как для дифференциальной диагностики при
болях в области сердца и за грудиной, так и для объективной характеристики
интенсивности кардиалгии. При типичной стенокардии гипералгезия мягких тканей и
вегетативных точек в левой половине грудной клетки отсутствует, что повышает
дифференциально-диагностическое значение объективного обследования больных,
предъявляющих жалобы на боли в области сердца. Специальное изучение
психического статуса больных с типичными приступами стенокардии выявило
незначительные невротические расстройства. Причина сочетанного
сердечно-болевого синдрома у больных ишемической болезнью сердца вообще и у
перенесших инфаркт миокарда, в частности, остается неясной. В патогенезе
атипичных болей определенное значение придают явлениям реперкуссии. Специальное
изучение этого вопроса на нашем контингенте больных показало, что нет
соответствия между тяжестью, величиной и локализацией перенесенного инфаркта
миокарда и степенью хронической коронарной недостаточности, с одной стороны, и
интенсивностью кардиалгии - с другой, среди больных, перенесших инфаркт
миокарда.
Среди предъявляющих жалобы на атипичные боли в области сердца можно
выделить еще одну небольшую группу. У лиц этой группы боли локализуются в
области сердца и шейно-грудном отделе позвоночника, усиливаются при длительном
лежании, при изменении положения тела. Характер болевого синдрома и объективные
данные позволяют диагностировать шейно-грудной радикулит вследствие
остеохондроза позвоночника. Появление атипичных болей в области сердца у
больных этой группы обусловлено, по-видимому, раздражением спинальных корешков
измененными межпозвоночными дисками. Касаясь динамики сердечно-болевого
синдрома у больных в восстановительном периоде инфаркта миокарда, необходимо
отметить следующее.
После выписки из больницы в связи с постепенным расширением двигательного
режима значительно возрастает частота стенокардии, и она выявляется
приблизительно у 50 % больных. При этом в половине случаев она остается
типичной стенокардией, а у другой половины больных сочетается с кардиалгией. Число
больных, у которых в восстановительном периоде заболевания выявляется
постинфарктная стенокардия, не изменяется, хотя под влиянием лечебных
мероприятий несколько уменьшается ее тяжесть. Стенокардия чаще встречается в
старших возрастных группах, у больных, перенесших повторный инфаркт миокарда, и
наиболее редко - у больных в восстановительном периоде после обширного
трансмурального инфаркта миокарда. У лиц, занятых физическим трудом,
стенокардия встречается несколько реже, чем у служащих, что можно объяснить,
по-видимому, благоприятным влиянием предшествующей заболеванию мышечной
деятельности на состояние коронарного резерва и, в частности, на развитие
коллатерального кровообращения.
Клинические данные свидетельствуют о том, что среди больных, у которых в
течение первого месяца амбулаторного лечения появилась стенокардия, в
дальнейшем удается ее устранить лишь в 16-18 % случаев. Однако стенокардия в
этих случаях, как правило, не бывает тяжелой. Это отражает прогрессирование
атеросклероза коронарных артерий в восстановительном периоде после инфаркта
миокарда. У большинства больных в периоде выздоровления после инфаркта миокарда
периодически возникают или остаются постоянно невротические боли в области
сердца различной интенсивности. Динамическое изучение болей в области сердца
невротического происхождения показало, что наиболее редко они встречаются у
больных перед выпиской из стационара (35,3 % случаев).
В период амбулаторного лечения частота кардиалгии увеличивается до 50 % и
остается без существенных изменений на протяжении последующего наблюдения. На
возникновение и интенсивность кардиалгии не влияют возраст больных, обширность
перенесенного инфаркта миокарда и сопутствующая гипертоническая болезнь. У
женщин кардиалгия бывает значительно чаще и интенсивнее, чем у мужчин. Однако
параллельно нарастанию интенсивности кардиалгии отчетливо увеличиваются частота
и выраженность изменений личности больного.
Нередко у больных, перенесших инфаркт миокарда, наблюдаются боли в
плечевых суставах, чаще в левом, чувство онемения в руке. Может развиться
картина выраженного периартрита. При рентгенологическом исследовании иногда
обнаруживается остеопороз костей, образующих плечевой сустав. Описанный
симптомокомплекс в литературе называется плечевым синдромом, или синдромом
"плечо - рука". Он наблюдается у 5-20 % больных постинфарктным
кардиосклерозом. Нередко плечевой синдром развивается уже в остром периоде
инфаркта миокарда, а иногда лишь через несколько лет после него.
Появление застойной сердечной недостаточности - сигнал о неблагоприятном
прогнозе. Так, например, среди больных, перенесших инфаркт миокарда в
трудоспособном возрасте, у которых уже перед выпиской из стационара или в
ближайшие дни после нее появились признаки застойной сердечной недостаточности,
летальный исход в течение ближайших 3 месяцев наступил в 35 % случаев. Большее
практическое значение и большие трудности представляет собой распознавание
начальной стадии сердечной недостаточности. В этой стадии нет истинных
признаков декомпенсации, гемодинамические показатели в покое еще не изменены,
но сократительная способность миокарда слегка снижена, выполнялась больным без
труда. При опросе важно выяснить, не возникла ли у больного потребность спать в
последнее время на высоких подушках или склонность к никтурии. Следует обращать
внимание на появление кашля по ночам, что может быть одним из первых симптомов
застойной левожелудочковой недостаточности. Другим классическим симптомом
является сердцебиение. Оно возникает на ранних этапах развития недостаточности
миокарда и обусловлено стремлением к компенсации путем увеличения частоты
сокращений. Однако жалобы на одышку и сердцебиение не могут служить достаточно
точными диагностическими ориентирами, так как в значительной мере зависят от
нагрузок, которым подвергается больной в повседневной жизни. Поскольку больные,
перенесшие инфаркт миокарда, обычно ведут размеренный образ жизни и избегают
перегрузок, на одышку при ходьбе и подъеме по лестнице или сердцебиение они
жалуются редко.
Значительно большую роль в распознавании скрытой (латентной) сердечной
недостаточности у больных, перенесших инфаркт миокарда, играют инструментальные
методы. Их можно разделить на две группы: неинвазивные (электрокардиография,
реография, рентгенография и др.) и инвазивные (катетеризация левых и правых
полостей сердца, вентрикулография).
Важную роль в диагностике начальной стадии сердечной недостаточности
может играть велоэргометрическое исследование. Появление тахикардии,
относительно малый прирост пульсового давления, удлинение восстановительного
периода, значительное повышение диастолического давления в легочной артерии, а
также конечного диастолического давления в полости левого желудочка под
влиянием дозированной физической нагрузки можно считать важными признаками
скрытой недостаточности кровообращения.
Гипертоническая болезнь значительно отягощает прогноз в отношении жизни у
больных инфарктом миокарда и неблагоприятно отражается на восстановлении их
трудоспособности. Под влиянием физической нагрузки систолическое кровяное
давление у здоровых лиц повышается, а диастолическое - снижается. Степень
повышения артериального давления прямо пропорциональна мощности выполняемой
работы. Чем выше тренированность обследуемого, тем относительно меньше
повышается артериальное давление при физической нагрузке и тем быстрее в
периоде реституции оно возвращается к исходным величинам. Под влиянием
небольшой физической нагрузки у больных повышается систолическое и
диастолическое давление, оно постепенно возвращается к исходным величинам после
прекращения работы на велоэргометре не более чем через 2 минуты.
Изучение реакции сердечно-сосудистой системы на дозированную физическую
нагрузку у больных, перенесших инфаркт миокарда, имеет большое практическое
значение.
С течением времени больные, перенесшие обширный трансмуральный инфаркт
миокарда, постепенно адаптируются к физической нагрузке. Это отражается в
уменьшении частоты пульса в покое, меньшем его учащении во время физической
нагрузки и в периоде реституции, меньших отклонениях от нормы систолического
показателя, более редким возникновением экстрасистол и изменений конечной части
желудочкового комплекса. По данным средних величин сердечного ритма, адаптация
к физической нагрузке у больных, перенесших обширный трансмуральный инфаркт
миокарда, в основном заканчивается через 3 месяца после выписки из стационара.
После этого срока уже нет существенной динамики в частоте сердечных сокращений
во время применявшейся пробы.
По динамическим наблюдениям, адаптация к физической нагрузке у больных,
перенесших крупноочаговый инфаркт миокарда, заканчивается также через 3 месяца
после выписки из стационара.
На протяжении года после выписки из стационара у больных, перенесших
повторный инфаркт миокарда, не отмечено существенных изменений в частоте
сердечного ритма во время исследования. Однако у этих больных в
восстановительном периоде также повышается толерантность к физической нагрузке:
постепенно уменьшается одышка, урежаются и облегчаются приступы стенокардии.
Таким образом, адаптация к физической нагрузке у больных, перенесших повторный
инфаркт миокарда, наступает между 3-м и 6-м месяцем после выписки из
стационара.
Частота сердечного ритма в покое, во время выполнения мышечной нагрузки и
в периоде реституции в основном характеризует толерантность к физической
нагрузке больных в восстановительном периоде после инфаркта миокарда. Помимо
сердечного ритма, повышение толерантности к мышечной работе выражается в
меньшем увеличении систолического показателя по отношению к должным величинам,
в более редких нарушениях сердечного ритма и менее значительных изменениях
зубца Т.
Средние величины сердечного ритма у больных после адаптации к физической
нагрузке по сравнению со здоровыми имеют следующие особенности:
1. сердечный ритм в покое, на высоте нагрузки и в периоде реституции,
как правило, выше;
2. за исключением больных, перенесших мелкоочаговый инфаркт
миокарда, сердечный ритм позже возвращается к исходным величинам;
. наиболее благоприятно реагируют на дозированную физическую
нагрузку больные, перенесшие мелкоочаговый инфаркт миокарда;
. между группами больных, перенесших обширный трансмуральный,
крупноочаговый и повторный инфаркт миокарда, значительных различий в реакции на
дозированную физическую нагрузку нет.
У больных постинфарктным кардиосклерозом после обширного трансмурального,
крупноочагового и повторного инфаркта миокарда реакция сердечного ритма на
дозированную физическую нагрузку по сравнению со здоровыми лицами отличается
как качественно, так и количественно. У больных, перенесших мелкоочаговый
инфаркт миокарда, эти различия лишь количественные.
Наряду с разумным и осторожным применением лечебной физкультуры и
постепенным повышением общей физической активности у больных оправдано
длительное применение сердечных гликозидов. Их включение в комплекс лечебных
мероприятий несомненно улучшит состояние больных и повысит их толерантность к
физической нагрузке. У больных со скрытой сердечной недостаточностью может
восстановиться трудоспособность. Однако резервные возможности их организма
остаются значительно сниженными и для предупреждения декомпенсации им показано
тщательное диспансерное наблюдение. В остром периоде инфаркта миокарда у
абсолютного большинства больных встречаются различные аритмии, их частота
нарастает параллельно тяжести состояния и обширности некроза сердечной мышцы. Значительно
меньше изучены частота и характер нарушений сердечного ритма у больных в
восстановительном периоде инфаркта миокарда. Нарушения сердечного ритма
наиболее редко встречаются у больных, перенесших мелкоочаговый инфаркт
миокарда. Клиническое значение аритмий в восстановительном периоде инфаркта
миокарда проявляется в возвращении больных к труду и летальности в течение года
после выписки из стационара.
Возможности выявления различных нарушений сердечного ритма у больных
ишемической болезнью сердца вообще и у перенесших инфаркт миокарда, в
частности, значительно возрастают при использовании современной аппаратуры,
позволяющей записывать ЭКГ в течение 24 ч на магнитную ленту с последующей
дешифрацией. Изменения функции внешнего дыхания у больных, перенесших инфаркт
миокарда, происходит не только за счет сердечной недостаточности.
Действительно, у больных, перенесших мелкоочаговый инфаркт миокарда,
сократительная способность левого желудочка сердца, судя по данным фазового
анализа, находилась в пределах нормы, однако у них были значительная
гипервентиляция и снижение других показателей функции внешнего дыхания. Можно
предположить, что указанные изменения у больных, перенесших инфаркт миокарда,
обусловлены и нарушениями центральных регуляторных механизмов. Таким образом,
можно считать, что изменения функции легких у больных, перенесших инфаркт
миокарда, обусловлены, с одной стороны, состоянием сердечной деятельности, а с
другой - характерным для атеросклероза нарушением центральных регуляторных
механизмов. В восстановительном периоде постепенно улучшается функция внешнего
дыхания, уменьшается число больных с недостатком кислорода в организме.
Урежение и особенно углубление дыхания у больных, перенесших инфаркт миокарда,
можно, по-видимому, рассматривать как компенсаторный механизм, направленный на
улучшение сердечной деятельности. Изменения функции внешнего дыхания у больных,
перенесших инфаркт миокарда, обусловлены не только состоянием сердечной
деятельности, но и нарушением центральной регуляции, что необходимо учитывать
при анализе спирографических показателей.
В периоде выздоровления после инфаркта миокарда нередко развивается
невротическая реакция на болезнь. Это проявилось в жалобах на невротические
боли в области сердца, наклонности к уходу в болезнь, сомнениях в своей
трудоспособности и жизнеспособности, неустойчивости настроения и т. д. Таким
образом, у большинства больных имеются более или менее выраженные отклонения в
психическом статусе. После выписки из стационара больные становятся ближе к
жизни, которая иногда весьма остро ставит перед ними сложные вопросы, к решению
которых больные ни физически, ни психологически не подготовлены. Возможно, это
и ухудшает психический статус больных. Не последнюю роль, вероятно, играет и
ухудшение самочувствия вследствие общей детренированности и усиления или
возникновения стенокардии. Это угнетает психику больного и убеждает его в
собственной физической неполноценности.
Наиболее остро субъективное ухудшение проявляется в первый месяц после
выписки из стационара. В последующем самочувствие больных постепенно
улучшается. Значительно медленнее уменьшаются проявления стенокардии и
негативные изменения психики. Возвращение к работе оказывает на больных большое
психотерапевтическое воздействие: они убеждаются, что могут справляться с
производственными обязанностями.
Возрастающую физическую активность больных можно считать важнейшим
фактором, приводящим к постепенному улучшению их состояния и уменьшающим
проявления хронической коронарной недостаточности.
Перечисленные компенсаторно-приспособительные механизмы включаются в
процесс выздоровления и позволяют больному, перенесшему даже тяжелый инфаркт
миокарда, не только сохранить жизнь, но и вернуться к трудовой деятельности.
Практически очень важен вопрос о длительности периода выздоровления после
инфаркта миокарда. Необходимо знать, когда у больного, перенесшего инфаркт
миокарда, компенсаторно-приспособительные механизмы уже настолько
восстановлены, что он может приступить к труду. Эти моменты не были детально
изучены, и этим можно объяснить значительные различия в длительности временной
нетрудоспособности больных, перенесших инфаркт миокарда. Наиболее быстрая
положительная динамика в состоянии больных отмечается в первые 3 месяца после
выписки из стационара. Однако наиболее важным объективным критерием состояния
больных, их пригодности к труду остаются толерантность к физической нагрузке и
адаптация к дозированной мышечной работе. Это один из главных ориентиров в
практической работе врача по реабилитации больных, перенесших инфаркт миокарда,
в определении сроков их возвращения к труду.
По-видимому, по срокам адаптации к дозированной физической нагрузке можно
определить окончание периода выздоровления. Для больных, перенесших
мелкоочаговый инфаркт миокарда, период выздоровления практически заканчивается
через месяц после выписки из стационара. Для больных, перенесших крупноочаговый
и обширный трансмуральный инфаркт миокарда, период выздоровления заканчивается
через 3 месяца после выписки из стационара. При повторном инфаркте миокарда
окончание периода выздоровления лежит между 3-м и 6-м месяцами после выписки из
стационара. К указанному времени, по средним данным, больной достаточно
адаптируется к физической нагрузке и его можно выписать на работу. Однако эти
сроки являются ориентировочными и могут колебаться в зависимости от
сопутствующей постинфарктной стенокардии, гипертонической болезни, нарушений
ритма, качества реабилитационных мероприятий и т. д.
В указанные сроки восстановительные процессы в организме больного ни в
коей мере не заканчиваются, однако их интенсивность значительно снижается.
После окончания восстановительного периода в состоянии больных продолжается
медленная положительная динамика, но в комплекс благоприятных факторов
включается труд в соответствующих условиях.
5.
Заболеваемость инфарктом миокарда г. о. Сызрань
Практическая часть дипломной работы проводилась на базе
кардиореанимационного отделения МУЗ "ЦГБ" г.о. Сызрань.
Отделение кардиологии МУЗ "ЦГБ" г.о. Сызрань рассчитано на 80
коек (6 - кардиореанимационных) и оказывает помощь населению г.о. Сызрань и
м.р. Сызранский в круглосуточном режиме. В отделении 5 врачей кардиологов,
включая заведующего отделением, и 2 врача реаниматолога- кардиолога. Отделение
имеет возможность работы по современным стандартам. Оснащение - 2 аппарата ЭКГ,
централизованная разводка кислорода по всем палатам, 3 дефибриллятора, 4
монитора ЭКГ, 1 кардиостимулятор, 5 дозаторов-инфузоматов. Больные обследуются
при необходимости с использованием аппарата ЭХОКГ, ВЭМ, холтерЭКГ, ЧПЭФИ, УЗИ.
УЗДГ, маркеры при инфаркте миокарда: тропонин Т, КФК-МВ, определяется
холестерин, В-липопротеиды, триглицериды.
Были проанализированы статистические данные за 2005 - 2009 годы.
Проанализировано количество пациентов, поступивших в отделение
кардиоренимации за период с 2005 по 2009 год с диагнозом инфаркт миокарда (рис.
9).
Рис.9 Количество случаев инфаркта миокарда с 2005 по 2009 года (чел.).
В 2005 году в отделение кардиореанимации поступило 492 человека, в 2006
году - 420 человек, в 2007 году - 446 человек, в 2008 году - 488 человек, в
2009 году - 527 человек. Очевидно, что количество случаев инфаркта миокарда с
каждым годом стабильно увеличивается.
В отделение кардиореанимации с диагнозом инфаркт миокарда поступают преимущественно
мужчины.
Поступило мужчин: 2005 год - 282, 2006 год -229, 2007 год -265, 2008 год
- 290, 2009 год - 288 человек.
Поступило женщин: 2005 год - 210, 2006 год - 191, 2007 год - 181, 2008
год - 198, 2009 год - 239 человек.
Рис.10 Соотношение женщин и мужчин с инфарктом миокарда (в %).
Проведен анализ по выяснению взаимосвязи между возрастом пациентов и
частотой возникновения инфаркта миокарда.
По возрасту: старше 70 лет 48,2% ; 60 - 69 лет - 25,3%; 50 - 59лет -
24,2%; 40 - 49 лет - 10,5%; 30 - 39 лет - 0,9%.
Рис.11 Взаимосвязь между возрастом пациентов и частотой возникновения
инфаркта миокарда (чел.).
Из рисунка видно, что в молодом возрасте случаи инфаркта миокарда практически
отсутствуют, а в пожилом (старше 70 лет) диагноз "инфаркт миокарда"
встречается гораздо чаще. Из этого можно сделать вывод, что частота инфарктом
миокарда напрямую связана с возрастом пациента, в первую очередь это связано с
возрастным поражением коронарных сосудов атеросклерозом и гипертонической
болезнью.
Также нами проведен анализ осложнений инфаркта миокарда. Было
определенно, что из общего числа пациентов с инфарктом миокарда, осложненный
инфаркт миокарда имели 50%.
Количество осложненных инфарктов миокарда по годам: в 2005 году - 202
человека, в 2006 году - 178 человек, в 2007 году - 223 человек, в 2008 году 245
человек, в 2009 - 303 человека.
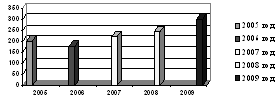
Рис.12 Количество осложненных инфарктов миокарда по годам (чел.).
Анализируя полученные результаты, можно констатировать, что число случаев
осложненного инфаркта миокарда с каждым годом неуклонно растет.
Были выявлены следующие осложнения при развитии инфаркта миокарда:
1. Кардиогенный шок
2. Острая левожелудочковая недостаточность
. Тромбоэмболия легочной артерии
. Фибрилляция желудочков
. Разрыв миокарда
Таблица 2. Осложнения инфаркта миокарда
|
Осложнения инфаркта
миокарда
|
2005
|
2006
|
2007
|
2008
|
2009
|
|
1. Кардиогенный шок
|
29
|
28
|
32
|
37
|
51
|
|
2. Острая левожелудочковая
недостаточность
|
62
|
63
|
51
|
53
|
103
|
|
3. Тромбоэмболия легочной
артерии
|
2
|
1
|
3
|
8
|
1
|
|
4. Фибрилляция желудочков
|
29
|
31
|
32
|
13
|
26
|
|
5. Разрыв миокарда
|
7
|
3
|
9
|
10
|
10
|
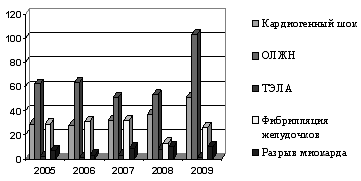
Рис. 13 Типичные осложнения инфаркта миокарда (чел.).
Из рисунка видно, что наиболее часто встречаемое осложнение инфаркта
миокарда - острая левожелудочковая недостаточность, число случаев которой
выросло с 62 в 2005 году до 103 случаев в 2009 году.
На втором месте по частоте осложнений стоит кардиогенный шок. Частота
кардиогенного шока колеблется от 29 случаев в 2005 году, 28 в 2006 году, 32 в
2007, 37 в 2008 году и 51 случай в 2009 году. Несмотря на небольшое количество
случаев, по сравнению с острой левожелудочковой недостаточностью, кардиогенный
шок остается серьёзным осложнением инфаркта миокарда, так как выживаемость
таких больных очень низка - 7,8%.
Увеличивается и число случаев разрыва миокарда: 7 в 2005 году, 3 - в 2006
году, 9 - в 2007 году, 10 - в 2008 году и в 2009 году. Рост разрывов миокарда
предположительно связано с применением сильных тромболитиков - проурокиназы. Также увеличилось число возникновений повторного инфаркта
миокарда.

Рис 14. Число повторных инфарктов миокарда по годам (чел.)
Повторный инфаркт миокарда составляет примерно 33,4% от всех осложнений,
возникающих при инфаркте миокарда, также можно сказать, что число повторных
инфарктов миокарда растет с каждым годом. Это происходит, так как этап
реабилитации проходят в полном объеме не все пациенты, перенесшие инфаркт
миокарда.
Определена взаимосвязь между летальностью и возрастом пациентов с
диагнозом "инфаркт миокарда".
Для этого сначала было проанализировано число смертности среди пациентов
с инфарктом миокарда: 2005 год - 64 случая (14,85%); 2006 год - 61 случай
(14,48%); 2007 год - 68 случаев (15,2%); 2008 год - 65 случаев (13,3%); 2009
год - 97 случаев (18,4%).
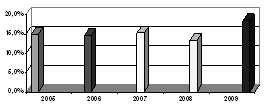
Рис.15 Смертность от инфаркта миокарда по годам (в %).
Наблюдается стабильное увеличение роста числа инфаркта миокарда г. о.
Сызрань, на фоне снижения общего числа населения.
Далее было изучено число случаев смертности в различных возрастных
группах. Было выявлено, что наибольшее количество смертности от инфаркта
миокарда в возрасте старше 70 лет.
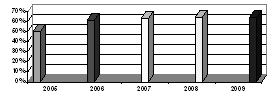
Рис. 16 Смертность в возрастной группе 70 лет и старше (в %).
Анализируя эти статистические данные можно сделать следующие выводы:
1. Прослеживается рост летальности от инфаркта миокарда
2. Наибольшее количество летальных исходов - в возрасте 70 лет и
старше.
Заключение
Цель дипломной работы достигнута, через решение задач:
1. Изучена учебная и научная литература, материалы специализированных
медицинских сайтов по теме дипломной работы.
2. Проведено исследование и определены статистические показатели,
основанные на работе кардиореанимации в МУЗ ЦГБ №1 города Сызрани с 2005 по
2009 года.
. Определено количество больных с диагнозом "инфаркт
миокарда", поступивших в кардиореанимацию МУЗ "ЦГБ" г. о.
Сызрань за период с 2005 по 2009 года.
. Определена взаимосвязь между возрастом пациентов и частотой
возникновения инфаркта миокарда.
. Определено число повторных инфарктов миокарда.
. Проведен анализ статистических данных по заболеваемости
инфарктом миокарда кардиореанимационного отделения МУЗ "ЦГБ" г.о.
Сызрань за 5 лет.
. Определен уровень смертности у больных с диагнозом "инфаркт
миокарда".
8. Выявлена взаимосвязь между возрастом пациентов и смертностью при
инфаркте миокарда.
В ходе работы были сделаны следующие выводы:
- количество случаев инфаркта миокарда с каждым годом стабильно
увеличивается;
инфаркт миокарда чаще встречается у мужчин;
частота инфарктом миокарда напрямую связана с возрастом пациента,
наибольшее количество случаев встречается после 70 лет;
число случаев осложненного инфаркта миокарда с каждым годом неуклонно
растет;
наиболее часто встречаемое осложнение инфаркта миокарда - острая
левожелудочковая недостаточность;
число повторных инфарктов миокарда растет с каждым годом;
- прослеживается рост летальности от инфаркта миокарда;
- наибольшее количество летальных исходов - в возрасте 70 лет
Учитывая актуальность данной темы, считаю необходимым вести подобную
исследовательскую работу с целью предупреждения развития такого грозного
заболевания, как острый инфаркт миокарда среди населения, а также среди
среднего медицинского персонала, так как систематизация информации и более
глубокое изучение инфаркта миокарда будет способствовать оказанию помощи более
высокого уровня, как на догоспитальном, так и на стационарном этапе лечения
заболевания.
Работа имеет практическую значимость в части:
в практической деятельности фельдшера, необходимо усилить просветительскую
работу по вопросам первичной профилактики инфаркта миокарда среди лиц, имеющих
факторы риска заболевания, а так же лицам, перенёсшим инфаркт миокарда и
проходящим реабилитационный этап лечения;
исследовательская работа позволила глубоко изучить особенности течения,
диагностики инфаркта миокарда, что позволит в практической деятельности
фельдшера оказывать квалифицированную доврачебную помощь на догоспитальном
этапе;
дипломная работа может быть использована в учебном процессе ГОУ СПО
Сызранского медицинского колледжа для аудиторной и внеаудиторной работы
студентов, а так же для создания учебного пособия с целью углубленного изучения
темы;
работа по данной теме является актуальной и может быть продолжена в
рамках СНО (студенческого научного общества) ГОУ СПО Сызранского медицинского
колледжа.
Используемая
литература
1. Мифтяхова Р.И., Гусева Г.И., Тухбатова А.А.
Стандарты ведения пациентов с сердечно-сосудистыми заболеваниями 2005г.
2. Окороков А.Н. Диагностика болезней внутренних
органов: Том 6. Диагностика болезней сердца и сосудов 2002г.
. Рафальский В.В., Крикова А.В., Багликова А.Н.
Кардиоваскулярная терапия и профилактика №7, 2009г.
4. Чазов Е.И., Беленков Ю.Н. Рациональная
фармакотерапия сердечнососудистых заболеваний. 2005г.
5. Беленков Ю.Н. Сердце: журнал для практикующих врачей
том 4 №1, 2005г.
6. Чазов Е.И. Руководство по кардиологии. Том 3.
Болезни сердца 2005г.
7. Филипов Г. А. Анатомия и физиология сердца. 2006г.
. Маркушевский В. В. Терапия острого инфаркта
миокарда. 2007г.
. Фадеев П. А. Инфаркт миокарда. 2010г.
10. Сторажоков В. И., Горбаченков А. А. Руководство по
кардиологии. Учебное пособие. Том 1. 2007г.
11. Овосопян Ю. А., Трошина Е. В. Неотложная помощь при
острой сердечно-сосудистой патологии. 2009г.
. Ковальский Г. Б. Морфологическая диагностика ИБС.
2001г.
. Суворов А. В. Клиническая электрокардиография.
2002г.
. Ройтберг Б. Е. Внутренние болезни.
Сердечно-сосудистая система. 1999г.
. Шанин В. Ю. Клиническая патофизиология инфаркта
миокарда. 2005 г.
Приложение 1
Основные направления и лекарственные средства, применяемые в острейшей
стадии неосложненного инфаркта миокарда
|
Лекарственное средство
|
Направления терапии
|
Рекомендуемая доза
|
|
Морфин внутривенно дробно
|
Адекватное обезболивание,
снижение пред- и постнагрузки, психо-моторного возбуждения, потребности
миокарда в кислороде
|
2-5 мг внутривенно каждые
5-15 минут до полного устранения болевого синдрома либо до появления побочных
эффектов
|
|
Стрептокиназа (стрептаза)
|
Восстановление коронарного
кровотока (тромболизис), купирование болевого синдрома, ограничение размеров
инфаркта миокарда, снижение летальности
|
1,5 млн. МЕ внутривенно за
60 минут
|
|
Гепарин внутривенно струйно
(если не проводится тромболизис)
|
Предупреждение или
ограничение коронарного тромбоза, профилактика тромбоэмболических осложнений,
снижение летальности
|
10000-15000 МЕ внутривенно
струйно
|
|
Нитроглицерин или
изосорбида динитрат внутривенно капельно
|
Купирование болевого
синдрома, уменьшение размеров инфаркта миокарда и летальности
|
10 мкг/мин. с увеличением
скорости на 20 мкг/мин каждые 5 минут под контролем ЧСС и АД
|
|
Бета-адреноблокаторы:
пропранолол (обзидан)
|
Снижение потребности
миокарда в кислороде, купирование болевого синдрома, уменьшение размеров
некроза, профилактика фибрилляции желудочков и разрыва левого желудочка,
повторных инфарктов миокарда, снижение летальности
|
1 мг/мин каждые 3-5 минут
до общей дозы 10 мг
|
|
Ацетилсалици-ловая кислота
(аспирин)
|
Купирование и профилактика
процессов, связанных с агрегацией тромбоцитов; при раннем(!) назначении
снижает летальность
|
160-325 мг разжевать;
|
|
Магния сульфат
(кормагнезин)
|
Снижение потребности
миокарда в кислороде, купирование болевого синдрома, уменьшение размеров
некроза, профилактика нарушений сердечного ритма, сердечной недостаточности,
снижение летальности
|
1000 мг магния (50 мл 10 %,
25 мл 20 % или 20 мл 25 % раствора) внутривенно в течение 30 минут.
|
Приложение 2
Неосложненный инфаркт миокарда.
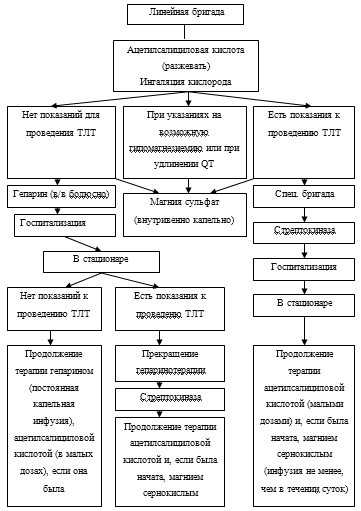
Приложение 3
Неосложненный инфаркт миокарда или инфаркт миокарда, осложненный упорным
болевым синдромом.

Приложение 4
Осложненный инфаркт миокарда
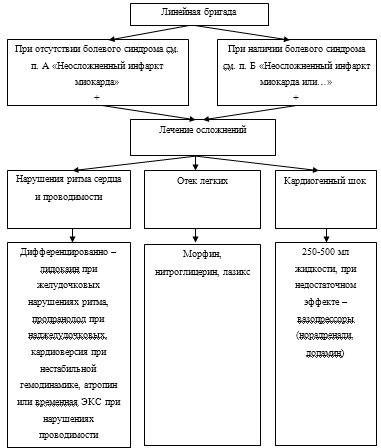
Приложение 5
Алгоритм ведения больных с острым коронарным синдромом.