Оценка прочности и процесс диссоциации химических соединений
Содержание
Введение
Оценка
прочности химических соединений
Задача №1.
Взаимодействие углерода с кислородосодержащей газовой фазой
Задача №2.
Восстановление оксида железа оксидом углерода и водородом
Библиографический
список
Введение
История человеческого общества неразрывно связана с развитием
металлургии. Ещё в глубокой древности человек стал применять металлы. Вначале
это были самородные металлы: золото, серебро, медь и метеоритное железо. Затем
были открыты способы получения металлов из руд, вначале меди и её сплавов
(бронза), а затем железа. Постепенно увеличивалось число известных человеку
металлов. Если к концу XVIII
века было открыто и использовалось примерно 20 металлов, то к концу XIX века их число достигло 50. Особенно
бурное развитие металлургии произошло в начале и середине XX века.
В настоящее время Периодическая система Д.И. Менделеева включает 106
элементов, 92 из которых являются металлами. Промышленное значение имеют 75
металлов. Ведущее место среди металлов, как по объему производства, так и по
степени использования, занимают железо и его сплавы. Их доля в общемировом
производстве металлов составляет 90%. Преимущественному применению в самых
различных областях народного хозяйства железо и его сплавы обязаны своими
ценными физическими и механическими свойствами.
Оценка прочности химических соединений
Процессы диссоциации (распада) химических соединений однотипны и могут
быть в общем виде представлены в зависимости от температуры уравнениями
АВтв = Атв + Вгаз
АВтв = Аж + Вгаз
АВж = Атв + Вгаз
АВж = Аж + Вгаз
Например:
СаСО3 = СаО + СО2
6Fe2O3 = 4Fe3O4 + O2
2Fe3O4 = 6FeO + O2
FeO = 2Fe + O22 = Fe+S2 и другие.
Равновесное парциальное давление газообразного продукта таких
гетерогенных реакций называется упругостью диссоциации соединения АВ и
характеризует степень прочности данного соединения. Процессы диссоциации
(особенно оксидов) представляют интерес для специалистов, поскольку указывают
на возможность реализации прямого способа получения металлов, а характеристики
этих реакций важны при анализе процессов восстановления оксидов и окисления
металлов (и низших оксидов). Если металл может иметь разные валентности, то
процессы диссоциации и окисления (восстановления) подчиняются принципу
последовательности превращений Байкова.
Диссоциация карбонатов. Можно привести много примеров гетерогенных
реакций, имеющих большое значение в металлургическом производстве: горение
твердого и жидкого топлива; восстановление твердых оксидов железа газами в
доменной печи; окисление углерода, растворенного в жидкой стали; реакции
превращения, происходящие в твердой стали при термической обработке;
диссоциация оксидов и карбонатов, высокотемпературное окисление металлов,
имеющих место на всех стадиях металлургического передела, когда нагретый металл
находится в контакте с атмосферой; взаимодействие жидкого металла с
расплавленным шлаком. Рассмотрим кинетику гетерогенного процесса на примере
диссоциации карбонатов.
Процесс диссоциации карбоната металла
MeCO3тв = MeOтв + CO2газ (1)
является гетерогенным, поскольку происходит на границе раздела между
двумя твердыми фазами - исходным веществом МеCO3 и продуктом реакции
MeO. Процесс диссоциации сопровождается исчезновением одной фазы и
возникновением новой твердой фазы, отличающейся от первой кристаллической
структурой. Такие процессы называются топохимическими. Для них весьма
существенна стадия формирования новой и разрушения старой кристаллической
решетки. Этот этап занимает определенное время, называемое инкубационным
периодом, и реакция диссоциации идет с ничтожно малой скоростью.
Диссоциация начинается с тех анионов СО3 2-,
которые имеют достаточный запас энергии, необходимый для отрыва от них анионов
кислорода
О32- = СО2 + О2-. (2)
Распад анионов CО32- и возникновение трехмерных
зародышей оксида
Ме2+ + О2- = МеО (2)
представляют элементарный кристаллохимический акт рассматриваемой
реакции. Появление зародышей новой фазы, и, следовательно, поверхности раздела
между двумя твердыми фазами, а также распад анионов CО32-происходит
на поверхности карбоната, а именно - в активных центрах. Активными центрами
могут быть вершины кристалликов МеСО3, отдельные дефектные места на
их гранях и ребрах, где частицы вещества обладают повышенным запасом энергии.
Начиная с зародышей новой фазы, граница раздела твердых фаз перемещается вглубь
кристаллической решетки материнской фазы - МеСО3. Следует заметить,
что с увеличением степени дисперсности карбоната растет число активных центров,
что при прочих равных условиях приводит к уменьшению инкубационного периода.
С момента появления зародышей новой фазы процесс диссоциации карбоната
развивается на границе раздела между карбонатом и оксидом. Течение реакции на
границе раздела твердых фаз облегчено, поскольку:
) Поверхностные ионы CО32- находятся в
несимметричном силовом поле, в силу чего они деформированы и легче распадаются;
) Ионы О2- и Ме2+ на поверхности раздела
достраивают решетку, что требует меньших затрат энергии, чем зарождение новой
фазы в объеме МеСО3;
) Процесс удаления молекул СО2 за счет диффузии от границы
МеО-МеСО3 осуществляется быстрее, чем из объема МеСО3.

Рис.1. Зависимость скорости (ν) топохимической реакции от времени (τ): I - инкубационный период (реакция
идет с такой малой скоростью, что чувствительности приборов не хватает для ее
фиксации); II - автокаталитический период (заметное увеличение скорости реакции
вследствие роста границы раздела между твердыми фазами); III - период
завершения реакции (скорость падает из-за уменьшения фронта реакции)
Увеличение межфазной границы облегчает дальнейшее течение реакции
диссоциации, что ведет к росту количества распадающегося карбоната в единицу
времени, т.е. скорости реакции (рис. 1, период II). Наконец, поверхность
раздела твердых фаз, достигнув максимального значения, начинает убывать в силу
того, что кусочки карбоната имеют конечные размеры и, следовательно, конечную
величину площади поверхности (рис. 1, период III). Одновременно с уменьшением
границы раздела твердых фаз падает скорость процесса. Уменьшению скорости
способствует и рост толщины слоя продукта. Если его пористость невелика, то со
временем процесс переходит в диффузионный режим, и лимитирующим этапом
становится диффузия молекул CO2 из зоны реакции. При значительной
пористости и сравнительно небольших размерах диссоциирующей фазы сохранится
кинетический режим процесса (замедленность кристаллохимического превращения).
Диссоциация оксидов
Важнейшие процессы в металлургических агрегатах
сводятся, как уже отмечалось, к реакциям восстановления или окисления, т. е. к
различным превращениям окислов. Поэтому прочность окислов, определяемая
сродством веществ к кислороду, играет первостепенную роль в термодинамике
металлургических процессов.
Для выяснения общих закономерностей рассмотрим реакцию
диссоциации окисла двухвалентного металла
МеО = Ме + 1/2О2 (4)
Равновесное парциальное давление кислорода в реакции
образования или диссоциации окисла называется упругостью диссоциации окисла Ро2.
При отсутствии растворов она непосредственно связана с константой равновесия и
является, следовательно, функцией только температуры
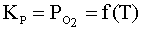 (5)
(5)
Реакция
окисления экзотермична, и константа равновесия убывает, а
упругость
диссоциации увеличивается с температурой (рис. 2). Иными словами, с ростом
температуры сродство окисляемых веществ к кислороду и прочность окислов
уменьшаются.
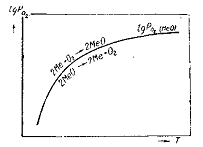
Рис.2. Зависимость логарифма упругости диссоциации
окисла от температуры
Задача №1. Взаимодействие углерода с
кислородосодержащей газовой фазой
Рассчитайте значения равновесного давления кислорода и кислородных
потенциалов в равновесной газовой смеси, образующейся при взаимодействии
обогащённого кислородом воздуха (N2
- O2) с твердым углеродом для шести заданных температур.
Исходные данные для расчёта:
|
состав обогащенного
воздуха, %
|
Температура, 0С
|
Давление, Па·10-5
|
|
N2
|
O2
|
1
|
2
|
3
|
4
|
5
|
6
|
|
|
67
|
33
|
716
|
766
|
816
|
866
|
916
|
966
|
1,7
|
Решение:
γ=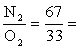 2,0303
2,0303
С
+ О2 = 2СО (1)
С
+ О2 = СО2 (2)
С
+СО2 = 2СО (3)
Константа
равновесия для реакции (1) равна:
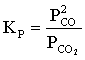
Пользуясь
уравнением

находим
значение 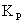 для шести заданных температур:
для шести заданных температур:
|
T,К
|
989
|
1039
|
1089
|
1139
|
1189
|
1239
|
|
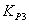 1,514,13910,34223,84851,259103,579 1,514,13910,34223,84851,259103,579
|
|
|
|
|
|
|
Находим равновесный состав газовой смеси:
СО,%= , (4)
, (4)
где
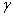 - количество молей N2 вносимых в смесь одним молем О2;
- количество молей N2 вносимых в смесь одним молем О2;
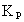 -
константа равновесия реакции (1);
-
константа равновесия реакции (1);
Р
- общее давление в газовой смеси
СО2,%
= (5)
(5)
N2,%=100-(СО,%+СО2,%) (6)
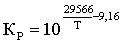 (7)
(7)
 (8)
(8)
 (9)
(9)
Результаты
расчётов сведены в таблицу 1.
Таблица
1
№№
п.п. t,0С Т,
К состав равновесной газовой смеси, % относительное содержание, %  ,Паlg
,Паlg
 ,
,
|
Дж
|
|
|
|
|
|
|
СО
|
СО2
|
N2
|
СО
|
СО2
|
|
|
|
|
1
|
716
|
989
|
32,137
|
17,557
|
50,307
|
64,67
|
35,33
|
5,5·10-22
|
-21,26
|
-402755
|
|
2
|
766
|
1039
|
39,825
|
26,965
|
33,209
|
59,623
|
40,372
|
2,32·10-20
|
-19,63
|
-390776
|
|
3
|
816
|
1089
|
44,685
|
33,949
|
21,363
|
56,828
|
43,172
|
5,91·10-19
|
-18,23
|
-380241
|
|
4
|
1139
|
47,23
|
37,926
|
14,842
|
55,464
|
44,535
|
1,03·10-17
|
-16,99
|
-370647
|
|
5
|
916
|
1189
|
48,45
|
39,911
|
11,636
|
54,833
|
45,167
|
1,33·10-16
|
-15,87
|
-361552
|
|
6
|
966
|
1229
|
49,028
|
40,868
|
10,101
|
54,54
|
45,46
|
1,38·10-15
|
-14,86
|
-352696
|
По данным таблицы 1 строим график зависимости состава равновесной газовой
смеси для реакции газификации углерода от температуры.
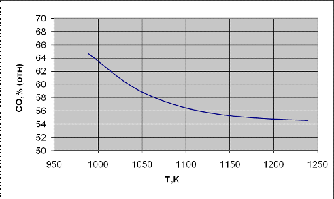
Рисунок 1 - график зависимости состава равновесной газовой смеси углерода
от температуры
Вывод: Проанализировав график, сделаем вывод, что при увеличении
температуры концентрация СО уменьшается.
Строим график зависимости равновесного давления кислорода в газовой смеси
для реакции газификации углерода от температуры.

Рисунок 2 - график зависимости равновесного давления от температуры
Вывод: Проанализировав график, сделаем вывод, что при увеличении
температуры давление над кислородом в газовой реакции газификации углерода
увеличивается.
Строим график зависимости кислородного потенциала для равновесной газовой
смеси СО-СО2 от температуры.
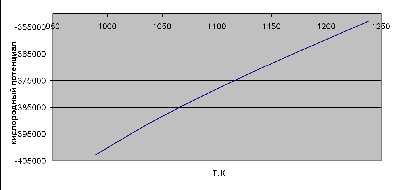
Рисунок 3 - график зависимости кислородного потенциала от температуры
Вывод: Проанализировав график, сделаем вывод, что при увеличении
температуры кислородный потенциал для равновесной газовой смеси СО-СО2
увеличивается.
Задача №2 Восстановление оксида железа оксидом углерода и
водородом
диссоциация оксид углерод водород
Определить равновесный состав газовых реакций восстановления оксидов
железа водородом при заданной температуре (Т=1150К).
Решение:
1.
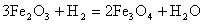 ;
;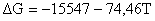
.
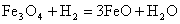 ;
;
.
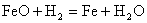 ;
;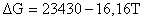
.
 , при Т<843 К;
, при Т<843 К; 
Т.к.
Т=1150 К то реакция под номером 4 происходить не будет
Определим
константы равновесия для каждой реакции по формуле
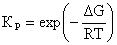 (1)
(1)
 39420,69
39420,69
 3,784
3,784
 0,602
0,602
где
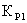 ,
, ,
,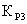 - константы равновесия для первой, второй и третьей
реакции соответственно.
- константы равновесия для первой, второй и третьей
реакции соответственно.
Но
константа равновесия реакции находится еще и по следующей формуле:
 (2)
(2)
где
 - давления паров воды и водорода
- давления паров воды и водорода
Общее
давление равно 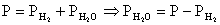 (3)
(3)
Общее
давление примем равным 1.
Подставим
(3) в (2) и получим:
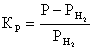 (4)
(4)
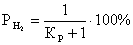 , (5)
, (5)
где
РН2 будет определять долю Н2 в реакции восстановления в
процентах
Подставим
вместо КР значения, полученные по формуле (1).
Равновесный
состав газовых реакций восстановления оксидов железа водорода предоставлен в
таблице 2
Таблица
2
%H2
|
%H2O
|
|
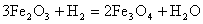 0,00253699,997464 0,00253699,997464
|
|
|
|
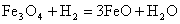 20,90379,097 20,90379,097
|
|
|
|
 62,42237,578 62,42237,578
|
|
|
Библиографический список
1. Рыжонков,
Д.И. Теория металлургических процессов: учебное пособие для вузов / Д.И.
Рыжонков, П.П. Арсентьев, В.В. Яковлев и др. - М.: Металлургия, 1989. - 392 с.
. Попель,
С.И. Теория металлургических процессов: учебное пособие для вузов / С.И.
Попель, А.И. Сотников, В.И. Бороненков. - М.: Металлургия, 1986. - 463 с.
. Падерин,
С.Н. Теория и расчеты металлургических систем и процессов: учебное пособие для
вузов / С.Н. Падерин, В.В. Филиппов. - М.: МИСИС, 2002. - 334 с.
. Казачков,
Е.А. Расчеты по теории металлургических процессов: учебное пособие для вузов /
Е.А. Казачков. - М.: Металлургия, 1988. - 288 с.