Взаимодействие 1,3-дегидроадамантана с бромистым и хлористым аллилами
Дипломная
работа
Взаимодействие
1,3-дегидроадамантана с бромистым и хлористым аллилами
Аннотация
В работе изучено взаимодействие 1,3-дегидроадамантанов с
аллилгалогенидами. Работа содержит литературный обзор, обсуждение результатов,
экспериментальную часть, инженерные расчеты и выводы.
Работа содержит 65 страниц, 6 рисунков, 8 таблиц, 46 литературных ссылок.
Введение
Адамантан - трицикло[3,3,1,13,7]декан - является трициклическим
насыщенным мостиковым углеводородом состава С10Н16, состоящим из трех
циклогексановых колец в конформации «кресло»; пространственное расположение
атомов углерода в молекуле адамантана такое же, как и в кристаллической решетке
алмаза. Впервые данное соединение было получено С. Ландой и В. Махачеком в 1933
г. при исследовании нефти Годонинского месторождения (Чехословакия).
Впоследствии адамантан был найден в ряде нефтей других месторождений.
Содержание адамантана в нефти в зависимости от ее характера составляет 0,03 -
0,0001 %, обычно это содержание больше для нефти с большим содержанием
нафтеновых углеводородов. К настоящему времени в нефти найдено около тридцати
углеводородов ряда адамантана, общее содержание которых в 10 и более раз
превышает содержание самого адамантана. Затем были разработаны синтетические
методы получения адамантана в лаборатории [1]
Целью данной работы является исследование взаимодействия
1,3-дегидроадамантана с бромистым и хлористым аллилами. Для достижения этой
цели, нам необходимо решить ряд задач:
1. Изучить взаимодействие 1,3-ДГА с бромистым и хлористым аллилами;
2. Исследовать хромато-масс-спектр реакционной массы данного
взаимодействия;
. Разработать эффективный метод получения
3-галоген-1-аллиладамантанов.
В работе мы будем использовать такой физико-химический метод анализа как
масс-спектрометрия. Сущность метода масс-спектрометрии заключается в переводе
молекул образца в ионизированную форму с последующим разделением и регистрацией
образующихся при этом ионов. Масс-спектр позволяет сделать выводы о
молекулярной массе соединения, его составе и структуре.
Поставленные перед нами цели являются чрезвычайно актуальными, поскольку
соединения на основе адамантана представляют собой еще не достаточно изученное
и активно развивающееся направление химической технологии. Кроме того,
перспективность применения производных адамантана обуславливается набором
специфических свойств: относительно большой размер адамантильного радикала (его
диаметр составляет 5Å), высокая липофильность (растворимость в неполярных
растворителях), конформационная жесткость. Последние два свойства особенно
важны при создании новых лекарственных препаратов. Введение адамантильного
радикала повышает, в целом, термическую стабильность вещества и его стойкость к
окислению и радиационному облучению, что важно, в частности, при получении
полимеров со специфическими свойствами. Вот лишь некоторые области применения
производных адамантана:
1. Входит в состав полимеров, отличающихся высокими температурами
стеклования, размягчения, низкой усадкой. Подобные полимеры применяются для
получения оптических стекол ;
2. Используется в лазерах на органических соединениях для продления
времени их работы, поскольку не имеет полос поглощения в ультрафиолетовом
диапазоне ;
. Как сырье для получения медицинских препаратов, обладающих
антивирусной (ремантадин, амантадин, троматадин) и неврологической активностью
(в том числе для борьбы с болезнью Паркинсона). [1]
1. Литературный обзор
.1 Методы получения целевого продукта
Бромпроизводные адамантана
-бромметиладамантан. Нагревают 4 часа при 1000 1-гидроксиметиладамантан с
насыщенным при 00 С раствором бромистого водорода в безводной уксусной кислоте.
Выход 85%
[2]:
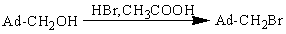
2
3-бромметил-1-метиладамантан
Раствор
спирта 1-метил-3-гидроксиадамантана в ледяной уксусной кислоте, насыщенной при
00 С бромистым водородом, нагревают на кипящей водяной бане 4 часа. Выход 97 %
[2]:

3
3-(
β -бромэтил)-1-метиладамантан
Получают
из спирта 1-метил-3-(β-гидроксиэтил)адамантана и насыщенного при 00 С раствора
бромистого водорода в уксусной кислоте. Выход 97 % [2]:
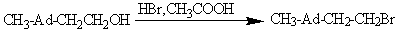
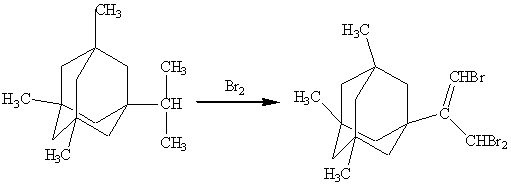
2-(1-адамантил)-1,3,3-трибром-1-пропен
Смесь
2-(1-адамантил)-2-бромпропана и брома нагревают с обратным холодильником в
течение 2 часов. Выход 61 %[3]:
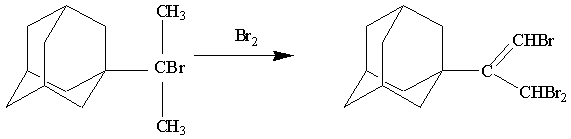
2-(3,5,7-триметил-1-адамантил)-2-бромпропан
Соединение
2-(3,5,7-триметил-1-адамантил)пропен нагревают с раствором бромистого водорода
в ледяной кислоте при 1000 в течение 10 часов. Выход 95 %[3]:
2-(3-бром-1-адамантил)-1,3,3-трибромпропен
Соединения
2-(3-бром-1-адамантил)-2-бромпропан и бром нагревают с обратным холодильником в
течение 5 часов. Выход 95 %[3]:

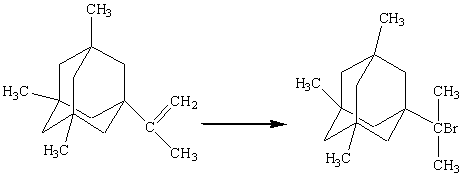
2-(3,5,7-триметил-1-адамантил)-1,3,3-трибромпропен
Смесь
соединения 1-изопропил-3,5,7-триметиладамантана и брома нагревают с обратным
холодильником. Выход 97%[3]:
Хлорпроизводные адамантана:
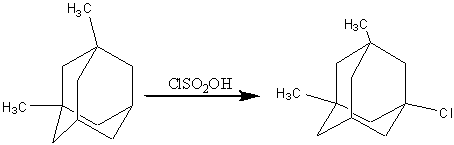
,3-диметил-5-хлорадамантан
К ClSO3H, охлажденной до 00 С, добавляли по каплям
1,3-диметиладамантан, перемешивали 1 час при охлаждении льдом и выливали на
лед. Выход 75 %[4]:
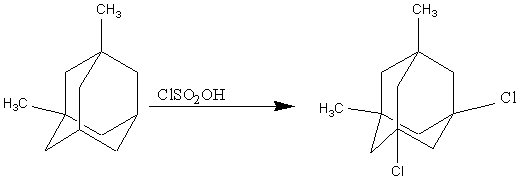
1,3-диметил-5,7-дихлорадамантан
Смесь выдерживают при 0-50 С 60 часов. Выход 83 %[4]:
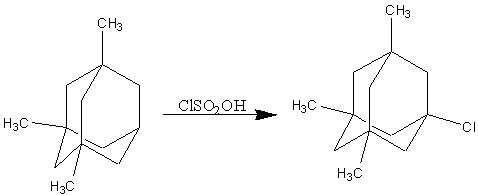
1,3,5-триметил-7-хлорадамантан
К
1,3,5-триметиладамантану, охлажденного до 50 С, добавляли ClSO3H.
Смесь перемешивали 1 час, выливали на лед и экстрагировали CHCl3.
Выход 92 %[4]:
При взаимодействии 1,3-ДГА с этиловым эфиром
хлоруксусной кислоты (1), методом хромато-масс-спектроскопии установлено
образование смеси продуктов реакции как по С-Н, так и по С-Сl связям, с преобладанием этилового
эфира 2-(адамант-1-ил)-2-хлоруксусной кислоты (1а). Аналогичное наблюдалось и
при взаимодействии 1,3-ДГА с этиловыми эфирами других 2-хлоркарбоновых кислот
(2, 3)[5]:
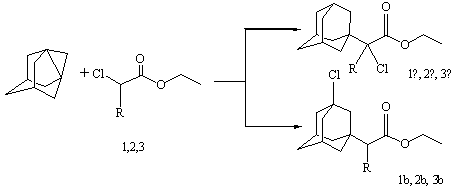
R = H(1),
Me(2), Et(3)
Эфир 2’-(3-хлор-адамант-1-ил)-2’,2’-дихлоруксусной
кислоты
С увеличением числа атомов хлора в молекуле исходного
эфира соотношение продуктов реакции по С-Н и С-С1 связям изменяется в пользу
последних. Так взаимодействие 1,3-ДГА с этиловым эфиром трихлоруксусной кислоты
приводит селективно к эфиру 2’-(3-хлор-адамант-1-ил)-2’,2’-дихлоруксусной
кислоты[5]:
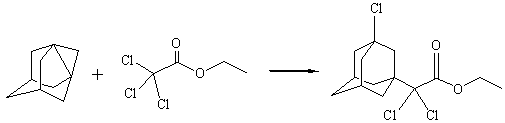
Фторпроизводные адамантана:
Адамантанкарбоновые кислоты гладко превращаются при действии
четырехфтористой серы в соответствующие трифторметильные производные. Таким
способом синтезированы 1-трифторметил- и 1,3бис(трифторметил)-адамантаны [6]:


При бромировании в присутствии BF3 1-трифторметиладамантана получен 1-трифторметил-3-бромадамантан:

Фторирование
2-карбоксильных и карбонильных производных адамантана
-(трифторметил)-5,7-дифторадамантан
Фторирование
адамантан- 2-карбоновой кислоты четырехфтористой серой в безводном фтористом
водороде при 1600 С позволяет ввести два атома фтора в адамантановый цикл и
приводит к образованию 2-(трифторметил)-5,7-дифторадамантана [7]:

2-(гексафторизопропилиден)-5,7-дифторадамантан
С
целью дальнейшего выяснения влияния электроотрицательных трифторметильных групп
на способность атомов водорода в узловых положениях адамантана замещаться
атомами фтора при окислительном фторировании было проведено фторирование
изопропилиденового эфира (адамантилен-2)малоновой кислоты четырехфтористой серой
во фтористом водороде. При этом был выделен
2-(гексафторизопропилиден)-5,7-дифторадамантан [7]:

1,3-ди(трифторметил)-5,7-дифторадамантан
Повышение
температуры в реакции 1,3-ди(трифторметил)адамантана с четырехфтористой серой и
фтористым водородом до 200-2100 С позволяет ввести в молекулу еще два атома
фтора и получить 1,3-ди(трифторметил)-5,7-дифторадамантан [7]:

Не
только адамантанкарбоновые кислоты фторируются четырехфтористой серой, но в
алкил- и ариладамантилкетонах карбонильные группы можно превратить в
дифторметильные. Так, адамантилметилкетон в реакции с SF4 превращается
в 1-(1,1-дифторэтил)адамантан, а адамантилфенилкетон - в 1-(a, a-дифторбензил)адамантан [7]:
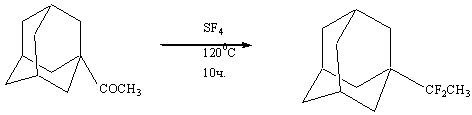

При
взаимодействии адамантан-1-карбоновой кислоты с SF4 в
присутствии большого избытка фтористого водорода происходит как превращение
карбоксильной группы в трифторметильную, так и замена двух атомов водорода
атомами фтора у третичных атомов углерода адамантанового цикла [8]:
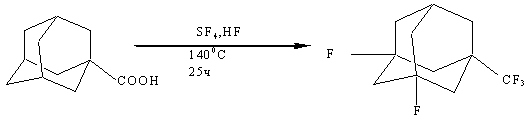
Продукт
этой реакции - 1-трифторметил-3,5-дифторадамантан.
Такая
же зависимость наблюдается и в реакции с адамантан-1-уксусной кислотой:

Продукт
этой реакции - 1-(2,2,2-трифторэтил)-3,5,7-трифторадамантан.
Получение
бромфторпроизводных адамантана
-(трифторметил)-3,5,7-трибромадaмантан
Установлено,
что 1-(трифторметил)-3,5,7-трифторадамантан не реагирует ни с едким кали, ни с
этилатом натрия в спирте при кипячении в течение нескольких часов. При действии
на это же соединение трехбромистого бора осуществляется обмен атомов фтора,
расположенных в узловых положениях, и образуется
1-(трифторметил)-3,5,7-трибромадaмантан [9]:

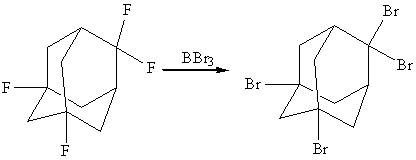
,2-дифтор-5,7-дибромадамантан
BBr3 при
действии на 2,2,5,7-тетрафторадамантан не вызывает обмена атомов фтора во
втором положении и изомеризации - образуется 2,2-дифтор-5,7-дибромадамантан
[10]:
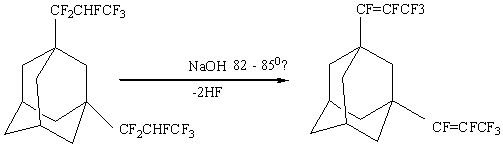
ди(перфторпропенил)адамантан
Дегидрофторирование
1,3-бис-(2Н-гексафторпропил)-адамантана [11]:
2-(адамант-1-ил)-2-фторуксусная кислота
Взаимодействие 1,3-ДГА с этил-2-фторацетатом протекает
исключительно с разрывом связи С-Н в исходном эфире и приводит к образованию
этилового эфира 2-(адамант-1-ил)-2-фторуксусной кислоты с выходом 65 %[12]:

Получение галогеналкиладамантанов:
Взаимодействие с галогеналкилами
Галогеналкилы малоэффективны в качестве алкилирующих агентов; реакции
адамантанов в этих случаях протекают неселективно и зачастую сопровождаются
реакциями галогенирования [1]:
С образованием непредельных полизамещенных бромидов
вступают в реакцию бромирования также некоторые тетрациклические углеводороды
ряда адамантана [1]:

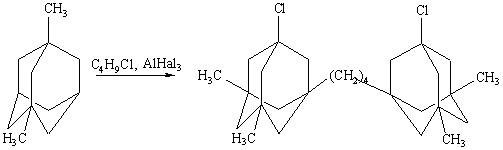
1-бромэтаноадамантан
В
2,4-этаноадамантане различную реакционную способность проявляет каждый из
четырех третичных атомов углерода. В присутствии бромистого алюминия и
бутилбромида углеводород с высокой селективностью образует 1-бромэтаноадамантан
[1]:

Взаимодействие
1,3-ДГА с a-бромкетонами:
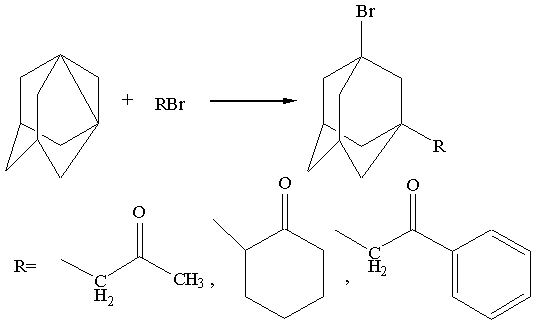
К 2-3-кратному мольному избытку соответствующего α-бромкетона приливают раствор
1,3-дегидроадамантана в легкокипящем инертном растворителе (диэтиловый эфир),
при этом наблюдается экзотермический эффект. Раствор 1,3-дегидроадамантана и α-бромкетона в диэтиловом эфире
нагревают в течение 3-4 часов при температуре кипения реакционной смеси (34-40°
С), после чего растворитель и избыток исходного α-бромкетона отгоняют в вакууме
водоструйного насоса. Возможна регенерация исходных α-бромкетонов путем их отгонки из
реакционной смеси и организация рецикла с добавлением рассчитанного количества
свежего α-бромкетона. Синтезированные
3-бромадамантил-1-алкил(арил)кетоны очищают вакуумной перегонкой. Выходы данных
продуктов составляют 59-86 %. [13]
1-бром-3-бромметиладамантан
Получен взаимодействием 3,7-диметиленбицикло[3,3,1]нонана с 4 % раствором
брома в безводном метиловом спирте в присутствии оксида ртути(HgO) при 00 С [1]:

Иодид N- (3-иод-1 -адамантил)пиридиния
Получен обработкой 1,3-дегидроадамантана иодом в присутствии пиридина
[14]:

Получение 1-(1-адамантил-1)-пропанола-1
В трехгорловую колбу, снабженную обратным холодильником и газоподводящей
трубкой, помещают 1,2 г (0,0079 моля) адамантанола; 1,5 мл (0,064 моля)
трифторуксусной кислоты; 15 мл хлористого метилена и при комнатной температуре
в течение 7 ч. Пропускают 0,5 л (0,022 моля) сухого пропилена. По окончании
реакции смесь разлагают разбавленным раствором соды и экстрагируют эфиром. Эфир
отгоняют, к остатку добавляют 15 мл 20 % раствора щелочи калия и кипятят в
течение 4 ч, после чего экстрагируют эфиром. Эфирные вытяжки промывают водой до
нейтральной реакции, высушивают над сульфатом магния, эфир отгоняют.
Сырой 1-(1-адамантил-1)-пропанол-1 перекристаллизовывают из петролейного
эфира (т. кип. 38-50° С). Выход 10,76 г, т.е. 66 %, считая на адамантанол-1,
вступивший в реакцию, и 50 % - на введенный, т. пл. 85-86° С. [15]
Взаимодействие адамантана с пропиленом
В стальной автоклав емкостью 50 мл загружают 1 г адамантана, 5 мл
циклогексана и 1 мл окиси алюминия, обработанной 3 н. серной кислотой,
добавляют пропилен при 20° С до 8 атм. Мольное отношение адамантан : пропилен
равно 1:6. Реакцию ведут при 190° в течение 5 ч. Получают 1,10 г продукта
(выход 110 % на адамантан). Выделение пропениладамантанов осуществляют методом
адсорбционной хроматографии, пропуская полученную смесь над силикагелем с азотнокислым
серебром. Получают 0,45 г продукта. [16]
Получение 1-виниладамантана
В реактор помещают 0,3 г катализатора (Re2O7, Al2O3), добавляют
раствор 1 г 1-пропениладамантана в 5мл н-гептана, через барботер пропускают
этилен (100 мл). Температура 200 С, давление атмосферное, длительность 1 ч. О
протекании реакции судят по содержанию пропилена в отходящем газе. Жидкие
продукты реакции отделяют от катализатора, отгоняют растворитель. Анализ
продуктов реакции осуществляют ГЖХ, ИК-, ПМР- и масс-спектрометрическими
методами. Выход (98 %) и селективность (99 %) практически не зависят от
заместителя а адамантановом ядре. [17]
Получение аллиладамантанов
В реактор помещают 21,5 г 1-бромадамантана и 12,1 г бромистого аллила в СS2 при -700С. Добавляем 1 г AlCl3. Повышаем температуру до - 300 С.
Длительность процесса 1 ч. Затем помещаем реактор в холодную воду или раствор
воды с эфиром. Добавляем MgSO4
и 25,5 г 1-(2,3-дибромпропил)адамантана. Реакцию ведем при атмосферном
давлении. Добавляем 7,8 г цинка и 70 мл 95 % этанола. Ведем реакцию еще 2,5 ч,
затем помещаем продукт в холодную воду. Выход 1-аллиладамантана составляет 89
%. [18]
1.2 Анализ основной реакции
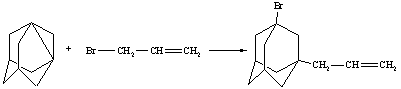
Таблица 1 - Физические свойства реагентов и продуктов реакции
|
Вещество
|
Фазовое состояние
|
Плотность, г/см3
|
ТКИП. ТПЛ.,° С
|
Примечание
|
|
C10H14 1,3-ДГА
|
Кристаллы белого цвета
|
-
|
55,68 152,659
|
Tвозг.=100-130° С при р=20 мм рт. ст. легко растворим
в простых эфирах, алканах, ацетоне, легко взаимодействует с влагой воздуха
уже при комнатной температуре. Полимеризуется при 130-160° С в запаянной
ампуле.
|
|
C3H5Br Бромистый аллил
|
Б/ц жидкость
|
1,398
|
71,3 -119,4
|
Не растворим в воде,
диэтиловом эфире и этиловом спирте. Растворим в хлороформе, сероуглероде и
тетрахлорметане.
|
Свойства реагентов и продуктов реакции взяты из литературных данных [19,
20].
Электронная структура реагентов и продуктов реакции
Электронная структура 1,3-дегидроадамантана
После разработки эффективного метода получения 1,3-ДГА стал доступным
соединением и применяются для получения 1-замещенных и 1,3-дизамещенных
адамантанов. Однако механизмы таких реакций до сих пор детально не изучены.
Было определено электронное строение катион-радикала 1,3-ДГА-одного из
основных возможных интермедиатов химических превращений данного соединения и
его производных. После проведения серии квантовомеханических расчетов
геометрического и электронного строения 1,3-ДГА была подтверждена sp2-гибридизация атомов углерода С1 и
С3 центральной связи, так как сумма валетных углов ∟ССС при этих атомах
углерода 124,10·2+111,60=359,80 близкое к значению 3600, характерному для sp2-гибридизованных атомов углерода.
Примечательно, что область повышенной электронной плотности для 1,3-ДГА
лежит с обратной стороны 1,3-узловой связи инвертированных углеродных атомов,
т.е. в части пространства, наименее защищенной от внешней атаки. В результате
этого 1,3-ДГА может проявлять свойства сильного основания. Формально считают,
что пропелланы, в том числе обсуждаемый 1,3-ДГА являются «олефинами» с
непривычной топологией sp2-гибридных
углеродных атомов, что определяет необычно высокую реакционную способность этих
соединений.
Считается, что такое поведение обусловлено особенностью электронного
строения одного из основных возможных интермедиатов химических превращений
1,3-ДГА и его производных - катион-радикала (КР) 1,3-ДГА.
В 1999г. Сотрудниками МГУ им. Ломоносова и Волгоградского ГТУ было
установлено, что необычное электронное строение КР 1,3-ДГА вызвано изменением
ориентации однакратно занятой молекулярной орбитали в ходе ионизации молекулы
1.3-ДГА.
Ранее было установлено, что при однократной ионизации циклопропановое
кольцо изменяет свою структуру путем сильного удлинения (и ослабления) либо
одной С-С-связи, либо одновременно двух (в зависимости от заместителя):
При повышении температуры одна удлиненная С-С-связь циклопропановых (в
обоих случаях) с легкостью испытывает дальнейшее удлинение, которое
сопровождается разворотом одной из концевых метиленовых групп на 900. В
результате этого образуется изомерные формы КР, в которых положительный заряд и
спиновая плотность пространственно разделены. Такие формы КР названы
дистоническими.
В 1,3-дегидроадамантане центральная тетразамещенная С1-С3-связь
циклопропанового кольца наиболее удлинена (1,5720 А) и, следовательно, обязана
при однократной ионизации испытывать дальнейшее удлинение. Однако в 1,3-ДГА
положение циклопропанового кольца жестко фиксировано норадамантановым
фрагментом, поэтому для катион-радикала дальнейшее растяжение центральной
циклопропановой С1-С3-связи с разворотом одной из ее составляющих частей на 900
невозможно.
В катион-радикале 1,3-ДГА атомы углерода С1 и С3 приобретают частично
тетраэдрическое строение. В каждом радикале 1,3-ДГА рассматриваемое значение
85,30 валентного угла ∟ССС превышает значение ~ 800, характерное для
циклической формы КР циклопропана, отвечает ситуации, при которой тип
однократно занятой молекулярной орбитали, по всей видимости, уже обязан
измениться.
В отличие от других пропелланов, в которых однократно занятая
молекулярная орбиталь локализована на центральной С1-С3-связи, в КР 1,3-ДГА она
преимущественно локализована на примыкающих к С1-С3-связи четырех
углерод-углеродных связях. Причиной необычного электронного строения КР 1,3-ДГА
является наличие дополнительной CH2-метиленовой
группы в 1,3-ДГА по сравнению с пропелланом, что приводит к повышению энергии
молекулярной орбитали центральрой связи С1-С3.
Необычность электронного строения КР 1,3-ДГА также состоит в том, что
приразрыве центральной связи С1-С3 образуются две однакратно занятые
несвязанные между собой p-орбитали
атомов углерода, что фактически означает образование бирадикальной структуры.
На основе изложенных особенностей строения катион-радикала 1,3-ДГА
объясняется необычное в ряду пропелланов химическое поведение 1,3-ДГА в
реакциях электрофильного присоединения.
Таким образом, на основании строения 1,3-ДГА можно сделать вывод о его
чрезвычайной реакционной способности и перспективности данного пропеллана в
качестве исходного реагента для синтеза адамантилсодержащих карбонильных
соединений.
В результате проведенного опыта: взаимодействие 1,3-ДГА с CBr4 мы получаем новое вещество, а
электронной структуры его не знаем, т.к. это новое вещество. [1]
Больший интерес у нас вызывает 1,3-ДГА, электронное строение которого мы
описали выше.
Бромистый аллил

В
молекуле бромистого аллила наблюдаются отрицательные индуктивный и мезомерный
эффекты. Индуктивный эффект представляет собой смещение электронной плотности
вдоль σ
связи в сторону атома брома. Мезомерный
эффект - это смещение π
электронного облака вдоль двойной связи в
сторону заместителя.
1.3 Химические свойства реагентов и продуктов реакции
Химические свойства аллилов
Галогензамещенные олефины с галогеном у насыщенного атома углерода способны
довольно легко присоединять галоген. Например, присоединением брома к
бромистому аллилу в ЧХУ при -5° С получается 1,2,3-трибромпропан с выходом
96-98 %.
Наличие галогена у насыщенного атома углерода затрудняет присоединение
галогена, способность присоединения снижается в ряду: [21]
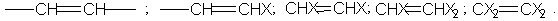
В
темноте и в отсутствии кислорода чистый свежеприготовленный бромистый аллил за
10 суток количественно присоединяет HBr с образованием «нормального»
1,2-дибромпропана. «Нормальному» присоединению значительно способствует добавка
ZnBr2.
В присутствии малых количеств кислорода или перекисей, добавляемых или
содержащихся в старых препаратах, за 30 мин. Из бромистого аллила образуется
«аномальный» 1,3-дибромпропан. «Аномальное» присоединение является
радикально-цепной реакцией, которая инициируется специальными
радикалообразующими веществами или фотохимически в жидкой и газовой фазах. [22]
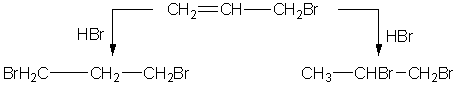
«аномальное»
присоединение «нормальное» присоединение
Индуцированное
бромом аутоокисление бромистого аллила до перекиси α,α’-дибромизопропила. [23]
К раствору 0,2 моль хлористого аллила и 0,002 моль перекиси бензоила в
ЧХУ или CH2Cl2 по каплям прибавляют смесь приблизительно одинаковых
количеств SO2Cl2 (0,15-0,3 моль) и ЧХУ с такой скоростью, чтобы смесь слабо
кипела, и после окончания прибавления кипятят ещё около часа. Выход 80-90 %.
[22]
Химические свойства 1,3-дегидроадамантана
Подобно другим ациклическим углеводородам, содержащим напряженный
трехчленный цикл, 1,3-дегидроадамантан и его производные обладают высокой
реакционной способностью. Связь С(1)-С(3) значительно ослаблена, ее длина; ее
длина 1,64 Å (длина других С-С связей в адамантане 1,53 Å).
Вследствие этого реакции
1,3-дегидроадамантана протекают селективно с раскрытием трехчленного цикла и
образованием 1-моно- или 1,3-дизамещенных производных адамантана; иногда
происходит также фрагментация адамантанового цикла.
Окисление 1,3-дегидроадамантана воздухом при 20° С в гептане
приводит к образованию пероксида, который разлагается со взрывом при 160° С. На
воздухе в растворе пентана при комнатной температуре 1,3-дегидроадамантан
превращается в смесь сополимеров с кислородом, главным из которых является
взрывоопасный полипероксиадамантан (ОС10Н14О)n. При нагревании (130-160° С) в запаянной ампуле
1,3-дегидроадамантан превращается в белый полимер - 1,3-полиадамантан состава (C10H14)n,
нерастворимый в органических растворителях и устойчивый в атмосфере азота при
400° С. Аналогичный полидиметиладамантан образуется из
1,3-дегидро-5,7-диметиладамантана при 90-145° С. В отсутствие кислорода
1,3-дегидроадамантан термически устойчив, период полупревращения при 195° С в
растворе н-октана составляет 4 ч. Каталитическое гидрирование 1,3-дегидроадамантана
приводит к адамантану с выходом 82 %; при взаимодействии 1,3-дегидроадамантана
с бромом или иодом образуется соответственно 1,3-дибром-или 1,3-дииодадамантан.
[1]
Взаимодействие с дихлоркарбеном
В условиях каталитического генерирования дихлоркарбена
1,3-дегидроадамантан присоединяет 2 экв. карбена с образованием
спиро[7-дихлорметиленбицикло [3,3,1] ионан-3,1’- (2’,2’-дихлорциклопропана)]
[24]:

Взаимодействие
с арилиодозокарбоксилатами
Исследована
реакция 1,3-дегидроадамантана с арилиодозокарбоксилатами общей формулы Ar(OCOR)3,
где R=Alk, Ar. Основными продуктами реакции, протекающей в инертных
растворителях при комнатной температуре, являются иодбензол и
1,3-диацилоксипроизводные адамантана. [25]
Взаимодействие
с ацетонитрилом
,3-Дегидроадамантан,
образующийся при электровосстановлении 1,3-дибромадамантана в ацетонитриле на
ртутном электроде, реагирует с ацетонитрилом и содержащейся в нем водой, давая
1-гидрокси-и 1-ацетоаминоадамантаны [26]:

Присоединение
уксусной кислоты к 1,3-дегидроадамантану приводит к 1-адамантилацетату.
При
взаимодействии 1,3-дегидроадамантана с малеиновым ангидридом, акрилонитрилом,
диметиловым эфиром ацетилендикарбоновой кислоты образуются олигомерные
продукты. Реакцию проводят при комнатной температуре и в отсутствие инициаторов
полимеризации; гомополимеризация каждого из этих мономеров протекает в более
жестких условиях. Известен ряд других реакций 1,3-дегидроадамантана,
протекающих с раскрытием трехчленного цикла и приводящих к получению
производных, представляющих интерес в отношении физиологической активности [27,
28, 29]:
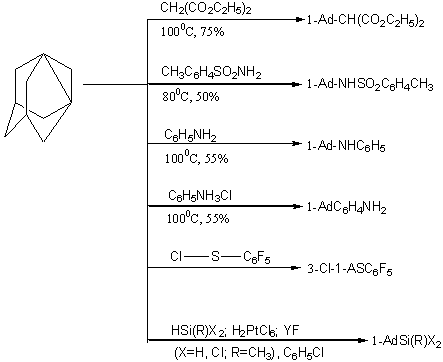
Взаимодействие 1,3-ДГА с рядом алифатических альдегидов:

IV=H: R2= Ме (I),
Pr (II), Bu (III); R1 = R2 = Me (IV)
Для получения 2-(1-адамантил)-2-метилпропаналя с хорошим выходом
целесообразно осуществлять взаимодействие в следующих условиях: проведение
реакции в среде исходного альдегида, с молярным соотношением 1,3-ДГА:
2-метилпропаналь равном 1:4-6, при температуре 35-400 С, в течение 3-5 часов.
Увеличение температуры реакции с 20 до 400 С выход возрастает с 38 до 74
%. Дальнейшее повышение температуры (с 50 до 650 С) ведет к снижению выхода
целевого соединения до 42 %, что по- видимому связано с протеканием побочной
реакции альдольной конденсации. [30]
Взаимодействие 1,3-ДГА с кетонами:

R1= R2= H, R3= t-Bu (IX); R1= H, R2=
Ме: R3= Ме (X), Et (XI);
R1= H, R2 = Et, R3= Pr (XII); R1= H, R2 = Pr: R3= Ме
(XIII),(XIV); R1= R2 = Me: R3= Pr (XV)
Адамантилирование в среде исходных кетонов, в атмосфере сухого, очищенного
от кислорода азота, в отсутствие катализатора, при мольных соотношениях
1,3-ДГА: кетон равном 1: (2-8), при температуре 60-1200 С, в течение 6-14 часов
и приводит к целевым a-адамантилсодержащим
кетонам (IX-XVI) с выходом 30-88 %.
Установлено, что при увеличении продолжительности реакции с 4 до 10-14
часов, выход 2-(адамантил)-циклопентанона увеличивался с 41 до 86 %.
Изменение молярного соотношения реагентов 1,3-ДГА: циклопентанон с 1:6 до
1:2 приводит к некоторому снижению выхода. [31]
Взаимодействие с фторсодержащими b-дикетонами
,3-ДГА быстро (за 1,5-2 часа) взаимодействует с разнообразными
фторсодержащими b-дикетонами
типа RFC(O)CH2C(O)R в среде кипящего
диэтилового эфира, в атмосфере сухого и очищенного от кислорода азота:
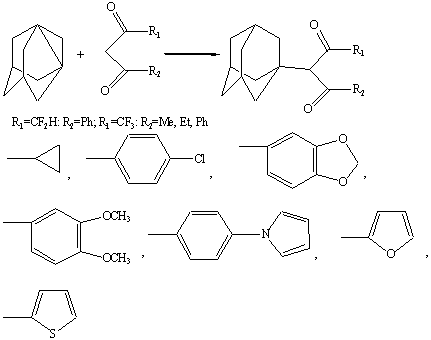
При этом соответствующие фторсодержащие адамант-1-ил-b-дикетоны образуются с выходом 87-98
%. Оптимальное мольное соотношение 1,3-ДГА: b-дикетон = 1:1,5-2, меньший избыток b-дикетона приводит к неполной
конверсии 1,3-ДГА [30].
Взаимодействие 1,3-ДГА с циклическими b-дикетонами [31]:

Взаимодействие
1,3-ДГА с кетоэфирами
Взаимодействие
1,3-ДГА с рядом кетоэфиров и 2-карбоксиметилциклопентаноном:
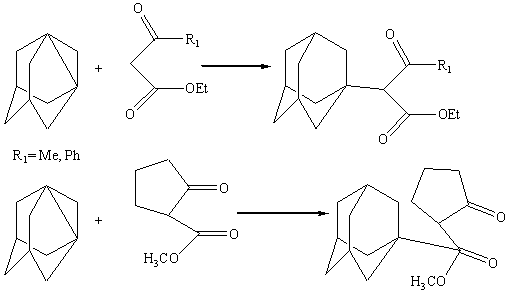
Адамантилирование ацетоуксусного эфира в условиях синтеза
адамантилсодержащих b-дикетонов
привело к относительно невысокому (51 %) выходу этилового эфира
2-(1-адамантил)-3-оксоизомасляной кислоты. Увеличение продолжительности реакции
до 4 часов привело к повышению выхода до 83 %. При адамантилировании этилового
эфира бензоилуксусной кислоты и 2-карбоксиметилциклопентанона в кипящем
диэтиловом эфире получены соответствующие адамантилсодержащие кетоэфиры с
выходами 90 и 95 % соответственно, при продолжительности взаимодействия 4 часа.
[30]
1.3.2.10 В последнее время интенсивно изучаются
полимеры на основе 1,3-ДГА. В частности, сополимеризация 1,3-дегидроадамантана
с электрондефицитными винильными мономерами, протекающая в тетрагидрофуране при
комнатной температуре с выходом до 88%, изучена коллективом из Японии [32]:
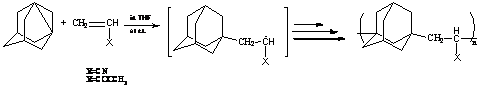
В
отличие от 1,3-полиадамантана, полученные сополимеры растворимы в различных
органических растворителях, включая хлороформ и тетрагидрофуран.
Поли(5-бутил-1,3-адамантан)
[33, 34], поли(6-бутил-6-метил-1,3-адамантан) [34], полученные катионной
полимеризацией с раскрытием цикла теми же авторами в присутствии CF3SO3H в
среде CH2Cl2 при 0°С за 6-42 ч. Полученные соединения растворимы
в хлороформе, ТГФ и 1,2-дихлорбензоле, но не растворимы в гексане, бензоле,
метаноле и воде. Строение полученных соединений доказано ИК-, 1H и
13C ЯМР-спектроскопией, элементным анализом.
2. Обсуждение результатов
.1 Химизм процесса
Анализ литературных данных указывает на возможность протекания реакции
между 1,3-дегидроадамантаном и аллилгалогенидами.
,3-Дегидроадамантан синтезировался из соответствующих дибромпроизводных
каталитической реакцией на Li-содержащих
катализаторах в тетрагидрофуране:
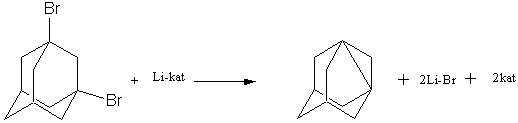
Исходное
дибромпроизводное всегда содержит инертные примеси моногалогенпроизводного и
адамантанола, которые отделить от целевых дегидроадамантанов очень сложно.
Поэтому данные примеси всегда присутсвуют в реакционной массе взаимодействия
дегидроадамантанов с протоноподвижными соединениями [1].
Как
было показано в литературном обзоре, 1,3-дегидроадамантан легко вступает в
реакции с галогенсодержащими соединениями.
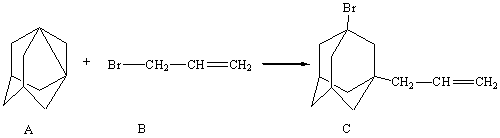
Взаимодействие
1,3-дегидроадамантана с данными аллилгалогенидами осуществлено нами впервые.
В качестве исходных реагентов в реакции присоединения к 1,3-ДГА нами были
использованы хлористый и бромистый аллилы. Реакции проводили в среде исходного
аллилгалогенида при температуре его кипения, в атмосфере сухого, очищенного от
кислорода азота, в отсутствии катализатора, в течение 2 часов. В случае
бромистого аллила реакция протекала с разрывом связи C-Br с получением
3-бром-1-аллиладамантана (1a).
Взаимодействием 1,3-ДГА с хлористым аллилом получены продукты как по связи
углерод-хлор (2a), так и
углерод-водород (2b), в близком
процентном соотношении, что, по-видимому, связано с высокой реакционной
способностью как атома хлора, так и протона метиленовой группы (Есв. С-Cl=417.2 кДж/моль, Есв. С-H=423.4 кДж/моль).

По
окончании реакции избыток аллилгалогенида отгоняли, полученные продукты
выделяли вакуумной перегонкой. Выход 3-бром-1-аллиладамантана составил 90%.
Разделить 3-хлор-1-аллиладамантан (2a) и 3-хлор-3-адамантил-1-пропен
(2b) не удалось ни данным методом, ни методом колоночной
хроматографии.
Структура
синтезированнох соединений подтверждена методами хромато-масс-спектрометрии
[35].
Наряду с целевым продуктом в реакционной массе взаимодействия 1,3-ДГА с
бромистым аллилом был обнаружен и идентифицирован аллиладамантиловый эфир,
являющийся продуктом взаимодействия 1,3-ДГА с аллиловым спиртом (примесь в
составе бромистого аллила).
2.2 Идентификация соединений
После отгонки избытка аллилгалогенида реакционная масса была исследована
методом хромато-масс-спектрометрии [36, 37].
Установлено, что в случае бромистого аллила реакция протекала с разрывом
связи C-Br с получением 3-бром-1-аллиладамантана (1a). Взаимодействием 1,3-ДГА с
хлористым аллилом получены продукты как по связи углерод-хлор (2a), так и углерод-водород (2b), в близком процентном соотношении.
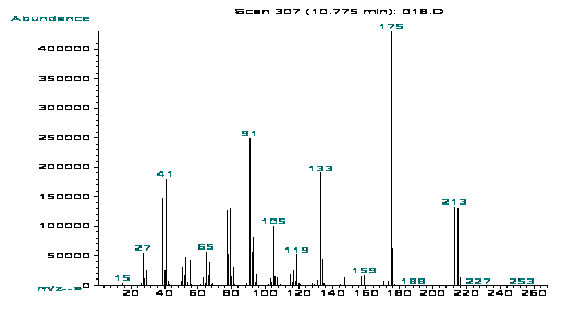

Рисунок 1 - Масс-спектр 3-бром-1-аллиладамантана
адамантан дегидрофторирование бром хлор

Рисунок 2 - Масс-спектр 3-хлор-1-аллиладамантана
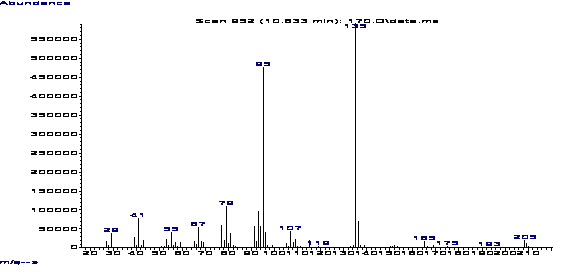
Рисунок 3 - Масс-спектр 3-хлор-3-(адамант-1-ил)-1-пропена
Масс-спектрометрическому изучению адамантанов с ненасыщенной боковой
цепью посвящен ряд работ [1, 38]. В то же время литературы о поведении
аллиладамантанов, имеющих в составе молекулы атом галогена, под действием
электронного удара практически нет.
В результате анализа масс-спектров полученных соединений выделен ряд
пиков, характерных для распада 3-(галоген)-1-аллиладамантанов(1a, 2a): пика тропилий-катиона (m/z 91), пика 1,3-адамантильного
иона с m/z 133(интенсивностью 37%(1a) и 29%(2a)), сигнал
бром-(m/z 213) или хлорадамантила(m/z 169), молекулярного иона слабой
интенсивности (2%(1a) и 3%(2a)). Масс-спектральный распад
3-хлор-3-адамантил-1-пропена(2b)
характеризуется наличием пиков, соответствующих ионам фрагментации
адамантанового каркаса (m/z 95, 107), 1-адамантильного иона (m/z 135),
являющегося самым интенсивным, молекулярного иона (m/z 209, 5%).
Исследование масс-спектров полученных соединений показало, что их
молекулярные ноны (М+) значительно менее устойчивы, чем молекулярный ион
аллиладамантана (для соединений 1a, 2a, 2b и аллиладамантана интенсивность М+ составят 2, 3, 5 и 92%
соответственно). Эти данные свидетельствуют о меньшей по сравнениию с
аллиладамантаном прочности СAd-СAllyl-связи
в аллиладамантанах, имеющие в составе молекулы атом галогена.
Таким образом, анализ масс-спектров полностью доказывает структуру
полученных соединений.
Таблица 1 - Параметры масс-спектров полученных соединений.
|
№
|
Соединение
|
Масс-спектр, m/z, I
|
|
1а
|
|
253, 2% М+;
213, 32% AdBr; 175, 100%[M - Br]; 133, 45% 1,3-Ad
|
|
2а
|
|
210,3% [М]; 169,
100% [AdCl]; 133, 31%
[1,3 - Ad]
|
|
2b
|
|
209, 5% [М]+;
175, 2% [Ad-CH-CH=CH2]+;135, 100% [1-Ad]
|
2.3 Механизм основной реакции
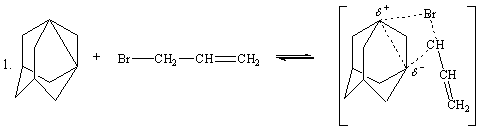
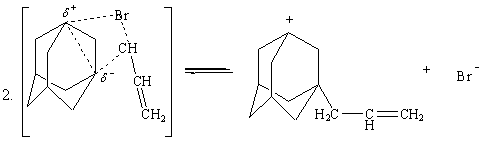
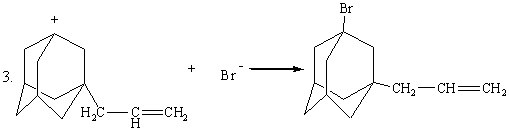
На
первой стадии катион-анионная пара бромистого аллила поляризует пропеллановую
связь 1,3-ДГА, образуется переходный комплекс. На второй стадии переходный
комплекс распадается, образуя адамантилаллильный катион и анион брома. На
третьей стадии образовавшийся адамантилаллильный катион быстро рекомбинирует с
анионом брома с образованием молекулы 3-бром-1-аллиладамантана.
При составлении механизма реакции были использованы литературные данные
[39].
2.4 Кинетическая модель реакции
Исходя из механизма, реакция является некаталитической и гомофазной,
соответствует второму порядку. Катализ в данной реакции отсутствует. Скорость
данной реакции будет определяться как произведение константы скорости реакции
на концентрацию 1,3 - дегидроадамантана и концентрацию бромистого аллила:
υr = K*С1,3-ДГА*СAllylBr
С1,3-ДГА - концентрация 1,3-дегидроадамантана; СAllylBr -концентрация бромистого аллила; К - константа
скорости химической реакции.
Из этого можно сделать вывод, что данная реакция является реакцией
второго порядка.
3. Экспериментальная часть
3.1 Свойства исходных соединений
,3-Дегидроадамантан синтезируется из соответствующих
1,3-дибромадамантанов по стандартной методике. Свойства 1,3-дегидроадамантана
соответствуют литературным данным [40]. Бромистый аллил синтезируется из
аллилового спирта по методике [41], его свойства соответствуют литературным
данным [42, 43].
3.2 Синтез 3-бром-1-аллиладамантана
В реактор с мешалкой поместили 165,44 г 1,3-ДГА (1,23 моль/мин) и 746,93
г (6,17 моль/мин) бромистого аллила. Реактор продувался инертным газом
(азотом). Реакционную смесь интенсивно перемешивали при t=70-80° C в течение двух часов.
По окончании реакции избыток бромистого аллила отгоняли, полученный
3-бром-1-аллиладамантан выделяли вакуумной перегонкой. Выход целевого продукта
составил 90 % (283,33 г).
3-бром-1-аллиладамантан - бесцветная прозрачная жидкость,
Tкип=104°
С/9 мм. рт. ст., nd20=1,5352
.3 Приборы анализа
Состав реакционной массы изучался на хромато-масс-спектрометре «Varian WS» (700 В), стальная колонка длиной 1 м, неподвижная фаза -
SE-30, газ-носитель-азот. Температура колонки - 230° С, испарителя - 250° С.
4.
Инженерные расчеты
4.1 Выбор
типа реактора
По фазовому состоянию реагентов реакция взаимодействия 1,3-ДГА с
бромистым аллилом является гомогенной, т.к. 1,3-дегидроадамантан растворен в
бромистом аллиле.
Для гомогенных реакций в жидкой фазе широко применяются реакторы с
перемешивающими устройствами.
Существует несколько видов перемешивающих устройств - механические
мешалки, пневматические мешалки, перемешивание на полках и перемешивание со
шнеком.
Тип мешалки определяется вязкостью реакционной среды. Для жидкостей с
незначительной вязкостью применяются реакторы с пропеллерными мешалками, а
также реакторы с пневматическими мешалками, т.е. с перемешиванием за счёт
барботажа воздуха или пара через реакционную массу. При повышении вязкости
реакционной среды применяют реакторы с якорными мешалками.
Нами выбрана лопастная мешалка, т.к. вязкость реакционной массы не
высока.
По гидродинамическому режиму выбранный нами реактор относится к реакторам
идеального смешения. Т.е. потоки всех реагентов мгновенно и равномерно
перемешиваются во всем реакционном объеме.
Реактор периодического действия. Все отдельные стадии процесса протекают
последовательно в разное время. Характер изменения концентрации реагирующих
веществ одинаков во всех точках реакционного объема, но различен во времени для
одной и той же точки объема. [44]
Время
проведения реакции 2ч, нагрева смеси 15 мин., охлаждения смеси 40 мин.;
техническое обслуживание реактора 2ч.
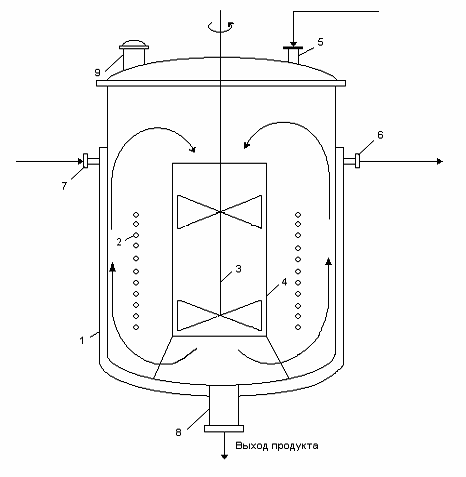

Рисунок 4 - Реактор периодического действия для получения
3-бром-1-аллиладамантана
- рубашка; 2 - змеевик ; 3 - мешалка; 4 - стакан (диффузор); 5 - штуцер
для ввода продуктов; 6,7 - штуцеры для входа и выхода теплоносителя; 8 - штуцер
для вывода продукта реакции; 9 - штуцер для сброса газов.
4.2 Расчет
материального баланса
Общее
выражение для материального баланса процесса имеет вид:
∑Gприх. = ∑Gрасх. + ∑Gпотери
где ∑Gприх. - мольный
поток, приходящий в реактор;
∑Gрасх. - мольный поток, уходящий из
реактора;
∑Gпотери. - потери (для теоретического
расчета баланса принимаем
∑Gпотери =0).
Данные материального баланса:
Основная реакция:
Побочная реакция:

Таблица 2 - Данные материального баланса
|
Технологический выход
продукта, f , %
|
Молярное Соотношение
исходных реагентов, А:В
|
Производительность
реактора, П, моль
|
Степень превращения, Ха, %
|
Селек-тивность основной
реакции, Ф, %
|
Состав исходного реагента,
А, %масс
|
Состав исходного реагента,
В %масс
|
|
|
|
|
|
1,3-ДГА
|
Примесь (адамантанол)
|
примесь (бром-адамантан)
|
Бромистый аллил
|
примесь (аллиловый спирт)
|
|
90
|
1:5
|
1
|
100
|
90
|
98
|
1
|
1
|
95
|
5
|
|
|
|
|
|
|
|
|
|
|
|
Материальный баланс составляется с учетом технико-экономических показателей
процесса (степень превращения, селективность, выход), соотношения исходных
реагентов, чистоты сырья.
Расчет
приходной части баланса
1. Рассчитаем производительность с учетом технологического выхода:
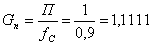 моль/мин.
моль/мин.
Т.
к. 1,3-дегидроадамантан в реакционной массе находится в недостатке, то
требуемый расход смеси рассчитываем по нему:
.
Количество 1,3-ДГА Необходимое для получения 1,1111 моль/мин. 3-бром-1-аллиладамантана:
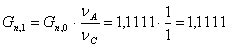 моль/мин.
моль/мин.
. Пересчитаем количество 1,3-ДГА с учетом селективности процесса:
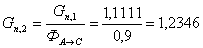 моль/мин.
моль/мин.
4. Определяем количество 1,3-ДГА с учетом степени превращения:
 моль/мин.
моль/мин.
 г/мин.
г/мин.
5.
Определим количество 1,3-ДГА, пошедшее на побочную реакцию:
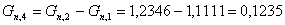 моль/мин.
моль/мин.
. Определим количество 1,3-ДГА, с учетом его состава:
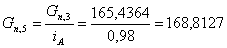 г/мин.
г/мин.
7. Количество примесей, поступивших с 1,3-ДГА:
iбромадамантан(I)= iадамантанол(II)=iприм.
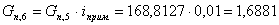 г/мин.
г/мин.
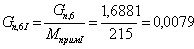 моль/мин.
моль/мин.
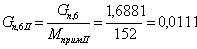 моль/мин.
моль/мин.
8. Определим количество бромистого аллила, поступающего в реактор,
с учетом мольного соотношения:
 моль/мин.
моль/мин.
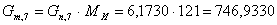 г/мин.
г/мин.
9. Определим количество бромистого аллила, пошедшее на основную
реакцию:
 моль/мин.
моль/мин.
10. Определим количество бромистого аллила с учетом его состава:
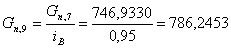 г/мин.
г/мин.
11. Определим количество примесей, поступающих с бромистым аллилом:
 г/мин.
г/мин.
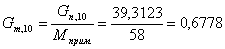 моль/мин.
моль/мин.
. Количество непрореагировавшего бромистого аллила:
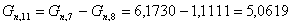 моль/мин.
моль/мин.
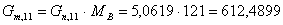 г/мин.
г/мин.
 моль/мин.
моль/мин.
.
Количество непрореагировавшего аллилового спирта:
 моль/мин.
моль/мин.
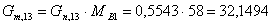 г/мин.
г/мин.
Расчет
расходной части баланса
1. Определим количество 3-бром-1-аллиладамантана, образующееся в
основной реакции:
 моль/мин.
моль/мин.
 г/моль
г/моль
. Определим количество аллиладамантилового эфира:
 моль/мин.
моль/мин.
Результаты
расчета сведем в таблицу.
Таблица 3 - Результаты расчета материального баланса
|
Приход
|
Расход
|
|
Вещество
|
моль/мин.
|
%, мольн.
|
г/мин.
|
%, масс.
|
Вещество
|
моль/мин.
|
% мольн.
|
г/мин.
|
% масс.
|
|
С10Н14
|
1,2346
|
15,23
|
165,4364
|
17,32
|
С13Н19Br
|
1,1111
|
16,17
|
283,3305
|
29,67
|
|
С3Н5Br
|
6,1730
|
76,17
|
746,9330
|
78,21
|
C13H20O
|
0,1235
|
1,80
|
23,7120
|
2,48
|
|
С3H6O
|
0,6778
|
8,36
|
39,3123
|
4,12
|
С3Н5Br
непрореаг.
|
5,0619
|
73,68
|
612,4899
|
64,13
|
|
С10Н15Br прим.
|
0,0079
|
0,10
|
1,6881
|
0,18
|
С3H6O
непрореаг.
|
0,5543
|
8,07
|
32,1494
|
3,37
|
|
С10Н16О прим.
|
0,0111
|
0,14
|
1,6881
|
0,18
|
С10Н15Br прим.
|
0,0079
|
0,11
|
1,6881
|
0,18
|
|
|
|
|
|
С10Н16О прим.
|
0,0111
|
0,16
|
1,6881
|
0,18
|
|
Итого
|
8,1044
|
100
|
955,0579
|
100
|
Итого
|
6,8698
|
100
|
955,0579
|
100
|
Вывод:
таким образом, в результате составления материального баланса, рассчитанного с
учетом технологических критериев и состава сырья соответствующему закону
действия масс (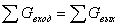 ), установлено, что для получения единицы продукции
(1моль/мин.) 3-бром-1-аллиладамантана требуется взять 165,4 г 1,3-ДГА и 746,9 г
бромистого аллила. Показатели данного процесса имеют высокие значения, а именно
степень превращения составляет 100 %, это говорит о том, что исходное вещество
полностью вступило в реакцию, а также, что реакция протекает в прямом
направлении (неравновесная). Селективность, равная 90 % показывает, что
прореагировавшее сырье в основном пошло на получение целевого продукта. Все
выше перечисленные факторы обеспечивают выход продукта, равный 90 %.
), установлено, что для получения единицы продукции
(1моль/мин.) 3-бром-1-аллиладамантана требуется взять 165,4 г 1,3-ДГА и 746,9 г
бромистого аллила. Показатели данного процесса имеют высокие значения, а именно
степень превращения составляет 100 %, это говорит о том, что исходное вещество
полностью вступило в реакцию, а также, что реакция протекает в прямом
направлении (неравновесная). Селективность, равная 90 % показывает, что
прореагировавшее сырье в основном пошло на получение целевого продукта. Все
выше перечисленные факторы обеспечивают выход продукта, равный 90 %.
4.3 Расчет
теплового баланса
В основе теплового баланса (энергетического) лежит закон сохранения
энергии:
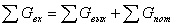
Составим
тепловой баланс стадии синтеза, используя данные для теплового баланса и данные
рассчитанного материального баланса, определим тепловую нагрузку на реактор.
Таблица 4 - Данные теплового баланса
|
Температура исходных
реагентов, К
|
288
|
|
Температура продуктов
реакции, К
|
344,3
|
|
Тепловые потери от прихода
тепла, %
|
4
|
Подготовка исходных данных
Рассчитаем эмпирическими методами теплоту образования и теплоемкость
участников реакции, используя литературные данные [45]
,3-ДГА:
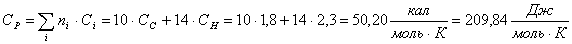

Бромистый
аллил:

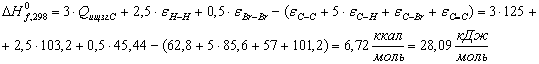
-бром-1-аллиладамантан:
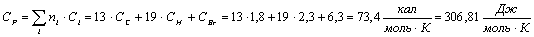

Аллиловый
спирт:
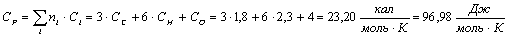

Аллиладамантиловый
эфир:
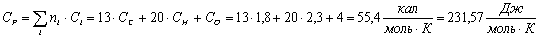
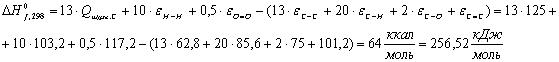
Бромадамантан:
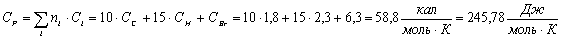

Адамантанол:


Таблица
5 - Термодинамические свойства веществ
|
Вещество
|
ΔH0298,
кДж/моль
|
C0p, Дж/(моль·К)
|
|
С10Н14
|
-177,23
|
209,84
|
|
С3Н5Br
|
28,09
|
96,98
|
|
С13Н19Br
|
-149,14
|
306,81
|
|
С3Н6О
|
-99,48
|
96,98
|
|
C13H20О
|
256,52
|
231,57
|
|
С10Н15Br
|
-200,14
|
245,78
|
|
С10Н16О
|
-327,71
|
287,58
|
Расчет тепловой нагрузки стадии нагрева реакционной смеси
Приход
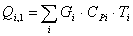


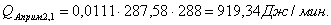



Расход
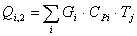
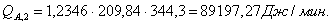
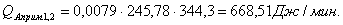
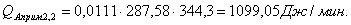
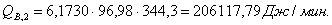
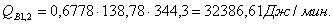
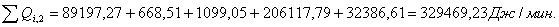
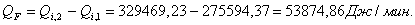
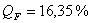
Таблица
6 - Результаты расчёта теплового баланса стадии нагрева реакционной смеси
|
Приход
|
Расход
|
|
Тепловые потери
|
Дж/мин.
|
%
|
Тепловые потери
|
Дж/мин.
|
%
|
|
∑Qi,1
|
275594,37
|
83,65
|
∑Qi,2
|
329469,23
|
100
|
|
QF
|
53874,86
|
16,35
|
|
|
|
|
Итого
|
329469,23
|
100
|
Итого
|
329469,23
|
100
|
Расчет
тепловой нагрузки стадии проведения реакции
Приход

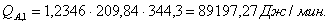

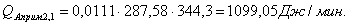
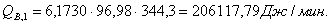
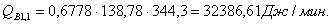
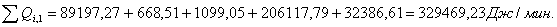
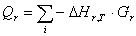
Основная
реакция:
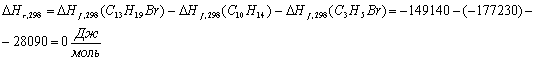


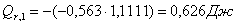
Побочная
реакция:
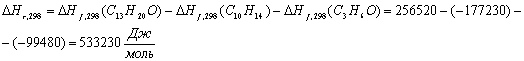
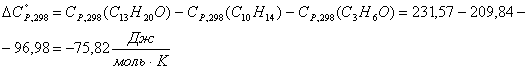
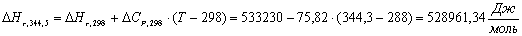
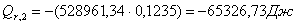

Расход

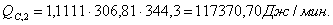
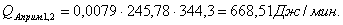
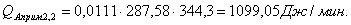

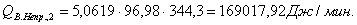
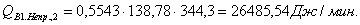
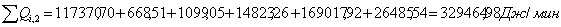
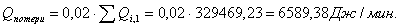

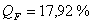
QF>0,
следовательно, реакция является экзотермической, то есть необходимо подводить
тепло к реактору.
Таблица
7 - Результаты расчёта теплового баланса стадии проведения реакции
|
Приход
|
Расход
|
|
Тепловые потери
|
Дж/мин.
|
%
|
Тепловые потери
|
Дж/мин.
|
%
|
|
∑Qi,1
|
329469,23
|
82,08
|
∑Qi,2
|
329464,98
|
82,08
|
|
QF
|
71911,69
|
17,92
|
Qпотери
|
6589,38
|
1,64
|
|
|
|
∑Qr
|
65326,56
|
16,28
|
|
Итого
|
401380,92
|
100
|
Итого
|
401380,92
|
100
|
Расчет
тепловой нагрузки стадии охлаждения отработанной смеси
Приход
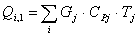
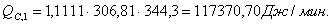

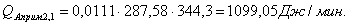
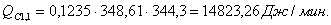


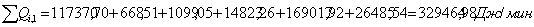
Расход

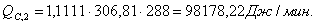
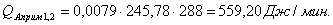
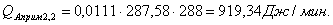
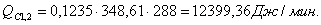
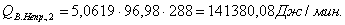
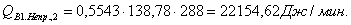

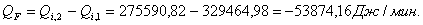
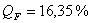
Таблица
8 - Результаты расчёта теплового баланса стадии охлаждения отработанной смеси
|
Приход
|
Расход
|
|
Тепловые потери
|
Дж/мин.
|
%
|
Тепловые потери
|
Дж/мин.
|
%
|
|
∑Qi,1
|
329464,98
|
100
|
∑Qi,2
|
275590,82
|
83,85
|
|
|
|
QF
|
53874,16
|
16,35
|
|
Итого
|
329464,98
|
100
|
Итого
|
329464,98
|
100
|
Определение
площади теплообмена реактора
Из трех рассчитанных ранее значений тепловой нагрузки выбираем
наибольшую. Так как для стадии охлаждения и стадия нагрева тепловые нагрузки
практически одинаковы, рассчитаем для стадии нагрева.
Нагрев будем производить паром с температурой 75º С.
Согласно литературным данным для нагрева паром коэффициент теплопередачи
колеблется в пределах 120 - 640 [46]. Принимаем коэффициент теплопередачи 120
Вт/м2·К.

Определение
объема реактора
Для реактора периодического действия в общем случае объем можно
рассчитать по формуле:

В
нашем случае она примет вид:
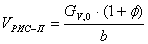
Принимая
плотность смеси 1,5 г/см3, получим GV,0.
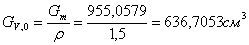
Коэффициент
запаса φ
принимаем равным 0,15
Коэффициент
заполнения b принимаем равным 0,7

Вывод:
расчёт теплового баланса показал, что реакция является экзотермической и для её
протекания необходимо подвести тепло в количестве 17,92 % от общего количества
к реактору, обладающему площадью теплообменной поверхности 1744 см2.
4.4
Операторная схема процесса
I
стадия: Подготовка сырья
.1. Приготовление раствора дибромадамантана
На данной стадии смешиваются в смесителе 1 1,3-дибромадамантан (1,3-ДБА)
с растворителем тетрагидрофураном (ТГФ).
1.2. Получение 1,3-ДГА
Полученная смесь поступает в реактор 2, где добавляется Li-содержащий катализатор (Li-kat) и осуществляется процесс получения 1,3-ДГА.
.3. Фильтрование раствора от Li-kat
Полученная смесь, образовавшаяся после реакции, поступает в аппарат
фильтрации 3 для отделения от Li-содержащего
катализатора, при этом Li-kat возвращается на стадию получения
1,3-ДГА.
.4. Отгонка растворителя (ТГФ)
После отделения от Li-kat, полученная смесь, состоящая из
1,3-дегидроадамантана (1,3-ДГА) и тетрагидрофурана (ТГФ), поступает в
ректификационную колонну 4 для отгонки растворителя, с целью получения чистого
1,3-ДГА. При этом ТГФ возвращается на стадию приготовления раствора
дибромадамантана.
.5. Возгонка 1,3-ДГА
,3-ДГА поступает в аппарат возгонки 5, где происходит возгонка
1,3-дегидроадамантана, в результате чего образуется кристаллическое вещество, а
побочные вещества остаются в кубе.
.6. Очистка бромистого аллила
Второй продукт бромистый аллил, участвующий в синтезе, необходимо
предварительно очистить от примесей. Он поступает в ректификационную колонну 6,
где происходит его очистка от примесей, которые остаются в кубе.
II
стадия: Стадия синтеза
,3 - ДГА и бромистый аллил поступают в реактор 7, который обогревается
теплоносителем 8, где происходит химическое превращение (t
= 70- 80º С) в
течение 2 часов.
III
стадия: Стадия разделения
.1. Отделение бромистого аллила
Продукт реакции и непрореагировавший бромистый аллил поступают в
ректификационную колонну 9, где происходит отделение непрореагировавшего
бромистого аллила, который возвращается на стадию очистки бромистого аллила. В
ректификационной колонне 10 происходит отделение от бромистого аллила
аллилового спирта.
.2. Очистка продукта (вакуумная перегонка)
Продукт реакции поступает в ректификационную колонну 11, где выделяется в
чистом виде, а примеси 1,3-ДГА и аллиладамантиловый эфир подаются в
ректификационную колонну 12.
.3. Разделение примесей и продукта побочной реакции
Примеси 1,3-ДГА и аллиладамантиловый эфир поступают в ректификационную
колонну 12, где происходит их разделение на аллиладамантиловый эфир и смесь
адамантанола и бромадамантана. После разделения они поступают на переработку.
На стадии подготовки 1,3-дибромадамантан (1,3-ДБА), тетрагидрофуран (ТГФ)
и Li-содержащий катализатор (Li-kat) смешиваются в смесителе 1 и поступают в реактор 2.
Полученная смесь, состоящая из 1,3-дегидроадамантана (1,3-ДГА) и
тетрагидрофурана, поступает в аппарат фильтрации 3 для отделения от Li-kat, при этом Li-kat возвращается на стадию получения
1,3-ДГА. После отделения от Li-kat, полученная смесь, состоящая из
1,3-дегидроадамантана (1,3-ДГА) и тетрагидрофурана (ТГФ), поступает в
ректификационную колонну 4 для отгонки растворителя, с целью получения чистого
1,3-ДГА. При этом ТГФ возвращается на стадию приготовления раствора
дибромадамантана, а 1,3-ДГА поступает в аппарат возгонки 5, где происходит
возгонка 1,3-дегидроадамантана, в результате чего образуется кристаллическое
вещество, а побочные вещества остаются в кубе. Далее 1,3-ДГА смешивается с
бромистым аллилом, и эта смесь поступает в реактор 7, который обогревается
теплоносителем 8, где происходит химическое превращение (t
= 70- 80º С) в
течение 2 часов. Продукты реакции и непрореагировавший бромистый аллил
поступают из реактора в ректификационную колонну 9, где происходит отделение
непрореагировавшего бромистого аллила, который возвращается на стадию очистки
бромистого аллила. В ректификационной колонне 10 происходит отделение от
бромистого аллила аллилового спирта. Продукт реакции поступает в
ректификационную колонну 11, где выделяется в чистом виде, а примеси 1,3-ДГА и
аллиладамантиловый эфир подаются в ректификационную колонну 12, где происходит
их разделение на аллиладамантиловый эфир и смесь адамантанола и бромадамантана.
После разделения они поступают на переработку.
Выводы
. В работе приведен обзор химических свойств 1,3-дегидроадамантана и
аллилгалогенидов. Анализ литературных данных указывает на возможность
протекания реакции между 1,3-дегидроадамантаном и аллилгалогенидами.
2. Изучены реакции взаимодействия бромистого и хлористого аллилов с
1,3-дегидроадамантаном. Установлено, что проведение реакций в среде
аллилгалогенидов приводит к образованию 1-бром-3-аллиладамантана (90%);
1-хлор-аллиладамантана (31 %) и 3-хлор-3-адамантил-1-пропена (31 %) в
отсутствии катализатора.
. Впервые были синтезированы 1-бром-3-аллиладамантан,
1-хлор-3-аллиладамантан и 3-хлор-3-адамантил-1-пропен. Структура полученных
продуктов была подтверждена методом хромато-масс-спектроскопии.
. Разработан эффективный метод синтеза 1-бром-3-аллиладамантана.
5. Исходя из природы использованных реагентов, а также учитывая условия
проведения рассмотренных реакций, предположен ионный (электрофильное
присоединение) механизм взаимодействия 1,3-дигидроадамантана с бромистым
аллилом.
6. На основании материального баланса установлено, что для получения 283
г/мин 1-бром-3-аллиладамантана необходимо взять 165 г/мин 1,3-дегидроадамантана
и 747 г/мин бромистого аллила.
7. Расчёт теплового баланса показал, что реакция является
экзотермической, так как (QF
>0), и для её протекания необходимо подводить тепло в количестве 17,92 % от
общего количества к реактору, обладающему площадью теплообменной поверхности
1774 см2.
. Для проведения процесса выбран реактор идеального смешения
периодического действия, объёмом 1,046 л.
. Предложена операторная схема процесса
получения1-бром-3-аллиладамантана.
Библиографический список
1. Багрий Е.И. Адамантаны: Получение, свойства,
применение - М.: Наука, 1989. - 290 с.
2. Степанов Ф.Н. Журнал органической химии / Ф.Н
Степанов, П. Н. Красуцкий, Л. И. Руденко //. - 1972. - т. 8. - №12. - с.2616
. Юрченко А.Г. Журнал органической химии / Юрченко
А.Г., Ворощенко А.Т., Степанов Ф.Н//. -1970. - т. 6. - № 1. - с.189-190
. Юрченко А.Г. Журнал органической химии/ Юрченко
А.Г., Мурзинова З.Н., Степанов Ф.Н.//.- 1972. - т. 8. - № 1. - с.2332-2338
. Подхалюзин А.Т., Назарова М.П.// Докл. АН
СССР.1976,т.229, №1, с.105-107
. Александров А.М. Журнал органической химии/
Александров А.М., Сорочинский А.Е., Краснощек А.П.//. - 1979. - т.15. - №2. -
с.336-342
. Александров А.М. Журнал органической химии/
Александров А.М., Даниленко Г.И., Краснощек А.П.//. - 1974. - т.10. - №7. -
с.1548-1549
. Александров А.М. Журнал органической химии/
Александров А.М., Сорочинский А.Е., Кухарь В.П., Краснощек А.П.//.- 1979. - т.15.
- №2. - с.445-446
. Сорочинский А. Е. Журнал органической химии/
Сорочинский А. Е., Тарасевич А. С., Александров А.М., Кухарь В. П.//. -1981. -
т.17. - №11. - с.2339-2343
. Подхалюзин А.Т., Назарова М.П.// Докл. АН СССР.1976,
Т.12, №4, с.910
. Бутов Г.М. Взаимодействие 1,3-ДГА с эфирами
галогенкарбоновых кислот./Г.М.Бутов, В.М.Мохов, С.В.Дьяконов// Известия
ВолгГТУ: межвуз. Сб. науч. ст. сер. Химия и технология элементорганических
мономеров и полимерных материалов. Вып. 4, №5 ВолгГТУ. - Волгоград, 2007.
с.30-34.
. Кунаев Р. У. Синтез адамантилсодержащих кетонов на
основе 1,3-дегидроадамантана: Автореф. канд. хим. наук. - Волгоград, 2007.-с.
15
. Соколенко В. А., Когай Б. Е. // Журн. орган. химии.
1976. Т. 12, №6. С. 1370 - 1371.
. А. с. 606853 СССР, М.Кл2 С 07С 35/22. Способ
получения 1-(адамантил-1)-пропанола-1 / В. В. Ковалев, Э. А. Шокова, А. Ф.
Платэ. -№2444307/23-04; заявлено 17.01.77; опубл. 24.04.78, Бюл. № 18. - 2 с.
. А. с. 639844 СССР, М.Кл2 С 07С 13/54. Способ
получения С13 - С18-алкениладамантанов / В. Н. Соловьев, В. Г. Заикин, Е. И.
Багрий, П. И. Санин. - №2381454/23-04; заявлено02.07.76; опубл. 30.12.78, Бюл.
№48. - 3 с.
. А. с. 789472 СССР, М.Кл3 С 07С 5/52. Способ
получения 1-виниладамана или его замещенных / В. Н. Соловьев, Е. И. Багрий, П.
И. Санин, С. М. Носакова, Л. Г. Либеров. - №2635730/23-04; заявлено 29.06.78;
опубл. 23.12.80, Бюл. №47. - 3 с.
. Пат. 3457318 США, МКИ2 С 07 С. Alkenyl adamantanes / C. Capaldi, A. E. Borchert . -
№686840; заявлено 30.11.67; опубл. 22.07.69, Бюл. № 71. - 6 с.
. Справочник химика. т.2, 2-е изд.; М.:1963-1169с.
. Справочник химика, том 1 / Под ред. Б.П.Никольского.
- Л.: Химия, 1966
21. J. R. Johnson, W. L. McEwen, Org. Syntesen, F.
Wieweg u. Sohn, Braubschweig, 1937, s. 522; Org. Synth., Coll. V. 1,
2ed, 1956, p. 521.
22. F. R. Mayo, C. Walling, Chem. Rev., v.27,
1940, p. 351
23. W.
Bockemüller, L. Pfeuffer, Ann., v. 537, 1939, p.178
24. Соколенко В. А. Журнал органической химии/ Соколенко
В. А., Маркова В. А., Когай Б. Е. //. - 1978. - т. 14. - №5. - с. 1111.
. Когай Б. Е., Карпицкая Л. Г., Меркушев Е. Б. и др.
// Науч. конф. по химии орган. полиэданов: Тез. докл. Волгоград, 1981. С. 81.
. Лейбзон В. Н., Мендкович А. С., Климова Т. А.,
Краюшкин М. М. // Науч. конф. по химии орган. полиэданов: Тез. докл. Волгоград,
1981. С. 81.
. Когай Б. Е., Соколенко В.А. // Науч. конф. по химии
орган. полиэданов: Тез. докл. Волгоград, 1981. С. 73.
. Когай Б. Е., Соколенко В. А., Фурин Г. Г., Якобсон
Г. Г. // Науч. конф. по химии орган. полиэданов: Тез. докл. Волгоград, 1981. С.
74.
. Но Б. Н., Сон В. В., Ущенко В. П. и др. // Науч.
конф. по химии орган. полиэданов: Тез. докл. Волгоград, 1981. С. 108.
. Паршин Г.Ю. Синтез адамантилсодержащих карбонильных
соединений на основе 1,3-дегидроадамантана и их свойства: автореф. канд. хим.
наук: 02.00.03 / Паршин Глеб Юрьевич. - Волгоград, 2002.-18 с.
31. a-Адамантилсодержащие
алифатические кетоны /Но Б.И., Бутов Г.М., Мохов В.М., Паршин Г.Ю. //XIII междунар. научно-техническая
конференция “Химические реактивы, реагенты и процессы малотоннажной химии”,
Тула, 23-25 мая 2000 г.: Тез. докл./Тула, 2000. - С.14.
32. Matsuoka S., Ogiwara N., Ishizone T. Formation
of alternating copolymers via spontaneous copolymerization of
1,3-dehydroadamantane with electron-deficient vinyl monomers.//
J.Am.Chem.Soc.,-2006.-128.-P.P.8708-8709.
33. Ishizone T.,Matsuoka S., Sakai S., Harada W.,
Tajima H. Synthesis of poly(1,3-adamantane)s by cationic ring-opening
polymerization of 1,3-dehydroadamantanes //
Macromolecules.-2004.-37.-PP.7069-7071.
. Ishizone T. Ring-Opening Polymerization of 1,3-Dehydroadamantanes // Перспективы развития химии и практического применения
алициклических соединений: Тезисы докладов XI Международной научно-технич. Конф /ВолгГТУ. - Волгоград 2008.-С.12.
35. Лебедев А.Т. Масс-спектрометрия в органической химии.
М., 2003.-493с.
36. Иоффе Б.В., Костиков Р.Р., Разин В.В. Физические
методы определения строения органических соединений. М., 1984.-336с.
. Преч Э. Определение строения органических
соединений. Таблицы спектральных данных/Э.Преч, Ф.Бюльман, К.Аффольтер.-М.:
Мир, 2006.-438с.
. Заикин В. Г., Соловьев В. Н., Сметанин В. И. и др.
// Изв. АН СССР. Сер. хим. 1975. №7. с. 1633 - 1636.
39. Рубанова Р. А., Бутов Г. М., Паршин Г. Ю., Пестов А. Г.
Механизмы реакций в органической химии. Учеб. пособие / ВолгГТУ. - Волгоград,
2005. 199 с.
40. Когай Б.Е. Реакции 1,3-дегидроадамантана с
электрофильными реагентами.: автореф. дис. канд. хим. наук: 02.00.03. -
Красноярск., 1983.-16 с.
. Вейгант-Хильгетаг. Методы эксперимента в
органической химии.-М.: Химия, 1968.-944 с.
. Справочник химика.т.2, 2-е изд.; М.:1963-1169с.
43. Cвойства газов и жидкостей. Рид, Шервуд. - Л: Химия, 1983
. Методы расчета процессов и аппаратов химической
технологии (примеры и задачи). Учеб. пособие для вузов./ П. Г. Романков, В. Ф.
Фролов, О.М. Флисюк, М.И. Курочкина - СПб: Химия, 1993. - 496с.
. Справочник химика, том 1 / Под ред. Б.П.Никольского.
- Л.: Химия, 1966, 1072 с.
. Березин Б.Д., Березин Д.Б. Курс современной
органической химии Учебное пособие для вузов. - М.: Высш. Шк.,1999. - 768 с:
ил.5