Контрольная работа по общей и неорганической химии
ГБОУ ВПО Дальневосточный государственный медицинский
университет
Минздравсоцразвития России
Кафедра
общей, физической и коллоидной химии
Контрольная
работа № 1 по общей и неорганической химии
Студентки
1 курса 105 группы
заочного
отделения фармацевтического факультета
Берченко
Людмилы Николаевны
№ зачётной книжки:11384
Вариант
№
84
Домашний
адрес:
инд.680033,
г. Хабаровск,
ул.
Тихоокеанская, д.170-а, кв.92
Задание № 9
Что такое
изотопы? Чем можно объяснить, что у большинства элементов периодической системы
атомные массы выражаются дробным числом? Могут ли атомы разных элементов иметь
одинаковую массу? Как называются подобные атомы?
ИЗОТОПЫ (от изо... и греч. topos - место), нуклиды одного хим. элемента, т.е. разновидности атомов определенного элемента, имеющие
одинаковый атомный номер, но разные массовые числа. Обладают ядрами с одинаковым числом протонов и различным числом нейтронов, имеют одинаковое строение электронных оболочек и занимают одно и то же
место в периодической системе химических элементов. Термин "изотопы"
предложен в 1910 Ф. Содди для обозначения химически неразличимых разновидностей
атомов, отличающихся по своим физическим (прежде всего радиоактивным) свойствам.
Стабильные изотопы впервые обнаружены в 1913 Дж. Томсоном с помощью
разработанного им т. наз. метода парабол - прообраза современной масс-спектрометрии. Он установил, что у Ne имеется, по крайней мере, 2
разновидности атомов с массовым числом 20 и 22. Названиями и символами изотопов обычно служат
названия и символы соответствующих химических элементов; массовое число указывают сверху слева от символа. Например, для
обозначения природных изотопов хлора используют запись 35Сl и 37С1; иногда внизу слева
указывают также порядковый номер элемента, т.е. пишут 3517Сl
и 3717Cl. Только изотопы самого легкого элемента
-водорода с маc. ч. 1, 2 и 3 имеют спец. названия и символы: протий (11Н), дейтерий (D, или 21Н) и тритий (Т, или 31H) соответственно. Из-за большой разницы
в массах поведение этих изотопов существенно различается. Стабильные изотопы
встречаются у всех четных и большинства нечетных элементов . Число стабильных
изотопов у элементов с четными номерами может быть равно 10 (напр., у олова); у элементов с нечетными номерами не более двух стабильных
изотопов. Известно около 280 стабильных и более 2000 радиоактивных изотопов у
116 природных и искусственно полученных элементов. Для каждого элемента содержание
отдельных изотопов в природной смеси претерпевает небольшие колебания, которыми
часто можно пренебречь. Более значит. колебания изотопного состава наблюдаются
для метеоритов и др. небесных тел. Постоянство изотопного состава приводит к
постоянству атомной массы встречающихся на Земле элементов, представляющей собой
среднее значение массы атома данного элемента, найденное с учетом
распространенности изотопов в природе. Колебания изотопного состава легких
элементов связаны, как правило, с изменением изотопного состава при различных
процессах, протекающих в природе (испарение, растворение, диффузия и т.п.). Для тяжелого элемента Рb колебания изотопного состава разных
образцов объясняются различным содержанием в рудах, минералах и др. источниках урана и тория - родоначальников естественных радиоактивных рядов. Различия свойств изотопов данного элемента называют изотопными эффектами. Важной практической задачей является получение из природных
смесей отдельных изотопов - изотопов разделение. В научной литературе термин "изотопы" длительное
время употреблялся не только в указанном значении, но и в единственном числе
для обозначения разновидности атомов с определенным значением массового числа, т. е. для обозначения нуклида. В настоящее время такое использование термина "изотопы"
неправильно.
Среди многочисленных изотопов
различных элементов можно найти ядра разного заряда, но с одинаковой массой.
Различные элементы, атомы которых обладают одинаковой массой, называют изобарами
(«равная тяжесть»).Ядра изобаров содержат равное число нуклонов, но различные
числа протонов и нейтронов . Например, атомы 104Be, 105B, 106C
представляют собой три изобара с атомной массой = 10. Массы изобаров могут
несколько отличаться друг от друга, что связано с различием в энергиях связи их
ядер. Изобары с наименьшими массами устойчивы относительно бета-распада, более
тяжёлые — неустойчивы. Тяжёлый изобар с избытком протонов испытывает позитронный распад или К-захват, а с избытком нейтронов — электронный распад. Частный случай изобаров — зеркальные ядра
(встречающиеся среди лёгких ядер), которые получаются заменой протонов на нейтроны и нейтронов на протоны, например 106С4 и 104Be6
или 73Li4 и 74Ве3.
Задание № 27
Что такое электроотрицательность? Как
изменяется электроотрицательность р-элементов в периоде, в группе периодической
системы с увеличением порядкового номера? Почему?
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ, величина, характеризующая
способность атома к поляризации ковалентных связей. Если в двухатомной молекуле А — В образующие связь электроны притягиваются к атому В сильнее, чем к атому А, то атом В считается более
электроотрицательным, чем А.
Л. Полинг предложил (1932) для количеств. характеристики электроотрицательности
использовать термохимохимические данные об энергии связей А—А, В — В и А — В -
соотв. ЕАА, Евв и ЕАВ. Энергия гипотетической
чисто ковалентной связи А — В (Еков) принимается равной среднеарифметической.
или среднегеометрической значению величин EAA и ЕВВ. Если
электроотрицательности атомов А и В различны, то связь А — В
перестает быть чисто ковалентной и энергия связи ЕАВ станет больше Еков
на величину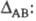
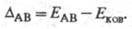 Чем
больше различие электроотрицательностей
Чем
больше различие электроотрицательностей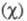 атомов А и В, тем больше величина
атомов А и В, тем больше величина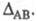 Используя эмпирическую формулу
Используя эмпирическую формулу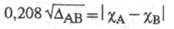 (множитель 0,208 возникает при переводе значений энергии из ккал/моль в эВ) и принимая для атома водорода произвольное значение электроотрицательности
(множитель 0,208 возникает при переводе значений энергии из ккал/моль в эВ) и принимая для атома водорода произвольное значение электроотрицательности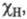 равное 2,1, Полинг получил удобную шкалу относительно числовых
значений электроотрицательности, часть которых отражена в таблице
электроотрицательности элементов. Наиболее электроотрицателен самый легкий из галогенов - F, наименее - тяжелые щелочные металлы.
равное 2,1, Полинг получил удобную шкалу относительно числовых
значений электроотрицательности, часть которых отражена в таблице
электроотрицательности элементов. Наиболее электроотрицателен самый легкий из галогенов - F, наименее - тяжелые щелочные металлы.
Для количеств. описания электроотрицательности, помимо термохимических данных,
используют также данные о геометрии молекул (напр., метод Сандерсона), спектральные характеристики (напр., метод
Горди).
Электроотрицательность зависит не
только от расстояния между ядром и валентными электронами, но и от того,
насколько валентная оболочка близка к завершенной. Атом с 7 электронами на
внешней оболочке будет проявлять гораздо большую электроотрицательность, чем
атом с 1 электроном. Фтор является "чемпионом" электроотрицательности
по двум причинам. Во-первых, он имеет на валентной оболочке 7 электронов (до
октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка
(...2s2 2p5) расположена близко к ядру.
Электроотрицательность по Полингу –
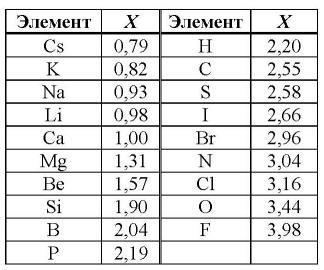
Если выбрать из Периодической таблицы
p-элементы и записать их в отдельный "блок" то обнаруживается
закономерность. Левая нижняя часть блока содержит типичные металлы, правая
верхняя - типичные неметаллы. Элементы, занимающие места на границе между
металлами и неметаллами, 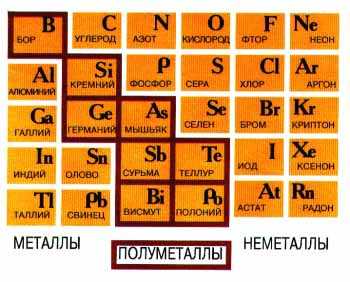 иногда называют полуметаллами. Полуметаллы расположены примерно
вдоль диагонали, проходящей от левого верхнего к правому нижнему углу блока
р-элементов в Периодической таблице. Полуметаллы имеют ковалентную кристаллическую
решетку при наличии металлической проводимости (электропроводности). Валентных
электронов у них либо недостаточно для образования полноценной
"октетной" ковалентной связи (как в боре), либо они не удерживаются
достаточно прочно (как в тeллуре или полонии) из-за больших размеров атома.
Поэтому связь в ковалентных кристаллах этих элементов имеет частично
металлический характер.
иногда называют полуметаллами. Полуметаллы расположены примерно
вдоль диагонали, проходящей от левого верхнего к правому нижнему углу блока
р-элементов в Периодической таблице. Полуметаллы имеют ковалентную кристаллическую
решетку при наличии металлической проводимости (электропроводности). Валентных
электронов у них либо недостаточно для образования полноценной
"октетной" ковалентной связи (как в боре), либо они не удерживаются
достаточно прочно (как в тeллуре или полонии) из-за больших размеров атома.
Поэтому связь в ковалентных кристаллах этих элементов имеет частично
металлический характер.
Некоторые полуметаллы (кремний,
германий) являются полупроводниками. Полупроводниковые свойства этих элементов
объясняются многими сложными причинами, но одна из них - существенно меньшая
(хотя и не нулевая) электропроводность, объясняемая слабой металлической
связью.
Электроотрицательность возрастает тоже слева на право, достигая
максимума у галогенов. Не последнюю роль в этом играет степень завершенности
валентной оболочки, ее близость к октету.
При перемещении сверху вниз по группам электроотрицательность
уменьшается. Это связано с возрастанием числа электронных оболочек, на
последней из которых электроны притягиваются к ядру все слабее и слабее.
Задание № 56
Какую химическую связь называют ионной?
Каков механизм её образования? Какие свойства ионной связи отличают её от
ковалентной? Приведите два примера типичных ионных соединений. Напишите
уравнения превращения соответствующих ионов в нейтральные атомы.
Ионные соединения – обычно твердые и хрупкие
вещества, плавящиеся при высоких температурах. Растворы ионных соединений
проводят электрический ток, потому что при растворении они распадаются на
заряженные ионы. Типичное ионное соединение – поваренная соль NaCl.

Рис.
поваренная соль NaCl (ионная связь между атомами) – твердое кристаллическое
вещество.
Прочная
химическая связь, образующаяся между атомами с большой разностью (>1,7 по
шкале Полинга) электроотрицательностей, при которой общая электронная пара
полностью переходит к атому с большей электроотрицательностью, при этом
образуются разноименно заряженные тела, которые называются ионами. Механизм
образования ионной связи можно рассмотреть на примере реакции между натрием и
хлором. Атом щелочного металла легко теряет электрон, а атом галогена -
приобретает. В результате этого возникает катион натрия и хлорид-ион. Они
образуют соединение за счет электростатического притяжения между ними.
•• ••
Na• + •Cl•• =Na++[••Cl••]-
•• ••
Важнейшие отличия ионной связи от других типов химической связи заключаются в
ненаправленности (взаимодействие между катионами и анионами не зависит от
направления, поэтому о ионной связи говорят как о ненаправленной) и
ненасыщаемости (каждый катион может притягивать любое число анионов, и
наоборот). Примером ионного соединения является поваренная соль FeCl2 и KCl
электролиз
FeCl2 →Fe+ Cl2
электролиз
2KCl→ 2K+ Cl2 (электролиз расплава). Иногда встречается утверждение, что
ионная связь – это химическая связь, возникающая в результате кулоновского
притяжения противоположно заряженных ионов. Действительно, электростатическое
притяжение противоположных зарядов в ионных соединениях вносит заметный вклад в
энергию связи. Но в то же время ковалентная составляющая химической связи
никогда не выключается полностью даже в наиболее ионных соединениях. Таким
образом, граница между полярными ковалентными и ионными соединениями достаточно
условна. Например, чистая вода (полярное ковалентное соединение) все-таки
обладает электропроводностью (правда, очень низкой), а если поваренную соль
(ионное соединение) расплавить и нагреть до кипения в вакууме, то в парах будут
присутствовать молекулы Na–Cl, а не отдельные ионы Na+ и Cl–.
Механизм
образования ионной связи можно рассмотреть на примере реакции между натрием и
хлором. Атом щелочного металла легко теряет электрон, а атом галогена -
приобретает. В результате этого возникает катион натрия и хлорид-анион. Они
образуют соединение за счет электростатического притяжения между ними.
Типичные ионные соединения: NaCl, LiF.
Уравнения превращения соответствующих ионов в нейтральные атомы:
Na+ + 1e → Na0
Cl- → Cl0 + 1e
Li+ + 1e → Li0
F- → F0 + 1e
Задание № 68
Вычислите молярную массу эквивалента
цинка, если 1,168*10-3 кг его вытеснили из кислоты 438*10-6 м3
водорода, измеренного при 170С и давлении 98642 Па.
Решение: приведем объем вытесненного водорода к нормальным
условиям, воспользовавшись объединенным газовым уравнением
V0 = P.V.Т0/P0.Т = 98642.438.273/1,013.105.298 = 401,5 мл
Эквивалентный объем водорода
VЭ(H2) = 11,2 л/моль при
нормальных условиях, поэтому
m(Zn)/V(H2) = MЭ(Zn)/VЭ(H2); MЭ(Zn)= 1,168
г.11,2 г/моль/0,4015 л = 32,58 г/моль.
Ответ: молярная
масса эквивалента Zn 32,58 г/моль
Задание № 94
Смешаны 0,8 дм3 1,5 М NaOH
и 0,4 дм3 0,6 М NaOH.
Какова молярная концентрация эквивалента и титр полученного раствора?
Решение: Молярная концентрация раствора См/ NaOH/- это отношение n /NaOH/ растворённого вещества NaOH к объёму раствора См/NaOH/= = моль/дм3,
где n- число моль вещества, соответственно находим n1- 0,8 дм3 1,5 М NaOH
; и n2 - 0,4
дм3 0,6 М NaOH;
= моль/дм3,
где n- число моль вещества, соответственно находим n1- 0,8 дм3 1,5 М NaOH
; и n2 - 0,4
дм3 0,6 М NaOH;
n1 = C1 * V1
= 1.5
моль/дм3 * 0.8 дм3 = 1.2 моль-экв
n2 = C2 * V2 = 0.6 моль/дм3* 0.4 дм3
= 0.24 моль-экв
n = n1 + n2 = 1.2 + 0.24 = 1.44 моль-экв
V = V1 + V2 = 0.8 + 0.4 = 1.2 дм3
С M = n / V = 1.44 моль-экв /
1.2 дм3
= 1.2 моль/дм3
Т.к. n /вещества/ =  , то
СM=
, то
СM=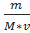 = моль/дм3
,зная СM /NaOH/ вычисляем массу
растворенного вещества m /NaOH/ в растворенном объёме V m/NaOH/ = CM /NaOH/ *M/NaOH/ *V , М(NaOH) =
= моль/дм3
,зная СM /NaOH/ вычисляем массу
растворенного вещества m /NaOH/ в растворенном объёме V m/NaOH/ = CM /NaOH/ *M/NaOH/ *V , М(NaOH) =
m =1.2 моль/дм3*40г/моль*1.2
дм3=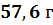
Эквивалентная или молярная концентрация эквивалента
Сн это число эквивалента вещества в 1 дм3/1л/ раствора Сн
или С / А/, где А растворенное
вещество, число моль эквивалента вещества обозначается n
(
А/, где А растворенное
вещество, число моль эквивалента вещества обозначается n
(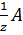 ). n
(
). n
(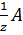 ) =
) = 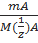 =
=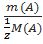 ; С/
; С/ А/ =
А/ = 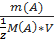 ,
моль/дм3, где
,
моль/дм3, где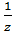 - фактор
эквивалентности, М/
- фактор
эквивалентности, М/ А/ - молярная масса эквивалента
вещества А(NaOH-для данной
задачи),следовательно: если фактор эквивалентности ƒэ или
А/ - молярная масса эквивалента
вещества А(NaOH-для данной
задачи),следовательно: если фактор эквивалентности ƒэ или  (формульная единица
вещества) = эквивалент основания равен
(формульная единица
вещества) = эквивалент основания равен 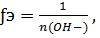 где n
(OH-)-
число отданных в ходе реакции гидроксид-ионов (кислотность основания), для NaOH
где n
(OH-)-
число отданных в ходе реакции гидроксид-ионов (кислотность основания), для NaOH
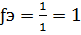 , тогда СH
(NaOH)
= (57,6 г)/(1*40г/моль*1.2
моль/дм3 ) = 0,12 моль/дм3
, тогда СH
(NaOH)
= (57,6 г)/(1*40г/моль*1.2
моль/дм3 ) = 0,12 моль/дм3
Титр раствора
Т(А) показывает отношение массы  растворенного вещества к объёму V
растворенного вещества к объёму V его раствора: T (NaOH) = m (NaOH)/V(NaOH), тогда
его раствора: T (NaOH) = m (NaOH)/V(NaOH), тогда
T (NaOH)
=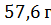 /1.2 дм3 = 48 г/ дм3
т.к. 1000см3 = 1дм3,тогда 48 г/ дм3 =48000
г/ см3
/1.2 дм3 = 48 г/ дм3
т.к. 1000см3 = 1дм3,тогда 48 г/ дм3 =48000
г/ см3
Ответ: молярная
концентрация эквивалента 0,12 моль/дм3, титр раствора 48000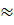 г/
см3
г/
см3
Задание № 109
Тепловой эффект какой реакции равен
теплоте образования NO?
Вычислите теплоту образования NO,
исходя из следующих термохимических уравнений:
4 NH3(г)+5О2(г)
= 4 NО(г) +6H2О
(ж); ΔН=-1168,80 кДж.
4 NH3(г)+3О2(г)
= 2 NО2(г)
+6H2О
(ж); ΔН=-1530,28 кДж.
Решение: Следствие из закона Гесса: «Тепловой эффект
реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы
энтальпий образования исходных веществ с учетом коэффициентов реакции»:
DH0х.р. = 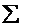 n × DH0продуктов -
n × DH0продуктов - 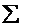 n × DH0исходных веществ.
n × DH0исходных веществ.
DH0х.р. = DH0обр.прод
4 NО(г) +DH0обр.прод
6H2О
(ж) - DH0исх.в-в
4 NH3(г)+ DH0исх.в-в
5О2(г) , если
∆H(О2(г)) = 0 ; ∆H(NH3(г)) =
-46,19 кДж ; ∆H(H2О(ж))
= -285,84 кДж
DH(NО(г)) = (DH0х.р.+ 4*∆H(NH3(г)) + 5*DH0(О2(г))
– 6*∆H(H2О(ж)))/4
∆H(NО(г)) = (-1168,8+4*(-46,19) + 0
-6*(-285,84)) = 90,37кДж.
Ответ:90,37кДж.
Задание № 134
Какие и взаимодействия карбонатов BeCO3,
CaCO3
или BaCO3
- можно получить по реакции взаимодействия
соответствующих оксидов с CO2?
Какая реакция идёт наиболее энергично? Вывод сделайте, сличив ΔG0289
реакций. Ответ: +31,24 кДж; -130,17 кДж; -216,02кДж.
Решение: Для реакций, протекающих при постоянном давлении
и температуре, введена термодинамическая функция DG - энергия Гиббса (изобарно-изотермический
потенциал), определяющая влияние энтальпии и энтропии на ход реакции. По знаку
и величине энергии Гиббса можно судить о направлении реакции. Если DG0
< 0, возможно самопроизвольное протекание реакции в прямом направлении; если
DG0
= 0, то в системе наступает состояние равновесия.
1) BeO + CO2(г)
= BeCO3(к)
∆Gх.р.1 = -944,75 + 581,61 + 394,38 = 31,24 кДж
2) CaO + CO2(г) = CaCO3(к)
∆Gх.р.2 = -1128,37 + 604,2 + 394,38 = -129,79 кДж
3) BaO + CO2(г) = BaCO3(к)
∆Gх.р.3 = -1138,8 + 528,4 + 394,38 = -216,02 кДж
Первая реакция не идет при стандартных условиях, т.к. ∆Gх.р.1
> 0. Наиболее энергично протекает третья реакция, т.к. ∆Gх.р.2
> ∆Gх.р.3.
Задание № 151
Константа скорости реакции разложения N2O,
протекающей по уравнению 2N2O=2N2
+ O2
, равна 5*10-4. Начальная концентрация N2O=6,0моль/дм3
. Вычислите начальную скорость реакции и её скорость, когда разложится
50% N2O.Ответ:
1,8 * 10-2 ; 4,5 * 10-3
.
Решение: При постоянной температуре скорость реакции прямо пропорциональна
произведению концентраций реагирующих веществ, возведенных в степени, равные
коэффициентам реакции. Аналитическая запись закона для реакции в общем виде
следующая:
aA
+ bB D cC + dD,
V
= k[A]a × [B]b,
Скорость реакции = k*[N2O]2
, где k - константа скорости реакции, а [N2O] - концентрация N2O.
Подставляя данные задачи в формулу получаем скорость реакции:
Vначальная
= 5*10-4 * 62 = 180*10-4 = 1,8*10-2
Vпри 50%«разлож.» = 5*10-4 * 32 = 45*10-4
= 4,5*10-3
Задача 172.
Определите, будут ли
при одной и той же температуре изотоническими (с одинаковым осмотическим
давлением) водные растворы сахара C12H22O11
и глицерина C3H8O3,
если массовые доли этих веществ в растворах 3%. Плотности растворов принять
равными 1.
Решение:
4.
Осмотическое давление. Осмос − явление
односторонней диффузии через полупроницаемую перегородку, разделяющую раствор и
чистый
растворитель или два раствора разной концентрации.
Давление,
которое требуется создать, чтобы остановить осмос
из
чистого растворителя в раствор, называется осмотическим
(принцип
Вант-Гоффа).
Pосм = CМ·R·T
где
СМ − молярная концентрация
раствора (число моль вещества на 1 л
раствора);
R −
универсальная
газовая постоянная; T − абсолютная
темпера-
тура,
если принять стандартными условия прохождения реакции, тогда Т = 298 К, R
= 8,314 Дж/моль*К
Изотонические
растворы имеющие одинаковое осмотическое давление, согласно
закону Вант-Гоффа должны иметь одинаковые молярные концентрации.
Молярная масса сахара 342 г/моль. Молярная
масса глицерина равна 92 г/моль.
Принимаем, что масса
раствора сахара равна 100 гр., m(р-раС12Н22О11)
= 100 гр. рассчитаем m (С12Н22О11),
массовая доля (w) показывает, сколько
граммов вещества растворено в 100 граммах раствора:
m
(С12Н22О11) =  m (С12Н22О11)
=
m (С12Н22О11)
=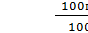 30 г
30 г
n
(С12Н22О11) = n
(С12Н22О11) =
n
(С12Н22О11) =  0,0877193
0,0877193
0,088 моль, рассчитываем
V выбранного образца раствора V
V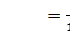 = 100 г = 0,1 л
= 100 г = 0,1 л
определяем молярную
концентрацию раствора С12Н22О11 С
м = 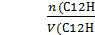
С (С12Н22О11)
м = 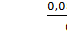 = 0,88 моль/л ; подобным образом
находим
= 0,88 моль/л ; подобным образом
находим
С (С3Н8О3)
м m (С3Н8О3)
=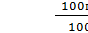 30 г
30 г
n
(С3Н8О3) = 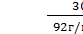 0,032608
0,032608 0,0326
моль
0,0326
моль
С (С3Н8О3)
м = 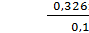 3,26 моль/л
3,26 моль/л
Росм(С12Н22О11)
= 0,88 моль/л *298 К *8,314 Дж/моль*К = 2180 кПа
Росм(С3Н8О3)
= 3,26 моль/л *298 К *8,314 Дж/моль*К = 8076,884 8087 кПа
,
8087 кПа
,
Ответ: Росм(С12Н22О11)
= 2180 кПа; Росм(С3Н8О3) = 8087
кПа растворы не имеют одинакового осмотического давления и не могут быть оба
изотоническими.
Задача 194.
Растворимость Aq2SO4
при t
0 0 равна 0,02 моль/дм3.
Рассчитайте концентрацию ионов Aq+
и SO42-
в насыщенном растворе соли, если кажущаяся степень
ионизации Aq2SO4
52%.
Степень электролитической диссоциации сильного электролита,
определяемая опытным путем, называется кажущейся или эффективной : αкаж
(или αэфф).
Степень диссоциации α
= n / N, где n-количество продиссоциировавших молекул вещества, отсюда n = α
* N= 0,52*0,02=0.0104 моль/л,
Ag2SO4 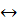 2Ag+ + SO42-
2Ag+ + SO42-
следовательно концентрация С [Ag+] = 2*0,0104=0,0208 моль/л
концентрация С [SO42-] = 0,0104 моль/л
Ответ :
концентрация ионов [Ag+]= 0,0208 моль/л, концентрация ионов [SO42]
= 0,0104 моль/л
Задача 214.
Составьте ионные и
молекулярные уравнения реакций, протекающих между веществами: FeCl3
и KOH; NiSO4 и (NH4)2S; MgCO3 и HNO3.
Решение:
FeCl3 + 3KOH → 3KCl + Fe(OH)3↓
Fe3+ + 3Cl- + 3K+ + 3OH- → 3K+
+ 3Cl- + Fe(OH)3↓
Fe3+ + 3OH- → Fe(OH)3↓
NiSO4 + (NH4)2S → (NH4)2SO4
+ NiS↓
Ni2+ + SO42- + 2NH4+ + S2-
→ 2NH4+ + SO42- + NiS↓
Ni2+ + S2- → NiS↓
MgCO3 + 2HNO3 → Mg(NO3)2 + H2O
+ CO2↑
MgCO3 + 2H+ + 2NO3- → Mg2+
+ 2NO3- + H2O + CO2↑
MgCO3 + 2H+ → Mg2+ + H2O + CO2↑