Газовый цикл тепловых двигателей и установок
Министерство
образования и науки Российской Федерации
Федеральное
агентство по образованию
Государственное
образовательное учреждение высшего профессионального образования
Ижевский
государственный технический университет
С.С. Макаров
Методические
указания к выполнению курсовой работы
«Газовый
цикл тепловых двигателей и установок»
Ижевск 2005
Составитель: С.С. Макаров
«Газовый цикл тепловых
двигателей и установок» - методические указания по выполнению курсовой работы
по дисциплине «Термодинамика и теплообмен ДВС» - Ижевск, 2005. – 21 с.
В методических указаниях изложены
теоретические основы термодинамического анализа циклов энергетических
установок, приведены варианты заданий к курсовой работе, порядок выполнения и
пример оформления курсовой работы.
Методические указания
предназначены для студентов Машиностроительного факультета специальностей
160302 («Ракетные двигатели»), 140501 («Двигатели внутреннего сгорания») и
направлениям 160100 («Авиа- и ракетостроение»), 140502 («Энергомашиностроение»).
Содержание
Введение
1. Теоретические основы термодинамического анализа циклов
1.1. Изохорный процесс
1.2. Изобарный процесс
1.3. Изотермический процесс
1.4. Адиабатный процесс
1.5. Политропный процесс
2. Варианты заданий
3. Пример выполнения расчетов в курсовой работе
4. Порядок оформления курсовой работы
Библиография
Приложение
Введение
Работа энергетических установок основана на реализации
термодинамического цикла. Циклом называется замкнутый круговой процесс, при
осуществлении которого рабочее тело, пройдя ряд последовательных состояний,
возвращается в исходное состояние. Система непрерывного перевода теплоты в
работу, путем осуществления кругового процесса в направлении по часовой
стрелке, называется тепловым двигателем. Для определения параметров тепловых
двигателей проводят анализ рабочего процесса двигателя.
В задании на курсовую работу приведены варианты рабочих
диаграмм идеальных термодинамических циклов тепловых двигателей, которыми
заменяют термодинамический процесс реального рабочего двигателя.
Задачами курсовой работы является проведение
термодинамического исследования идеального цикла теплового двигателя;
определения работы цикла 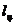 ,
термического к.п.д.
,
термического к.п.д.  ,
индикаторного давления
,
индикаторного давления  ,
а также построения тепловой диаграммы процесса (в координатах
,
а также построения тепловой диаграммы процесса (в координатах 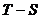 ). Результаты необходимо
представить в соответствии с рекомендуемым порядком выполнения и оформления.
). Результаты необходимо
представить в соответствии с рекомендуемым порядком выполнения и оформления.
1. Теоретические основы
термодинамического анализа циклов [1]
Метод исследования анализа идеального термодинамического цикла основан на
определении параметров состояния составляющих процессов и состоит в следующем:
1. Выводятся уравнения процесса, устанавливается взаимосвязь
между начальными и конечными параметрами рабочего тела.
2. Находится работа процесса  .
.
3. Находится количества тепла  .
.
4. Находится изменение внутренней энергии  .
.
5. Находится изменение энтропии 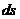 .
.
6. Цикл отображается в масштабе в рабочей 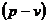 и тепловой
и тепловой 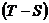 диаграммах.
диаграммах.
Практический интерес представляют
частные случаи изменения состояния газа, составляющие цикл: изохорный,
изобарный, изотермический, адиабатный и обобщающий политропный процессы.
1.1 Изохорный процесс [2]
Изохорный процесс - процесс, происходящий в физической системе при
постоянном объеме.
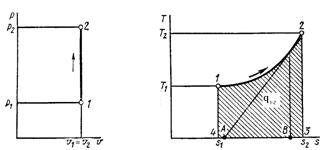
Рис.1.1 Изохорный процесс, 
Уравнение изохорного процесса имеет
вид: 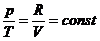 . Давления газа пропорционально
абсолютным температурам:
. Давления газа пропорционально
абсолютным температурам:
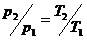 (1)
(1)
В изохорном процессе работа
расширения не совершается:
 , т.к.
, т.к. 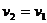 , то
, то 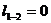 . (2)
. (2)
Из уравнения первого закона
термодинамики следует:
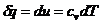 (3)
(3)
Вся подведенная теплота расходуется
на изменение внутренней энергии рабочего тела. При  для двух значений температур (
для двух значений температур (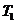 и
и 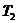 ):
):
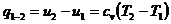 (4)
(4)
Изменение энтропии изохорического
процесса:
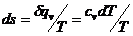 (5)
(5)
При 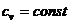 изменение энтропии процесса для двух значений
температур (
изменение энтропии процесса для двух значений
температур (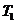 и
и 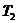 ) определится:
) определится:
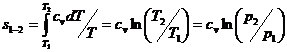 (6)
(6)
1.2 Изобарный процесс [2]
Изобарный процесс - процесс, происходящий в физической
системе при постоянном внешнем давлении.
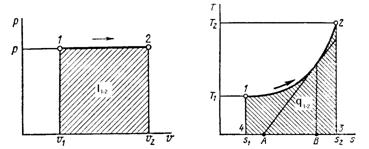
Рис. 1.2 Изобарный процесс, 
Уравнение изобарного процесса имеет
вид: 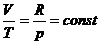 .
.
Объемы газа пропорциональны
абсолютным температурам:
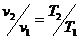 (7)
(7)
В изобарном процессе совершается работа
расширения:
 (8)
(8)
Из уравнения первого закона
термодинамики следует: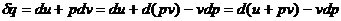 ,
,
принимая  , а при
, а при 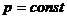
 имеем:
имеем:
 (9)
(9)
Вся подведенная теплота расходуется
на изменение энтальпии
рабочего тела.
При 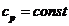 для двух значений температур (
для двух значений температур (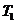 и
и 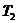 ):
):
 (10)
(10)
Изменение внутренней энергии изобарного
процесса:
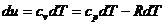 (11)
(11)
При 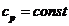 для двух значений температур (
для двух значений температур (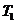 и
и 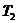 ):
):
 (12)
(12)
Изменение энтропии изобарного
процесса:
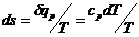 (13)
(13)
При  изменение энтропии процесса для двух значений
температур (
изменение энтропии процесса для двух значений
температур (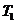 и
и 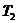 ) определится:
) определится:
 (14)
(14)
1.3 Изотермический процесс [2]
Изотермический процесс - процесс, происходящий в физической
системе при постоянной температуре.
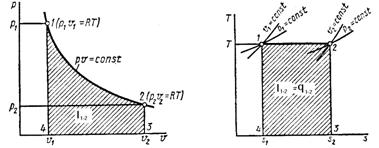
Рис. 1.3 Изотермический процесс, 
Уравнение изотермического процесса
имеет вид:  .
.
Давления обратно пропорциональны
объемам газа:
 (15)
(15)
В изотермическом процессе работа
расширения:
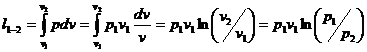 (16)
(16)
В изотермическом процессе не
происходит изменения внутренней энергии и энтальпии т.к. 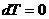 :
:
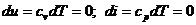 , (17)
, (17)
следовательно 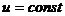 ,
, 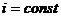 .
.
Из первого закона термодинамики  . Все количество теплоты,
подведенное к газу, затрачивается на совершение работы в процессе расширения:
. Все количество теплоты,
подведенное к газу, затрачивается на совершение работы в процессе расширения:
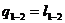 (18)
(18)
Изменение энтропии изотермического
процесса:
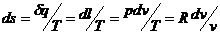 (19)
(19)
Изменение энтропии процесса для двух
точек процесса:
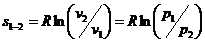 (20)
(20)
1.4 Адиабатный процесс [2]
Адиабатный процесс - процесс, происходящий в физической
системе не получающей теплоту из вне и не отдающей ее, т.е. отсутствует
теплообмен рабочего тела с окружающими системами.

Рис. 1.4 Адиабатный процесс, 
Уравнение адиабатного процесса имеет
вид: 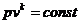 .
.
Давления обратно пропорциональны
объемам в степени 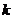 :
:
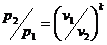 (21)
(21)
Коэффициент адиабаты: 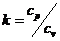 считается
считается  .
.
Работа расширения в адиабатном
процессе:
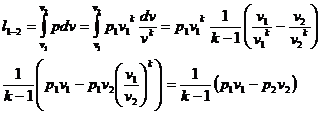 (22)
(22)
Используя уравнение состояния 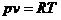 и соотношения:
и соотношения:
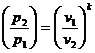 ;
; 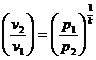 ;
; 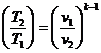 ;
;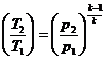 ,
,
можно получить приведенные
соотношения для работы расширения в адиабатном процессе:
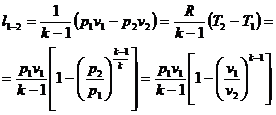 (23)
(23)
В адиабатном процессе не происходит
теплообмена рабочего тела с окружающими системами  . Из первого закона термодинамики следует, что
работа совершается только за счет изменения внутренней энергии:
. Из первого закона термодинамики следует, что
работа совершается только за счет изменения внутренней энергии:
 (24)
(24)
При  для двух значений температур (
для двух значений температур (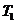 и
и 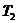 ):
):
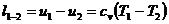 (25)
(25)
Изменение энтропии в адиабатном
процессе:
 (26)
(26)
Энтропия является величиной
постоянной 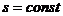 .
.
1.5 Политропный процесс [3]
Политропный процесс – термодинамический процесс
изменения состояния физической системы, в течение которого сохраняется
постоянство теплоемкости.
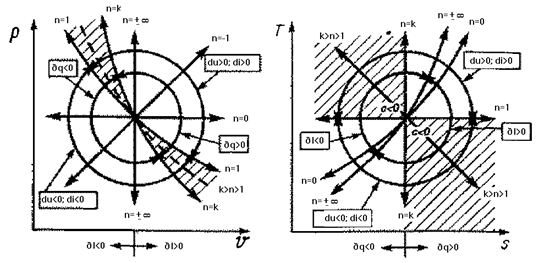
Рис.1.5 Сводные графики политропных
процессов
Уравнение политропного процесса имеет
вид:  .
.
Давления обратно пропорциональны
объемам в степени 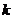 :
:
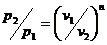 (27)
(27)
Коэффициент политропы  считается для отдельно взятого процесса величиной постоянной
считается для отдельно взятого процесса величиной постоянной
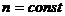 значение которой могут
изменятся
значение которой могут
изменятся 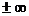 .
.
При известный параметрах состояния:
 (28)
(28)
Работа расширения в политропном
процессе:
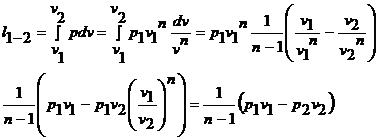 (29)
(29)
Используя уравнение состояния 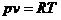 и соотношения:
и соотношения:
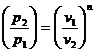 ;
; 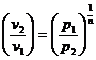 ;
; 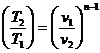 ;
;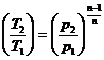 ,
,
можно получить приведенные
соотношения для работы расширения в адиабатном процессе:
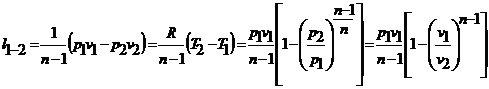 (30)
(30)
Изменение внутренней энергии в
политропном процессе:
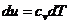 (31)
(31)
При  для двух значений температур (
для двух значений температур (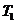 и
и 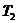 ):
):
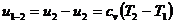 (32)
(32)
Изменение энтальпии в политропном
процессе
 (33)
(33)
При  для двух значений температур (
для двух значений температур (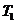 и
и 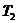 ):
):
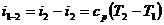 (34)
(34)
Количество теплоты в политропном
процессе:
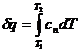 (35)
(35)
При 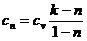 и для двух значений температур (
и для двух значений температур (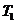 и
и 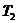 ):
):
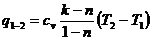 (36)
(36)
Изменение энтропии в политропном процессе:
 (37)
(37)
Энтропия в политропном
процессе определится по зависимости:
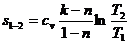 (38)
(38)
Политропный процесс
обобщает всю совокупность основных термодинамических процессов.
|
Процесс
|
|
|
|
изохорный 
|
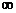
|

|
|
изобарный 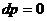
|
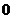
|
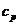
|
|
изотермический 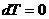
|
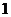
|
|
|
адиабатный 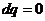
|
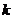
|
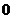
|
2. Варианты заданий [4]
В приведенных ниже вариантах
заданий на курсовую работу рассматривается газовые циклы тепловых двигателей.
Основное допущение для
термодинамического расчета газового цикла теплового двигателя: рабочим телом
является атмосферный воздух не изменяющейся массой 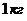 .
.
Известные параметры воздуха
при нормальных условиях: 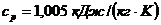 ;
; 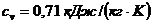 ;
; 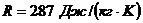 . Задается цикл в координатах
. Задается цикл в координатах  , без учета масштаба.
, без учета масштаба.
Требуется:
1. Определить параметры p,
v, T, u, i для основных точек цикла.
2. Найти: n,  ,
, 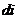 ,
, 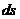 ,
, 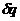 ,
, 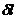 для каждого процесса, входящего в состав цикла.
для каждого процесса, входящего в состав цикла.
3. Определить работу
цикла 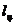 , термический
к.п.д.
, термический
к.п.д.  цикла и
индикаторное давление
цикла и
индикаторное давление .
.
4. Полученные данные
поместить в сводные таблицы.
5. Построить цикл в
координатах  и
и 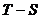 , соблюдая масштаб
построения. Каждый процесс должен быть построен по двум-трем промежуточным
точкам. При выполнении задания следует обратить внимание на физический смысл
величин и их размерности.
, соблюдая масштаб
построения. Каждый процесс должен быть построен по двум-трем промежуточным
точкам. При выполнении задания следует обратить внимание на физический смысл
величин и их размерности.

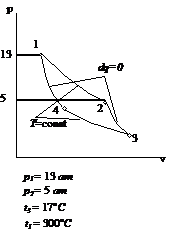
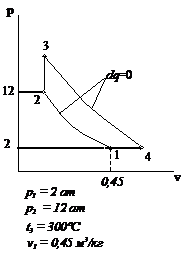
Рис.2.1 Вариант 1
Рис.2.2 Вариант 2 Рис.2.3 Вариант 3
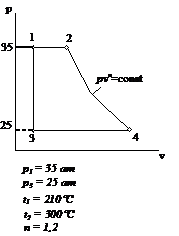

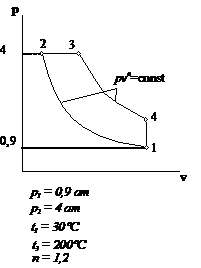
Рис.2.4 Вариант 4
Рис.2.5 Вариант 5 Рис.2.6 Вариант 6

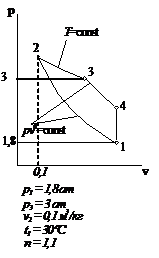
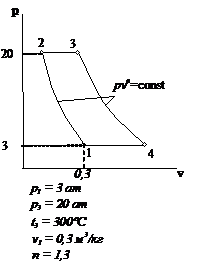
Рис.2.7 Вариант 7
Рис.2.8 Вариант 8 Рис.2.9 Вариант 9

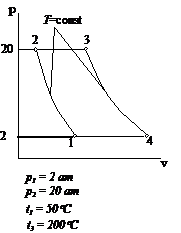

Рис.2.10 Вариант 10
Рис.2.11 Вариант 11 Рис.2.12 Вариант 12
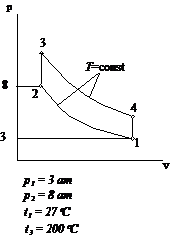
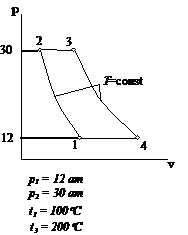

Рис.2.13 Вариант 13
Рис.2.14 Вариант 14 Рис.2.15 Вариант 15
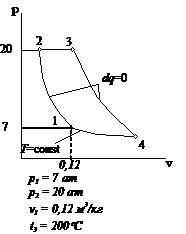
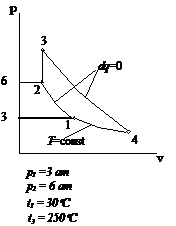
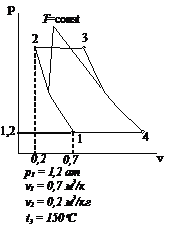
Рис.2.16 Вариант 16
Рис.2.17 Вариант 17 Рис.2.18 Вариант 18
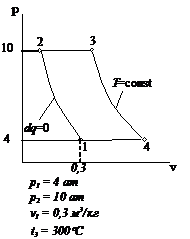
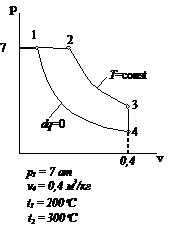
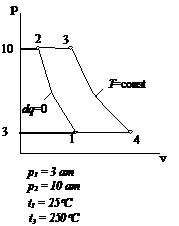
Рис.2.19 Вариант 19
Рис.2.20 Вариант 20 Рис.2.21 Вариант 21
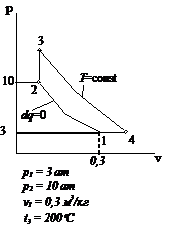

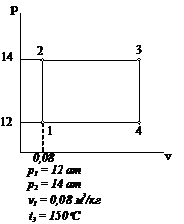
Рис.2.22 Вариант 22
Рис.2.23 Вариант 23 Рис.2.24 Вариант 24
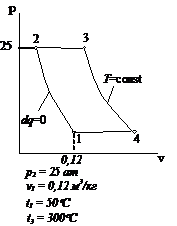
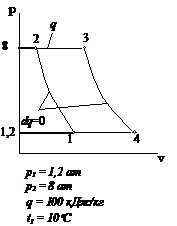
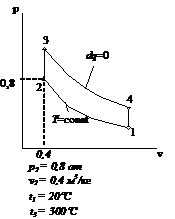
Рис.2.25 Вариант 25
Рис.2.26 Вариант 26 Рис.2.27 Вариант 27
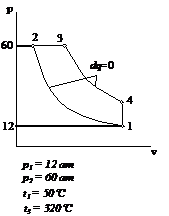
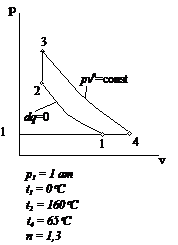

Рис.2.28 Вариант 28
Рис.2.29 Вариант 29 Рис.2.30 Вариант 30
3. Пример выполнения расчетов
в курсовой работе
3.1 Исходные данные
для расчета
Вариант задания №12
|
Рис. 3.1
Рабочая диаграмма процесса
|
|


Цикл состоит из четырех
процессов:
1 – 2 адиабатный процесс;
2 – 3 изотермический
процесс;
3 – 4 адиабатный процесс;
4 – 1 изобарный процесс;
Исходными данными для
расчета являются следующие значения термодинамических параметров в точках:
p1=4 атм; p2=16 атм; p3=6 атм; t1=100°C. Теплоемкости процессов: 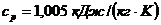 ;
; 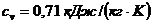 . Удельная
газовая постоянная воздуха
. Удельная
газовая постоянная воздуха 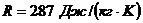 .
.
3.2Порядок выполнения
расчетов
Переведем
единицы измерения в систему СИ:
1 атм » 98 кПа;
p1 = 4 атм
= 3,92×105
Па;
p2 = 16 атм
= 15,68×105
Па;
p3 = 6 атм
= 5,88×105
Па;
Т1 = 373 К.
3.3 Определяем параметры
состояния p, v, T, u, i для основных точек
цикла:
Для точки 1 дано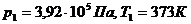 .
.
Из уравнения Клапейрона 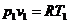 следует, что
следует, что
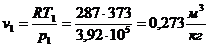 .
.
Находим внутреннюю
энергию 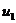 и энтальпию
и энтальпию 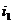 при температуре
при температуре  :
:
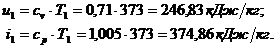
Для точки 2 дано .
.
Для определения  используем уравнение адиабаты
рvk = const, откуда
используем уравнение адиабаты
рvk = const, откуда
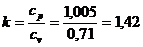 .
.
Из соотношения 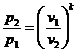 найдем
найдем
 .
.
Для определения
температуры 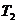 используем
уравнение состояния в виде
используем
уравнение состояния в виде  :
:
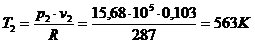 .
.
Находим внутреннюю
энергию  и энтальпию
и энтальпию  при температуре
при температуре
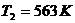 :
:

Для точки 3 дано p3 = 5,88×105 Па, Т3 = Т2
= 563 К.
Из уравнения Клапейрона  следует, что
следует, что
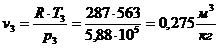 .
.
Находим внутреннюю
энергию 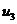 и энтальпию
и энтальпию  при температуре
при температуре 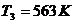 :
:

Для точки 4 дано p1 = p4 =
3,92×105 Па.
Для определения 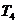 используем уравнение адиабаты
используем уравнение адиабаты
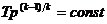 , откуда
, откуда
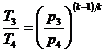 ,
,
где  , откуда
, откуда 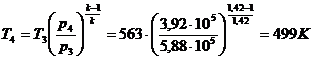
Для определения 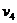 используем уравнение
состояния:
используем уравнение
состояния:
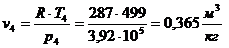 .
.
Находим внутреннюю
энергию  и энтальпию
и энтальпию  при температуре
при температуре 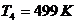 :
:
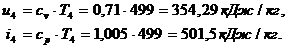
3.4 Определение
параметров p, v, T, u, i для дополнительных точек
цикла:
Для точки 1' дано 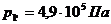 Определим
Определим 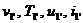 .
.
Для определения  используем уравнение pvk = const:
используем уравнение pvk = const:
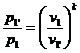 , где
, где  .
.
Откуда 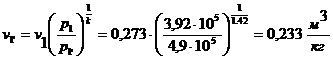 .
.
Для определения
температуры 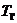 используем
уравнение состояния
используем
уравнение состояния 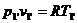 ,
откуда:
,
откуда:
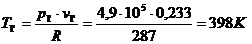 .
.
Находим внутреннюю
энергию 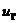 и энтальпию
и энтальпию 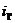 при температуре
при температуре 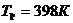 :
:
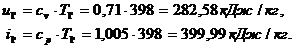
Для точки 1'' дано 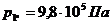
Для определения  используем уравнение рvk
= const, из которого:
используем уравнение рvk
= const, из которого:
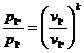 ,
,
где 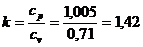 . Откуда
. Откуда
 .
.
Для определения
температуры  используем
уравнение состояния:
используем
уравнение состояния:
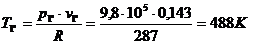 .
.
Находим внутреннюю
энергию  и энтальпию
и энтальпию  при температуре
при температуре  :
:
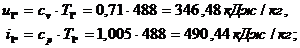
Для точки 2' дано 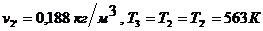
Из уравнения Клапейрона 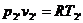 следует, что
следует, что
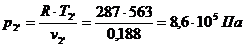 .
.
Находим внутреннюю энергию
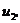 и энтальпию
и энтальпию 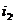 при температуре
при температуре 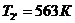 :
:
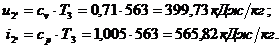
Для точки 2'' дано 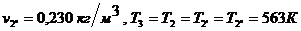 .
.
Из уравнения Клапейрона  следует, что
следует, что
 .
.
Находим внутреннюю
энергию 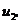 и энтальпию
и энтальпию 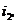 при температуре
при температуре
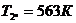 :
: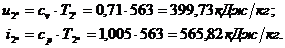
Для точки 3' дано  .
.
Для определения  используем уравнение рvk
= const, согласно которому
используем уравнение рvk
= const, согласно которому
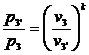 , где
, где 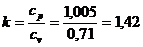
откуда 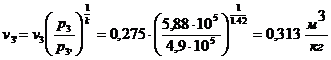 .
.
Для определения
температуры  используем
уравнение состояния, из которого
используем
уравнение состояния, из которого
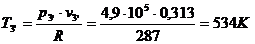
Находим внутреннюю
энергию 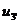 и энтальпию
и энтальпию  при температуре
при температуре 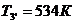 :
:
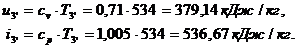
Для точки 4' дано 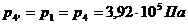 , при температуре
, при температуре
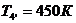 определим
определим 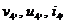 .
.
Для определения 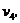 используем уравнение
состояния:
используем уравнение
состояния:
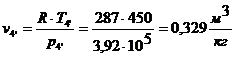 .
.
Находим внутреннюю
энергию  и энтальпию
и энтальпию  при температуре
при температуре 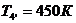 :
:
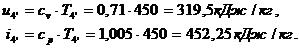
Для точки 4'' дано 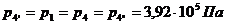 , при температуре
, при температуре 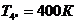 определим
определим  Для определения
Для определения 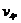 используем уравнение состояния:
используем уравнение состояния:
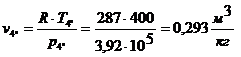 .
.
Находим внутреннюю энергию
 и энтальпию
и энтальпию  при температуре
при температуре 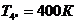 :
:

3.5 Для каждого
процесса, входящего в состав цикла, найдем n, c, Du, Di, Ds, q, l.
Определим
перечисленные величины:
Для адиабатного
процесса 1-2 при 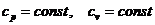 ;
;
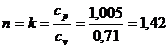
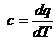 ,
,
так как для адиабаты
dq = 0, то c =
0; 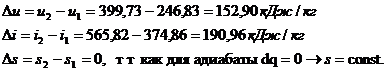
Адиабатный процесс
протекает без теплообмена с окружающей средой, поэтому q = 0.
Работу процесса определим
из уравнения первого закона термодинамики: 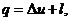 так как
так как 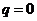
то 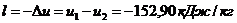 ;
;
Для изотермического
процесса 2-3 при Т
= const показатель политpопы 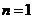 .
.
Теплоемкость 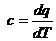 , так как для изотермы dТ
= 0, то
, так как для изотермы dТ
= 0, то 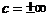 ;
;

Удельное количество
теплоты, участвующее в изотермическом процессе, равно:  при изотермическом процессе работа
численно равна количеству теплоты:
при изотермическом процессе работа
численно равна количеству теплоты: 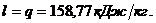
Для адиабатного
процесса 3-4 пpи 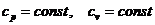 ;
; 
 , так как для адиабаты dq = 0,
то c = 0;
, так как для адиабаты dq = 0,
то c = 0;
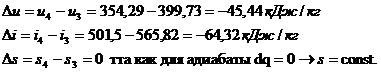
Адиабатный процесс
протекает без теплообмена с окружающей средой, поэтому q = 0.
Работу процесса определим
из уравнения первого закона термодинамики:
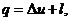 так как
так как 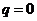 то
то 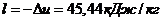 .
.
Для изобарического
процесса 4-1 при n
= 0 и теплоемкости 
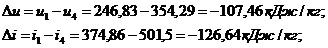
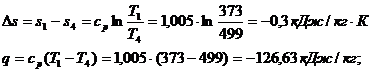
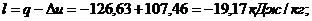
Для адиабатного
процесса 1-1' при 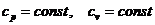 ;
;

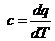 , так как для адиабаты dq = 0, то c =
0;
, так как для адиабаты dq = 0, то c =
0;
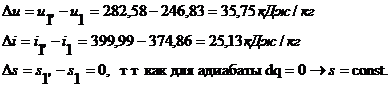
Адиабатный процесс
протекает без теплообмена с окружающей средой, поэтому q = 0.
Работу процесса определим
из уравнения первого закона термодинамики: 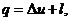 так как
так как 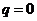 то
то  .
.
Для адиабатного
процесса 1'-1'' при  ;
;
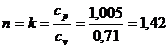
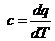 , так как для адиабаты dq = 0, то c =
0;
, так как для адиабаты dq = 0, то c =
0;

Адиабатный процесс
протекает без теплообмена с окружающей средой, поэтому q = 0.
Работу процесса определим
из уравнения первого закона термодинамики: 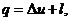 так как
так как 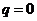 то
то 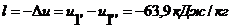 .
.
Для изотермического
процесса 2-2' при Т
= const показатель политропы 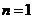 .
.
Теплоемкость 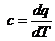 , так как для изотермы dТ
= 0, то
, так как для изотермы dТ
= 0, то 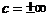 ;
;
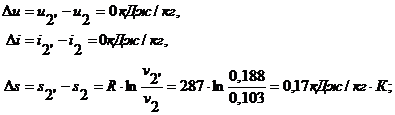
Удельное количество
теплоты, участвующее в изотермическом процессе, равно: 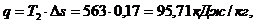
при изотермическом
процессе работа численно равна количеству теплоты
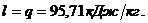
Для изотермического
процесса 2'-2'' при Т
= const показатель политропы  .
.
Теплоемкость 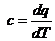 , так как для изотермы dТ
= 0, то
, так как для изотермы dТ
= 0, то 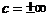 ;
;
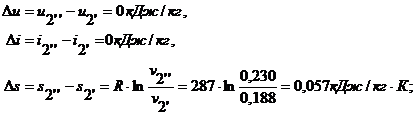
Удельное количество
теплоты, участвующее в изотермическом процессе, равно: 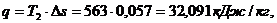
при изотермическом
процессе работа численно равна количеству теплоты
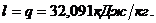
Для адиабатного
процесса 3-3' при 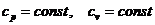 ;
;

 , так как для адиабаты dq = 0, то c = 0;
, так как для адиабаты dq = 0, то c = 0;
Адиабатный процесс
протекает без теплообмена с окружающей средой, поэтому q = 0.
Работу процесса определим
из уравнения первого закона термодинамики:
 так как
так как 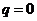 то
то 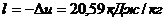
Для изобарического
процесса 4-4' при n
= 0 и теплоемкости

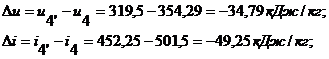

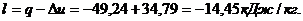
Для изобарического
процесса 4'-4'' при n
= 0 и теплоемкости 
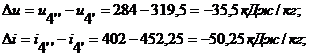
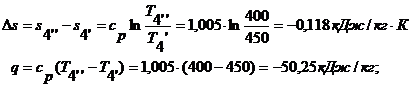

3.6 Определяем работу
цикла lц, qц, термический к.п.д. ht, а так же среднее индикаторное
давление pi:
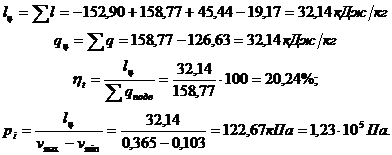
Таблица 3.1. Термодинамические
параметры процесса в точках
|
|
p, кПа
|
v, м3/кг
|
Т, К
|
u, кДж/кг
|
i, кДж/кг
|
|
1
|
392
|
0,273
|
373
|
246,83
|
374,86
|
|
2
|
1568
|
0,103
|
563
|
399,73
|
565,82
|
|
3
|
588
|
0,275
|
563
|
399,73
|
565,82
|
|
4
|
392
|
0,365
|
499
|
354,29
|
501,5
|
Таблица 3.2. Термодинамические
параметры процесса в дополнительных точках
|
|
p, кПа
|
v, м3/кг
|
Т, К
|
u, кДж/кг
|
i, кДж/кг
|
|
1'
|
490
|
0,233
|
398
|
282,58
|
399,99
|
|
1''
|
980
|
0,143
|
488
|
346,48
|
490,44
|
|
2'
|
860
|
0,188
|
563
|
399,73
|
565,82
|
|
2''
|
702,5
|
0,230
|
563
|
399,73
|
565,82
|
|
3'
|
490
|
0,313
|
534
|
379,14
|
536,67
|
|
4'
|
392
|
0,329
|
450
|
319,5
|
452,25
|
|
4''
|
392
|
0,293
|
400
|
284
|
402
|
Таблица 3.3. Изменение термодинамических
параметров процесса в основных точках
|
Процессы
|
n
|
Du, кДж/кг
|
Di, кДж/кг
|
Ds, кДж/кг×К
|
q, кДж/кг
|
l, кДж/кг
|
|
1-2
|
1,42
|
152,90
|
190,96
|
0,00
|
0,00
|
-152,90
|
|
2-3
|
1
|
0,00
|
0,00
|
0,3
|
158,77
|
158,77
|
|
3-4
|
1,42
|
-45,44
|
-64,32
|
0,00
|
0,00
|
45,44
|
|
4-1
|
0
|
-107,46
|
-126,64
|
-0,3
|
-126,63
|
-19,17
|
|
SDu=0
|
SDi=0
|
SDs=0
|
SDq=32,14
|
SDl=32,14
|
Таблица 3.4. Изменение термодинамических
параметров процесса в дополнительных точках
|
Процессы
|
n
|
Du, кДж/кг
|
Di, кДж/кг
|
Ds, кДж/кг×К
|
q, кДж/кг
|
l, кДж/кг
|
|
1-1'
|
1,42
|
35,75
|
25,13
|
0,00
|
0,00
|
-35,75
|
|
1'-1''
|
1,42
|
63,9
|
90,45
|
0,00
|
0,00
|
-63,9
|
|
2-2'
|
1
|
0,00
|
0,00
|
0,17
|
95,71
|
95,71
|
|
2'-2''
|
1
|
0,00
|
0,00
|
0,057
|
32,091
|
32,091
|
|
3-3'
|
1,42
|
-20,59
|
-29,15
|
0,00
|
0,00
|
20,59
|
|
4-4'
|
0,00
|
-34,79
|
-49,25
|
-0,104
|
-49,24
|
-14,45
|
|
4'-4''
|
0,00
|
-35,50
|
-50,25
|
-0,118
|
-50,25
|
-14,75
|
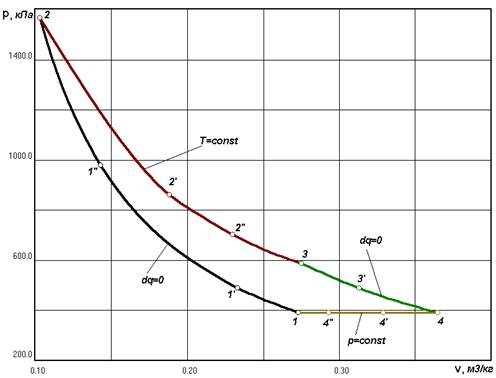
Рис. 3.2 Рабочая
диаграмма процесса
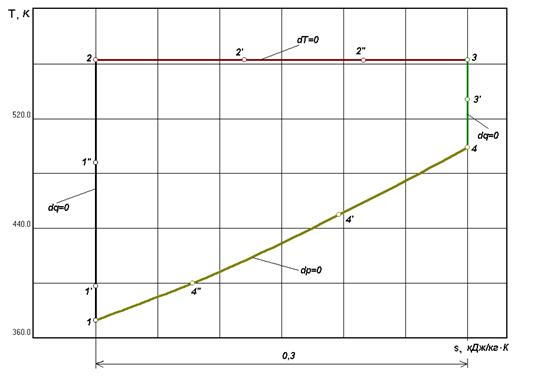
Рис. 3.3 Тепловая
диаграмма процесса
4. Порядок оформления курсовой
работы
Курсовая работа должна содержать следующие разделы:
Титульный лист (см. приложение А.)
Содержание (перечень разделов и подразделов
работы)
Основные сокращения и
обозначения (выносят
обозначения и сокращения, встречающиеся в работе более трех раз).
Введение (кратко определяется суть курсовой
работы и ее место в учебном процессе).
1. Теоретическая часть (привести теоретические основы
расчетов термодинамических параметров рассматриваемого цикла, привести
теоретические определения и зависимости).
2. Расчетная часть (последовательно и подробно
произвести расчеты, связанные с определением числовых значений параметров
состояния, характеризующие рассматриваемый цикл, количество теплоты и работы).
3. Графическая часть (используя графические редакторы
отобразить рассматриваемый цикл в рабочей (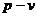 ) и тепловой (
) и тепловой (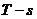 ) диаграммах с отображением расчетных точек и
их значений).
) диаграммах с отображением расчетных точек и
их значений).
Заключение (результаты и вывод по курсовой
работе).
Библиография (перечень используемых литературных
источников, на которые необходима ссылка в процессе выполнения курсовой
работы).
Библиография
1. Б.Я. Бендерский. Техническая
термодинамика и теплопередача. Курс лекций с краткими библиографиями ученых. –
Москва-Ижевск: Институт компьютерных исследований, 2002. – 264 с.
2. Юдаев. Б.Н. Техническая
термодинамика. – М.: Высшая школа, 1988. – 479 с.
3. Теплотехника. Учебник для вузов. /
Под. Ред. В.Н. Луканина. – М.: ВШ, 2000. – 671 с.
4. Сборник задач по технической
термодинамике и теплопередаче / Под. pед. Юдаева Б.H. М: Высшая школа, 1968 - 346
с.
Приложение.
А. Пример оформления титульного листа
Министерство
образования и науки Российской Федерации
Федеральное
агентство по образованию
Государственное
образовательное учреждение высшего профессионального образования
Ижевский
государственный технический университет
Газовый
цикл
Курсовая
работа
«Газовый цикл
тепловых двигателей и установок»
Вариант №12
Выполнил:
студент гр. 551
Пупышев О.В.
Проверил:
к.т.н., доцент
Макаров С.С.
Ижевск 2005